郑春菊1,2, 陈曼佳3, 童辉3

 , 孟方圆1,2, 吕亚辉3, 刘承帅1,3
, 孟方圆1,2, 吕亚辉3, 刘承帅1,3

1. 中国科学院地球化学研究所, 环境地球化学国家重点实验室, 贵州 贵阳 550081;
2. 中国科学院大学, 北京 100049;
3. 广东省科学院生态环境与土壤研究所, 华南土壤污染控制与修复国家地方联合工程研究中心, 广东省农业环境综合治理重点实验室, 广东 广州 510650
收稿日期:2021-02-25;修回日期:2021-03-19;网络出版日期:2021-04-12
基金项目:国家自然科学基金(41921004,41977291);广东省科学院创新驱动发展专项(2019GDASYL-0301002,2019GDSYL-0401003)
作者简介:童辉,广东省科学院生态环境与土壤研究所副研究员,博士。研究方向为土壤生物铁循环过程及其重金属固定效应。主持包括国家自然科学基金、广东省自然科学基金、博士后科学基金等科研项目6项;发表论文30余篇,其中SCI收录20余篇,授权发明专利5件;
刘承帅,中国科学院地球化学研究所二级研究员,博士、博士生导师。国家自然科学****基金获得者、国家重点研发计划项目首席科学家,担任环境地球化学国家重点实验室副主任。研究方向为地表金属元素环境行为及土壤重金属污染控制与修复。主持包括国家重点研发计划、NSFC-广东联合重点、中科院前沿重点等在内的科研项目20余项;发表论文140多篇,其中SCI收录120多篇,SCI他引3000多次,高引指数31;申请发明专利31件,其中授权16件,5件转让.
*通信作者:童辉, Tex/Fax: +86-851-85891334;huitong@soil.gd.cn;
刘承帅, E-mail: liuchengshuai@vip.gyig.ac.cn.
摘要:[目的] 探究中性厌氧条件下,金属锌影响下硝酸盐依赖型铁氧化菌Pseudomonas stutzeri LS-2驱动的硝酸盐还原耦合亚铁氧化成矿过程机制,对深入理解中性厌氧环境中微生物亚铁氧化驱动的反硝化作用及重金属固定机制具有重要意义。[方法] 以不同Zn(Ⅱ)浓度构建LS-2驱动的亚铁氧化成矿体系,分析不同体系中亚铁氧化速率、硝酸盐还原速率以及形成矿物的结构变化规律。[结果] LS-2驱动的硝酸盐还原耦合亚铁氧化成矿过程中,共存Zn(Ⅱ)降低该过程中硝酸盐的还原速率和亚铁氧化速率。同时,随着Zn(Ⅱ)浓度提高,抑制作用增强。微生物亚铁氧化形成的矿物通过吸附、共沉淀和离子置换等过程固定Zn(Ⅱ),降低Zn(Ⅱ)活性。Zn(Ⅱ)浓度对形成的矿物结构有较大的影响:低浓度Zn(Ⅱ)体系中,形成的矿物为纤铁矿;随着Zn(Ⅱ)浓度的提高,矿物结构与结晶度都有一定程度的变化,当Zn(Ⅱ)达到4 mmol/L时,形成的矿物主要为铁锌尖晶石。[结论] 明确了重金属锌对LS-2菌株反硝化及亚铁氧化过程的抑制规律,同时阐明了Zn(Ⅱ)浓度对形成矿物结构的影响。研究结果有助于深入认识中性厌氧环境中重金属与微生物驱动的铁循环和反硝化过程的耦合作用,为土壤重金属污染防治提供理论支撑。
关键词:铁氧化菌Pseudomonas stutzeri LS-2重金属Zn硝酸盐还原生物成矿
Effect of Zn on Fe(Ⅱ) oxidation and nitrate reduction by a denitrifying bacterium, Pseudomonas stutzeri LS-2
Zheng Chunju1,2, Chen Manjia3, Tong Hui3

 , Meng Fangyuan1,2, Lü Yahui3, Liu Chengshuai1,3
, Meng Fangyuan1,2, Lü Yahui3, Liu Chengshuai1,3

1. State Key Laboratory of Environmental Geochemistry, Institute of Geochemistry, Chinese Academy of Sciences, Guiyang 550081, Guizhou Province, China;
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. National-Regional Joint Engineering Research Center for Soil Pollution Control and Remediation in South China, Guangdong Key Laboratory of Integrated Agro-environmental Pollution Control and Management, Guangdong Institute of Eco-environmental Science & Technology, Guangdong Academy of Sciences, Guangzhou 510650, Guangdong Province, China
Received: 25 February 2021; Revised: 19 March 2021; Published online: 12 April 2021
*Corresponding author: Hui Tong, Tex/Fax: +86-851-85891334; E-mail: huitong@soil.gd.cn;
Chengshuai Liu, E-mail: liuchengshuai@vip.gyig.ac.cn.
Foundation item: Supported by the National Natural Science Foundation of China (41921004, 41977291) and GDAS' Project of Science and Technology Development (2019GDASYL-0301002, 2019GDSYL-0401003)
Abstract: [Objective] The aim of this study was to investigate the effect of Zn on the Fe(Ⅱ)-driven denitrification and mineralization by a denitrifying bacterium, Pseudomonas stutzeri LS-2 under neutral anaerobic conditions. The result will extend our knowledge of microbial Fe(Ⅱ)-driven denitrification and its environmental behavior under anaerobic conditions. [Methods] We designed the microbial driven Fe(Ⅱ) oxidation with a series of Zn(Ⅱ) concentration, detected the rates of Fe(Ⅱ) oxidation and nitrate reduction, and characterized the mineralogy under different conditions. [Results] The activity of the Fe(Ⅱ)-oxidizing denitrifying culture was affected by the presence of Zn. The results showed that the presence of Zn inhibited the rates of nitrate reduction and Fe(Ⅱ) oxidation. A low inhibition was observed at initial concentrations of Zn(Ⅱ) from 0.15 to 2 mmol/L. When Zn(Ⅱ) was supplemented up to 4 mmol/L, the higher inhibition was observed. In addition, the minerals during nitrate-reducing Fe(Ⅱ) oxidation can efficiently remove the supplemented Zn(Ⅱ), including co-precipitation, sorption and isomorphous substitution. The nitrate-reducing Fe(Ⅱ) oxidation resulted in the formation of a mixture of Fe(Ⅲ) minerals in the presence of different Zn(Ⅱ) concentrations. The use of low Zn(Ⅱ) concentration cultures enhanced the formation of lepidocrocite, while the higher concentration resulted in the formation of franklinite. [Conclusion] The results clarified the effect of Zn on the nitrate-reducing Fe(Ⅱ) oxidation process, including the rates of nitrate reduction and Fe(Ⅱ) oxidation, and the mineral structure. These findings increase the understanding of the relationship between the heavy metals and the bacteria-driven Fe(Ⅱ) oxidation and denitrification and provide scientific support for remediation of contaminated soils by heavy metals.
Keywords: Fe(Ⅱ)-oxidizing bacteriaPseudomonas stutzeri LS-2heavy metal Znnitrate reductionbiomineralization
硝酸盐是地下水和土壤中常见的一种污染物,影响着生活用水的安全,同时可能造成地表水的富营养化现象[1-2]。农业中大量氮肥的施用、生活污水的排放及含氮工业废水的渗漏是水体和土壤硝酸盐污染的主要来源[3]。硝酸盐在有氧环境中能够稳定长时间存在,且能通过远距离传输,造成大面积的污染。在南方红壤区,地下水或者土壤中同时存在大量的溶解态铁,厌氧环境下主要为Fe(Ⅱ)。氧气含量的减少促进了铁还原环境的形成,从而增加了溶解态铁的含量和移动性[2]。因此,在厌氧富铁土壤中,硝酸盐和Fe(Ⅱ)很可能是普遍同时存在的[2]。从热力学上分析,硝酸盐和Fe(Ⅱ)在厌氧条件下可以较容易发生氧化还原反应,在这个过程中Fe(Ⅱ)被氧化形成Fe(Ⅲ),最终形成沉淀,硝酸盐被还原,从反应体系中去除[4]。硝酸盐还原耦合Fe(Ⅱ)氧化过程不仅能去除水体中过量的硝酸盐,还能形成具有较强吸附能力的絮状铁氧化物沉淀。这些沉淀物能有效吸附环境中的重金属元素,降低其移动性和生物有效性[1]。许多研究表明生物和非生物作用都能介导硝酸盐依赖的亚铁氧化过程[5-8]。如Li等从华南富铁土壤中分离出一株硝酸盐依赖型亚铁氧化菌Pseudomonas stutzeri LS-2,能有效还原土壤中的硝酸盐,形成一氧化二氮、氮气等[6]。
硝酸盐依赖型亚铁氧化菌在亚铁氧化过程中利用硝酸根作为电子受体并耦合其还原,从而参与氮循环过程中[9]。硝酸盐依赖型亚铁氧化菌系统发育地位较广,并广泛分布于海洋、淡水及厌氧沉积物中,归属于Alpha-、Beta-、Gamma-及Delta-变形菌纲[10]。相对于光合型亚铁氧化菌,硝酸盐依赖型亚铁氧化菌在亚铁氧化过程并不产生生物量来维持生长,因此Fe(Ⅱ)作为唯一的电子供体难以维持亚铁氧化菌的连续培养,在培养体系中必须加入低浓度的有机碳作为共同电子供体[11]。作为硝酸盐依赖型亚铁氧化菌模式菌株的Acidovorax BoFeN1,在醋酸盐作为电子供体的条件下,氧化亚铁的同时快速还原NO3-及NO2-,并产生能量供亚铁氧化菌生长[10]。硝酸依赖型亚铁的氧化是Fe-N耦合循环的纽带,特别是在厌氧土壤和地下水环境中,对深入理解厌氧环境中硝酸盐的去除机制以及活性氧化铁的再生具有重要意义。
研究表明,硝酸盐污染环境中常伴随着重金属的污染,如来自肥料或者工业废水中的铜、镍、锌、砷等[2-12]。重金属的存在可能促进或者抑制微生物的反硝化活性,如适量的微量元素可以增强某些微生物的活性,而当这些微量元素的浓度超过一定量时,就会对反硝化微生物产生抑制作用[13-14]。当重金属离子浓度增加时,微生物为了适应这些浓度,也会产生相应的应对机制,如将重金属离子排出体外、在体内将重金属离子形成络合物或者改变重金属价态以降低其毒性[15-17]。但是,在高浓度重金属离子体系中,微生物的代谢途径、酶的种类及活性都有可能被改变,从而影响与这些微生物相关的过程。如重金属离子铜和镍会影响自养型亚铁氧化菌的反硝化效率及成矿过程[18]。但重金属对异养型硝酸盐依赖型亚铁氧化菌的反硝化过程以及成矿种类的影响仍然研究较少。同时,生物亚铁氧化过程形成的铁氧化物由于有较高的零电荷点,使其表面带正电荷可作为吸附剂固定重金属[19]。在土壤或者水体中,由于铁氧化物对重金属有很强的吸附作用,因此可以利用亚铁氧化成矿过程促进环境中重金属的固定。如微氧亚铁氧化菌Gallionella和Leptothrix形成的铁氧化物通过表面吸附及共沉淀可以去除地下水中90%的砷[20];光合型亚铁氧化菌能与重金属离子形成二次矿物,将重金属从溶液中去除[18]。吸附在铁氧化物表面的重金属有可能进入铁氧化物的晶格中形成铁-重金属次生矿物,被更稳定地固定在矿物中[17-18, 21]。
锌(Zn)作为水稻土中最为常见的重金属元素,其产生的环境问题日益受到重视。已有的报道显示,当锌的浓度达到32 mg/L时,生物反应中的反硝化速率将降低34%[22]。在自养型亚铁氧化菌的反硝化过程中,低浓度的锌对整个反硝化过程影响较小,当锌浓度达到40 mg/L时,反硝化速率将降低17%[1]。然而,水稻土中锌对异养型铁氧化菌的影响是否与自养型亚铁氧化菌一致仍然不清楚。硝酸盐依耐型亚铁氧化菌Pseudomonas stutzeri LS-2来自华南水稻土,研究其反硝化过程更能代表中性厌氧水稻土中发生的铁氧化菌驱动硝酸盐还原过程。本文以Pseudomonas stutzeri LS-2为目标微生物,研究锌对整个自养亚铁氧化菌的生物成矿过程硝酸还原和亚铁氧化速率的影响。同时对形成的矿物进行表征,研究锌的添加对形成的矿物的结晶度以及结构的影响。通过对硝酸盐反应动力学及次生矿物形成的研究,揭示锌对微生物驱动的亚铁氧化成矿过程的胁迫作用。
1 材料和方法 1.1 微生物来源及培养 本次实验采用的硝酸盐依赖型铁氧化菌株为Pseudomonas stutzeri LS-2,分离自华南水稻土,在中国普通微生物菌种保藏管理中心保存序号为CGMCC 1156[23]。菌株LS-2首先利用LB液体培养基(pH 7.0±0.2)在30 ℃厌氧恒温箱中避光培养20 h,随后转接到新的LB液体培养基中,继续以相同条件培养20 h,将所得的菌液离心后弃清液,使用生物缓冲溶液3-(N-吗啡林)丙磺酸(MOPS)重新悬浮,再次离心,重复上述步骤2次,最后得到的菌液用高纯N2曝气30 min后加入到反应体系。反应体系由含有20 mmol/L MOPS的脱氮培养基(denitrifier basal medium,DBM,pH 7.0±0.2)组成[23]。所有溶液均用去离子水配制(18.2 ΜΩ) (来自超纯水系统Easy Pure Ⅱ RF/UV,Thermo Scientific,USA)。
1.2 硝酸盐/亚硝酸盐还原耦合亚铁氧化实验设计 本研究主要采用化学对照组和生物处理组,处理如表 1所示。所有含有微生物处理的培养基如下:OD600=0.2的菌液、5 mmol/L乙酸钠、5 mmol/L氯化亚铁、10 mmol/L NaNO3、1 mL/L微量元素和维生素、20 mmol/L的MOPS,含锌的处理组中锌浓度[Zn(Ⅱ)]为0.15、0.8、2和4 mmol/L,反应体系最终体积为30 mL。化学对照组除了不添加菌株外,其他条件保持与生物处理组一致。所有操作都在厌氧培养箱中进行,反应体系最终避光静置培养30 d。
表 1. 硝酸盐还原耦合亚铁氧化实验设计 Table 1. Experimental design of nitrate/nitrite reduction coupled with Fe(Ⅱ) oxidation
| Numbers | Treatments |
| 1 | NO3-+Fe(Ⅱ) |
| 2 | NO3-+Fe(Ⅱ)+Zn(Ⅱ) |
| 3 | Cell+Fe(Ⅱ) |
| 4 | Cell+NO3- |
| 5 | Cell+Fe(Ⅱ)+Zn(Ⅱ) |
| 6 | Cell+NO3-+Fe(Ⅱ) |
| 7 | Cell+NO3-+Fe(Ⅱ)+Zn(Ⅱ) |
表选项
1.3 样品的采集与测定 实验测定的产物有:NO3-、溶解态和吸附态Fe(Ⅱ)和Zn(Ⅱ)。取样的时间点分别为0、1、3、6、12 h和1、2、3、4、6、10、15、20、25、30 d。取样过程均在厌氧手套箱中使用无菌注射器取样。NO3-样品的采集与测定:吸取2 mL样品,利用氧气曝气20 min将体系中未反应的Fe(Ⅱ)氧化形成沉淀,用0.22 μm的滤头过滤后置于-40 ℃冰箱保存,然后使用离子色谱仪测定其浓度(ICS-600,Thermo SCIENTIFIC)。溶解态和吸附态的Fe(Ⅱ)和Zn(Ⅱ)样品的采集与测定:将样品倒入离心管中,9500 r/min离心10 min,将上清液过滤到离心管中,加入200 μL 5 mol/L HCl后保存于4 ℃冰箱,此为溶解态的样品;剩余固体加入10 mL 0.1 mol/L HCl重悬浮,提取10 min后过滤,此为吸附态的样品。溶解态和吸附的Fe(Ⅱ)用邻菲罗啉显色20 min,使用酶标仪在510 nm波长处测试吸光值。溶解态和吸附态Zn(Ⅱ)的样品用NexION 300X电感耦合等离子体质谱仪ICP-OES (PerKinElmer公司)测定浓度。矿物收集后使用X射线衍射仪XRD测定(Co钯,D2 PHASER,德国布鲁克AXS公司),使用Jade和BRUKER-TOPAS软件进行矿物分析鉴定。
2 结果和讨论 2.1 外源Zn对生物亚铁氧化的影响 硝酸盐依耐型亚铁氧化菌以亚铁作为唯一电子供体时,能有效去除反应体系中的硝酸根[6, 24]。重金属离子存在的情况下,其亚铁氧化速率及硝酸盐去除效率都会受到一定程度的影响[1]。为了研究重金属Zn对亚铁氧化耦合硝酸盐还原过程的影响,本研究在亚铁氧化体系中,添加不同浓度的Zn(Ⅱ),同时测定不同处理中,亚铁和硝酸盐浓度的变化。单独添加Fe(Ⅱ)或者不添加微生物的体系中,都没有亚铁氧化过程的发生(图 1-A),说明亚铁氧化过程是由微生物驱动的,同时该微生物不能单独进行亚铁氧化过程。体系中Fe(Ⅱ)浓度在初期的下降可能是由于MOPS缓冲液对Fe(Ⅱ)有一定的吸附作用,但这种吸附作用不会影响亚铁氧化过程[25]。硝酸盐与亚铁同时存在的接种体系中,亚铁在反应12 h后被全部氧化。添加Zn(Ⅱ)的处理中,反应1 d后,溶解态Fe(Ⅱ)浓度降为0,说明Zn(Ⅱ)的添加在一定程度上抑制了Fe(Ⅱ)氧化过程,但整体上Fe(Ⅱ)氧化在整个生物反应体系中仍然活跃(图 1-A)。随后,采用添加不同浓度的Zn(Ⅱ)研究其对生物亚铁氧化的影响。结果表明随着Zn(Ⅱ)浓度增加,亚铁氧化速率逐渐下降(图 1-B)。当Zn(Ⅱ)浓度较低时(< 0.8 mmol/L),Zn(Ⅱ)对亚铁氧化的抑制作用并不明显,但当其浓度大于2 mmol/L时,对亚铁氧化过程表明出明显的抑制作用。如Zn(Ⅱ)浓度为4 mmol/L时,在反应30 d后,反应体系中只有80%的Fe(Ⅱ)被氧化。这与之前报道的砷对硝酸盐依耐型亚铁氧化菌的影响结果相一致,只有在砷的浓度达到一定程度时,才会对铁氧化菌的生长产生明显的抑制作用[21]。该研究中用到的LS-2菌株分离自华南红壤区,其水稻土Zn含量较高[26],因此LS-2菌株对Zn表现出较强的抗性,只有当Zn浓度较高时才对铁氧化过程表现明显的抑制作用(图 1-B)。
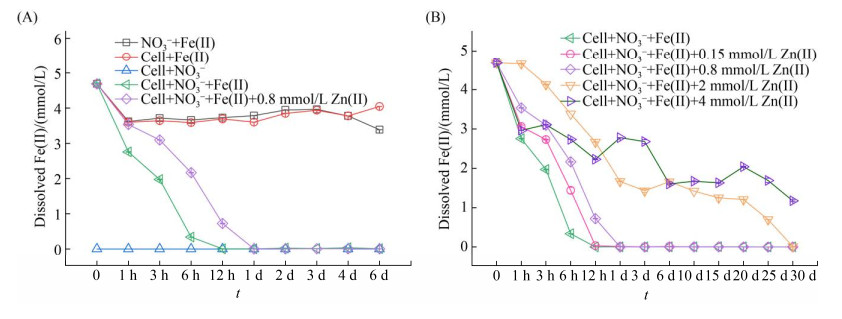 |
| 图 1 亚铁氧化耦合硝酸盐还原过程中溶解态Fe(Ⅱ)浓度的变化(A)和不同Zn(Ⅱ)浓度下溶解态Fe(Ⅱ)浓度变化(B) Figure 1 Concentrations of dissolved Fe(Ⅱ) under different treatments (A) and dissolved Fe(Ⅱ) with different Zn(Ⅱ) (B) concentrations. |
| 图选项 |
2.2 外源Zn对硝酸盐还原过程的影响 在硝酸盐还原耦合亚铁氧化过程中,测定了反应体系中NO3-的浓度,结果如图 2所示。没有接种LS-2的体系中,NO3-的浓度基本保持不变。在接种LS-2的体系中,NO3-浓度随着反应时间的延长而降低,其中,只添加NO3-的体系中,NO3-在反应1 d后基本耗尽,而添加Fe(Ⅱ)和Zn(Ⅱ)的体系中,仅有60%的硝酸盐被还原(图 2-A)。之前报道的亚铁氧化耦合硝酸盐还原过程中显示,Paracoccus denitrificans ATCC 19367和P. denitrificans 1222菌株能完全还原体系中的硝酸盐[27],但在接种P. stutzeri ATCC 17588或P. denitrificans ATCC 17741菌株的体系中,仅有17%-21%的硝酸盐被还原[28]。这说明硝酸盐的还原取决于菌株本身的性能。本研究表明,亚铁的添加在一定程度上抑制了硝酸盐的还原过程,这与之前报道的结果相一致[6]。这可能是由于亚铁氧化过程抑制了硝酸盐还原酶的活性,从而降低了硝酸盐的还原速率[6]。在LS-2菌株进行亚铁氧化过程中,形成的铁氧化物会将细胞包裹,形成结壳现象[6],阻止了硝酸盐还原酶的释放,也可能降低硝酸盐的去除效率[29]。但接种LS-2的体系中,硝酸盐还原的抑制作用比接种P. stutzeri ATCC 17588或P. denitrificans ATCC 17741体系中弱,可能是由于亚铁氧化过程中形成了不同类型的矿物(详细内容见2.3节)。LS-2进行亚铁氧化作用主要形成的是纤铁矿,而形成的纤铁矿能够促进亚铁与硝酸盐反应,促进硝酸盐的还原[6, 29]。
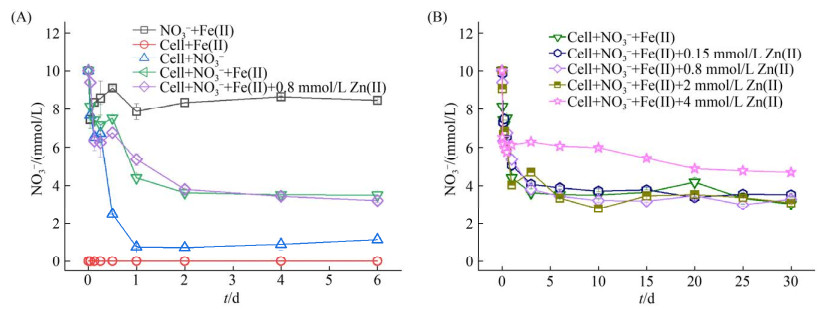 |
| 图 2 亚铁氧化耦合硝酸盐还原过程中硝酸根浓度的变化(A)和不同Zn(Ⅱ)浓度下硝酸根浓度的变化(B) Figure 2 Changes of nitrate concentration in the process of ferrous oxidation-coupled nitrate reduction(A) and Variation of nitrate concentration under different Zn(Ⅱ) concentrations(B). |
| 图选项 |
图 2-A表明添加0.8 mmol/L的Zn(Ⅱ)对硝酸盐的还原过程基本没有影响。随着Zn(Ⅱ)浓度的增加,Zn(Ⅱ)对硝酸盐还原过程的抑制作用增强。当Zn(Ⅱ)浓度达到4 mmol/L时,其对硝酸盐还原过程产生明显的抑制作用(图 2-B),硝酸盐还原速率从含有低浓度Zn(Ⅱ)体系中的0.093 mmol/d降到含有高浓度Zn(Ⅱ)体系中的0.018 mmol/d。Kiskira等报道低浓度Zn(Ⅱ)对亚铁氧化耦合硝酸盐还原过程中硝酸盐还原速率仅有4%-17%的抑制作用,但在高浓度条件下,其抑制率接近50%[1]。在沉淀物环境中,当Zn(Ⅱ)浓度超过500 mg/kg时,Zn能显著降低反硝化作用[30]。Zhang等发现环境中氧化锌的缓慢释放不仅抑制了反硝化作用,还降低了环境中微生物多样性[31]。沉积物环境相对比较复杂,同时不同的重金属的生物可利用性水平差距很大,这些因素可能造成沉积物环境中微生物对重金属的忍受浓度比较高。而在复合污染的水环境中(铜、铅、镉、锌共存),当Zn(Ⅱ)浓度仅达到32.3 mg/L时,厌氧反应器中微生物的反硝化能力降低20%-34%[22]。这可能与水环境中容纳重金属离子浓度有限有关,一旦某种重金属离子超过限度,浓度轻微的增加都可能造成严重的毒害作用[30]。Maderova和Paton研究表明土壤中溶解态Zn(Ⅱ)的浓度与生物毒性成正相关[32],说明游离态Zn(Ⅱ)可能是主要的生物可利用形态。溶液中存在过量的游离态Zn(Ⅱ)很可能直接对硝酸盐依耐型亚铁氧化菌产生毒害作用,从而阻碍反硝化过程。
2.3 亚铁氧化过程中矿物结构变化 为考察不同Zn(Ⅱ)浓度对亚铁氧化耦合硝酸盐还原过程中矿物结构的变化,本研究采用XRD对不同处理中矿物随时间的变化进行表征(图 3)。未添加Zn(Ⅱ)的体系中,LS-2驱动的亚铁氧化过程主要形成的是纤铁矿,且随着反应时间的延长,并未观测到新的矿物特征衍射峰(图 3-A)。在反应30 d后,XRD谱图中衍射峰强度较大,表明形成的纤铁矿具有较好的结晶度。这与之前Li等报道的结果一致[6]。添加低浓度的Zn(Ⅱ)体系中,形成的矿物与未添加Zn(Ⅱ)的基本一致(图 3-B、C、D、E)。低浓度的Zn(Ⅱ)并未实质影响亚铁氧化及反硝化作用(图 1和2),因此可能没有参与成矿过程或者被微生物利用从而形成二次矿物。之前的报道也表明在低浓度重金属条件下(含有铜、镍或者锌),反硝化微生物T. denitrificans和Pseudogulbenkiania strain 2002形成的铁氧化物与不添加的体系中形成的矿物结构基本一致[18]。但从图 3-B-E中,随着Zn(Ⅱ)浓度提高,形成的矿物的衍射峰强度以及锐度在不停变化,说明形成的矿物受到外界的干扰,结晶度和结构都可能在发生微小的变化。当Zn(Ⅱ)浓度达到4 mmol/L时,由于Zn(Ⅱ)的抑制作用,亚铁氧化速率变慢,反应第4天才收集到少量矿物进行表征,结果表明反应4 d后形成结晶度很弱的纤铁矿,但随着反应时间的延长,XRD图谱中衍射峰均为铁锌尖晶石的特征衍射峰,且具有较高的结晶度(图 3-F)。Qu等在研究铁锌尖晶石形成过程时,发现降低Fe(Ⅱ)的氧化速率能有效形成Fe(Ⅱ)-Fe(Ⅲ)表面络合物,从而促进铁锌尖晶石的形成[33]。因此,Zn(Ⅱ)对生物Fe(Ⅱ)氧化速率的抑制作用,可能是促进形成新矿物转变的一个重要原因。
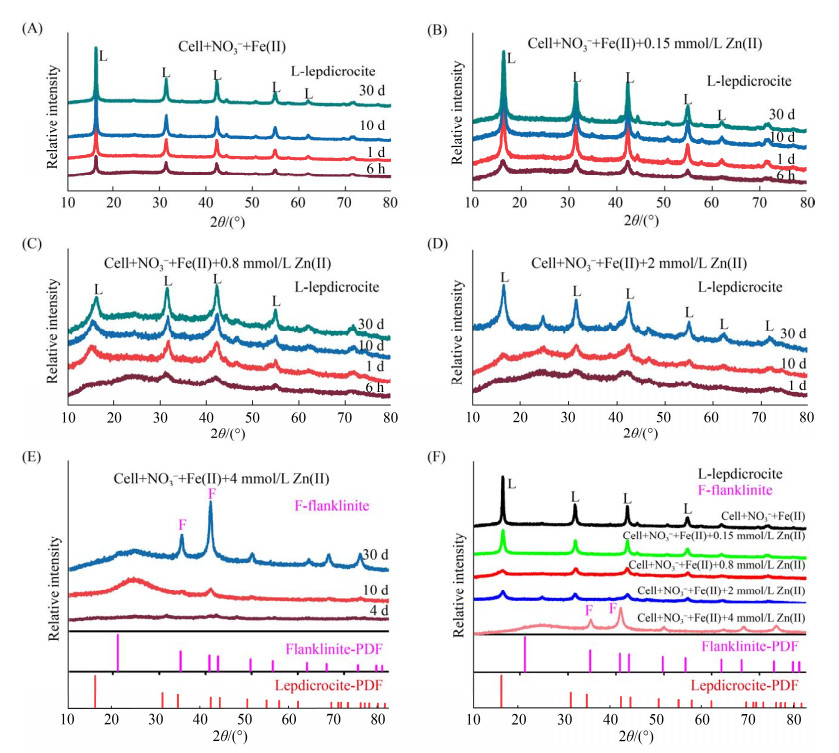 |
| 图 3 不同Zn(Ⅱ)浓度条件下形成的矿物的XRD图谱 Figure 3 XRD patterns of minerals formed under different Zn(Ⅱ) concentrations. The concentration of Zn(Ⅱ) in A-E is 0, 0.15, 0.8, 2.0, 4.0 mmol/L, respectively; F shows the XRD patterns of all treatments after 30 days of reaction. |
| 图选项 |
为了探明形成矿物差异的原因,测定了溶解态和吸附态Zn的浓度,结果如图 4所示。结果表明Zn(Ⅱ)在Fe(Ⅱ)氧化过程中,主要以吸附态存在,说明生物Fe(Ⅱ)氧化形成的矿物能作为有效的载体吸附环境中的重金属[16]。本研究中,添加0.15、0.8和4 mmol/L Zn(Ⅱ)的体系中,Zn(Ⅱ)的去除率分别为95.8%、78.7%和86.0%。同时,通过计算质量平衡,发现在低浓度Zn(Ⅱ)条件下,Zn(Ⅱ)的存在形式为游离态和吸附态,并未进入形成的矿物中(图 3、图 4),说明低浓度体系中,Zn(Ⅱ)主要通过吸附作用从体系中去除。当Zn(Ⅱ)浓度达到4 mmol/L时,其吸附量明显增加,使得Zn(Ⅱ)发生置换的机会也增加。在硝酸盐依赖型亚铁氧化菌LS-2的作用下,形成的铁氧化物容易结壳,包裹于微生物表面,阻止微生物进一步的呼吸作用[6]。大量Zn(Ⅱ)的吸附导致结痂现象更为严重,使得微生物进一步氧化Fe(Ⅱ)的机会变小,形成的矿物量也会减少。Zn(Ⅱ)与Fe(Ⅱ)的离子半径接近,当大量Zn(Ⅱ)吸附在矿物表面时,容易与Fe(Ⅱ)发生置换,取代分布在矿物结构中占据八面体位置的Fe(Ⅱ),从而形成铁锌尖晶石(图 3)[34]。含Zn(Ⅱ)的体系中,形成二次矿物的可能原因有吸附和共沉淀两个过程。前人的研究表明,生物亚铁氧化过程能通过共沉淀过程与重金属离子形成新的矿物[16-35]。同时,亚铁的化学氧化在共沉淀作用下也能形成铁锌尖晶石。亚铁氧化的生物过程与非生物过程中当重金属浓度相对较大时,除了离子置换作用,共沉淀作用可与成矿过程形成新的二次矿物。对于重金属的去除过程,相比于吸附固定,形成二次矿物能更有效地固定环境中的重金属,使得其更难以重新释放到环境中。但Zn(Ⅱ)是如何影响硝酸盐还原、微生物的生长以及Zn(Ⅱ)进入矿物结构形成二次矿物的机制仍需要进一步的研究,如Zn(Ⅱ)浓度对Zn(Ⅱ)转运蛋白的影响、Zn(Ⅱ)在矿物结构表面形态与吸附状态的实时变化等。
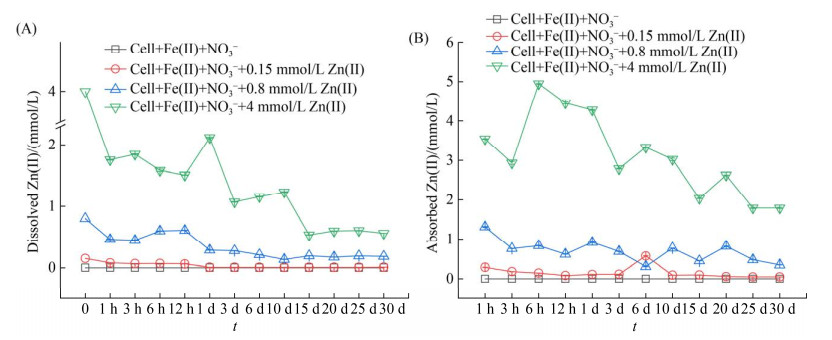 |
| 图 4 硝酸根还原耦合亚铁氧化过程中溶解态Zn(Ⅱ)的变化(A)和吸附态Zn(Ⅱ)的变化(B) Figure 4 Changes of dissolved Zn(Ⅱ) (A) and adsorbed Zn(Ⅱ) (B) in the process of nitric acid reduction coupled with ferrous oxidation. |
| 图选项 |
3 结论 伴随着矿山开采、城市化进程、农田肥料的使用,大量锌元素进入土壤系统,使得土壤微生物群暴露在高锌环境中。本研究通过添加不同浓度的Zn(Ⅱ),研究锌对生物亚铁氧化过程中反硝化及成矿过程的影响。低浓度Zn(Ⅱ)体系中,锌对亚铁氧化和硝酸盐还原两个过程皆有微弱的抑制作用。随着Zn(Ⅱ)浓度增加,其抑制作用加强。同时,亚铁氧化过程形成的矿物通过吸附、共沉淀和离子置换等过程有效地固定Zn(Ⅱ),降低Zn(Ⅱ)活性。添加不同浓度Zn(Ⅱ)的体系中,在反应10 d后锌的去除率均达到70%以上。成矿过程中,共存Zn(Ⅱ)会降低形成矿物的结晶度以及改变矿物类型。在不添加Zn(Ⅱ)和低浓度Zn(Ⅱ)的体系中,生物亚铁氧化过程主要形成的是纤铁矿,当Zn(Ⅱ)浓度增加时,主要形成的矿物为铁锌尖晶石,部分锌进入到形成的矿物结构中,形成二次矿物。低浓度Zn(Ⅱ)体系中Zn(Ⅱ)的去除主要是吸附作用,而高浓度体系中主要是吸附、共沉淀和置换的共同作用。本研究有助于深入认识中性厌氧环境(如淹水稻田、湖泊沉积物等)中重金属与微生物驱动的铁循环和反硝化过程的耦合作用,为土壤重金属污染防治提供理论支撑。
References
| [1] | Kiskira K, Papirio S, Fourdrin C, van Hullebusch ED, Esposito G. Effect of Cu, Ni and Zn on Fe(Ⅱ)-driven autotrophic denitrification. Journal of Environmental Management, 2018, 218: 209-219. |
| [2] | Smith RL, Kent DB, Repert DA, B?hlke JK. Anoxic nitrate reduction coupled with iron oxidation and attenuation of dissolved arsenic and phosphate in a sand and gravel aquifer. Geochimica et Cosmochimica Acta, 2017, 196: 102-120. DOI:10.1016/j.gca.2016.09.025 |
| [3] | Bi JJ, Peng CS, Xu HZ. Review of research on groundwater nitrate pollution and its removal. Ground Water, 2010, 32(1): 97-102. (in Chinese) 毕晶晶, 彭昌盛, 胥慧真. 地下水硝酸盐污染与治理研究进展综述. 地下水, 2010, 32(1): 97-102. DOI:10.3969/j.issn.1004-1184.2010.01.042 |
| [4] | Hedrich S, Schl?mann M, Johnson DB. The iron-oxidizing proteobacteria. Microbiology: Reading, England, 2011, 157(Pt 6): 1551-1564. |
| [5] | Hansen HCB, Koch CB, Nancke-Krogh H, Borggaard OK, S?rensen J. Abiotic nitrate reduction to ammonium: key role of green rust. Environmental Science & Technology, 1996, 30(6): 2053-2056. |
| [6] | Li S, Li XM, Li FB. Fe(Ⅱ) oxidation and nitrate reduction by a denitrifying bacterium, Pseudomonas stutzeri LS-2, isolated from paddy soil. Journal of Soils and Sediments, 2018, 18(4): 1668-1678. DOI:10.1007/s11368-017-1883-1 |
| [7] | Roden EE. Microbial iron-redox cycling in subsurface environments. Biochemical Society Transactions, 2012, 40(6): 1249-1256. DOI:10.1042/BST20120202 |
| [8] | Weber KA, Achenbach LA, Coates JD. Microorganisms pumping iron: anaerobic microbial iron oxidation and reduction. Nature Reviews Microbiology, 2006, 4(10): 752-764. DOI:10.1038/nrmicro1490 |
| [9] | Straub KL, Benz M, Schink B, Widdel F. Anaerobic, nitrate-dependent microbial oxidation of ferrous iron. Applied and Environmental Microbiology, 1996, 62(4): 1458-1460. DOI:10.1128/AEM.62.4.1458-1460.1996 |
| [10] | Kappler A, Straub KL. 5. geomicrobiological cycling of iron. Banfield JF, Cervini-Silva J, Nealson K. eds. Molecular Geomicrobiology. Berlin, Boston: De Gruyter, 2005: 85-108. |
| [11] | Straub KL, Sch?nhuber WA, Buchholz-Cleven BEE, Schink B. Diversity of ferrous iron-oxidizing, nitrate-reducing bacteria and their involvement in oxygen-independent iron cycling. Geomicrobiology Journal, 2004, 21(6): 371-378. DOI:10.1080/01490450490485854 |
| [12] | Zou G, Papirio S, Ylinen A, Capua F, Lakaniemi AM, Puhakka JA. Fluidized-bed denitrification for mine waters.Part Ⅱ: effects of Ni and Co.. Biodegradation, 2014, 25(3): 417-423. |
| [13] | Gikas P. Single and combined effects of nickel (Ni(Ⅱ)) and cobalt (Co(Ⅱ)) ions on activated sludge and on other aerobic microorganisms: a review. Journal of Hazardous Materials, 2008, 159(2/3): 187-203. |
| [14] | Giller KE, Witter E, McGrath SP. Heavy metals and soil microbes. Soil Biology and Biochemistry, 2009, 41(10): 2031-2037. DOI:10.1016/j.soilbio.2009.04.026 |
| [15] | Hemmat-Jou MH, Safari-Sinegani AA, Che RX, Mirzaie-Asl A, Tahmourespour A, Tahmasbian I. Toxic trace element resistance genes and systems identified using the shotgun metagenomics approach in an Iranian mine soil. Environmental Science and Pollution Research, 2021, 28(4): 4845-4856. DOI:10.1007/s11356-020-10824-x |
| [16] | Tong H, Liu CS, Hao LK, Swanner ED, Chen MJ, Li FB, Xia YF, Liu YH, Liu YN. Biological Fe(Ⅱ) and As(Ⅲ) oxidation immobilizes arsenic in micro-oxic environments. Geochimica et Cosmochimica Acta, 2019, 265: 96-108. DOI:10.1016/j.gca.2019.09.002 |
| [17] | Tong H, Zheng CJ, Li B, Swanner ED, Liu CS, Chen MJ, Xia YF, Liu YH, Ning ZP, Li FB, Feng XB. Microaerophilic oxidation of Fe(Ⅱ) coupled with simultaneous carbon fixation and as(Ⅲ) oxidation and sequestration in karstic paddy soil. Environmental Science & Technology, 2021, 55(6): 3634-3644. |
| [18] | Kiskira K, Papirio S, Mascolo MC, Fourdrin C, Pechaud Y, van Hullebusch ED, Esposito G. Mineral characterization of the biogenic Fe(Ⅲ)(hydr) oxides produced during Fe(Ⅱ)-driven denitrification with Cu, Ni and Zn. Science of the Total Environment, 2019, 687: 401-412. DOI:10.1016/j.scitotenv.2019.06.107 |
| [19] | Dixit S, Hering JG. Comparison of arsenic(Ⅴ) and arsenic(Ⅲ) sorption onto iron oxide minerals: implications for arsenic mobility. Environmental Science & Technology, 2003, 37(18): 4182-4189. |
| [20] | Zouboulis AI, Katsoyiannis IA. Recent advances in the bioremediation of arsenic-contaminated groundwaters. Environment International, 2005, 31(2): 213-219. DOI:10.1016/j.envint.2004.09.018 |
| [21] | Hohmann C, Winkler E, Morin G, Kappler A. Anaerobic Fe(Ⅱ)-oxidizing bacteria show as resistance and immobilize as during Fe(Ⅲ) mineral precipitation. Environmental Science & Technology, 2010, 44(1): 94-101. |
| [22] | Feng B, Fang Z, Hou JC, Ma X, Huang YL, Huang LQ. Effects of heavy metal wastewater on the anoxic/aerobic-membrane bioreactor bioprocess and membrane fouling. Bioresource Technology, 2013, 142: 32-38. DOI:10.1016/j.biortech.2013.05.019 |
| [23] | 李爽. 水稻土厌氧硝酸盐还原耦合亚铁氧化与砷氧化机制. 中国科学院大学博士学位论文, 2018. |
| [24] | Kiskira K, Papirio S, van Hullebusch ED, Esposito G. Fe(Ⅱ)-mediated autotrophic denitrification: a new bioprocess for iron bioprecipitation/biorecovery and simultaneous treatment of nitrate-containing wastewaters. International Biodeterioration & Biodegradation, 2017, 119: 631-648. |
| [25] | Buchholz A, Laskov C, Haderlein SB. Effects of Zwitterionic buffers on sorption of ferrous iron at goethite and its oxidation by CCl4. Environmental Science & Technology, 2011, 45(8): 3355-3360. |
| [26] | Liu Z. Regularities of content and distribution of zinc in soils of China. Scientia Agricutura Sinica, 1994, 27(1): 30-37. (in Chinese) 刘铮. 我国土壤中锌含量的分布规律. 中国农业科学, 1994, 27(1): 30-37. |
| [27] | Klueglein N, Zeitvogel F, Stierhof YD, Floetenmeyer M, Konhauser KO, Kappler A, Obst M. Potential role of nitrite for abiotic Fe(Ⅱ) oxidation and cell encrustation during nitrate reduction by denitrifying bacteria. Applied and Environmental Microbiology, 2014, 80(3): 1051-1061. DOI:10.1128/AEM.03277-13 |
| [28] | Muehe EM, Gerhardt S, Schink B, Kappler A. Ecophysiology and the energetic benefit of mixotrophic Fe(Ⅱ) oxidation by various strains of nitrate-reducing bacteria. FEMS Microbiology Ecology, 2009, 70(3): 335-343. DOI:10.1111/j.1574-6941.2009.00755.x |
| [29] | Klueglein N, Kappler A. Abiotic oxidation of Fe(Ⅱ) by reactive nitrogen species in cultures of the nitrate-reducing Fe(Ⅱ) oxidizer Acidovorax sp. BoFeN1-questioning the existence of enzymatic Fe(Ⅱ) oxidation. Geobiology, 2013, 11(2): 180-190. DOI:10.1111/gbi.12019 |
| [30] | Sakadevan K, Zheng H, Bavor HJ. Impact of heavy metals on denitrification in surface wetland sediments receiving wastewater. Water Science and Technology, 1999, 40(3): 349-355. DOI:10.2166/wst.1999.0181 |
| [31] | Zhang XJ, Zhang N, Fu HQ, Chen T, Liu S, Zheng SH, Zhang J. Effect of zinc oxide nanoparticles on nitrogen removal, microbial activity and microbial community of CANON process in a membrane bioreactor. Bioresource Technology, 2017, 243: 93-99. DOI:10.1016/j.biortech.2017.06.052 |
| [32] | Maderova L, Paton GI. Deployment of microbial sensors to assess zinc bioavailability and toxicity in soils. Soil Biology and Biochemistry, 2013, 66: 222-228. DOI:10.1016/j.soilbio.2013.07.017 |
| [33] | Qu SC, Yang HB, Ren DW, Kan SH, Zou GT, Li DM, Li MH. Magnetite nanoparticles prepared by precipitation from partially reduced ferric chloride aqueous solutions. Journal of Colloid and Interface Science, 1999, 215(1): 190-192. DOI:10.1006/jcis.1999.6185 |
| [34] | Cornell RM, Schwertmann U. Cation Substitution. The Iron Oxides: Structure, Properties, Reactions, Occurences and Uses, Second Edition. Wiley-VCH Verlag GmbH & Co. KGaA, 2004. |
| [35] | Xiu W, Guo H, Liu Q, Liu Z, Zou Y, Zhang B. Arsenic removal and transformation by Pseudomonas sp. StrainGE-1induced ferrihydrite: Co-precipitation versus adsorption. Springer International Publishing, 2015, 226(6): 1-14. DOI:10.1007/s11270-015-2408-4 |
