杨泽胜1,2,3, 陈国俊2, 张相杰2, 程宽2, 龙明亮2, 刘同旭2


1. 中国科学院广州地球化学研究所, 广东 广州 510640;
2. 广东省科学院生态环境与土壤研究所, 华南土壤污染控制与修复国家地方联合工程研究中心, 广东省农业环境综合治理重点实验室, 广东 广州 510650;
3. 中国科学院大学, 北京 100049
收稿日期:2020-11-19;修回日期:2021-01-06;网络出版日期:2021-01-18
基金项目:国家自然科学基金(41977028,41807026)
作者简介:刘同旭,研究员、博士生导师,担任广东省科学院生态环境与土壤研究所土壤分子过程团队负责人,兼任中国土壤学会土壤化学专业委员会副主任。研究方向为微生物-矿物相互作用及环境效应。曾获国家自然科学优秀青年基金、广东省****基金、澳大利亚新南威尔士大学Vice-Chancellor's Postdoctoral Research Fellowship,入选广东省特支计划科技创新领军人才。发表SCI论文85篇,包括Environmental Science & Technology、Geochimica et Cosmochimica Acta等环境科学与地球化学权威期刊,入选封面/高被引/热点论文8篇。授权发明专利12项,包括国际发明专利4项。获第十五届广东省丁颖科技奖(2019)、2项中国专利优秀奖(2010、2016)、3项广东省科学技术一等奖(2006、2016、2020),以及中国土壤学会优秀青年****奖和中国环境科学学会青年科技奖等.
*通信作者:刘同旭, Tel/Fax: +86-20-87025180; E-mail: txliu@soil.gd.cn.
摘要:[目的] 探究不同菌浓度和亚铁浓度条件下,Acidovorax sp.strain BoFeN1介导的厌氧亚铁氧化耦合硝酸盐还原过程的动力学和次生矿物。[方法] 构建包含菌BoFeN1、硝酸盐、亚铁的厌氧培养体系,测试硝酸根、亚硝酸根、乙酸根、亚铁等浓度,并收集次生矿物,采用XRD、SEM进行矿物种类和形貌表征。[结果] 在微生物介导硝酸盐还原耦合亚铁氧化的体系中,高菌浓度促进硝酸盐还原,对亚铁氧化也有一定促进作用;高浓度亚铁在低菌浓度下氧化反应速率和程度降低,但是在高菌浓度下无明显影响;亚铁浓度越高次生矿物结晶度越高,但对硝酸盐还原具有一定抑制作用。在微生物介导亚硝酸盐还原耦合亚铁氧化的体系中,高的菌浓度和亚铁浓度都会促进亚硝酸盐还原,但亚铁氧化的次生矿物会对亚硝酸盐的微生物还原产生较强的抑制作用,次生矿物的种类和结晶度主要受亚铁浓度影响。[结论] 硝酸盐还原主要是生物反硝化作用,亚硝酸盐还原包含生物反硝化和化学反硝化两部分,在硝酸盐体系中亚铁氧化与次生矿物生成是受生物和化学反硝化作用的共同影响,但亚硝酸盐体系中亚铁氧化与次生矿物生成主要是受化学反硝化作用影响。该研究可为深入理解厌氧微生物介导铁氮耦合反应机制提供基础数据和理论支撑。
关键词:Acidovorax sp. strain BoFeN1硝酸盐还原亚铁氧化含铁矿物
Kinetics and influencing factors of microbially-mediated nitrate reduction coupled with Fe(Ⅱ) oxidation process
Yang Zesheng1,2,3, Chen Guojun2, Zhang Xiangjie2, Cheng Kuan2, Long Mingliang2, Liu Tongxu2


1. Guangzhou Institute of Geochemistry, Chinese Academy of Sciences, Guangzhou 510640, Guangdong Province, China;
2. Institute of Eco-environmental and Soil Sciences, Guangdong Academy of Sciences, National-Regional Joint Engineering Research Center for Soil Pollution Control and Remediation in South China, Guangdong Key Laboratory of Integrated Agro-environmental Pollution Control and Management, Guangzhou 510650, Guangdong Province, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
Received: 19 November 2020; Revised: 6 January 2021; Published online: 18 January 2021
*Corresponding author: Tongxu Liu, Tel/Fax: +86-20-87025180; E-mail: txliu@soil.gd.cn.
Foundation item: Supported by the National Natural Science Foundation of China (41977028, 41807026)
Abstract: [Objective] This study aims to investigate the effects of cell density and Fe(Ⅱ) concentrations on the kinetics and secondary minerals during nitrate reduction and Fe(Ⅱ) oxidation by Acidovorax sp. strain BoFeN1 under anoxic condition. [Methods] The anaerobic culture system containing strain BoFeN1, nitrate and Fe(Ⅱ) was set up; the concentrations of nitrate, nitrite, acetate, Fe(Ⅱ) were determined with the use of ion chromatography and microplate reader; and the mineralogy and morphology of the secondary minerals were characterized by using XRD and SEM. [Results] In the system of microbially-mediated nitrate (NO3-) reduction coupled with Fe(Ⅱ) oxidation, high cell density substantially promoted nitrate reduction and Fe(Ⅱ) oxidation. With low cell density, the Fe(Ⅱ) oxidation reaction rate and extent of reaction declined for the high concentrations of Fe(Ⅱ), while no obvious effect was observed in the high cell density. The higher crystallinity of secondary minerals was generated and inhibited the nitrate reduction to some extent. In the system of microbially-mediated nitrite (NO2-) reduction coupled with Fe(Ⅱ) oxidation, the high cell density and Fe(Ⅱ) concentration promoted the nitrite reduction, but the Fe(Ⅱ) oxidation had a strong inhibitory effect on the microbial reduction of nitrite, and the types and crystallinity of secondary minerals were mainly affected by the concentration of Fe(Ⅱ). [Conclusion] Biological denitrification is the main process controlling nitrate reduction; nitrite reduction was contributed by both of the biological and chemical denitrification; biological and chemical denitrification are the main reasons for Fe(Ⅱ) oxidation and secondary mineral formation in the nitrate system; but chemical denitrification is the main reason for Fe(Ⅱ) oxidation and secondary mineral formation in the nitrite system. This study can provide basic data and theoretical support for the coupling reactions of iron and nitrogen mediated by anaerobic microorganisms.
Keywords: Acidovorax sp. strain BoFeN1nitrate reductionferrous oxidationiron-containing minerals
铁元素是地壳中含量第四丰富的元素,仅次于氧、硅、铝元素[1-2],同时铁元素也是地壳上分布最为广泛的变价金属之一。铁元素与碳、氮、氧和硫的氧化还原耦合过程,驱动了地球表层的主要生物地球化学循环[3-4]。自然界的亚铁氧化与其氧逸度密切相关,可以分为好氧和厌氧条件下两种不同的形式,其中好氧条件体系下主要是以化学的氧化为主[5];微生物介导的厌氧铁氧化过程主要有微需氧型微生物、光营养型微生物、硝酸盐还原微生物三种形式对亚铁进行氧化[6-11]。而微生物介导的硝酸盐还原耦合亚铁氧化过程在不同生境中广泛存在,例如各种沉积物、稻田土壤等[12-13]。环境效应方面,亚铁氧化本身是铁循环重要过程,可以影响矿物形成演化、重金属固定;硝酸盐还原可以影响氮素污染转化、温室气体排放[14-15]。因此,微生物介导的厌氧硝酸盐还原耦合亚铁氧化过程得到国际上广泛关注。
Straub等在1996年报道了微生物驱动的硝酸盐还原亚铁氧化过程[10]。在中性厌氧条件下,微生物介导的硝酸盐还原耦合亚铁氧化可以生成的铁-氢氧化物,通过吸附和共沉淀的方式影响环境中的As等重金属的迁移转化[16-19],所以微生物介导的硝酸盐还原亚铁氧化成矿对地球化学环境有很重要的环境意义。2005年,Kappler等科学家从康斯坦斯湖底沉积物中分离得到Acidovorax sp. strain BoFeN1,该菌是一个化能异养型的硝酸盐还原-亚铁氧化微生物。微生物BoFeN1是以硝酸盐为电子受体,亚铁为电子供体,乙酸盐为碳源,最后氧化二价铁生成三价铁矿物[20];同时,硝酸盐通过微生物还原生成亚硝酸盐,而亚硝酸盐可以继续还原生成一氧化氮,再通过生物反硝化生成了氧化亚氮以及氮气,例如,菌BoFeN1还原硝酸盐的产物有亚硝酸盐,最后再被微生物还原为氧化亚氮[18, 21-22]。上述过程主要由微生物相关功能基因和所表达的蛋白完成。值得注意的是,硝酸盐不能直接与亚铁反应,但是硝酸盐还原的中间产物亚硝酸盐可以与亚铁发生快速的化学反应[23-26],即化学反硝化过程。上述过程生成的三价铁矿物会导致很明显的细胞结壳现象,而且在细胞周质也出现了亚铁氧化生成的三价铁矿物[27-28]。该次生矿物主要包括针铁矿或纤铁矿或有少量的绿绣等矿物[18, 29]。据报道,不同微生物种类以及微生物的菌量,会导致矿物的结晶度不同[30]。硝酸盐还原的第一步产物是亚硝酸盐,在微生物参与下,亚硝酸盐的生物还原和化学反硝化作用是亚硝酸盐还原的两个主要途径[31-32]。硝酸盐还原微生物能够表达亚硝酸盐还原酶Nir将亚硝酸盐还原[21, 33]。硝酸盐还原的中间产物亚硝酸盐可以将亚铁通过化学反应氧化,同时微生物也会对亚铁进行生物氧化,因此,亚铁的微生物氧化与亚硝酸盐化学氧化形成了竞争关系[34]。但是在实际环境中,微生物的生长条件都会受到其他环境因素的影响,使得在厌氧环境体系中微生物的量、亚铁的浓度不尽相同,从而导致其产物和动力学各不相同,进而对不同体系的其他反应过程造成不同程度影响。
硝酸盐还原亚铁氧化菌Acidovorax sp. strain BoFeN1是一个典型的兼性营养型硝酸盐还原亚铁氧化菌,在有碳源的条件下进行硝酸盐的还原亚铁氧化反应[35]。尽管前人对于该过程已经有了大量研究,但是对于菌浓度和亚铁浓度对该过程的影响研究较少,因此,本文主要针对菌量和亚铁浓度这两个关键的反应参数,构建厌氧硝酸盐还原耦合亚铁氧化的实验体系,详细研究各物质的动力学以及次生矿物生成情况,主要研究目的是:探明菌量和亚铁浓度对于亚铁、硝酸盐转化动力学及次生矿物的影响;揭示微生物介导硝酸盐还原耦合亚铁氧的反应机制。该研究可以加深对复杂多变的环境条件下铁氮耦合过程的理解,具有重要的生物地球化学意义。
1 材料和方法 1.1 实验材料 本次实验采用的硝酸盐还原型亚铁氧化菌是Acidovorax sp. strain BoFeN1,来自德国微生物菌种保存中心(DSMZ)。使用的试剂包括FeCl2·4H2O (阿拉丁有限公司,纯度99%)、乙酸钠(广州化学试剂厂,纯度99%)、硝酸钠和亚硝酸钠(国药集团化学试剂有限公司,纯度99%),微生物缓冲液采用哌嗪-1, 4-二乙磺酸(PIPES)(北京百灵威科技有限公司,纯度99%)。其他化学试剂购自广州化学试剂厂。
1.2 微生物培养 解冻活化菌种的具体操作为:首先将菌从-80 ℃冰箱中取出解冻并置于超净工作台。配制矿物质培养基B,采用PIPES 9.07 g/L作为缓冲液,KH2PO4 0.14 g/L、NH4Cl 0.3 g/L、MgCl2·6H2O 0.42 g/L、CaCl2·2H2O 0.1 g/L、NaCl 0.3 g/L[18, 36],并进行高温高压灭菌处理。用无菌注射器接种2 mL菌悬液注射到40 mL厌氧的无机培养基中。用无菌注射器加入1 mL已用0.22 μm滤头过滤灭菌的微量元素和维生素到培养基中,在30 ℃培养箱中避光静置活化培养24 h后,再次以相同的步骤将已活化培养的菌液接种到新的培养基中,30 ℃避光静置培养16 h后,将所得菌液离心收集,去除上清液后,使用30 mmol/L已灭菌的PIPES将离心沉淀的菌重悬清洗,再次离心,重复上述步骤2次。最后得到的菌液用高纯氮气曝气40 min后加入到反应体系中。
1.3 反应体系构建 本研究设计2个实验体系,分别是以硝酸盐和亚硝酸盐作为氮源,包括:Cells+Fe(Ⅱ)+NO3-+acetate和Cells+Fe(Ⅱ)+NO2-+acetate的处理组以及Fe(Ⅱ)+NO2-+acetate的空白对照组。每个体系设置不同的亚铁浓度和菌浓度。浓度各自设计为:空白对照组不加菌,对应Fe(Ⅱ)为0.5、2、5 mmol/L的反应体系;OD600为0.2,对应Fe(Ⅱ)为0.5、2、5 mmol/L的反应体系;OD600为1.0,对Fe(Ⅱ)为0.5、2、5 mmol/L的反应体系。反应体系中配制30 mmol/L PIPES,加入3 mmol/L乙酸盐,加入5 mmol/L的硝酸盐/亚硝酸盐,然后加入不同浓度的亚铁和菌。以上操作均在厌氧箱中操作,厌氧避光静置培养124 h。
1.4 反应物和产物测试 实验测试指标:硝酸根、亚硝酸根、乙酸根和亚铁浓度。在实验过程中采取连续在0、3、10、20、36、56、80、100、124 h取样,整个取样过程在厌氧箱中使用无菌注射器进行取样。其中硝酸根、亚硝酸根、乙酸根取样共0.6 mL之后,马上曝氧气15 min,然后用0.22 μm滤膜过滤,放入到-40 ℃冰箱中保存。在整个取样完成之后,使用离子色谱(DionexICS-90,美国戴安(DIONEX)公司)测试硝酸根、亚硝酸根和乙酸根浓度。亚铁的测试:包括游离态加吸附态的亚铁,在厌氧箱中取样0.2 mL到离心管中后,向离心管中加入40 mmol/L 0.8 mL的氨基磺酸,然后取出样品,放入摇床,在180 r/min下提取1.5 h,之后使用0.22 μm的滤头过滤,取滤液加入邻菲罗啉和乙酸钠缓冲液避光显色5 min,最后使用酶标仪在510 nm波长处测试吸光值。分别在X射线衍射仪(D2phaser,德国布鲁克AXS公司)测试矿物的晶体结构,在扫描电子显微镜(PhenomProX,荷兰)测试矿物和菌体形貌[34]。
2 结果和讨论 2.1 硝酸盐还原耦合亚铁氧化的动力学与次生矿物 在不同菌浓度和亚铁浓度条件下,测试亚铁氧化和硝酸盐还原的反应动力学,结果显示(图 1),硝酸根、亚铁和乙酸盐的衰减速率都与亚铁、菌浓度密切相关。硝酸盐还原结果如图 1-A和1-B所示,反应速率见表 1。在菌浓度OD600为0.2的体系中,硝酸盐的还原在亚铁浓度为0.5 mmol/L和2.0 mmol/L条件下非常接近,但是在5 mmol/L亚铁条件下,硝酸盐还原的量低于0.5 mmol/L和2 mmol/L亚铁体系。但是对于OD600为1.0的反应体系下,其总体反应速率高于OD600为0.2的体系。亚铁浓度从0.5 mmol/L提高至2 mmol/L时,硝酸盐的还原速率略有加速。亚铁提高至5 mmol/L时,硝酸盐还原速率反而下降,但OD600=1.0条件下,随着反应时间延长,其还原程度高于0.5 mmol/L和2 mmol/L亚铁体系。而在整个过程中硝酸盐还原的第一中间产物亚硝酸盐生成结果如图 1-C和1-D,说明基本该过程亚硝酸盐没有长时间积累。上述结果说明,菌浓度对于硝酸盐还原是主要影响因素,较低亚铁浓度对硝酸盐还原影响不显著,高浓度亚铁对硝酸盐还原具有一定抑制作用。
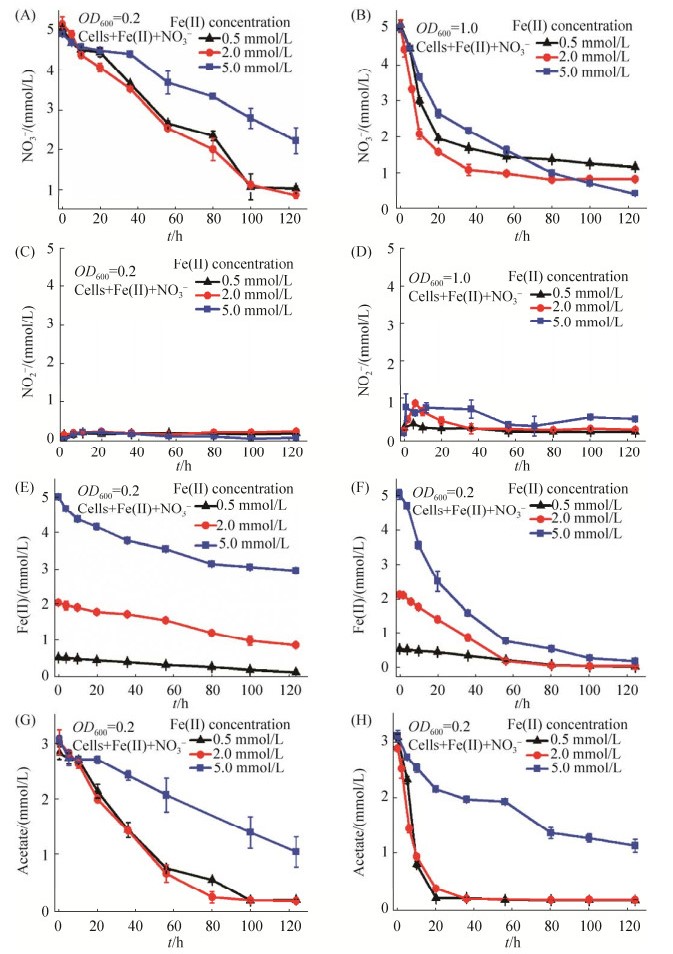 |
| 图 1 不同亚铁浓度(0.5、2.0、5.0 mmol/L)与菌浓度(OD600为0.2、1.0)条件下,硝酸盐还原、亚硝酸盐生成、亚铁氧化、乙酸盐消耗的反应动力学曲线 Figure 1 The kinetic results of nitrate reduction, nitrite formation, Fe(Ⅱ) oxidation, and acetate consumption with different initial Fe(Ⅱ) concentrations (0.5, 2.0 and 5.0 mmol/L) and different initial cell density (OD600 0.2 and 1.0). Error bars represent the standard deviation of the mean (n=3). |
| 图选项 |
表 1. 硝酸盐体系下亚铁氧化、硝酸盐还原、乙酸盐消耗的反应速率 Table 1. The reaction rate of Fe(Ⅱ) oxidation, nitrate reduction, and acetate consumption in nitrate system
| OD600 | c(Fe(Ⅱ)/mmol/L) | KFe(Ⅱ)/(h-1) | r2 | Knitrate/(h-1) | r2 | Kacetate/(h-1) | r2 |
| 0.2 | 0.5 | 0.012 | 0.968 | 0.014 | 0.946 | 0.024 | 0.968 |
| 2.0 | 0.007 | 0.977 | 0.015 | 0.981 | 0.027 | 0.962 | |
| 5.0 | 0.004 | 0.938 | 0.006 | 0.964 | 0.008 | 0.980 | |
| 1.0 | 0.5 | 0.029 | 0.966 | 0.032 | 0.890 | 0.141 | 0.978 |
| 2.0 | 0.039 | 0.957 | 0.043 | 0.904 | 0.076 | 0.954 | |
| 5.0 | 0.028 | 0.989 | 0.019 | 0.992 | 0.008 | 0.955 |
表选项
亚铁氧化动力学如图 1-E和1-F所示,反应速率见表 1。OD600为0.2体系中,5 mmol/L亚铁中反应速率最慢,在124 h时反应不完全,剩余2.94 mmol/L,仅反应了总亚铁的41.2%;在2 mmol/L亚铁体系中,反应124 h降至0.866 mmol/L,反应了57.5%;初始0.5 mmol/L亚铁在124 h反应了78.4%。OD600为1.0体系中,同样是亚铁浓度为5 mmol/L条件下的反应最慢,但是与图 1-E相比,亚铁氧化更加彻底,从初始5 mmol/L亚铁反应了96.6%,初始2 mmol/L亚铁反应了98.5%,初始0.5 mmol/L亚铁反应了98.1%。由上述结果可知,亚铁浓度和菌浓度都对其反应速率和亚铁氧化反应程度产生影响,菌浓度越高对亚铁氧化的速率和反应程度越高,而亚铁浓度越高,在低菌浓度体系下则反应速率越慢,且亚铁氧化反应程度降低,但高菌浓度条件下反应速率和程度无明显差异。
电子供体乙酸盐的消耗动力学如图 1-G和1-H所示,平均反应速率见表 1。对于OD600为0.2体系,乙酸盐的动力学曲线和硝酸盐的动力学曲线趋势呈现相似规律,5 mmol/L亚铁体系中的乙酸盐消耗量低于0.5 mmol/L和2 mmol/L体系,且0.5 mmol/L和5 mmol/L体系中的乙酸盐消耗更彻底。在OD600为1.0体系中,不同亚铁浓度下呈现相同规律,5 mmol/L亚铁体系下的乙酸盐消耗速率比2 mmol/L和0.5 mmol/L亚铁体系更慢,且在2 mmol/L和0.5 mmol/L亚铁体系下乙酸盐的消耗速率非常快,在接近40 h时已经完全被消耗。上述结果说明亚铁浓度会影响到乙酸盐的消耗程度和速率,在相对较低的亚铁浓度条件下高浓度菌则加速乙酸盐的消耗,而高浓度亚铁抑制乙酸盐消耗。
亚铁被氧化成了三价铁矿物沉淀下来,利用XRD和SEM对反应124 h后的次生矿物沉淀进行表征。如图 2-A,OD600为0.2体系中,生成的结晶态矿物主要是针铁矿,随着亚铁浓度提高,成矿的结晶度不断提高。如图 2-B,OD600为1.0体系成矿情况相似,生成的矿物也主要为针铁矿,成矿的结晶度也随亚铁浓度不断提高。SEM结果如图 3所示,菌浓度OD600为0.2时,随着亚铁浓度逐渐提高,菌体表面次生矿物沉淀不断增多;菌浓度OD600为1.0时呈现出相似的结果,菌体表面次生矿物随着亚铁浓度提高不断增多,且所有的次生矿物主要都呈团聚的球形。两个菌浓度体系下5 mmol/L亚铁中,微生物细胞都几乎完全被次生矿物包裹,出现很明显的细胞表面结壳。因此,从上述表征结果可以看出,菌浓度对次生矿物形成没有显著影响,但是亚铁浓度对次生矿物类型和结晶程度有显著影响,高浓度亚铁有利于形成高结晶度次生铁矿物。
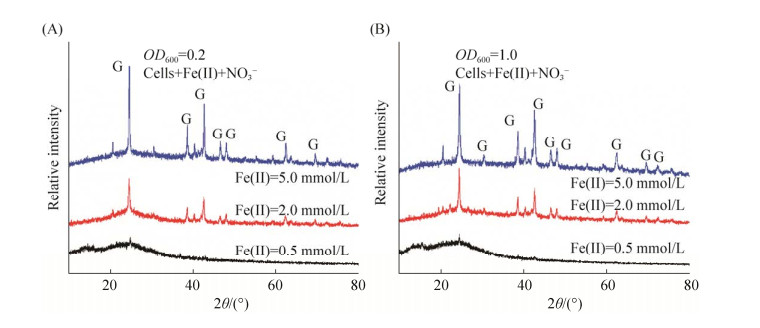 |
| 图 2 不同亚铁浓度(0.5、2.0、5.0 mmol/L)与菌浓度(OD600为0.2、1.0)条件下,硝酸盐还原耦合亚铁氧化生成的次生矿物的XRD图谱 Figure 2 XRD patterns of the secondary minerals from nitrate reduction coupled with Fe(Ⅱ) oxidation in the incubation with different initial Fe(Ⅱ) concentrations (0.5, 2.0 and 5.0 mmol/L) and different initial cell density (OD600 0.2 and 1.0). "G" strands for goethite. |
| 图选项 |
 |
| 图 3 不同亚铁浓度(0.5、2.0、5.0 mmol/L)与菌浓度(OD600为0.2、1.0)条件下,硝酸盐还原耦合亚铁氧化生成的次生矿物的SEM图 Figure 3 SEM images of the secondary minerals from nitrate reduction coupled with Fe(Ⅱ) oxidation in the incubation with different initial Fe(Ⅱ) concentrations (0.5, 2.0 and 5.0 mmol/L) and different initial cell density (OD600 0.2 and 1.0). |
| 图选项 |
基于上述动力学与次生矿物表征结果,在微生物介导硝酸盐还原耦合亚铁氧化的体系中,硝酸盐还原主要受到菌浓度影响,高浓度亚铁对硝酸盐还原具有一定抑制作用;亚铁氧化受到亚铁浓度和菌浓度的共同影响,菌浓度越高则亚铁反应速率越快,低菌浓度条件下,亚铁浓度越高,则反应速率越慢,且亚铁被氧化的程度降低,但是高菌浓度条件下,无明显影响;次生矿物类型和结晶程度主要受到亚铁浓度影响,高浓度亚铁条件下形成高结晶度次生铁矿物。在微生物介导硝酸盐还原耦合亚铁氧化的反应过程中,硝酸盐可以通过反硝化作用被微生物直接还原,其中间产物亚硝酸盐等则可以与亚铁发生化学反硝化反应,亚铁还会被菌外膜上的细胞色素c直接氧化[18, 37]。在相同亚铁浓度条件下,提高菌浓度可加速硝酸盐的还原,导致菌的代谢过程加快,乙酸盐消耗速率也越快,具有活性的微生物数量越多[38-39],通过硝酸盐还原酶Nar将更多硝酸盐还原为亚硝酸盐[14, 21, 40-41]。与此同时,大量的亚硝酸盐与亚铁直接反应,导致亚铁的氧化速率也加快,这也解释了高浓度菌加速亚铁氧化的结果。针对亚铁浓度的影响,提高亚铁浓度导致硝酸盐和乙酸盐的反应速率降低,主要的原因可能是:亚铁氧化过程中会出现到三价铁矿物的生成,导致细胞结壳现象的出现[20, 27-28, 42-45],可能会损害细胞对营养物质和底物的摄取利用,限制细胞的活性,甚至导致细胞的死亡[29]。所以亚铁浓度高的体系中,更多亚铁被氧化,大量三价铁生成导致细胞更容易结壳,从而限制了细胞的活性;此外,高浓度亚铁可能对于生物具有一定的毒性作用[46-47],导致微生物细胞的代谢活性降低,使微生物对硝酸盐的还原降低,也进一步降低了亚铁氧化能力。最后生成的矿物都主要是针铁矿,说明Strain BoFeN1介导的硝酸盐还原亚铁氧化在反应124 h之后,生成的三价铁矿物转化成了相对比较稳定的针铁矿[29],但是高浓度亚铁体系中,大量三价铁产生,导致矿物的形成与结晶过程加快,从而生成结晶度更高的次生矿物。
2.2 亚硝酸盐还原耦合亚铁氧化的动力学与次生矿物 亚硝酸盐是硝酸盐还原的第一级中间产物,既可以被微生物直接还原,也可以被亚铁化学还原。分别测试了不同处理组的亚硝酸根、亚铁和乙酸的动力学曲线。如图 4-A、B和C,反应速率见表 2。两个菌浓度体系下呈现相同的规律,即亚铁浓度为2 mmol/L的体系中亚硝酸盐的还原量最少,反应速率也最慢;5 mmol/L亚铁体系下的亚硝酸盐还原比2 mmol/L体系快,且2个菌浓度下的还原速率和趋势相近;OD600为0.2的体系中0.5 mmol/L亚铁与5 mmol/L亚铁的亚硝酸还原速率接近,但OD600为1.0时,0.5 mmol/L亚铁体系中亚硝酸盐的还原程度更高。空白对照组中亚硝酸盐的还原与两个处理组有相似结果,即亚铁5 mmol/L的比2 mmol/L体系的亚硝酸盐消耗多,但是0.5 mmol/L亚铁体系的亚硝酸盐消耗最少,与有微生物的处理组中0.5 mmol/L亚铁体系有较大差别,说明了微生物对亚硝酸盐有明显的还原作用。上述结果说明亚铁浓度和菌浓度都对亚硝酸盐还原具有影响,即在低浓度亚铁体系下,高的菌浓度会促进亚硝酸盐的微生物还原;而在较高的亚铁浓度下,亚铁与亚硝酸盐的化学反应占据主导,而且亚铁氧化会对亚硝酸盐的微生物还原产生较强的抑制作用。
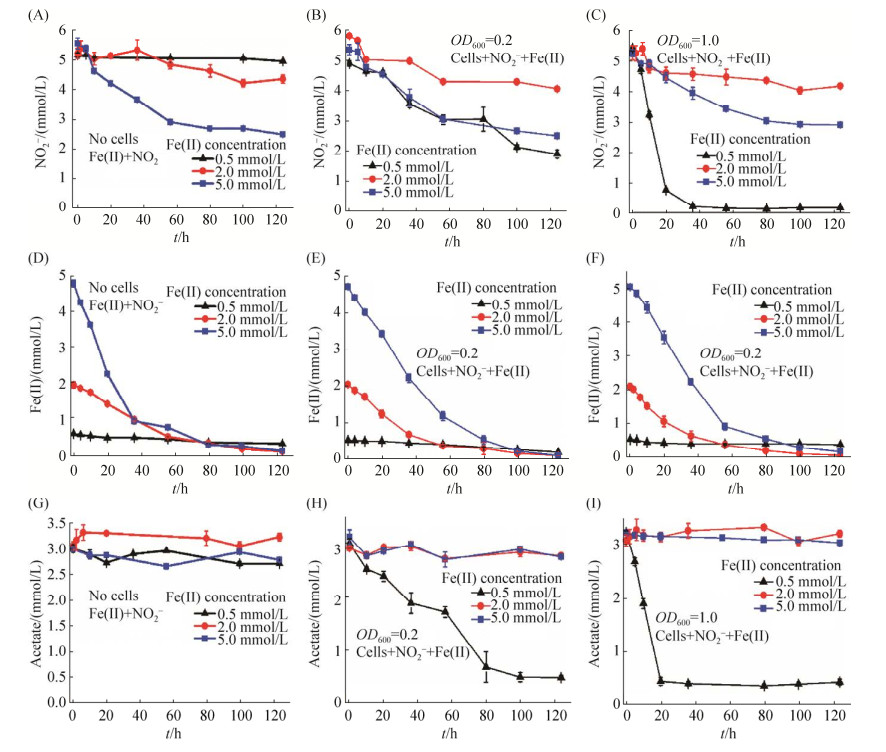 |
| 图 4 不同亚铁浓度(0.5、2.0、5.0 mmol/L)与空白对照组(无菌)以及菌浓度(OD600为0.2、1.0)条件下,亚硝酸盐还原、亚铁氧化、乙酸盐消耗反应动力学曲线 Figure 4 The kinetic results of nitrite reduction, Fe(Ⅱ) oxidation, and acetate consumption with different initial Fe(Ⅱ) concentrations (0.5, 2.0 and 5.0 mmol/L) and blank control (no cells) and different initial cell density (OD600 0.2 and 1.0). Error bars represent the standard deviation of the mean (n=3). |
| 图选项 |
表 2. 亚硝酸盐体系下亚铁氧化、硝酸盐还原、乙酸盐消耗的反应速率 Table 2. The reaction rate of Fe(Ⅱ) oxidation, nitrite reduction, and acetate consumption in nitrite system.
| OD600 | c(Fe(Ⅱ)/(mmol/L) | KFe(Ⅱ)/(h-1) | r2 | Knitrite/(h-1) | r2 | Kacetate/(h-1) | r2 |
| No cells | 0.5 | 0.006 | 0.953 | 0.0002 | 0.801 | - | |
| 2.0 | 0.035 | 0.960 | 0.002 | 0.845 | - | ||
| 5.0 | 0.036 | 0.982 | 0.007 | 0.893 | - | ||
| 0.2 | 0.5 | 0.008 | 0.955 | 0.008 | 0.961 | 0.065 | 0.861 |
| 2.0 | 0.026 | 0.988 | 0.003 | 0.839 | - | ||
| 5.0 | 0.032 | 0.986 | 0.006 | 0.936 | - | ||
| 1.0 | 0.5 | 0.008 | 0.859 | 0.072 | 0.923 | 0.017 | 0.944 |
| 2.0 | 0.028 | 0.996 | 0.002 | 0.810 | - | ||
| 5.0 | 0.029 | 0.994 | 0.005 | 0.933 | - |
表选项
亚铁氧化动力学如图 4-D、E和F所示,反应速率见表 2。在空白对照组,5 mmol/L体系中亚铁在124 h后剩余0.035 mmol/L,反应了99.2%;2 mmol/L亚铁体系中亚铁在124 h后剩余0.019 mmol/L,反应了98.9%;0.5 mmol/L亚铁体系中亚铁在124 h后剩余0.243 mmol/L,反应了54.1%。OD600 为0.2的体系下,5 mmol/L亚铁在124 h后剩余0.086 mmol/L,反应了98.2%;2 mmol/L亚铁124 h后剩余0.08 mmol/L,反应了96%;而0.5 mmol/L亚铁反应124 h后仍然剩余0.18 mmol/L,仅反应了64.8%。在OD600为1.0条件下,反应124 h之后,5 mmol/L亚铁剩余0.164 mmol/L,反应了96.7%;2 mmol/L亚铁剩余0.065 mmol/L,反应了96.8%;0.5 mmol/L亚铁剩余0.38 mmol/L,仅反应了28.8%。空白对照组和两个处理组体系下亚铁0.5、2、5 mmol/L的反应动力学变化趋势非常相似。上述结果表明,低的亚铁浓度条件下亚铁的氧化率相对比较低,菌浓度对亚铁氧化速率和氧化程度无明显影响,表明亚铁氧化以亚硝酸盐的直接化学氧化作用为主。
电子供体乙酸盐的消耗动力学如图 4-G、H和I所示,对照组以及两个处理组的2 mmol/L和5 mmol/L的亚铁体系中,乙酸盐都几乎没有被消耗;但是亚铁浓度为0.5 mmol/L条件下,乙酸盐都被大量消耗,在OD600为1.0体系中亚铁在40 h时已基本被完全消耗。说明菌浓度和亚铁浓度对乙酸盐的消耗都有影响,但是亚铁的影响因素要大于菌浓度的因素,即在低浓度亚铁条件下,菌浓度越高则乙酸盐消耗越快,而较高浓度的亚铁对微生物代谢产生直接抑制作用,导致乙酸盐无明显消耗。
利用XRD和SEM对亚硝酸盐还原耦合亚铁氧化反应124 h后的次生矿物沉淀进行矿物种类和形貌表征。如图 5所示,在不同菌浓度的2、5 mmol/L亚铁体系中,生成的矿物主要是针铁矿和纤铁矿,且随着亚铁浓度提高,成矿的结晶度不断提高。菌浓度对成矿晶体结构没有明显影响,但是亚铁浓度对成矿的结晶程度有一定影响,高浓度亚铁条件下最后矿物的结晶度较高,且包含针铁矿和纤铁矿,而低浓度条件下生成矿物主要是针铁矿,且结晶度较差。SEM结果显示(图 6),菌浓度OD600为0.2和1.0时,随着亚铁浓度逐渐提高,菌体表面次生矿物不断增多;空白对照组中出现矿物生成量随亚铁浓度提高不断增多。2、5 mmol/L亚铁体系下次生矿物都主要呈针形和纤形,但是在0.5 mmol/L亚铁的3个处理组次生矿物主要呈团聚球形。两个菌浓度体系下5 mmol/L亚铁中,微生物细胞被次生矿物包裹最为显著,出现明显的细胞结壳。因此,次生矿物的种类和结晶度主要受亚铁浓度影响,受菌浓度影响较小。
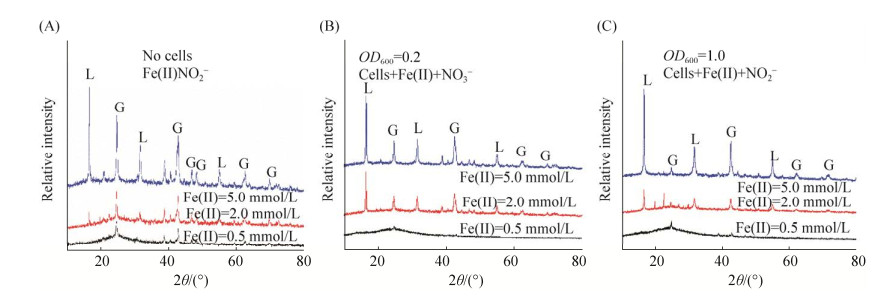 |
| 图 5 不同亚铁浓度(0.5、2.0、5.0 mmol/L)与空白对照组(无菌)以及菌浓度(OD600为0.2、1.0)条件下,硝酸盐还原耦合亚铁氧化生成的次生矿物的XRD图谱 Figure 5 XRD patterns of the secondary minerals from nitrate reduction coupled with Fe(Ⅱ) oxidation in the incubation with different initial Fe(Ⅱ) concentrations (0.5, 2.0, 5.0 mmol/L) and blank control (no cells) and different initial cell density (OD600 0.2 and 1.0). "L" strands for lepidocrocite, "G" strands for goethite. |
| 图选项 |
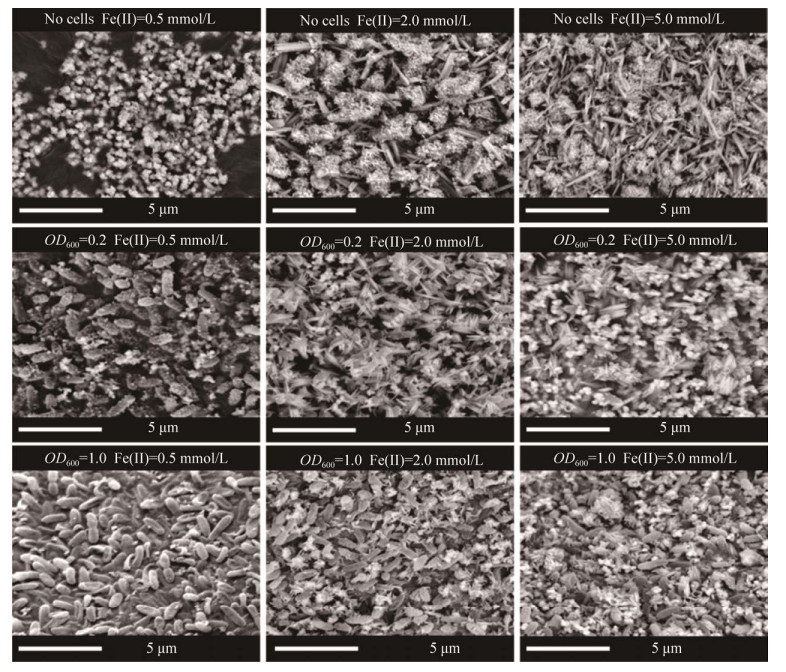 |
| 图 6 不同亚铁浓度(0.5、2.0、5.0 mmol/L)与空白对照组(无菌)以及菌浓度(OD600为0.2、1.0)条件下,亚硝酸盐还原耦合亚铁氧化生成的次生矿物的SEM图 Figure 6 SEM images of the secondary minerals from nitrite reduction coupled with Fe(Ⅱ) oxidation in the incubation with different initial Fe(Ⅱ) concentrations (0.5, 2.0 and 5.0 mmol/L) and blank control (no cells) and different initial cell density (OD600 0.2 and 1.0). |
| 图选项 |
基于上述动力学与次生矿物表征结果,在微生物介导亚硝酸盐还原耦合亚铁氧化的体系中,菌浓度和亚铁浓度都会对亚硝酸盐还原造成影响,高浓度菌会促进亚硝酸盐的微生物还原,而高浓度亚铁则会促进亚硝酸盐的化学还原,亚铁氧化会对亚硝酸盐的微生物还原产生较强的抑制作用,次生矿物的种类和结晶度仍然主要受亚铁浓度影响。在微生物介导亚硝酸盐还原耦合亚铁氧化的反应过程中,亚硝酸盐可以通过生物反硝化和化学反硝化的共同影响,二者是竞争关系,其次生矿物也会进一步影响生物反硝化过程。菌浓度对亚铁氧化速率没有明显影响,但是亚铁浓度越高,则反应的速率越快。说明亚硝酸盐与亚铁的化学反硝化作用在亚铁氧化中起主导作用[48-49],微生物外膜蛋白虽然可能有一定作用,但是与化学作用相比非常微弱。总的来讲,在亚硝酸盐体系中,亚硝酸盐通过亚铁的化学还原作用和菌体的生物还原作用消耗。其中亚铁浓度越高,化学还原作用越强;亚铁浓度越低,生物还原作用越强。当亚铁被氧化,会导致三价铁矿物生成和细胞结壳[50-52],同时较高浓度亚铁对微生物产生一定毒性[29, 53],因此高浓度亚铁会显著降低微生物活性,导致生物还原作用降低。值得注意的是,两个微生物处理组中亚铁浓度为2 mmol/L体系的亚硝酸盐还原是最少的。结果表明在2 mmol/L和5 mmol/L亚铁体系中乙酸盐基本没有被消耗,证实了微生物活性受到抑制,亚硝酸盐还原主要以化学还原作用为主,亚铁浓度越高则消耗亚硝酸盐越多,所以2 mmol/L相对5 mmol/L亚铁体系消耗更少的亚硝酸盐。而0.5 mmol/L亚铁体系中乙酸被大量消耗,说明生物作用为主,且微生物活性远高于2 mmol/L亚铁体系,从而导致0.5 mmol/L亚铁体系的亚硝酸盐消耗多于2 mmol/L亚铁体系。在高浓度亚铁体系下生成的主要是针铁矿和纤铁矿,与硝酸盐体系的结果不一致,说明在亚硝酸盐体系生成的矿物稳定性弱于硝酸盐体系,但是在低浓度亚铁体系下0.5 mmol/L中最后生成的矿物主要也是针铁矿,所以在低浓度亚铁体系下,反应速率较慢,会生成更为稳定的矿物。硝酸盐和亚硝酸体系中的亚铁氧化动力学曲线也有差异,亚硝酸盐体系空白对照组和微生物的处理组中亚铁氧化速率整体上快于硝酸盐体系,特别是2 mmol/L和5 mmol/L亚铁体系更为明显,氧化速率可能是导致次生矿物晶形差异的原因之一;同样乙酸盐的动力学曲线也有明显差异,硝酸盐比亚硝酸盐体系中乙酸盐消耗的更多,且高浓度亚铁体系中乙酸盐消耗相对最少,说明了高浓度亚铁对微生物活性产生了抑制,而相同亚铁浓度2 mmol/L和5 mmol/L条件下,亚硝酸盐体系的乙酸盐消耗明显低于硝酸盐体系,说明在亚硝酸盐体系中高浓度亚铁对微生物的抑制更加明显。
综上所述,在微生物-硝酸盐-亚铁体系中,高菌浓度促进硝酸盐还原和亚铁氧化;在低菌浓度条件下,亚铁浓度越高,则反应速率和程度降低,但在高菌浓度条件下影响较小;亚铁浓度越高,其次生矿物结晶度也越高,对硝酸盐还原具有一定抑制作用。菌浓度和亚铁浓度都会促进亚硝酸盐还原,但亚铁氧化的次生矿物会对亚硝酸盐的微生物还原产生较强的抑制作用,次生矿物的种类和结晶度仍然主要受亚铁浓度影响。因此,硝酸盐还原主要是生物反硝化作用,亚硝酸盐还原包含生物反硝化和化学反硝化两部分,在硝酸盐体系下亚铁氧化与次生矿物生成主要是受生物和化学反硝化作用共同影响,但亚硝酸盐体系下主要是化学反硝化作用。该研究有助于深入认识厌氧土壤、沉积物环境中的微生物介导铁循环耦合氮转化过程。
References
| [1] | Hauck S, Benz M, Brune A, Schink B. Ferrous iron oxidation by denitrifying bacteria in profundal sediments of a deep lake (lake constance). FEMS Microbiology Ecology, 2001, 37(2): 127-134. DOI:10.1111/j.1574-6941.2001.tb00860.x |
| [2] | Kappler A, Straub KL. Geomicrobiological cycling of iron. Reviews in Mineralogy and Geochemistry, 2005, 59(1): 85-108. DOI:10.2138/rmg.2005.59.5 |
| [3] | Hazen RM, Papineau D, Bleeker W, Downs RT, Ferry JM, McCoy TJ, Sverjensky DA, Yang HX. Mineral evolution. American Mineralogist, 2008, 93(11/12): 1693-1720. |
| [4] | Stumm W, Sulzberger B. The cycling of iron in natural environments: considerations based on laboratory studies of heterogeneous redox processes. Geochimica et Cosmochimica Acta, 1992, 56(8): 3233-3257. DOI:10.1016/0016-7037(92)90301-X |
| [5] | Chen L, Zhang HX, Li Y, Zheng SL, Liu FH. The role of microorganisms in the geochemical iron cycle. Scientia Sinica Vitae, 2016, 46(9): 1069-1078. (in Chinese) 陈蕾, 张洪霞, 李莹, 郑世玲, 刘芳华. 微生物在地球化学铁循环过程中的作用. 中国科学: 生命科学, 2016, 46(9): 1069-1078. |
| [6] | Chaudhuri SK, Lack JG, Coates JD. Biogenic magnetite formation through anaerobic biooxidation of fe(Ⅱ). Applied and Environmental Microbiology, 2001, 67(6): 2844-2848. DOI:10.1128/AEM.67.6.2844-2848.2001 |
| [7] | Hafenbradl D, Keller M, Dirmeier R, Rachel R, Rossnagel P, Burggraf S, Huber H, Stetter KO. Ferroglobus placidus gen. nov., sp. Nov., a novel hyperthermophilic archaeum that oxidizes Fe2+ at neutral ph under anoxic conditions. Archives of Microbiology, 1996, 166(5): 308-314. DOI:10.1007/s002030050388 |
| [8] | Kappler A, Newman DK. Formation of Fe(Ⅲ)-minerals by Fe(Ⅱ)-oxidizing photoautotrophic bacteria. Geochimica et Cosmochimica Acta, 2004, 68(6): 1217-1226. DOI:10.1016/j.gca.2003.09.006 |
| [9] | Melton ED, Swanner ED, Behrens S, Schmidt C, Kappler A. The interplay of microbially mediated and abiotic reactions in the biogeochemical Fe cycle. Nature Reviews Microbiology, 2014, 12(12): 797-808. DOI:10.1038/nrmicro3347 |
| [10] | Straub KL, Benz M, Schink B, Widdel F. Anaerobic, nitrate-dependent microbial oxidation of ferrous iron. Applied and Environmental Microbiology, 1996, 62(4): 1458-1460. DOI:10.1128/AEM.62.4.1458-1460.1996 |
| [11] | Widdel F, Schnell S, Heising S, Ehrenreich A, Assmus B, Schink B. Ferrous iron oxidation by anoxygenic phototrophic bacteria. Nature, 1993, 362(6423): 834-836. DOI:10.1038/362834a0 |
| [12] | Ratering S, Schnell S. Nitrate-dependent iron(Ⅱ) oxidation in paddy soil. Environmental Microbiology, 2001, 3(2): 100-109. DOI:10.1046/j.1462-2920.2001.00163.x |
| [13] | Weiss JV, Emerson D, Megonigal JP. Geochemical control of microbial Fe(Ⅲ) reduction potential in wetlands: comparison of the rhizosphere to non-rhizosphere soil. FEMS Microbiology Ecology, 2004, 48(1): 89-100. DOI:10.1016/j.femsec.2003.12.014 |
| [14] | Liu TX, Chen DD, Li XM, Li FB. Microbially mediated coupling of nitrate reduction and Fe(Ⅱ) oxidation under anoxic conditions. FEMS Microbiology Ecology, 2019, 95(4): fiz030. |
| [15] | Liu TX, Cheng K, Chen DD, Wang Y, Yin YL, Li FB. Formation of Fe(Ⅲ)-minerals by microbially mediated coupling of nitrate reduction and Fe(Ⅱ) oxidation: a review. Ecology and Environmental Sciences, 2019, 28(3): 620-628. (in Chinese) 刘同旭, 程宽, 陈丹丹, 王莹, 殷云璐, 李芳柏. 微生物介导的硝酸盐还原耦合亚铁氧化成矿研究进展. 生态环境学报, 2019, 28(3): 620-628. |
| [16] | Chen XP, Zhu YG, Hong MN, Kappler A, Xu YX. Effects of different forms of nitrogen fertilizers on arsenic uptake by rice plants. Environmental Toxicology and Chemistry, 2008, 27(4): 881-887. DOI:10.1897/07-368.1 |
| [17] | H?hn R, Isenbeck-Schr?ter M, Kent DB, Davis JA, Jakobsen R, Jann S, Niedan V, Scholz C, Stadler S, Tretner A. Tracer test with As(Ⅴ) under variable redox conditions controlling arsenic transport in the presence of elevated ferrous iron concentrations. Journal of Contaminant Hydrology, 2006, 88(1/2): 36-54. |
| [18] | Liu TX, Chen DD, Luo XB, Li XM, Li FB. Microbially mediated nitrate-reducing Fe(Ⅱ) oxidation: Quantification of chemodenitrification and biological reactions. Geochimica et Cosmochimica Acta, 2019, 256: 97-115. DOI:10.1016/j.gca.2018.06.040 |
| [19] | Wang XQ, Liu TX, Li FB, Li B, Liu CP. Effects of simultaneous application of ferrous iron and nitrate on arsenic accumulation in rice grown in contaminated paddy soil. ACS Earth and Space Chemistry, 2018, 2(2): 103-111. DOI:10.1021/acsearthspacechem.7b00115 |
| [20] | Kappler A, Schink B, Newman DK. Fe(Ⅲ) mineral formation and cell encrustation by the nitrate-dependent Fe(Ⅱ)-oxidizer strain BoFeN1. Geobiology, 2005, 3(4): 235-245. DOI:10.1111/j.1472-4669.2006.00056.x |
| [21] | Kuypers MMM, Marchant HK, Kartal B. The microbial nitrogen-cycling network. Nature Reviews Microbiology, 2018, 16(5): 263-276. DOI:10.1038/nrmicro.2018.9 |
| [22] | Zehr JP, Kudela RM. Nitrogen cycle of the open ocean: from genes to ecosystems. Annual Review of Marine Science, 2011, 3: 197-225. DOI:10.1146/annurev-marine-120709-142819 |
| [23] | Hedrich S, Schl?mann M, Johnson DB. The iron-oxidizing proteobacteria. Microbiology, 2011, 157(6): 1551-1564. DOI:10.1099/mic.0.045344-0 |
| [24] | Moraghan JT, Buresh RJ. Chemical reduction of nitrite and nitrous oxide by ferrous iron. Soil Science Society of America Journal, 1977, 41(1): 47-50. DOI:10.2136/sssaj1977.03615995004100010017x |
| [25] | Picardal F. Abiotic and microbial interactions during anaerobic transformations of Fe(Ⅱ) and NOx-. Frontiers in Microbiology, 2012, 3: 112. |
| [26] | Roden EE. Microbial iron-redox cycling in subsurface environments. Biochemical Society Transactions, 2012, 40(6): 1249-1256. DOI:10.1042/BST20120202 |
| [27] | Kappler A, Johnson CM, Crosby HA, Beard BL, Newman DK. Evidence for equilibrium iron isotope fractionation by nitrate-reducing iron(Ⅱ)-oxidizing bacteria. Geochimica et Cosmochimica Acta, 2010, 74(10): 2826-2842. DOI:10.1016/j.gca.2010.02.017 |
| [28] | Miot J, Benzerara K, Morin G, Kappler A, Bernard S, Obst M, Férard C, Skouri-Panet F, Guigner JM, Posth N, Galvez M, Brown GE Jr, Guyot F. Iron biomineralization by anaerobic neutrophilic iron-oxidizing bacteria. Geochimica et Cosmochimica Acta, 2009, 73(3): 696-711. DOI:10.1016/j.gca.2008.10.033 |
| [29] | Klueglein N, Zeitvogel F, Stierhof YD, Floetenmeyer M, Konhauser KO, Kappler A, Obst M. Potential role of nitrite for abiotic Fe(Ⅱ) oxidation and cell encrustation during nitrate reduction by denitrifying bacteria. Applied and Environmental Microbiology, 2014, 80(3): 1051-1061. DOI:10.1128/AEM.03277-13 |
| [30] | Senko JM, Dewers TA, Krumholz LR. Effect of oxidation rate and Fe(Ⅱ) state on microbial nitrate-dependent Fe(Ⅲ) mineral formation. Applied and Environmental Microbiology, 2005, 71(11): 7172-7177. DOI:10.1128/AEM.71.11.7172-7177.2005 |
| [31] | Bristow LA, Callbeck CM, Larsen M, Altabet MA, Dekaezemacker J, Forth M, Gauns M, Glud RN, Kuypers MMM, Lavik G, Milucka J, Naqvi SWA, Pratihary A, Revsbech NP, Thamdrup B, Treusch A H, Canfield DE. N2 production rates limited by nitrite availability in the bay of bengal oxygen minimum zone. Nature Geoscience, 2017, 10(1): 24-29. DOI:10.1038/ngeo2847 |
| [32] | Kampschreur MJ, Kleerebezem R, de Vet WWJM, van Loosdrecht MCM. Reduced iron induced nitric oxide and nitrous oxide emission. Water Research, 2011, 45(18): 5945-5952. DOI:10.1016/j.watres.2011.08.056 |
| [33] | Chakraborty A, Picardal F. Induction of nitrate-dependent Fe(Ⅱ) oxidation by Fe(Ⅱ) in Dechloromonas sp. strain 2AN. Applied and Environmental Microbiology, 2013, 79(2): 748-752. DOI:10.1128/AEM.02709-12 |
| [34] | 程宽. 赤铁矿对Acidovorax sp. strain BoFeN1亚铁氧化与硝酸盐还原的影响. 中国科学院大学(中国科学院广州地球化学研究所)硕士学位论文, 2019. |
| [35] | Ilbert M, Bonnefoy V. Insight into the evolution of the iron oxidation pathways. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2013, 1827(2): 161-175. DOI:10.1016/j.bbabio.2012.10.001 |
| [36] | Pantke C, Obst M, Benzerara K, Morin G, Ona-Nguema G, Dippon U, Kappler A. Green rust formation during Fe(Ⅱ) oxidation by the nitrate-reducing Acidovorax sp. strain BoFeN1. Environmental Science & Technology, 2012, 46(3): 1439-1446. |
| [37] | Liu TX, Wang Y, Li XM, Li FB. Redox dynamics and equilibria of c-type cytochromes in the presence of Fe(Ⅱ) under anoxic conditions: insights into enzymatic iron oxidation. Chemical Geology, 2017, 468: 97-104. DOI:10.1016/j.chemgeo.2017.08.019 |
| [38] | Byrne-Bailey KG, Weber KA, Chair AH, Bose S, Knox T, Spanbauer TL, Chertkov O, Coates JD. Completed genome sequence of the anaerobic iron-oxidizing bacterium Acidovorax ebreus strain TPSY. Journal of Bacteriology, 2010, 192(5): 1475-1476. DOI:10.1128/JB.01449-09 |
| [39] | Muehe EM, Gerhardt S, Schink B, Kappler A. Ecophysiology and the energetic benefit of mixotrophic Fe(Ⅱ) oxidation by various strains of nitratereducing bacteria. FEMS Microbiology Ecology, 2009, 70(3): 335-343. DOI:10.1111/j.1574-6941.2009.00755.x |
| [40] | Chen GJ, Chen DD, Li FB, Liu TX, Zhao ZY, Cao F. Dual nitrogen-oxygen isotopic analysis and kinetic model for enzymatic nitrate reduction coupled with Fe(Ⅱ) oxidation by Pseudogulbenkiania sp. Strain 2002. Chemical Geology, 2020, 534: 119456. DOI:10.1016/j.chemgeo.2019.119456 |
| [41] | Moreno-Vivián C, Cabello P, Martínez-Luque M, Blasco R, Castillo F. Prokaryotic nitrate reduction: Molecular properties and functional distinction among bacterial nitrate reductases. Journal of Bacteriology, 1999, 181(21): 6573-6584. DOI:10.1128/JB.181.21.6573-6584.1999 |
| [42] | Hitchcock AP, Obst M, Wang J, Lu YS, Tyliszczak T. Advances in the detection of as in environmental samples using low energy X-ray fluorescence in a scanning transmission X-ray microscope: arsenic immobilization by an Fe(Ⅱ)-oxidizing freshwater bacteria. Environmental Science & Technology, 2012, 46(5): 2821-2829. |
| [43] | Miot J, Benzerara K, Morin G, Bernard S, Beyssac O, Larquet E, Kappler A, Guyot F. Transformation of vivianite by anaerobic nitrate-reducing iron-oxidizing bacteria. Geobiology, 2009, 7(3): 373-384. DOI:10.1111/j.1472-4669.2009.00203.x |
| [44] | Miot J, Maclellan K, Benzerara K, Boisset N. Preservation of protein globules and peptidoglycan in the mineralized cell wall of nitrate-reducing, iron(Ⅱ)-oxidizing bacteria: a cryo-electron microscopy study. Geobiology, 2011, 9(6): 459-470. DOI:10.1111/j.1472-4669.2011.00298.x |
| [45] | Sch?dler S, Burkhardt C, Hegler F, Straub KL, Miot J, Benzerara K, Kappler A. Formation of cell-iron-mineral aggregates by phototrophic and nitrate-reducing anaerobic Fe(Ⅱ)-oxidizing bacteria. Geomicrobiology Journal, 2009, 26(2): 93-103. DOI:10.1080/01490450802660573 |
| [46] | Rai LC, Gaur JP. Algal adaptation to environmental stresses: physiological, biochemical and molecular mechanisms. Berlin, Heidelberg: Springer Berlin Heidelberg, 2001: 363-388. |
| [47] | He WL, Feng Y, Li XL, Wei YY, Yang XE. Availability and toxicity of Fe(Ⅱ) and Fe(Ⅲ) in Caco-2 cells. Journal of Zhejiang University Science B, 2008, 9(9): 707-712. DOI:10.1631/jzus.B0820023 |
| [48] | Klueglein N, Kappler A. Abiotic oxidation of Fe(Ⅱ) by reactive nitrogen species in cultures of the nitrate-reducing Fe(Ⅱ) oxidizer Acidovorax sp. BoFeN1-questioning the existence of enzymatic Fe(Ⅱ) oxidation. Geobiology, 2013, 11(2): 180-190. DOI:10.1111/gbi.12019 |
| [49] | Weber KA, Achenbach LA, Coates JD. Microorganisms pumping iron: anaerobic microbial iron oxidation and reduction. Nature Reviews Microbiology, 2006, 4(10): 752-764. DOI:10.1038/nrmicro1490 |
| [50] | Chen DD, Liu TX, Li XM, Li FB, Luo XB, Wu YD, Wang Y. Biological and chemical processes of microbially mediated nitrate-reducing Fe(Ⅱ) oxidation by Pseudogulbenkiania sp. strain 2002. Chemical Geology, 2018, 476: 59-69. DOI:10.1016/j.chemgeo.2017.11.004 |
| [51] | Hu M, Chen PC, Sun WM, Li FB, Cui JH. A novel organotrophic nitrate-reducing Fe(Ⅱ)-oxidizing bacterium isolated from paddy soil and draft genome sequencing indicate its metabolic versatility. RSC Advances, 2017, 7(89): 56611-56620. DOI:10.1039/C7RA09328D |
| [52] | Li S, Li XM, Li FB. Fe(Ⅱ) oxidation and nitrate reduction by a denitrifying bacterium, Pseudomonas stutzeri ls-2, isolated from paddy soil. Journal of Soils and Sediments, 2018, 18(4): 1668-1678. DOI:10.1007/s11368-017-1883-1 |
| [53] | Hao LK, Li JL, Kappler A, Obst M. Mapping of heavy metal ion sorption to cell-extracellular polymeric substance-mineral aggregates by using metal-selective fluorescent probes and confocal laser scanning microscopy. Applied and Environmental Microbiology, 2013, 79(21): 6524-6534. DOI:10.1128/AEM.02454-13 |
