王红越1, 于景丽1

 , 李千雪1, 马巧丽1, 特日格乐1, 魏亚茹1, 夏晶晶1, 吕赫1, 赵吉1, 希尼尼根2
, 李千雪1, 马巧丽1, 特日格乐1, 魏亚茹1, 夏晶晶1, 吕赫1, 赵吉1, 希尼尼根2 1. 蒙古高原生态与资源利用教育部重点实验室, 内蒙古大学生态与环境学院, 内蒙古自治区环境污染控制与 废物资源化重点实验室, 内蒙古 呼和浩特 010021;
2. 内蒙古农业大学兽医学院, 内蒙古 呼和浩特 010018
收稿日期:2021-02-27;修回日期:2021-05-08;网络出版日期:2021-05-19
基金项目:国家自然科学基金(41361053,31660724);内蒙古大学校级大学生创新创业训练计划(201917443,202017398)
作者简介:于景丽,内蒙古大学生态与环境学院副教授,硕士生导师,主要研究方向为环境微生物分子生态学。1996–2000年于沈阳农业大学土壤与农业化学系攻读土壤与农业化学专业学士学位,2000–2003年于四川农业大学微生物系攻读土壤学专业硕士学位,2008–2015年于内蒙古大学生命科学学院攻读微生物学专业博士学位。2012年11月–2013年11月在澳大利亚CSIRO访问学习;2015年12月–2016年10月在美国俄克拉荷马大学IEG访问学习。主持和参加国家自然科学基金项目等20余项,发表文章30余篇,专业领域涉及地质微生物学、蒙古高原河湖湿地及旱地微生物地理学、水体-土壤-牧草-家畜系统微生物群落生态学。.
*通信作者:于景丽, E-mail: hot-yjl@163.com.
摘要:[目的] 为了探究锡林河流域中游不同植被带土壤绿菌门(Chlorobi)成员的空间分布特征及驱动因子。[方法] 本文选择典型河滨带环境为研究对象,沿河流中心至河流阶地(陆向)方向,在无植被带(BC)、水莎草沼泽(BS)、灯芯草沼泽化草甸(LF)、鹅绒委陵菜草甸(HF)、河流阶地羊草草原(LT)、丘陵坡地大针茅典型草原(HT)中分别采集0-10 cm土壤样品。基于16S rRNA基因高通量测序分析土壤绿菌门微生物群落的组成、丰度及空间分布特征;结合土壤理化因子分析绿菌门微生物群落空间异质性的驱动因子。[结果] 在属水平上共检测到来自绿菌目(Chlorobiales)和Ignavibacteriales目的9个类群。Chlorobiales1、2、6及Ignavibacteriales7、9类群的最高相对丰度低于0.40%;Ignavibacteriales3、4、5、8类群的最高相对丰度介于0.54%-1.06%。Chlorobiales1、2类群在HF、LT和HT的相对丰度显著高于BS(P < 0.05),Chlorobiales1类群的相对丰度与pH和总有机碳含量呈极显著正相关(P < 0.01);Chlorobiales2类群的相对丰度与粉黏粒含量呈极显著正相关(P < 0.01);Ignavibacteriales3、5、7、9和Ignavibacterium4类群在LF的相对丰度显著高于BC(P < 0.05),与含水量呈极显著正相关(P < 0.01);Chlorobiales6和Ignavibacteriales8类群在BS的相对丰度显著高于其他植被带(P < 0.05),与氨态氮含量呈极显著正相关(P < 0.01)。变异权重分析表明,土壤含水量解释了绿菌门微生物群落空间变异的65.7%。[结论] 锡林河流域不同植被带土壤绿菌门微生物群落存在明显的空间异质性;土壤含水量是不同植被带绿菌门微生物群落空间异质性的主要驱动因子。
关键词:锡林河流域植被类型不产氧光合细菌绿菌空间异质性驱动因子
Spatial distribution characteristics of soil microbial communities from Chlorobi phylum in different vegetation zones from Xilin River Basin
Hongyue Wang1, Jingli Yu1

 , Qianxue Li1, Qiaoli Ma1, Terigele1, Yaru Wei1, Jingjing Xia1, He Lv1, Ji Zhao1, Xininigen2
, Qianxue Li1, Qiaoli Ma1, Terigele1, Yaru Wei1, Jingjing Xia1, He Lv1, Ji Zhao1, Xininigen2 1. Ministry of Education Key Laboratory of Ecology and Resource Use of the Mongolia Plateau, School of Ecology and Environment in Inner Mongolia University, Inner Mongolia Key Laboratory of Environmental Pollution Control & Waste Resource Reuse, Hohhot 010021, Inner Mongolia Autonomous Region, China;
2. College of Veterinary Medicine, Inner Mongolia Agricultural University, Hohhot 010018, Inner Mongolia Autonomous Region, China
Received: 27 February 2021; Revised: 8 May 2021; Published online: 19 May 2021
*Corresponding author: Jingli Yu, E-mail: hot-yjl@163.com.
Foundation item: Supported by the National Natural Science Foundation of China (41361053, 31660724) and by the College Students Innovation and Entrepreneurship Training Program of Inner Mongolia University (201917443, 202017398)
Abstract: [Objective] In this study, the main goal was to explore the spatial heterogeneity and driving factors of soil microbial populations from Chlorobi phylum in different vegetation zones from the middle reach of Xilin River Basin. [Methods] We selected the typical riparian vegetation zones along the landward direction from the riverbed center (BC) without vegetation zone to the river terrace. These vegetation zones included Juncellus serotinus-dominated marsh plant communities from riverbed side (BS), Juncus effusus-dominated marsh meadow plant communities from low floodplain (LF), Potentilla anserina-dominated meadow plant communities from high floodplain (HF), Leymus chinensis grassland on the river terrace (LT) and Stipa grandis grassland on a slope in the hilly zone (HT). Meanwhile, we collected 0-10 cm soil samples and analyzed the spatial distribution characteristics, abundance and composition of soil Chlorobi communities based on 16S rRNA gene high-throughput sequencing. To explore the environmental factors driving the spatial heterogeneity of soil microbial communities from Chlorobi phylum, we detected the soil physiochemical factors. [Results] Nine populations from the orders Chlorobiales and Ignavibacteriales were detected at genus level. The highest relative abundance of Chlorobiales1, Chlorobiales2, Chlorobiales6, Ignavibacteriales7 and Ignavibacteriales9 were less than 0.40%, while those of the other four populations from order Ignavibacteriales ranged from 0.54% to 1.06%. The relative abundances of both Chlorobiales1 and Chlorobiales2 in HF, LT and HT were higher than those in BS (P < 0.05). The abundance of Chlorobiales1 was significantly positively correlated with pH and total organic carbon content (P < 0.01), while that of Chlorobiales2 was significantly positively correlated with the content of clay and silt particles (P < 0.01). The relative abundances of Chlorobiales6 and Ignavibacteriales8 in BS were higher than those of the other vegetation zones (P < 0.05). Their abundances were significantly positively correlated with ammonia nitrogen content (P < 0.01). Variation partitioning analysis (VPA) showed that soil water content accounted for 65.7% of the spatial variation of microbial communities from Chlorobi phylum. [Conclusion] In the Xilin River Basin, the populations of Chlorobi communities from different vegetation zones demonstrated obvious spatial heterogeneity. Water content was the main driving factor of the spatial heterogeneity of the soil microbial communities from Chlorobi phylum in different vegetation zones.
Keywords: Xilin River Basinvegetation typeanoxygenic phototrophic bacteriaChlorobispatial heterogeneitydriving factors
不产氧光合细菌(anoxygenic phototrophic bacteria,AnPB)大约出现在38亿年前[1-2],是产氧光合生物(oxygenic photosynthetic organisms)的祖先[1, 3-5]。绿菌门(Chlorobi)是AnPB的五大门类之一[6],其主要分布在古生代海洋[7-10]、南极海洋沉积物[11]和龙景湖原有河道表层沉积物[12]等环境,是推动早期地球演化和现代环境演变的标志性生物[6-12]。绿菌包括光能自养型、光能异养型和光能混合营养型[13]。Bryant等[14]报道绿菌是厌氧不产氧的光合细菌(anaerobic anoxygenic phototrophic bacteria,AnAnPB)。Roy等[15]通过整合宏基因组推测早期的绿菌属于好氧的化能有机异养菌,在后期进化过程中绿菌逐渐分化出厌氧光能无机自养菌。大多数绿菌成员能利用还原态硫(H2S或单质硫)作为电子供体通过反向TCA循环固定CO2和N2[16];少部分光合异养型绿菌(Thermochlorobacter aerophilum)自身虽不能固定CO2和N2,但可依存于其他生物固定的碳氮满足生存需要且能占据更广泛的生态位[16]。
研究证实好氧不产氧光合细菌(aerobic anoxygenic phototrophic bacteria,AAnPB)是水域生态系统的优势功能群[17-24],分别占南太平洋(寡营养环境)[20]、巴西Arraial do Cabo海湾[21]和全球[22]海洋中总细菌丰度的24%、24%和15%,占北冰洋麦肯齐羽流(plume)底部的雾状层(nepheloid layer)和地表水原核微生物群落的10%和14%[23]。Lehours和Jeanthon的研究证明了水文环境决定了北冰洋AAnPB的β多样性[24]。何一平等[25]在蒙古高原乌梁素海发现了富营养化湖区特有的AAnPB类群。尽管AAnPB在陆地生态系统中的研究[26]相对较少,但AAnPB发挥的作用不容忽视。Feng等[27]通过FACE (free-air CO2 enrichment)发现提升CO2浓度会显著提升稻田土壤中AAnPB的相对丰度,AAnPB在细菌群落中的比例从0.5%增加到1.5%[6, 27]。目前未见专门针对绿菌门微生物群落空间分布异质性及驱动因子的研究报道。关于绿菌等AnPB更适应砂粒较多的沉积物/土壤环境还是更适应粉黏粒为主的土壤环境[28-29]及绿菌门微生物群落与植被类型[30]的关系尚无定论。至此,本研究关注的问题为河流地貌不同植被带是否存在土壤绿菌门微生物群落的空间分布异质性。影响绿菌门微生物群落空间分布异质性的主要驱动因子是什么?
河滨带作为水陆交错带具有衰减洪水、稳定河岸、补给地下水和平衡养分循环等生态系统服务功能。河滨带是生物多样性热区,能为动植物提供栖息地。为此,本文选择锡林河流域中游典型河滨不同植被带环境为研究对象,运用16S rRNA基因高通量测序技术,分析土壤绿菌门微生物群落的类群组成、丰度及空间分布变化;分析影响绿菌门微生物群落结构空间分布异质性的关键驱动因子。
1 材料和方法 1.1 研究区概况 锡林河横贯蒙古高原典型草原区,是半干旱区具有代表性的内陆河之一,发源于赤峰市克什克腾旗巴彦查干苏木,终止于锡林浩特市朝克乌拉苏木,全长由原来的268 km缩减至近十年的144 km,全流域面积约为10542 km2。锡林河流域东邻大兴安岭余脉,南接灰腾梁玄武岩台地。东南高达1500 m以上,西北低至900 m左右。锡林河流域属于温带半干旱大陆性季风气候区,年均温2.6 ℃,年均降水量300 mm,其中5-8月份降水量占全年的51%-89%。本研究选择的锡林河中游位于内蒙古自治区锡林浩特市中国科学院内蒙古草原生态系统定位研究站,地理坐标为115°33-117°28′ E,43°39′-44°36′ N。锡林河中游代表性的植被包括水莎草(Juncellus serotinus)等水生植被、灯芯草(Juncus effusus)和鹅绒委陵菜(Potentilla anserina)等湿生植被、羊草(Leymus chinensis)和大针茅(Stipa grandis)等旱生植被;代表性的土壤包括沼泽土、沼泽化草甸土、草甸土和栗钙土等。土地利用方式主要为围封禁牧样地。
1.2 采样点设置及样品采集 土壤采样时间为2019年植物生长季(7月26日)。沿着垂直河道方向由水及陆(陆向)在锡林河中游冲积岸依次采集长期淹水的河床中心无植被带土壤BC、长期淹水的河床边缘水莎草(Juncellus serotinus)沼泽土壤BS、季节性淹水的低河漫滩灯芯草(Juncus effusus)沼泽化草甸土壤LF、季节性淹水的高河漫滩鹅绒委陵菜(Potentilla anserina)草甸土壤HF、不淹水的河流阶地羊草(Leymus chinensis)草原土壤LT、不淹水的丘陵坡地大针茅(Stipa grandis)典型草原土壤HT。
每个样带沿着河流走向依次设计3个样点(样点间距500-2000 m),6个样带合计18个采样点。样带BC-HF的中心间距5-100 m,样带LT-HT的中心间距50-500 m,样带HF-LT的中心间距大于1 km。鉴于湿地及旱地表层土壤是链接生物圈、大气圈、水圈和土壤圈的纽带和关键界面系统,是生物多样性最丰富和生物地球化学循环最活跃的层次[31-32],本研究采集0-10 cm表层土壤样品。每个采样点均按照S型进行5点取样,均匀混合后制备成1个样品(约1 kg)置于无菌塑料袋中,24 h内用冰盒运到实验室。新鲜土壤样品过2 mm筛后按照四分法分取样品,每个样品抽取50 g保存到?80 ℃冰箱,进行后续的分子生物学分析,其余土样风干、研磨、过筛后,进行理化因子检测。采样点信息见表 1。
表 1. 锡林河流域不同植被带土壤样品采样信息 Table 1. Information of soil sampling sites in different vegetation zones from Xilin River Basin
| Topographical gradient | Vegetation types | Sample ID | Longitude (E) | Latitude (N) | Altitude/m |
| Riverbed center, BC | No plant | BC1 | 116°41′4.98″ | 43°37′31.62″ | 1164 |
| BC2 | 116°41′12.60″ | 43°36′35.88″ | 1165 | ||
| BC3 | 116°39′25.20″ | 43°36′36.60″ | 1166 | ||
| Riverbed side, BS | Juncellus serotinus | BS1 | 116°41′8.34″ | 43°35′35.40″ | 1164 |
| BS2 | 116°41′8.34″ | 43°35′39.90″ | 1165 | ||
| BS3 | 116°41′8.34″ | 43°34′39.90″ | 1164 | ||
| Low floodplain, LF | Juncus effusus | LF1 | 116°41′5.58″ | 43°37′31.38″ | 1164 |
| LF2 | 116°41′6.78″ | 43°36′31.44″ | 1165 | ||
| LF3 | 116°39′25.20″ | 43°36′36.18″ | 1166 | ||
| High floodplain, HF | Potentilla anserina | HF1 | 116°41′12.06″ | 43°37′40.38″ | 1171 |
| HF2 | 116°41′9.48″ | 43°37′38.94″ | 1176 | ||
| HF3 | 116°39′24.96″ | 43°36′35.04″ | 1178 | ||
| River terrace, LT | Leymus chinensis | LT1 | 116°33′29.88″ | 43°32′32.88″ | 1179 |
| LT2 | 116°33′29.70″ | 43°32′32.70″ | 1203 | ||
| LT3 | 116°33′31.98″ | 43°32′32.64″ | 1201 | ||
| Hilly-slope, HT | Stipa grandis | HT1 | 116°41′22.20″ | 43°33′5.58″ | 1255 |
| HT2 | 116°40′25.02″ | 43°33′10.50″ | 1257 | ||
| HT3 | 116°40′26.40″ | 43°35′54.12″ | 1265 |
表选项
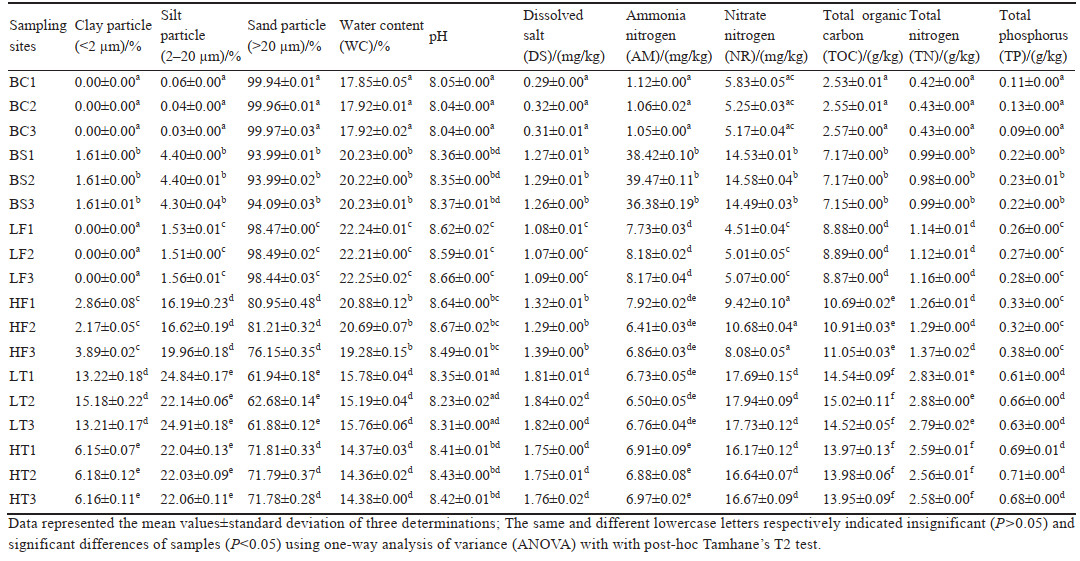
1.3 土壤理化特性测定 土壤黏粒、粉粒和砂粒含量采用激光粒度分析仪进行测定;氨态氮(ammonia nitrogen,AM)含量和硝态氮(nitrate nitrogen,NR)含量是将样品与2 mol/L的KCl溶液按1:2.5浸提1 h后,用0.45 μm微孔滤膜过滤后用连续流动分析仪(SAN plus,Skalar Analytical B. V.,Breda,the Netherlands)进行测定;土壤其他理化指标依照《土壤农化分析》[33]方法进行。其中,土壤含水量(water content,WC)利用105 ℃烘干称重法测定;土壤总有机碳(total organic carbon,TOC)含量采用重铬酸钾容量法-外加热法测定;全氮(total nitrogen,TN)含量采用半微量凯式定氮法测定;全磷(total phosphorus,TP)含量采用高氯酸-硫酸溶解钼锑抗分光光度法测定;pH值采用电极电位法(水土比2.5:1)测定;溶解性盐(dissolved salt,DS)含量利用DDS-11A型电导率仪测定。所有理化指标测定3次重复,表 2中数据为3个测定重复的平均值。
表 2. 锡林河流域不同植被带土壤样品的理化特性 Table 2. Physicochemical properties of soil samples in different vegetation zones in Xilin River Basin
 |
表选项
1.4 土壤DNA的提取、细菌群落16S rRNA基因PCR及高通量测序 18个土壤样品充分混匀后按照FastDNA?Spin Kit for Soil (土壤基因组DNA提取试剂盒)说明提取微生物基因组总DNA。利用16S rRNA基因V3-V4区引物进行PCR扩增。正向、反向引物分别为338F (5′-ACTCCTACGGGA GGCAGCA-3′)、806R (5′-GGACTACHVGGGTW TCTAAT-3′)。每个样品加10 bp标签序列用以区分样本来源。20 μL PCR反应体系:DNA模板(10 ng/μL) 1 μL,FastPfu DNA聚合酶(5 U/μL) 0.4 μL,5×Fast Pfu缓冲液4 μL,dNTPs (2.5 mmol/L) 2 μL,正、反向引物(5 μmol/L)各0.4 μL,超纯水补至20 μL。PCR反应条件:95 ℃ 2 min,95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,25个循环;72 ℃ 5 min[34]。PCR产物用2%的琼脂糖凝胶进行电泳,采用AxyPrepDNA凝胶纯化试剂盒进行回收,后送往北京百迈客生物科技有限公司的Illumina MiSeqPE300测序平台进行高通量测序。
1.5 细菌高通量测序数据分析及绿菌类群的选择 使用Trimmomatic软件将测序接头、标签和前引物序列去除后获得有效序列,进一步修剪、去除非特异性扩增片段、模糊碱基、单碱基高重复区以及长度过短的序列获得优化序列,使用FLASH软件将双端测序的序列进行拼接,最小重叠区长度设置为10 bp,得到长度大约468 bp的序列,使用UPARSE软件基于97%的相似度水平进行操作分类单元(operational taxonomic units,OTUs)聚类分析,同时利用UCHIME去除嵌合体。本研究共获得43830个细菌OTUs。利用RDP classifier对每条序列进行分类学(门、纲、目、科、属、种)注释,共获得绿菌等37个细菌门及625个细菌属,运用SILVA数据库将全部样品获得的625个细菌属在每个样品中分配的细菌类群及其类群对应的序列数进行组成的划分和相对丰度的计算[34]。
从625类细菌中选取隶属于绿菌门(Chlorobi)的9个细菌属进行深入分析。9类细菌隶属于绿菌纲(Chlorobia)和Ignavibacteria纲,绿菌目(Chlorobiales)和Ignavibacteriales目,OPB56、SJA-28、Ignavibacteriaceae、BSV26、PHOS-HE36、LD-RB-3等7个科(表 3)。全部样品16S rRNA基因序列已上传至NCBI,登录号为SRR8835404-47。
表 3. 属水平上绿菌门所有类群的分类学谱系 Table 3. Taxonomic lineage of all bacterial genera from phylum Chlorobi
| Class | Order | Family | Genus | Taxonomic rename at genus level | Abbreviation at genus level |
| Chlorobia | Chlorobiales | SJA-28 | ub | Chlorobiales_SJA-28_ub1 | Chlorobiales1 |
| OPB56 | uc | Chlorobiales_SJA-28_uc6 | Chlorobiales6 | ||
| ub | Chlorobiales_OPB56_ub2 | Chlorobiales2 | |||
| Ignavibacteria | Ignavibacteriales | PHOS-HE36 | ub | Ignavibacteriales_ PHOS-HE36_ub3 | Ignavibacteriales3 |
| Ignavibacteriaceae | Ignavibacterium | Ignavibacterium.o4 | Ignavibacterium4 | ||
| BSV26 | ub | Ignavibacteriales_ BSV26_ub5 | Ignavibacteriales5 | ||
| o | Ignavibacteriales_ BSV26_o8 | Ignavibacteriales8 | |||
| LD-RB-34 | ub | Ignavibacteriales_ LD-RB-34_ub7 | Ignavibacteriales7 | ||
| o | o | Ignavibacteriales_o_o9 | Ignavibacteriales9 | ||
| ub: uncultured_bacterium; o: other; uc: uncultured_Chlorobi_bacterium; the number represented the serial number of each genus. | |||||
表选项
1.6 数据的统计学分析 采用SPSS 22.0进行皮尔逊(Pearson)相关性分析、单因素方差分析(analysis of variance,ANOVA)及Duncan多重比较。针对不同的绿菌类群选择最适合的Bonferroni、Tamhane’s T2或Games-Howell检验方法。用R语言绘制Heatmap图。运用CANOCO 5.0 (Biometris-Plant Research International,Wageningen,Netherlands)软件进行冗余分析(redundancy analysis,RDA),研究绿菌门微生物群落的空间分布及绿菌门微生物群落对环境因子的响应,随后进行单个环境因子的变异权重分析(variation partitioning analysis,VPA),单个环境因子解释度的显著性检验采用Monte Carlo置换检验(permutation test)方法,置换系数默认为999,利用CanoDraw for windows进行制图。运用AMOS软件(ADC,Chicago,IL,USA)构建结构方程模型(structural equation modeling,SEM)。
2 结果和分析 2.1 锡林河流域不同植被带土壤理化因子的陆向分布特征 不同植被带土壤各理化因子表现出明显的空间异质性。土壤含水量的最大值和最小值分别出现在LF和HT,pH值的最大值和最小值分别出现在HF和BC;砂粒含量的最大值和最小值分别出现在BC和LT;土壤氨态氮含量的最大值和最小值分别出现在BS和HT (表 2)。
2.2 锡林河流域不同植被带土壤绿菌门微生物群落的丰度特征 单个绿菌类群的最高相对丰度依次出现在BS2 (Chlorobiales6: 0.29%)和BS3 (Ignavibacteriales8: 0.66%),LF1 (Ignavibacteriales7: 0.32%)、LF2 (Ignavibacteriales5: 0.54%)和LF3 (Ignavibacterium4: 1.06%),HF1 (Ignavibacteriales3: 1.04%;Ignavibacteriales9: 0.21%)、HF2 (Chlorobiales1: 0.25%)和HF3 (Chlorobiales2: 0.15%),见图 1。依据单个绿菌类群的最高相对丰度,将绿菌门微生物群落中的Ignavibacteriales3和Ignavibacterium4划分为最优势类群,最高相对丰度介于1.04%-1.06%;Ignavibacteriales5和Ignavibacteriales8划分为中等优势类群,最高相对丰度介于0.54%-0.66%;剩余5个类群相对罕见,最高相对丰度低于0.50%。
 |
| 图 1 锡林河流域不同植被带土壤绿菌门微生物类群的空间分布特征 Figure 1 Spatial distribution characteristics of soil microbial populations from Chlorobi phylum in different vegetation zones from Xilin River Basin. The same and different lowercase letters respectively indicated insignificant (P > 0.05) and significant differences of samples (P < 0.05) using one-way analysis of variance (ANOVA) with post-hoc Bonferroni, Tamhane's T2 or Games-Howell test. |
| 图选项 |
2.3 锡林河流域不同植被带土壤绿菌门微生物群落的组成及空间分布特征 不同植被带土壤9个类群的累积相对丰度依次为0.23%-0.25% (BC)、1.81%-1.96% (BS)、2.14%-2.45% (LF)、0.37%-1.63% (HF)、0.20%-0.24% (LT)和0.21%-0.23% (HT),见图 1。其中Chlorobiales1和Chlorobiales2广泛分布在BC、BS、LF、HF、LT和HT,但Chlorobiales1在BC和BS的相对丰度显著低于其他4个植被带土壤(P < 0.05),Chlorobiales2在BS和LF的相对丰度显著低于其他4个植被带土壤(P < 0.05);Ignavibacteriales3在BS和LF的相对丰度显著高于其他4个植被带土壤(P < 0.05);Ignavibacterium4在LF的相对丰度显著高于其他5个植被带土壤(P < 0.05);Ignavibacteriales5在LF的相对丰度显著高于BS和其他4个植被带土壤(P < 0.05);Chlorobiales6和Ignavibacteriales8在BS的相对丰度显著高于其他5个植被带土壤(P < 0.05);Ignavibacteriales7在LF的相对丰度显著高于BC和BS以及其他3个植被带土壤(P < 0.05);Ignavibacteriales9在BS、LF、HF的相对丰度显著高于其他3个植被带土壤(P < 0.05)。
2.4 锡林河流域不同植被带土壤绿菌门微生物群落不同类群的相似性 18个样点共聚为两大类五簇(图 2)。BC、LT、HT、HF归为第一大类,BS和LF归为第二大类。其中,BC聚为第一簇;LT和HT聚为第二簇;HF聚为第三簇;BS聚为第四簇,LF聚为第五簇。9个绿菌类群共聚为两大类(图 3)。其中,主要分布在HF、LT和HT中的Chlorobiales1与Chlorobiales2类群聚为第一大类;其余7个绿菌类群聚为第二大类。
 |
| 图 2 锡林河流域不同植被带土壤绿菌门微生物类群的相似性 Figure 2 The similarity of soil microbial populations from Chlorobi phylum in different vegetation zones from Xilin River Basin. |
| 图选项 |
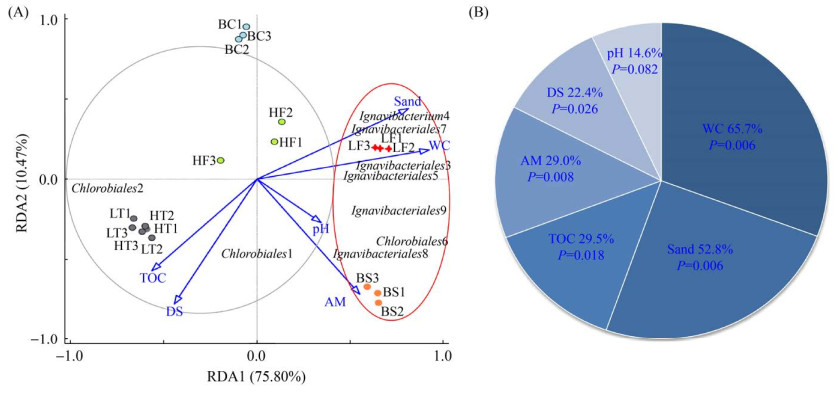 |
| 图 3 锡林河流域不同植被带土壤绿菌门微生物类群与环境因子关系的冗余分析(A)及变异权重分析(B) Figure 3 Relationship between soil microbial populations from Chlorobi phylum and environmental factors in different vegetation zones in Xilin River Basin by redundancy analysis (RDA) (A) and variation partitioning analysis (VPA) (B). |
| 图选项 |
2.5 锡林河流域不同植被带土壤绿菌门微生物群落对环境因子的响应 从Pearson相关性(表 4)分析可知,Chlorobiales1类群的分布与溶解性盐含量和粉粒含量存在显著正相关关系(P < 0.05),与pH和总有机碳存在极显著正相关关系(P < 0.01);Chlorobiales2与总有机碳含量、总氮含量、总磷含量存在显著正相关关系(P < 0.05),与粉粒和黏粒含量存在极显著正相关关系(P < 0.01);Ignavibacteriales3、Ignavibacterium4、Ignavibacteriales5、Ignavibacteriales9与pH存在显著正相关关系(P < 0.05),与含水量存在极显著正相关关系(P < 0.01),其中Ignavibacteriales3与氨态氮含量存在显著正相关关系(P < 0.05),Ignavibacterium4与砂粒含量存在显著正相关关系(P < 0.05),Ignavibacteriales5与砂粒含量存在极显著正相关关系(P < 0.01);Chlorobiales6和Ignavibacteriales8与氨态氮含量存在极显著正相关关系(P < 0.01);Ignavibacteriales7与含水量和砂粒含量存在极显著正相关关系(P < 0.01)。
表 4. 基于皮尔逊相关性分析锡林河流域不同植被带土壤绿菌门微生物类群对环境因子的响应 Table 4. The responses of different soil microbial populations from Chlorobi phylum in different vegetation zones to environmental factors from Xilin River Basin based on Pearson's correlation analysis
 |
表选项
RDA (图 3-A)结果显示,第1排序轴与第2排序轴解释度分别为75.80%和10.47%。Chlorobiales1和Chlorobiales2与总有机碳含量和溶解性盐含量等环境因子的关联度较高;Ignavibacteriales3、Ignavibacterium4、Ignavibacteriales5、Ignavibacteriales7、Ignavibacteriales9与含水量和砂粒含量等环境因子的关联度较高;Chlorobiales6和Ignavibacteriales8与氨态氮含量的关联度较高。VPA结果显示,含水量对绿菌门微生物群落空间变异的解释度高达65.7%、砂粒含量为52.8%、总有机碳含量为29.5%、氨态氮含量为29.0%、溶解性盐含量为22.4%,上述因子均达到了Monte Carlo检验显著性水平(P < 0.05),见图 3-B。
3 讨论 3.1 不同植被带土壤绿菌门群落的空间分布异质性 无植被覆盖的BC土壤Chlorobiales1类群的相对丰度(0.00%-0.01%)显著低于有植被覆盖的LF、HF、LT和HT土壤Chlorobiales1类群的相对丰度(0.09%-0.25%) (P < 0.05,图 1),这和大豆、三叶草、拟南芥等植物叶际AnPB的puf基因丰度显著高于土壤AnPB puf基因丰度的结果[6]具有相似性。研究表明,植物和土壤绿菌等AnPB之间存在puf等基因的水平传递作用[6],据此推测有植被覆盖土壤Chlorobiales1相对丰度高的原因可能与土壤和植物间AnPB的基因流传递有关,但地上植被AnPB基因能否传向地下AnPB并导致其相对丰度增加尚无定论,有待后续研究证实。相比于产氧光合生物,不产氧光合细菌AnPB只有一个反应中心(铁硫型反应中心RC1或苯醌型反应中心RC2)[5-6, 13],对光的需求低。例如,绿菌是以Fe-S为反应中心(RC1)的type Ⅰ型AnPB[6],绿菌门微生物群落不耐强光、对强光竞争能力弱、适于栖居在光线较弱的底水层[35],绿菌和栖居在光线较弱的底水层的苦草植被的生境特征相似[36]。这些报道为本研究无植被覆盖的表层土壤因受强光影响不利于绿菌等低光型AnPB定殖的结果提供了间接依据[2]。
不同植被带土壤9个绿菌类群的累积相对丰度存在统计学差异(图 1)。水莎草沼泽土壤BS和灯芯草沼泽化草甸土壤LF均是绿菌门微生物群落的分布热区,其累积相对丰度(1.81%-1.96%和2.14%-2.45%)显著高于其他植被带土壤绿菌门微生物群落的累积相对丰度(P < 0.05),这和三叶草AnPB的bchY基因丰度高于大豆和拟南芥的研究结果[16]具有相似性,和灯芯草沉积物(相比于米草沉积物)中Ignavibacteriales丰度较高的研究结果相似[37],说明不同植被类型引起的生境差异对土壤绿菌门微生物群落的空间分布异质性有重要影响。Cleary等[37]研究两种盐沼植被对沉积物细菌群落代谢通路的影响,发现米草沉积物中的细菌群落与活性化合物的生物合成有关,灯芯草沉积物中Ignavibacteriales等细菌群落与外源化合物的降解有关,说明不同植被类型引起的生境差异对土壤绿菌门微生物群落的代谢多样性有重要影响。Ignavibacteriales作为绿菌门的重要成员是以Fe-S为反应中心(RC1)的type Ⅰ型AnPB[6],包含硫酸盐还原酶基因cysH和cysD及固氮酶基因nifDKH[2],Hidalgo等[38]证实了底层含水沉积物中Ignavibacteriales成员的硫酸盐还原能力。研究表明,三叶草叶际AnPB的pufM、pufL和bchY基因丰度远远高于大豆和拟南芥[6],说明不同植被类型AnPB功能基因多样性存在差异。这为本研究水莎草沼泽土壤和灯芯草沼泽化草甸土壤绿菌门微生物群落的累积相对丰度远高于其他植被带土壤绿菌门微生物群落的累积相对丰度提供了间接依据,但植被类型究竟如何影响绿菌等AnPB群落结构及功能多样性有待后续研究证实。
3.2 土壤因素对绿菌门微生物群落空间分布异质性的影响 据报道,绿菌门微生物群落适应于海洋、湖泊、河流等水域生态系统[6-12],这为本文绿菌门微生物群落中Ignavibacteriales3等大多数类群主要分布于锡林河流域水莎草沼泽土壤(水生生境)和灯芯草沼泽化草甸土壤(湿生生境)的研究结果提供了依据。原因可能是含水量是驱动不同植被带土壤绿菌门微生物群落空间分布异质性的关键要素。本研究通过皮尔逊相关性分析、冗余分析及变异权重分析证实了含水量对土壤绿菌门微生物群落空间变异的重要性,其解释度高达65.7%。结构方程(图 4)证实含水量是直接驱动土壤绿菌门微生物群落Ignavibacteriales成员空间变异的决定性因子,相关系数高达0.844;而含水量通过直接影响土壤粉粒含量来间接影响Chlorobiales成员的空间分布异质性。
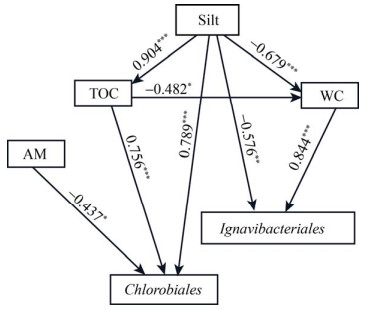 |
| 图 4 基于结构方程模型分析主要环境变量对土壤绿菌门微生物类群空间异质性的影响 Figure 4 Effects of main environmental variables on spatial heterogeneity of microbial populations from Chlorobi phylum based on structural equation model (SEM). |
| 图选项 |
Chlorobiales1和Chlorobiales2类群与有机碳含量存在显著的正相关关系(P < 0.01),这和杭州湾入海口沉积物绿菌与有机碳呈显著正相关的研究结果[39]是一致的,Hidalgo等研究发现萘污染的底层含水沉积物中Ignavibacteriales成员占总细菌群落的80%[38],说明Ignavibacteriales成员是有机污染物的重要降解菌。Bryant和Frigaard于2006年提出Ignavibacteries成员是专性厌氧光自养生物[40]。但绿菌究竟为专性自养型还是混合营养型光合微生物尚不能依据其与有机碳的相关性直接判断。关于绿菌为土壤有机碳的主要贡献者及碳源或碳汇问题有待于后续研究证实。
绿菌门微生物群落中有7个类群与全氮含量存在负相关关系但与氨态氮含量存在正相关关系,推测这7个类群可能是利用N2产生氨态氮的光合固氮细菌[16]。本研究发现绿菌门微生物群落中8个类群与含水量和pH存在正相关关系,这与美国黄石国家公园碱性温泉绿菌的生境特征具有相似性[16],推测绿菌适应于碱性的水生和湿生环境。盐度和pH是驱动塑料生物膜Ignavibacteries多样性变化的重要因子[41]。本研究还发现Ignavibacteriales3等7个类群的相对丰度与砂粒含量存在正相关关系,这与美国黄石公园硅质温泉绿菌的生境特征具有相似性[16]。Schmidt等[35]剖析了不同生产力湖泊深度及生活方式对细菌群落空间分布异质性的影响,发现主要栖居在湖泊深水层的绿菌属于游离型微生物,推测与深水层丰富的砂粒含量有关。de Beer等[42]通过微型传感器研究了美国佛罗里达州小盐泉缺氧和亚硫酸盐水中9-10 m深度的产氧和不产氧光合菌群的空间分布异质性特征,发现湖泊沉积物下层以绿色硫细菌(Chlorobiacea)为主。Hook等研究表明潮间带沉积物细菌会附着在有生物膜包裹的砂粒上,以游离态栖居于周围的孔隙水中[43]。研究表明,砂粒为主的沉积物或土壤只能形成具有保水能力差但透水能力强的大团聚体(> 250 μm)[44],原因是粗砂粒间极少量的触点毛管水为游离型细菌创造了天然的生境。据此推测,栖居在低河漫滩灯芯草沼泽化草甸土壤的大多数Ignavibacteriales类群为游离型绿菌成员。相比于大多数Ignavibacteriales类群,Chlorobiales1和Chlorobiales2类群的相对丰度与粉黏粒含量呈正相关关系,推测其可能为颗粒附着型细菌,原因是粉黏粒为主的土壤微团聚体(< 250 μm)[44],为附着型细菌创造了天然的生境。
4 结论 锡林河流域不同植被带土壤绿菌门微生物群落9个类群具有明显的陆向分布特征。Chlorobiales6及来自Ignavibacteriales目的所有类群分布在灯芯草沼泽化草甸土壤及水莎草沼泽土壤中;Chlorobiales1和Chlorobiales2分布在鹅绒委陵菜草甸土壤、河流阶地羊草草原和丘陵坡地大针茅典型草原土壤中。
植被覆盖状况可能对绿菌门微生物群落的空间分布异质性有间接影响。植被类型可能对土壤绿菌门微生物群落的空间分布异质性有重要影响,但植被类型究竟如何影响绿菌等AnPB群落结构及功能多样性有待后续研究证实。
Chlorobiales1的相对丰度与pH和总有机碳存在极显著正相关关系(P < 0.01);Chlorobiales2的相对丰度与粉黏粒含量存在极显著正相关关系(P < 0.01);Ignavibacteriales3、4、5、7、9的相对丰度与含水量以及Ignavibacteriales5、7与砂粒含量呈极显著正相关关系(P < 0.01)。土壤含水量是直接驱动土壤绿菌门微生物群落Ignavibacteriales成员空间变异的决定性因子,解释了绿菌门微生物群落空间变异的65.7%,是锡林河流域不同植被带绿菌门微生物群落空间异质性的关键驱动因子。
References
| [1] | Czaja AD, Johnson CM, Beard BL, Roden EE, Li WQ, Moorbath S. Biological Fe oxidation controlled deposition of banded iron formation in the ca. 3770 Ma Isua Supracrustal Belt (West Greenland). Earth and Planetary Science Letters, 2013, 363: 192-203. DOI:10.1016/j.epsl.2012.12.025 |
| [2] | Thompson KJ, Simister RL, Hahn AS, Hallam SJ, Crowe SA. Nutrient acquisition and the metabolic potential of photoferrotrophic Chlorobi. Frontiers in Microbiology, 2017, 8: 1212. DOI:10.3389/fmicb.2017.01212 |
| [3] | Xiong J, Fischer WM, Inoue K, Nakahara M, Bauer CE. Molecular evidence for the early evolution of photosynthesis. Science, 2000, 289(5485): 1724-1730. DOI:10.1126/science.289.5485.1724 |
| [4] | Blankenship RE. Molecular evidence for the evolution of photosynthesis. Trends in Plant Science, 2001, 6(1): 4-6. DOI:10.1016/S1360-1385(00)01831-8 |
| [5] | Zheng Q, Koblí?ek M, Beatty JT, Jiao NZ. Evolutionary divergence of marine aerobic anoxygenic phototrophic bacteria as seen from diverse organisations of their photosynthesis gene clusters. Amsterdam: Elsevier, 2013, 63: 359-383. |
| [6] | Atamna-Ismaeel N, Finkel O, Glaser F, von Mering C, Vorholt JA, Koblí?ek M, Belkin S, Béjà O. Bacterial anoxygenic photosynthesis on plant leaf surfaces. Environmental Microbiology Reports, 2012, 4(2): 209-216. DOI:10.1111/j.1758-2229.2011.00323.x |
| [7] | Summons RE, Powell TG. Chlorobiaceae in Palaeozoic seas revealed by biological markers, isotopes and geology. Nature, 1986, 319(6056): 763-765. DOI:10.1038/319763a0 |
| [8] | Grice K, Schaeffer P, Schwark L, Maxwell JR. Changes in palaeoenvironmental conditions during deposition of the Permian Kupferschiefer (Lower Rhine Basin, northwest Germany) inferred from molecular and isotopic compositions of biomarker components. Organic Geochemistry, 1997, 26(11): 677-690. |
| [9] | Grice K, Cao CQ, Love GD, B?ttcher ME, Twitchett RJ, Grosjean E, Summons RE, Turgeon SC, Dunning W, Jin YG. Photic zone Euxinia during the Permian-Triassic superanoxic event. Science, 2005, 307(5710): 706-709. DOI:10.1126/science.1104323 |
| [10] | Cao CQ, Love GD, Hays LE, Wang W, Shen SZ, Summons RE. Biogeochemical evidence for euxinic oceans and ecological disturbance presaging the end-Permian mass extinction event. Earth and Planetary Science Letters, 2009, 281(3/4): 188-201. |
| [11] | Herbert RA, Tanner AC. The isolation and some characteristics of photosynthetic bacteria (Chromatiaceae and Chlorobiaceae) from Antarctic marine sediments. Journal of Applied Bacteriology, 1977, 43(3): 437-445. DOI:10.1111/j.1365-2672.1977.tb00770.x |
| [12] | Niu FX, Ji FY, Zhao G, Zhang Q, Shen QS, He Q, Yan HB. Vertical distribution of bacterial communities in sediments of Longjing Lake. China Environmental Science, 2017, 37(6): 2322-2331. (in Chinese) 牛凤霞, 吉芳英, 赵艮, 张倩, 沈秋实, 何强, 颜海波. 龙景湖沉积物的细菌群落垂向分布特征. 中国环境科学, 2017, 37(6): 2322-2331. DOI:10.3969/j.issn.1000-6923.2017.06.041 |
| [13] | Hamilton TL, Bennett AC, Murugapiran SK, Havig JR. Anoxygenic phototrophs span geochemical gradients and diverse morphologies in terrestrial geothermal springs. mSystems, 2019, 4(6): 498. DOI:10.1128/msystems.00498-19 |
| [14] | Bryant DA, Liu ZF, Li T, Zhao FQ, Costas AMG, Klatt CG, Ward DM, Frigaard NU, Overmann J. Comparative and functional genomics of anoxygenic green bacteria from the taxa, Chlorobi, Chloroflexi, and Acidobacteria. Functional Genomics and Evolution of Photosynthetic Systems, 2012: 47-102. DOI:10.1007/978-94-007-1533-2_3 |
| [15] | Roy C, Bakshi U, Rameez MJ, Mandal S, Haldar PK, Pyne P, Ghosh W. Phylogenomics of an uncultivated, aerobic and thermophilic, photoheterotrophic member of Chlorobia sheds light into the evolution of the Phylum Chlorobi. Computational Biology and Chemistry, 2019, 80: 206-216. DOI:10.1016/j.compbiolchem.2019.04.001 |
| [16] | Liu ZF, Klatt CG, Ludwig M, Rusch DB, Jensen SI, Kühl M, Ward DM, Bryant DA. 'Candidatus Thermochlorobacter aerophilum: ' an aerobic chlorophotoheterotrophic member of the Phylum Chlorobi defined by metagenomics and metatranscriptomics. The ISME Journal, 2012, 6(10): 1869-1882. DOI:10.1038/ismej.2012.24 |
| [17] | Zhang XX, Liu YP, Yuan B, Zhao JR, Wang RG, Feng FY. Sphingomonas sp.MIM37 possessing aerobic anoxygenic photosynthetic gene cluster and xanthorhodopsin-like gene: its genome draft and growth stimulation by illumination. Microbiology China, 2015, 42(8): 1520-1528. (in Chinese) 张星星, 刘亚鹏, 袁博, 赵吉睿, 王瑞刚, 冯福应. 含好氧不产氧光合基因簇和Xanthorhodopsin-like基因的Sphingomonas sp. MIM37:基因组及光促生长分析. 微生物学通报, 2015, 42(8): 1520-1528. |
| [18] | Feng FY, Jiao NZ, Du HL, Zeng YH. Phylogenetic analysis of aerobic anoxygenic phototrophic bacteria and their relatives based on farnesyl pyrophosphate synthase gene. Acta Oceanologica Sinica, 2010, 29(5): 82-89. DOI:10.1007/s13131-010-0066-3 |
| [19] | Imhoff JF. Diversity of anaerobic anoxygenic phototrophic purple bacteria. Modern Topics in the Phototrophic Prokaryotes. Cham: Springer International Publishing, 2017: 47-85. |
| [20] | Lami R, Cottrell MT, Ras J, Ulloa O, Obernosterer I, Claustre H, Kirchman DL, Lebaron P. High abundances of aerobic anoxygenic photosynthetic bacteria in the south Pacific Ocean. Applied and Environmental Microbiology, 2007, 73(13): 4198-4205. DOI:10.1128/AEM.02652-06 |
| [21] | Cuadrat RRC, Ferrera I, Grossart HP, Dávila AMR. Picoplankton bloom in global south? A high fraction of aerobic anoxygenic phototrophic bacteria in metagenomes from a coastal bay (arraial do Cabo-Brazil). OMICS: A Journal of Integrative Biology, 2016, 20(2): 76-87. DOI:10.1089/omi.2015.0142 |
| [22] | Jiao NZ, Zhang Y, Zeng YH, Hong N, Liu RL, Chen F, Wang PX. Distinct distribution pattern of abundance and diversity of aerobic anoxygenic phototrophic bacteria in the global ocean. Environmental Microbiology, 2007, 9(12): 3091-3099. DOI:10.1111/j.1462-2920.2007.01419.x |
| [23] | Boeuf D, Cottrell MT, Kirchman DL, Lebaron P, Jeanthon C. Summer community structure of aerobic anoxygenic phototrophic bacteria in the western Arctic Ocean. FEMS Microbiology Ecology, 2013, 85(3): 417-432. DOI:10.1111/1574-6941.12130 |
| [24] | Lehours AC, Jeanthon C. The hydrological context determines the beta-diversity of aerobic anoxygenic phototrophic bacteria in European Arctic seas but does not favor endemism. Frontiers in Microbiology, 2015, 6: 638. |
| [25] | He YP, Zeng YH, Yuan B, Liu HR, Feng FY. Phylogenetic diversity of aerobic anoxygenic phototrophic bacteria in eutrophic zone of lake ulansuhai based on gene pufM. Microbiology China, 2010, 37(8): 1138-1145. (in Chinese) 何一平, 曾永辉, 袁博, 刘惠荣, 冯福应. 基于pufM基因的乌梁素海富营养化湖区好氧不产氧光合细菌系统发育多样性分析. 微生物学通报, 2010, 37(8): 1138-1145. |
| [26] | Tang K, Jia LJ, Yuan B, Yang SS, Li H, Meng JY, Zeng YH, Feng FY. Aerobic anoxygenic phototrophic bacteria promote the development of biological soil crusts. Frontiers in Microbiology, 2018, 9: 2715. DOI:10.3389/fmicb.2018.02715 |
| [27] | Feng YZ, Lin XG, Mao TT, Zhu JG. Diversity of aerobic anoxygenic phototrophic bacteria in paddy soil and their response to elevated atmospheric CO2. Microbial Biotechnology, 2011, 4(1): 74-81. DOI:10.1111/j.1751-7915.2010.00211.x |
| [28] | Smith MW, Zeigler Allen L, Allen AE, Herfort L, Simon HM. Contrasting genomic properties of free-living and particle-attached microbial assemblages within a coastal ecosystem. Frontiers in Microbiology, 2013, 4: 120. |
| [29] | Cottrell MT, Ras J, Kirchman DL. Bacteriochlorophyll and community structure of aerobic anoxygenic phototrophic bacteria in a particle-rich estuary. The ISME Journal, 2010, 4(7): 945-954. DOI:10.1038/ismej.2010.13 |
| [30] | Geddes BA, Paramasivan P, Joffrin A, Thompson AL, Christensen K, Jorrin B, Brett P, Conway SJ, Oldroyd GED, Poole PS. Engineering transkingdom signalling in plants to control gene expression in rhizosphere bacteria. Nature Communications, 2019, 10: 3430. DOI:10.1038/s41467-019-10882-x |
| [31] | Zhu YG, Zhao Y, Li B, Huang CL, Zhang SY, Yu S, Chen YS, Zhang T, Gillings MR, Su JQ. Continental-scale pollution of estuaries with antibiotic resistance genes. Nature Microbiology, 2017, 2: 16270. DOI:10.1038/nmicrobiol.2016.270 |
| [32] | Preston T, Stewart WDP, Reynolds CS. Bloom-forming cyanobacterium Microcystis aeruginosa overwinters on sediment surface. Nature, 1980, 288(5789): 365-367. DOI:10.1038/288365a0 |
| [33] | Bao SD. Soil and agricultural chemistry analysis. Beijing: Chinese Agriculture Press, 2000. (in Chinese) 鲍士旦. 土壤农化分析. 3版. 北京: 中国农业出版社, 2000. |
| [34] | Yu JL, Xia JJ, Li CH, Zhang SH, Li X, Lu Y, Xininigen. Niche differentiation of Nitrospira and associated environmental driving forces in Xilin river basin. Microbiology China, 2020, 47(5): 1418-1429. (in Chinese) 于景丽, 夏晶晶, 李传虹, 张少华, 李新, 芦燕, 希尼尼根. 锡林河流域Nitrospira的生态位分化及环境驱动力. 微生物学通报, 2020, 47(5): 1418-1429. |
| [35] | Schmidt ML, Denef VJ. Dissecting microbial habitats in stratified lakes: Evidence of deterministic changes in free-living and particle-associated bacterial community composition across a productivity gradient. Esa Convention, 2014: 8. |
| [36] | Su WH, Zhang GF, Zhang YS, Xiao H, Xia F. The photosynthetic characteristics of five submerged aquatic plants. Acta Hydrobiologica Sinica, 2004, 28(4): 391-395. (in Chinese) 苏文华, 张光飞, 张云孙, 肖衡, 夏峰. 5种沉水植物的光合特征. 水生生物学报, 2004, 28(4): 391-395. DOI:10.3321/j.issn:1000-3207.2004.04.010 |
| [37] | Cleary DFR, Polónia ARM, Sousa AI, Lilleb? AI, Queiroga H, Gomes NCM. Temporal dynamics of sediment bacterial communities in monospecific stands of Juncus maritimus and Spartina maritima. Plant Biology, 2016, 18(5): 824-834. DOI:10.1111/plb.12459 |
| [38] | Hidalgo KJ, Teramoto EH, Soriano AU, Valoni E, Baessa MP, Richnow HH, Vogt C, Chang HK, Oliveira VM. Taxonomic and functional diversity of the microbiome in a jet fuel contaminated site as revealed by combined application of in situ microcosms with metagenomic analysis. Science of the Total Environment, 2020, 708: 135152. DOI:10.1016/j.scitotenv.2019.135152 |
| [39] | Li ST, Zhang QF, Zhou YJ, Tang FY, Cheng JR, Zheng QH, Xu JR. Prokaryotic community diversity in the estuarine sediments of Hangzhou Bay, China. Journal of Biology, 2018, 35(3): 47-51. (in Chinese) 李双彤, 张秋芳, 周阳靖, 唐方园, 程军蕊, 郑琦宏, 徐继荣. 杭州湾入海口沉积物原核生物多样性分析. 生物学杂志, 2018, 35(3): 47-51. |
| [40] | Bryant DA, Frigaard NU. Prokaryotic photosynthesis and hototrophy illuminated. Trends in Microbiology, 2006, 14: 488-496. DOI:10.1016/j.tim.2006.09.001 |
| [41] | Pinnell LJ, Turner JW. Temporal changes in water temperature and salinity drive the formation of a reversible plastic-specific microbial community. FEMS Microbiology Ecology, 2020, 96(12): 109312. |
| [42] | de Beer D, Weber M, Chennu A, Hamilton T, Lott C, Macalady J, M Klatt J. Oxygenic and anoxygenic photosynthesis in a microbial mat from an anoxic and sulfidic spring. Environmental Microbiology, 2017, 19(3): 1251-1265. DOI:10.1111/1462-2920.13654 |
| [43] | Hook W, Plante C. Antibiotic production by intertidal sedimentary and porewater bacteria and the characterization of their prevalence in situ. Plankton and Benthos Research, 2019, 14(3): 197-205. DOI:10.3800/pbr.14.197 |
| [44] | Hemkemeyer M, Dohrmann AB, Christensen BT, Tebbe CC. Bacterial preferences for specific soil particle size fractions revealed by community analyses. Frontiers in Microbiology, 2018, 9: 149. DOI:10.3389/fmicb.2018.00149 |
