李术艺1, 冯旗1, 董依然1,2


1. 中国地质大学(武汉)环境学院, 湖北 武汉 730074;
2. 中国地质大学(武汉)生物环境和生物地质国家重点实验室, 湖北 武汉 730074
收稿日期:2020-11-13;修回日期:2021-03-10;网络出版日期:2021-03-27
基金项目:国家自然科学基金(41877321,91851211,9205111)
作者简介:董依然,中国地质大学(武汉)环境学院教授,博士生导师,致力于环境生物地球化学和地质微生物等领域的研究,具有丰富的深部地下微生物研究经验,形成了以功能微生物为主要研究对象的多学科、多尺度、多种研究方法结合的环境微生物组研究体系。自2009年以来一直从事和二氧化碳地质封存环境体系中的生物地球化学过程相关研究工作,目前受到国家自然科学基金面上项目、国家自然科学基金重大研究计划子课题等支持。已在Environmental Science & Technology,Environmental Microbiology,Applied and Environmental Microbiology等环境科学和环境微生物领域经典期刊发表论文30余篇.
*通信作者:董依然, Tel: +86-27-87663152;E-mail: dongyr@cug.edu.cn.
摘要:地质封存将工业和能源相关领域生产活动产生的二氧化碳(CO2)进行捕集并注入到深部地下岩石构造中,以实现长期储存的目标,是降低温室气体排放、实现CO2长期封存的重要可行性手段之一。向深部地下地质构造中注入大量CO2会导致深地环境发生显著变化,进而引起原生微生物活性及群落结构发生明显改变。因此,地质封存CO2能够直接或间接影响深地微生物驱动的生物地球化学过程。同时,微生物在短期和长期的超临界CO2(scCO2)胁迫作用下,也会通过不同的适应性进化方式影响CO2在地下环境中的迁移、转化和赋存形态。本文介绍了国内外二氧化碳捕获与封存发展现状以及地质封存CO2影响条件下的scCO2-水-微生物-矿物的相互作用领域的最新科研进展,并展望了利用深地微生物强化CO2固定以及将其转化为高附加值产物的潜力。
关键词:二氧化碳地质封存深地微生物CO2胁迫scCO2-水-微生物-矿物的相互作用生物转化CO2固定
Interactions between geological sequestration of carbon dioxide and deep subsurface microorganisms
Li Shuyi1, Feng Qi1, Dong Yiran1,2


1. School of Environmental Studies, China University of Geosciences(Wuhan), Wuhan 730074, Hubei Province, China;
2. State Key Laboratory of Biogeology and Environmental Geology, China University of Geosciences(Wuhan), Wuhan 730074, Hubei Province, China
Received: 13 November 2020; Revised: 10 March 2021; Published online: 27 March 2021
*Corresponding author: Yiran Dong, Tel: +86-27-87663152;E-mail: dongyr@cug.edu.cn.
Foundation item: Supported by the National Natural Science Foundation of China (41877321, 91851211, 9205111)
Abstract: Geological sequestration is the process that injects carbon dioxide (CO2) captured from an industrial or energy-related source into deep subsurface rock formations for long-term storage, which is one of the viable and feasible means to reduce greenhouse gas emission and sequester CO2 permanently. Injecting massive amounts of CO2 into the deep geological formations may cause significant changes to subsurface that abundant microbiota use as habitats, and hence influence microbial activity and microbial structure. Thus, geological sequestration of CO2 will directly or indirectly affect the subsurface biogeochemical processes. When exposed to short-or long-term stresses by super-critical phase CO2(scCO2), adaptive evolution of the deep subsurface microorganisms may influence the fate and transport of the sequestered CO2. This review focuses on the latest progress in the domestic and international studies and the current understandings about the scCO2-water-microbe-mineral interactions in the subsurface environments impacted by CO2 geological sequestration. In addition, this paper also includes a discussion about the potential to enhance CO2 stabilization and transformation to the value-added products by the deep subsurface microorganisms.
Keywords: geological sequestration of CO2deep subsurface microorganismsstresses by CO2scCO2-water-microbes-mineral interactionsmicrobial transformationCO2 fixation
1 二氧化碳地质封存概念以及发展现状 二氧化碳的捕获与封存(carbon dioxide capture and storage,CCS)是指将固定的大型工业源(如电厂)释放的CO2在排放到大气之前进行捕获、运输并储存在深部地下构造中[1-3]。在这一过程中,CO2被注入地下深部具有较好多孔性和渗透性的地层岩石(通常为砂岩),在其上部具有低渗透性的盖层作为密封层阻止注入的CO2在“浮力”的作用下向上部的运动,从而实现长期储存,也被称为二氧化碳地质封存(CO2 geological sequestration)(图 1)。在深部地下环境中,当温度和压力超过CO2的临界点(31.1 ℃和72.9 MPa),CO2以超临界状态存在,同时表现出气体以及液体的部分性质[4-5]。作为一种降低温室气体释放压力的可行性方法,二氧化碳地质封存已经获得了广泛认可和大规模的实践应用。二氧化碳地质封存所涉及的深层地下天然封存场地(如石油天然气储层、不可开发煤层、深地咸水层、富含有机质的页岩等)由于其分布广泛、技术成熟、储存规模大和将CO2转化为碳酸盐矿物或其他高附加值产品的潜力,成为了目前研究最为深入的二氧化碳地质封存场地,据预测CO2储存能力达到2.6×104–2.1×105亿t[6]。
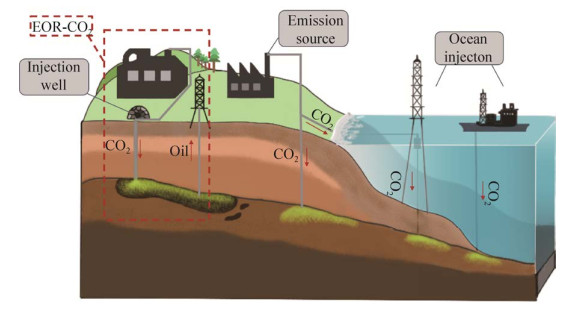 |
| 图 1 二氧化碳地质封存示意图 Figure 1 Schematic diagram of CO2 geological sequestration. |
| 图选项 |
1.1 国际CCS的发展现状 据不完全统计,截止2018年4月全球范围已有305个CCS项目,分布于6大洲的30多个国家。尽管部分项目还处于计划和开发初级阶段,但是大部分已经完成,目前有约37个项目处于捕获或者CO2注入阶段[6]。作为最早的CCS项目之一,日本的新能源技术综合开发机构于2000–2005年启动了CO2含水层封存技术研究开发计划,在新泻县长岗市向1200米深的地下注入2万t CO2,并用地震波层析技术对注入地中的CO2进行了监测,证实了CO2被封闭在地层中[7]。
值得一提的是,尽管CCS概念的提出、发展和应用开始于本世纪初[8],但是向深地注入CO2在之前相当长一段时间已经在油气开采行业发展为三级采油的重要手段之一。将纯度大于95 %的CO2注入井中,通过CO2与石油混合以使其膨胀,将原油从岩石孔隙脱离,并使其在油层中更自由地流动,从而实现利用CO2来强化采油的目的,亦称为二氧化碳强化采油(CO2-EOR)[9-10]。尽管二氧化碳强化采油的主要目标并不是二氧化碳封存,但是在实施的过程中部分CO2被保留在地下环境中,因此实现了对其长期储存的效应。CO2-EOR最早于20世纪70年代在美国德克萨斯州的二叠纪盆地(SACROC项目)[11]和新墨西哥州的东南部(Crossett项目)[12]进行了测试,证明通过向储层中注入CO2确实可以提高石油产量,因此这一技术被沿用至今。截至2014年,美国有136个有效CO2-EOR项目。每年约注入6800万t CO2,生产30万桶增量的石油[13]。加拿大Weyburn Midale油田也曾通过人为注入CO2来实现CO2-EOR,CO2注入量总计2700万t,商业化的CO2-EOR将石油产量从2000年的8000桶/d增至2014年的26000桶/d,增长了2倍以上[14]。从这个角度来看,CO2-EOR不但具有抑制CO2排放的潜力,同时也在很大程度上提高了能源产率,增加了经济效益。
近20年来,二氧化碳封存在北美、欧洲、澳洲以及亚洲发展迅速。据2018年的一项报道显示,已经有至少14个工业级的CCS项目在技术上实现了年注入和封存超过1百万t CO2的能力,其中3项是将CO2封存在深地的咸水层[15]。美国区域碳封存合作伙伴关系计划(Regional Carbon Sequestration Partnership)于2003年启动,2008年开始通过大型野外项目在深地地质构造中安全封存了超过1100万吨CO2。在美国能源部工业碳捕集与封存(Industrial CO2 Capture and Storage,ICCS)计划的支持下,美国国内部署了一系列先进的大规模项目,其中伊利诺伊州的ICCS项目在2017年投运,该项目每天可封存CO2约3000 t,预期累积将封存3–5百万t CO2[16]。美国国家环境保护局采用了东南部地区碳封存作伙伴项目(The Southeast Regional Carbon Sequestration Partnership)的锡特罗内尔场地和中西部地质封存协会(Midwest Geological Sequestration Consortium)的伊利诺伊盆地-迪凯特项目场地的储层模型,用于划定这些CO2注入项目的审查区域。在2019至2020年,美国能源部国家能源和技术实验室批准了一系列新的CCS项目或在原有CCS项目基础上的三期工程。例如在密西西比州开展CO2封存项目EC02S Ⅲ期工程以及北达科他州、新墨西哥州、怀俄明州、伊利诺伊州的Carbonsafe三期工程,拟评价区域性CCS复合体系的可行性,并为国家风险评估合作项目评价商业CCS项目的风险作为参考[17]。在欧洲地区,2015年荷兰鹿特丹E.ON Benelux公司设计开展的CATO1-Rotterdam ROAD项目每年从Maasvlakte的一个发电厂捕获110万t二氧化碳,并将捕获的二氧化碳通过一条25公里长的管道储存在北海的一个枯竭的天然气储层中。同年,德国Vattenfall公司开展的Altmark封存项目,在欧洲第二大天然气田——阿尔马克气田进行,该项目计划控制已有的井,同时推进监测技术、过程建模和风险评估。澳大利亚的FutureGas公司则利用CCS进行合成液体燃料和发电,捕获得到的CO2被储存在Otway盆地[6]。在亚洲,韩国于2018年提出Korea CCS1 (计划中),计划利用燃烧后捕获二氧化碳的方法,每年将120万t的CO2输送到咸水层。2016年,日本政府在北海道苫小牧市开始了大规模的CCS示范项目,计划在三年内从炼油厂制氢过程中捕集约30万t CO2,并将其封存在该市港口滨海的岩盐地层中,该目标已于2019年年底实现。2014年开展的广岛试验项目每天可回收2 t CO2[18]。2016年底,全球第一个钢铁行业大规模商业运作的CCS项目作为阿拉伯联合酋长国钢铁工业(Emirates Steel Industries) CCS项目一期工程(The Abu Dhabi CCS Project PhaseⅠ)开始运行。该系统采用了胺基吸附工业,设计年均CO2捕集量为80万t,被吸附的CO2通过长达43 km的管道被注入油田用于强化产油[19]。目前,该项目的二期工程也已经被提上日程。
1.2 中国CCS发展现状 中国是主要的能源消费国和CO2排放国之一,加大力度控制日益增长的CO2排放对于减缓全球气候变化至关重要[20]。2020年9月,中国领导人在联合国大会上表示:“中国将提高国家资助贡献力度,采取更加有力的政策和措施,CO2排放力争于2030年前达到峰值,争取在2060年前实现碳中和”。要取得长期和高效的减排效果,碳捕获和封存是一系列技术组合中不可缺少的部分。创新型CO2资源化利用技术,有利于能耗和成本降低,深化和拓展CO2资源化利用途径将为我国未来温室气体减排和可持续发展提供重要的战略性技术选择。中国政府高度重视碳捕获、利用与封存技术(carbon capture,utilization and sequestration,CCUS),《国家中长期科学和技术发展规划纲要(2006-2020年)》[21]、《中国应对气候变化科技专项行动》[22]、《国家“十二五”科学和技术发展规划》[23]等科技政策文件中均明确提出要将CCUS技术开发作为控制温室气体排放和减缓气候变化的重要任务,并围绕CO2捕获、运输、资源化利用与封存的相关科学理论、关键技术、示范及相关战略等进行了比较系统的部署[24-27]。在国家相关技术政策引导和各级政府的支持配合下,建成多个万吨以上级CO2捕获示范装置,部分工业试点和示范工程项目(表 1)[6, 28]。其中,由中国国家能源集团(原神华集团)鄂尔多斯煤制油分公司承担的我国首个地下咸水层二氧化碳封存项目成功实施,其规模为10万吨/年。作为国家科技支撑的重大科研项目,监测期将长达50年。从2011年5月至2015年4月,共试验封存了约30.26万t二氧化碳,是亚洲唯一的10万t级以上的地下咸水层封存项目,其封存总潜力预计在300亿t以上。截至2019年,监测数据显示该项目封存区的地下水质、压力、温度、地表二氧化碳浓度等指标没有明显变化,采用的示踪技术也没有检测到二氧化碳泄漏现象。此项目的成功实施,标志着中国已形成CCS的成套技术并将在减少温室气体的领域作出更大的贡献。
表 1. 中国的示范级CCUS项目[6, 28] Table 1. Demonstration level CCUS projects in China[6, 28]
| Project name | Location | The scale (×104 tons/year) | Starting time | Content |
| Research and Demonstration of CO2-EOR Project, Jilin Oilfield of PetroChina Company Limited | Jilin Oilfield, Jilin | 20 | 2007 | CO2-EOR |
| CO2 Chemical Utilization Project, Jiangsu Jinlong-CAS Environmental Protection New Material Co., Ltd | Taixing, Jiangsu | 0.8 | 2007 | Using CO2 produced from an alcohol-generating plant for the downstream chemical engineering production |
| Pilot CO2 Capture Project, Beijing Thermo Power Plant, China Huaneng Group | Gaobeidian, Beijing | 0.3 | 2008 | Post-combustion capture and production of food-grade CO2 |
| CO2-to-Plastics Project, China National Offshore Oil Corporation | Dongfang, Hainan | 0.21 | 2009 | Separation of CO2 from natural gas and generation of value-added products |
| Demonstration Level Carbon Capture Project, Huaneng Group | Shidongkou, Shanghai | 12 | 2009 | Post-combustion capture and production of food-grade CO2 |
| Demonstration Level Carbon Capture Project, Chongqing Shuanghuai Power Plant, China Power Investment Corporation | Hechuan, Chongqing | 1 | 2010 | Post-combustion capture and production of food-grade CO2 |
| Small Scale Demonstration Level Project of CO2 Capture and Enhanced Oil Recovery, Shengli Oilfield, Sinopec | Shengli Oilfield, Shandong | 4 | 2010 | Post-combustion capture CCS-EOR |
| Ordos CCS Demonstration Project, China Energy Investment Corporation (formerly Shenhua Group) | Ordos, Inner Mongolia | 10 | 2011 | Pre-combustion capture and sequestration in saline aquifer |
| Clean Coal Energy System, Lianyungang | Binhai, Jiangsu | 3 | 2011 | Pre-combustion capture and sequestration in saline aquifer |
| Chemical Capture Project, Shaanxi Yanchang Petroleum Engineering Co., Ltd. | Jingbian Oilfield, Shaanxi | 5 | 2012 | CO2-EOR |
| CCUS Project, Tianjin Beitang Power Plant | Tianjin | 2 | 2012 | Food application |
| CO2-EOR Project, Zhongyuan Oil field, China National Petroleum Corporation | Puyang, Henan | 10 | 2015 | CO2-EOR |
| CCS Project, Xinjiang Dunhua Petroleum Co., Ltd. | Karamay Oilfield, Xinjiang Uygur Autonomous Region | 6 | 2015 | CO2-EOR |
| CCS Project, Sinopec Qilu Petrochemical | Dongying, Shandong | 35 | 2017 | EOR |
表选项
2 地质CO2封存对深地环境和深地微生物的影响 深地生物圈(deep subsurface biosphere)是存在于陆地或海底1米以下,不依赖光合作用作为能量来源的生物圈,涵盖了地球上大部分生态系统[29-30]。由于不具备光合作用的条件,深地生物圈可以通过化能合成作用将无机物转化为有机物,并作为初级生产者为其他微生物提供能量和碳源,形成“黑色食物链”[31]。作为全球2%–19%微生物总量的栖息地,地下的极端环境造就了地下微生物丰富的物种、代谢途径和活性,直接和间接影响全球范围多种元素(如碳、氮、硫、铁)的生物地球化学过程[29, 32-33]。生活在深地生物圈的微生物也参与矿物岩石风化、油气和金属矿产的形成、污染物迁移转化、温室气体地质封存等,直接或间接影响与能源、环境、气候相关的自然过程以及人类活动[34-35]。
由于深地地质构造通常是CCS中CO2的储藏地,因此深地生物圈是与CO2接触最为直接并受其迁移和转化直接影响的生态系统。同时,保存在地下存储场地和迁移或渗漏至较浅深度沉积物的CO2也受到深地微生物的影响和调节。在这些环境中CO2的状态(如溶解态或scCO2)和浓度的不均匀分布以及在时间和空间上的动态迁移、转化对深地生物圈的影响方式和程度可能呈现出多样化和动态化的特征[36-40]。在CO2地质封存干扰的地下环境系统中,深地微生物除了需要耐受例如无氧、黑暗、高温、高压、寡营养、低孔隙率、高盐等典型深地环境压力因子的影响外,同时也不同程度地受到注入的大量CO2尤其是scCO2的胁迫作用,其存活能力、物种组成、丰度、代谢能力和代谢活性都可能受到CO2及其注入对环境条件的影响并反作用于CO2的迁移和转化过程。同时,由于存储场地的微生物能迅速响应环境变化,并且能够通过不同方式转化CO2或改变其赋存形式[36-37, 39, 41],因此地下微生物,尤其是生活在CO2地质封存场地浅层地下水环境的微生物群落,也可以作为生物监测的理想手段,例如通过对功能群落或者CO2固定相关功能基因的鉴定来监测CO2的泄漏。CO2地质封存与深地生物圈的紧密联系和相互作用涉及微生物-CO2-水-矿物的多界面反应。
二氧化碳注入引发的地球化学变化可以改变地下厌氧菌的种类和数量以及对微生物群落产生影响。许多深地生物圈的微生物群落研究表明硫酸盐还原、发酵、产甲烷是深地环境中最重要的代谢途径[42]。因此,研究CO2的注入如何改变微生物群落结构的平衡、活性微生物种类、代谢活性和代谢潜力,不但对理解二氧化碳地质封存过程中注入的CO2的迁移与转化的短期和长期效应有所帮助,也对深地生物圈相关的生物地球化学过程的影响、二氧化碳地质封存的环境监测和泄漏治理具有重要的作用。
2.1 CO2地质封存对深地微生物生存环境的影响 CO2注入可以从多方面改变深地生物圈中不同微生物所处的环境条件。例如CO2在水中的溶解可以形成碳酸,分解产生碳酸根和碳酸氢根,这一过程会引起氢离子(H+)的富集和pH的降低(公式1)。基于包气带、浅层地下水以及深地咸水环境的模拟实验和模型预测显示,CO2注入可以引起水体pH值降低1–3个单位[39, 43-45]。
 | 公式(1) |
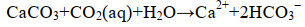 | 公式(2) |
 | 公式(3) |
 | 公式(4) |
此外,CO2注入还会引起水体中具有氧化还原活性成分的氧化态和还原态的重新分配,导致水环境中氧化-还原电位的变化[48, 50]。这一系列环境变化会直接或间接引起与深地生物圈相关的大多数微生物反应(如铁还原、硫酸还原、产甲烷)的自由能发生改变。由此引起的不同生物过程的热动力学变化可以解释在不同模拟实验中CO2注入会影响不同生物地球化学过程以及功能微生物的演替[41, 55-58]。例如,自由能计算显示CO2注入条件下微生物铁还原反应的热动力学更为有利,这一计算结果和在不同CO2注入场地观察到的微生物铁还原反应显著增加现象一致[41, 50]。同理,Mayumi等(2013)在油田样品中观察到提高CO2的压力环境能够促进微生物产甲烷的能力,但是低CO2分压环境下占主导地位的嗜氢产甲烷过程被高CO2分压环境下的乙酸型产甲烷过程所替代。这一现象和不同CO2压力条件下产甲烷过程的热动力学计算结果一致[56]。因此,CO2地质封存可能通过对环境条件的改变影响深地环境中的微生物及其反应活性,并通过微生物反应间接调节环境条件。
2.2 scCO2对微生物活性的影响 由于scCO2的疏水性和脂溶性,其化学性质类似于有机溶剂,对微生物有毒害作用,因此广泛应用于医疗和食品行业中的灭菌处理[59]。其主要原理包括高压条件下,scCO2引起的细胞质酸化、碳酸根离子浓度提高、渗透胁迫、细胞膜渗透和泄漏,或者导致细胞破裂从而对细胞产生致死作用[60-63]。在Zhang等(2006)的工作中,对22种不同的营养微生物进行scCO2处理的实验显示,其中20种在特定的温度、压力和处理时间的组合作用下完全丧失活性[59]。在温度37 ℃、压力介于7.4–15 MPa时,细胞粘度和表面张力较低,scCO2可快速地渗透进入细胞,导致细胞内pH降低,蛋白质变性,酶活性受到抑制,从而发生细胞破裂、死亡[59, 62]。针对功能酶的研究亦显示scCO2导致微生物酶活性丧失的主要原因不仅源于在酶分子层面的破坏作用,更是由于scCO2和细胞膜及细胞壁的相互作用引起细胞膜通透性发生改变,导致尚未修饰的酶提前释放并伴随细胞酶活性的显著降低[61]。由于细胞膜的通透性和完整性对于微生物在scCO2作用下的活性至关重要,革兰氏阳性微生物由于细胞壁更厚,肽聚糖含量更高,渗透性相对较差,因此对scCO2的耐受性比革兰氏阴性菌更强[53, 57, 59]。
除营养细胞外,scCO2也能引起孢子的萌发率的降低。一系列以杆菌、嗜热脂肪芽孢杆菌以及梭状芽孢杆菌作为研究对象的工作显示在中温或高温条件下,scCO2作用在2–10 h内可以造成大部分芽孢完全致死,其他部分芽孢萌发率为未处理组的10–1至10–7,其降低程度受到温度、压力以及微生物种类的影响[59, 64-67]。其中Peet等(2015)对分离自CO2封存场地地下水的三株杆菌的芽孢进行scCO2处理相关工作显示,相比起对干孢子的直接处理引起的2周内丧失68%–88%孢子活性,在水溶液中的处理对孢子活性则没有明显的影响。造成这一差异的主要原因是scCO2的溶剂和脱水特性,使处于干燥状态下的孢子更容易受到scCO2脱水作用的破坏,并从失活的芽孢中释放吡啶二羧酸[66, 68]。这一发现对于地下注入CO2对环境生态系统的影响尤为重要。由于scCO2的密度小于水,在“救生圈作用”下向盖岩迁移的过程中可能造成环境条件的波动(如局部和暂时的失水状态)。因此,地下生态系统中的微生物孢子在scCO2作用下可能不会被完全灭活,当合适的环境条件得以恢复,孢子可能再次萌发并恢复其微生物活性[66]。
基于上述scCO2对微生物和芽孢生物活性影响的相关机理,迄今大多数以二氧化碳地质封存作为研究背景和纯培养微生物作为研究对象的工作均显示出scCO2对于微生物活性的负面影响。地下生态系统的代表性微生物(如希瓦氏菌、土芽孢杆菌、甲烷嗜热杆菌、脱硫弧菌和杆菌)和来自天然CO2富集热泉的耐CO2乳杆菌对scCO2表现出不同程度的响应,随着CO2分压的升高以及接触时间的增长,整体呈现存活率和生长活性显著降低甚至死亡的趋势[57, 62, 69]。在已报道的菌株实验中,从二氧化碳地质封存场地地下水分离和培养得到的杆菌菌株具有对CO2最佳的耐受能力。部分能形成孢子的杆菌菌株在和scCO2达到平衡的液体培养基中可存活2周以上[66]。其他菌株在低于10 MPa的CO2压力条件下,其活细胞数目和代谢活性在几小时内迅速降低,但是在同样的N2压力条件下,微生物活性没有明显变化,说明压力本身不是微生物失活的主要原因[53, 57, 62, 69]。
2.3 注入CO2对深地微生物群落影响和微生物响应分子机制 除了人为活动向深地生物圈注入的大量scCO2外,自然界也存在天然的scCO2富集环境(如富含CO2的陆地或海底热泉)[70-71]。早期的工作充分利用这些天然和工程环境体系研究CO2封存对深地生物圈微生物群落结构、微生物活性以及生物地球化学过程的影响,尤其是组学手段(宏基因组、宏转录组、宏蛋白组和宏代谢组)和生物信息学的快速发展使得对这些特殊生境的微生物研究突破了传统微生物培养的局限,为系统理解CO2封存对深地生态系统的影响以及由此引起的微生物-CO2-地下水-矿物之间的相互作用,更准确地预测scCO2注入后的状态和评估CO2长期储存的生态效应及可靠性提供了理论基础。
注入实验显示CO2对微生物群落和活性的影响与CO2的浓度、压力以及微生物-scCO2的接触时间具有紧密联系。在多个CO2封存场地或模拟封存场地的原位分析,以及采用富含有机质的煤炭-砂岩作为基质的模拟高压土柱实验都表明微生物群落对CO2具有高度敏感性,CO2注入在短时间内会造成微生物数量和群落多样性的显著降低,微生物结构亦发生显著变化[36, 41, 54, 72-74]。其变化程度与CO2分压具有紧密联系,分压越高对于微生物群落的短期负面效应越明显[36, 37]。但是,根据对CO2封存环境体系或模拟环境体系的长期观察表明,CO2对于原位微生物的负面影响并非不可逆。当CO2暴露时间延长,微生物群落的生物量、多样性或结构会逐步恢复[54, 73-76]。例如在冰岛热Hellisheidi地热电厂的二氧化碳地质封存项目对CO2注入前后地下以玄武岩为主的地下沉积物环境体系中的微生物响应进行了分析,结果显示由于CO2注入引起的pH降低和可溶性无机碳(DIC)浓度降低,微生物的多样性降低了2.5–4.0个数量级,在DIC浓度最高的时候处于微生物多样性的最低值。但是后期随着环境条件的改善和各种水化学参数逐渐恢复到接近CO2注入前的状态,微生物的多样性也得到恢复[54]。这一现象和其他原位以及模拟实验所观察到的现象有异曲同工之处。在德国Ketzin二氧化碳封存的深地咸水层注入scCO2后,荧光原位杂交(FISH)和分子指纹图谱均表明微生物群落受到注入二氧化碳的强烈影响,细胞数目降低三个数量级。但是,当scCO2储存5个月后,微生物种群的活性和数量逐渐增加[73-74]。此外,Shelton等(2018)在美国路易斯安纳州的Olla油田对9口油井的出水进行了采集,其中2口油井40年前曾一度通过CO2注入的方法进行强化采油(CO2-EOR),5口油井处于同一地层但是未经过CO2处理,其余2口油井处于较浅地层且没有经过CO2处理。通过对来自这些连续抽油井中微生物群落的分析,显示不同油井类型的微生物群落之间没有明显差别,其中和CO2浓度具有明显相关性的微生物生态型也没有显示出明显的CO2代谢潜力[76]。张凤君等(2019)开展的工作采用我国鄂尔多斯咸水层二氧化碳地质封存场地的岩芯和扩大培养的微生物在12 MPa的CO2压力条件下进行了90天的模拟实验,微生物群落分析也显示微生物数目先降低后升高的趋势,同时微生物群落组成发生了显著变化。这些工作都表明在尽管在scCO2作用下地下生态系统的环境会发生显著变化,造成对微生物群落的巨大影响;但是由于受scCO2和地下水、矿物、微生物的相互作用和其他物理过程(如溶解、扩散、迁移等)的影响,部分范围内scCO2对地球化学条件的长期效应可能会逐步减弱[54]。同时,微生物群落或部分微生物可能适应scCO2的胁迫环境条件,通过恢复(部分)生物活性或者对环境胁迫条件的选择性进化形成新的微生物优势菌群[54, 73-75]。
基于含高浓度CO2的自然和工程环境体系中的微生物群落宏基因组和转录组的分析显示部分微生物能够适应scCO2和低pH的胁迫作用,并通过不同的代谢机制建立起与环境因子的紧密联系,间接调控其生长和养分循环。Trias等(2017)观察到scCO2注入后,DIC浓度的增高和玄武岩中的有机物的溶解促进了自养和异养微生物的繁殖。其中自养型铁氧化菌得到富集,可同时固定CO2并利用编码铁氧化基因mtrA、mtoA等的外膜c型细胞色素等功能酶氧化Fe(Ⅱ)。在这一反应过程中,CO2的注入促进铁氧化菌所需要的无机碳源和Fe(Ⅱ)的生物可利用性。同时,部分富集微生物也可以通过发酵或降解芳香族有机物进行N2固定、无氧呼吸或硫氧化,从而实现C、N、S循环的耦联[54]。除了二氧化碳地质工程项目外,天然富集CO2或者scCO2胁迫环境下的微生物和其功能的多样性,在美国科罗拉多州McElmo Dome的莱德维尔构造的天然scCO2储层产出井和犹他州富含CO2的热泉(Crystal Geyser)均得到了证实[70-72]。尽管在不同的环境系统中功能微生物有所差别,但是这些工作都显示出微生物在CO2环境条件下转化CO2的重要作用。基于宏基因组解析发现微生物碳固定(如卡尔文循环、rTCA循环或Wood-Ljungdahl通路)在这些环境体系中都是重要的代谢通路。同时,部分微生物也可能利用碳酸酐酶将CO2转化为HCO3–,并在氨甲酰基-磷酸合成酶和磷酸烯醇丙酮酸羧化酶的作用下进行生物合成[70, 72]。与这两组工作所观察到的现象不同的是对日本Okinawa深渊中富含CO2 (scCO2或CO2水合物)的转录组研究并没有明确显示自养型微生物对CO2的利用,但是发现了高CO2浓度环境中厌氧嗜甲烷微生物和硫酸还原微生物的富集和活性,表明微生物对C1物质的代谢能力[71]。因此,深地生物圈中的微生物可以利用CO2作为自养代谢的底物,或者通过从地下有机质中提取其他含碳化合物作为营养物,甚至利用从溶解的矿物中释放具有氧化还原特征的物质来间接促进微生物的生长。
2.4 微生物对CO2封存环境胁迫的其他应对策略 在高浓度CO2的作用下,部分微生物的形态、细胞成分以及功能基因表达发生明显变化。除了希瓦氏菌在高压CO2胁迫作用下(5 MPa)发生细胞大小萎缩和明显裂解外[62],来源于高浓度CO2热泉的乳杆菌在1 MPa二氧化碳作用下,细胞个体变小,并显示出明显的荚膜物质的合成。同时,饱和脂肪酸含量增加,但是单不饱和脂肪酸含量降低[53, 55]。Wilkins等(2014)通过硫酸盐还原菌脱硫弧菌在高压CO2处理条件下的mRNA转录组分析表明部分氨基酸(如亮氨酸、异亮氨酸)合成基因、噬菌体休克蛋白、细胞间质Fe-氢化酶基因的表达上调。其中氨基酸合成基因的高表达可能是由于应激反应引起特定氨基酸的积累以缓解渗透胁迫的结果。这些氨基酸可能是其他缓冲蛋白或伴侣蛋白(如铁蛋白)的重要成分,但其在CO2应激反应中的潜在作用机理尚不清楚[69]。
通过实验手段进行的生物膜相关技术和理论的研究为了解深地微生物适应或耐受地质二氧化碳封存CO2胁迫作用的机理提供了可能。前期研究表明生物膜在scCO2环境中对微生物的生存能力具有一定的保护作用。这一现象反映了胞外聚合物(EPS)的抗传质性,可能与其具有丰富的表面积以及能够固化CO2或与其相互作用的大量官能团[77]的特征有关。因此,生物膜中的微生物比处于悬浮状态的细胞具有对scCO2环境更强的耐受力。EPS能承受高压,使微生物暴露在scCO2中的时间更长[78]。同时,在暴露于酸性水之后,微生物在多孔介质中仍然能够保持完整并改变流体传导性。例如,注入井周围的微生物生长会引起局部堵塞、腐蚀、油层变酸,导致注入速率的降低[69, 79]。但另一方面,生物膜的形成还可以起到堵塞小裂缝和孔隙的作用,阻止CO2向上迁移到含水层,而微生物增强的矿物质沉淀可能会加速CO2矿化的速率[77]。同时,基于模式微生物铜绿假单胞菌和沙门氏菌的研究显示EPS为微生物提供保护屏障,营养不足会使细胞从生物膜快速脱落。当微生物缺乏维生素、营养和能量来源时,时间越长,细胞更易分离,从而寻找新的微环境以满足这些需求。因此,为了长期维持屏障的完整性,可能需要不断向地下生物膜屏障提供足够的维生素、营养和能量来源的培养基,通过注入生长底物进行微生物复苏,这个过程可以产生凝聚的菌胶团,并产生大量的EPS,从而堵塞含水层的孔隙空间,使scCO2渗透率降低[77]。
除了微生物对于scCO2的主动应激反应和自我保护,天然矿物也能够缓解scCO2对微生物的胁迫作用,提高微生物在scCO2环境中的存活率[53, 57, 80]。矿物对于微生物的保护作用通过两个主要途径实现。其一,矿物为生物膜的形成提供表面位点,促进生物膜的形成。矿物表面形成的生物膜可以通过降低沉积物的可渗透性或者EPS作为保护屏障减缓环境压力(如高浓度CO2)对微生物的破坏[78, 81, 59](如上述讨论)。其二,在自然环境中常见的碳酸盐矿物或者其他富含Ca或Mg的矿物可以作为天然的缓冲剂减缓CO2注入对pH的强烈改变或者与碳酸根反应生成次生碳酸盐矿物[53, 55, 57]。
3 CO2封存条件下微生物调节CO2的转化 在CO2封存作用下的地下生态系统中微生物能够存活并保持其生物活性,不但对注入的scCO2稳定性具有重要作用,也是微生物驱动的各种物质和元素循环过程的维持与进行的重要前提。基于已知的微生物驱动的scCO2和深地生物圈中不同界面相互作用原理,微生物可能直接或间接影响CO2的几种主要的封存方式:(1)结构封存:微生物形成的生物膜对沉积物颗粒的孔隙进行堵塞,从而阻止scCO2的流动[78, 81-82];(2)残余封存:微生物分泌的表面活性剂对scCO2产生润湿作用,并在沉积物孔隙的毛细作用下将CO2限制在沉积物孔隙中[83];(3)矿物封存:微生物表面的活性基团为碳酸盐矿物的晶核形成提供表面位点,同时微生物作用可以促进矿物风化,细菌呼吸代谢产生的二氧化碳、有机酸等酸性代谢产物都能使其微环境中的pH降低呈酸性,促进矿物腐蚀风化[53], 为结合CO2形成新的碳酸盐矿物提供了必要的阳离子[84-87];(4)溶解封存:在高CO2分压条件下,微生物作用(如尿素分解、铁还原等)引起的pH值的上升促进CO2在液相的溶解[82, 88]。
3.1 微生物促进CO2固定 深地环境中的微生物群落可能促进碳酸盐矿物的沉淀,帮助CO2以固体的稳定形式封存在深地地质构造中。已知参与微生物诱导的碳酸盐矿物沉淀(MICP)的微生物类型包括硫酸盐还原菌、解脲菌、铁还原菌、硝酸盐还原菌、构巢曲霉等。这些微生物反应可能通过提高碱度(如pH值、CO32–、HCO3–)达到碳酸盐矿物沉淀的饱和度,从而促进CO2封存环境体系中的原位CO2固化[78, 81-82]。例如,解脲菌Sporosarcina pasteurii能够在很短的时间内生成大量的碳酸根,诱导CaCO3沉淀并降低地下环境的孔隙率,缓解CO2注入后的渗漏[78, 82];构巢曲霉的碳酸酐酶基因中canA参与了硅酸盐风化作用,并参与碳的迁移转化[81]。此外,微生物可能为碳酸盐矿物的形成提供更有利的微观环境。微生物表面带负电的官能团能够吸附阳离子,因此在代谢过程中能够驱动溶液的化学条件的改变,提高矿物的饱和状态并诱导晶核形成。此外,许多蛋白质、多糖、脂质也被证明能够通过降低沉淀的活化能提高CaCO3成核速率[89]。这些因子对于形成含铁碳酸盐(如菱铁矿)的情况也同样适用。例如在巴西里约热内瓦河水中(pH约3.5),虽然理论上达不到碳酸盐矿物沉淀的过饱和度,但是生物膜中富集的铁还原嗜酸微生物Acidiphilium sp. PM通过铁还原反应调节微环境的pH,其表面为形成菱铁矿(FeCO3)纳米晶核提供反应位点。因此,尽管酸性条件并没有达到形成碳酸盐矿物的饱和度,但是仍然为在微生物表面形成含铁碳酸盐的纳米颗粒晶核和次生矿物的生长提供了合适的微观环境[85]。Zeng和Tice(2004)也发现当溶液中存在Ca2+时,通过吸附或者细胞内氧化铁沉淀,使铁还原微生物表面局部Fe(Ⅱ)浓度降低,pH升高,形成热动力学不稳定的富含钙的菱铁矿微粒。这些菱铁矿微粒可以作为菱铁矿、方解石以及白云石的前体,为其提供成核和晶体生长的位点,形成天然沉积物中的碳酸盐[90]。因此,深地环境中的土著微生物或者通过接种能够促进CO2固化形成碳酸盐的功能微生物,能通过代谢过程形成碳酸盐矿物作为反应的副产物促进CO2的固化和稳定封存。
3.2 微生物催化CO2转化形成具有附加值的产物 由于自身的化学稳定性,二氧化碳地质中所固定的CO2本身并不具备很高的能源利用潜力和经济价值。但是,如果能够利用并提高微生物转化CO2生成高附加值产物的能力,在实现减少碳排放的同时能够把温室气体转化为具有经济效益的物质,二氧化碳地质在经济和能源层面将更具有吸引力[91]。目前,油田微生物CO2的原位转化作为这一领域的前沿研发方向,具有良好的发展潜力[56, 92-93]。二氧化碳地质项目中注入的CO2可能改变深地环境中的土著微生物群落和代谢途径[41, 56, 71],因此也可能改变CO2最终的分布和赋存形式。在自养微生物利用CO2生长的过程中,生物酶的催化作用可以将CO2转化为一系列的有机物质,包含C1-C5短链脂肪酸(如甲酸、乙酸、乳酸)、醇(如乙醇、丁醇、丁二醇)、酮类(如丙酮)和甲烷等[91]。微生物转化CO2的活性受到众多环境因子(如温度、压力、pH、电子供体和电子受体浓度、营养物质和代谢物浓度和扩散速度)的影响,尽管CO2封存对于微生物活性、群落多样性和结构的负面影响已有多个研究报道,但是部分工作仍然显示少数微生物在富集CO2条件下仍然可以保持生物活性[40, 71],表明实现这一生物转化反应的潜力。
高温油田可以作为天然的“原位生物反应器”,在CO2生物转化为有经济价值的产物的过程中发挥重要作用[92-93]。其中,天然气(甲烷,CH4)是目前所有环境中最清洁的碳氢化合物能源,具有高能量转化率和发电效率,因此是目前CCSU最受关注的潜在转化产物。为了充分发挥油田作为“生物反应器”的功能,微生物群落是否能够适应高浓度甚至超临界状态的CO2并且将其转化为高附加值的产物是能否实现有效生物转化的关键[91]。目前产生甲烷的石油微生物主要包括氢气营养型(公式5)和乙酸营养型(公式6)[92, 94]。
 | 公式(5) |
 | 公式(6) |
4 结论和展望 二氧化碳捕获与封存技术是降低温室气体排放、实现长期封存的重要可行性方法之一。作为CCS中CO2的储藏地,深地地质环境与所注入的CO2有诸多方面的相互作用。对于深地微生物,注入的CO2直接影响和改变微生物群落结构的平衡、活性微生物种类、代谢活性、代谢潜力等,而深地微生物也可反作用于CO2的迁移、转化和赋存形态。CO2地质封存与深地生物圈的紧密联系和相互作用涉及微生物-CO2-水-矿物的多界面反应。微生物在生长代谢过程中产生的次生矿物,可以有效促进CO2的固化和封存稳定性。深地微生物可能通过促进碳酸盐矿物的沉淀,例如通过提高碱度达到碳酸盐矿物沉淀的饱和度,从而促进CO2以固体的稳定形式封存在深地环境中,也可能通过在微生物表面提供反应位点诱导晶核形成,为碳酸盐矿物的形成提供更有利的微观环境。此外,微生物对CO2封存进行环境监测和泄漏治理可能也具有重要的意义。由于微生物细胞与环境的直接接触性以及微生物对其反应的多样性和敏感性,受到CO2封存影响的微生物可能环境条件的变化作出迅速的反应,并且能够通过不同方式转化CO2,并引起功能群落或者CO2固定相关功能基因组成和丰度的改变。因此深地微生物也可以作为生物监测CO2地质封存与预防泄漏问题的理想的指示生物。与此同时,利用并提高微生物催化CO2转化生成高附加值产物,是有效减少碳排放的同时产生具有经济效益的物质的有益尝试。目前甲烷作为清洁和高效的碳氢化合物能源,是CO2地质封存中最受关注的潜在转化产物。然而,微生物群落能否适应高浓度甚至scCO2并且将其转化为高附加值产物,以及是能否实现有效生物转化是这一技术的关键,其中涉及的一系列科学问题值得进一步的工作研究和探讨。
致谢
感谢中国地质大学(武汉)石良和美国伊利诺伊州地质调查局邵洪波在本文写作过程中参与的深入讨论,以及给予的悉心指导和修改意见。
References
| [1] | NETL. Carbon sequestration atlas. 2015: 114 |
| [2] | NETL. Carbon sequestration technology roadmap and program plan. US Department of Energy, 2007. |
| [3] | National Energy Technology Laboratory. The United States 2012 Carbon Utilization and Storage Atlas. 4th Edition. Search Report, 2012: 130. |
| [4] | Bachu S. CO2 storage in geological media: Role, means, status and barriers to deployment. Progress in Energy and Combustion Science, 2008, 34(2): 254-273. DOI:10.1016/j.pecs.2007.10.001 |
| [5] | Budisa N, Schulze-Makuch D. Supercritical carbon dioxide and its potential as a life-sustaining solvent in a planetary environment. Life: Basel, Switzerland, 2014, 4(3): 331-340. |
| [6] | Data Series OGP. International association of oil & gas producers, 2013(2012): 1-4. |
| [7] | Zhang HX, Li XC, Wei N. The major technology track and analysis about carbon dioxide capture and storage. Advances in Earth Science, 2010, 25(3): 335-340. (in Chinese) 张鸿翔, 李小春, 魏宁. 二氧化碳捕获与封存的主要技术环节与问题分析. 地球科学进展, 2010, 25(3): 335-340. |
| [8] | Melzer LS. Carbon dioxide enhanced oil recovery (CO2 EOR): Factors involved in adding carbon capture, utilization and storage (CCUS) to enhanced oil recovery. Center for Climate and Energy Solutions, 2012: 1-17. |
| [9] | Warwick PD, Attanasi ED, Blondes MS, Brennan ST, Buursink ML, Doolan CA. Carbon dioxide-enhanced oil recovery and residual oil zone studies at the U.S. Geological Survey. 14th Greenhouse Gas Control Technologies Conference (GHGT-14), Melbourne, 21-26 October 2018. |
| [10] | Heidug W, Lipponen J, McCoy S, Benoit P. Storing CO2 through enhanced oil recovery. France: International Energy Agency, 2015: 46. |
| [11] | Crameik T, Plassey J. Carbon dioxide injection project Sacroc unit, Scurry County, API Annual Meeting, Division of Production, Houston, Texas, March 6-8, 1972. |
| [12] | Smyth RC, Hovorka SD, Lu JM, Romanak KD, Partin JW, Wong C, Yang CB. Assessing risk to fresh water resources from long term CO2 injection-laboratory and field studies. Energy Procedia, 2009, 1(1): 1957-1964. DOI:10.1016/j.egypro.2009.01.255 |
| [13] | Kuuskraa V, Wallace M. CO2-EOR set for growth as new CO2 supplies emerge. Oil and Gas Journal, 2014, 112(4): 92-105. |
| [14] | Sacuta N, Daly D, Botnen B, Worth K. Communicating about the geological storage of carbon dioxide-comparing public outreach for CO2 EOR and saline storage projects. Energy Procedia, 2017, 114: 7245-7259. DOI:10.1016/j.egypro.2017.03.1855 |
| [15] | Bui M, Adjiman CS, Bardow A, Anthony EJ, Boston A, Brown S, Fennell PS, Fuss S, Galindo A, Hackett LA, Hallett JP, Herzog HJ, Jackson G, Kemper J, Krevor S, Maitland GC, Matuszewski M, Metcalfe IS, Petit C, Puxty G, Reimer J, Reiner DM, Rubin ES, Scott SA, Shah N, Smit B, Trusler JPM, Webley P, Wilcox J, Mac Dowell N. Carbon capture and storage (CCS): the way forward. Energy & Environmental Science, 2018, 11(5): 1062-1176. |
| [16] | Carman CH, Blakley CS, Korose CP, Zimmerman J, Zaccheo S. Application of emerging monitoring techniques at the Illinois Basin-Decatur Project. International Journal of Greenhouse Gas Control, 2020, 103. |
| [17] | NETL. Safe geologic storage of captured carbon dioxide: two decades of DOE's carbon storage R&D program in review. 2020. |
| [18] | Takuya H, Shinya K, Masayuki I, Tatsuya T, Daisuke S, Shimpei K. MHI's commercial experiences with CO2 capture and recent R&D activities. Mitsubishi Heavy Industries Technical Review, 2018, 5(1): 31-37. |
| [19] | Nediljka GM, Karolina NM, Matej M. Carbon Capture and Storage (CCS): Technology, projects and monitoring review. The Mining-Geology-Petroleum Engineering Bulletin, 2018: 1-15. |
| [20] | Jin HG, Wood A, Salle A. Roadmap for carbon capture and storage demonstration and deployment. Asian Development Bank, 2015: 1-68. (in Chinese) 金红光, 安东尼伍德, 安妮卡赛乐尔. 中国碳捕集与封存示范和推广路线图研究. 亚洲开发银行, 2015: 1-68. |
| [21] | 中华人民共和国国务院. 国家中长期科学和技术发展规划纲要(2006-2020). 科技法律法规与政策选编(1985-2008年) (上册), 2005: 36-61. |
| [22] | 中华人民共和国科学技术部, 国家发展改革委, 外交部, 教育部, 财政部, 国家环保总局. 中国应对气候变化科技专项行动, 2007: 18. |
| [23] | 中华人民共和国科学技术部. 国家"十二五"科学和技术发展规划, 2011. |
| [24] | 中华人民共和国科学技术部社会发展科技司, 科学技术部国际合作司, 中国21世纪议程管理中心. 中国碳捕集、利用与封存(CCUS)技术进展报告, 2011: 46. |
| [25] | 蒋兰兰, 宋永臣, 赵越超. 二氧化碳封存和资源化利用研究进展. 能源与环境, 2010(3): 71-72, 78. DOI:10.3969/j.issn.1672-9064.2010.03.031 |
| [26] | 李琦, 陈征澳, 张九天, 李小春, 张贤. 中国CCUS技术路线图未来版的(更新)启示——基于世界CCS路线图透视的分析. 低碳世界, 2014(13): 7-8. |
| [27] | Huang B, Xu SS, Gao SW, Liu LB, Tao JY, Niu HW, Cai M, Cheng J. Industrial test of CO2 capture in Huaneng Beijing coal-fired power station. Proceedings of the CSEE, 2009, 29(17): 14-20. (in Chinese) 黄斌, 许世森, 郜时旺, 刘练波, 陶继业, 牛红伟, 蔡铭, 程健. 华能北京热电厂CO2捕集工业试验研究. 中国电机工程学报, 2009, 29(17): 14-20. DOI:10.3321/j.issn:0258-8013.2009.17.003 |
| [28] | Mi JF, Ma XF. Development trend analysis of carbon capture, utilization and storage technology in China. Proceedings of the CSEE, 2019, 39(9): 2537-2544. (in Chinese) 米剑锋, 马晓芳. 中国CCUS技术发展趋势分析. 中国电机工程学报, 2019, 39(9): 2537-2544. |
| [29] | Edwards KJ, Becker K, Colwell F. The deep, dark energy biosphere: intraterrestrial life on earth. Annual Review of Earth and Planetary Sciences, 2012, 40(1): 551-568. DOI:10.1146/annurev-earth-042711-105500 |
| [30] | 殷鸿福. 中国深部地下生物圈亟待研究. 科学通报, 2018, 63(36): 3883-3884. |
| [31] | Wang FP, Chen YR. Progress and prospect in deep biosphere investigation. Advances in Earth Science, 2017, 32(12): 1277-1286. (in Chinese) 王风平, 陈云如. 深部生物圈研究进展与展望. 地球科学进展, 2017, 32(12): 1277-1286. DOI:10.11867/j.issn.1001-8166.2017.12.1277 |
| [32] | Dong YR, Sanford RA, Boyanov MI, Kemner KM, Flynn TM, O'Loughlin EJ, Chang YJ, Locke RA, Weber JR, Egan SM, Mackie RI, Cann I, Fouke BW. Orenia metallireducens sp. nov. strain Z6, a novel metal-reducing member of the Phylum Firmicutes from the deep subsurface. Applied and Environmental Microbiology, 2016, 82(21): 6440-6453. DOI:10.1128/AEM.02382-16 |
| [33] | Magnabosco C, Lin L-H, Dong H, Bomberg M, Ghiorse W, Stan-Lotter H, Pedersen K, Kieft TL, van Heerden E, Onstott TC. The biomass and biodiversity of the continental subsurface. Nature Geoscience, 2018, 11(10): 707-717. DOI:10.1038/s41561-018-0221-6 |
| [34] | Jiang YG, Shi L. The impacts of human activity on the microorganisms in deep subsurface. Chinese Science Bulletin, 2018, 63(36): 3920-3931. (in Chinese) 蒋永光, 石良. 人类活动对深地微生物的影响. 科学通报, 2018, 63(36): 3920-3931. |
| [35] | Dong HL. Recent developments and future directions of deep biosphere research. Chinese Science Bulletin, 2018, 63(36): 3885-3901. (in Chinese) 董海良. 深地生物圈的最新研究进展以及发展趋势. 科学通报, 2018, 63(36): 3885-3901. |
| [36] | Dong YR, Sanford RA, Locke RA, Cann IK, Mackie RI, Fouke BW. Fe-oxide grain coatings support bacterial Fe-reducing metabolisms in 1.7-2.0 km-deep subsurface quartz arenite sandstone reservoirs of the Illinois Basin (USA). Frontiers in Microbiology, 2014, 5: 511. DOI:10.3389/fmicb.2014.00511 |
| [37] | Gulliver DM, Lowry GV, Gregory KB. Effect of CO2(aq) exposure on a freshwater aquifer microbial community from simulated geologic carbon storage leakage. Environmental Science & Technology Letters, 2014, 1(12): 479-483. |
| [38] | Gulliver DM, Lowry GV, Gregory KB. Comparative study of effects of CO2 Concentration and pH on microbial communities from a saline aquifer, a depleted oil reservoir, and a freshwater aquifer. Environmental Engineering Science, 2016, 33(10): 806-816. DOI:10.1089/ees.2015.0368 |
| [39] | Dong YR, Kumar CG, Chia N, Kim PJ, Miller PA, Price ND, Cann IKO, Flynn TM, Sanford RA, Krapac IG, Locke RA II, Hong PY, Tamaki H, Liu WT, Mackie RI, Hernandez AG, Wright CL, Mikel MA, Walker JL, Sivaguru M, Fried G, Yannarell AC, Fouke BW. Halomonas sulfidaeris-dominated microbial community inhabits a 1.8 km-deep subsurface Cambrian Sandstone reservoir. Environmental Microbiology, 2014, 16(6): 1695-1708. DOI:10.1111/1462-2920.12325 |
| [40] | Mu A, Moreau JW. The geomicrobiology of CO2 geosequestration: a focused review on prokaryotic community responses to field-scale CO2 injection. Frontiers in Microbiology, 2015, 6: 263. DOI:10.3389/fmicb.2015.00263 |
| [41] | Kirk MF. Variation in energy available to populations of subsurface anaerobes in response to geological carbon storage. Environmental Science & Technology, 2011, 45(15): 6676-6682. |
| [42] | Chapelle FH, O'Neill K, Bradley PM, Methé BA, Ciufo SA, Knobel LL, Lovley DR. A hydrogen-based subsurface microbial community dominated by methanogens. Nature, 2002, 415(6869): 312-315. DOI:10.1038/415312a |
| [43] | Shao HB, Thompson CJ, Qafoku O, Cantrell KJ. In situ spectrophotometric determination of pH under geologic CO2 sequestration conditions: method development and application. Environmental Science & Technology, 2013, 47(1): 63-70. |
| [44] | Altevogt AS, Jaffe PR. Modeling the effects of gas phase CO2 intrusion on the biogeochemistry of variably saturated soils. Water Resources Research, 2005, 41(9): W09426. |
| [45] | Little MG, Jackson RB. Potential impacts of leakage from deep CO2 geosequestration on overlying freshwater aquifers. Environmental Science & Technology, 2010, 44(23): 9225-9232. |
| [46] | Duan ZH, Sun R. An improved model calculating CO2 solubility in pure water and aqueous NaCl solutions from 273 to 533 K and from 0 to 2000 bar. Chemical Geology, 2003, 193(3/4): 257-271. |
| [47] | Spycher N, Pruess K. CO2-H2O mixtures in the geological sequestration of CO2. Ⅱ. Partitioning in chloride brines at 12-100℃ and up to 600 bar. Geochimica et Cosmochimica Acta, 2005, 69(13): 3309-3320. DOI:10.1016/j.gca.2005.01.015 |
| [48] | Harvey OR, Qafoku NP, Cantrell KJ, Lee G, Amonette JE, Brown CF. Geochemical implications of gas leakage associated with geologic CO2 storage-a qualitative review. Environmental Science & Technology, 2013, 47(1): 23-36. |
| [49] | Kharaka YK, Cole DR, Hovorka SD, Gunter WD, Knauss KG, Freifeld BM. Gas-water-rock interactions in Frio Formation following CO2 injection: Implications for the storage of greenhouse gases in sedimentary basins. Geology, 2006, 34(7): 577. DOI:10.1130/G22357.1 |
| [50] | Dong YR, Sanford RA, Boyanov MI, Flynn TM, O'Loughlin EJ, Kemner KM, George S, Fouke KE, Li SY, Huang DM, Li SZ, Fouke BW. Controls on iron reduction and biomineralization over broad environmental conditions as suggested by the Firmicutes Orenia metallireducens strain Z6. Environmental Science & Technology, 2020, 54(16): 10128-10140. |
| [51] | Shao HB, Ray JR, Jun YS. Dissolution and precipitation of clay minerals under geologic CO2 sequestration conditions: CO2-brine-phlogopite interactions. Environmental Science & Technology, 2010, 44(15): 5999-6005. |
| [52] | Shao HB, Kukkadapu RK, Krogstad EJ, Newburn MK, Cantrell KJ. Mobilization of metals from Eau Claire siltstone and the impact of oxygen under geological carbon dioxide sequestration conditions. Geochimica et Cosmochimica Acta, 2014, 141: 62-82. DOI:10.1016/j.gca.2014.06.011 |
| [53] | Santillan EU, Kirk MF, Altman SJ, Bennett PC. Mineral influence on microbial survival during carbon sequestration. Geomicrobiology Journal, 2013, 30(7): 578-592. DOI:10.1080/01490451.2013.767396 |
| [54] | Trias R, Ménez B, le Campion P, Zivanovic Y, Lecourt L, Lecoeuvre A, Schmitt-Kopplin P, Uhl J, Gislason SR, Alfreesson HA, Mesfin KG, Sn?bj?rnsdóttir Só, Aradóttir ES, Gunnarsson I, Matter JM, Stute M, Oelkers EH, Gérard E. High reactivity of deep biota under anthropogenic CO2 injection into basalt. Nature Communications, 2017, 8: 1063. DOI:10.1038/s41467-017-01288-8 |
| [55] | Kirk MF, Santillan EFU, Sanford RA, Altman SJ. CO2-induced shift in microbial activity affects carbon trapping and water quality in anoxic bioreactors. Geochimica et Cosmochimica Acta, 2013, 122: 198-208. DOI:10.1016/j.gca.2013.08.018 |
| [56] | Mayumi D, Dolfing J, Sakata S, Maeda H, Miyagawa Y, Ikarashi M, Tamaki H, Takeuchi M, Nakatsu CH, Kamagata Y. Carbon dioxide concentration dictates alternative methanogenic pathways in oil reservoirs. Nature Communications, 2013, 4: 1998. DOI:10.1038/ncomms2998 |
| [57] | Kirk MF, Altman SJ, Santillan EFU, Bennett PC. Interplay between microorganisms and geochemistry in geological carbon storage. International Journal of Greenhouse Gas Control, 2016, 47: 386-395. DOI:10.1016/j.ijggc.2016.01.041 |
| [58] | Kirk MF, Jin QS, Haller BR. Broad-scale evidence that pH influences the balance between microbial iron and sulfate reduction. Groundwater, 2016, 54(3): 406-413. DOI:10.1111/gwat.12364 |
| [59] | Zhang J, Davis TA, Matthews MA, Drews MJ, LaBerge M, An YH. Sterilization using high-pressure carbon dioxide. The Journal of Supercritical Fluids, 2006, 38(3): 354-372. DOI:10.1016/j.supflu.2005.05.005 |
| [60] | Dillow AK, Dehghani F, Hrkach JS, Foster NR, Langer R. Bacterial inactivation by using near- and supercritical carbon dioxide. Proceedings of the National Academy of Sciences, 1999, 96(18): 10344-10348. DOI:10.1073/pnas.96.18.10344 |
| [61] | Bertoloni G, Bertucco A, De Cian V, Parton T. A study on the inactivation of micro-organisms and enzymes by high pressure CO2. Biotechnology and Bioengineering, 2006, 95(1): 155-160. DOI:10.1002/bit.21006 |
| [62] | Wu B, Shao HB, Wang ZP, Hu YD, Tang YJ, Jun YS. Viability and metal reduction of Shewanella oneidensis MR-1 under CO2 stress: implications for ecological effects of CO2 leakage from geologic CO2 sequestration. Environmental Science & Technology, 2010, 44(23): 9213-9218. |
| [63] | Hong SI, Pyun YR. Inactivation kinetics of Lactobacillus plantarum by high pressure carbon dioxide. Journal of Food Science, 1999, 64(4): 728-733. DOI:10.1111/j.1365-2621.1999.tb15120.x |
| [64] | Frerichs J, Rakoczy J, Ostertag-Henning C, Krüger M. Viability and adaptation potential of indigenous microorganisms from natural gas field fluids in high pressure incubations with supercritical CO2. Environmental Science & Technology, 2014, 48(2): 1306-1314. |
| [65] | Ishikawa H, Shimoda M, Tamaya K, Yonekura A, Kawano T, Osajima Y. Inactivation of Bacillus spores by the supercritical carbon dioxide micro-bubble method. Bioscience, Biotechnology, and Biochemistry, 1997, 61(6): 1022-1023. DOI:10.1271/bbb.61.1022 |
| [66] | Peet KC, Freedman AJE, Hernandez HH, Britto V, Boreham C, Ajo-Franklin JB, Thompson JR. Microbial growth under supercritical CO2. Applied and Environmental Microbiology, 2015, 81(8): 2881-2892. DOI:10.1128/AEM.03162-14 |
| [67] | Watanabe T, Furukawa S, Hirata J, Koyama T, Ogihara H, Yamasaki M. Inactivation of Geobacillus stearothermophilus spores by high-pressure carbon dioxide treatment. Applied and Environmental Microbiology, 2003, 69(12): 7124-7129. DOI:10.1128/AEM.69.12.7124-7129.2003 |
| [68] | Setlow B, Korza G, Blatt KMS, Fey JP, Setlow P. Mechanism of Bacillus subtilis spore inactivation by and resistance to supercritical CO2 plus peracetic acid. Journal of Applied Microbiology, 2016, 120(1): 57-69. DOI:10.1111/jam.12995 |
| [69] | Wilkins MJ, Hoyt DW, Marshall MJ, Alderson PA, Plymale AE, Markillie LM, Tucker AE, Walter ED, Linggi BE, Dohnalkova AC, Taylor RC. CO2 exposure at pressure impacts metabolism and stress responses in the model sulfate-reducing bacterium Desulfovibrio vulgaris strain Hildenborough. Frontiers in Microbiology, 2014, 5: 507. |
| [70] | Probst AJ, Castelle CJ, Singh A, Brown CT, Anantharaman K, Sharon I, Hug LA, Burstein D, Emerson JB, Thomas BC, Banfield JF. Genomic resolution of a cold subsurface aquifer community provides metabolic insights for novel microbes adapted to high CO2 concentrations. Environmental Microbiology, 2017, 19(2): 459-474. DOI:10.1111/1462-2920.13362 |
| [71] | Yanagawa K, Morono Y, de Beer D, Haeckel M, Sunamura M, Futagami T, Hoshino T, Terada T, Nakamura KI, Urabe T, Rehder G, Boetius A, Inagaki F. Metabolically active microbial communities in marine sediment under high-CO(2) and low-pH extremes. The ISME Journal, 2013, 7(3): 555-567. DOI:10.1038/ismej.2012.124 |
| [72] | Freedman AJE, Tan B, Thompson JR. Microbial potential for carbon and nutrient cycling in a geogenic supercritical carbon dioxide reservoir. Environmental Microbiology, 2017, 19(6): 2228-2245. DOI:10.1111/1462-2920.13706 |
| [73] | Morozova D, Zettlitzer M, Let D, Würdemann H. Monitoring of the microbial community composition in deep subsurface saline aquifers during CO2 storage in Ketzin, Germany. Energy Procedia, 2011, 4: 4362-4370. DOI:10.1016/j.egypro.2011.02.388 |
| [74] | Morozova D, Zettlitzer M, Vieth A, Würdemann H. CO2SINK Group, Microbial monitoring during CO2 storage in deep subsurface saline aquifers in Ketzin, Germany. Energy Procedia, 2011: 4362-4370. |
| [75] | Zhang FJ, Song YP, Zhong S, Fan K, Li CY, Zhang ZY. Impact of microorganisms on the mineral interaction in scCO2-saline-sandstone system. China Environmental Science, 2019, 39(1): 281-289. (in Chinese) 张凤君, 宋云鹏, 钟爽, 樊凯, 李晨阳, 张志勇. 微生物对scCO2-咸水-砂岩体系中矿物反应的影响. 中国环境科学, 2019, 39(1): 281-289. DOI:10.3969/j.issn.1000-6923.2019.01.032 |
| [76] | Shelton JL, Andrews RS, Akob DM, DeVera CA, Mumford A, McCray JE, McIntosh JC. Microbial community composition of a hydrocarbon reservoir 40 years after a CO2 enhanced oil recovery flood. FEMS Microbiology Ecology, 2018, 94(10): fiy153. |
| [77] | Wilkins MJ, Daly RA, Mouser PJ, Trexler R, Sharma S, Cole DR, Wrighton KC, Biddle JF, Denis EH, Fredrickson JK, Kieft TL, Onstott TC, Peterson L, Pfiffner SM, Phelps TJ, Schrenk MO. Trends and future challenges in sampling the deep terrestrial biosphere. Frontiers in Microbiology, 2014, 5: 481. |
| [78] | Mitchell AC, Phillips AJ, Hamilton MA, Gerlach R, Hollis WK, Kaszuba JP, Cunningham AB. Resilience of planktonic and biofilm cultures to supercritical CO2. The Journal of Supercritical Fluids, 2008, 47(2): 318-325. DOI:10.1016/j.supflu.2008.07.005 |
| [79] | Mitchell AC, Phillips AJ, Hiebert R, Gerlach R, Spangler LH, Cunningham AB. Biofilm enhanced geologic sequestration of supercritical CO2. International Journal of Greenhouse Gas Control, 2009, 3(1): 90-99. DOI:10.1016/j.ijggc.2008.05.002 |
| [80] | Wu WF, Wang FP, Li JH, Yang XW, Xiao X, Pan YX. Iron reduction and mineralization of deep-sea iron reducing bacterium Shewanella piezotolerans WP3 at elevated hydrostatic pressures. Geobiology, 2013, 11(6): 593-601. |
| [81] | Sun QB, Lian B. The different roles of Aspergillus nidulans carbonic anhydrases in wollastonite weathering accompanied by carbonation. Geochimica et Cosmochimica Acta, 2019, 244: 437-450. DOI:10.1016/j.gca.2018.10.022 |
| [82] | Mitchell AC, Dideriksen K, Spangler LH, Cunningham AB, Gerlach R. Microbially enhanced carbon capture and storage by mineral-trapping and solubility-trapping. Environmental Science & Technology, 2010, 44(13): 5270-5276. |
| [83] | Jenneman GE, McInerney MJ, Knapp RM, Clark JB, Menzie DE. A halotolerant, biosurfactant-producing Bacillus species potentially useful for enhanced oil recovery, 39th General Meeting of the Society for Industrial Microbiology, St. Paul, MN, USA, 14 Aug 1982. |
| [84] | McMahon PB, Chapelle FH. Microbial production of organic acids in aquitard sediments and its role in aquifer geochemistry. Nature, 1991, 349(6306): 233-235. DOI:10.1038/349233a0 |
| [85] | Sánchez-Román M, Fernández-Remolar D, Amils R, Sánchez-Navas A, Schmid T, San Martin-Uriz P, Rodríguez N, McKenzie JA, Vasconcelos C. Microbial mediated formation of Fe-carbonate minerals under extreme acidic conditions. Scientific Reports, 2014, 4: 4767. |
| [86] | Dong YR, Sanford RA, Inskeep WP, Srivastava V, Bulone V, Fields CJ, Yau PM, Sivaguru M, Ahrén D, Fouke KW, Weber J, Werth CR, Cann IK, Keating KM, Khetani RS, Hernandez AG, Wright C, Band M, Imai BS, Fried GA, Fouke BW. Physiology, metabolism, and fossilization of hot-spring filamentous microbial mats. Astrobiology, 2019, 19(12): 1442-1458. DOI:10.1089/ast.2018.1965 |
| [87] | Power IM, Dipple GM, Southam G. Bioleaching of ultramafic tailings by Acidithiobacillus spp. for CO2 sequestration. Environmental Science & Technology, 2010, 44(1): 456-462. |
| [88] | Dong YR, Sanford RA, Chang YJ, McInerney MJ, Fouke BW. Hematite reduction buffers acid generation and enhances nutrient uptake by a fermentative iron reducing bacterium, Orenia metallireducens strain Z6. Environmental Science & Technology, 2017, 51(1): 232-242. |
| [89] | Talham DR. Biomineralization: Principles and Concepts in Bioinorganic Materials Chemistry, ed. Mann S., Oxford University Press, New York, 2001. |
| [90] | Zeng Z, Tice MM. Promotion and nucleation of carbonate precipitation during microbial iron reduction. Geobiology, 2014, 12(4): 362-371. DOI:10.1111/gbi.12090 |
| [91] | Hicks N, Vik U, Taylor P, Ladoukakis E, Park J, Kolisis F, Jakobsen KS. Using prokaryotes for carbon capture storage. Trends in Biotechnology, 2017, 35(1): 22-32. DOI:10.1016/j.tibtech.2016.06.011 |
| [92] | Liu JF, Sun XB, Yang GC, Mbadinga SM, Gu JD, Mu BZ. Analysis of microbial communities in the oil reservoir subjected to CO2-flooding by using functional genes as molecular biomarkers for microbial CO2 sequestration. Frontiers in Microbiology, 2015, 6: 236. |
| [93] | Yang GC, Zhou L, Mbadinga SM, Liu JF, Yang SZ, Gu JD, Mu BZ. Formate-dependent microbial conversion of CO2 and the dominant pathways of methanogenesis in production water of high-temperature oil reservoirs amended with bicarbonate. Frontiers in Microbiology, 2016, 7: 365. |
| [94] | Mach V, Blaser MB, Claus P, Chaudhary PP, Rulík M. Methane production potentials, pathways, and communities of methanogens in vertical sediment profiles of river Sitka. Frontiers in Microbiology, 2015, 6: 506. |
| [95] | Berdugo-Clavijo C, Gieg LM. Conversion of crude oil to methane by a microbial consortium enriched from oil reservoir production waters. Frontiers in Microbiology, 2014, 5: 197. |
| [96] | Kiet?v?inen R. The origin, source, and cycling of methane in deep crystalline rock biosphere. Frontiers in Microbiology, 2015, 6: 725. DOI:10.3389/fmicb.2015.00725 |
| [97] | Chivian D, Brodie EL, Alm EJ, Culley DE, Dehal PS, DeSantis TZ, Gihring TM, Lapidus A, Lin LH, Lowry SR, Moser DP, Richardson PM, Southam G, Wanger G, Pratt LM, Andersen GL, Hazen TC, Brockman FJ, Arkin AP, Onstott TC. Environmental genomics reveals a single-species ecosystem deep within Earth. Science, 2008, 322(5899): 275-278. DOI:10.1126/science.1155495 |
| [98] | Sleep NH, Meibom A, Fridriksson T, Coleman RG, Bird DK. H2-rich fluids from serpentinization: geochemical and biotic implications. Proceedings of the National Academy of Sciences, 2004, 101(35): 12818-12823. DOI:10.1073/pnas.0405289101 |
| [99] | Berg IA. Ecological aspects of the distribution of different autotrophic CO2 fixation pathways. Applied and Environmental Microbiology, 2011, 77(6): 1925-1936. DOI:10.1128/AEM.02473-10 |
| [100] | Magot M, Ollivier B, Patel BK. Microbiology of petroleum reservoirs. Antonie Van Leeuwenhoek, 2000, 77(2): 103-116. DOI:10.1023/A:1002434330514 |
