张婧琳1, 胡然2, 靳增军3, 杜文斌2

 , 梁宇红1,4
, 梁宇红1,4

1. 北京大学口腔医学院牙体牙髓科, 北京 100081;
2. 中国科学院微生物研究所, 微生物资源前期开发国家重点实验室, 北京 100101;
3. 河北工程大学医学院, 河北 邯郸 056002;
4. 北京大学国际医院口腔科, 北京 102206
收稿日期:2020-06-03;修回日期:2020-07-25;网络出版日期:2020-12-11
基金项目:国家自然科学基金(91951103,21822408);中国科学院重点部署项目(KFZD-SW-219-4)
*通信作者:杜文斌, E-mail: wenbin@im.ac.cn;
梁宇红, E-mail: leungyuhong@sina.com.
摘要:口腔是人体最重要的微生物储藏库之一,这些微生物通常以生物被膜的形式稳定地黏附于口腔内粘膜及牙齿表面,在病理条件下则可以深入髓腔及牙槽骨内,成为龋病、根尖周炎、牙周病等常见口腔疾病的主要病因,甚至与许多全身性疾病密切相关。在人类口腔微生态系统中,微生物种类繁多,生物被膜的构成及相互作用关系复杂,目前对其认识还十分有限;此外,在宿主免疫、口腔内外多种理化因素的调控下,生物被膜还可以出现不同的表型及生物特性,因此对其致病机制的研究也具有挑战性。微流控技术作为一种能够灵活操控微尺度流体的技术,不仅能够精准模拟理化微环境,还能够进行高通量可视化的分析,在生命分析化学及生物被膜的研究方面已经展现出显著优势,在口腔微生态系统研究中具有广阔的应用前景。本文将回顾近期微流控技术在生物被膜方面的研究进展,并结合口腔微生态系统中生物被膜研究的关键问题对微流控技术的应用做系统阐述和展望。
关键词:微流控技术生物被膜口腔微生物组口腔微生态
Microfluidics in biofilm and oral microecosystem
Jinglin Zhang1, Ran Hu2, Zengjun Jin3, Wenbin Du2

 , Yuhong Liang1,4
, Yuhong Liang1,4

1. Department of Cariology and Endodontology, Peking University School and Hospital of Stomatology, Beijing 100081, China;
2. State Key Laboratory of Microbial Resources, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China;
3. School of Medicine, Hebei University of Engineering, Handan 056002, Hebei Province, China;
4. Department of Stomatology, Peking University International Hospital, Beijing 102206, China
Received: 3 June 2020; Revised: 25 July 2020; Published online: 11 December 2020
*Corresponding author: Wenbin Du, E-mail: wenbin@im.ac.cn;
Yuhong Liang, E-mail: leungyuhong@sina.com.
Foundation item: Supported by the National Natural Science Foundation of China (91951103, 21822408) and by the Key Research Program of the Chinese Academy of Sciences (KFZD-SW-219-4)
Abstract: Oral cavity harbors human oral microecosystem, one of the largest microbial reservoirs in the human body. The oral microorganisms usually stably adhere to the surfaces of oral mucosa and teeth in the form of biofilm, and the composition and interaction of biofilms are complicated. Under pathological conditions, microbes can penetrate the pulp cavity and alveolar bone to cause common oral infectious diseases such as dental caries, periapical periodontitis, periodontitis. The infection caused by oral biofilms is even closely related to many systemic diseases. Currently, it is still challenging to study the pathogenic mechanism of the oral biofilm. Moreover, under the influence of the host immunity and various physical and chemical factors inside or outside the oral cavity, the phenotypes and biological characteristics of biofilms remain unclear due to lag of technological advances to mimic and study biofilms in vitro. Microfluidics is a multi-disciplinary field that involves flexible control of micro-scale fluids. It can not only accurately simulate the physical and chemical microenvironment but also be used to conduct real-time observation, high-throughput testing, and single-cell analysis. In this article, we will review the recent research progress of microfluidic technologies in biofilm study, and elaborate on the application prospects of microfluidics for the study of microbial biofilms in the oral microecosystem.
Keywords: microfluidicsbacterial biofilmsoral microbiomeoral microecology
微生物被膜(也被称为生物膜,microbial biofilm),是一种由单细胞微生物互相黏附并依附于载体表面而形成的类似高等生物组织的群体结构,是引起持续性感染的常见病因之一[1]。在生物被膜中,微生物被包被在自身产生的胞外聚合物(extracellular polymeric substance,EPS)基质网内,具有高度的组织性和复杂的互作关系[2]。通过形成生物被膜,微生物可以具备增强的致病性及生存能力、高度的抗机械干扰能力与抗生素抗性,引起高达65%–80%的感染性疾病,因此在医学微生态研究中具有重要意义[3]。
早在300多年前,荷兰科学家列文虎克(Antony van Leeuwenhoek)就首次应用光学显微镜从牙齿表面观察到了生物被膜的结构,然而由于研究技术的限制,当时仅将其定义为大量的“小生物” (animalcules)[4]。目前的研究表明,在健康人群口腔中,多种微生物常常以生物被膜的形式稳定存在。反之,当口腔内微生态环境发生改变时,生物被膜则可以成为多种常见口腔感染性疾病(如龋病、牙髓根尖周病、牙周病等)的主要病因,甚至与一些全身性疾病密切相关[5]。目前口腔感染性疾病生物被膜的研究主要采用静态培养法或动态培养法在体外构建生物被膜模型[6]。静态培养法通常在平板或孔板上进行(图 1-A),生物被膜生长在琼脂培养基表面或是一些气液交界面,这些界面环境相对固定,较少有微生态条件的变化,培养液无法持续更新,生物被膜可能受到浮游细胞的干扰。动态培养法主要通过流动反应器或恒化器进行(图 1-B),在培养过程中能够施加流体剪切力并实现培养液和刺激物的持续更新。然而实现动态培养的恒化器等设备设计制作较为复杂,需消耗大量的培养液,因此研究和开发一种多功能培养平台技术,从而在实验室中实现严格调控的生物被膜微环境,模拟自然条件下的生物被膜微生态,对研究生物被膜内部生长变化、开展原位定量分析十分重要。
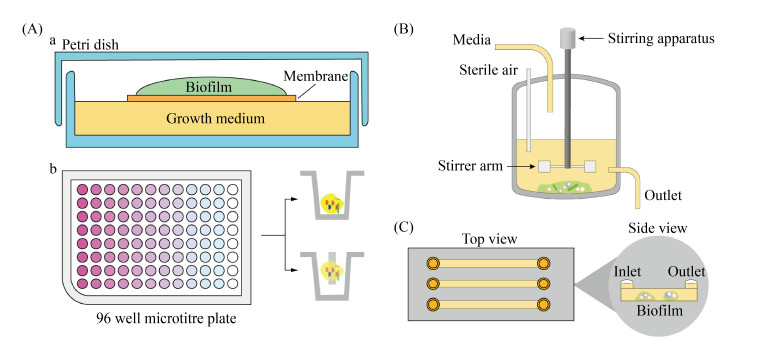 |
| 图 1 体外构建生物被膜模型 Figure 1 Construction of biofilm model in vitro. A: Static culture methods. a: cultural plate; b: 96-well microtiter plate. B: Continuous flow culture method (Chemostat). C: Microfluidic device. |
| 图选项 |
自20世纪90年代初期微全分析系统(Micro Total Analysis System,μTAS)的开拓性理念提出以来,微流控技术(Microfluidics)已成为生命分析化学研究方向的热点。随着研究的不断深入,许多****开始将微流控芯片运用于生物被膜的研究当中。通过微流控装置(图 1-C),研究者可以在三维的微通道中精准地控制并模拟生物被膜生长的理化微环境(如剪切力、温度、氧含量、pH、药物浓度等),提高检测的灵敏度及效率,同时还具有实时观察、高通量测试、单细胞分析等独特优势,这些都为生物被膜的研究提供了新的思路与方向[7]。本文将回顾近期微流控技术在生物被膜方面的研究进展,并结合口腔微生态系统研究的关键科学问题,对微流控技术在口腔生物被膜研究应用及前景作一综述。
1 微流控生物被膜研究进展 微流控技术是指在微米尺度上进行流体操控的技术,是一个集微纳米加工、化学、光学、生物学和流体力学等多学科交叉的新领域。通过微流控芯片,可以集成样品制备、反应、分离、检测等多种操作,进而取代常规生化实验室的许多功能,因此也被称为芯片实验室(Lab On a Chip,LOC)[8]。近年来,微流控技术在生物被膜研究中的应用不断增加,也取得了很多突破性的研究进展。
1.1 模拟理化微环境对生物被膜的影响 生物被膜可以被视为一个微生物的小型“社会”,当外界物理、化学环境发生改变时,生物被膜的群落结构、形态、致病性、耐药性等特性都会发生变化[9]。为了更好地分析环境因素对生物被膜的影响,研究者将微流控芯片的通道底面作为生物被膜生长的支持基质,通过设计不同的通道几何形状,创造三维的生长平台,可以控制流体流动剪切力、效应物或溶解氧浓度梯度等多种理化因素的自动定量[10]。
1.1.1 模拟物理环境对生物被膜的作用: 在单相体系中考察流体流速对生物被膜生命进程的作用是一项非常重要的研究,通过利用聚二甲基硅氧烷(polydimethylsiloxane,PDMS)制成微通道,可以在微环境中考察流体力学因素(流体剪切力和流动条件)对生物被膜结构的影响。Kim等通过调节微通道宽窄来控制流速,并利用雷诺数(Reynolds number,Re)和通道的宽高比(r)表征了铜绿假单胞菌(Pseudomonas aeruginosa,PA14)生物被膜的空间结构,结果显示在低Re时,较高的流速刺激生物被膜的生长,而在高Re时,较高的流速却抑制生物被膜的生长[11]。Weaver等利用从入口到出口不断变窄的平行微通道发现流体剪切力可以诱导胞内多糖黏附素阳性的表皮葡萄球菌(Staphylococcus epidermidis)形成生物被膜并改变其结构(图 2-A)[12]。这些结果为我们理解流体动力环境下生物被膜的生长特性提供了较为简单且便于复制的理论与实验模型。
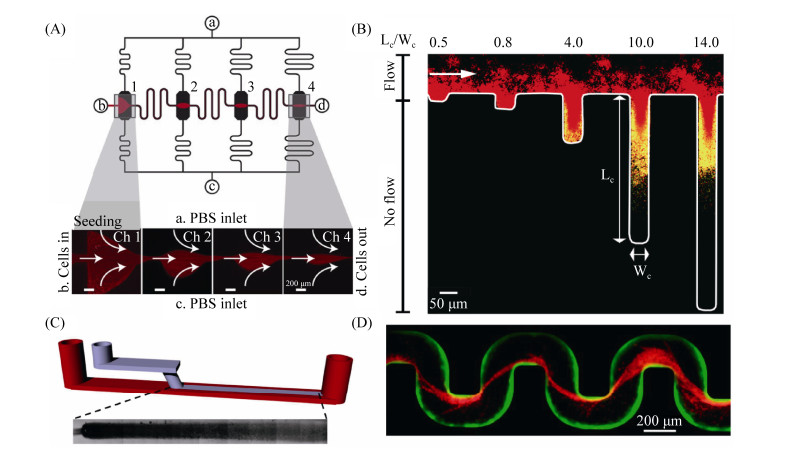 |
| 图 2 微流控技术在生物被膜流体动力学研究中的应用(改编自文献[10, 12–14]) Figure 2 Application of Microfluidics in Biofilm Hydrodynamics. A: Schematic of the microfluidic biofilm device: the microchannel design consists of 4 parallel channels (black) with culture chambers placed halfway between inlet a and outlet c. These are connected by a seeding channel (red and black) from b to d. B: Merged images of S. aureus in a complex topography: As in, red shows QS-off cells, and yellow shows QS-on cells. C: Schematic of the two-level flow-templating micro-bioreactor: the small channel (blue) brings the biofilm nutrient solution template stream to the measurement channel, the inlet connected to the large (measurement) channel in red brings the confinement solution. Observation of the measurement channel occurs from the bottom side using an inverted microscope. D: Streamers (red) impeding flow. Adapted from the literature [10, 12–14]. |
| 图选项 |
同时,不同的流体环境还可以影响生物被膜内细菌的群体感应特性(quorum sensing,QS),进而改变生物被膜的构成与致病性。利用微流控技术,Bassler等发现,在流动条件下,即使相同基因型细菌也可以因为群体感应(QS)在时间和空间上的差异而出现不同的表型,导致不同程度的定殖和致病能力(图 2-B)[13]。此外,还可以通过微通道几何形状的改变来模拟生物被膜生长的现实环境。例如,Aznaveh等利用限制性层流模板形成不同宽度的带状生物被膜,可以模拟不同的剪切力环境并控制生物被膜均一的生长(图 2-C)[14]。Kim等通过三维管状的微通道来模拟土壤多孔介质、工业过滤及医疗支架中的液体流动,发现铜绿假单胞菌(P. aeruginosa,PA14)生物被膜可以形成生物被膜条带(streamer),进而造成液体流动的突然阻滞(图 2-D),该研究暗示了细菌生物被膜条带在类似自然环境中的普遍性[10]。这些结果显示,相比传统的静态培养方法,微流控芯片上的生物被膜培养显示出更好的生长可控性,对生物被膜的流体动力学及其相关影响因素的研究也更加定量。
1.1.2 分析化学效应物浓度对生物被膜的影响: 在复杂生态环境中,微生物(特别是细菌)能够感知周围环境中的化学物质及氧气的变化,并沿着化学物质的浓度梯度产生定向的趋化行为,这种趋化行为被认为在生物被膜的形成、分散与致病等作用中至关重要[15]。利用分子在水凝胶中的扩散特性,可以在微流控芯片中形成精准的物质浓度梯度进而研究效应物及氧气对生物被膜的影响。Kim等使用浓度梯度微流控芯片原位监测了抗生素对生物被膜的最小去除浓度(minimal biofilm eradication concentration,MBEC),发现对PAO1生物被膜的MBEC远比临床中用的最小抑制浓度(minimum inhibitory concentration,MIC)要高,该方法更加精确快捷,对于临床用药具有指导意义(图 3-A)[16]。Skolimowski等设计了一种可以产生不同溶解氧浓度梯度的微流控芯片,可以观察P. aeruginosa生物被膜在不同氧浓度下的生长形态,为微需氧或厌氧条件下生物被膜的研究提供了条件[17]。2012年,Jayaraman研究组设计了一个集成了多个阀门的多层PDMS微流控芯片(图 3-B),利用群体感应信号通路相关分散蛋白,通过精确的程序化添加效应物分子控制大肠杆菌生物被膜的生长,使得改造的工程菌株成功取代已存在的生物被膜并得到清除,为临床上生物被膜的去除提供了新的研究策略[18]。综上,上述研究所采用的微流控技术不仅能够产生稳定精确的物质浓度梯度,而且可以满足实时监控和高通量测量的要求,而采用传统培养方法是较难实现的。
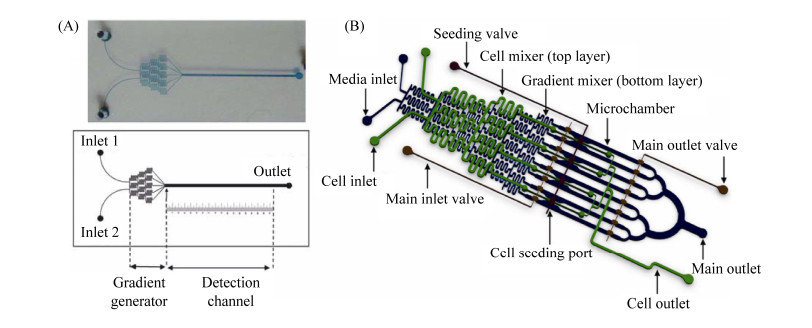 |
| 图 3 微流控技术用于浓度梯度的建立(改编自文献[16–18]) Figure 3 Microfluidics for generating gradients. A: Schematic diagram and optical image of the microfluidic device. The microfluidic device consists of gradient generator and main detection microchannel. B: The novel microfluidic device is shown with its two PDMS layers, a bottom layer with a diffusive mixer and eight microchambers, and a top layer containing a second diffusive mixer and the pneumatic elements to control microvalves. The diffusive mixer in the bottom layer was used to generate different concentrations of dispersal signals and to perfuse growth media into the biofilm microchambers. The mixer in the top layer was used to introduce bacteria into the microchambers at different cell densities. Adapted from the literature [16–18]. |
| 图选项 |
1.2 高通量可视化生物被膜生长过程与机制研究 微生物在形成生物被膜后,对于药物及宿主免疫的抵抗能力大幅度提升,已有众多的研究表明,生物被膜是多种慢性难治性疾病的病因,如中耳炎、囊性纤维化、心内膜炎等等[19]。为了能够及时控制或去除致病生物被膜,临床中需要快速鉴定对生物被膜有效的药物,并鉴定参与增强的生物被膜抗性的基因,进一步理解生物被膜内物种间的相互作用机制。以高通量的微流控芯片为平台,结合多种化学修饰技术及可视化技术可以很好地满足这一需求。
2010年,Benoit等使用Bioflux公司的商品化微流控芯片结合绿色荧光蛋白示踪技术鉴定了铜绿假单胞菌(P. aeruginosa,PAO1)生物被膜对抗生素的敏感性,该芯片可以同时对96个生物被膜进行培养与鉴定,极大地提高了通量与效率(图 4-A)[20]。利用3D显微打印技术,Connell等用明胶(Gelatin)打印出相邻的或镶嵌的十几至几十微米大小的微菌落,并利用明胶的通透性研究不同菌株间的抗药交互作用(图 4-B)[21]。Liu等将延时显微技术与一个简单的微流控芯片相结合,研究了枯草芽孢杆菌(Bacillus subtilis)生物被膜内细菌的竞争与合作机制,该****将微通道的厚度限制在几个微米,从而把生物被膜复杂的三维扩张生长二维化,在延时显微镜下发现了生物被膜内代谢共依赖及电子通讯引起的细菌振荡,从而揭示控制生物被膜生长的新策略[22]。
 |
| 图 4 微流控装置用于生物被膜的高通量可视化研究(改编自文献[20–21, 23–24]) Figure 4 Microfluidics for high-throughput and visualized biofilm researches. A: Close-up of Bioflux microfluidic channels (black lines). Each channel has a serpentine region (one serpentine region is enclosed in a box) to provide sufficient back pressure and a chamber for microscope viewing (arrow). B: Cut-away 3D mask reconstructions (Upper) and bright-field images (Lower) depict examples of nested polymicrobial communities of varying geometries and cell densities. C: A microfluidic device with specific geometry consisting of a PDMS stencil, jig, and glass coverslipis shown (The image inset is a PDMS stencil imaged using stereomicroscopy). D: Patterned biofilm using surface modification. Adapted from the literature [20–21, 23–24]. |
| 图选项 |
此外,阵列图案化的生物被膜培养也能够实现具有一致生理特性生物被膜的生物学重复,有助于实现多参数的定量研究。Eun等人利用具有特定几何形状的模板控制微生物细胞的吸附,使生物被膜(包括铜绿假单胞菌、枯草芽孢杆菌、表皮葡萄球菌等)阵列化生长(图 4-C),开展了在不同物理、化学等环境因素下,生物被膜生长的定量统计学研究[23]。为了维持图案化生物被膜长时间稳定性,可以利用生物惰性表面化学修饰的方法,如在基质上修饰末端为甘露醇基团的单分子层图案(具有生物惰性且可以抵抗条件致病菌的吸附),将生物被膜的生长限制在非修饰区内(图 4-D)。通过这种方法目前很好地实现了铜绿假单胞菌(PAO1),大肠杆菌(RP437)和白色念珠菌(SC5314)生物被膜的限制性生长,可重复的图案化的生物被膜可以维持图案化长达26 d[24],这也为研究生物被膜的去除提供了一种新的平台。
1.3 微液滴技术在细菌生物被膜培养中的应用 液滴微流控是微流控技术的重要分支,其特点是在微通道中用不相溶的载液相将样品和试剂分割为皮纳升级的均一液滴,实现生物样品的分隔、反应、扩增和检测。液滴微流控不仅可以提供高通量的均一微生物被膜培养反应器,甚至可以定量检测单细胞的行为[25]。例如,哈佛大学Weitz研究组使用单分散乳化液滴培养细菌生物被膜,该方法能够很快地产生数千个双层乳化或三层乳化液滴,这些液滴作为一个三维的密闭微环境来提供生物被膜的生长空间;这些液滴的大小仅为几十到几百微米,便于操控和剖析;通过显微镜可以实现观察每个液滴中枯草芽孢杆菌生物被膜群体细胞的分化以及生物被膜的微结构[26]。Zhu等利用基于琼脂糖液滴的微流控技术,结合单细胞乳液PCR的方法在高本底的正常细菌下定量检测出了稀有病原体,该方法具有较高的灵敏度与特异性,对于检测复合型病原感染具有一定意义[27]。
现有的液滴微流控技术无法实现流体剪切力作用及培养基的实时更新,难以实现稳定条件下的长时间生物被膜培养。针对这一局限,本研究组开发了一种动态固着微液滴培养生物被膜(Dynamic Sessile-droplet Habitat,DSH)技术(图 5),DSH通过在微流控通道底部进行表面亲疏水图案化修饰,并利用连续流动微流控液滴与亲水图案的交换融合实现了生物被膜接种、培养、动态刺激研究[28]。DSH方法成功应用于在稳定剪切流水动力条件下,原位实时和定量分析生物被膜的生长,评价PAO1及其不同突变菌株生长过程和特点,还发现了依赖面积的生物被膜生长、剪切流条件下的生物被膜周期性脱落、生物被膜的边界扩张和生物被膜条带的形成等一些有趣的结果,这些结果证明使用DSH方法培养抓住了自然环境中和微通道中生物被膜生长的内在特性。与层流微通道连续培养生物被膜方法相比,DSH技术可以准确控制生物被膜的形状和大小,可对生物被膜施加长时间的稳定周期性剪切力刺激,通道不易发生堵塞和阻滞,一次实验提供更多的重复容易对生物被膜进行更加准确的定量分析。
 |
| 图 5 动态固着液滴生物被膜培养系统(改编自文献[28]) Figure 5 Grow bacterial biofilm in dynamic sessile-droplet habitats (DSH). A: 3D schematic of device with arrays of DSHs patterned on the bottom of microfluidic channel. B: Comparison of biofilm formations in microfluidic flow cell and DSHs. Adapted from the literature [28]. |
| 图选项 |
2 口腔微生态系统中生物被膜的研究现状 2.1 口腔生物被膜的形成特点 生物被膜的形成和发育不仅仅是随机简单的细胞被动聚集,而是一个渐进的复杂的生物学演替过程,包括微生物黏附、聚集、成熟与分散等阶段,期间还有很多胞外物质和信号分子参与[29]。在口腔微生态系统中,微生物,宿主与宿主饮食之间存在着动态的相互作用,引起微生物在口腔中定殖并形成独特的生物被膜结构。以最典型的牙菌斑生物被膜为例,其形成大致可以分为3个阶段(图 6):(1) 获得性膜(acquired pellicle)形成和初期聚集:唾液中的蛋白或糖蛋白、龈沟液以及细菌产物可以选择性的吸附在牙面上,形成无物质结构的薄膜。它形成的速度很快,在刚清洁过的牙面上,20 min内便可形成,并迅速成层增厚,既能为后期细菌黏附提供特殊受体,又可作为细菌的营养。(2) 细菌粘附(adhesion)和共聚(coaggregation):浮游微生物可逆的黏附于获得性薄膜上,进而在细菌表面结构(如鞭毛,菌毛,内毒素和胞外多糖等)的参与下介导不可逆性黏附,同时,细菌间通过特异性的识别黏附发生共聚并分泌EPS基质形成小菌落;(3) 菌斑成熟和散播阶段:微菌落中的细菌增殖并不断聚集融合形成大的菌落而呈典型的蘑菇样突起,最后形成复杂的菌斑生物被膜结构,而成熟菌斑表面的细菌可以脱落,重新成为浮游态,从而开始新的附着和循环[30]。
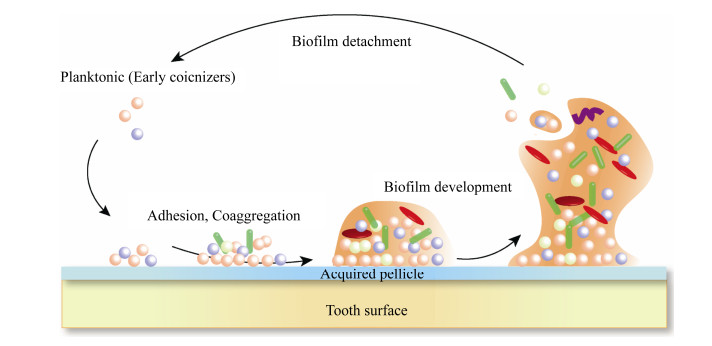 |
| 图 6 菌斑生物被膜形成的不同阶段示意图 Figure 6 Schematic representation of the distinct steps in dental plaque development. Including forming aquired pellicle, initial attachment to the surface, adhesion and coaggregation of bacteria, biofilm maturation with formation of a three-dimensional structure, and biofilm detachment. |
| 图选项 |
研究者认为,生物被膜是一种可以预测的生命周期形式,在菌斑成熟过程中,细菌的定殖也有一定的顺序。随着微生物的生长繁殖,菌斑逐渐增厚,其内部的理化因子可以呈垂直向和水平向梯度分布,使菌斑内的微环境多样化[31]。因此,即使菌斑内的微生物相距很近,其中的营养物质、氧气浓度、pH、氧化还原电位以及微生物代谢产物的浓度等都可能存在着巨大的差异。此外,EPS基质的屏障作用,细菌间的代谢交流,遗传交换,以及群体感应,宿主口腔微环境的动态变化,都可以影响菌斑中微生物被膜的种类、数量及生理特性[1]。
2.2 口腔生物被膜的构成及影响因素 生物被膜在口腔中分布广泛、具有多个定居位点,研究者在健康人群口腔软组织粘膜表面、龈沟内、牙及修复体表面等部位都观察到多种形态的生物被膜存在,在病理条件下,这些生物被膜甚至可以深入根管内并定殖于根尖周组织[32]。研究口腔生物被膜构成的方法主要分为培养法和基因多态性分析法,二者的研究结论常常存在较大差异。例如,van Strijp等****通过传统的培养法在口腔微生物群落中仅分离出十余个“属”级微生物[33]。而Keijser等使用分子生物学方法则在健康成人的龈上菌斑生物被膜中发现了约10000个不同的分类单元(OTUs) (3%的遗传差异聚类分析),超过200个属,远高于先前的报道[34]。Zuara等通过454焦磷酸测序技术分析了3名健康高加索人5个口腔部位(牙齿表面,颊部,硬腭,舌部和唾液)的微生物组,在每个个体中发现了逾500个OTUs (3%的遗传差异聚类分析),其中厚壁菌门、变形菌门、放线菌门、拟杆菌门和梭杆菌门是其优势分类群[35]。
目前普遍认为在健康情况下,口腔生物被膜与宿主之间呈现一种动态平衡的状态,而当体内外微环境发生变化时,可以引起口腔微生态的失衡,触发生物被膜产生增强的致病性或毒力因子[36]。研究表明,能够影响生物被膜的因素包括以下两方面。
2.2.1 宿主口腔微生态环境发生改变: 宿主的生理或免疫水平发生改变而引起的稳态失调。例如,对于免疫缺陷病人或化疗患者,其机会性感染的易感性显著增加;唾液流量减少或口干人群,其口腔常驻菌群引起龋齿、牙周炎或口腔念珠菌病的可能性也会增加[37]。此外,女性激素水平变化在某些情况下也可能破坏口腔微生态平衡,导致妊娠期龈炎等疾病的易感性增加。
生物被膜生长的外环境(如营养供给、氧含量、pH、抗生素干预等)发生显著变化,微生物在口腔内生长的流体动力发生变化,导致群落中一个或多个物种的相对丰度突然增加或减少。例如,频繁食用糖类等碳水化合物可以引起生物被膜内糖发酵细菌如变异链球菌和乳杆菌过度生长,它们通过糖代谢产生大量的乳酸,使口腔环境酸化,进而选择抗酸细菌、消除酸敏感细菌,增加患龋风险[38]。同理,抗生素治疗可以导致敏感菌种的迅速减少,耐药菌种相对增加,这就不可避免地引起生物被膜内物种丰度的转移和群落平衡的破坏[39]。
疾病的进展也能够影响口腔生物被膜初期定殖及生长变化。研究表明,急性根尖周炎患牙其根管生物被膜内微生物的丰度与多样性相比于无症状的慢性根尖周炎大的多,然而这些微生物的种类却因人而异,为根管治疗带来了很大的挑战[40]。
2.2.2 微生物间的相互作用造成口腔生物被膜内环境或构成发生转变: 在口腔生物被膜中,微生物彼此间距离很近,在代谢上也存在着广泛的协同与拮抗作用。例如当专性厌氧菌牙龈卟啉菌与需氧菌奈瑟球菌发生共聚时,二者均可以在有氧环境中生存[41];而某些微生物则可以产生抑制性产物(如细菌素、酸,过氧化氢等),进而抑制邻近细胞的活动,部分解释了为什么某些细菌会在口腔生物被膜中以离散的细胞簇形式存在[38],目前已有许多研究证实了这些天然分子(如抗菌肽)作为新型生物被膜抑制剂的前景。
同时,生物被膜中细菌还可以通过密度依赖性的方式进行交流并协调其基因表达(即群体感应现象),进而增加其致病性。例如Li等发现,口腔中变异链球菌的群体感应系统可以将其形成生物被膜的能力提高10–600倍[42]。此外,最近提出的“关键病原体假说” (keystone-pathogen hypothesis)也支持了这一观点,该假说认为某些低丰度的微生物病原体可以通过基因转移等细胞间作用将群落中无害的常驻微生物群转变为致病微生物群[43]。
综上,人类口腔是一个动态而复杂的微生态系统,种类繁多的微生物在健康人群口腔中常以生物被膜的形式存在并保持着动态平衡的关系。口腔理化微环境的变化、细菌的相互作用关系等都可能引起口腔微生态失衡,导致生物被膜感染性口腔疾病[44]。此外,研究表明,微生物在形成生物被膜后其抗机械干扰能力显著增加,耐药性甚至可以较其浮游状态提高约1000倍,这也为临床医生的治疗口腔生物被膜感染性疾病增加了难度[45]。然而目前对于口腔生物被膜依然缺乏充分全面的认识,亟须建立一个高效快捷的生物被膜模型来精确模拟并调控口腔微生态环境,从而深入了解其致病机制、研究精准的治疗方法。微流控技术的出现为研究者们打开了新的视野。
3 微流控技术在口腔微生态系统研究中的应用 如前文所述,作为一种新兴的方法,微流控技术在生物被膜的研究中已经体现出许多原有技术难以达到的优势,然而其在口腔微生态研究中的应用还处于起步阶段。2010年,Shumi等使用装有玻璃珠的微流体装置来模拟体内天然牙的牙间隙,通过激光共聚焦显微镜和原子力显微镜下定量测量了环境因素(如蔗糖和金属离子)对变异链球菌附着和生物被膜形成的影响,该****发现蔗糖是变异链球菌附着和产生胞外多糖的必需因素,与传统上需要通过复杂的实验才能得到的结果相同,表明了微流控生物被膜模型非常适合原位模拟口腔环境[46]。2013年,Nance等使用Bioflux公司商品化的单层微流控芯片,模拟了口腔内多种微生物的生物被膜,并在激光共聚焦显微镜下实时观察了不同浓度抗菌剂西吡氯铵对唾液微生物所形成的生物被膜清除的有效性[47],显示高通量的微流控实时监测装置在口腔生物被膜的研究中具有巨大前景。香港城市大学的研究人员Lam等设计制作了更为复杂的人工牙齿微流控芯片,该芯片由六层PDMS结合而成,集成了有氧气和氮气比例控制的气路系统和多通道营养输入的控制系统,含有128个人工牙齿腔室的阵列芯片(图 7),在有氧培养或有氧无氧交替培养、不同口腔细菌共同培养等多种参数生化条件下,对菌斑生物被膜的生长进行了分析,其结果显示了牙齿菌斑生物被膜由简单分析到多功能集成分析的可行性,为我们精确模拟口腔微生态环境、筛选特定生长参数下的生物被膜提供了新的思路[48]。
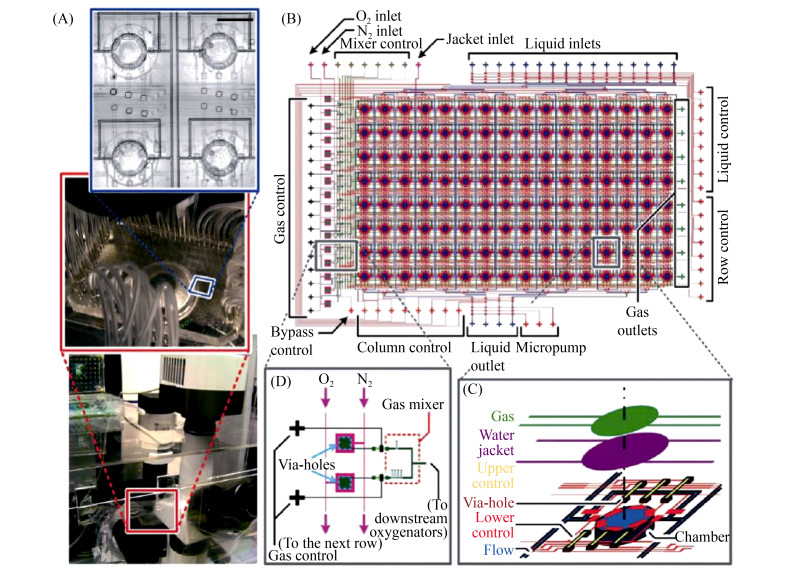 |
| 图 7 人工牙齿大规模集成芯片实物图和示意图(改编自文献[47]) Figure 7 Schematic of the microfluidic "artificial teeth" device. A: Fabricated device placed on the automated microfluidic control platform. Scale bar: 1 mm. B: Design layout of 128-chamber artificial teeth chip. C: Sketch of multiple structural layers in a culture region. D: Design of the gas micromixer. Adapted from the literature [47]. |
| 图选项 |
4 总结和展望 口腔作为人体消化系统的入口,是连通人体内外的重要枢纽,其微生态环境也与全身健康密切相关。许多严重的慢性非传染性疾病,如早产、糖尿病、类风湿性关节炎、感染性心内膜炎等都被证实与口腔疾病有着密切的关系[36],尽管目前已有大量针对于口腔内感染性疾病的病因及治疗的相关研究,但近十几年来口腔感染性疾病的疗效并没有显著地提高。以慢性根尖周炎为例,临床横断面流行病学调查结果显示,不同国家根管治疗后患牙仍然存在根尖周炎的比例在24.1%–53.5%,意味着平均一半左右的患牙持续存在根尖周组织的感染[49]。本研究团队前期相关的临床研究也发现,按照现代化根管治疗标准程序,10–19个月后慢性根尖周炎患牙影像学完全愈合率仅有25%,两年愈合率也仅有48%[50–51]。根管内外长期存留的感染性生物被膜是根尖周炎迁延不愈的主要原因。然而目前对于其构成及特性的认识依然有待加强。因此,还需要进行更为深入的研究来明确口腔微生态环境中生物被膜的生长状态、致病机制与治疗方法。
微流控技术能够在微尺度上对多种理化因子进行精确的操控与分析,为微生物学家提供了全新理念和实验平台,具有较大的开发空间与应用前景。微流控技术和口腔微生态研究的进一步整合,可以使我们不仅能够关注到单个细胞的细节,而且能够观察到复杂的多物种群落变化,以及口腔宿主细胞与微生物被膜的互作现象,为我们在复杂口腔环境中探索生物被膜生长特性,解开其形成与理化因素的协同过程提供了更多的可能。通过在实验室进行的高通量可视化实验,包括细菌个体生长、生物被膜的发育过程、生物被膜结构及其与药物作用的原位观察和定量分析等,将有助于我们更深入地理解口腔细菌生物被膜生命周期、开发更有效的治疗方法,对口腔疾病的风险预警及疗效预测具有重要意义。
References
| [1] | Flemming HC, Wingender J, Szewzyk U, Steinberg P, Rice SA, Kjelleberg S. Biofilms: an emergent form of bacterial life. Nature Reviews Microbiology, 2016, 14(9): 563-575. DOI:10.1038/nrmicro.2016.94 |
| [2] | Flemming HC, Wingender J. The biofilm matrix. Nature Reviews Microbiology, 2010, 8(9): 623-633. DOI:10.1038/nrmicro2415 |
| [3] | van Acker H, van Dijck P, Coenye T. Molecular mechanisms of antimicrobial tolerance and resistance in bacterial and fungal biofilms. Trends in Microbiology, 2014, 22(6): 326-333. DOI:10.1016/j.tim.2014.02.001 |
| [4] | H?iby N. A personal history of research on microbial biofilms and biofilm infections. Pathogens and Disease, 2014, 70(3): 205-211. DOI:10.1111/2049-632X.12165 |
| [5] | Flemmig TF, Beikler T. Control of oral biofilms. Periodontology 2000, 2011, 55(1): 9-15. DOI:10.1111/j.1600-0757.2010.00383.x |
| [6] | Magana M, Sereti C, Ioannidis A, Mitchell CA, Ball AR, Magiorkinis E, Chatzipanagiotou S, Hamblin MR, Hadjifrangiskou M, Tegos GP. Options and limitations in clinical investigation of bacterial biofilms. Clinical Microbiology Reviews, 2018, 31(3): e00084-16. |
| [7] | Vertes A, Hitchins V, Phillips KS. Analytical challenges of microbial biofilms on medical devices. Analytical Chemistry, 2012, 84(9): 3858-3866. DOI:10.1021/ac2029997 |
| [8] | Zhou WT, Le J, Chen Y, Cai Y, Hong ZY, Chai YF. Recent advances in microfluidic devices for bacteria and fungus research. TrAC Trends in Analytical Chemistry, 2019, 112: 175-195. DOI:10.1016/j.trac.2018.12.024 |
| [9] | Bowen WH, Burne RA, Wu H, Koo H. Oral biofilms: pathogens, matrix, and polymicrobial interactions in microenvironments. Trends in Microbiology, 2018, 26(3): 229-242. DOI:10.1016/j.tim.2017.09.008 |
| [10] | Drescher K, Shen Y, Bassler BL, Stone HA. Biofilm streamers cause catastrophic disruption of flow with consequences for environmental and medical systems. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(11): 4345-4350. DOI:10.1073/pnas.1300321110 |
| [11] | Kim J, Kim HS, Han S, Lee JY, Oh JE, Chung S, Park HD. Hydrodynamic effects on bacterial biofilm development in a microfluidic environment. Lab on a Chip, 2013, 13(10): 1846-1849. DOI:10.1039/c3lc40802g |
| [12] | Weaver WM, Milisavljevic V, Miller JF, Di Carlo D. Fluid flow induces biofilm formation in Staphylococcus epidermidis polysaccharide intracellular adhesin-positive clinical isolates. Applied and Environmental Microbiology, 2012, 78(16): 5890-5896. DOI:10.1128/AEM.01139-12 |
| [13] | Kim MK, Ingremeau F, Zhao AS, Bassler BL, Stone HA. Local and global consequences of flow on bacterial quorum sensing. Nature Microbiology, 2016, 1(1): 15005. DOI:10.1038/nmicrobiol.2015.5 |
| [14] | Aznaveh NB, Safdar M, Wolfaardt G, Greener J. Micropatterned biofilm formations by laminar flow-templating. Lab on a Chip, 2014, 14(15): 2666-2672. DOI:10.1039/C4LC00084F |
| [15] | Liebchen B, L?wen H. Synthetic chemotaxis and collective behavior in active matter. Accounts of Chemical Research, 2018, 51(12): 2982-2990. DOI:10.1021/acs.accounts.8b00215 |
| [16] | Kim KP, Kim YG, Choi CH, Kim HE, Lee SH, Chang WS, Lee CS. In situ monitoring of antibiotic susceptibility of bacterial biofilms in a microfluidic device. Lab on a Chip, 2010, 10(23): 3296-3299. DOI:10.1039/c0lc00154f |
| [17] | Skolimowski M, Nielsen MW, Emnéus J, Molin S, Taboryski R, Sternberg C, Dufva M, Geschke O. Microfluidic dissolved oxygen gradient generator biochip as a useful tool in bacterial biofilm studies. Lab on a Chip, 2010, 10(16): 2162-2169. DOI:10.1039/c003558k |
| [18] | Hong SH, Hegde M, Kim J, Wang XX, Jayaraman A, Wood TK. Synthetic quorum-sensing circuit to control consortial biofilm formation and dispersal in a microfluidic device. Nature Communications, 2012, 3: 613. DOI:10.1038/ncomms1616 |
| [19] | Del Pozo JL. Biofilm-related disease. Expert Review of Anti-infective Therapy, 2018, 16(1): 51-65. DOI:10.1080/14787210.2018.1417036 |
| [20] | Benoit MR, Conant CG, Ionescu-Zanetti C, Schwartz M, Matin A. New device for high-throughput viability screening of flow biofilms. Applied and Environmental Microbiology, 2010, 76(13): 4136-4142. DOI:10.1128/AEM.03065-09 |
| [21] | Connell JL, Ritschdorff ET, Whiteley M, Shear JB. 3D printing of microscopic bacterial communities. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(46): 18380-18385. DOI:10.1073/pnas.1309729110 |
| [22] | Liu JT, Prindle A, Humphries J, Gabalda-Sagarra M, Asally M, Lee DYD, Ly S, Garcia-Ojalvo J, Süel GM. Metabolic co-dependence gives rise to collective oscillations within biofilms. Nature, 2015, 523(7562): 550-554. DOI:10.1038/nature14660 |
| [23] | Eun YJ, Weibel DB. Fabrication of microbial biofilm arrays by geometric control of cell adhesion. Langmuir, 2009, 25(8): 4643-4654. DOI:10.1021/la803985a |
| [24] | Hou SY, Burton EA, Wu RL, Luk YY, Ren D. Prolonged control of patterned biofilm formation by bio-inert surface chemistry. Chemical Communications, 2009(10): 1207-1209. DOI:10.1039/b822197a |
| [25] | Zhu Z, Yang CJ. Hydrogel droplet microfluidics for high-throughput single molecule/cell analysis. Accounts of Chemical Research, 2017, 50(1): 22-31. DOI:10.1021/acs.accounts.6b00370 |
| [26] | Chang CB, Wilking JN, Kim SH, Shum HC, Weitz DA. Monodisperse emulsion drop microenvironments for bacterial biofilm growth. Small, 2015, 11(32): 3954-3961. DOI:10.1002/smll.201403125 |
| [27] | Zhu Z, Zhang WH, Leng XF, Zhang MX, Guan ZC, Lu JQ, Yang CJ. Highly sensitive and quantitative detection of rare pathogens through agarose droplet microfluidic emulsion PCR at the single-cell level. Lab on a Chip, 2012, 12(20): 3907-3913. DOI:10.1039/c2lc40461c |
| [28] | Jin ZJ, Nie MY, Hu R, Zhao TH, Xu JY, Chen DW, Yun JL, Ma LZ, Du WB. Dynamic sessile-droplet habitats for controllable cultivation of bacterial biofilm. Small, 2018, 14(22): e1800658. DOI:10.1002/smll.201800658 |
| [29] | Jakobsen TH, Tolker-Nielsen T, Givskov M. Bacterial biofilm control by perturbation of bacterial signaling processes. International Journal of Molecular Sciences, 2017, 18(9): 1970. DOI:10.3390/ijms18091970 |
| [30] | Dufour D, Leung V, Lévesque CM. Bacterial biofilm: structure, function, and antimicrobial resistance. Endodontic Topics, 2010, 22(1): 2-16. DOI:10.1111/j.1601-1546.2012.00277.x |
| [31] | Kolenbrander PE, Palmer RJ, Periasamy S, Jakubovics NS. Oral multispecies biofilm development and the key role of cell-cell distance. Nature Reviews Microbiology, 2010, 8(7): 471-480. DOI:10.1038/nrmicro2381 |
| [32] | Jenkinson HF, Lamont RJ. Oral microbial communities in sickness and in health. Trends in Microbiology, 2005, 13(12): 589-595. DOI:10.1016/j.tim.2005.09.006 |
| [33] | van Strijp AJ, van Steenbergen TJ, de Graaff J, Ten Cate JM. Bacterial colonization and degradation of demineralized dentin matrix in situ. Caries Research, 1994, 28(1): 21-27. DOI:10.1159/000261615 |
| [34] | Keijser BJF, Zaura E, Huse SM, van der Vossen JMBM, Schuren FHJ, Montijn RC, Ten Cate JM, Crielaard W. Pyrosequencing analysis of the oral microflora of healthy adults. Journal of Dental Research, 2008, 87(11): 1016-1020. DOI:10.1177/154405910808701104 |
| [35] | Zaura E, Keijser BJF, Huse SM, Crielaard W. Defining the healthy "core microbiome" of oral microbial communities. BMC Microbiology, 2009, 9(1): 259. DOI:10.1186/1471-2180-9-259 |
| [36] | He JZ, Li Y, Cao YP, Xue J, Zhou XD. The oral microbiome diversity and its relation to human diseases. Folia Microbiologica, 2015, 60(1): 69-80. DOI:10.1007/s12223-014-0342-2 |
| [37] | Marsh PD, Zaura E. Dental biofilm: ecological interactions in health and disease. Journal of Clinical Periodontology, 2017, 44(Suppl 18): S12-S22. |
| [38] | Marsh PD, Moter A, Devine DA. Dental plaque biofilms: communities, conflict and control. Periodontology 2000, 2011, 55(1): 16-35. DOI:10.1111/j.1600-0757.2009.00339.x |
| [39] | Robinson CJ, Bohannan BJM, Young VB. From structure to function: the ecology of host-associated microbial communities. Microbiology and Molecular Biology Reviews, 2010, 74(3): 453-476. DOI:10.1128/MMBR.00014-10 |
| [40] | R??as IN, Siqueira JF Jr, Debelian GJ. Analysis of symptomatic and asymptomatic primary root canal infections in adult Norwegian patients. Journal of Endodontics, 2011, 37(9): 1206-1212. DOI:10.1016/j.joen.2011.05.026 |
| [41] | Bradshaw DJ, Marsh PD, Watson GK, Allison C. Oral anaerobes cannot survive oxygen stress without interacting with facuitative/aerobic species as a microbial commmunity. Letters in Applied Microbiology, 1997, 25(6): 385-387. DOI:10.1111/j.1472-765X.1997.tb00001.x |
| [42] | Li YH, Tang N, Aspiras MB, Lau PCY, Lee JH, Ellen RP, Cvitkovitch DG. A quorum-sensing signaling system essential for genetic competence in streptococcus mutans is involved in biofilm formation. Journal of Bacteriology, 2002, 184(10): 2699-2708. DOI:10.1128/JB.184.10.2699-2708.2002 |
| [43] | Hajishengallis G, Darveau RP, Curtis MA. The keystone-pathogen hypothesis. Nature Reviews Microbiology, 2012, 10(10): 717-725. DOI:10.1038/nrmicro2873 |
| [44] | Zhou XD, Shi WY. Oral Microecology. Beijing: People's Medical Publishing House, 2013: 90-118. (in Chinese) 周学东, 施文元. 口腔微生态学. 北京: 人民卫生出版社, 2013: 90-118. |
| [45] | Al-Ahmad A, Ameen H, Pelz K, Karygianni L, Wittmer A, Anderson AC, Spitzmüller B, Hellwig E. Antibiotic resistance and capacity for biofilm formation of different bacteria isolated from endodontic infections associated with root-filled teeth. Journal of Endodontics, 2014, 40(2): 223-230. DOI:10.1016/j.joen.2013.07.023 |
| [46] | Shumi W, Lim J, Nam SW, Lee K, Kim SH, Kim MH, Cho KS, Park S. Environmental factors that affect Streptococcus mutans biofilm formation in a microfluidic device mimicking teeth. Biochip Journal, 2010, 4(4): 257-263. DOI:10.1007/s13206-010-4401-8 |
| [47] | Nance WC, Dowd SE, Samarian D, Chludzinski J, Delli J, Battista J, Rickard AH. A high-throughput microfluidic dental plaque biofilm system to visualize and quantify the effect of antimicrobials. Journal of Antimicrobial Chemotherapy, 2013, 68(11): 2550-2560. DOI:10.1093/jac/dkt211 |
| [48] | Lam RHW, Cui X, Guo WJ, Thorsen T. High-throughput dental biofilm growth analysis for multiparametric microenvironmental biochemical conditions using microfluidics. Lab on a Chip, 2016, 16(9): 1652-1662. DOI:10.1039/C6LC00072J |
| [49] | Di Filippo G, Sidhu SK, Chong BS. Apical periodontitis and the technical quality of root canal treatment in an adult sub-population in London. British Dental Journal, 2014, 216(10): E22. DOI:10.1038/sj.bdj.2014.404 |
| [50] | Liang YH, Jiang LM, Jiang L, Chen XB, Liu YY, Tian FC, Bao XD, Gao XJ, Versluis M, Wu MK, van der Sluis L. Radiographic healing after a root canal treatment performed in single-rooted teeth with and without ultrasonic activation of the irrigant: a randomized controlled trial. Journal of Endodontics, 2013, 39(10): 1218-1225. DOI:10.1016/j.joen.2013.06.024 |
| [51] | Zhang MM, Liang YH, Gao XJ, Jiang L, van der Sluis L, Wu MK. Management of apical periodontitis: healing of post-treatment periapical lesions present 1 year after endodontic treatment. Journal of Endodontics, 2015, 41(7): 1020-1025. DOI:10.1016/j.joen.2015.02.019 |
