郝兆, 王艳红, 郑艳艳, 郭小芳

 , 德吉
, 德吉

西藏大学理学院, 西藏 拉萨 850000
收稿日期:2020-06-04;修回日期:2020-09-05;网络出版日期:2020-12-11
基金项目:国家自然科学基金(31960024);2019年中央支持地方高校改革发展基金(藏财预指[2019]01号); 西藏大学科研培育基金(ZDCZJH18-06);西藏大学研究生高水平人才培养计划(2018-GSP-014)
*通信作者:郭小芳, E-mail: gxf005@hotmail.com;
德吉, E-mail: dg971103@163.com.
摘要:[目的] 开展羊卓雍措水体可培养酵母菌多样性研究,探究影响其多样性的主要理化因子。[方法] 采用膜过滤平置培养法分离纯化酵母菌,并结合rRNA ITS区域序列分析与经典分类法对酵母菌菌株进行鉴定。运用SPSS 20.0和CANOCO 5分析可培养酵母菌多样性及其与理化因子之间的关系。[结果] 羊卓雍措水体可培养酵母菌为16个属25个种,优势属为Vishniacozyma,优势物种为Vishniacozyma victoriae。Pearson相关系数显示,pH、电导率、总溶解固体量、盐度与各样点可培养酵母菌种数和属数呈显著正相关;总磷与各样点及各区域可培养酵母菌属数呈显著负相关,与各样点种数呈显著负相关。冗余分析显示,pH和总磷是影响羊卓雍措水体可培养酵母菌分布的主要环境因子。[结论] 羊卓雍措水体酵母菌资源比较丰富且存在明显的空间异质性,人类活动对酵母菌分布有较大影响。酵母菌分布与人类活动的关系值得进一步研究。
关键词:高原湖泊羊卓雍措酵母菌多样性理化因子
Diversity of culturable yeasts in Yamzhog Yumco Lake
Zhao Hao, Yanhong Wang, Yanyan Zheng, Xiaofang Guo

 , Ji De
, Ji De

School of Science, Tibet University, Lhasa 850000, Tibet, China
Received: 4 June 2020; Revised: 5 September 2020; Published online: 11 December 2020
*Corresponding author: Xiaofang Guo, E-mail: gxf005@hotmail.com;
Ji De, E-mail: dg971103@163.com.
Foundation item: Supported by the National Natural Science Foundation of China (31960024), by the Tibet University 2019 Central Financial Support Special Funds for Local Colleges and Universities ([2019]01), by the Research and Cultivation Fund of Tibet University (ZDCZJH18-06) and by the Graduate High Level Talent Training Program of Tibet University (2018-GSP-014)
Abstract: [Objective] To investigate culturable yeast diversity in Yamzhog Yumco Lake and analyze the influence of environmental factors on yeast diversity. [Methods] Yeasts were isolated by membrane filtration flat culture. Identification was based on sequence analysis of ITS domains of rRNA gene, combining with traditional classification method. SPSS 20.0 and CANOCO 5 were used to examine correlations between culturable yeast diversity and environmental factors. [Results] In total of 297 yeast strains were isolated, these strains were identified as 25 species in 16 genera. Vishniacozyma was the dominating genera in the Lake. Vishniacozyma victoriae was the dominating species. Statistical analysis indicated that pH, electric conductivity (EC), total dissolved salt (TDS) and salt were significantly positive related to yeast species number and genera number among different sites, total phosphorus (TP) is significantly negative related to yeast genera number among different sites and different regions, TP is significantly negative related to yeast species number among different regions, additionally, pH and TP were important factors influencing the community structure of yeast in the Yamzhog Yumco Lake. [Conclusion] The yeast community from Yamzhog Yumco Lake showed high species richness, the yeast community structure was different at different sites, and anthropogenical influenced is an important factor for the yeast community. The relationship between yeast community and human activities deserves further study.
Keywords: Plateau lakeYamzhog Yumco Lakeyeastdiversityenvironmental factors
湖泊是陆地水圈的重要组成部分,约占内陆水体总面积的83%[1]。在湖泊生态系统中,包括酵母菌在内的微生物广泛参与物质循环和能量流动且易受环境影响,其物种数量与组成被认为是衡量湖泊生态系统稳定性的重要指标[2-5]。近年来,国内外探讨湖泊可培养酵母菌多样性的研究陆续开展。研究人员在得到了大量具有特殊功能的酵母菌菌株的同时发现不同生境条件的湖泊酵母菌物种组成及多样性存在明显差异[6-8]。相较于低海拔湖泊,高原湖泊具有缺氧、低温以及高辐射等特点,对其酵母菌多样性及功能特性研究具有特殊意义。目前对高原湖泊酵母菌的研究主要集中于阿根廷和中国,如Russo等对阿根廷巴塔哥尼亚西北部高海拔天然酸性湖泊水体可培养酵母菌多样性进行了研究,发现pH和重金属含量是影响该湖水生可培养酵母菌多样性的重要因素[8]。Brand?o以及Libkind等对阿根廷Nahuel Huapi湖酵母菌多样性进行研究,发现大部分所分离得到的酵母菌菌株表现出至少一种胞外酶活性,紫外线和外源有机质输入是影响该湖酵母菌多样性的重要因素[9-10]。董明华等研究了云南杞麓湖冬季可培养酵母菌多样性,发现水体总磷与pH分别是影响杞麓湖Rhodosporidium和Cryptococcus分布的重要环境因子[4]。郭小芳等对云南抚仙湖可培养酵母菌空间分布进行了研究,发现水体总有机碳浓度和人类活动对酵母菌的空间分布有一定的影响[11]。李治滢等对云南星云湖水体酵母菌进行分离、鉴定并初步测定了其产类胡萝卜素的能力,发现Rhodosporidiobolus和Rhodotorula是星云湖类胡萝卜素产量较高的主要类群以及该湖酵母菌多样性受湖泊营养化程度以及地理差异的影响[12]。严亚萍等对云南阳宗海水体酵母菌种群结构及产胞外酶活性进行了研究,发现15.9%的酵母菌具有产胞外酶活性,人类活动、浊度以及电导率是影响阳宗海酵母菌种群结构的重要因素[13]。综上研究表明,高原湖泊拥有较为丰富的酵母菌资源,但不同湖泊酵母菌多样性对环境因子的响应不尽相同。
青藏高原面积约250万km2,平均海拔4000–5000 m,是中国最大、世界最高的湖区,湖泊总面积45240.51 km2,约占全国湖泊总面积的56%[14]。独特的地理单元和极端的环境条件使得青藏高原孕育着丰富的微生物资源[15]。羊卓雍措流域位于西藏南部,是喜马拉雅山与雅鲁藏布江之间面积较大的内陆湖区[16]。长期以来,由于地理位置等条件限制,对羊卓雍措流域生物资源的研究大多为鸟类研究[17-20]和植物研究[21],对羊卓雍措流域微生物的研究仅局限于湖边土壤放线菌多样性及其生防潜力和部分湖区沉积物细菌群落结构垂直分布的研究[22-23]。关于羊卓雍措水体微生物尤其是酵母菌的研究尚未见报道。开展羊卓雍措水体酵母菌多样性分析能够为羊卓雍措环境保护以及青藏高原微生物多样性研究提供理论依据,并为极端环境下的酵母菌资源的开发和利用提供有价值的资源和参考。
1 材料和方法 1.1 研究地概况及水样采集 羊卓雍措位于西藏自治区南部,山南地区浪卡子县境内,是喜马拉雅山北麓最大的内陆湖,其形状很不规则,湖岸蜿蜒曲折,并附有空母措、沉措和巴纠措3个小湖,其中空母措北面经河道与羊卓雍措相连,沉措西侧经河道与羊卓雍措相连[24]。湖面海拔4439 m,湖泊总面积592 km2。流域属藏南山地灌丛草原半干旱气候,干湿季分明,年均降水量363.4 mm,年均气温2.9 ℃[25]。
2019年夏季根据湖水分布情况,结合生境及地理位置差异,在羊卓雍措、空母措和沉措共选择10个样点采集水样(表 1)。为了更系统地分析羊卓雍措酵母菌多样性及其与理化因子的相关性,将10个样点按照地理位置划分为4个区域,分别为羊卓雍措沿岸区(样点1–4)、空母措沿岸区(样点5–6)、沉措沿岸区(样点7–8)、羊卓雍措湖心区(样点9–10)。使用无菌采样器在距水面约50 cm处采集水样。利用多功能参数仪原位测定水样温度、pH、总溶解固体量、电导率以及盐度,每个参数测定3次。每个样点共采集5 L水样,将采集的水样分别装入2个无菌塑料桶中避光保存。一份水样立即送往拉萨景博环境监测科技有限公司测定总氮、总磷、氨氮、化学需氧量、浊度,另一份带回实验室立即分离其中的酵母菌。
表 1. 羊卓雍措水体采集样点概况 Table 1. Sampling sites information in Yamzhog Yumco Lake
| Sites | Elevation/m | Longitude | Latitude |
| 1 | 4443 | 90°44′E | 29°07′N |
| 2 | 4442 | 90°35′E | 29°11′N |
| 3 | 4443 | 90°34′E | 29°11′N |
| 4 | 4439 | 90°22′E | 29°05′N |
| 5 | 4441 | 90°23′E | 29°00′N |
| 6 | 4447 | 90°30′E | 28°59′N |
| 7 | 4431 | 90°29′E | 28°57′N |
| 8 | 4432 | 90°34′E | 28°58′N |
| 9 | 4438 | 90°41′E | 28°56′N |
| 10 | 4442 | 90°42′E | 28°55′N |
表选项
1.2 酵母菌菌株的分离及纯化 采用孔径为0.45 μm,直径为50 mm的醋酸纤维素滤膜抽滤50 mL湖水,将滤膜正置于固体培养基平板上进行培养。分离培养基为RBCH培养基、酸性PDA培养基以及酸性YM培养基,培养基组成成分等参照文献[13]。每个处理设置3个重复。培养3–5 d后进行酵母菌菌落形态观察和菌落数统计,计数后挑取单菌落接种于YM斜面进行恒温培养(28 ℃)。采用平板划线法纯化菌株后于20%甘油管中冷冻保藏(–20 ℃)。
1.3 酵母菌菌株的分子鉴定 采用rRNA ITS区域序列法进行酵母菌菌株的分析鉴定。
1.3.1 DNA提取及扩增: DNA的提取采用CTAB法[26],引物采用ITS1 (5′-TCCGTAGGTGAACC TGCGG-3′),ITS4 (5′-TCCTCCGCTTATTGATAT GC-3′)[27]。PCR反应条件为:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 60 s,35个循环;72 ℃ 7 min。1%琼脂糖凝胶检测扩增目标产物后送往生工生物工程(上海)股份有限公司测序。
1.3.2 序列分析: 对供试菌株rRNA ITS序列进行人工校对,去除引物及双峰序列后在GenBank核酸序列数据库中进行同源序列搜索,选取与供试菌株相似度99%以上的模式菌株作为比对结果。供试菌株的序列号上传至NCBI的GenBank核酸序列库,登录号为MT408608–MT408904。
1.4 羊卓雍措水体理化指标测定 pH、温度(T)、电导率(EC)、总溶解固体量(TDS)以及盐度(Salt)使用多功能参数仪(Multi- Parameter PCSTestrTM35)测定。总氮、总磷等5个理化指标由拉萨景博环境监测科技有限公司进行测定,其中氨氮(NH4+-N)、总氮(TN)、总磷(TP)使用UV5800紫外可见分光光度计进行测量,方法分别为纳氏试剂分光光度法、碱性过硫酸钾消解紫外分光光度法和钼酸铵分光光度法;化学需氧量(COD)采用重铬酸盐法进行测定,浊度采用目视比色法-福尔马肼标准进行测定。
1.5 数据处理与分析 数据处理与分析使用Excel 2019、SPSS 20.0、CANOCO 5等软件进行,绘图使用R 3.6.1和Origin 2019进行。使用Excel对Simpson多样性指数、Shannon-Wiener多样性指数以及Pielou均匀度指数进行计算,差异性分析以及相关性分析采用SPSS软件的Duncan检验法和Pearson相关性系数法进行分析。
2 结果和分析 2.1 羊卓雍措各样点水体可培养酵母菌多样性分析
2.1.1 羊卓雍措各样点水体可培养酵母菌种水平分布状况: 从羊卓雍措水体中共分离到297株酵母菌,分属于16个属25个种(表 2)。其中Cryptococcus属6个种,Naganishia属4个种,Filobasidium属2个种,其余属均仅分离到1个种。
表 2. 羊卓雍措各样点水体在种水平上可培养酵母菌的分布 Table 2. Species distribution of culturable yeasts among different sites in Yamzhog Yumco Lake
| Strains | Sampling sites | Occurrence frequency/% | Relative abundance/% | |||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |||
| Aureobasidium pullulans | 1 | 10 | 0.34 | |||||||||
| Cryptococcus adeliensis | 1 | 10 | 0.34 | |||||||||
| Cryptococcus chernovii | 3 | 1 | 1 | 1 | 40 | 2.02 | ||||||
| Cryptococcus foliicola | 3 | 1 | 2 | 30 | 2.02 | |||||||
| Cryptococcus heimaeyensis | 1 | 8 | 3 | 3 | 1 | 28 | 60 | 14.81 | ||||
| Cryptococcus oeirensis | 1 | 1 | 20 | 0.67 | ||||||||
| Cryptococcus uzbekistanensis | 3 | 1 | 20 | 1.35 | ||||||||
| Cystobasidium minutum | 1 | 1 | 20 | 0.67 | ||||||||
| Cystofilobasidium macerans | 1 | 1 | 3 | 1 | 40 | 2.02 | ||||||
| Debaryomyces hansenii | 3 | 1 | 20 | 1.35 | ||||||||
| Dioszegia fristingensis | 9 | 10 | 3.03 | |||||||||
| Filobasidium magnum | 17 | 1 | 2 | 2 | 40 | 7.41 | ||||||
| Filobasidium stepposum | 2 | 6 | 5 | 5 | 3 | 1 | 60 | 7.41 | ||||
| Holtermanniella takashimae | 1 | 10 | 0.34 | |||||||||
| Lodderomyces elongisporus | 1 | 1 | 1 | 30 | 1.01 | |||||||
| Microbotryozyma collariae | 1 | 10 | 0.34 | |||||||||
| Naganishia albida | 1 | 12 | 3 | 1 | 2 | 50 | 6.40 | |||||
| Naganishia albidosimilis | 1 | 1 | 1 | 1 | 1 | 50 | 1.68 | |||||
| Naganishia diffluens | 1 | 1 | 4 | 1 | 40 | 2.36 | ||||||
| Naganishia globosa | 1 | 1 | 2 | 1 | 40 | 1.68 | ||||||
| Pichia fermentans | 1 | 10 | 0.34 | |||||||||
| Rhodotorula mucilaginosa | 1 | 3 | 1 | 30 | 1.68 | |||||||
| Saccharomyces cerevisiae | 2 | 5 | 1 | 1 | 36 | 50 | 15.15 | |||||
| Solicoccozyma aeria | 3 | 10 | 1.01 | |||||||||
| Vishniacozyma victoriae | 4 | 14 | 21 | 18 | 2 | 5 | 2 | 6 | 1 | 90 | 24.58 | |
表选项
分析25个种的酵母菌出现频率可知,V. victoriae出现频率最高(90%),在9个样点中被分离到,其次为C. heimaeyensis和F. stepposum,在6个样点中被分离到,而A. pullulans、C. adeliensis等7个种仅在1个样点中被分离到。相对丰度表明,25种酵母菌中,V. victoriae相对丰度最高,为24.6%,其次为S. cerevisiae和C. heimaeyensis,相对丰度分别为15.2%和14.8%,而A. pullulans、C. adeliensis等5种酵母菌均仅分离到1株,相对丰度仅为0.3%。综合分析出现频率及相对丰度可知,羊卓雍措水体可培养酵母菌优势种为V. victoriae。
2.1.2 羊卓雍措各样点水体可培养酵母菌属水平分布状况: 为了更深入探讨羊卓雍措水体中分离的酵母菌菌株群落组成特征,将各酵母菌属水平分布结果整理为表 3。通过表 3可以看出,16个属中,Vishniacozyma出现频率最高,在9个样点中被分离出,其次为Naganishia,在8个样点中被分离出,Cryptococcus和Filobasidium出现频率也较高,在7个样点中被分离出。相对丰度表明,Vishniacozyma相对丰度最高,为24.6%,其次为Cryptococcus,相对丰度为21.2%。
表 3. 羊卓雍措各样点水体在属水平上可培养酵母菌的分布 Table 3. Genera distribution of culturable yeasts among different sites in Yamzhog Yumco Lake
| Strains | Sampling sites | Occurrence frequency/% | Relative abundance/% | |||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |||
| Aureobasidium | 1 | 10 | 0.34 | |||||||||
| Cryptococcus | 7 | 9 | 7 | 5 | 1 | 32 | 2 | 70 | 21.21 | |||
| Cystobasidium | 1 | 1 | 20 | 0.67 | ||||||||
| Cystofilobasidium | 1 | 1 | 3 | 1 | 40 | 2.02 | ||||||
| Debaryomyces | 3 | 1 | 20 | 1.35 | ||||||||
| Dioszegia | 9 | 10 | 3.03 | |||||||||
| Filobasidium | 19 | 7 | 7 | 5 | 2 | 3 | 1 | 70 | 14.81 | |||
| Holtermanniella | 1 | 10 | 0.34 | |||||||||
| Lodderomyces | 1 | 1 | 1 | 30 | 1.01 | |||||||
| Microbotryozyma | 1 | 10 | 0.34 | |||||||||
| Naganishia | 1 | 1 | 15 | 4 | 1 | 3 | 9 | 2 | 80 | 12.12 | ||
| Pichia | 1 | 10 | 0.34 | |||||||||
| Rhodotorula | 1 | 3 | 1 | 30 | 1.68 | |||||||
| Saccharomyces | 2 | 5 | 1 | 1 | 36 | 50 | 15.15 | |||||
| Solicoccozyma | 3 | 10 | 1.01 | |||||||||
| Vishniacozyma | 4 | 14 | 21 | 18 | 2 | 5 | 2 | 6 | 1 | 90 | 24.58 | |
表选项
2.1.3 羊卓雍措各样点水体可培养酵母菌种水平组成相似性: 为了解羊卓雍措不同样点分离的酵母菌菌株组成相似性,计算了不同样点间酵母菌的Jaccard相似度系数。从表 4可以得知,羊卓雍措各样点水体可培养酵母菌相似度系数范围为0–0.57;仅6号样点与8号样点间达到中等相似(0.50–0.75),比例为2.2%;20组样点间相似度为中度不相似(0.25–0.50),比例为44.4%;24组样点为极度不相似(0–0.25),比例为53.3%,其中有6组样点间酵母菌Jaccard相似度系数范围为0–0.10。总体而言,羊卓雍措各样点水体酵母菌在种水平上存在较大的差异。
表 4. 羊卓雍措各样点水体可培养酵母菌Jaccard相似度系数 Table 4. Jaccard coefficient of culturable yeasts among different sites in Yamzhog Yumco Lake
| Sites | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 1 | 1 | |||||||||
| 2 | 0.27 | 1 | ||||||||
| 3 | 0.40 | 0.41 | 1 | |||||||
| 4 | 0.20 | 0.24 | 0.28 | 1 | ||||||
| 5 | 0.07 | 0.38 | 0.33 | 0.31 | 1 | |||||
| 6 | 0.09 | 0.07 | 0.31 | 0.17 | 0.10 | 1 | ||||
| 7 | 0.10 | 0.27 | 0.23 | 0.30 | 0.25 | 0.17 | 1 | |||
| 8 | 0.15 | 0.13 | 0.43 | 0.21 | 0.17 | 0.57 | 0.11 | 1 | ||
| 9 | 0.29 | 0.31 | 0.44 | 0.25 | 0.21 | 0.08 | 0.30 | 0.13 | 1 | |
| 10 | 0.15 | 0.13 | 0.33 | 0.21 | 0.17 | 0.38 | 0.11 | 0.40 | 0.13 | 1 |
表选项
2.1.4 羊卓雍措不同样点水体可培养酵母菌多样性指数: 羊卓雍措水体可培养酵母菌多样性指数显示(图 1),3号样点物种数最多,2号、4号和9号样点物种数也较多。相对而言,物种数最少的为7号样点,仅有3种。从属水平来讲,2号、3号样点属数最多,其次为1号、4号、9号样点,6号样点和7号样点属数最少,仅有3个属。
 |
| 图 1 羊卓雍措各样点水体可培养酵母菌多样性指数 Figure 1 Diversity indexes of culturable yeasts in different sites from Yamzhog Yumco Lake. A: yeast species number and genera number; B: yeast counts; C: yeast diversity indexes. H′: Shannon index; D: Simpson index; J′: Pielou evenness index; The data marked with different alphabets indicated that difference between sites was significant (P < 0.05). |
| 图选项 |
为对羊卓雍措酵母菌多样性进行深入探究,利用SPSS 20.0软件对不同样点酵母菌总丰度进行差异性分析。从图 1可以看出,1号样点水体中酵母菌总丰度最高,其次为4号样点,5号样点相对较少,其余样点之间并没有显著性差异且明显少于以上3个样点(P < 0.05)。Shannon-Wiener多样性指数、Simpson多样性指数和Pielou均匀度指数显示(图 1),3号样点Shannon-Wiener多样性指数最高,其次为2号样点,10号样点Shannon-Wiener多样性指数则最低;3号和2号样点Simpson多样性指数最高,其次是8号样点,10号样点则最低。从图 1可以看出,Shannon-Wiener多样性指数和Simpson多样性指数趋势基本一致,这两个指数综合表明,3号样点和2号样点中分离到的酵母菌菌株丰富度和多样性较高。而Pielou均匀度指数的趋势则不同,6号样点中分离到的酵母菌菌株分布最均匀,其次是2号和8号样点,10号样点则最不均匀。
2.2 羊卓雍措各区域水体可培养酵母菌多样性分析
2.2.1 羊卓雍措各区域水体可培养酵母菌种水平分布状况: 为更好地对羊卓雍措水体酵母菌进行研究分析,将羊卓雍措10个采样点依照地理位置分为羊卓雍措沿岸区、空母措沿岸区、沉措沿岸区和羊卓雍措湖心区4个区域,其中1–4号样点属于羊卓雍措沿岸区、5–6号样点属于空母措沿岸区、7–8号样点为沉措沿岸区、9–10号样点为羊卓雍措湖心区。将4个区域水体酵母菌种水平分布结构总结为表 5,分析出现频率可知,C. heimaeyensis、N. diffluens、N. globosa、V. victoriae这4个种出现频率最高,在4个区域均被分离出,A. pullulans、C. adeliensis等8个种出现频率最低,仅在1个区域被分离出。
表 5. 羊卓雍措各区域水体在种水平上可培养酵母菌的分布 Table 5. Species distribution of culturable yeasts among different regions in Yamzhog Yumco Lake
| Strains | CY | CK | CC | YC | Occurrence frequency/% | Relative abundance/% |
| Aureobasidium pullulans | 1 | 25 | 0.34 | |||
| Cryptococcus adeliensis | 1 | 25 | 0.34 | |||
| Cryptococcus chernovii | 4 | 1 | 1 | 75 | 2.02 | |
| Cryptococcus foliicola | 3 | 1 | 2 | 75 | 2.02 | |
| Cryptococcus heimaeyensis | 12 | 3 | 1 | 28 | 100 | 14.81 |
| Cryptococcus oeirensis | 1 | 1 | 50 | 0.67 | ||
| Cryptococcus uzbekistanensis | 3 | 1 | 50 | 1.35 | ||
| Cystobasidium minutum | 1 | 1 | 50 | 0.67 | ||
| Cystofilobasidium macerans | 5 | 1 | 50 | 2.02 | ||
| Debaryomyces hansenii | 4 | 25 | 1.35 | |||
| Dioszegia fristingensis | 9 | 25 | 3.03 | |||
| Filobasidium magnum | 20 | 2 | 50 | 7.41 | ||
| Filobasidium stepposum | 18 | 3 | 1 | 75 | 7.41 | |
| Holtermanniella takashimae | 1 | 25 | 0.34 | |||
| Lodderomyces elongisporus | 2 | 1 | 50 | 1.01 | ||
| Microbotryozyma collariae | 1 | 25 | 0.34 | |||
| Naganishia albida | 16 | 1 | 2 | 75 | 6.40 | |
| Naganishia albidosimilis | 3 | 1 | 1 | 75 | 1.68 | |
| Naganishia diffluens | 1 | 1 | 4 | 1 | 100 | 2.36 |
| Naganishia globosa | 1 | 1 | 2 | 1 | 100 | 1.68 |
| Pichia fermentans | 1 | 25 | 0.34 | |||
| Rhodotorula mucilaginosa | 4 | 1 | 50 | 1.68 | ||
| Saccharomyces cerevisiae | 7 | 1 | 37 | 75 | 15.15 | |
| Solicoccozyma aeria | 3 | 25 | 1.01 | |||
| Vishniacozyma victoriae | 39 | 20 | 7 | 7 | 100 | 24.58 |
| CY: coastal area of Yamzhog Yumco Lake; CK: coastal area of Kongmo Co Lake; CC: coastal area of Chen Co Lake; YC: Yamzhog Yumco Lake center. | ||||||
表选项
2.2.2 羊卓雍措水体各区域可培养酵母菌属水平分布状况: 表 6数据表明,Cryptococcus、Filobasidium、Naganishia、Vishniacozyma 4个属酵母菌出现频率最高,在4个区域均有被分离出,Aureobasidium、Debaryomyces等7个属出现频率最低,均只在1个区域中被分离出。
表 6. 羊卓雍措各区域水体在属水平上可培养酵母菌的分布 Table 6. Genera distribution of culturable yeasts among different regions in Yamzhog Yumco Lake
| Genus | CY | CK | CC | YC | Occurrence frequency/% | Relativeabundance/% |
| Aureobasidium | 1 | 25 | 0.34 | |||
| Cryptococcus | 23 | 5 | 1 | 34 | 100 | 21.21 |
| Cystobasidium | 1 | 1 | 50 | 0.67 | ||
| Cystofilobasidium | 5 | 1 | 50 | 2.02 | ||
| Debaryomyces | 4 | 25 | 1.35 | |||
| Dioszegia | 9 | 25 | 3.03 | |||
| Filobasidium | 38 | 2 | 3 | 1 | 100 | 14.81 |
| Holtermanniella | 1 | 25 | 0.34 | |||
| Lodderomyces | 2 | 1 | 50 | 1.01 | ||
| Microbotryozyma | 1 | 25 | 0.34 | |||
| Naganishia | 21 | 4 | 9 | 2 | 100 | 12.12 |
| Pichia | 1 | 25 | 0.34 | |||
| Rhodotorula | 4 | 1 | 50 | 1.68 | ||
| Saccharomyces | 7 | 1 | 37 | 75 | 15.15 | |
| Solicoccozyma | 3 | 25 | 1.01 | |||
| Vishniacozyma | 39 | 20 | 7 | 7 | 100 | 24.58 |
| CY: coastal area of Yamzhog Yumco Lake; CK: coastal area of Kongmo Co Lake; CC: coastal area of Chen Co Lake; YC: Yamzhog Yumco Lake center. | ||||||
表选项
2.2.3 羊卓雍措水体各区域可培养酵母菌相似性分析: 羊卓雍措各区域水体酵母菌Jaccard相似度系数显示(表 7),各区域酵母菌相似度范围为0.32–0.61,其中仅羊卓雍措沿岸区和羊卓雍措湖心区达到中度相似水平(0.61),其余5组均为中度不相似(0.25–0.50),比例为83.3%。总体而言,羊卓雍措各区域水体酵母菌存在一定差异。
表 7. 羊卓雍措各区域水体可培养酵母菌种水平Jaccard相似度系数 Table 7. Jaccard coefficient of culturable yeasts among different regions in Yamzhog Yumco Lake
| Regions | CY | CK | CC | YC |
| CY | 1 | |||
| CK | 0.39 | 1 | ||
| CC | 0.35 | 0.46 | 1 | |
| YC | 0.61 | 0.32 | 0.33 | 1 |
| CY: coastal area of Yamzhog Yumco Lake; CK: coastal area of Kongmo Co Lake; CC: coastal area of Chen Co Lake; YC: Yamzhog Yumco Lake center. | ||||
表选项
2.2.4 羊卓雍措各区域水体可培养酵母菌多样性指数分析: 从图 2可以看出,羊卓雍措4个区域间酵母菌总丰度、Shannon-Wiener多样性指数、Simpson多样性指数以及Pielou均匀度指数均没有显著性差异(P > 0.05),从物种数上来看,沉措沿岸区显著小于羊卓雍措沿岸区(P < 0.05),从属数上来看,空母措沿岸区和沉措沿岸区则显著低于羊卓雍措沿岸区(P < 0.05)。
 |
| 图 2 羊卓雍措各区域水体可培养酵母菌多样性指数 Figure 2 Diversity indexes of culturable yeasts in different regions from Yamzhog Yumco Lake. A: yeast species number and genera number; B: yeast counts; C: yeast diversity indexes. CY: coastal area of Yamzhog Yumco Lake; CK: coastal area of Kongmo Co Lake; CC: coastal area of Chen Co Lake; YC: Yamzhog Yumco Lake center; H′: Shannon index; D: Simpson index; J′: Pielou evenness index. The data marked with different alphabets indicated that difference between sites was significant (P < 0.05). |
| 图选项 |
2.3 羊卓雍措水体理化因子
2.3.1 羊卓雍措各样点水体理化因子差异性分析: 为探究酵母菌多样性与水体理化因子之间的关系,测定了羊卓雍措水体的10个理化因子数据。由图 3可以看出,在羊卓雍措各样点水体间,10个理化因子存在不同程度的差异。就水温而言,羊卓雍措水温为10.7–25.2 ℃,其中8号样点最高,9号样点最低,除1号样点与4号样点间、2号样点和7号样点间、6号样点和7号样点间,其余样点间均存在显著差异(P < 0.05);就pH而言,羊卓雍措水体整体呈现偏碱性(8.37–9.08),其中3号样点最高,8号样点最低;就EC、TDS和Salt而言,羊卓雍措10个样点变化趋势一致,10号样点最高,5号样点最低,其中EC为523.67–2346.67 μs/cm,TDS为371.67–1666.67 mg/L,Salt为0.25–1.18 psu;10个样点NTU为3–15,其中5号样点最大,6号样点和9号样点最小;就COD和TP值而言,5号样点和7号样点均高于其他样点,其中10个样点COD范围为6.72–185.81 mg/L,5号样点最高,其次为7号样点,9号样点最低,10个样点TP范围为0.02–0.06 mg/L,5号样点和7号样点最高,1号样点最低;就TN和NH4+-N而言,9号样点这两个值均最低;5号样点TN值最高,10个样点TN范围为0.25–0.61 mg/L,7号样点NH4+-N值最高,10个样点NH4+-N范围为0.01–0.04 mg/L。
 |
| 图 3 羊卓雍措各样点水体理化因子差异性分析 Figure 3 Aquatic environmental factors of different sites in Yamzhog Yumco Lake. T: temperature; EC: electric conductivity; TDS: total dissolved salt; NTU: turbidity; COD: chemical oxygen demand; TP: total phosphorus; TN: total nitrogen; NH4+-N: ammonia nitrogen. The data marked with different alphabets indicated that difference was significant (P < 0.05). |
| 图选项 |
2.3.2 羊卓雍措各区域水体理化因子差异性分析: 通过Duncan检验法分析羊卓雍措各区域湖水理化因子的差异性(图 4),可以看出,羊卓雍措沿岸区和羊卓雍措湖心区pH显著高于沉措沿岸区和空母措沿岸区(P < 0.05);EC、TDS、Salt具有相同的变化趋势,均为羊卓雍措沿岸区和羊卓雍措湖心区显著高于沉措沿岸区,沉措沿岸区显著高于空母措沿岸区(P < 0.05);而羊卓雍措沿岸区TP则显著低于沉措沿岸区和空母措沿岸区(P < 0.05)。4个区域在其他理化因子方面则没有显著差异。
 |
| 图 4 羊卓雍措各区域水体理化因子差异性分析 Figure 4 Aquatic environmental factors of different regions in Yamzhog Yumco Lake. CY: coastal area of Yamzhog Yumco Lake; CK: coastal area of Kongmo Co Lake; CC: coastal area of Chen Co Lake; YC: Yamzhog Yumco Lake center; T: temperature; EC: electric conductivity; TDS: total dissolved salt; NTU: turbidity; COD: chemical oxygen demand; TP: total phosphorus; TN: total nitrogen; NH4+-N: ammonia nitrogen. The data marked with different alphabets indicated that difference was significant (P < 0.05). |
| 图选项 |
2.4 羊卓雍措水体可培养酵母菌多样性指数与水体理化因子相关性分析
2.4.1 羊卓雍措各样点水体理化因子与可培养酵母菌多样性指数相关性分析: 如图 5所示,各样点pH、EC、TDS以及Salt这4个理化因子间两两呈现极显著正相关(P < 0.01);TP与pH、EC、TDS和Salt之间呈现显著负相关(P < 0.05);NTU与NH4+-N以及COD之间呈极显著正相关(P < 0.01),与TN之间呈显著正相关(P < 0.05);TN与COD之间呈现显著正相关(P < 0.05);COD与EC、TDS和Salt之间呈现显著负相关(P < 0.05)。各样点物种数和属数以及Shannon-Wiener多样性指数之间分别呈极显著(P < 0.01)和显著(P < 0.05)正相关,Shannon-Wiener多样性指数与Simpson多样性指数之间以及Simpson多样性指数与Pielou均匀度指数之间呈极显著正相关(P < 0.01)。各样点水体酵母菌物种数和属数与pH之间呈现显著正相关(P < 0.05),相关性系数分别为0.77和0.82;属数与EC、TDS、Salt之间呈显著正相关(P < 0.05),相关性系数分别为0.72、0.71、0.72;属数与TP呈显著负相关(P < 0.05),相关性系数为–0.64;其他参数间则没有明显相关性。Pearson相关性分析结果表明,EC、TDS、Salt、TP、pH是影响羊卓雍措各样点酵母菌物种数和属数的主要理化因子。
 |
| 图 5 羊卓雍措各样点可培养酵母菌多样性指数及水体理化因子Pearson相关性系数 Figure 5 Pearson correlation coefficient between culturable yeasts diversity index and environmental factors of different sites in Yamzhog Yumco Lake. T: temperature; EC: electric conductivity; TDS: total dissolved salt; NTU: turbidity; COD: chemical oxygen demand; TP: total phosphorus; TN: total nitrogen; NH4+-N: ammonia nitrogen; H′: Shannon index; D: Simpson index; J′: Pielou evenness index; *: There was a significant correlation at the 0.05 level; **: There was a significant correlation at the 0.01 level. |
| 图选项 |
2.4.2 羊卓雍措各区域水体理化因子与可培养酵母菌多样性指数相关性分析: 对羊卓雍措各区域水体酵母菌多样性指数与水体理化因子进行Pearson相关性分析(图 6)发现,各区域EC、TDS以及Salt这3个理化因子间两两呈现极显著正相关(P < 0.01);NTU与NH4+-N之间呈显著正相关(P < 0.05);COD与EC、TDS以及Salt之间呈极显著负相关(P < 0.01)。各区域物种数和属数与TP呈极显著负相关(P < 0.01),其他多样性指数与水体理化因子之间则没有显著相关性。
 |
| 图 6 羊卓雍措各区域可培养酵母菌多样性指数及水体理化因子Pearson相关性系数 Figure 6 Pearson correlation coefficient between culturable yeasts diversity index and environmental factors of different regions in Yamzhog Yumco Lake. T: temperature; EC: electric conductivity; TDS: total dissolved salt; NTU: turbidity; COD: chemical oxygen demand; TP: total phosphorus; TN: total nitrogen; NH4+-N: ammonia nitrogen; H′: Shannon index; D: Simpson index; J′: Pielou evenness index; *: There was a significant correlation at the 0.05 level; **: There was a significant correlation at the 0.01 level. |
| 图选项 |
2.4.3 羊卓雍措可培养酵母菌物种分布与环境理化因子冗余分析: 为更直观地反映酵母菌与环境理化因子的关系,筛选出2项水体理化指标进行排序分析。首先进行去趋势对应分析(DCA),结果显示第一排序轴长度为2.7,表明冗余分析(RDA)更为合适。RDA分析结果显示,第1排序轴对响应变量的解释度比例为19.9%,第2排序轴为13.1%,二者总和达到33.0%。为避免冗杂,在排序图中,仅展现贡献度最高的10种酵母菌(图 7)。
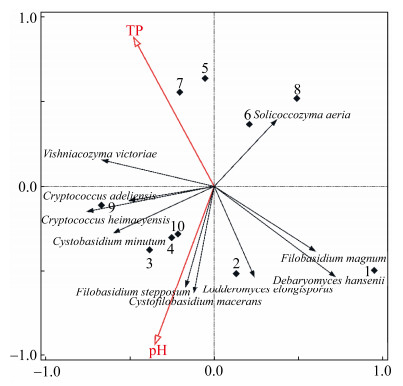 |
| 图 7 羊卓雍措水体可培养酵母菌与理化因子RDA分析排序图 Figure 7 RDA ordination diagram of culturable yeasts associated with environmental factors in Yamzhog Yumco Lake. TP: total phosphorus. |
| 图选项 |
样点分布状况显示,空母措和沉措的4个样点(5–8)距离较近且明显区分于位于羊卓雍措的样点(1–4、9、10),在位于羊卓雍措的样点中,1号样点又与其他样点相距较远。D. hansenii和F. magnum主要分布于1号样点中;C. heimaeyensis以及C. adeliensis主要分布于9号样点;S. cerevisiae主要分布于10号样点,这与表 2结果一致。
贡献度最高的10种酵母菌中,C. heimaeyensis和C. adeliensis间相关性较高;F. stepposum和C. macerans之间相关性较高;F. magnum和D. hansenii之间相关性也较高。
环境因子对酵母菌种群分布的影响在排序图中有较直观的展示,F. stepposum和C. macerans与pH之间呈正相关,S. aeria则与pH之间呈现较强的负相关,另外,L. elongisporus、D. hansenii以及F. magnum与TP之间也呈现较强的负相关。
3 讨论 从羊卓雍措水体中共分离到297株酵母菌,分属于16个属25个种,不同于其他****对云南高原湖泊水体可培养酵母菌优势种的研究结果,本研究结果显示,Vishniacozyma是羊卓雍措水体酵母菌中的优势属。V. victoriae是羊卓雍措水体酵母菌中的优势种。张瑞蕊等[28]研究发现,V. victoriae是天山一号冰川冰尘和底部沉积层可培养酵母菌的优势种,有着较强的耐低温性。由此推测,较低的年均温是V. victoriae在羊卓雍措水体中广泛分布的可能原因。
将分离得到的羊卓雍措水体酵母菌物种分布与云南5个高原湖泊进行比较发现(表 8),羊卓雍措水体酵母菌属数为16,仅次于抚仙湖和星云湖,但种数相对较少。羊卓雍措水体酵母菌总丰度为397 CFU/L,低于星云湖和杞麓湖,但高于抚仙湖、程海、阳宗海,这一方面与这些湖泊地理位置和环境因素有关,另一方面也与取样深度和距离沿岸距离等有关。由于星云湖和程海的研究没有测定理化性质,所以只对其余4个湖泊进行分析。分析发现,杞麓湖、阳宗海、抚仙湖平均EC分别为1081.93、760.58、346.63 μs/cm,而羊卓雍措平均EC为1784.60 μs/cm,所以猜测是由于EC的差异以及羊卓雍措独特的地理位置共同导致了该湖泊与其他几个高原湖泊酵母菌总丰度的差异。羊卓雍措与云南5个高原湖泊种群Jaccard相似度为0.06–0.11,均为极度不相似。6者间共有种为A. pullulans、N. albida (C. albidus)、R. mucilaginosa。相较于其他5个高原湖泊,羊卓雍措水体特有酵母菌14种,其中Dioszegia、Holtermanniella、Microbotryozyma、Saccharomyces、Solicoccozyma为羊卓雍措特有属。综合来看,羊卓雍措与云南5个高原湖泊虽都属于高原湖泊,但所分离到的酵母菌组成存在较大差异,这可能与羊卓雍措独特的地理位置和青藏高原低温、缺氧、强辐射等环境特点有关。
表 8. 羊卓雍措与云南高原湖泊可培养酵母菌分布比较 Table 8. Comparison of culturable yeasts distribution between Yamzhog Yumco Lake and plateau lakes in Yunnan province
| Sites | Specis number | Genera number | Yeast counts/(CFU/L) | Jaccard coefficient with Yamzhog Yumco Lake | Common yeast species with Yamzhog Yumco Lake |
| Chenghai Lake[31] | 22 | 14 | 189 | 0.11 | Aureobasidium pullulans, Cryptococcus albidus, Cryptococcus oeirensis, Debaryomyces hansenii, Rhodotorula mucilaginosa |
| Fuxian Lake [11] | 52 | 22 | 259 | 0.09 | Aureobasidium pullulans, Cryptococcus albidus, Cryptococcus heimaeyensis, Cystofilobasidium macerans, Debaryomyces hansenii, Lodderomyces elongisporus, Rhodotorula mucilaginosa |
| Qilu Lake[4] | 27 | 14 | 551 | 0.10 | Aureobasidium pullulans, Cryptococcus albidus, Cryptococcus foliicola, Cryptococcus uzbekistanensis, Rhodotorula mucilaginosa |
| Yangzonghai Lake [13] | 48 | 15 | 124 | 0.06 | Aureobasidium pullulans, Cryptococcus albidus, Cryptococcus uzbekistanensis, Rhodotorula mucilaginosa |
| Xingyun Lake [12] | 37 | 18 | 1298 | 0.09 | Aureobasidium pullulans, Debaryomyces hansenii, Naganishia albida, Pichia fermentans, Rhodotorula mucilaginosa |
| Yamzhog Yumco Lake | 25 | 16 | 397 | – | – |
表选项
羊卓雍措各样点水体酵母菌多样性指数与水体理化因子相关性分析显示,EC、TDS、Salt、TP、pH是影响羊卓雍措各样点水体酵母菌种数和属数的主要理化因子。分析各区域理化因子与多样性指数相关性可知,TP是影响羊卓雍措各区域水体酵母菌种数和属数的主要理化因子,国内外其他对高海拔湖泊酵母菌的研究中也有类似的结果。TN以及TP浓度影响着巴西Doce河流域可培养酵母菌属水平丰度[6],EC是影响阳宗海可培养酵母菌多样性的重要因素[13],TP和pH分别影响着杞麓湖所分离的产色素红冬孢酵母属和隐球酵母的生长[4]。
理化因子差异性分析结果表明,除TP与NTU外,各样点其余理化因子差异较为明显。各区域理化因子差异性分析结果显示,羊卓雍措沿岸区和湖心区pH、EC、TDS和Salt显著高于沉措沿岸区和空母措沿岸区。造成这种差异的原因一方面是由于流域特殊的高寒气候以及地质条件等自然因素所导致的,另一方面人类活动对流域水体理化因子亦有影响[29]。
根据地表水环境质量标准基本项目标准限值,羊卓雍措各样点TP、TN、NH4+-N均显示羊卓雍措水质为清洁,但COD值却超出限值。究其原因可能是由于沿岸部分样点水位偏低,采样时无法避免将底泥混入水样所导致的。因此羊卓雍措水体清洁程度无法用本实验理化因子数据来呈现,但这些数据作为酵母菌多样性的影响指标而言具有评价和分析意义。
各样点水体酵母菌多样性指数表明,1号样点总丰度显著高于其他样点(P < 0.05);3号样点的种数和属数均相对较多,3号样点和2号样点酵母菌多样性较高而10号样点则相对较低。分析羊卓雍措样点地理位置可以看出,1号样点位于村庄旁,较强的人为活动可能是导致1号样点总丰度显著高于其他样点的原因;3号样点EC、Salt、TDS、pH均相对较高,这是导致3号样点种数和属数以及酵母菌丰富度和多样性较高的可能原因之一;10号样点位于雍布朵寺旁,虽然EC、Salt、TDS、pH也相对较高,但样点位置是信教群众采集圣水处,人为活动频繁,推测取水活动以及就地饮水的行为是导致S. cerevisiae明显高于其他酵母菌菌种进而导致10号样点酵母菌丰富度和多样性较低的原因。从各区域水体酵母菌多样性指数可以看出,羊卓雍措沿岸区酵母菌总丰度最高,该区域酵母菌种类也最丰富,究其原因,可能是由于人类活动相对频繁所致。羊卓雍措沿岸区4个采集样点分别为秀琼村旁、羊卓雍措蓄能电站旁、羊卓雍措观景台旁、羊卓雍措西端畜牧草地旁,相对而言,空母措和沉措4个采集样点位置相对较为偏僻,游客鲜至。
Jaccard相似度分析和RDA分析均表明,羊卓雍措沿岸区和羊卓雍措湖心区之间有较为相似的酵母菌群落组成,且与空母措沿岸区和沉措沿岸区有较大差异。可见,羊卓雍措不同湖区沿岸区间酵母菌种类差异高于同一湖区沿岸区与湖心区的差异,这可能与酵母菌对理化因子的响应趋势以及同一湖区微生物易于交流有关。
近年来,越来越多的****更趋向于采用免培养的方法从宏基因组方面来分析湖泊水体酵母菌的多样性及其与理化因子的关系,ARDRA、DGGE和高通量测序等方法能够更多地发现免培养微生物类群,其中高通量测序更是能在整体微生物群落水平分析物种遗传多样性[30]。本研究所采用的可培养方法虽能为微生物资源的开发和利用提供资源,但相比免培养的研究方法,所获得的微生物种类要少,不一定能够反映羊卓雍措水体酵母菌多样性的全貌,下一步我们计划采用免培养的研究方法对羊卓雍措水体微生物多样性及系统发育进行更深入的研究。
4 结论 本研究探讨了羊卓雍措水体可培养酵母菌多样性以及水体理化因子对其的影响。结果显示,羊卓雍措水体酵母菌资源丰富,群落组成与其他高原湖泊有较大差异。人为活动对羊卓雍措水体酵母菌分布影响较大,同时发现EC、TDS、Salt、TP、pH是影响羊卓雍措各样点酵母菌种数和属数的主要理化因子,TP是影响羊卓雍措各区域酵母菌丰度和多样性的主要理化因子。pH和TP是影响羊卓雍措水体可培养酵母菌分布的主要环境因子。
References
| [1] | Seitzinger S, Harrison JA, B?hlke JK, Bouwman AF, Lowrance R, Peterson B, Tobias C, Van Drecht G. Denitrification across landscapes and waterscapes: a synthesis. Ecological Applications, 2006, 16(6): 2064-2090. DOI:10.1890/1051-0761(2006)016[2064:DALAWA]2.0.CO;2 |
| [2] | Wu QL, Jiang HL. China lake microbiome project. Bulletin of Chinese Academy of Sciences, 2017, 32(3): 273-279. (in Chinese) 吴庆龙, 江和龙. 中国湖泊微生物组研究. 中国科学院院刊, 2017, 32(3): 273-279. |
| [3] | Luo JH, Tao Y, Xing P, Wu QL. Mini-review: advances of metagenomics research for lake microbiomes. Journal of Lake Sciences, 2020, 32(1): 271-280. (in Chinese) 罗建桦, 陶晔, 邢鹏, 吴庆龙. 湖泊微生物宏基因组学研究进展. 湖泊科学, 2020, 32(1): 271-280. |
| [4] | Dong MH, Li ZY, Zhou B, Zhou Q, Yan YP, Jin FY, Li YX, Yang LY, Li SL. Diversity of cultivable yeast in Qilu Lake in winter. Acta Microbiologica Sinica, 2016, 56(4): 603-613. (in Chinese) 董明华, 李治滢, 周斌, 周巧, 严亚萍, 晋方佑, 李云霄, 杨丽源, 李绍兰. 云南高原湖泊杞麓湖冬季可培养酵母菌多样性分析. 微生物学报, 2016, 56(4): 603-613. |
| [5] | Diao XJ, Li YW, Wang SG. Effects of outbreak and extinction of algal blooms on the microbial community structure in sediments of Chaohu Lake. Environmental Science, 2015, 36(1): 107-113. (in Chinese) 刁晓君, 李一葳, 王曙光. 水华生消过程对巢湖沉积物微生物群落结构的影响. 环境科学, 2015, 36(1): 107-113. |
| [6] | Medeiros AO, Missagia BS, Brand?o LR, Callisto M, Barbosa FAR, Rosa CA. Water quality and diversity of yeasts from tropical lakes and rivers from the Rio Doce basin in southeastern Brazil. Brazilian Journal of Microbiology, 2012, 43(4): 1582-1594. DOI:10.1590/S1517-83822012000400043 |
| [7] | Silva-Bedoya LM, Ramírez-Castrilló M, Osorio-Cadavid E. Yeast diversity associated to sediments and water from two Colombian artificial lakes. Brazilian Journal of Microbiology, 2014, 45(1): 135-142. DOI:10.1590/S1517-83822014005000035 |
| [8] | Russo G, Libkind D, Sampaio JP, Van Broock MR. Yeast diversity in the acidic Rio Agrio-Lake Caviahue volcanic environment (Patagonia, Argentina). FEMS Microbiology Ecology, 2008, 65(3): 415-424. DOI:10.1111/j.1574-6941.2008.00514.x |
| [9] | Brand?o LR, Libkind D, Vaz ABM, Santo LCE, Moliné M, De García V, Van Broock M, Rosa CA. Yeasts from an oligotrophic lake in Patagonia (Argentina): diversity, distribution and synthesis of photoprotective compounds and extracellular enzymes. FEMS Microbiology Ecology, 2011, 76(1): 1-13. DOI:10.1111/j.1574-6941.2010.01030.x |
| [10] | Libkind D, Moliné M, Sampaio JP, Van Broock M. Yeasts from high-altitude lakes: influence of UV radiation. FEMS Microbiology Ecology, 2009, 69(3): 353-362. DOI:10.1111/j.1574-6941.2009.00728.x |
| [11] | Guo XF, Li ZY, Dong MH, Zhou B, Yang LY, Li SL. Spatial dynamics of yeast community and its relationship to environmental factors in Lake Fuxian, Yunnan Province. Journal of Lake Sciences, 2016, 28(2): 358-369. (in Chinese) 郭小芳, 李治滢, 董明华, 周斌, 杨丽源, 李绍兰. 云南高原湖泊抚仙湖酵母菌空间分布及其与环境因子的关系. 湖泊科学, 2016, 28(2): 358-369. |
| [12] | Li ZY, Fan ZQ, Dong MH, Tan JL, Zhou B, Yang LY, Li SL. Diversity and evaluation of carotenoids-producing of yeasts isolated from Xingyun Lake. Microbiology China, 2019, 46(6): 1309-1319. (in Chinese) 李治滢, 樊竹青, 董明华, 谭金连, 周斌, 杨丽源, 李绍兰. 云南星云湖酵母菌多样性及产类胡萝卜素的评价. 微生物学通报, 2019, 46(6): 1309-1319. |
| [13] | Yan YP, Li ZY, Dong MH, Zhou Q, Jin FY, Yang LY, Li SL. Yeasts from Yangzonghai Lake in Yunnan (China): diversity and extracellular enzymes. Acta Microbiologica Sinica, 2013, 53(11): 1205-1212. (in Chinese) 严亚萍, 李治滢, 董明华, 周巧, 晋方佑, 杨丽源, 李绍兰. 云南阳宗海酵母菌种群结构及产胞外酶测试. 微生物学报, 2013, 53(11): 1205-1212. |
| [14] | Yan LJ, Zheng MP, Qi LJ. Surface area variations of lakes in the Tibetan Plateau and their influencing factors. Science & Technology Review, 2017, 35(6): 83-88. (in Chinese) 闫立娟, 郑绵平, 齐路晶. 青藏高原湖泊湖面变迁及影响因素. 科技导报, 2017, 35(6): 83-88. |
| [15] | Guo CY, Yue LY, Zhao K, Xing P, Kong WD. Effect of preservation methods on culturable microorganisms from Tibetan Plateau lake waters. Chinese Journal of Ecology, 2018, 37(8): 2541-2548. (in Chinese) 郭春燕, 岳琳艳, 赵康, 邢鹏, 孔维栋. 水样保存方法对青藏高原湖泊可培养微生物的影响. 生态学杂志, 2018, 37(8): 2541-2548. |
| [16] | Zhe M, Zhang XQ, Sun R, Wang BW. Assessment of water quality and the pollution factors of waters in Yamzhog Yumco Basin, Tibet. Journal of Lake Sciences, 2016, 28(2): 287-294. (in Chinese) 者萌, 张雪芹, 孙瑞, 汪步惟. 西藏羊卓雍错流域水体水质评价及主要污染因子. 湖泊科学, 2016, 28(2): 287-294. |
| [17] | Yan RQ, Shen WS, Zhao W, Ouyang Y. Dynamics of suitability and conservation of the Black-Necked Crane habitats in the midstream of the Yarlung Zangbo River. Journal of Ecology and Rural Environment, 2018, 34(2): 146-152. (in Chinese) 闫瑞强, 沈渭寿, 赵卫, 欧阳琰. 雅鲁藏布江中游河谷黑颈鹤生境适宜性及其保护状况动态变化. 生态与农村环境学报, 2018, 34(2): 146-152. |
| [18] | 宋立东. 雅鲁藏布江中游河谷黑颈鹤保护区生态环境质量评价研究. 中国地质大学(北京)硕士学位论文, 2019. |
| [19] | Zhang GG, Liu DP, Qian FW, Hou YQ, Chen LX, Dai Q, Lu J. The water bird community and home range of the bar-headed goose at Yamdrok Lake in Tibet, China. Acta Ecologica Sinica, 2016, 36(4): 946-952. (in Chinese) 张国钢, 刘冬平, 钱法文, 侯韵秋, 陈丽霞, 戴强, 陆军. 西藏南部羊卓雍错水鸟群落及斑头雁活动区域特征. 生态学报, 2016, 36(4): 946-952. |
| [20] | Liu DP, Zhang GG, Qian FW, Hou YQ, Dai M, Jiang HX, Lu J, Xiao WF. Population, distribution and home range of wintering bar-headed goose along Yaluzangbu River, Tibet. Acta Ecologica Sinica, 2010, 30(15): 4173-4179. (in Chinese) 刘冬平, 张国钢, 钱法文, 侯韵秋, 戴铭, 江红星, 陆军, 肖文发. 西藏雅鲁藏布江中游斑头雁的越冬种群数量、分布和活动区. 生态学报, 2010, 30(15): 4173-4179. |
| [21] | Wang CQ, Zhang WJ, Deji ZM, Deng SM, Liang S, Miao YJ. Responses to water and salt stress on seed germinationm of Elymus nutans in Nagarzê County, Tibet. Seed, 2018, 37(7): 39-43. (in Chinese) 王传旗, 张文静, 德吉卓玛, 邓时梅, 梁莎, 苗彦军. 西藏浪卡子县野生垂穗披碱草种子萌发对水盐胁迫的响应. 种子, 2018, 37(7): 39-43. DOI:10.3969/j.issn.1000-8071.2018.07.020 |
| [22] | 郑有坤. 青藏高原土壤放线菌的多样性及其对三七根腐病的生防潜力. 云南大学硕士学位论文, 2015. |
| [23] | Shi Y, Sun HB, Liu YQ, Hou JZ, Zhu LP, Chu HY. Vertical distribution of bacterial community in sediments of freshwater lake Puma Yumco and saline lake AWongco on the Tibetan Plateau. Microbiology China, 2014, 41(11): 2379-2387. (in Chinese) 时玉, 孙怀博, 刘勇勤, 侯居峙, 朱立平, 褚海燕. 青藏高原淡水湖普莫雍错和盐水湖阿翁错湖底沉积物中细菌群落的垂直分布. 微生物学通报, 2014, 41(11): 2379-2387. |
| [24] | Chu D, Pu Q, Laba ZM, Zhu LP, Zhang XQ, Pubu CR, Deji YZ, Sun R. Remote sensing analysis on lake area variations of Yamzho Yumco in Tibetan Plateau over the past 40 a. Journal of Lake Sciences, 2012, 24(3): 494-502. (in Chinese) 除多, 普穷, 拉巴卓玛, 朱立平, 张雪芹, 普布次仁, 德吉央宗, 孙瑞. 近40a西藏羊卓雍错湖泊面积变化遥感分析. 湖泊科学, 2012, 24(3): 494-502. DOI:10.3969/j.issn.1003-5427.2012.03.024 |
| [25] | Zhang XQ, Sun R, Zhu LP. Lake water in the Yamzhog Yumco basin in South Tibetan Region: quality and evaluation. Journal of Glaciology and Geocryology, 2012, 34(4): 950-958. (in Chinese) 张雪芹, 孙瑞, 朱立平. 藏南羊卓雍错流域主要湖泊水质状况及其评价. 冰川冻土, 2012, 34(4): 950-958. |
| [26] | Sun LF, Zhang YH, Pei KQ. A rapid extraction of genomic DNA from fungi. Mycosystema, 2009, 28(2): 299-302. (in Chinese) 孙立夫, 张艳华, 裴克全. 一种高效提取真菌总DNA的方法. 菌物学报, 2009, 28(2): 299-302. |
| [27] | White TJ, Bruns T, Lee S, Taylor J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics//PCR protocols: a guide to methods and applications. San Diego: Academic Press, 1990: 315–322. |
| [28] | Zhang RR, Xue M, Li NN, Jin YM, Wei XJ, Ni YQ. Phylogeny and diversity of culturable yeasts in supraglacial cryoconite and subglacial sediments of the Glacier No.1 in Tianshan Mountains. Acta Microbiologica Sinica, 2019, 59(2): 334-348. (in Chinese) 张瑞蕊, 薛梅, 李宁宁, 靳亚梅, 魏小晶, 倪永清. 天山一号冰川表面冰尘和底部沉积层中可培养酵母菌系统发育类群的分布及生态生理特征. 微生物学报, 2019, 59(2): 334-348. |
| [29] | Sun R, Zhang XQ, Zheng D. Spatial variation and its causes of water chemical property in Yamzhog Yumco Basin, South Tibet. Acta Geographica Sinica, 2013, 68(1): 36-44. (in Chinese) 孙瑞, 张雪芹, 郑度. 藏南羊卓雍错流域水化学区域差异及其成因. 地理学报, 2013, 68(1): 36-44. |
| [30] | Shen S. Community structure and diversity of culturable moderate halophilic bacteria isolated from Qrhan Salt Lake on Qinghai-Tibet Plateau. Acta Microbiologica Sinica, 2017, 57(4): 490-499. (in Chinese) 沈硕. 青藏高原察尔汗盐湖地区可培养中度嗜盐菌的群落结构与多样性. 微生物学报, 2017, 57(4): 490-499. |
| [31] | Li ZY, Zhou XL, Zhou B, Dong MH, Wang YX, Yang LY, Li SL. Diversity and extracellular enzymes of yeasts from Chenghai Lake in winter. Mycosystema, 2017, 36(2): 177-185. (in Chinese) 李治滢, 周新丽, 周斌, 董明华, 王永霞, 杨丽源, 李绍兰. 云南程海湖冬季酵母菌多样性及胞外酶活性研究. 菌物学报, 2017, 36(2): 177-185. |
