霍娆娆1, 孙钦秒2

 , 王晓娜2
, 王晓娜2

1. 中国科学技术大学生命科学与医学部, 安徽 合肥 230022;
2. 中国科学院动物研究所, 北京 100101
收稿日期:2020-08-17;修回日期:2020-11-08;网络出版日期:2021-02-03
基金项目:国家自然科学基金(31970895)
*通信作者:孙钦秒, Tel/Fax: +86-10-64807318; E-mail: qinmiaosun@ioz.ac.cn;
王晓娜, Tel/Fax: +86-10-64807318; E-mail: xiaonayn@126.com.
摘要:[目的] 利用RNA-Seq,分析人巨噬细胞在牛痘病毒(VACV)感染前后基因表达的变化,探索牛痘病毒与宿主细胞相互作用的机制。[方法] 用牛痘病毒感染人巨噬细胞,采用RNA-Seq比较感染组和对照组的差异表达基因,并进行KEGG、GO以及STRING网络分析。[结果] 感染组与对照组相比,筛选出显著性差异表达基因4796个,其中上调表达2416个,下调表达2380个。KEGG富集分析表明差异基因主要参与新陈代谢、信号转导、免疫系统和感染疾病等通路。GO功能注释显示这些基因富集在细胞功能调控、物质代谢和免疫调控等生命过程。运用STRING在线蛋白互作数据库,对NOD样信号通路进行分析,鉴定出以JUN、CHUK、IL1B和PYCARD为核心的调控基因。[结论] 牛痘病毒感染可以诱导人巨噬细胞基因差异性表达,涉及的生物学过程有很多,对免疫相关的信号通路进行深入的分析,发现C型凝集素受体信号通路(C-type lectin receptor signaling pathway)、Toll样受体信号通路以及NOD样通路等多条通路可能参与调控牛痘病毒感染引起的炎症反应,该研究为解析牛痘病毒的感染机制和免疫逃逸机制以及其在临床上治疗感染性疾病和癌症提供了新思路。
关键词:RNA-Seq基因差异表达牛痘病毒巨噬细胞
RNA-Seq analysis of gene expression profile of human macrophages infected by vaccinia virus
Huo Raorao1, Sun Qinmiao2

 , Wang Xiaona2
, Wang Xiaona2

1. Department of Life Science and Medicine, University of Science and Technology of China, Hefei 230022, Anhui Province, China;
2. Institute of Zoology, Chinese Academy of Sciences, Beijing 100101, China
Received: 17 August 2020; Revised: 8 November 2020; Published online: 3 February 2021
*Corresponding author: Qinmiao Sun, Tel/Fax: +86-10-64807318; E-mail: qinmiaosun@ioz.ac.cn;
Xiaona Wang, Tel/Fax: +86-10-64807318; E-mail: xiaonayn@126.com.
Foundation item: Supported by the National Natural Science Foundation of China (31970895)
Abstract: [Objective] In this study, we used high throughput sequencing (RNA-Seq) to investigate the gene expression profiles in human monocyte-derived macrophages (THP-1) before and post-infection of vaccinia virus (VACV). [Methods] We analyzed differentially expressed genes in human macrophages with and without vaccinia virus infection by RNA-seq and performed the KEGG, GO, and STRING network analysis to study the immune-related signal alterations during infection. [Results] A total of 4796 genes were differentially expressed (2416 genes upregulated and 2380 genes downregulated) of VACV treatment THP-1 versus control. Further KEGG enrichment analysis shows that differential genes expression in VACV treatment THP-1 cells were mainly involved in metabolism, signal transduction, immune system, infectious diseases and other pathways. Gene Ontology (GO) functional annotation indicated that these genes were mainly enriched on cell function regulation, metabolism, immune regulation and other life processes. The STRING online database analysis showed that JUN, CHUK, IL1B, PYCARD protein were higher in the infected THP-1 cells. [Conclusion] Vaccinia virus can induce the differential expression of various genes in host cells, and multiple biological processes. We conducted in-depth analysis of immune-related signal pathways, and found the C-type lectin receptor-, NOD-like receptor-, and Toll-like receptor- signaling pathway are involved in inflammation responses induced by vaccinia virus infection. These results provide new insights not only in exploring the mechanism of interaction between vaccinia virus and host, but also in applying it in treatments of infectious diseases and cancers.
Keywords: RNA-Seqdifferentially expressed genesvaccinia virusmacrophages
牛痘病毒(vaccinia virus,VACV),是正痘病毒家族的一个成员,包含大约200 kb的dsDNA基因组,在胞浆内复制,其转录翻译的蛋白,可以调节宿主先天免疫反应[1-2]。牛痘病毒在消除天花疾病中起着重要的作用,研究还发现表达外源基因的重组牛痘病毒株有可能作为新的应用疫苗甚至是多价疫苗,诱导抗体产生以及T细胞对外源抗原的免疫反应[3-4]。近年来,它还被作为一种溶瘤病毒用于癌症的治疗[5]。同时,牛痘病毒被广泛用于研究DNA病毒感染与宿主免疫反应的相互作用。牛痘病毒编码的蛋白会抑制先天性免疫反应,进而发生免疫逃逸。目前对于牛痘病毒感染与宿主免疫反应的相互关系仍存在很多未知的调控机制。
RNA-Seq测序技术具有高灵敏度,能够检测到细胞中少至几个拷贝的稀有转录本,实现样品的多路复用,并去除PCR重复的测序读数,进行高通量测序,不仅是细菌基因表达的首选方法[6],也广泛应用于动植物等生物体单细胞测序。RNA-Seq是现代科学深度测序技术进行转录组分析的先进方法。使用这种方法的研究已经改变了我们对真核转录组的范围和复杂性的看法。与其他方法相比,RNA-Seq还可以更准确地测量转录本及其同工型的水平[7]。近些年来,RNA-Seq技术被用于真核生物单细胞无偏、高分辨率、高通量测序;在哺乳动物胚胎、器官发育、以及在免疫学、肿瘤治疗、表观遗传学和常见疾病等方面的研究中发挥了重要作用[8-10]。
已有相关文献报道,RNA-Seq技术用于探索病毒与宿主相互作用机制的研究,如在登革热病毒(DENV)感染外周血单核细胞以及牛病毒性腹泻病毒(BVDV)感染细胞的研究中,通过RNA-Seq分析感染后细胞基因差异表达情况,发现某些基因在抗病毒免疫中发挥重要作用[11-12]。RNA-Seq技术的应用,为研究病毒和宿主细胞的相互作用关系提供便利,同时也促进科学研究的发展。在本文中,为研究牛痘病毒和宿主细胞的相互关系,我们用牛痘病毒感染人巨噬细胞,利用RNA-Seq技术对感染前后人巨噬细胞中基因表达的差异进行分析,以期为进一步解析牛痘病毒与宿主相互作用的分子机制提供新的线索,并为改良牛痘病毒溶瘤的能力提供新的思路。
1 材料和方法 1.1 实验材料、试剂 实验材料:细胞系:人单核细胞(THP-1);病毒:牛痘病毒(VACV),来源于中国科学院微生物所方敏老师研究组;5% CO2/37 ℃的恒温无菌培养箱;细胞培养皿;低速离心机;试剂:RPMI-1640完全培养基购自HyClone公司;胎牛血清购自VISTECH公司;PBS缓冲液,实验室配制;双抗购自Thermo Fisher Scientific公司;PMA (佛波酯)购自Sigma公司;Trizol购自天根生物公司。
1.2 细胞培养 复苏细胞:从液氮中取出细胞,立刻将其放入37 ℃水浴锅,迅速晃动冻存管,使其快速融化,低速离心,转移至超净台,弃上清;细胞培养:用1640培养基将细胞重悬,移至悬浮培养皿,加入适量的培养基,放入恒温箱进行细胞培养(5% CO2/37 ℃)。
1.3 病毒感染 通过细胞计数板对THP-1细胞进行计数,取细胞数量5×106个,铺于贴壁培养皿中,使用PMA (20 nm/L)处理24 h使其分化为巨噬细胞。首先进行不同时间和不同量的牛痘病毒感染预实验,发现用2 MOI的病毒刺激细胞9 h,既能较强地激活下游相关信号通路,又能避免细胞的死亡。因此感染组使用2 MOI的病毒感染9 h的细胞,未感染的细胞作为对照。每个处理设置3个重复。
1.4 RNA制备 收集6份细胞样品,各加入1 mL的Trizol,吹打均匀,冰上裂解10 min;加入200 μL的三氯甲烷,上下摇晃,充分混匀;4 ℃、12000 r/min离心;取500 μL上清至新的1.5 mL的RNase-free EP管中,勿吸到中间蛋白质层;加入等体积500 μL的异丙醇,上下摇匀,4 ℃、12000 r/min离心;弃上清,注意不要吸走沉淀;加入1 mL 75%的RNase-free的乙醇,4 ℃、12000 r/min离心,重复步骤;弃上清,打开离心管的管盖,在冰上放置让乙醇挥发,再加入20 μL RNase-free的水溶解。测浓度后–80 ℃保存样品。
1.5 转录组测序 将提取完成的RNA,通过NanoDrop仪器检测RNA浓度。对照组和实验组各有3个RNA样本的重复,后续测序文库构建及RNA-seq测序由贝瑞和康完成。文库构建:使用NEBNext?Ultra II定向RNA库制备试剂盒(美国New England Biolabs,Inc.)构建Illumina Truseq文库,使用NovaSeq平台进行测序。配对末端读取长度为150 bp。
1.6 数据处理与分析 通过质控软件fastp[13]对原始数据(raw reads)进行数据过滤,参数为“-q 3 -u 50”,去除接头序列、空读序列以及低质量序列。过滤后的数据使用Hista2[14]软件将质控后的实验组和对照组的测序数据与参考基因序列进行比对;参考基因组为Hg38,基因信息均从NCBI数据库下载。通过featureCounts软件[15],使用基于Count计数的基因表达矩阵进行基因差异表达分析和多重校验P值,通过R语言程序包DESeq2[16]对两组样品进行基因差异表达分析,然后以“P-value≤0.01,且差异倍数在2倍以上”为标准,筛选显著差异基因。对差异表达基因进行KEGG富集分析和GO功能分析以及STRING在线数据库进行蛋白互作网络分析。将原始数据上传到NCBI网站数据库(https://www.ncbi.nlm.nih.gov/geo),编号为:GSE156003。
2 结果和分析 2.1 测序质量评估 阴性对照组、牛痘病毒感染的实验组的raw data经质控处理,分别获得68270636条和58430410条reads,在原始数据中,Q20≥95%和Q30≥90%。说明本次转录组测序质量可信度较高。
2.2 差异表达基因KEGG富集分析 牛痘病毒处理组与对照组相比,人巨噬细胞显著差异表达基因4796个,其中上调表达基因2416个,下调表达基因2380个;通过KEGG功能富集分析,共得到323个信号通路的功能注释,显著性注释信号通路27个。将富集程度排名前20的信号通路以图形化方式展示,其生物学过程以及涉及基因数目如图 1所示,其中与疾病相关信号通路有癌症中的转录失调(56)、心律失常性右室心肌病(ARVC)(25)、癌症的途径(118)、癌症中的MicroRNA (41)、扩张型心肌病(DCM)(29)、肥厚型心肌病(HCM)(27)、急性粒细胞白血病(20)和军团菌病(23);免疫相关信号通路:C型凝集素受体信号通路(32)、NOD样受体信号通路(46)和FcγR介导的吞噬作用(27);还发现与代谢相关的信号通路:类固醇生物合成(9)、糖胺聚糖的生物合成-硫酸软骨素/硫酸皮肤素(9)。这些结果表明牛痘病毒感染可能会与机体一些疾病形成有关,同时参与调控体内免疫反应,而糖胺聚糖和类固醇物质的合成在调控机体抗原识别、免疫反应以及机体发展中占重要地位。
 |
| 图 1 KEGG信号通路散点图 Figure 1 Scatter diagram of KEGG signal pathway. Horizontal axis: rich factor; vertical axis: signal pathway. Rich factor: the ratio of the number of differentially expressed genes in a signal pathway to the all annotated genes; only the top 20 gene regulation entries are displayed. |
| 图选项 |
为更全面且有针对性地综合分析其生物学效应,将各信号通路根据所注释的功能归类整理,如图 2所示,发现差异表达基因主要富集在新陈代谢(metabolism)、信号转导(signal transduction)、内分泌系统(endocrine system)、免疫系统(immune system)、感染疾病(infections diseases)、癌症相关途径(cancers),表明牛痘病毒感染THP-1细胞会影响机体免疫反应、信号转导以及相关疾病的形成。为研究牛痘病毒感染THP-1细胞引起机体免疫反应的调控机制,我们整理了本次测序结果中基因差异显著性较高的免疫系统信号通路包括:NOD样受体信号通路、趋化因子信号通路、C型凝集素受体信号通路、白细胞跨内皮迁移、FcγR介导的吞噬作用、Toll样受体信号通路、细胞内的DNA识别通路和RIG-I样受体的信号通路等主要信号通路(表 1)。
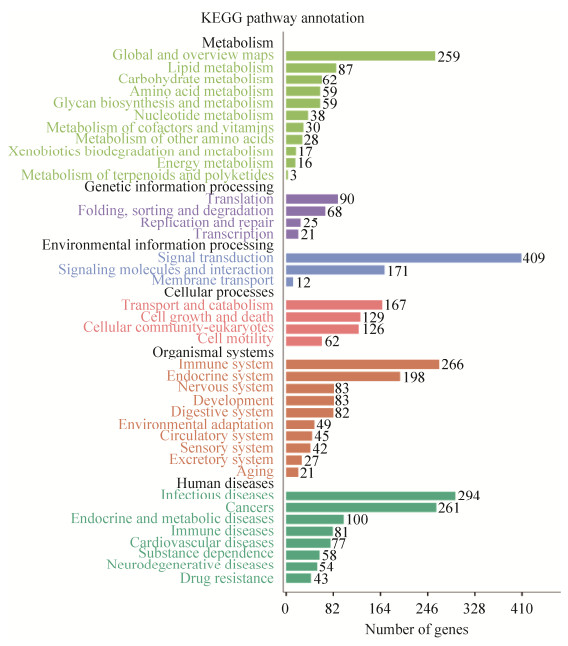 |
| 图 2 KEGG信号通路条形图 Figure 2 KEGG signal pathways bar chart. |
| 图选项 |
表 1. 免疫相关信号通路 Table 1. Immune-related signaling pathways
| Category | Some classical signaling pathways | Number of genes |
| ko04625 | C-type lectin receptor signaling pathway | 32 |
| ko04666 | Fc gamma R-mediated phagocytosis | 27 |
| ko04621 | NOD-like receptor signaling pathway | 46 |
| ko04670 | Leukocyte transendothelial migration | 30 |
| ko04062 | Chemokine signaling pathway | 44 |
| ko04611 | Platelet activation | 30 |
| ko04662 | B cell receptor signaling pathway | 18 |
| ko04657 | IL-17 signaling pathway | 21 |
| ko04610 | Complement and coagulation cascades | 19 |
| ko04623 | Cytosolic DNA-sensing pathway | 14 |
| ko04622 | RIG-I-like receptor signaling pathway | 15 |
| ko04664 | Fc epsilon RI signaling pathway | 12 |
| ko05323 | Toll-like receptor signaling pathway | 29 |
表选项
2.3 差异表达基因进行GO功能分析 图 3为从生物过程、细胞组分和分子功能水平对牛痘病毒处理组中显著性差异表达基因进行GO聚类分析,结果显示在牛痘病毒刺激下,基因表达量显著上调或下调,主要涉及细胞功能调控、物质代谢、免疫调控、酶活调控、信号转导和转录因子活性等重要生命活动。同时我们对差异表达比较显著的免疫信号通路进行整理分析时,发现C型凝集素受体信号通路、NOD样受体信号通路以及Toll样通路基因表达显著性比较高。我们分析了这3条信号通路中主要的基因表达差异情况,所得结果如图 4所示。这3条信号通路在调控免疫反应中占据重要地位,在此次RNA-Seq分析中基因差异表达显著,NOD样受体信号通路上调表达基因有:CXCL8、TRAF2、JUN、NLRP1、TP53BP1、CHUK、CASP1、NFKBIA等,下调表达基因有:BCL2L1、BCL2、TAB1、OAS1、OAS3、AIM2、IL1B、IKBKE、PRKCD等;Toll样受体信号通路上调表达基因有:CTSK、CXCL8、CHUK、JUN、NFKBIA等,下调表达基因有:TAB1、IL12A、CD14、IL1B、TLR4、IKBKE等;C型凝集素受体信号通路上调表达基因有:JUN、CHUK、MALT1、MAP3K14、CYLD、SRC等,下调基因有:KRAS、EGR2、IL12A、SYK、CLEC7A、CD209等。因此,我们推测牛痘病毒感染THP-1细胞会引起多种免疫信号通路的激活,并通过影响基因表达量上调或下调,调控机体免疫应答。
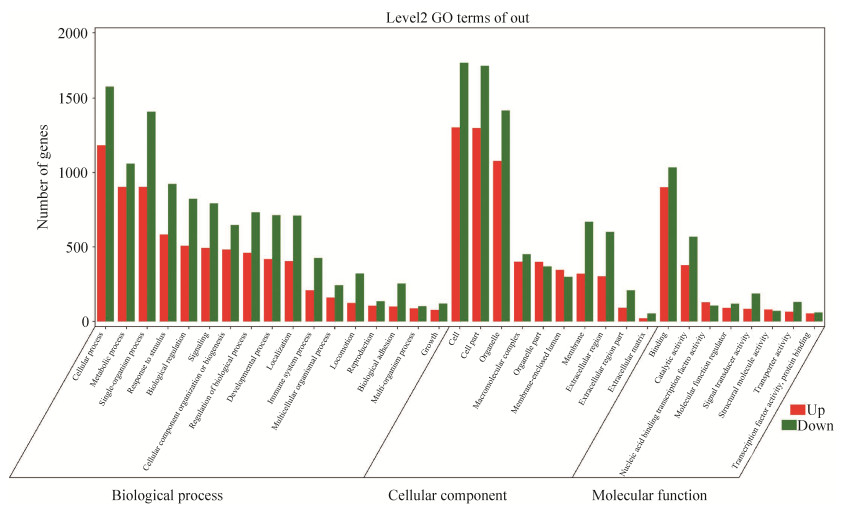 |
| 图 3 牛痘病毒处理人巨噬细胞差异表达基因功能分析图 Figure 3 Functional group categories and canonical pathway of differentially expressed genes in vaccinia virus treated human macrophages. Up-regulated (red) and down-regulated (green). |
| 图选项 |
 |
| 图 4 牛痘病毒处理人巨噬细胞引起免疫相关信号通路差异表达基因 Figure 4 Heat maps show the differentially expressed genes in the immune-related signaling pathways induced by Vaccinia virus treatment in human macrophages. |
| 图选项 |
2.4 差异表达基因相互作用功能分析 牛痘病毒感染的人巨噬细胞,其差异表达基因相互作用涉及信号通路多,存在较为复杂的调控机制。以NOD样信号通路中差异表达基因为例,通过STRING在线数据库分析得到蛋白相互作用网络图(图 5),发现此信号通路是以JUN、CHUK、IL1B、PYCARD和TLR4等蛋白为核心的调控机制。进一步对筛选的全部显著差异表达基因进行分析,发现节点比较高的蛋白有GNB3、TACR2、FFAR3、YPEL4、AMBP、TACR2、VANGL2、S1PR5、OXGR1、EGF、FOXD3、IGF1/2、PROM、F5、EPCAM、FIGF等,由于结构网络复杂程度高,不再通过图例展示。
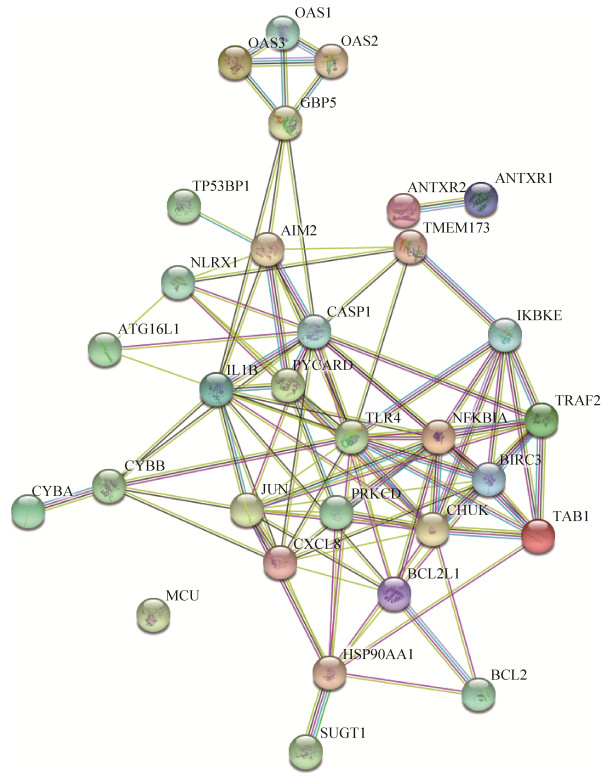 |
| 图 5 蛋白相互作用网络图 Figure 5 Protein interaction network diagram. Straight line represents the direct action, line colors represent the different modes of action between the proteins, and the thickness of the line represents the action intensity. |
| 图选项 |
3 讨论 牛痘病毒是一种外源病原微生物,当其侵入机体后,会引起一系列的机体免疫反应。在维持免疫平衡的过程中,机体会表现出非常复杂的调控机制[17]。目前,对牛痘病毒调控机体免疫应答的研究已经有不少,如牛痘病毒编码用于抵抗宿主的蛋白,辅助其免疫逃逸进而感染机体[18-19];牛痘病毒可激起天然免疫反应和适应性免疫反应,如与巨噬细胞相互作用、诱导抗体分泌以及T细胞家族成员Th1、Th2分化[20]等。我们的RNA-Seq分析表明,牛痘病毒感染后,人巨噬细胞基因显著差异表达数目达4796个,涉及信号通路323个,这说明两者之间有着较为密切的相互作用机制,但目前对于牛痘病毒和宿主细胞的相互关系以及调控机制仍然还有很多未知。本文利用RNA-Seq技术研究了人巨噬细胞在感染牛痘病毒前后基因表达的差异,并对差异基因进行了较系统的分析。本研究主要通过对KEGG信号通路、GO功能富集和STRING蛋白互作网络的研究,解析揭示牛痘病毒与人巨噬细胞的互作机制。
在分析RNA-Seq数据时发现大量差异基因表达富集在外源病原菌感染信号通路,如军团菌病、沙门氏菌感染和志贺氏菌等信号通路,说明牛痘病毒作用于人巨噬细胞会引起比较广泛的免疫反应,激活不同的病原菌信号通路进行免疫防御,表明牛痘病毒可能与外源病原菌感染途径具有一定的相似性。进一步通过RNA-Seq分析发现,牛痘病毒对人巨噬细胞的重要生命活动过程也都产生了广泛影响,如在新陈代谢、信号转导、内分泌系统、免疫系统、感染疾病和癌症相关途径等信号通路基因差异性表达显著。这些结果显示,牛痘病毒可以通过调控多种信号通路来调节机体的生命活动甚至是影响疾病的发生。
为针对性地研究牛痘病毒感染引起机体免疫反应的调控机制,我们分析了参与免疫反应的主要相关信号通路,其中天然免疫信号通路相关的基因蛋白表达差异性显著,如C型凝集素受体信号通路、细胞内的DNA识别通路、RIG-I样受体的信号通路以及Toll、NOD样通路等。有趣的是这些信号通路都参与调控机体的炎症反应。由此可知牛痘病毒可以通过调控多条信号通路调控机体的炎症免疫反应。其中牛痘病毒通过不同的病毒蛋白抑制细胞内的Toll信号通路、DNA识别通路和RIG-I样受体的信号通路来逃逸机体的免疫反应已多有报道[21-23]。而对牛痘病毒通过NOD样信号通路和C型凝集素受体信号通路介导的炎症反应鲜有报道,因此这里我们主要针对这两条信号通路进行分析。
NLRP是NOD样受体家族成员的一类受体,它含有多个成员。当配体和这些受体结合后,可以募集重要的接头蛋白凋亡相关斑点样蛋白ASC (又称PYCARD),并进一步招募半胱天冬酶蛋白酶前体,形成炎症小体,并活化CASP1,进而促进炎症因子IL-1B和IL-18成熟以及促使其分泌到细胞外,消除病毒感染的细胞。通过我们的RNA-Seq结果发现牛痘病毒感染能诱导NLRP1、PYCARD和IL-1B的升高,并发现TRAF2和TAB1这些参与NF-κB激活的重要分子也增加,而NF-κB的激活是诱导IL-1B和IL-18的前体产生所必需的。有趣的是我们还发现AIM2、TLR4和NLRX1这些也参与炎症反应的重要分子含量减少。这些结果表明牛痘病毒感染既能激活NLRP1介导的信号通路进而诱导产生炎症反应,同时又能抑制AIM2和NLRX1等参与炎症的信号通路,从而维持炎症反应的平衡。至于这几条信号通路是如何协同调控牛痘病毒感染引起免疫反应还有待进一步的深入研究。
非常有趣的是我们发现牛痘病毒引起C型凝集素受体信号通路差异表达基因显著性高,此信号通路在抵抗外源真菌、细菌、寄生虫以及病毒的免疫应答中发挥重要作用[24]。C型凝集素家族成员具有多种生理功能,如在炎症和抗菌免疫方面、调控机体自身免疫病方面和癌症转移扩散过程中发挥作用,但具体调控机制不是特别清楚。牛痘病毒引起C型凝集素受体信号通路上调表达的基因代表有MALT1、MAP3K14、CYLD、SRC,下调基因有KRAS、EGR2、SYK、CD209等基因。值得注意的是,此信号通路成员在调控癌症形成以及识别抗原过程中具有双重作用,CD209 (DC-SIGN)蛋白促进癌细胞与血小板、白细胞以及与内皮细胞的相互作用,其他成员则具有抑制癌症发生的功能[25];CD207蛋白可以识别并清除HIV病毒,而CD209蛋白可以破坏机体识别HIV病毒[26-27]。此次对牛痘病毒处理后的人巨噬细胞进行RNA-Seq分析,发现dsDNA牛痘病毒感染引起CD209蛋白表达量下调,此蛋白在癌症迁移方面扮演重要角色,这为解析通过牛痘疫苗抑制癌细胞转移和增强机体抵抗病毒的能力提供新的思路。SYK激酶与下游CARD9、BCl-10和MAlT1蛋白相互作用可以诱导下游信号传导,这些信号分子主要是诱导NF-κB依赖性的促炎反应,牛痘病毒感染引起SYK蛋白表达量下调,进而调节机体的炎症程度,防止炎症反应过度。有关C型凝集素受体信号通路在牛痘病毒感染引起的炎症反应中的作用和调控机制还有待更深入的探讨。
总之,本研究通过应用RNA-seq技术对牛痘病毒与宿主细胞的相互关系进行了更进一步的探索,发现牛痘病毒感染能调控C型凝集素受体信号通路、细胞内的DNA识别通路、RIG-I样受体的信号通路以及Toll、NOD样通路等多条通路,这为解析牛痘病毒的感染机制和免疫逃逸机制以及其在临床上治疗感染性疾病和癌症提供了一些新的线索。
References
| [1] | Bhattacharya S, Campani CEDP. Re-assessing the foundations: worldwide smallpox eradication, 1957-67. Medical History, 2020, 64(1): 71-93. DOI:10.1017/mdh.2019.77 |
| [2] | Ramírez M, Santos S, Martínez O, Rodríguez R, Miranda E, Ramos-Perez WD, Otero M. Characterization of the immune response elicited by the vaccinia virus L3 protein delivered as naked DNA. Vaccine, 2018, 36(15): 2049-2055. DOI:10.1016/j.vaccine.2018.02.033 |
| [3] | Panicali D, Davis SW, Weinberg RL, Paoletti E. Construction of live vaccines by using genetically engineered poxviruses: biological activity of recombinant vaccinia virus expressing influenza virus hemagglutinin. Proceedings of the National Academy of Sciences of the United States of America, 1983, 80(17): 5364-5368. DOI:10.1073/pnas.80.17.5364 |
| [4] | Bennink JR, Yewdell JW, Smith GL, Moller C, Moss B. Recombinant vaccinia virus primes and stimulates influenza haemagglutinin-specific cytotoxic T cells. Nature, 1984, 311(5986): 578-579. DOI:10.1038/311578a0 |
| [5] | Potts KG, Irwin CR, Favis NA, Pink DB, Vincent KM, Lewis JD, Moore RB, Hitt MM, Evans DH. Deletion of F4L (ribonucleotide reductase) in vaccinia virus produces a selective oncolytic virus and promotes anti-tumor immunity with superior safety in bladder cancer models. EMBO Molecular Medicine, 2017, 9(5): 638-654. DOI:10.15252/emmm.201607296 |
| [6] | Poulsen LD, Vinther J. RNA-Seq for bacterial gene expression. Current Protocols in Nucleic Acid Chemistry, 2018, 73(1): e55. DOI:10.1002/cpnc.55 |
| [7] | Wang Z, Gerstein M, Snyder M. RNA-Seq: a revolutionary tool for transcriptomics. Nature Reviews Genetics, 2009, 10(1): 57-63. DOI:10.1038/nrg2484 |
| [8] | Tang FC, Barbacioru C, Bao SQ, Lee C, Nordman E, Wang XH, Lao KQ, Surani MA. Tracing the derivation of embryonic stem cells from the inner cell mass by single-cell RNA-Seq analysis. Cell Stem Cell, 2010, 6(5): 468-478. DOI:10.1016/j.stem.2010.03.015 |
| [9] | Bj?rklund ?K, Forkel M, Picelli S, Konya V, Theorell J, Friberg D, Sandberg R, Mj?sberg J. The heterogeneity of human CD127+ innate lymphoid cells revealed by single-cell RNA sequencing. Nature Immunology, 2016, 17(4): 451-460. DOI:10.1038/ni.3368 |
| [10] | Zheng CH, Zheng LT, Yoo JK, Guo HH, Zhang YY, Guo XY, Kang BX, Hu RZ, Huang JY, Zhang QM, Liu ZZR, Dong MH, Hu XD, Ouyang WJ, Peng JR, Zhang ZM. Landscape of infiltrating T cells in liver cancer revealed by single-cell sequencing. Cell, 2017, 169(7): 1342-1356. DOI:10.1016/j.cell.2017.05.035 |
| [11] | Zanini F, Robinson ML, Croote D, Sahoo MK, Sanz AM, Ortiz-Lasso E, Albornoz LL, Rosso F, Montoya JG, Goo L, Pinsky BA, Quake SR, Einav S. Virus-inclusive single-cell RNA sequencing reveals the molecular signature of progression to severe dengue. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(52): E12363-E12369. DOI:10.1073/pnas.1813819115 |
| [12] | Liu C, Liu YH, Liang L, Cui SJ, Zhang YM. RNA-Seq based transcriptome analysis during bovine viral diarrhoea virus (BVDV) infection. BMC Genomics, 2019, 20(1): 774. DOI:10.1186/s12864-019-6120-4 |
| [13] | Chen SF, Zhou YQ, Chen YR, Gu J. fastp: an ultra-fast all-in-one FASTQ preprocessor. Bioinformatics, 2018, 34(17): i884-i890. DOI:10.1093/bioinformatics/bty560 |
| [14] | Kim D, Langmead B, Salzberg SL. HISAT: a fast spliced aligner with low memory requirements. Nature Methods, 2015, 12(4): 357-360. DOI:10.1038/nmeth.3317 |
| [15] | Liao Y, Smyth GK, Shi W. featureCounts: an efficient general purpose program for assigning sequence reads to genomic features. Bioinformatics, 2014, 30(7): 923-930. DOI:10.1093/bioinformatics/btt656 |
| [16] | Varet H, Brillet-Guéguen L, Coppée JY, Dillies MA. SARTools: a DESeq2- and EdgeR-based R pipeline for comprehensive differential analysis of RNA-Seq data. PLoS ONE, 2016, 11(6): e0157022. DOI:10.1371/journal.pone.0157022 |
| [17] | Beutler B. Innate immunity: an overview. Molecular Immunology, 2004, 40(12): 845-859. DOI:10.1016/j.molimm.2003.10.005 |
| [18] | Gerlic M, Faustin B, Postigo A, Yu ECW, Proell M, Gombosuren N, Krajewska M, Flynn R, Croft M, Way M, Satterthwait A, Liddington RC, Salek-Ardakani S, Matsuzawa SI, Reed JC. Vaccinia virus F1L protein promotes virulence by inhibiting inflammasome activation. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(19): 7808-7813. DOI:10.1073/pnas.1215995110 |
| [19] | Bowie A, Kiss-Toth E, Symons JA, Smith GL, Dower SK, O'Neill LAJ. A46R and A52R from vaccinia virus are antagonists of host IL-1 and toll-like receptor signaling. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(18): 10162-10167. DOI:10.1073/pnas.160027697 |
| [20] | Xu R, Johnson AJ, Liggitt D, Bevan MJ. Cellular and humoral immunity against vaccinia virus infection of mice. The Journal of Immunology, 2004, 172(10): 6265-6271. DOI:10.4049/jimmunol.172.10.6265 |
| [21] | Smith GL, Benfield CTO, Maluquer de Motes C, Mazzon M, Ember SWJ, Ferguson BJ, Sumner RP. Vaccinia virus immune evasion: mechanisms, virulence and immunogenicity. The Journal of General Virology, 2013, 94(Pt 11): 2367-2392. |
| [22] | Unterholzner L. The interferon response to intracellular DNA: why so many receptors?. Immunobiology, 2013, 218(11): 1312-1321. DOI:10.1016/j.imbio.2013.07.007 |
| [23] | Davies ML, Sei JJ, Siciliano NA, Xu RH, Roscoe F, Sigal LJ, Eisenlohr LC, Norbury CC. MyD88-dependent immunity to a natural model of vaccinia virus infection does not involve Toll-like receptor 2. Journal of Virology, 2014, 88(6): 3557-3567. DOI:10.1128/JVI.02776-13 |
| [24] | Brown GD, Willment JA, Whitehead L. C-type lectins in immunity and homeostasis. Nature Reviews Immunology, 2018, 18(6): 374-389. DOI:10.1038/s41577-018-0004-8 |
| [25] | Ding DB, Yao Y, Zhang SB, Su CJ, Zhang YL. C-type lectins facilitate tumor metastasis. Oncology Letters, 2017, 13(1): 13-21. DOI:10.3892/ol.2016.5431 |
| [26] | van den Berg LM, Cardinaud S, van der Aar AMG, Sprokholt JK, de Jong MAWP, Zijlstra-Willems EM, Moris A, Geijtenbeek TBH. Langerhans cell-dendritic cell cross-talk via langerin and hyaluronic acid mediates antigen transfer and cross-presentation of HIV-1. The Journal of Immunology, 2015, 195(4): 1763-1773. DOI:10.4049/jimmunol.1402356 |
| [27] | Monteiro JT, Lepenies B. Myeloid C-type lectin receptors in viral recognition and antiviral immunity. Viruses, 2017, 9(3): 59. DOI:10.3390/v9030059 |
