曾红梅1, 赵位1, 王翔1, 晏仕强1, 杨泽晓1,2

 , 罗燕1,2
, 罗燕1,2
 , 程建国3, 王印1,2, 姚学萍1,2
, 程建国3, 王印1,2, 姚学萍1,2 1. 四川农业大学动物医学院, 四川 成都 611130;
2. 动物疫病与人类健康四川省重点实验室, 四川 成都 611130;
3. 四川养麝研究所, 四川 都江堰 611800
收稿日期:2020-07-22;修回日期:2020-10-05;网络出版日期:2020-10-22
基金项目:四川省科技厅四川省级科研院所科技成果转化项目(2020JDZH0024)
*通信作者:杨泽晓, E-mail: yzxyang2003@126.com;
罗燕, E-mail: Lycjg@163.com.
摘要:[目的] 为探究林麝的死亡原因,本研究无菌采集1只死亡林麝肺脏后进行细菌的分离鉴定。[方法] 通过细菌分离纯化、生化试验和16S rRNA序列分析,对分离菌株进行鉴定;然后通过药敏试验、全基因组测序与分析以及细胞致死性肿胀毒素(cytolethal distendin toxin subunit B,CDTB)分析,对分离菌株耐药性和致病性进行研究。[结果] 在死亡林麝肺脏中分离出1株革兰阴性菌,经鉴定为创口博德特氏杆菌,命名为ZL0001。经过细胞培养观察和CDTB分析表明该菌为胞内寄生菌,含有细胞致死性肿胀毒素,能导致细胞凋亡。药敏结果表明该分离株对氨苄西林、亚胺培南、链霉素和四环素等药物敏感;对氨曲南、林可霉素、克林霉素和呋喃妥因耐药。全基因组测序分析结果表明,该菌株与其他创口博德特氏杆菌的平均核苷酸一致性(average nucleotide identity,ANI)值均>97%,基因组大小为4350644 bp,共发现22个耐药相关基因。此外,该菌株基因组包含63个毒力相关基因,其参与鞭毛蛋白、脂多糖、铁摄取、抗血清蛋白以及细胞致死性肿胀毒素等毒力因子的合成。[结论] 本研究首次在动物呼吸道中分离出创口博德特氏杆菌,并证明其为胞内寄生菌,对林麝肺炎的发病机理研究具有重要意义。
关键词:林麝创口博德特氏杆菌胞内寄生菌细胞致死性肿胀毒素全基因组序列
Whole genome sequence and cytolethal distending toxin analysis of a Bordetella trematum from the lung of a forest musk deer
Hongmei Zeng1, Wei Zhao1, Xiang Wang1, Shiqiang Yan1, Zexiao Yang1,2

 , Yan Luo1,2
, Yan Luo1,2
 , Jianguo Chen3, Yin Wang1,2, Xueping Yao1,2
, Jianguo Chen3, Yin Wang1,2, Xueping Yao1,2 1. College of Veterinary Medicine, Sichuan Agricultural University, Chengdu 611130, Sichuan Province, China;
2. Key Laboratory of Animal Disease and Human Health of Sichuan Province, Chengdu 611130, Sichuan Province, China;
3. Sichuan Institute of Musk Deer Breeding, Dujiangyan 611800, Sichuan Province, China
Received: 22 July 2020; Revised: 5 October 2020; Published online: 22 October 2020
*Corresponding author: Zexiao Yang, E-mail: yzxyang2003@126.com;
Yan Luo, E-mail: Lycjg@163.com.
Foundation item: Supported by the Science & Technology Achievements Transfer Project in 2020 from Scientific Research Institutions of Science & Technology Department of Sichuan Province, Sichuan, China (2020JDZH0024)
Abstract: [Objective] In order to investigate a forest musk deer's death, we collected the musk deer's lung tissue to isolate and identify bacteria. [Methods] We identified the strains by bacterial isolation and purification, biochemical test and 16S rRNA sequence analysis. Then, we designed the whole genome and cytolethal distendin toxin subunit B analysis to learn the drug resistance and pathogenicity of the isolated strain. [Results] First, a gram-negative strain was isolated from the lungs of the musk deer, and identified as Bordetella trematum and named as ZL0001. It was an intracellular parasitic bacterium containing cytolethal distendin toxin subunit B. According to drug sensitivity test, the isolate was sensitive to ampicillin but resistant to amtriaxone. The average nucleotide identity values of the strain compared to other Bordetella trematum were >97%, and the genome size was 4350644 bp. In the whole-genome, 22 drug-resistant genes were found. Moreover, the genome contains 63 virulence genes that participated in many processes, such as iron intake. [Conclusion] Bordetella trematum was isolated in the respiratory tract of forest musk, and proved as intracellular bacterium.
Keywords: forest musk deerBodetella trematumintracellular bacteriacytolethal distending toxinwhole genome sequence
林麝属于偶蹄目,反刍亚目,为国家一级重点保护动物。麝香是雄性麝科动物香囊的分泌物,具有广泛的临床应用和多种药理作用,是一种珍贵的中药材[1-2]。由于人类对林麝的过度利用以及栖息环境的破坏,野生林麝已濒临灭绝。发展林麝人工饲养繁殖,不仅是实现林麝资源保护与可持续发展的有效方法,同时可以解决麝香的供需矛盾[3]。
创口博德特氏杆菌(Bordetella trematum)是1种革兰阴性的短小杆菌,属于博德特氏杆菌属[4]。博德特氏杆菌属有16种(https://lpsn.dsmz.de/search?word=Bordetella),其中百日咳博德特氏杆菌(Bordetella pertussis)与人百日咳疾病有关,通常感染婴幼儿[5]。支气管败血博德特氏杆菌(Bordetella bronchiseptica)常定殖于多种哺乳动物,是导致猪肺炎、传染性萎缩性鼻炎等呼吸道传染病的主要病原之一[6]。创口博德特氏杆菌是一种机会致病菌,当宿主的免疫屏障被打开或者免疫功能异常时,该菌可造成感染或者致病,已有多种案例表明其与人的耳部感染以及皮肤表面的溃烂、脓肿相关[4, 7]。目前,关于创口博德特氏杆菌的致病性研究主要是关于毒力因子—脂多糖。Caroff等[8]曾在创口博德特氏杆菌的脂多糖中发现O抗原单位,这不同于其它博德特氏杆菌,提示其可能影响宿主免疫系统。Novikov等[9]则报道了创口博德特氏杆菌的脂质A修饰,推测其发挥了保护该菌远离宿主免疫系统的作用。
2019年12月,四川某林麝养殖场一头成年林麝突然死亡,临床观察可见,死亡林麝体型偏瘦,其他无明显异常。剖检可见胸腔内脏器粘连,肺脏与胸腔内壁、心脏粘连,左侧肺脏严重出血,肿大实变,且可见肺脏上有鸡蛋大小脓肿,剪开可见草绿色豆腐渣样渗出;右侧肺脏无明显可见病理变化。心脏出血,内有积液;肝脏出血肿大;脾脏肿大;肠系膜淋巴结肿大出血,其他脏器未见明显病理变化。根据临床症状、病理变化,无菌采集死亡林麝的肺脏组织进行细菌的分离鉴定,以探究林麝死亡的原因。本实验是国内外首次从动物呼吸道中分离出创口博德特氏杆菌,首次证明创口博德特氏杆菌为胞内寄生菌,且含有细胞致死性肿胀毒素(cytolethal distending toxin)。
1 材料和方法 1.1 材料
1.1.1 病料来源: 采集于四川某林麝养殖场的一头病死林麝的肺部组织。
1.1.2 试剂材料: 营养琼脂(NA)培养基、血清琼脂培养基、麦康凯培养基、药敏纸片、细菌微量生化鉴定管等,购于杭州微生物试剂有限公司。2×Taq Master Mix (Dye Plus)购于南京诺唯赞生物科技股份有限公司。DNA maker Ⅲ、DL2000、细菌基因组DNA提取试剂盒购于天根生化试剂(北京)有限公司。DMEM、胎牛血清(FBS)购于Gibco公司。胰酶、购于索莱宝公司。细菌引物的合成和测序均由成都有康生物技术有限公司完成,全基因组测序由上海派森诺生物科技有限公司完成。
1.2 细菌的分离纯化 将无菌采集到的林麝肺脏组织分别划线接种于营养琼脂(NA)培养基、5%绵羊血清琼脂培养基,然后置于恒温细菌培养箱,37 ℃培养24 h。根据菌落形态选择单个菌落进行革兰氏染色镜检,接种于5%绵羊血清琼脂培养基和麦康凯琼脂培养基上,对其进行进一步纯化,观察其培养特性。
1.2.1 生化试验: 依据《伯杰氏细菌鉴定手册》,将已纯化好的分离菌接种于细菌微量生化反应管中,实验步骤与结果判定按照试剂说明书进行。
1.2.2 16S rRNA基因扩增及序列分析: 采用细菌基因组提取试剂盒提取分离菌的DNA,作为PCR反应模板。选用16S rRNA基因通用引物27F (5?-A GAGTTTGATCCTGGCTCAG-3?)和1492R (5?-TA CGGTTACCTTGTTACGACTT-3?)进行PCR扩增。反应体系为50 μL:2×Taq Master Mix (Dye Plus) 25 μL,上下游引物各1.5 μL,DNA模板2.0 μL,ddH2O补足50 μL。反应条件:94 ℃ 3 min;94 ℃ 15 s,55 ℃ 15 s,72 ℃ 80 s,34个循环;72 ℃ 5 min。PCR产物经1%琼脂糖凝胶电泳后进行胶回收,回收产物送至成都有康生物技术有限公司进行测序。
1.2.3 林麝肺细胞的培养与观察: 将无菌采集无明显病理变化的林麝肺脏组织,经胰酶消化分离细胞,并用含青链霉素的DMEM进行传代培养,同时对细胞形态和变化进行观察记录。
1.2.4 药敏试验: 采用KB纸片扩散法进行药敏试验,用0.5麦氏浊度的麦氏标准管进行对比,调整菌液浓度至5×107-8 CFU/mL。在37 ℃培养24 h后,参照《CLSI标准》和中国药检标准[10],按照抑菌圈直径大小和各抗菌药的具体标准评定为敏感、中介或耐药。
1.2.5 分离菌的全基因组测序及序列分析: 挑取单菌落涂板连续传2代后,使用无菌生理盐水洗下菌苔,按照细菌基因组DNA提取试剂盒说明书提取细菌DNA。测定核酸浓度和纯度,送至上海派森诺生物科技有限公司完成全基因组测序。
测序采用全基因组鸟枪法(whole genome shotgun,WGS)策略,构建不同插入片段的文库,利用第二代测序技术(next generation sequencing,NGS),基于Illumina Nova Seq测序平台,对这些文库进行双末端(paired-end,PE)测序。
1.2.6 数据处理: 对原始数据进行统计、质控和过滤等处理后,采用A5-MiSeq和SPAdes对去除接头序列的测序数据进行从头拼装,得到初步组装结果。采用GeneMarkS软件对分离菌全基因组的蛋白质编码基因进行预测。经过代谢通路数据库KEGG (Kyoto encyclopedia of genes and genomes)和蛋白质功能数据库COG (clusters of orthologous groups)对B. trematum ZL0001株基因组进行基因功能预测,将预测结果与各功能数据库进行BLAST比对(e value≤1e-5),最后选取score最高的比对结果进行注释。选取NCBI上的13株相关菌株进行全基因组比对,选择在线网站EzBioCloud的比对工具ANI Calculator (https://www.ezbiocloud.net/tools/ani)对分离菌株平均核苷酸一致性进行分析(ANI)。同时,采用毒力因子数据库(virulence factors of pathogenic bacteria, VFDB)和抗生素耐药基因数据库(the comprehensive antibiotic research database, CARD)对菌株的基因组中所包含的毒力基因和耐药基因进行预测。
1.2.7 细胞致死性肿胀毒素B亚基的基因扩增及序列分析: 基于ZL0001全基因组序列分析发现的细胞致死性肿胀毒素B亚基基因序列(JABBMS010000010.1: 168798-169634),设计PCR扩增引物,扩增分离菌株细胞致死性肿胀毒素B亚基基因。上游引物为CDTB-F:5?-TACGCCCGCCTTGTCG-3?;下游引物为CDTB-R:5?-CCGAAGCCAATTGTCCGA-3?。利用已提取的细菌DNA和该引物进行PCR扩增,反应体系与反应程序参照1.2.2。PCR产物经电泳验证条带后送到成都有康生物技术有限公司进行测序验证。将测序结果在NCBI上进行比对,下载比对上的菌株的核苷酸序列,使用DNAMAN将序列转化为CDTB因子的氨基酸序列,并进行多序列比对。
2 结果和分析 2.1 菌株的分离鉴定
2.1.1 细菌的形态以及培养特性: 对该林麝肺脏组织进行细菌分离鉴定,发现仅有一种分离株生长,纯化后的分离株细菌在5%绵羊血清琼脂培养基上呈边缘整齐,白色、湿润、光滑、突起、圆形的小菌落;在麦康凯琼脂培养基上呈粉红色。革兰氏染色结果表明,该分离菌为革兰染色阴性的短小杆菌(图 1)。
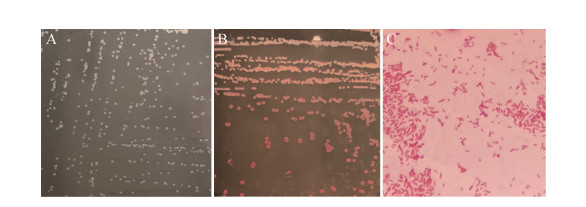 |
| 图 1 分离菌的菌落形态与革兰染色 Figure 1 Colony morphology and gram staining of isolated bacteria. A, B: the growth characteristic of isolate on serum tablet and McConkey tablet; C: the gram staining microscopy result. |
| 图选项 |
2.1.2 生化试验结果: 经生化鉴定显示,该分离株的氧化酶、葡萄糖分解发酵、脲酶和脱羧酶试验检测结果均为阴性,过氧化氢酶、细菌运动、柠檬酸和硝酸盐还原试验的检测结果均为阳性。这与文献报道的该菌的生化特征一致[11]。
2.1.3 分离细菌16S rRNA基因的扩增结果及序列分析: 分离菌株16S rRNA基因PCR扩增结果表明,目的条带大小约为1441 bp,结果符合预期。扩增的产物回收测序后,将测序结果上传GenBank,登录号为:MN847725。将该序列在GenBank中进行在线比对,结果显示与该菌株相似度最高的为创口博德特氏杆菌(Bordetella trematum),且相似性高达99%以上。选择7株来源不同的创口博德特氏杆菌和7株同属不同种的其他代表性菌种,下载16S rRNA序列构建系统发育树,如图 2所示,分离菌株(编号ZL0001)与Bordetella trematum处于同一分支上,故鉴定为创口博德特氏杆菌。
 |
| 图 2 基于16S rRNA的分离株及相关菌株系统发育树 Figure 2 Phylogenetic tree based on 16S rRNA of the isolate and related strains. The sequence number in brackets represents the login number of the strain in NCBI. The numbers on the branch are bootstrap values and the number below the phylogenetic tree is the scale of the tree. |
| 图选项 |
2.1.4 细胞培养与观察: 在37 ℃、CO2浓度5%的条件下培养4 d后,林麝肺脏细胞分裂明显变慢,且大部分细胞体积变大,发生肿胀、死亡,细胞内部可见大量细菌运动,如图 3所示。使用胰酶消化发生肿胀的细胞,并接种细胞培养液于5%绵羊血清琼脂培养基与麦康凯琼脂培养基,发现有细菌生长,其培养特性及革兰染色与2.1.1中的分离株一致,经鉴定为创口博德特氏杆菌。
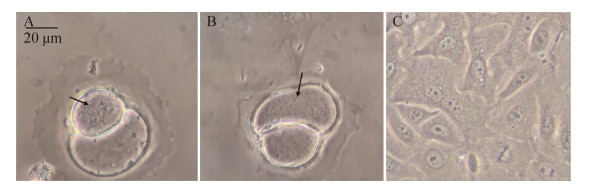 |
| 图 3 林麝肺脏细胞的病变情况以及胞内菌的观察 Figure 3 Lung cell lesions of forest musk deer and observation of intracellular bacteria. A, B: swelling cells; C: normal cells of forest musk deer. The black spots shown by the arrows are intracellular bacteria. The motile bacteria can be observed under the microscope. |
| 图选项 |
2.2 菌株的药敏试验结果 对分离菌进行多类药物的敏感性检测,结果显示该分离株对氨苄西林、阿莫西林、亚胺培南、链霉素、庆大霉素、多粘菌素B、四环素、多西环素、红霉素和磺胺异恶唑敏感;对氨曲南、林可霉素、克林霉素、呋喃妥因和利福平耐药。
2.3 菌株的全基因组分析
2.3.1 全基因组基本信息以及ANI分析: 分离菌株的全基因组大小为4350644 bp,G+C百分含量为65.70%,开放阅读框架(open reading framework)为3958个,占整个序列89.80%,包含tRNA 58个,rRNA 3个。将菌株命名为ZL0001,组装后的序列以FASTA形式上传至Genome数据库,登录号为JABBMS000000000。
下载GenBank上的4株不同来源的Bordetella trematum全基因组及9株Bordetella其他菌的标准株进行ANI值计算。结果显示,ZL0001与Bordetella trematum标准株H044680328的ANI值为97.47%,与Bordetella trematum菌的ANI值均 > 97%,与Bordetella其他菌的标准株的ANI值均<81%。按照全基因组ANI值>96%作为同一菌种判定的依据,进一步明确ZL0001为创口博德特氏杆菌。
2.3.2 KEGG与COG功能库注释分析: 通过与KEGG数据库的比对分析,ZL0001中共有4606个基因参与代谢通路,根据功能不同可分为7类,分别是新陈代谢(1628个),BRITE层次(1572个),信息加工(520个),细胞过程(286个),疾病(199个),有机系统(86个)和未知功能(315个)。其中参与新陈代谢的基因最多,占总数的35.35%,最少的为参与有机系统的基因,占总数的1.87%。
通过COG功能库对比注释,ZL0001基因组共有3682个基因被注释,共有25类,大部分与氨基酸转运、生物合成以及新陈代谢等相关。用于氨基酸转运代谢的蛋白数量最多,为385个,其次是用于转录的蛋白,为361个。有4组COG功能未被注释到,分别是通用功能预测、胞外结构、核结构和细胞骨架,此外,共有854个蛋白功能未知,2828个蛋白与已知蛋白或已知的假设蛋白同源。
2.3.3 耐药基因分析: 通过对基因序列进行本地比对,利用NCBI进行BLAST验证,发现创口博德特氏杆菌ZL0001携带了5种耐药基因,22个抗生素耐药基因。从表 1中可知,外排泵系统基因数量最多,主要包括adeF(5个)、macB、mexA、mexl、mdtB、mdtC、muxB(2个)、msbA、OprM和OprZ共15个耐药基因。其次为3个氨基糖苷类耐药基因,分别为AAC(3)-II、AAC(6')-Ib和APH(3'')-Ib。其他基因共4个,具体如表 1所示。
表 1. ZL0001基因组耐药基因预测 Table 1. Predicted resistance genes in ZL0001 genome
| Resistant gene category | Resistant gene names |
| Aminoglycoside | AAC(3)-II, AAC(6')-Ib, APH(3'')-Ib |
| Fluoroquinolone Pulvomycin Rifampicin | gyrB EF-Tu rpoB |
| Efflux pump conferring antibiotic resistance | adeF, macB, mexA, mexl, mdtB, mdtC, muxB, msbA, OprM, OprZ |
表选项
2.3.4 毒力因子分析: 经VFDB注释、本地比对,选取得分最高且e值≤1e-5的结果。结果显示63个基因编码与ZL0001相关的毒力因子。主要分为以下8个大类,数量最多的是编码鞭毛蛋白相关的基因,为26个。具体分类以及相关基因见表 2。
表 2. ZL0001基因组中致病性相关的毒力基因 Table 2. Virulence genes associated with pathogenicity in ZL0001 genome
| Virulence factor | Related genes | |
| Flagellin protein |  | fliA, flhA, flhB, flhF, fliR, fliP, fliN, fliL, fliT |
| flhC, fliN, fliM, fliG, fliI, flgM, motA, motB | ||
| flaA, fliD, fliF, flgE, flgD, flgB, flgH, flgG, flgI, flgK | ||
| Two component systerm |  | OmpR, prrA |
| cheB, cheR, cheW, cheZ | ||
| Internalization protein | Rv1837c, glnA1, secA2, hbhA, rpoV, CDTB | |
| Lipopolysaccharide | bplA, bplB, bplC | |
| Metabolism protein | narG, algC, ppkA, algA, ahpC, syrE, icl | |
| Iron uptake | fepA, fauA, bhuU, bhuS, bhuR, hasD | |
| Transport regulator | cyaB, eccCb5, relA, clpB | |
| Antiserum protein | brkB | |
表选项
2.4 细胞致死性肿胀毒素B亚基的基因扩增与序列分析 根据2.1.4的细胞病变情况、2.3.4中的毒力因子比对结果以及国内外的报道[12-13],证明该创口博德特氏杆菌具有细胞致死性肿胀毒素,可导致肺脏细胞肿胀、凋亡。设计引物,进行PCR扩增后,结果显示在850 bp左右有一特异性扩增条带,将PCR产物回收以后测序,测序结果在GenBank中进行BLAST。结果显示,该序列与另外5株创口博德特氏杆菌的CDTB序列比对成功。
根据上述比对结果,下载比对成功的5株菌株的CDTB氨基酸序列,进行多序列比对,显示氨基酸序列相似度达99%以上。ZL0001与F581、H044680328和E202株的相似度达100%,与CBM01、E202.2的氨基酸序列有所差异,存在突变,具体情况如图 4所示。
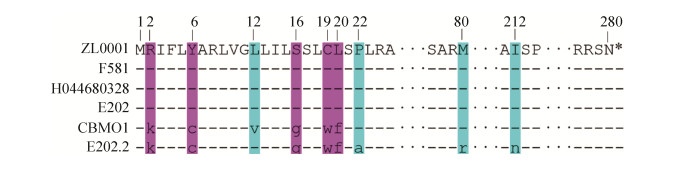 |
| 图 4 CDTB氨基酸序列比对图 Figure 4 Alignment diagram of CDTB amino acid sequence. Numbers represent amino acid sequence sites, and different colors represent specific differences. Pink represents one different site, and green represents two. |
| 图选项 |
3 讨论 林麝作为一种珍稀的保护动物,其成年雄性分泌的麝香是多种中药的重要成分,目前已经在四川、陕西等多个地方开展了林麝人工养殖基地[14-15]。林麝数量一直无法稳步增长,而细菌感染是导致林麝死亡的一个主要原因,严重威胁林麝的健康。鉴于林麝重要的医用以及经济价值,对林麝死亡原因进行研究显得尤为重要。创口博德特氏杆菌是一种罕见的革兰氏阴性杆菌[16],其宿主、发病机制、致病性和毒力水平等一直没有得到深入的研究。由于创口博得特氏杆菌相关信息匮乏,对其进行全基因组测序分析,挖掘其致病和耐药机制对该菌的防治极其重要。
研究认为,博德特氏杆菌属细菌主要感染人的呼吸道,例如百日咳博德特氏杆菌[17]和副百日咳博德特氏菌[18],由于人是其唯一宿主且可以导致严重的呼吸系统疾病而引起广泛关注。而支气管败血博德特氏杆菌则可以引起哺乳动物包括猪、兔、犬等急、慢性呼吸系统疾病[19]。不同的是,创口博德特氏杆菌的分离部位主要在皮肤伤口、耳朵,Vandamme等[20]于1996年在感染人的伤口与耳道中首次分离出创口博德特氏杆菌。目前,对于创口博德特氏杆菌的报道相对较少,并且从未在动物呼吸系统中被分离,分析原因可能与它生长缓慢,培养24 h后菌落细小,极易被忽视而漏检有关[4]。创口博德特氏菌的宿主主要是人,Chang等[12]曾在健康牛的瘤胃中分离出该菌,除此之外无更多动物相关的报道。
目前,已有多篇文献报道百日咳博德特氏杆菌以及支气管败血博德特氏杆菌具有在宿主细胞内存活的能力以及可能的作用机制[21-23],这个过程是多种毒力因子与分泌系统共同作用的结果,需要病原体有效地适应细胞内环境和相关的胁迫。目前,尚未有关于创口博德特氏杆菌胞内寄生的报道,在此基础上我们进行了细胞实验,实验结果证明创口博德特氏杆菌确为胞内寄生菌。通常情况下,创口博德特氏杆菌被认为是一种机会致病菌,它的致病力与宿主的免疫状态有关,被认为致病力不强,这可能与它常在慢性病例上被分离出来有关[8]。考虑到创口博德特氏杆菌能在胞内存活,当没有被巨噬细胞识别、吞噬并释放到组织中的情况下,不能引起宿主的免疫与炎症反应,导致症状与病变不明显,即被认为致病性一般,但关于创口博德特氏杆菌的致死病例较少,致病性研究还需结合更多的临床病例进行分析。
在全基因组序列测序、毒力因子预测分析以后,分离菌株ZL0001的毒力因子可分为8类,包括鞭毛蛋白、内化相关蛋白和脂多糖等。博德特氏杆菌属中报道最多的毒力因子为脂多糖,它可以参与结合宿主上呼吸道的纤毛上皮细胞而导致细菌定殖,同时也与博德特氏杆菌属细菌的内毒素毒力有关[24-25]。综合细胞试验与全基因组测序结果,发现ZL0001基因组中含有一种重要的毒素—细胞致死性肿胀毒素。细胞致死性肿胀毒素是一种可以导致细胞体积增大、细胞周期阻滞和凋亡的三聚体毒力因子,其毒性取决于CDT的活性亚基,即CDTB[26]。细胞致死性肿胀毒素是由革兰氏阴性细菌产生的细菌外毒素,有数据表明,该毒素参与慢性炎症的相关反应。Pere-Vedrenne等[27]的研究发现肝螺杆菌的CdtB亚基对人的肠和肝上皮细胞具有促炎症能力,Ge等[28]发现CDT可以通过诱导IL-6的mRNA水平的增加,并通过活化NF-κB信号通路促进肝炎到癌前病变的过程。目前,关于创口博德特氏杆菌CDTB毒素在该菌发挥致病性中的作用还是未知数,但可以推测的是该毒素是导致本研究中的林麝肺炎死亡的关键因子。
此外,在6种内化作用的相关蛋白中,除CDTB外,Rv1837c、glnA1、secA2、hbhA和rpoV毒力基因均可以在结核分枝杆菌的基因组中找到,并且有一定的相似性。谷氨酰胺合成酶GlnA1被证明对结核分枝杆菌在人巨噬细胞和豚鼠中的生长至关重要[29],超氧化物歧化酶A(secA2)是一种重要的输出毒力因子,参与一种新型的分泌途径,可以使结核分枝杆菌免受巨噬细胞的氧化攻击[30]。结核分枝杆菌是一种经典、重要的胞内寄生菌,而创口博德特氏杆菌ZL0001株与其有相同的入胞机制相关的毒力因子。据此,我们怀疑创口博德特氏杆菌的胞内寄生、存活的机制是否与结核分枝杆菌存在一定的共性,这还需要进一步的研究。
References
| [1] | 罗燕, 王印. 麝常见细菌性疾病及其防治. 成都: 四川科学技术出版社, 2018. |
| [2] | Zhang JQ, Zhou YB, Xu WX, Hu JC, Liao WB. Discussion about musk-deer's classification. Journal of China West Normal University (Natural Sciences), 2004, 25(3): 251-255. (in Chinese) 章敬旗, 周友兵, 徐伟霞, 胡锦矗, 廖文波. 几种麝分类地位的探讨. 西华师范大学学报(自然科学版), 2004, 25(3): 251-255. |
| [3] | Wang YL, Ha CY. Research progress on musk and artificial propagation technique of forest musk deer. China Journal of Chinese Materia Medica, 2018, 43(19): 3806-3810. (in Chinese) 王玉玲, 哈成勇. 林麝的人工繁殖新技术及麝香研究进展. 中国中药杂志, 2018, 43(19): 3806-3810. |
| [4] | Zhang ZF, Zhou WQ. One patient with chronic otitis media was found with Bodetella trematum in ear pus. Laboratory Medicine and Clinic, 2018, 15(3): 431-432. (in Chinese) 张之烽, 周万青. 慢性中耳炎患者耳脓中检出创口博德特菌1例. 检验医学与临床, 2018, 15(3): 431-432. DOI:10.3969/j.issn.1672-9455.2018.03.052 |
| [5] | Guiso N. Bordetella pertussis: Why is it still circulating?. Journal of Infection, 2014, 68 Suppl 1: S119-S124. |
| [6] | Jiang RJ, Zhang PF, Wang Y, Yao XP, Yang ZX, Luo Y. Isolation and identification of Bordetella bronchiseptica from western hylobates hoolock and detection of resistance gene. Acta Agriculturae Boreali-occidentalis Sinica, 2020, 29(5): 668-674. (in Chinese) 姜睿姣, 张鹏飞, 王印, 姚学萍, 杨泽晓, 罗燕. 西部白眉长臂猿支气管败血波氏杆菌的分离鉴定及其耐药基因检测. 西北农业学报, 2020, 29(5): 668-674. |
| [7] | Daxboeck F, Goerzer E, Apfalter P, Nehr M, Krause R. Isolation of Bordetella trematum from a diabetic leg ulcer. Diabetic Medicine: A Journal of the British Diabetic Association, 2004, 21(11): 1247-1248. DOI:10.1111/j.1464-5491.2004.01310.x |
| [8] | Caroff M, Aussel L, Zarrouk H, Martin A, Richards JC, Thérisod H, Perry MB, Karibian D. Structural variability and originality of the Bordetella endotoxins. Journal of Endotoxin Research, 2001, 7(1): 63-68. DOI:10.1177/09680519010070011101 |
| [9] | Novikov A, Shah NR, AlBitar-Nehme S, Basheer SM, Trento I, Tirsoaga A, Moksa M, Hirst M, Perry MB, Hamidi AE, Fernandez RC, Caroff M. Complete Bordetella avium, Bordetella hinzii and Bordetella trematum lipid A structures and genomic sequence analyses of the loci involved in their modifications. Innate Immunity, 2013, 20(6): 659-672. |
| [10] | Chen HB, Wang H. 2017 CLSI M100-S27 main update content interpretation. Chinese Journal of Laboratory Medicine, 2017, 40(4): 238-241. (in Chinese) 陈宏斌, 王辉. 2017年CLSI M100-S27主要更新内容解读. 中华检验医学杂志, 2017, 40(4): 238-241. DOI:10.3760/cma.j.issn.1009-9158.2017.04.006 |
| [11] | Castro TRY, Martins RCR, Dal Forno NLF, Santana L, Rossi F, Schwarzbold AV, Costa SF, De Arruda Trindade P. Bordetella trematum infection: case report and review of previous cases. BMC Infectious Diseases, 2019, 19(1): 485. DOI:10.1186/s12879-019-4046-8 |
| [12] | Chang DH, Jin TE, Rhee MS, Jeong H, Kim S, Kim BC. Draft genome sequence of Bordetella trematum strain HR18. Genome Announcements, 2015, 3(1): e01357-14. |
| [13] | Lu S, Sun N, Ren ZH, Ye CY. Investigation on constitution of cytolethal distending toxin gene in some intestinal bacteria and cell toxicity thereof. China Preventive Medicine, 2009, 10(5): 326-331. (in Chinese) 卢珊, 孙娜, 任志鸿, 叶长芸. 几种肠道菌中细胞致死性肿胀毒素的检测及其细胞毒性初步研究. 中国预防医学杂志, 2009, 10(5): 326-331. |
| [14] | Zheng CL, Cai YH, Wang JM, Wang CX, Zhou L, Feng DY, Yang Y. An investigation report on the current situation of forest musk deer breeding in Sichuan province. Heilongjiang Animal Science and Veterinary Medicine, 2020(3): 136-139. (in Chinese) 郑程莉, 蔡永华, 王建明, 王承旭, 周磊, 冯达勇, 杨营. 四川省林麝养殖现状调查报告. 黑龙江畜牧兽医, 2020(3): 136-139. |
| [15] | Zhao KL, Li XX, Paha'erding P, Zeng B, Zhang XY, Yue BS. Isolation and identification on pathogens of musk deer abscess disease and antibiotic susceptibility assay. Sichuan Journal of Zoology, 2011, 30(4): 522-526. (in Chinese) 赵克雷, 李旭鑫, 帕哈尔定·帕拉哈提, 曾博, 张修月, 岳碧松. 圈养林麝脓肿病病原菌分离鉴定及药敏分析. 四川动物, 2011, 30(4): 522-526. DOI:10.3969/j.issn.1000-7083.2011.04.027 |
| [16] | Halim I, Ihbibane F, Belabbes H, Zerouali K, El Mdaghri N. Isolation of Bordetella trematum from bacteremia. Annales de Biologie Clinique, 2014, 72(5): 612-614. DOI:10.1684/abc.2014.0998 |
| [17] | Zhang JS, Wang HM, Yao KH, Liu Y, Lei YL, Deng JK, Yang YH. Clinical characteristics, molecular epidemiology and antimicrobial susceptibility of pertussis among children in southern China. World Journal of Pediatrics, 2020, 16(2): 185-192. DOI:10.1007/s12519-019-00308-5 |
| [18] | Karalius VP, Rucinski SL, Mandrekar JN, Patel R. Bordetella parapertussis outbreak in Southeastern Minnesota and the United States, 2014. Medicine (Baltimore), 2017, 96(20): e6730. DOI:10.1097/MD.0000000000006730 |
| [19] | Ma CF. Isolation, identification and investigation of Bordetella bronchiseptica in rabbit. Chinese Journal of Veterinary Medicine, 2019, 55(7): 60-62, 121. (in Chinese) 马超锋. 兔支气管败血波氏杆菌的分离鉴定与调查. 中国兽医杂志, 2019, 55(7): 60-62, 121. |
| [20] | Vandamme P, Heyndrickx M, Vancanneyt M, Hoste B, De Vos P, Falsen E, Kersters K, Hinz KH. Bordetella trematum sp. nov., isolated from wounds and ear infections in humans, and reassessment of Alcaligenes denitrificans Rüger and Tan 1983. International Journal of Systematic Bacteriology, 1996, 46(4): 849-858. DOI:10.1099/00207713-46-4-849 |
| [21] | Cafiero JH, Lamberti YA, Surmann K, Vecerek B, Rodriguez ME. A Bordetella pertussis MgtC homolog plays a role in the intracellular survival. PLoS ONE, 2018, 13(8): e0203204. DOI:10.1371/journal.pone.0203204 |
| [22] | Hasan S, Kulkarni NN, Asbjarnarson A, Linhartova I, Osicka R, Sebo P, Gudmundsson GH. Bordetella pertussis adenylate cyclase toxin disrupts functional integrity of bronchial epithelial layers. Infection and Immunity, 2018, 86(3): e00445-17. |
| [23] | Bendor L, Weyrich LS, Linz B, Rolin OY, Taylor DL, Goodfield LL, Smallridge WE, Kennett MJ, Harvill ET. Type six secretion system of Bordetella bronchiseptica and adaptive immune components limit intracellular survival during infection. PLoS ONE, 2015, 10(10): e0140743. DOI:10.1371/journal.pone.0140743 |
| [24] | Bouchez V, AlBitar-Nehmé S, Novikov A, Guiso N, Caroff M. Bordetella holmesii: lipid a structures and corresponding genomic sequences comparison in three clinical isolates and the reference strain ATCC 51541. International Journal of Molecularences, 2017, 18(5): 1080. |
| [25] | Lamberti YA, Hayes JA, Vidakovics MLP, Harvill ET, Rodriguez ME. Intracellular trafficking of Bordetella pertussis in human macrophages. Infection and Immunity, 2010, 78(3): 907-913. DOI:10.1128/IAI.01031-09 |
| [26] | Shenker BJ, Walker LM, Zekavat A, Weiss RH, Boesze-Battaglia K. The cell-cycle regulatory protein p21CIP1/WAF1 is required for cytolethal distending toxin (Cdt)-induced apoptosis. Pathogens, 2020, 9(1): 38. DOI:10.3390/pathogens9010038 |
| [27] | Péré-Védrenne C, Cardinaud B, Varon C, Mocan I, Buissonnière A, Izotte J, Mégraud F, Ménard A. The cytolethal distending toxin subunit CdtB of Helicobacter induces a Th17-related and antimicrobial signature in intestinal and hepatic cells in vitro. Journal of Infectious Diseases, 2016, 213(12): 1979-1989. DOI:10.1093/infdis/jiw042 |
| [28] | Ge ZM, Rogers AB, Feng Y, Lee A, Xu SL, Taylor NS, Fox JG. Bacterial cytolethal distending toxin promotes the development of dysplasia in a model of microbially induced hepatocarcinogenesis. Cellular Microbiology, 2010, 9(8): 2070-2080. |
| [29] | Tullius MV, Harth G, Horwitz MA. Glutamine synthetase GlnA1 is essential for growth of Mycobacterium tuberculosis in human THP-1 macrophages and guinea pigs. Infection and Immunity, 2003, 71(7): 3927-3936. DOI:10.1128/IAI.71.7.3927-3936.2003 |
| [30] | Braunstein M, Espinosa BJ, Chan J, Belisle JT, Jacobs WR Jr. SecA2 functions in the secretion of superoxide dismutase A and in the virulence of Mycobacterium tuberculosis. Molecular Microbiology, 2003, 48(2): 453-464. DOI:10.1046/j.1365-2958.2003.03438.x |
