张露1,2, 邵锐1,2, 潘鑫1,2, 王绍平3, 王广成3, 李伟3, 岳正波1,2, 王进1,2


1. 合肥工业大学资源与环境工程学院, 安徽 合肥 230009;
2. 纳米矿物与污染控制安徽普通高校重点实验室, 安徽 合肥 230009;
3. 安徽马钢矿业资源集团南山矿业有限公司, 安徽 马鞍山 243000
收稿日期:2021-03-26;修回日期:2021-04-27;网络出版日期:2021-05-10
基金项目:国家自然科学基金(U20A20325,41772361)
作者简介:王进,教授,博士生导师。2007年获中国科学技术大学博士学位,2007–2008年在香港科技大学从事博士后研究,2009–2010年在密歇根州立大学任访问****。主要从事环境科学与技术领域的教学与科研工作。主持国家自然科学基金项目4项,作为科研骨干参加其他省部级以上科研项目10余项。获安徽省科技进步一等奖1项、教育部科技进步二等奖1项,申请和授权国家发明专利20余项,授权国际专利1项。公开发表SCI/EI收录论文100多篇.
*通信作者:王进, E-mail: sophiawj@hfut.edu.cn.
摘要:[目的] 探讨在酸性含锰极端水环境中油球藻的生长特性及其对环境pH和Mn2+的影响。[方法] 从某硫铁矿山的酸性废水库中分离获得纯化藻株,通过形态观察及18S rRNA基因测序对其进行鉴定,并着重考察了不同pH和典型金属离子Mn2+浓度对其生长特性的影响,并通过测定藻生物量、光合色素、丙二醛(malondialdehyde,MDA)和还原型谷胱甘肽(reduced glutathione,GSH)含量以及超氧化物歧化酶(superoxide dismutase,SOD)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)比活力的变化,分析该藻对Mn2+胁迫的生理响应机制。[结果] 分离得到的藻株经鉴定为Graesiella sp.MA1;pH对该藻的生长有显著影响,其最低耐受初始pH为3.5;在初始pH为3.5和Mn2+浓度分别为5、30和55 mg/L时,藻细胞生物量随着Mn2+浓度的增加而下降,各试验组中的Mn2+浓度亦分别降低了28.62%、21.90%和18.84%,且pH值分别升高至5.7、5.6、5.4,对照组pH则高达9.1;在培养24 d后,藻细胞叶绿素a/b值随Mn2+浓度增加而下降,而MDA、GSH含量以及SOD、APX比活力则显著增加。结果表明,从酸性矿山废水库中分离纯化获得的油球藻能够同时耐受低pH和一定浓度范围内的Mn2+,在这种极端环境下,其细胞内的抗氧化系统缓减了膜脂质过氧化作用,从而在耐受重金属离子与解毒方面起到了重要作用。[结论] Graesiella sp.MA1具有耐受低pH、重金属离子以及产碱的作用,研究结果为利用油球藻开展酸性矿山废水原位生物修复提供了一定的理论依据。
关键词:锰离子酸性条件油球藻抗氧化机制酸性矿山废水
Isolation and identification of an acid-tolerant microalgae and its physiological response to manganese ion stress
Lu Zhang1,2, Rui Shao1,2, Xin Pan1,2, Shaoping Wang3, Guangcheng Wang3, Wei Li3, Zheng-bo Yue1,2, Wang Jin1,2


1. School of Resources and Environmental Engineering, Hefei University of Technology, Hefei 230009, Anhui Province, China;
2. Key Laboratory of Nanominerals and Pollution Control of Anhui Higher Education Institutes, Hefei University of Technology, Hefei 230009, Anhui Province, China;
3. Masteel(Group) Holding Co., Ltd. Nanshan Mining Company, Ma'anshan 243000, Anhui Province, China
Received: 26 March 2021; Revised: 27 April 2021; Published online: 10 May 2021
*Corresponding author: Jin Wang, E-mail: sophiawj@hfut.edu.cn.
Foundation item: Supported by the National Natural Science Foundation of China (U20A20325, 41772361)
Abstract: [Objective] The purpose of this study was to investigate the growth characteristics of Graesiella sp. and the influence of pH and Mn2+ in acidic manganese-containing extreme water environments. [Methods] The purified algae was isolated from an acid mine drainage in a pyrite mine and identified by morphological observation and 18S rRNA gene sequencing. Firstly, we investigated the effects of pH and typical metal ion Mn2+ concentration on its growth characteristics. Then, with the determination of algae biomass, photosynthetic pigment, malondialdehyde (MDA), reduced glutathione (GSH) content and the specific vitalities of superoxide dismutase (SOD) and ascorbate peroxidase (APX), we analyzed the physiological response mechanism of the algae to Mn2+ stress. [Results] The isolated algae strain was identified and named as Graesiella sp. MA1. The medium pH had a significant effect on the growth of Graesiella sp. MA1, and its minimum initial tolerance pH was 3.5. When the initial pH was 3.5 and the concentration of Mn2+ was 5, 30 and 55 mg/L, the biomass of algal decreased with the increase of Mn2+ concentration. The Mn2+ concentration in experimental groups also decreased by 28.62%, 21.90% and 18.84%, respectively, and the pH value increased to 5.7, 5.6 and 5.4, respectively, while the pH value in control group was 9.1. After 24 days, the chlorophyll a/b value of algal decreased with the increase of Mn2+ concentration, while the contents of MDA and GSH, and the specific activities of SOD and APX increased significantly. The results showed that Graesiella sp. isolated and purified from acidic mine drainage could tolerate both low pH and Mn2+ in a certain concentration range. Under such extreme environment, the intracellular antioxidant system of Graesiella sp. could reduce membrane lipid peroxidation, and thus play an important role in tolerance of heavy metal ions and detoxification. [Conclusion] Graesiella sp. MA1 can tolerate low pH and heavy metal ions and generate alkalinity, thus this study provides a theoretical basis for in situ bioremediation of acidic mine drainage by using Graesiella sp..
Keywords: manganese ionacidic conditionGraesiella sp.antioxidant mechanismacid mine drainage
金属矿山开采产生的酸性矿山废水(acid mine drainage,AMD)因其低pH、高硫酸盐和高溶解态有毒金属浓度等特性,成为矿区周边水土环境污染和生态破坏的首要因素[1]。AMD作为典型地球极端环境之一,是大量极端耐酸/嗜酸微生物的生存环境,因此亦成为生物学研究的重要模式系统[2-3]。AMD体系微生物群落主要包括细菌、古菌、真核生物(真菌和藻类为主)和病毒,在铁、碳、硫、氮等元素循环中具有重要的作用[3]。嗜酸性藻类作为初级生产者,能够固定空气中CO2并和异养微生物发生信号传导、营养交换和基因转移等,进而间接影响微生物群落组成[4]。藻类的代谢活动还可以产生碱性物质,提高系统pH值,影响金属离子的迁移转化过程[5]。如螺旋藻、小球藻等对AMD中不同重金属元素具有高选择性,可作为“超蓄能器”和“超吸附剂”[6]。因此,利用藻类的生物修复技术在治理重金属污染中得到广泛应用[7-8]。
然而,利用藻类修复矿山酸性水体面临着许多尚未解决的问题。如AMD中大量的Cu2+、As5+、Mn2+、Zn2+等溶解性(重)金属离子和低pH、高酸度等环境条件均对藻类等微生物的高效处理能力构成威胁和挑战[9]。前人的研究表明,重金属离子会损害藻类细胞膜功能、抑制光合作用、诱导氧化应激释放过量的活性氧(reactive oxygen species,ROS),导致膜脂质过氧化并产生有毒物质丙二醛(malondialdehyde,MDA)[10-13],进而影响微藻的生长代谢过程。另一方面,ROS的产生能促进微藻释放超氧化物歧化酶(superoxide dismutase,SOD)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)等抗氧化酶,以及与ROS作用的抗氧化分子,如抗坏血酸(ascorbic acid,ASA)、还原型谷胱甘肽(reduced glutathione,GSH)和生育酚(tocopherol)等,它们可防止细胞过氧化并维持细胞的氧化还原状态[10]。这些物质能够缓解重金属离子或高H+浓度对微藻的毒性作用,增加其对AMD的环境适应性。
理解嗜酸/耐酸微藻如何适应AMD极端环境是实现利用微藻进行生物修复的研究基础。安徽东部某铁硫矿山酸性废水库形成至今已有50年左右,其微生物多样性较丰富,藻的丰度较高,且其最典型的高浓度有毒金属离子为锰离子[14]。因此,本文从该酸性矿山废水库中筛选获得一株耐酸油球藻,并以其作为研究对象,着重考察不同pH和Mn2+浓度对其生长特性的影响,并通过测定藻生物量、光合色素、MDA和GSH含量以及SOD、APX比活力的变化,分析其对Mn2+胁迫的生理响应机制,以期为酸性矿山废水原位生物修复提供藻株资源,并为其进一步研究提供理论基础。
1 材料和方法 1.1 水样采集 样品取自安徽东部某铁硫矿山酸性废水库,样品于4 ℃下储存并在24 h内带回实验室。
1.2 藻种分离及鉴定
1.2.1 富集和分离: 将采集水样经离心后使用BG11培养基进行培养富集,培养温度25 ℃,光照强度为2500 lx,光照周期为14 h/10 h。对富集获得的样品进行分离纯化,主要步骤为:①取一定量微藻进行梯度稀释,选取适宜稀释度的稀释液注入无菌BG11固体培养基中进行涂布,平板倒置放入光照下培养;②挑取上述培养皿中长出的单藻落,经平板划线法直至分离纯化。利用光学显微镜(Olympus,BX53)观察藻株形态。
用于分离纯化的BG11培养基配方为(g/L):NaNO3 1.5,K2HPO4 0.04,MgSO4·7H2O 0.075,CaCl2·2H2O 0.036,柠檬酸0.006,柠檬酸铁铵0.006,EDTA 0.001,Na2CO3 0.02,H3BO4 0.00286,MnCl2·H2O 0.00181,ZnSO4·7H2O 0.000222,CuSO4·5H2O 0.000079,Na2MoO4·2H2O 0.00039,Co(NO3)2·6H2O 0.000049。
1.2.2 藻株18S rRNA基因提取与测序:: 将纯化的藻种用Ezup柱式真菌基因组DNA抽提试剂盒提取该藻DNA,所用18S rRNA基因通用引物为NS1和NS6 (上海生物工程股份有限公司),PCR反应条件:94 ℃ 4 min;94 ℃ 45 s,55 ℃ 45 s,72 ℃ 1 min;72 ℃ 10 min。扩增结果用1%琼脂糖电泳,150 V、100 mA 20 min电泳观察。
1.2.3 分离藻株18S rRNA基因:: 序列的测定及系统发育树的构建:PCR扩增产物由生工生物工程(上海)股份有限公司进行测序。将获得的序列提交至国家微生物科学数据中心(National Microbiology Data Center),编号为NMDCN0000M5U。并将序列通过NCBI的BLAST进行比对后,利用软件MEGA-X对测序结果和GenBank中所下载的序列进行对位排列,采用邻接法(neighbor-joining method,NJ)构建系统发育树。
1.3 pH对微藻生长过程的影响 以对数生长期的微藻为接种物,接种至150 mL锥形瓶,采用BG11培养基,藻初始接种OD684为0.1,对应细胞干重为0.02 g/L,设置8组实验,初始pH分别为7.0、6.0、5.0、4.5、4.0、3.5、3.0和2.5。定时取样用可见分光光度计(722E,上海精仪)测定684 nm处吸光度,转化为干重表示细胞生物量[15],计算公式为预实验得到的藻细胞干重(DW,g/L)与对应吸光值(A)关系的标准曲线DW=0.4365A–0.0256 R2=0.9975。比生长速率μ (d–1)计算公式为:μ=(lnN2–lnN1)/(t2–t1)。式中N1、N2分别代表t1、t2时刻微藻干重。
1.4 锰离子浓度对微藻生长过程的影响 以对数生长期的微藻为接种物,设置初始pH 3.5,Mn2+初始浓度为5、30和55 mg/L,以不加Mn2+为对照组,藻初始接种OD为0.3,对应细胞干重为0.11 g/L,每隔3 d取样测定其吸光度(684 nm),转化为干重表示细胞生物量。使用pH计(PHS-3E,上海雷磁)测定培养基pH值,火焰原子吸收分光光度计(WYS2200,安徽皖仪)测定培养基中残余的Mn2+浓度。
1.5 水质理化指标和微藻生理生化指标测定 水样pH、温度(T)、氧化还原电位(ORP)和溶解氧(DO)使用六位参数仪(MYRONL 6PFC)于采样现场测定,其他指标于实验室内分析。硫酸盐含量采用离子色谱仪(戴安ICS-900,美国)测定,锰离子等金属离子含量采用电离耦合等离子体原子发射光谱仪(安捷伦7500)测定。
取适量藻液3000 r/min离心5 min弃上清液,蒸馏水洗涤2次后,再次离心,取沉淀加入2 mL磷酸缓冲液(0.05 mol/L,pH 7.8),反复冻融破碎藻细胞,12000 r/min离心10 min (4 ℃),上清液即为粗酶液。
叶绿素含量采用95%乙醇法测定[16]。MDA含量采用硫代巴比妥酸法测定[17]。SOD比活力采用氮蓝四唑法测定[17]。APX比活力采用紫外分光光度法测定[17]。GSH含量采用DTNB-GSH还原酶循环法测定[18]。可溶性蛋白质含量采用福林酚法测定[18]。
1.6 数据分析方法 Microsoft Excel 2010用于数据前期处理。SPSS 18软件用于统计学分析,使用单因素方差分析(one-way ANOVA)分析组间的差异显著性,P < 0.05时有显著差异。
2 结果和分析 2.1 水样理化性质 采集水样的酸性矿山废水pH为3.3,硫酸盐含量超过10 g/L,含有多种金属离子。同国内外其他酸性矿山废水如广东大宝山横石河流域(pH 2.0,Mn2+ < 100 mg/L)[19]、Iberian Pyrite Belt (IPB)酸性矿山废水(pH < 2.5,Mn2+ < 150 mg/L)[20]相比,本研究酸性矿山废水中Mn2+含量高,酸性稍弱(pH > 3),水体中的溶解氧(DO)浓度显著高于一般环境水体,且水样中检测到一定浓度的叶绿素a (表 1)。这说明,该酸性矿山废水库中含有藻类,且藻类的生长代谢可能对该酸性水体的水质变化产生影响。
表 1. 酸性矿山废水样品理化性质 Table 1. Characteristics of surface water of acid mine drainage
| Parameter | Value |
| pH | 3.3±0.036 |
| T/℃ | 24.9±0.84 |
| Oxidation-reduction potential (ORP)/mV | 332.4±1.52 |
| Dissolved oxygen (DO)/(mg/L) | 9.17±0.21 |
| SO42?/(mg/L) | 10924.1±12.49 |
| Chlorophyll a/(μg/L) | 230±2.49 |
| Mn2+/(mg/L) | 336.7±5.83 |
| Cu2+/(mg/L) | 41.2±0.49 |
| Zn2+/(mg/L) | 17.7±0.71 |
| Fe/(mg/L) | 106.9±0.68 |
| Fe2+/(mg/L) | 18.3±0.02 |
表选项
2.2 分离藻株鉴定结果分析 如图 1所示,通过多次平板划线和纯化后,分离获得的藻种MA1为球形或近球形单细胞绿藻。藻种MA1的PCR扩增产物经1%琼脂糖电泳染色获得条带位于1000–3000 bp (图 2)。18S rRNA基因序列和NCBI的BLAST比对结果表明其与油球藻(Greasiella emersonii)相似度达到99.93%。其系统发育树结果表明MA1与Graesiella emersonii NIES-2151 (GenBank登录号:AB488562.1)的自展值为84 (图 3)。因此可认为MA1属Graesiella sp.,故命名为Graesiella sp. MA1。
 |
| 图 1 Graesiella sp. MA1平板划线(A)及显微镜观察(×400) (B) Figure 1 Scribing (A) and microscope image (×400) (B) of Graesiella sp. MA1. |
| 图选项 |
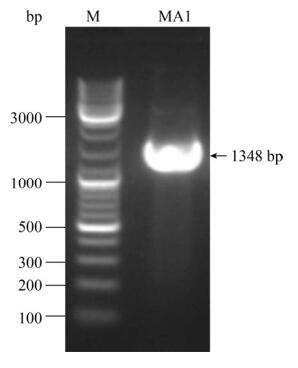 |
| 图 2 Graesiella sp. MA1 18S rRNA基因的PCR产物 Figure 2 PCR product of Graesiella sp. MA1 18S rRNA gene. M: marker. |
| 图选项 |
 |
| 图 3 Graesiella sp. MA1基于18S rRNA基因序列的系统发育树 Figure 3 Phylogenetic tree based on 18S rRNA gene sequence of Graesiella sp. MA1. |
| 图选项 |
2.3 初始pH对Graesiella sp. MA1生长过程的影响 图 4为Graesiella sp. MA1在不同初始pH条件下的生长曲线和比生长速率。结果表明,Graesiella sp. MA1在初始pH 7.0–3.5条件下均能生长(图 4-A),且初始pH对该藻的生长抑制作用随pH的降低逐渐增加。Graesiella sp. MA1的比生长速率随着初始pH的降低呈降低趋势(图 4-B),在pH7.0–2.5,比生长速率从0.20 d–1降低至0.0029 d–1,且各组间均存在显著差异(P < 0.05)。Graesiella sp. MA1在pH 3.5条件下的生长虽然受到了很大程度的抑制,但经过20 d的培养其生物量达到了0.13 g/L,比生长速率也达到了0.082 d–1。初始pH低于3.5时,Graesiella sp. MA1生长情况不佳。因此认为Graesiella sp. MA1最低耐受pH为3.5。
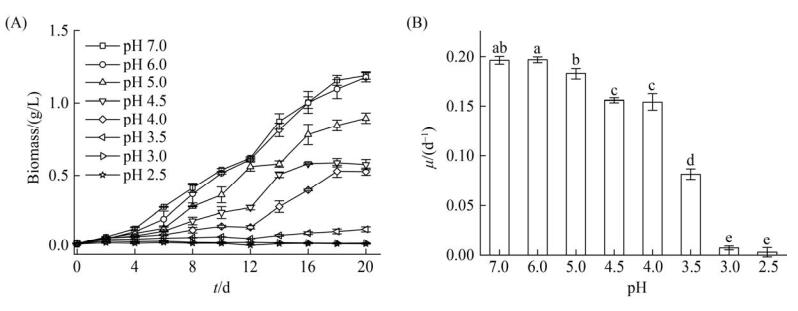 |
| 图 4 不同初始pH条件下Graesiella sp. MA1生长(A)及比生长速率(B) Figure 4 Growth (A) and specific growth rate (B) of Graesiella sp. MA1 at different initial pH. Error bars in figure represent standard deviation, and different letters indicate significant difference (P < 0.05). |
| 图选项 |
2.4 Mn2+浓度对Graesiella sp. MA1生长过程的影响 如图 5所示,当培养基初始pH为3.5时,不同浓度Mn2+对Graesiella sp. MA1生长具有显著影响。培养至第21天时,与对照组的干重值(0.36 g/L)相比,各实验组生物量仅为其83.21%、65.28%和52.81% (图 5-A),这表明在试验浓度范围内,Mn2+的存在抑制了Graesiella sp. MA1的生长,且抑制作用随着锰离子浓度的增加而提高。
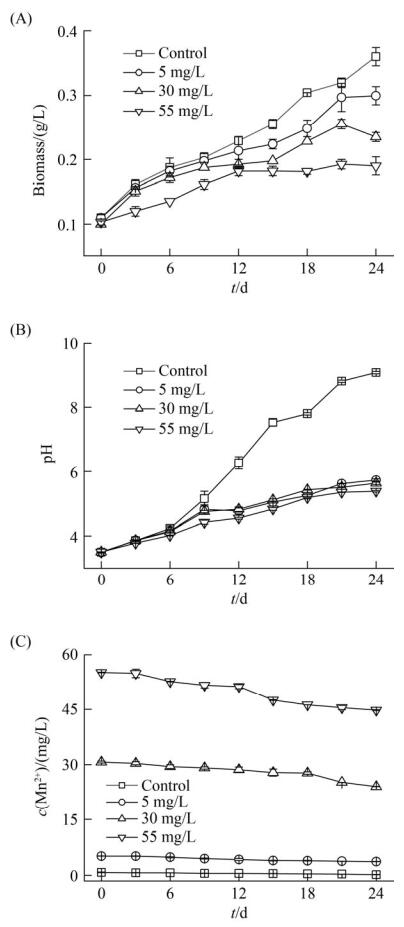 |
| 图 5 Graesiella sp. MA1在含Mn2+培养基中的生长(A)、pH变化(B)及培养基残余Mn2+浓度(C) Figure 5 Analysis of microbial growth (A), variation of the pH value (B), and residual Mn2+ ions concentration (C) in the Mn2+-containing medium with Graesiella sp. MA1. Error bars in this figure represent standard deviation. |
| 图选项 |
随着Graesiella sp. MA1的生长,各实验组pH分别从初始的3.5升高至5.7、5.6和5.4,对照组pH高达9.1 (图 5-B)。这说明Graesiella sp. MA1在生长过程中提高了培养基的碱度,在一定程度上可以中和酸度,提高培养基的pH。Mn2+的存在对该过程具有抑制作用,但不影响pH升高的趋势。
图 5-C所示结果表明,培养至第24天时,5、30、55 mg/L试验组培养基中残余Mn2+浓度分别为3.66、23.98、44.79 mg/L,其去除率分别为28.62%、21.90%和18.84%。这说明,Graesiella sp. MA1具有一定生物除锰的作用。
2.5 Mn2+胁迫对Graesiella sp. MA1叶绿素a/b的影响 如图 6所示,pH 3.5时Mn2+浓度对Graesiella sp. MA1的叶绿素a/b值影响显著(P < 0.05)。对照及5 mg/L Mn2+实验组叶绿素a/b值随培养时间逐渐增加,相比于初始值分别增加了2.95倍和1.76倍。而30和55 mg/L Mn2+实验组叶绿素a/b值则随培养时间逐渐降低,培养结束时相对于初始值分别降低了16.11%和19.15%。此外,在所试浓度范围内,随着Mn2+浓度的增加,Graesiella sp. MA1叶绿素a/b逐渐下降。
 |
| 图 6 pH 3.5时不同初始Mn2+浓度对Graesiella sp. MA1叶绿素a/b的影响 Figure 6 Effects of initial Mn2+ concentrations on the chlorophyll a/b of Graesiella sp. MA1 at pH 3.5. Error bars in the figure represent standard deviation, and different letters indicate significant difference (P < 0.05). |
| 图选项 |
2.6 Mn2+胁迫对Graesiella sp. MA1抗氧化系统的影响 在培养过程中,对照组、5 mg/L和30 mg/L Mn2+实验组MDA含量先降低后升高(图 7-A),55 mg/L实验组MDA则随时间呈上升趋势,表明Mn2+对Graesiella sp. MA1毒害作用随时间逐渐增强。Mn2+浓度对MDA含量有显著影响(P < 0.05)。在第12天时,5 mg/L和30 mg/L实验组MDA含量显著低于对照组(P < 0.05),而55 mg/L实验组MDA含量则要高于对照组;在第24天时,MDA含量随Mn2+浓度的增加而增加。
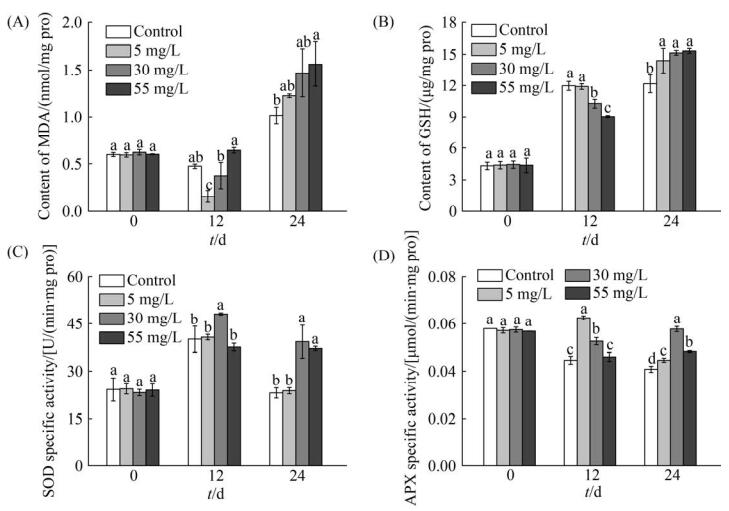 |
| 图 7 pH 3.5条件下不同初始Mn2+浓度对Graesiella sp. MA1 MDA (A)、GSH (B)含量及SOD (C)、APX (D)比活力的影响 Figure 7 Influence of initial Mn2+ concentrations on the MDA (A), GSH (B) content and SOD (C), APX (D) specific activity of Graesiella sp. MA1 at pH 3.5. Error bars in the figure represent standard deviation, and different letters indicate significant difference (P < 0.05). |
| 图选项 |
各组GSH含量随时间变化呈现逐渐升高的趋势(图 7-B)。在第12天时,GSH含量随Mn2+的增加而降低,第24天时GSH含量则呈现出了相反的趋势。
SOD比活力随时间变化明显,各组SOD比活力呈现出先升高后降低的趋势(图 7-C)。在第12天时,SOD比活力在30 mg/L时出现最大值(48.13 U/min/mg pro);在第24天时,Mn2+浓度为0和5 mg/L时的SOD比活力要显著低于30和55 mg/L实验组(P < 0.05)。
APX比活力随时间变化如图 7-D所示,对照组APX比活力在培养过程中逐渐降低,5 mg/L实验组APX比活力呈现先增加后降低的趋势,而30和55 mg/L实验组的APX比活力呈现出先降低再增加的趋势。Mn2+对APX比活力影响显著(P < 0.05),在第12天时APX比活力随Mn2+浓度的增加而降低,且最大值出现在5 mg/L实验组,而在第24天时APX比活力最大值出现在30 mg/L实验组。
3 讨论 有研究者从碱性湖泊、热泉等极端环境中筛选获得油球藻,例如从半碱性的云南程海湖分离获得的Graesiella sp. WBG-1[21]、从水温60 ℃突尼斯北部某温泉分离获得的Graesiella sp. CINS 60[22],这表明油球藻属对环境适应能力强。而本研究从安徽东部某硫铁矿山酸性废水库中分离获得的Graesiella sp. MA1有助于进一步丰富对油球藻属的认识。
当培养基初始pH小于5.0时Graesiella sp. MA1生长受到不同程度的抑制(图 4),这主要是由于高浓度的H+对藻细胞有直接破坏作用,能够降低碳酸酐酶活性,并使微藻细胞质和叶绿体内pH值降低[23],进而影响其光合作用。但培养基初始pH为3.5时,Graesiella sp. MA1仍能够缓慢生长,因此认为其最低耐受pH为3.5。Abinandan等[24]研究也表明培养基pH为3.5时,Desmodesmus sp. MAS1和Heterochlorella sp. MAS3可以在20 mg/L的Mn2+浓度中有良好生长。在本研究中,Graesiella sp. MA1具有提高环境pH的作用(图 5-B),这是由于微藻在光合作用过程中同化无机碳,不断消耗碳酸根和碳酸氢根离子,进而产生大量的OH–从而提高了培养基的碱度[25]。Spirulina sp.生长产生的碱度使得酸性矿山废水中的主要金属离子(Zn、Pb、Fe、Cu)以金属氢氧化物的形式沉淀,并使废水pH从1.8升高至9.0[5]。此外,Graesiella sp. MA1在酸性条件下对Mn2+具有一定的去除作用(图 5-C),这是由于微藻能通过细胞表面官能团与Mn2+结合[7],或是通过生物氧化作用将Mn2+氧化成Mn3+或Mn4+从而析出锰氧化物[5],还有研究发现Desmodesmus sp. WR1通过提高溶液pH和溶解氧浓度间接加速了Mn2+的去除或氧化[26]。Graesiella sp. MA1具体的生物除锰机制尚不明确,有待进一步深入研究。
叶绿素a和叶绿素b是藻细胞中吸收和传递光能的主要物质,其比值叶绿素a/b反映植物光合作用能力的强弱[27]。在本实验中,5 mg/L Mn2+对藻细胞叶绿素a/b影响不显著,30和55 mg/L Mn2+显著降低了叶绿素a/b,这主要是由于Mn是藻类生长所需微量元素之一,因此Graesiella sp. MA1对低浓度的锰离子具有一定的耐受能力,而其过量存在时会影响藻类对P、Mg、Ca及Fe等其他元素的吸收,不利于叶绿素的合成,从而抑制藻类的生长[12]。
MDA是膜脂质过氧化过程产生的重要标志物。随着Mn2+浓度的增加Graesiella sp. MA1细胞中MDA含量升高(图 7-A),这表明藻细胞受到氧化损害[28]。微藻通过启动抗氧化系统,包括酶促和非酶促防御系统来降低过量ROS的毒性作用,从而维持细胞正常的生理代谢过程[13]。GSH作为生物体内重要的抗氧化分子,可以保护巯基免受ROS对其破坏、降解过量ROS[28]。Graesiella sp. MA1在Mn2+胁迫过程中GSH的含量呈现出波动上升的趋势(图 7-B),表明GSH是其应对氧化应激的重要策略。以往的研究也发现Chlorella vulgaris和Chlorella sorokiniana在重金属胁迫时GSH水平会有所上调[28-29]。在本研究中,SOD和APX比活力随Mn2+浓度的增加而升高(图 7-C,7-D),表明抗氧化系统在Graesiella sp. MA1应对Mn2+胁迫过程中具有重要作用,SOD通过催化O2?–发生歧化反应转化为H2O2和氧分子[13],APX通过参与抗坏血酸-谷胱甘肽循环过程中将ASA氧化,并还原H2O2为水分子[9],以降低细胞内ROS的浓度,从而保护机体免受重金属的毒害。
4 结论 从酸性矿山废水库分离得到一株Graesiella sp. MA1,在pH 3.5时仍能够生长,表现出较好的耐酸性能,同时该微藻表现出一定的生物产碱和生物除锰作用。Mn2+显著抑制Graesiella sp. MA1生长,藻细胞生物量随着Mn2+浓度的增加而下降,当Mn2+浓度超过30 mg/L时会对Graesiella sp. MA1产生毒害作用,影响其叶绿素合成。Graesiella sp. MA1的抗氧化系统在其对Mn2+的耐受与解毒方面起到了重要作用。
References
| [1] | Wang J, Zhang SY, He C, She ZX, Pan X, Li YY, Shao R, Shi Q, Yue ZB. Source identification and component characterization of dissolved organic matter in an acid mine drainage reservoir. Science of the Total Environment, 2020, 739: 139732. DOI:10.1016/j.scitotenv.2020.139732 |
| [2] | Zhang SY, Yue ZB, She ZX, Pan X, Shao R, Shi Q, He C, Li YY, Wang J. Characteristics analysis of dissolved organic matter in the acid mine drainage. China Environmental Science, 2020, 40(8): 3401-3407. (in Chinese) 张思宇, 岳正波, 佘智祥, 潘鑫, 邵锐, 史权, 何晨, 李运运, 王进. 某酸性矿山排水中溶解性有机物的特征分析. 中国环境科学, 2020, 40(8): 3401-3407. DOI:10.3969/j.issn.1000-6923.2020.08.018 |
| [3] | Quatrini R, Johnson DB. Microbiomes in extremely acidic environments: functionalities and interactions that allow survival and growth of prokaryotes at low pH. Current Opinion in Microbiology, 2018, 43: 139-147. DOI:10.1016/j.mib.2018.01.011 |
| [4] | Huang LN, Kuang JL, Shu WS. Microbial ecology and evolution in the acid mine drainage model system. Trends in Microbiology, 2016, 24(7): 581-593. DOI:10.1016/j.tim.2016.03.004 |
| [5] | Li YC, Xu Z, Ma HQ, Hursthouse AS. Removal of manganese(II) from acid mine wastewater: a review of the challenges and opportunities with special emphasis on Mn-oxidizing bacteria and microalgae. Water, 2019, 11(12): 2493. DOI:10.3390/w11122493 |
| [6] | Mangal V, Phung T, Nguyen TQ, Guéguen C. Molecular characterization of mercury binding ligands released by freshwater algae grown at three photoperiods. Frontiers in Environmental Science, 2019, 6: 155. DOI:10.3389/fenvs.2018.00155 |
| [7] | Ahmad S, Pandey A, Pathak VV, Tyagi VV, Kothari R. Phycoremediation: Algae as Eco-friendly Tools for the Removal of Heavy Metals from Wastewaters. Bioremediation of Industrial Waste for Environmental Safety, 2020: 53-76. DOI:10.1007/978-981-13-3426-9_3 |
| [8] | Pi YR, Lv YH, Liu Y, Tang YZ, Gao L, Bao MT. Application of microalgae-bacteria symbiosis system in wastewater treatment. Acta Microbiologica Sinica, 2019, 59(6): 1188-1196. (in Chinese) 皮永蕊, 吕永红, 柳莹, 唐永政, 高丽, 包木太. 微藻-细菌共生体系在废水处理中的应用. 微生物学报, 2019, 59(6): 1188-1196. |
| [9] | Abinandan S, Subashchandrabose SR, Venkateswarlu K, Megharaj M. Microalgae-bacteria biofilms: a sustainable synergistic approach in remediation of acid mine drainage. Applied Microbiology and Biotechnology, 2018, 102(3): 1131-1144. DOI:10.1007/s00253-017-8693-7 |
| [10] | Hirooka S, Hirose Y, Kanesaki Y, Higuchi S, Fujiwara T, Onuma R, Era A, Ohbayashi R, Uzuka A, Nozaki H, Yoshikawa H, Miyagishima SY. Acidophilic green algal genome provides insights into adaptation to an acidic environment. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(39): E8304-E8313. DOI:10.1073/pnas.1707072114 |
| [11] | Dean AP, Hartley A, McIntosh OA, Smith A, Feord HK, Holmberg NH, King T, Yardley E, White KN, Pittman JK. Metabolic adaptation of a Chlamydomonas acidophila strain isolated from acid mine drainage ponds with low eukaryotic diversity. Science of the Total Environment, 2019, 647: 75-87. DOI:10.1016/j.scitotenv.2018.07.445 |
| [12] | Wang ML, Jiang YL. Effects of manganese on the growth and fluorescence induction kinetics of Conticribra weissflogii. Environmental Science, 2018, 39(12): 5514-5522. (in Chinese) 王木兰, 姜玥璐. 微量元素锰对威氏海链藻生长及叶绿素荧光的影响. 环境科学, 2018, 39(12): 5514-5522. |
| [13] | Apel K, Hirt H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction. Annual Review of Plant Biology, 2004, 55: 373-399. DOI:10.1146/annurev.arplant.55.031903.141701 |
| [14] | Cao ZM, Banda JF, Pei LX, Wei PF, Xin RR, Dong HY, Hao CB. Microbial community structure characteristics in different mine drainage lakes of an iron mine in Anhui Province. Acta Microbiologica Sinica, 2019, 59(6): 1076-1088. (in Chinese) 曹子敏, Banda Joseph Frazer, 裴理鑫, 卫朋飞, 辛瑞瑞, 董慧渊, 郝春博. 安徽某铁矿不同矿山废水库中微生物群落结构特征. 微生物学报, 2019, 59(6): 1076-1088. |
| [15] | Sarrafzadeh MH, La HJ, Seo SH, Asgharnejad H, Oh HM. Evaluation of various techniques for microalgal biomass quantification. Journal of Biotechnology, 2015, 216: 90-97. DOI:10.1016/j.jbiotec.2015.10.010 |
| [16] | 王学奎. 植物生理生化实验原理和技术. 第2版. 北京: 高等教育出版社, 2006. |
| [17] | Wu M, Zhang WH, Zhou JY, Ma C, Han WJ. Effects of drought stress on growth, physiological and biochemical parameters in fine roots of Quercus variabilis Bl. seedlings. Acta Ecologica Sinica, 2014, 34(15): 4223-4233. (in Chinese) 吴敏, 张文辉, 周建云, 马闯, 韩文娟. 干旱胁迫对栓皮栎幼苗细根的生长与生理生化指标的影响. 生态学报, 2014, 34(15): 4223-4233. |
| [18] | Fu RY, Chen J, Li Y. Glutathione plays an anti-oxidant role in Lactococcus lactis. Acta Microbiologica Sinica, 2006, 46(3): 379-384. (in Chinese) 傅瑞燕, 陈坚, 李寅. 谷胱甘肽在乳酸乳球菌抵抗氧胁迫中的保护作用. 微生物学报, 2006, 46(3): 379-384. DOI:10.3321/j.issn:0001-6209.2006.03.009 |
| [19] | Bao YP, Guo CL, Wang H, Lu GN, Yang CF, Chen MQ, Dang Z. Fe-and S-metabolizing microbial communities dominate an AMD-contaminated river ecosystem and play important roles in Fe and S cycling. Geomicrobiology Journal, 2017, 34(8): 695-705. DOI:10.1080/01490451.2016.1243596 |
| [20] | Gomes P, Valente T, Geraldo D, Ribeiro C. Photosynthetic pigments in acid mine drainage: Seasonal patterns and associations with stressful abiotic characteristics. Chemosphere, 2020, 239: 124774. DOI:10.1016/j.chemosphere.2019.124774 |
| [21] | Wang ZJ, Wen XB, Xu Y, Ding Y, Geng YH, Li YG. Maximizing CO2 biofixation and lipid productivity of oleaginous microalga Graesiella sp. WBG-1 via CO2-regulated pH in indoor and outdoor open reactors. Science of the Total Environment, 2018, 619/620: 827-833. DOI:10.1016/j.scitotenv.2017.10.127 |
| [22] | Ben Ouada S, Ben Ali R, Leboulanger C, Zaghden H, Choura S, Ben Ouada H, Sayadi S. Effect and removal of bisphenol A by two extremophilic microalgal strains (Chlorophyta). Journal of Applied Phycology, 2018, 30(3): 1765-1776. DOI:10.1007/s10811-017-1386-x |
| [23] | Wu YD, Wu YY, Li Q, Zhao K. Effect of pH and fluoride on extracelluar carbonic anhydrase activity and photosynthetic efficiency of Chlamydomonas reinhardtii and Chlorella pyrenoidosa. Journal of Agro-Environment Science, 2011, 30(10): 1972-1977. (in Chinese) 吴运东, 吴沿友, 李潜, 赵宽. pH与氟对莱茵衣藻和蛋白核小球藻胞外碳酸酐酶活性及光合效率的影响. 农业环境科学学报, 2011, 30(10): 1972-1977. |
| [24] | Abinandan S, Subashchandrabose SR, Panneerselvan L, Venkateswarlu K, Megharaj M. Potential of acid-tolerant microalgae, Desmodesmus sp. MAS1 and Heterochlorella sp. MAS3, in heavy metal removal and biodiesel production at acidic pH. Bioresource Technology, 2019, 278: 9-16. DOI:10.1016/j.biortech.2019.01.053 |
| [25] | Wallace J, Champagne P, Hall G. Multivariate statistical analysis of water chemistry conditions in three wastewater stabilization ponds with algae blooms and pH fluctuations. Water Research, 2016, 96: 155-165. DOI:10.1016/j.watres.2016.03.046 |
| [26] | Wang R, Wang S, Tai YP, Tao R, Dai YN, Guo JJ, Yang Y, Duan SS. Biogenic manganese oxides generated by green algae Desmodesmus sp. WR1 to improve bisphenol A removal. Journal of Hazardous Materials, 2017, 339: 310-319. DOI:10.1016/j.jhazmat.2017.06.026 |
| [27] | Luo SS, Cao Y, Ji XS, Xu LM, Wang JY, Wang WL. Effects of water depth on chlorophyll content and antioxidant enzyme activity of Hydrilla verticillata. Chinese Journal of Ecology, 2019, 38(1): 221-228. (in Chinese) 罗姗姗, 曹昀, 纪欣圣, 许令明, 王佳艺, 王文林. 水深对黑藻叶绿素含量和抗氧化酶活性的影响. 生态学杂志, 2019, 38(1): 221-228. |
| [28] | Suman TY, Radhika Rajasree SR, Kirubagaran R. Evaluation of zinc oxide nanoparticles toxicity on marine algae Chlorella vulgaris through flow cytometric, cytotoxicity and oxidative stress analysis. Ecotoxicology and Environmental Safety, 2015, 113: 23-30. DOI:10.1016/j.ecoenv.2014.11.015 |
| [29] | Hamed SM, Zinta G, Kl?ck G, Asard H, Selim S, AbdElgawad H. Zinc-induced differential oxidative stress and antioxidant responses in Chlorella sorokiniana and Scenedesmus acuminatus. Ecotoxicology and Environmental Safety, 2017, 140: 256-263. DOI:10.1016/j.ecoenv.2017.02.055 |
