蚁烁星1,2, 周杨1, 张鲜姣1, 姚青3, 李华平2, 朱红惠1


1. 广东省微生物研究所, 广东省科学院, 华南应用微生物国家重点实验室, 广东省菌种保藏与应用重点实验室, 广东省微生物菌种保藏中心, 广东 广州 510070;
2. 华南农业大学植物保护学院, 广东 广州 510642;
3. 华南农业大学园艺学院, 广东 广州 510642
收稿日期:2020-05-26;修回日期:2020-07-21;网络出版日期:2020-08-05
基金项目:国家自然科学基金(31900084);广东省科技计划(2019B030316010);新疆生产建设兵团重点实验室开放基金(BRYB1301)
作者简介:蚁烁星, 出生于1995年, 华南农业大学与广东省科学院微生物研究所联合培养硕士研究生, 从事研究方向为微生物资源利用与植物保护。主要研究从农田、森林生态系统中挖掘粘细菌等潜在生防菌, 评估粘细菌捕食和抑制植物病原细菌、真菌活性, 并从胞外裂解酶和小分子天然产物两个方面研究粘细菌生防菌的抑菌机制.
*通信作者:朱红惠。Tel/Fax: +86-20-87137581;E-mail: zhuhh@gdim.cn.
摘要:[目的] 基于模拟原位环境策略、可培养粘细菌的营养策略及细菌互作网络,改良分离培养基,以提高分离粘细菌的多样性。[方法] 通过添加土壤浸提液、使用不同种类的诱导菌和改变诱导菌的接种方式设置分离方法,同时以传统的分离方法作对照。[结果] 改良的分离方法比对照组诱导出了更多粘细菌子实体种类,采自4个地区的9份样品共分离纯化出40株粘细菌,按形态学和分子生物学,将其归类于原囊菌属(Archangium)、珊瑚菌属(Corallococcus)、软骨霉状菌属(Chondromyces)、粘球菌属(Myxococcus)、侏囊菌属(Nannocystis)、多囊菌属(Polyangium)、匣状球菌属(Pyxidicoccus)。[结论] 与传统分离方法相比,添加土壤浸提液,诱导菌点接法能大大提高诱导出的粘细菌子实体种类的数目,革兰氏阳性菌和革兰氏阴性菌作为诱导菌对子实体种类影响较小,但是也发现革兰氏阳性菌特异性诱导出的子实体。虽然本研究通过对分离培养基的改良大大增加了子实体种类,但是纯化出的粘细菌种类远少于观察到的子实体种类,说明除改良分离方法外,还需进一步研究粘细菌的纯化方法,提高分离所得粘细菌的多样性,获取更多粘细菌新资源。
关键词:粘细菌分离纯化子实体土壤浸提液诱导菌
Effects of different methods on the formation of fruiting bodies and isolation of myxobacteria
Yi Shuoxing1,2, Zhou Yang1, Zhang Xianjiao1, Yao Qing3, Li Huaping2, Zhu Honghui1


1. State Key Laboratory of Applied Microbiology Southern China, Guangdong Provincial Key Laboratory of Microbial Culture Collection and Application, Guangdong Open Laboratory of Applied Microbiology, Guangdong Microbial Culture Collection Center(GDMCC), Guangdong Institute of Microbiology, Guangdong Academy of Sciences, Guangzhou 510070, Guangdong Province, China;
2. College of Plant Protection, South China Agricultural University, Guangzhou 510642, Guangdong Province, China;
3. College of Horticulture, South China Agricultural University, Guangzhou 510642, Guangdong Province, China
Received: 26 May 2020; Revised: 21 July 2020; Published online: 5 August 2020
*Corresponding author: Honghui Zhu, Tel/Fax: +86-20-87137581; E-mail: zhuhh@gdim.cn.
Foundation item: Supported by the National Natural Science Foundation of China (31900084), by the Science and Technology Project of Guangdong Province (2019B030316010) and by the Foundation for Opening Key Laboratory of Xinjiang Production and Construction Corps (BRYB1301)
Abstract: [Objective] We modified myxobacterial isolation methods based on the in-situ simulation, the nutritional requirements of cultured myxobacteria and myxobacterial interactions with bacteria inferred from co-occurrence network, to obtain more cultured myxobacteria. [Methods] We set experiment by adding soil extract into isolation medium, using Gram-positive bacteria as bait and changing the inoculation method of bait, with traditional methods as control. [Results] More types of myxobacteria fruiting bodies were induced by the modified methods than traditional methods. A total of 40 myxobacteria strains were isolated from 9 soil samples including subtropical forest soil, saline-alkaline soil, and wetland sediment. The isolated myxobacteria were from genera of Archangium, Chondromyces, Corallococcus, Myxococcus, Nannocystis, Polyangium and Pyxidicoccus. [Conclusion] Compared with traditional methods, the addition of soil extract and bait inoculated by spotting can obviously increase the types of fruiting bodies. Although the strains of bait showed little effect on the fruiting bodies, Gram-positive bacteria could induce specific fruiting bodies. In this study, we modified isolation methods of myxobacteria and greatly increased the types of fruiting bodies, but the number of purified myxobacteria were far less than that of fruiting bodies observed, indicating that the improvement of purification is required to obtain more cultured myxobacteria.
Keywords: myxobacteria isolationpurificationfruiting bodysoil extractprey bacteria
粘细菌是一类广泛分布于森林、农田、湿地、沙漠、海洋和盐碱地等生境的细菌,属于变形杆菌门δ变形杆菌纲粘细菌目,是具有多细胞群体行为和复杂生活史的滑动运动细菌,并以能够产生丰富多样、结构新颖、作用机制独特、功能多效的活性天然产物而著称[1-2]。目前已在粘细菌中发现多种具有抗真菌,抗细菌,抗病毒,抗肿瘤等活性的代谢产物,这使得粘细菌成为继放线菌之后的又一大类尚待开发的新型药源微生物资源。此外,粘细菌还是一类捕食性微生物,在捕食过程中通过产生多种抗菌物质和胞外酶杀死猎物细胞,因而在药物开发、水体富营养化治理、植物病害防治、清洁能源生产、废弃物资源化利用等方面具有广阔的应用前景[1]。
粘细菌子实体的发育与形成是其生活史阶段中最引人关注的多细胞群体行为,其子实体的形成需要具备3个基本条件:营养物质匮乏,高细胞密度和固体介质表面[2-3]。在营养缺乏条件下,细胞感受饥饿信号,聚集形成球状或嵴形聚合体,随后逐渐形成子实体[2, 4]。子实体大小一般为10–1000 μm[5],由105–106个细胞组成,形状各异,颜色鲜艳[5-9],这一特征为粘细菌的分类提供了重要依据。根据粘细菌能够形成子实体的特性和子实体的形态学特征,以及粘细菌生长的细胞密度依赖性特点,当前从环境中分离粘细菌的经典方法不同于普通细菌的稀释涂布法,而是通过诱导子实体的形成进而纯化的方法。粘细菌的另一个特点是作为一类广泛的捕食性细菌,通过“狼群捕食”策略分泌次级代谢产物和胞外酶裂解猎物细胞,并获取营养物质[10-13]。根据粘细菌的捕食特性,研究者逐渐形成了基于辅助菌诱导的粘细菌分离方法,即以被捕食细菌作为诱饵,诱导粘细菌从样品中“爬出”而形成子实体。被捕食细菌能够为粘细菌提供营养、能量和生长因子等,显著促进粘细菌的生长和子实体的形成,从而有助于粘细菌的分离培养[14-15]。李百元等[15]报道了利用原位样品中筛选出的不同种类细菌作为被捕食菌株能够诱导获得不同的粘细菌菌株。
目前已有许多研究从土壤、树皮、沉积物、盐碱地等环境中分离出粘细菌[1, 3, 5, 7-8, 15]。基于粘细菌的子实体形成能力、细胞的滑行运动和对细菌的捕食性这三个特点,采用寡营养培养基,并根据粘细菌的“食性”利用不同的底物诱导粘细菌子实体的形成,达到分离纯化粘细菌的目的。经典的粘细菌分离方法有兔粪诱导法、酵母诱导法、大肠杆菌诱导法和纤维素诱导法[16],纯化方法包括转接法、划线法、挖取底部菌落法、水琼脂纯化法、抗生素处理法、水浴加热法、低温处理法等[17-18]。然而,由于粘细菌单个细胞不能形成菌落,生长缓慢,容易被其他生长较快的菌污染,胞外粘液易携带其他微生物,增加了粘细菌分离纯化的难度[7]。这些问题导致粘细菌的分离困难,纯化耗时长,成为一类难培养微生物,其资源挖掘工作远远落后于放线菌等其他药源微生物,目前仅报道的可培养粘细菌仅有3个亚目,10个科,29个属和62个种[1]。可培养资源的匮乏极大地限制了对粘细菌资源的开发,使得其应用研究较其他的微生物类群更为落后。因此,不断发展新的方法来分离和认识环境中尚未被分离培养的新的粘细菌种类,对于获得新的微生物药物具有重要意义。
基于免培养的方法表明,各类环境中存在大量未发掘的粘细菌资源,目前发现的可培养粘细菌仅仅是粘细菌资源宝库的“冰山一角”[1, 19]。目前粘细菌的分离纯化方法所得到的种类不能满足后续粘细菌的应用研究,要继续挖掘粘细菌资源,就必须优化粘细菌的分离方法,以获得更多新的种类。本研究在原有的粘细菌分离方法基础上,尝试添加其他诱导菌或诱导因子,同时设置传统分离方法作对照,探究所设计的几种分离诱导方法对不同土壤样品中粘细菌分离的影响,获取更多粘细菌资源。
1 材料和方法 1.1 样品采集与前处理 样品采自南岭国家森林自然保护区(Nanling National Reserve)、新疆十六团、肇庆星湖湿地公园、广州南沙湿地公园(Nansha Wetland Park)。南岭国家森林自然保护区位于广东省北部和湖南省宜章县两省交界处,是典型的亚热带温湿气候。新疆十六团位于天山南麓、塔里木河源头,气候干燥,降水稀少,属暖温带内陆荒漠气候。星湖湿地公园位于广东省肇庆市区北侧,是一处典型的岩溶湖泊型湿地,为南亚热带季风气候。南沙湿地公园地处珠江出海口西岸,属于南亚热带季风性海洋气候。样品地理信息见表 1。
表 1. 采样点地理信息 Table 1. The geographic information of samples
| Number | Sample site | Latitude | Longitude |
| NL02R1 | Nanling National Reserve | N 24°83′62″ | E 112°79′47″ |
| NL03R3 | Nanling National Reserve | N 24°93′49″ | E 113°00′77″ |
| NL04R3 | Nanling National Reserve | N 24°91′97″ | E 112°97′47″ |
| NL05R3 | Nanling National Reserve | N 24°56′16″ | E 113°00′09″ |
| NL07R1 | Nanling National Reserve | N 24°89′41″ | E 113°02′86″ |
| HL5 | Shiliutuan Town | N 80°55′64″ | E 40°28′09″ |
| HH6 | Shiliutuan Town | N 80°55′54″ | E 40°27′95″ |
| SD27 | Xinghu Wetland Park | N 23°05′07″ | E 112°28′11″ |
| SD34 | Nansha Wetland Park | N 23°02′57″ | E 113°21′34″ |
表选项
采集的样品分别取100 g风干,剩余部分置于4 ℃保存。称取风干样品7.5 g,加缓冲液没过样品,并加入放线菌酮(100 μg/mL)抑制霉菌,充分混匀,静置过夜。
1.2 粘细菌的分离
1.2.1 分离试验设置: 环境中大部分微生物不能在实验室条件下培养,其中一个原因是实验室条件培养不能满足其生长需求[20-21]。粘细菌也是一类难培养微生物,本试验采取的第一个策略是通过添加土壤浸提液,还原生境中的小分子成分,改良分离培养基。
粘细菌中的溶细菌类群可捕食多种细菌,研究人员常用革兰氏阴性菌Escherichia coli作诱导菌,但分离得到的粘细菌多样性较低[15]。针对这个问题,本试验采取的第二个策略是改变诱导菌种类。Zhang等[22]采用同位素标记的方法证实革兰阳性菌Arthrobacter globiformis DSM 2012能够被包括Haliangium属在内的多种粘细菌所利用。此外,在前期研究中根据土壤细菌的共发生网络(Co-occurrence network),发现一些放线菌OTU与粘细菌之间明显的互作。这些结果表明一些粘细菌类群与放线菌等革兰氏阳性菌之间存在一定联系。因此,我们选择A. globiformis DSM 2012作为被捕食菌诱导粘细菌子实体的形成。
本试验采取的第三个策略是改变诱导菌的接种方式,根据Dawid[23]的研究结果,在分离培养基上以点接的方式接种E. coli (ED)或A. globiformis (AD),见图 1-A。同时,对上述的三个策略设置不添加土壤浸提液(SE),大肠杆菌划线诱导法(EH/AH)作为对照组,划线法中的诱导菌以“田字格”方式接种,见图 1-B。
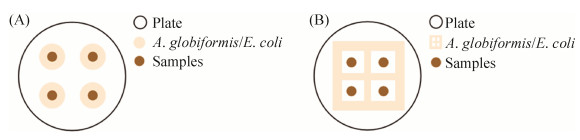 |
| 图 1 诱导菌的两种接种方式示意图 Figure 1 Two inoculation methods of prey. A: predator-spot method; B: predator-cross method. |
| 图选项 |
1.2.2 分离培养基: 土壤浸提液的制备:称取新鲜土壤样品,按水土比3:1的比例加入去离子水,于28 ℃、150 r/min振荡2 h,静置后取上清液。为避免高温高压灭菌对浸提液中不稳定分子的破坏,本研究用0.22 μm滤膜过滤除菌。试验中所用的分离培养基均在灭菌后加入终浓度为25 μg/mL的放线菌酮抑制霉菌生长。分离培养基包括:WCX (CaCl2·2H2O 0.1%,3-吗啉丙磺酸2.093 g/L,琼脂1.5%,pH 7.2)、ST21 (K2HPO4 0.1%,酵母提取物0.002%,KNO3 0.1%,MgSO4·7H2O 0.1%,CaCl2·2H2O 0.1%,FeCl3 0.02%,MnSO4·7H2O 0.01%,微量元素0.01%,琼脂1%,培养基表面放置无菌滤纸)、WCX-SE (WCX添加土壤浸提液)、ST21-SE (ST21添加土壤浸提液)、WCX-SE-EH (E. coli划线于WCX-SE)、WCX-EH (E. coli划线于WCX)、WCX-ED (E. coli点接于WCX)、WCX-AH (A. globiformis划线于WCX)、WCX-AD (A. globiformis点接于WCX)。
1.3 粘细菌子实体的观察与纯化
1.3.1 纯化培养基: MD1培养基(酪蛋白胨0.6%,可溶性淀粉0.2%,MgSO4·7H2O 0.2%,CaCl2·2H2O 0.04 %,pH 7.2)、VY/2培养基(安琪酵母0.5%,CaCl2·2H2O 0.1%,琼脂1.5%,pH 7.2,灭菌后加入终浓度为50 μg/mL VB12)、ST21培养基。
1.3.2 子实体观察与纯化: 接种7 d后,在体式显微镜下观察子实体,挑取子实体转接到纯化培养基,置于30 ℃培养3–7 d,再反复转接子实体或菌膜进行纯化。挑取肉眼辨别已纯化的菌落转接到营养肉汤液体培养基中培养过夜验纯。
1.4 粘细菌的鉴定 根据子实体、营养细胞的形态和颜色对粘细菌进行初步归类,再基于16S rRNA基因进行分子鉴定。用Chelex提取法[24]提取菌株DNA,以通用引物27F/1492R扩增16S rRNA基因,PCR反应体系(25 μL):2×Taq Master Mix 12.5 μL,10 μmol的上下游引物各0.5 μL,模板DNA 1 μL,无菌去离子水10.5 μL。PCR反应程序:95 ℃ 5 min,94 ℃ 45 s,55 ℃ 45 s,72 ℃ 90 s,30个循环;72 ℃ 10 min。将PCR产物电泳检测合格后,送至美吉生物医药科技有限公司测序。
1.5 数据处理 用软件DNAMAN 8拼接16S rRNA基因序列,利用在线分析工具EzBiocloud (http://www.ezbiocloud.net)进行鉴定,并用MEGA-X软件构建系统发育树。将子实体照片与纯化菌株一一对应,按样地、分离方法、形态颜色归类,在R软件中根据子实体有无绘图。
2 结果和分析 2.1 添加土壤浸提液对粘细菌分离的影响 添加土壤浸提液的试验共设置3组,分别是水琼脂平板(WCX/WCX-SE),大肠杆菌诱导法(WCX-EH/WCX-SE-EH)和纤维素诱导法(ST21/ST21-SE)。对照组中出现的子实体形态可分为以下几种:Archangium (颗粒状、簇生,橘红色),Corallococcus (球状、指状,有珊瑚状分支,粉红色),Myxococcus (球状,单生,橙色、黄色),Pyxidicoccus (团粒状,白色),Chondromyces (花冠状,橙色),Polyangium (近球形,粉红色)和Nannocystis (卵球形,浅黄色)。此外,还有一些子实体在后续未能成功纯化,包括unknow 1 (球状,透明),unknow 4 (椭圆形,棕色),unknow 6 (白色,脑状),unknow 7 (波浪状,浅黄色),unknow 8 (晶体状,无色透明),unknow 17、21 (椭圆形,橙色、暗红色),unknow 19、20 (形态不规则,堆生,白色、黑色)和unknow 22 (球状,黄绿色),见图 2-A,C,E。添加土壤浸提液还能够诱导出多种后续为成功纯化的子实体,见图 2-B,D,F。与对照组相比,添加土壤浸提液诱导的子实体种类是对照组的1–3倍,表明在分离培养基中添加浸提液能提高分离粘细菌的多样性。值得一提的是,湿地样品在ST21-SE平板上子实体开始出现的时间比其对照早7 d左右。
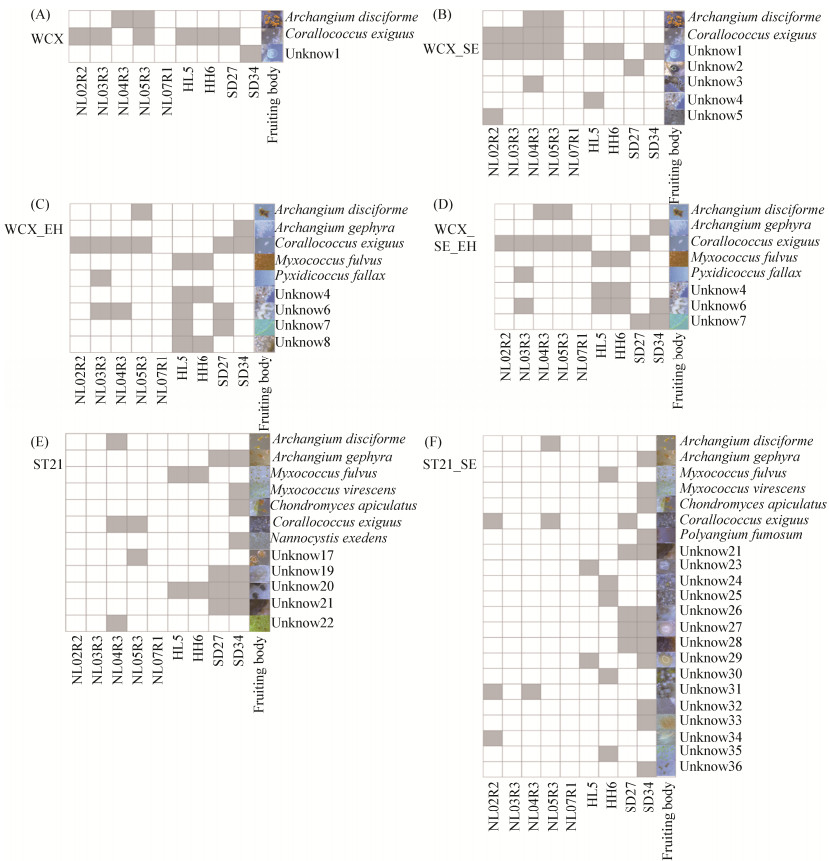 |
| 图 2 添加土壤浸提液试验对子实体形成的影响 Figure 2 The influence of soil extract on the induction of fruiting bodies. The right side of the figure is the type of fruiting body, and the bottom is the sample name. The gray square in the figure indicates that the specific fruiting body was induced. The white square indicates that the specific fruiting body could not be induced. WCX: water agar medium; WCX-SE: WCX medium added with soil extract; WCX-EH: WCX medium steaked with E. coli; WCX-SE-EH: WCX-EH medium added with soil extract; ST21: inorganic salt medium with filter paper; ST21-SE: ST21 medium added with soil extract. "unknow" indicates that this type of fruiting body was not successfully purified. NL02R1, NL03R3, NL04R3, NL05R3, NL07R1 represent Nanling forest soil samples; HL5 and HH6 represent Xinjiang Shiliutuan Town saline-alkaline soil samples; SD27 and SD34 represents wetland sediment. |
| 图选项 |
添加土壤浸提液的处理最终分离纯化的粘细菌种类和菌株数略多于对照组,见表 2。采用添加土壤浸提液的方法最终分离纯化出6个属,8个种,共15株粘细菌,其他种类子实体在纯化过程中由于生长较弱、被杂菌污染覆盖等而无法获得纯培养物。获得纯培养物的粘细菌分别是Archangium disciforme 2株,Archangium gephyra 2株,Chondromyces apiculatus 1株,Corallococcus exiguus 5株,Myxococcus fulvus 1株,Myxococcus virescens 1株,Polyangium fumosum 1株,Pyxidicoccus fallax 1株。不添加土壤浸提液的传统分离方法最终分离纯化出6个属,6个种,共12株粘细菌,分别是A. disciforme 3株,C. apiculatus 1株,C. exiguus 4株,M. fulvus 1株,Nannocystis exedens 1株,P. fallax 1株。
表 2. 添加土壤浸提液的处理组与对照组最终分离纯化的各粘细菌种属数目 Table 2. Myxobacteria strains isolated from medium with soil extract added
| Isolation methods | Archangium disciforme | Archangium gephyra | Chondromyces apiculatus | Corallococcus exiguus | Myxococcus fulvus | Myxococcus virescens | Nannocystis exedens | Polyangium fumosum | Pyxidicoccus fallax |
| WCX | 3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| WCX-SE | 1 | 0 | 0 | 3 | 0 | 0 | 0 | 0 | 1 |
| WCX-EH | 0 | 0 | 0 | 2 | 1 | 0 | 0 | 0 | 2 |
| WCX-SE-EH | 1 | 2 | 0 | 1 | 1 | 0 | 0 | 0 | 1 |
| ST21 | 0 | 0 | 1 | 2 | 0 | 0 | 1 | 0 | 0 |
| ST21-SE | 0 | 0 | 1 | 1 | 0 | 1 | 0 | 1 | 0 |
表选项
2.2 诱导菌种类对粘细菌分离的影响 选择革兰氏阳性细菌球形节杆菌A. globiformis作为诱导菌,以传统方法常用的大肠杆菌作为对照,比较诱导菌种类对粘细菌子实体形成和分离的影响。两种菌均能够诱导A. disciforme,Corallococcus,Pyxidicoccus和unknow 6这四种子实体,见图 3。革兰氏阴性菌E. coli诱导的子实体除了上述四种类型,还有A. gephyra,M. fulvus,unknow 4、7、8,unknow 9、11、12 (球形或卵圆形,黑色,乳白色,橘黄色)和unknow 10(形态不规则,橙色),见图 3-A,C。仅由革兰氏阳性菌A. globiformis诱导的子实体有M. stipitatus (球状带柄,粉红色),unknow 13、15、17、18 (形态不规则,明黄色、白色、橙色)和unknow 16 (球形,褐色),见图 3-B,D。试验结果表明,利用革兰氏阳性菌A. globiformis诱导分离的粘细菌子实体种类中有2/3与革兰氏阴性菌E.coli诱导的种类不同。利用革兰氏阳性菌A. globiformis在新疆土壤样品和湿地样品诱导出了波浪状,粉红色或橙色的子实体(unknow14),见图 3-B,D,但并未由E. coli却未诱导成功,表明这种子实体可能是由革兰氏阳性菌A. globiformis特异性诱导的。
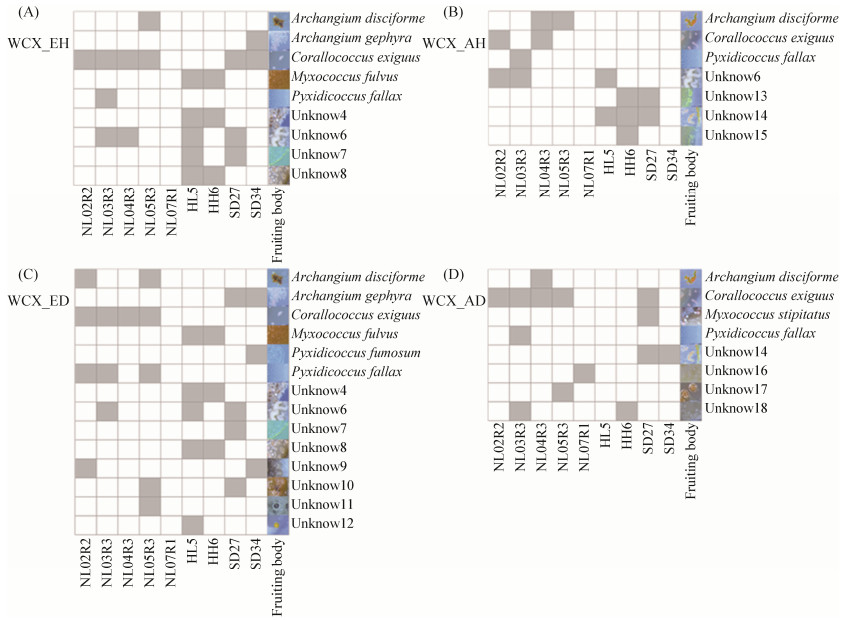 |
| 图 3 革兰氏阳性菌A. globiformis与革兰氏阴性菌E. coli诱导的子实体类型 Figure 3 The types of fruiting bodies induced by Gram-positive bacteria A. globiformis and Gram-negative bacteria E. coli (see the legend in Figure 2). |
| 图选项 |
利用两种诱导菌分离粘细菌,最终纯化出的粘细菌种类不同,见表 3。使用革兰氏阳性菌A. globiformis诱导的方法最终分离出2个属,2个种,2株粘细菌,分别是A. disciforme 1株,M. stipitatus 1株。利用革兰氏阴性菌E.coli诱导的方法最终分离出4个属,4个种,16株粘细菌,分别是A. gephyra 4株,C. exiguus 5株,M. fulvus 2株,P. fallax 5株。
表 3. 不同诱导菌和诱导菌接种方式最终分离的各粘细菌种属数目 Table 3. Myxobacteria strains isolated on different prey strain and inoculation method
| Isolution methods | Archangium disciforme | Archangium gephyra | Corallococcus exiguus | Myxococcus fulvus | Myxococcus stipitatus | Pyxidicoccus fallax |
| WCX-EH | 0 | 0 | 2 | 1 | 0 | 2 |
| WCX-AH | 0 | 0 | 0 | 0 | 0 | 0 |
| WCX-ED | 0 | 4 | 3 | 1 | 0 | 3 |
| WCX-AD | 1 | 0 | 0 | 0 | 1 | 0 |
表选项
2.3 诱导菌接种方式对粘细菌分离的影响 试验设置点接和划线法探究诱导菌接种方式粘细菌对分离的影响。大肠杆菌点接和划线法接种均能够诱导出Archangium,Corallococcus,Myxococcus,Pyxidicoccus,unknow 4、6、7、8几种子实体,见图 4-A,B。除此之外,利用大肠杆菌点接还诱导出Polyangium,unknow 9、10、11、12,见图 4-B。球形节杆菌点接和划线法均能够诱导出A. disciforme、Corallococcus、Pyxidicoccus、unknow 14这几类子实体,见图 4-C,D。另外,仅在球形节杆菌划线法中出现的子实体种类有unknow 6、13、15,见图 4-C。仅在球形节杆菌点接法中出现的子实体种类有M. stipitatus,unknow16、17、18,见图 4-D。这表明,点接的诱导菌接种方式分离到的子实体种类要多于划线的诱导菌接种方式分离的子实体种类。
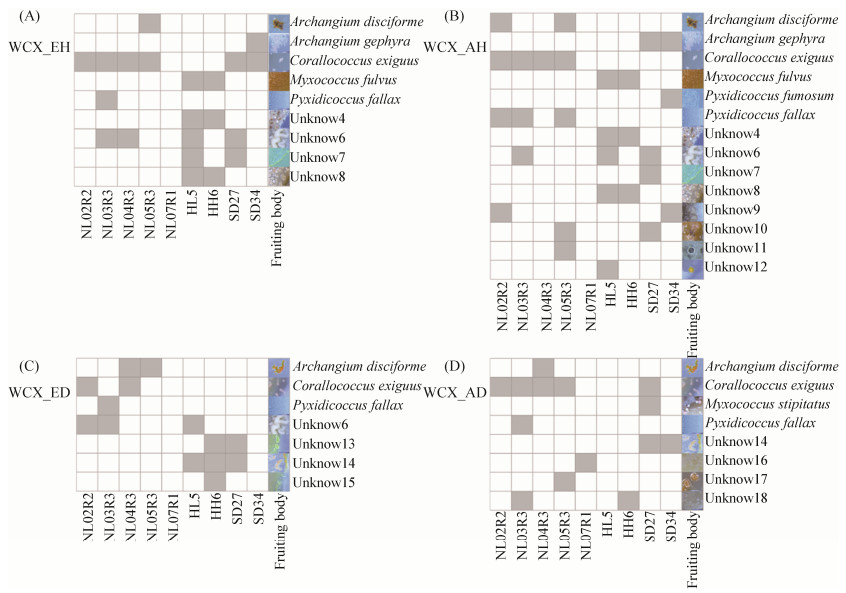 |
| 图 4 诱导菌接种方式对子实体形成的影响 Figure 4 The influence of inducing bacteria inoculation methods on fruiting bodies formation (see the legend in Figure 2). |
| 图选项 |
诱导菌点接的接种方式最终分离纯化出的粘细菌种类和数量比划线接种的方式分离到的粘细菌种类和数量多,见表 3。诱导菌点接的分离方法最终纯化出4个属,6个种,13株粘细菌,分别是A. disciforme 1株,A. gephyra 4株,C. exiguus 3株,M. fulvus 1株,M. stipitatus 1株,P. fallax 3株。诱导菌划线的分离方法最终纯化出3个属,3个种,5株粘细菌,分别是C. exiguus 2株,M. fulvus 1株,P. fallax 2株。
3 讨论 自然界中蕴藏着高度丰富的微生物资源,但可培养微生物的数量不到1%,还有99%的微生物未能获得纯培养[25]。造成这些微生物难培养的原因主要有:(1)人工培养无法复原微生物的原始生态环境;(2)细菌暴露在不利条件下时进入休眠状态,即活的不可培养状态;(3)培养基富营养化,不利于嗜寡营养微生物的生长;(4)微生物生长速度缓慢,在实验室条件下,容易被生长较快的菌覆盖,难以识别和鉴定;(5)微生物细胞之间的信息传递、代谢之间的相互作用以及共同培养关系被忽视。粘细菌在自然界中分布广泛,已通过未培养的手段确定了粘细菌多样性丰富,但目前可培养粘细菌资源匮乏,这已经成为粘细菌开发利用中的重大瓶颈。本研究发现添加土壤浸提液能提高诱导出的粘细菌子实体种类多样性。试验结果表明在添加土壤浸提液的分离培养基WCX-SE、ST21-SE中,粘细菌子实体种类明显多于不添加组,而在WCX-SE-EH中土壤浸提液的优势不明显。原始生态环境不可复原是微生物难培养的原因之一,某些微生物的生长需要特定的助长微生物、营养物质、pH值等生长因子[26-27]。前人通过向培养基中添加五氨基酸短肽、木聚糖、土壤浸提液的方法,获得了新物种[28-30]。本研究的结果表明添加土壤浸提液有助于获得更多子实体种类,利用ST21-SE培养基分离粘细菌时,发现粘细菌的子实体出现的时间比不添加土壤浸提液早了7 d左右,说明土壤浸提液可能提供了粘细菌所需的生长因子。前期制备土壤浸提液时采用的是过滤除菌法,避免了高温高压灭菌对土壤浸提液中不稳定分子的破坏。
粘细菌中的溶细菌类群能捕食其他革兰氏阴性菌和革兰氏阳性菌,但是对革兰氏阴性菌和革兰氏阳性菌的偏好不同[15]。本研究中以革兰氏阳性菌A. globiformis作为诱导菌分离粘细菌,分离结果与李百元等[15]的研究结果相似,革兰氏阳性菌和革兰氏阴性菌均能诱导出几种相同的粘细菌,包括A. disciforme,C. exiguus,P. fallax;在本研究中也存在仅由革兰氏阳性菌或革兰氏阴性菌诱导的种类,例如A. globiformis在新疆盐碱地样品和湿地样品诱导出了波浪状,粉红色或橙色的子实体(unknow14)。导致不同类群细菌对粘细菌的诱导效果不同,存在的可能性有:(1)革兰氏阳性菌与革兰氏阴性菌的细胞壁结构不同[32],粘细菌分泌的细胞壁水解酶种类有差异,导致了被捕食菌对粘细菌诱导效果的差异;(2)从粘细菌的捕食机制与细菌间的互作来讲,粘细菌依靠滑行运动接近“猎物”[10],细胞间的近距离能够扩散和交换小分子[26],这些小分子可能存在双向作用,一方面“猎物”释放的信号刺激粘细菌分泌水解酶参与捕食,另一方面,小分子启动了被捕食菌的防御机制,分泌有毒性的物质抵御粘细菌的捕食,有毒物质可能对某些种类粘细菌有抑制生长的作用,导致出现不同粘细菌对不同类群的细菌偏好差异的现象。
本研究还采取了改变诱导菌接种方式的策略来探究诱导菌接种方式的影响。试验使用的两种诱导菌点接法比诱导菌划线法分离到粘细菌子实体种类更多,与前人研究结果相似[23, 31]。“点接”与“划线”实际上是改变被捕食菌与样品的距离,“点接”缩短了被捕食菌与样品中粘细菌的距离,且“点接”的方式使粘细菌“爬出”时接触到了比“划线”方式更多的猎物,革兰氏阳性菌A. globiformis和革兰氏阴性菌E. coli的点接法分离效果都优于划线法,表明在诱导菌与样品的距离和诱导菌的种类中,诱导菌与样品的距离是影响粘细菌分离效果的主导因素。
本研究使用不同策略改良分离方法,在前期观察粘细菌子实体时达到了预期效果,但最终纯化得到的粘细菌种类远低于前期诱导出的子实体种类,说明在纯化粘细菌方面还有很大的研究空间。分离粘细菌是一个较长的过程,我们在分离时发现,尽管在分离培养基中添加了放线菌酮,但随着时间的增长,部分样品仍长出霉菌或其他杂菌,特别是在森林土壤样品中,到分离后期霉菌几乎覆盖了整个样品,影响了前期分离粘细菌的效率。目前对分离粘细菌的样品处理较为单一,通常是添加放线菌酮或制霉菌素。对不同类型的样品处理的针对性不强,可考虑增加变温处理、调节pH、使用其他抗生素等方法,根据样品的类型和性质采用适合的预处理方法。抗生素处理法、水浴加热法、低温处理法[17-18]等纯化方法等均是从除杂的角度出发进行粘细菌的纯化,但是某些杂菌与粘细菌可能存在依赖关系,一味的除杂不仅达不到纯化效果,而且会导致粘细菌在纯化过程中丢失。因此,粘细菌的纯化不仅要考虑杂菌的干扰,还需从增强粘细菌自身生长的角度出发,根据粘细菌的生长特性和“喜好”设计纯化培养基,找出替代依赖菌提供的生长因子,提高粘细菌的纯化效率。由此可见,除关注粘细菌的分离方法外,还需结合样品的预处理和粘细菌的纯化方法进行更深入的研究,以获得更多粘细菌新资源。
References
| [1] | Mohr KI. Diversity of myxobacteria-we only see the tip of the iceberg. Microorganisms, 2018, 6(3): 84. DOI:10.3390/microorganisms6030084 |
| [2] | Zhou L, Li YZ, Li J. Multicellular morphogenesis in myxobacteria and its molecular regulation. Progress in Biochemistry and Biophysics, 1999, 26(6): 544-547. (in Chinese) 周璐, 李越中, 李健. 粘细菌的多细胞形态发生及其分子调控. 生物化学与生物物理进展, 1999, 26(6): 544-547. DOI:10.3321/j.issn:1000-3282.1999.06.008 |
| [3] | Dworkin M. Recent advances in the social and developmental biology of the myxobacteria. Microbiology Reviews, 1996, 60(1): 70-102. DOI:10.1128/MR.60.1.70-102.1996 |
| [4] | Sutherland IW. Polysaccharides produced by Cystobactev, Archangium, Sorangium and Stigmatella species. Journal of General Microbiology, 1979, 111(1): 211-216. DOI:10.1099/00221287-111-1-211 |
| [5] | 武志华. 内蒙古中部地区粘细菌分离及其抑制马铃薯晚疫病菌的活性和成分研究. 内蒙古农业大学博士学位论文, 2018. |
| [6] | Zusman DR, Scott AE, Yang ZM, Kirby JR. Chemosensory pathways, motility and development in Myxococcus xanthus. Nature Reviews Microbiology, 2007, 5(11): 862-872. DOI:10.1038/nrmicro1770 |
| [7] | Li YZ, Li J, Zhou L, Zhang Y, Hu W, Chen Q. Isolation and identification of myxobacteria. Acta Microbiologica Sinica, 2000, 40(6): 652-656. (in Chinese) 李越中, 李健, 周璐, 张勇, 胡玮, 陈琦. 我国粘细菌(Myxobacteria)资源的分离与鉴定. 微生物学报, 2000, 40(6): 652-656. DOI:10.3321/j.issn:0001-6209.2000.06.015 |
| [8] | Zhang XJ, Lv YY, Zhu HH. Isolation and identification of myxobacteria in virgin forest of Vietnam. Current Biotechnology, 2018, 8(2): 147-152. (in Chinese) 张鲜姣, 吕颖颖, 朱红惠. 越南原始森林粘细菌的分离与鉴定. 生物技术进展, 2018, 8(2): 147-152. |
| [9] | Zhang XJ, Lv YY, Zhu HH. Study on diversity of cultivable myxobacteria in wetland environment. Current Biotechnology, 2018, 8(2): 140-146. (in Chinese) 张鲜姣, 吕颖颖, 朱红惠. 湿地环境可培养粘细菌多样性研究. 生物技术进展, 2018, 8(2): 140-146. |
| [10] | Berleman JE, Allen S, Danielewicz MA, Remis JP, Gorur A, Cunha J, Hadi MZ, Zusman DR, Northen TR, Witkowska HE, Auer M. The lethal cargo of Myxococcus xanthus outer membrane vesicles. Frontiers in Microbiology, 2014, 5: 474. |
| [11] | Rosenberg E, Keller KH, Dworkin M. Cell density-dependent growth of Myxococcus xanthus on casein. Journal of Bacteriology, 1977, 129(2): 770-777. DOI:10.1128/JB.129.2.770-777.1977 |
| [12] | Berleman JE, Kirby JR. Deciphering the hunting strategy of a bacterial wolfpack. FEMS Microbiology Reviews, 2009, 33(5): 942-957. DOI:10.1111/j.1574-6976.2009.00185.x |
| [13] | Xiao Y, Wei XM, Ebright R, Wall D. Antibiotic production by myxobacteria plays a role in predation. Journal of Bacteriology, 2011, 193(18): 4626-4633. DOI:10.1128/JB.05052-11 |
| [14] | Lloyd DG, Whitworth DE. The myxobacterium Myxococcus xanthus can sense and respond to the quorum signals secreted by potential prey organisms. Frontiers in Microbiology, 2017, 8: 439. |
| [15] | Li BY, Xie XL, Zhang XJ, Cai ZP, Zhu HH. Influence of different prey strains on isolation of myxobacteria in saline-alkaline soils of Xinjiang. Acta Microbiologica Sinica, 2013, 53(4): 379-389. (in Chinese) 李百元, 谢小林, 张鲜娇, 蔡卓平, 朱红惠. 不同被捕食细菌对新疆盐碱地粘细菌分离的影响. 微生物学报, 2013, 53(4): 379-389. |
| [16] | 徐文. 粘细菌的分离纯化、鉴定及生物活性物质的筛选研究. 河北大学硕士学位论文, 2013. |
| [17] | Zhang YT, Hui M, Tian Q. Screening of myxobacteria and its application prospects. Biotechnology, 2010, 20(6): 95-98. (in Chinese) 张宜涛, 惠明, 田青. 粘细菌的分离筛选方法及其应用前景. 生物技术, 2010, 20(6): 95-98. DOI:10.3969/j.issn.1004-311X.2010.06.209 |
| [18] | Chang NN, Ou YX, Xu QY, Qian XM, Zheng ZH, Huang YJ. The isolation, identification and activity assays of the myxobacteria. Journal of Xiamen University (Natural Science), 2012, 51(1): 112-116. (in Chinese) 常宁宁, 欧一新, 徐庆妍, 钱晓鸣, 郑忠辉, 黄耀坚. 粘细菌的分离鉴定及活性检测. 厦门大学学报(自然科学版), 2012, 51(1): 112-116. |
| [19] | Liu Y, Yao Q, Zhu HH. Meta-16S rRNA gene phylogenetic reconstruction reveals the astonishing diversity of cosmopolitan myxobacteria. Microorganisms, 2019, 7(11): 551. DOI:10.3390/microorganisms7110551 |
| [20] | Rappé MS, Giovannoni SJ. The uncultured microbial majority. Annual Review of Microbiology, 2003, 57(1): 369-394. DOI:10.1146/annurev.micro.57.030502.090759 |
| [21] | Overmann J, Abt B, Sikorski J. Present and future of culturing bacteria. Annual Review of Microbiology, 2017, 71(1): 711-730. DOI:10.1146/annurev-micro-090816-093449 |
| [22] | Zhang L, Lueders T. Micropredator niche differentiation between bulk soil and rhizosphere of an agricultural soil depends on bacterial prey. FEMS Microbiology Ecology, 2017, 93(9): fix103. |
| [23] | Dawid W. Biology and global distribution of myxobacteria in soils. FEMS Microbiology Reviews, 2000, 24(4): 403-427. DOI:10.1111/j.1574-6976.2000.tb00548.x |
| [24] | de Lamballerie X, Zandotti C, Vignoli C, Bollet C, de Micco P. A one-step microbial DNA extraction method using "Chelex 100" suitable for gene amplification. Research in Microbiology, 1992, 143(8): 785-790. DOI:10.1016/0923-2508(92)90107-Y |
| [25] | Epstein SS. The phenomenon of microbial uncultivability. Current Opinion in Microbiology, 2013, 16(5): 636-642. DOI:10.1016/j.mib.2013.08.003 |
| [26] | 王肖慢. 微生物富集培养过程的宏转录组分析及三株新菌的鉴定. 山东大学硕士学位论文, 2019. |
| [27] | 李维. 粘细菌分离方法探究. 山东大学硕士学位论文, 2014. |
| [28] | Nichols D, Lewis K, Orjala J, Mo S, Ortenberg R, O'Connor P, Zhao C, Vouros P, Kaeberlein T, Epstein SS. Short peptide induces an "uncultivable" microorganism to grow in vitro. Applied and Environmental Microbiology, 2008, 74(15): 4889-4897. DOI:10.1128/AEM.00393-08 |
| [29] | Sait M, Hugenholtz P, Janssen PH. Cultivation of globally distributed soil bacteria from phylogenetic lineages previously only detected in cultivation-independent surveys. Environmental Microbiology, 2002, 4(11): 654-666. DOI:10.1046/j.1462-2920.2002.00352.x |
| [30] | Awal RP, Garcia R, Gemperlein K, Wink J, Kunwar B, Parajuli N, Müller R. Vitiosangium cumulatum gen. nov., sp. nov. and Vitiosangium subalbum sp. nov., soil myxobacteria, and emended descriptions of the genera Archangium and Angiococcus, and of the family Cystobacteraceae. International Journal of Systematic and Evolutionary Microbiology, 2017, 67(5): 1422-1430. DOI:10.1099/ijsem.0.001829 |
| [31] | 丁一秀. 鄂尔多斯高原地区粘细菌的分离鉴定及其拮抗致病疫霉活性的初步分析. 内蒙古农业大学硕士学位论文, 2017. |
| [32] | Desvaux M, Candela T, Serror P. Surfaceome and proteosurfaceome in parietal monoderm bacteria: focus on protein cell-surface display. Frontiers in Microbiology, 2018, 9: 100. DOI:10.3389/fmicb.2018.00100 |
