于殿江, 施定基, 何培民, 贾睿


上海海洋大学海洋生态与环境学院, 上海 201306
收稿日期:2020-04-02;修回日期:2020-05-19;网络出版日期:2020-07-28
基金项目:国家重点研发计划(2019YFC0312604)
*通信作者:贾睿, Tel:+86-21-61900449; E-mail:rjia@shou.edu.cn.
摘要:微藻作为地球上最古老的物种之一,其诞生可追溯到35亿多年前。微藻的种类十分丰富,形态也多种多样。微藻一般都含有叶绿体,因此可进行光合作用,有研究表明微藻固定CO2的能力是陆地植物的10倍。微藻以其丰富的代谢产物及独特的生理特性在可再生能源、生物医药、食品工业和环境监测等方面有着广泛的应用。然而如何在控制成本的前提下对微藻进行规模化培养成为困扰微藻应用行业的一大难题。为此,本文将从微藻的生化特点及其在各领域中的应用、微藻的规模化培养和微藻的采收3个方面对微藻的规模化培养近十年的研究进展进行综述,旨在为微藻高效培养、低成本采收的研究开发提供参考。
关键词:微藻规模化培养光生物反应器微藻采收
Progress in large-scale culture of microalgae
Dianjiang Yu, Dingji Shi, Peimin He, Rui Jia


College of Marine Ecology and Environment, Shanghai Ocean University, Shanghai 201306, China
Received: 2 April 2020; Revised: 19 May 2020; Published online: 28 July 2020
*Corresponding author: Rui Jia, Tel:+86-21-61900449; E-mail:rjia@shou.edu.cn.
Foundation item: Supported by the National Key R & D Program of China (2019YFC0312604)
Abstract: The species of microalgae are very rich and diverse. Microalgae generally contains chloroplasts for photosynthesis. Studies have shown that microalgae's ability to fix CO2 is 10 times that of land plants. Microalgae is widely used in renewable energy, biomedicine, food industry and environmental monitoring due to its rich metabolites and unique physiological characteristics. However, how to scale-up microalgae under the premise of controlling cost has become a difficult problem in the application. Therefore, we review the research progress of microalgae scale culture in the recent ten years from the biochemical characteristics of microalgae and its application in various fields, the three growth modes of microalgae, the application of photobioreactors and the harvesting of microalgae, with a view to providing a basis for the further development and utilization of microalgae.
Keywords: microalgaescale culturephotobioreactormicroalgae harvesting
微藻被认为是世界上最古老的物种之一,研究表明微藻的首次出现可以追溯到大约35亿年前,微藻的种类十分丰富,高达20多万种[1]。微藻既有原核又有真核微生物,具有单细胞或简单的多细胞结构,可以在恶劣的环境中生长和繁殖。微藻在生物能源、生物医药、环境治理等方面日益发挥着重要的作用[2]。研究表明,微藻是一种潜在的可再生燃料来源,微藻生物质能够满足全球25%的能源需求;微藻中富含蛋白质、脂质等营养物质,可以作为动物饲料的蛋白质来源;微藻中可以提取多种化学物质,如胡萝卜素、虾青素、藻胆蛋白等生物活性物质,已被广泛应用于医药和化妆品等领域[3];目前,基于转基因蓝藻开发的防治对虾白斑综合征的对虾疫苗成效显著[4–5];利用废水培养微藻不仅获得了丰富的生物质资源,而且实现了废水的资源化利用[6]。基于微藻的这些优势,使得微藻的规模化培养和资源化利用得到国内外广泛关注。孙溢华[7]等优化使用100 L内置光源的光生物反应器,改3组光源为6组光源,使微藻对数生长期延长36 h,生物量产量显著增加,藻种纯化[8]和微藻采收同样也影响着微藻规模化培养的生产成本。在此背景下,本文结合微藻规模化培养近10年的研究进展,着眼于微藻的3种生长模式、光生物反应器的应用和微藻的采收方法,分析微藻规模化培养的制约因素,以期为微藻的规模化培养提供参考。
1 微藻简介 绝大部分的微藻能够利用太阳光,吸收CO2和水进行光合作用。微藻的个体普遍较小,通常为单细胞或丝状体,直径小于1 mm,只有在显微镜下才能观察到,属于原生动物。微藻的生长环境比较广泛,适应各种栖息地的生长,包括湖泊、池塘、河流、海洋甚至废水。它们可以在较广范围的温度、盐度、pH值和光照强度下生长,既可以单独生长,也可以与其他生物共生。微藻具有以下两个优势:(1)微藻的种类繁多,生化特性独特,能产生很多功能独特的生物活性物质如多糖、蛋白质、类胡萝卜素等,在医药、食品、水产养殖、化妆品等领域具有重要的开发价值。从微藻中获取生物活性物质已经成为微藻资源化利用的重要部分。(2)微藻可以将标记同位素13C、15N和2H带入体内,进而出现在微藻产生的各种代谢产物中。因此,利用微藻可产生稳定性同位素标记的化合物。
2 微藻在各领域中的应用 微藻在可再生能源生产、生物医药、食品工业、环境监测等方面有着广泛的应用[2]。目前能够应用生物技术进行大规模培养或生产产品的微藻主要包括以下4个门类:蓝藻门、绿藻门、金藻门和红藻门。然而,由于微藻种类繁多,生长条件和产业应用也各不相同。
2.1 微藻在生物能源领域中的应用 世界人口的迅速增长和经济的发展大大增加了对燃料能源的需求。由于化石燃料的不可再生性,世界范围内对化石燃料的密集使用导致了化石燃料的渐趋枯竭。因此,作为化石燃料的替代品,生物燃料的开发利用在世界范围业已展开。一些发达国家已经实现了在商业层面生产生物燃料。其中藻类生物燃料已被提出作为下一代生物燃料[9]。它们可以作为生产生物柴油、生物甲烷、生物乙醇、生物氢和生物丁醇的原料[10–11]。这些生物燃料被认为是最有前途的化石燃料替代品,能够提供全球25%的能源需求。
2.2 微藻在生物医学领域中的应用 微藻在生物医学领域中的应用也得到迅速发展,微藻含有各种生物活性物质,如多糖、蛋白质、类胡萝卜素等。多糖的提取以及在化妆品中的应用得到广泛研究;转基因蛋白质在水产生物疾病的防治中也获得重大进展,例如为了防治对虾白斑综合征病毒(WSSV)在凡纳滨对虾中的传播,Jia等[12]成功的利用三亲结合法将vp28基因转入鱼腥藻7120 (Anabaena sp. PCC 7120)中,并以转vp28基因的鱼腥藻7120投喂对虾10 d,之后进行WSSV攻毒,发现投喂转基因鱼腥藻的凡纳滨对虾的存活率达到了68%,显著提高了凡纳滨对虾的存活率。
2.3 微藻在环境治理方面的应用 在环境污染问题日益严重的今天,人们逐渐意识到环境保护的重要性,而微藻在环境治理方面的应用也引起了人们的重视。时文强等[13]利用村镇生活污水规模化培养小球藻不仅解决了村镇生活污水污染环境的问题,而且获得了丰富的能源微藻,推动了微藻能源的产业化发展。陈楠楠[6]选取了酒精发酵废水、城市废水和猪场废水3种行业废水摇瓶培养小球藻,既可以降低微藻的培养成本,又使废水中的营养物质得到了充分的利用。韩松芳等[14]利用城市生活污水培养产油微藻,不仅降低了生物柴油生产成本,还实现了城市生活污水的资源化利用。综上所述,利用废水培养微藻具有广阔的前景,为生态环境治理提供了另一种可能。
2.4 微藻在食品工业领域中的应用 藻类从古代起就被用作食物,是天然抗生素的极佳来源[15]。微藻还可产生各种维生素、多糖和色素。除此之外,藻类还是蛋白质的重要来源,藻类合成丰富的必需氨基酸的能力使之具有成为高蛋白食物的潜力[16]。
3 微藻的规模化培养 微藻的规模化培养始于20世纪50年代,1952年微藻实现了从实验室向大规模培养的跨越式发展[17]。20世纪60年代初日本就开始大规模培养小球藻,20世纪80年代墨西哥和泰国就分别建立了螺旋藻和小球藻规模化培养的新模式。随后,日本、澳大利亚、以色列、美国、巴西和中国等也相继开始了微藻的工业化养殖[18]。近年来,微藻已被广泛应用于水产养殖、营养保健品、药用化妆品、转基因药物、生物能源、环境净化、太空站等领域。除此之外,藻类一方面可以固定空气中的CO2,缓解全球气候变暖,另一方面可以生产生物质原料,符合我们国家可持续发展的理念[19]。想要实现微藻的规模化培养,首先需要对微藻进行纯化,其次需要深入了解微藻的培养方式,设计合适的光生物反应器,探究影响微藻生长的各种因素,目前这是唯一的途径[20]。
3.1 微藻的纯化 微藻在各领域中的应用日益广泛,微藻的规模化培养势在必行。但是由于规模化培养微藻生产环节复杂,接触人员繁多,因此在培养过程中感染病菌的几率也相应地大幅度提高,藻种不纯往往会造成许多不利影响[21]。(1)受到杂藻的稀释,目的产物含量降低严重影响产品的质量和数量;(2)不纯的藻液杂质影响对产品的加工使生产工艺更加复杂繁琐;(3)含杂藻杂菌的产品不仅会降低药效还可能产生毒副作用。
因此,微藻的纯化是规模化培养微藻不可或缺的一步。对于水体藻类的常用分离方法主要集中于利用藻类的生理生化特性实现微藻的分离纯化[22],其方法主要包括以下几种。
第一、利用不同藻类生长环境的不同,包括对氮、磷、无机盐等营养物质的要求不同;对温度、光照、盐度、pH等生长条件的不同;利用微藻对不同抑制剂[23]的敏感性不同;利用藻细胞直径大小的差异不同,最终达到初步分离纯化的目的。Hong[24]利用亚胺培南具有广谱抗菌性杀灭绝大多数的异养菌,利用卡那霉素清除亚胺培南残留的污染物达到杀菌和纯化藻种的目的。
第二、使用毛细管分离微藻[25],即在显微镜下将毛细管人为拉长,吸取单个藻细胞进行培养,其优点是可直接获得纯种藻细胞,缺点是技术要求相对较高。
第三、使用稀释培养及平板划线[26]的方法,待平板上长出单一菌落后划线可分离得到单一的纯藻种。在使用传统的平板划线、涂布的方法获得单藻落后,还可以使用RT-qPCR、电泳和Western blotting的分子生物学手段来区分转基因藻和野生型藻[8]。
3.2 微藻的培养方式 微藻的生物量是其系列产物的基础,微藻主要通过光合作用积累生物量,同时生物量正是测定微藻的生长和生产力的重要因素。而如何提高微藻的产量以及探究微藻合适的培养方式是进行下一步研究的基础。微藻具有多种营养方式,其中大多数是以光合自养的方式进行生长,具有能耗低的优势;也有一部分的微藻是利用外来有机物进行异养生长,通过异养生长可以解决光抑制和CO2供应不足的问题;除此之外,还有部分微藻既可以利用CO2进行光合作用也可以利用外来有机物进行异养生长,此生长模式称为混养。
3.2.1 光自养: 光自养是指微藻直接利用太阳能,固定大气中的CO2进行生长,是目前微藻规模化培养的主要方式[19]。微藻单位CO2固定能力是陆生植物的10–50倍[27]。CO2固定是指微藻通过光合作用[28],在腺嘌呤核苷三磷酸(Adenosine triphosphate,ATP)和还原型烟酰胺腺嘌呤二核苷酸磷酸(Triphosphopyridine nucleotide,NADPH)提供动力的条件下,将CO2和水转化为有机化合物的过程。与陆生植物相似,微藻同样借助卡尔文循环捕获二氧化碳,包括羧化、还原和再生3个阶段[27]。在微藻中,CO2通过细胞壁、细胞膜、细胞质、叶绿体膜、基质和细胞外边界层的连续交叉传递到核酮糖-1, 5-二磷酸羧化酶上[29],最终实现碳的固定。
3.2.2 异养: 异养被定义为使用外来有机化合物促进自身生长[30]。异养生物的底物和能量需求均来自于其他生物合成的有机化合物[31]。异养培养的基本培养基组成与自养培养相似,唯一不同的是添加了有机碳源[32]。有机碳源主要为糖类、醋酸盐和有机酸等[33]。其优点是不仅提高了微藻的培养密度,还消除了光照的限制。在异养培养过程中,微藻具有代谢多样性和灵活性,常随着有机碳源的变化导致代谢衍生物的变化[34]。同时低成本和操作简便成为异养生长的主要优势,这为获得高密度的微藻细胞和大规模培养微藻提供了一种经济可行的方法[35]。值得注意的是在某些异养生长条件下,微藻的生物量远远高于自养生长的微藻生物量[36–38]。
3.2.3 混养: 混合培养结合了自养和异养两种培养方式的优势,以光能和CO2等无机碳源为主,同时以有机碳源为辅[39],不仅充分利用了环境中的资源,而且提高了微藻的培养密度,消除了光抑制。Orus等[40]通过光自养、异养和混合培养3种培养方式对小球藻进行实验室的规模化培养,结果发现混合培养的小球藻的密度远远高于光自养和异养。但是此种方法需要使用专门的光生物反应器,培养过程既需要保证无菌,又需要外界提供充足的光照,培养成本相对较高。
3.3 光生物反应器 微藻在可再生能源、生物医药和食品工业等领域有着广阔的前景,而光生物反应器(Photobioreactor,PBR)在规模化培养中发挥着至关重要的作用。目前,由于光生物反应器的设备投资和运行成本高且寿命相对较短,故其应用于微藻的规模化培养仍旧很难[41]。典型的光生物反应器是一种以培养基为液相、细胞为固相、富CO2的空气为气相的自噬培养三相体系。光作为一个独特的特征是一个叠加的辐射场,通常被称为第四相[42]。目前,光生物反应器主要包括开放式和封闭式两大类。市面上也已出现了各种类型的光生物反应器,包括跑道式[43]、蓄水池式[44]、柱式[45]、管道式[42]、平板式[46]、塑料袋式[47]等。接下来将对开放式和封闭式光生物反应器的类型、基本结构及其优缺点进行详细介绍。
3.3.1 开放式光生物反应器: 开放式光生物反应器主要分为自然池塘、人工池塘、带搅拌装置的循环池以及人工制作的开放式光生物反应器等[48](图 1)。其构造简单、成本低廉、操作方便的优点使其成为目前微藻商业化培养中应用最广泛的系统[46]。开放式光生物反应器以太阳光为主要光源,由于太阳光的穿透力有限,在规模养殖中多进行浅水养殖,并采用泵或浆轮使藻液达到有效混合,此培养方式多为单层跑道池培养。2014年Schoepp等[43]在8000 L的跑道池中培养二形栅藻(Scenedesmus dimorphus),采用自然光源,测定藻的平均生长率可达0.054 g/(L·d),最大密度为0.625 g/L。
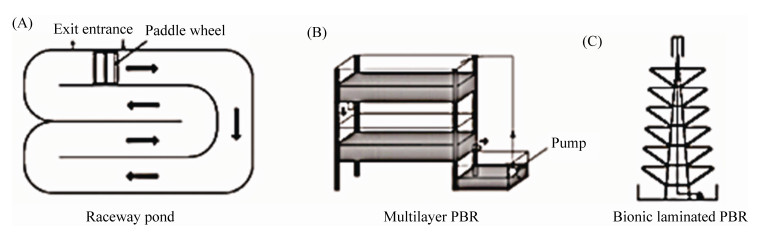 |
| 图 1 三种开放式光生物反应器[46] Figure 1 Three open type photobioreactors[46]. A: Raceway pond; B: Multilayer PBR; C: Bionic laminated PBR. |
| 图选项 |
尽管开放式的跑道池成本低、操作简单,但由于其露天的原因,易受环境、气候的影响,易受杂藻、杂菌的污染,同时反应器占地面积大,其光合效率也相对较低。为此,Hu等[49]设计了开放式多层光生物反应器,藻液可以利用重力进行流动,降低了成本,同时减少了反应器的占地面积。但同时多层光生物反应器也具有上层遮蔽下层太阳光的缺点,为此刘玉环等[50]设计研制了仿生型叠层式微藻光生物反应器。他们借助仿生学的原理,通过调整储液槽的倾角使太阳光可以被微藻充分利用。
3.3.2 封闭式光生物反应器: 封闭式光生物反应器主要包括柱式光生物反应器、平板式光生物反应器、管道式光生物反应器和塑料袋式光生物反应器。它们的优缺点见表 1。
表 1. 封闭式光生物反应器的优缺点 Table 1. Advantages and disadvantages of closed photobioreactors
| Type of PBR | Advantages | Disadvantages |
| Column PBRs | High mass transfer efficiency; low shear force; high light energy utilization and high density of microalgae | The culture size is small; high capital cost; high cleaning cost |
| Flat plate PBRs | Low power consumption; good mixed mass transfer; high light energy utilization and high density of microalgae; long lifespan | Short light path and difficult amplification; high capital cost |
| Tubular PBRs | Large illumination surface area and high land utilization | High pH, CO2 and O2 gradients; prone to cell attachment; cleaning difficulties |
| Plastic bag PBRs | Good ductility and low capital cost in the short term | Bad mixing; cleaning difficult; short lifespan |
表选项
柱式光生物反应器主要由种子罐、发酵罐、气体发生装置、控制装置和光源组成。种子罐负责藻种的储存;发酵罐即规模化培养的生产罐;气体发生系统主要负责光反应器的灭菌和充气;控制装置连接一台计算机,可实时调控温度、光照、pH、溶解氧(Dissolved oxygen,DO)等,实现光反应器的自动化管理;光源包括外置光源和内置光源,外置光源操作方便,但光能利用率低,当藻液达到一定浓度时,光能传播的衰减作用也逐步加剧,由此造成反应器内部出现暗区[51],暗区出现后藻细胞的生长就会达到极限,藻细胞的增殖也随之停止,为此孙溢华等[7]设计使用内置光源大大提高了光能的利用率,藻细胞生物量也得到了大幅度提高。柱式光生物反应器具有传质效率高、混合均匀、剪切力小、光能利用率高、微藻培养密度高等优点,但因为其培养体积小、成本高昂、清洗困难等问题使其很难大规模应用于实际生产[52],多应用于实验室规模的微藻培养研究。
平板式光生物反应器的应用比较广泛,反应器材质也比较多样,如玻璃、树脂玻璃等各种材料均可应用于平板式光生物反应器[53]。平板式光生物反应器根据藻液混合的方式可分为气升式和泵循环平板光生物反应器。气升式平板光生物反应器采用气升系统促进藻液混合,泵循环即通过空气泵促进藻液的循环。平板式光生物反应器具有光照表面积大、微藻培养浓度高、光照利用率高等优点,但平板式反应器的光路径短,放大困难,同样也增加了生产成本。
管道式光生物反应器是一种比较合适和相对可行的户外大规模培养的光生物反应器,具有相对较大的光照表面积,可以利用空气泵实现藻液在管道内的循环[54]。制作材料通常采用透明的玻璃管或者塑料管[55–57],管道采取不同的模式(如直、弯、螺旋)排列,以最大限度地获取阳光。为了提高土地的利用率,管道通常以水平的栅栏式进行排列,这也相应地增加了运营成本[58]。管道式光生物反应器的直径一般为10 mm,最大可达60 mm[42]。然而管道式光生物反应器仍然存在许多缺点,管道式光生物反应器由于内部直径较小,极易发生细胞贴壁现象,增大流体阻力,影响光线射入,导致微藻的光合效率下降。为此,及时进行机械清洗是必不可少的一部分[58]。同时,还应考虑CO2和O2的梯度以及反应器出入口之间的pH值的差别。由于传质的问题,通常导致曝气区溶解二氧化碳(Dissolved carbon dioxide,DCD)浓度较高,而在脱气区DO浓度较高[59]。此外由于管道的体积有限,通常在管道外额外添加一密闭的储液桶,大大提高了反应器的培养体积。
塑料袋式光生物反应器是一种极具发展前景的新型反应器,由于其成本低廉,近年来在微藻的工业化生产中受到越来越多的关注。2014年Schoepp等[43]使用塑料袋、跑道池和蓄水池3种方式培养二形栅藻和微拟球藻发现塑料袋式反应器的生产力是最高的。由于塑料袋的可延展性和低成本性在规模化培养雨生红球藻中也获得越来越多的重视[60]。其中比较有代表性的厂商是Supreme Biotechnologies公司和Maui Tropical Algae Farm公司[47]。2013年Chen等[61]使用塑料袋式光生物反应器大规模培养小球藻(Chlorella sorokiniana,CY1)。但是塑料袋的清洗及其寿命短的问题也是阻碍其发展的重要原因。
3.4 影响微藻规模化培养的因素 随着微藻规模化培养研究开发的深入,探究制约微藻规模化培养的因素同样至关重要。2010年Grobbelaar[62]提出了以下八大因素。
(1) 培养深度或光学截面。在开放式跑道池中光照随着培养深度的增加而逐渐衰减,而在封闭的光生物反应器中,光衰减和分布则更为复杂。(2)混合和由此产生的传质。封闭式光生物反应器较开放式的跑道池拥有更好的混合传质。(3)营养物质和CO2的供应以及赤字区的预防。(4)生物量浓度即培养密度。(5)操作方法的选择:分批、半连续或连续培养。(6)温度以及DO值。(7)微藻培养产生的有机渗出物,可能存在自抑制作用。(8)外来物种的入侵。
除以上所述8个方面,光质[63]、生产成本[43]、pH值和盐度亦是影响微藻规模化培养的因素。在进行微藻规模化培养之前需要对以上影响因素进行详细考量。
4 微藻的采收 尽管微藻的应用范围很广,且已经探索出了几种途径来降低微藻培养的成本,但微藻的规模化培养仍有很长的路要走。首先,利用废水培养微藻显著降低了生产成本和对淡水的需求;其次,基于生物精炼厂的生产高价值产品的策略同样也降低了生产成本;最后应该研究一种低成本的采收方法,有数据表明微藻的采收占微藻粉生产成本的20%–30%[64–66]。此外,微藻的表面携带负电荷,细胞携带高铝有机物(AOM),使微藻分散状态保持稳定[67]。目前,还没有一种既经济可行又高效的微藻采收方法。因此,降低采收成本被认为是生产微藻生物量可持续发展的关键因素[65]。为了降低成本,通常采用两步分离的方法来收集微藻:第一步,浓缩,将微藻液浓缩到悬浮固体总量的7%左右;第二步,脱水,使悬浮固体浓度达15%–25%[68]。
微藻采收主要包括化学絮凝、生物絮凝、重力沉降、浮选、电处理和过滤离心[69]等6种方法(表 2)。
表 2. 采收方法的优缺点 Table 2. Advantages and disadvantages of harvesting methods
| Harvesting method | Advantages | Disadvantages |
| Chemical coagulation | Easy to operate No energy requirements | Chemical ?occulants may be expensive and toxic to microalgal biomass Recycling of culture medium is limited |
| Auto and bio?occulation | Low cost. Low energy consumption; Allows culture medium recycling; Non-toxic to microalgal biomass | Changes in cellular composition Possibility of microbiological contamination |
| Gravity sedimentation | Simple and the inexpensive method | Time-consuming Possibility of biomass deterioration Low concentration of the algal cake |
| Flotation | Feasible for large scale applications Low cost method Low space requirements Short operation times | Generally requires the use of chemical ?occulants Unfeasible for marine microalgae harvesting |
| Electrical based processes | Applicable to a wide variety of microalgal species Do not require the addition of chemical ?occulants | Poorly disseminated High energetic and equipment costs |
| Filtration and centrifugation | High recovery ef?ciencies Suitable for almost all microalgal species | The possibility of fouling/clogging increases operational costs Expensive method High energy requirements Suitable only for the recovery of high-valued products |
表选项
4.1 化学絮凝 化学絮凝是实现微藻采收工艺优化的主要途径,化学絮凝可以定义为细颗粒在悬浮液中凝聚成更大的团聚体,然后凝聚成更大的絮凝体,最后沉降到容器底部。化学絮凝具有操作简单方便、无能源需求等优点,同时由于部分化学絮凝剂是昂贵且有毒的化学物质,因此不能重复使用培养基[68]。
4.2 生物絮凝或自絮凝 尽管生物絮凝和自絮凝具有不同的现象,但通常我们认为生物絮凝和自絮凝是同一个概念。自絮凝成本低、能耗低且对微藻无毒,而且不需要使用絮凝剂,使得培养基可以重复使用[70]。而生物絮凝是指由水中微生物分泌的生物高分子引起的微藻絮凝,最常见的是由胞外多聚物(Extracellular polymeric substances,EPS)引起的絮凝[65]。细菌产生的絮凝剂是实现微藻生物燃料可持续生产的重要经济手段,同时生物絮凝消除了对化学絮凝剂的需求,具有一定的应用价值。然而,微藻与细菌、真菌的共培养有可能导致微生物的污染,影响微藻生物量的产量和质量[71]。
4.3 重力沉降 重力沉降法适用于各种微藻,并具有很高的能量效率。因此,当最终产品的价值较低时可选择重力沉降法收集微藻[64],但是微藻沉降速率只有0.1–2.6 cm/h,导致沉降过程中大量生物质恶化,限制了此种方法在常规收获中的应用。为了加快微藻沉降,通常在重力沉降之前采用化学絮凝。
4.4 浮选 浮选通常被定义为反向沉淀,这一过程通常应用于废水处理过程,浮选法比沉淀法收获微藻效率更高。浮选法已成功地应用于淡水微藻的分离,是一种很有前途的低成本的大规模捕收方法。但海洋微藻的浮选因为受到盐度的干扰导致对浮选产生一定的影响。泡沫浮选已被证明是一种很有前途的微藻工业化采收方法,Huang等[72]制备了一种新型的表面活性剂N, N′-双(十六烷基二甲基)-1, 4-丁烷二溴化二铵,简称BCBD,并首次作为采收剂使用,使浮选收获性能得到明显提高。
4.5 电处理 尽管微藻采集的电处理方法没有得到推广和应用,但是利用电处理的方法收集微藻可以应用于所有微藻生物量的采集,电极材料的选择尤为重要,据测算铝电极的收集率可达100%,而铁电极的去除率仅为78.9%[68]。
4.6 过滤离心 过滤是脱水的一种主要方法,通常在混凝或絮凝后使用,以提高收获效率,它的应用需要维持整个系统的压降,以迫使藻液通过过滤膜。在此过程中,微藻沉积在过滤膜上,在恒压降的作用下,微藻沉积在过滤膜上的厚度逐渐增大,阻力增大,过滤通量减小[73]。这种现象(称为污垢/堵塞)是与过滤方法相关的主要缺陷,增加了它们的运行成本[65]。临界通量被定义为在膜上产生不可逆沉积的最低通量;离心是最快的收获方法,但也是最昂贵的,因为它的设备贵,能耗高,限制了其在大生产上的应用。
以上介绍了微藻采收的6种方法,但是,目前还没有一种通用的方法能够高效地应用于收获所有的微藻。微藻采收应根据微藻的性质、细胞形态、大小和细胞表面的性质、培养基的性质以及最终产品的质量和价值来设计一种有效的方法。此外,为了提高收获效率和降低成本,通常会联合应用两种甚至多种采收方法。比如生物絮凝后的重力沉降是一种经济有效的微藻生物量的回收方法,同时,为了避免化学试剂的毒性和生物絮凝过程中的微生物污染,电凝法可能是一种潜在的替代方法。
5 总结和展望 本文综述了近10年来微藻规模化培养的研究进展,首先介绍了微藻的生理特性及其在各领域中的应用、微藻的生长方式、光生物反应器的应用,最后介绍了影响微藻规模化培养的各种因素及微藻采收常用的6种方法。首先,光自养和异养相结合的微藻培养方式是效率最高的培养模式;其次在光生物反应器的选择上,生物质产量、生产效率和生产成本成为选择的必要条件,塑料袋式光生物反应器的广泛应用可能成为微藻规模化培养最有发展潜力的方法;最后,微藻生物量采收方法的选择同样是影响最终生产成本的重要问题,多种采收过程的联合使用可以显著提高收获效率,降低生产成本,同时电处理法的深入研究也为微藻高效率的采收提供了可能。微藻规模化高效培养仍有很长的路要走,通过深入研究微藻自养、异养及混养方式的特点,并利用合适的光生物反应器,采取合适的采收方法,将微藻规模化培养与环境治理相结合,必将有利于微藻产业的长远发展。
References
| [1] | Su YY, Mennerich A, Urban B. Municipal wastewater treatment and biomass accumulation with a wastewater-born and settleable algal-bacterial culture. Water Research, 2011, 45(11): 3351-3358. DOI:10.1016/j.watres.2011.03.046 |
| [2] | 陈宁.基于CFD的柱状微藻光生物反应器进气布置及其内部结构的优化设计.华中科技大学硕士学位论文, 2017. |
| [3] | Dhargalkar VK, Verlecar XN. Southern ocean seaweeds:a resource for exploration in food and drugs. Aquaculture, 2009, 287(3/4): 229-242. |
| [4] | Zhai YF, Shi DJ, He PM, Cai CE, Yin R, Jia R. Effect of trans-vp28 gene synechocystis sp. Pcc6803 on growth and immunity of Litopenaeus vannamei and defense against white spot syndrome virus (WSSV). Aquaculture, 2019, 512: 734306. DOI:10.1016/j.aquaculture.2019.734306 |
| [5] | Zhu C, Shi DJ, Liao SY, He PM, Jia R. Effects of Synechococcus sp. PCC 7942 harboring vp19, vp28, and vp (19+28) on the survival and immune response of Litopenaeus vannamei infected WSSV. Fish & Shellfish Immunology, 2020, 99: 1-8. |
| [6] | 陈楠楠.小球藻基于废水的异养发酵试验研究.南阳师范学院硕士学位论文, 2019. |
| [7] | 孙溢华.转vp28基因工程聚球藻的规模培养与采收.上海海洋大学硕士学位论文, 2016. |
| [8] | Zhu JC, He CJ, Jia XH, Gu J, Shi DJ, Zhuang MM, Feng SY, Jia R, Luan BR, He PM. Separation and purification for transgenic Anabaena sp. PCC 7120 and its subspecies. Journal of Shanghai Ocean University, 2018, 27(5): 645-655. (in Chinese) 朱嘉诚, 贺婵娟, 贾晓会, 顾娟, 施定基, 庄旻敏, 冯思豫, 贾睿, 栾必荣, 何培民. 转基因及相关亚品系鱼腥藻的纯化. 上海海洋大学学报, 2018, 27(5): 645-655. |
| [9] | Georgianna DR, Mayfield SP. Exploiting diversity and synthetic biology for the production of algal biofuels. Nature, 2012, 488(7411): 329-335. DOI:10.1038/nature11479 |
| [10] | Harun R, Danquah MK, Forde GM. Microalgal biomass as a fermentation feedstock for bioethanol production. Journal of Chemical Technology and Biotechnology, 2010, 85(2): 199-203. |
| [11] | Ho SH, Chen WM, Chang JS. Scenedesmus obliquus CNW-N as a potential candidate for CO2 mitigation and biodiesel production. Bioresource Technology, 2010, 101(22): 8725-8730. DOI:10.1016/j.biortech.2010.06.112 |
| [12] | Jia XH, Zhang CL, Shi DJ, Zhuang MM, Wang X, Jia R, Zhang ZY, Huang J, Sun YH, Qian WY, Peng GH, He PM. Oral administration of Anabaena-expressed VP28 for both drug and food against white spot syndrome virus in shrimp. Journal of Applied Phycology, 2015, 28(2): 1001-1009. |
| [13] | 时文强.村镇生活污水高效培养小球藻的环境优化研究.兰州理工大学硕士学位论文, 2019. |
| [14] | 韩松芳.城市污水中斜生栅藻产脂促进条件及作用机制研究.哈尔滨工业大学博士学位论文, 2018. |
| [15] | Jensen GS, Ginsberg DI, Drapeau C. Blue-green algae as an immuno-enhancer and biomodulator. JANA, 2001, 3(4): 24-30. |
| [16] | Khan MI, Shin JH, Kim JD. The promising future of microalgae:current status, challenges, and optimization of a sustainable and renewable industry for biofuels, feed, and other products. Microbial Cell Factories, 2018, 17(1): 36. DOI:10.1186/s12934-018-0879-x |
| [17] | Burlew JS. Algal culture: from laboratory to pilot plant. Washington, Carnegie Institution, 1953: 41-59. |
| [18] | Hossain NM, Teuku Meurah Indra Mahlia. Progress in physicochemical parameters of microalgae cultivation for biofuel production. Critical Reviews in Biotechnology, 2019, 39(6): 835-859. DOI:10.1080/07388551.2019.1624945 |
| [19] | Lü X, Sun RW, Zhang HB. Development of mass cultivation technology for microalgae. Applied Chemical Industry, 2019, 48(6): 1487-1490. (in Chinese) 吕旭, 孙仁旺, 张红兵. 微藻规模化培养技术研究进展. 应用化工, 2019, 48(6): 1487-1490. DOI:10.3969/j.issn.1671-3206.2019.06.052 |
| [20] | Li X, Wang WL, Huang JK. Research progress and industrialization of microalgae culture technology. Biotechnology & Business, 2016(3): 7-13. (in Chinese) 李雄, 王伟良, 黄建科. 微藻规模化培养技术研究进展及产业化概况. 生物产业技术, 2016(3): 7-13. |
| [21] | 朱嘉诚. Vp28基因在集胞藻中的克隆表达及转基因工程藻的纯化.上海海洋大学硕士学位论文, 2017. |
| [22] | Wang MM, Xiong YN, Liu AH, Zhang GL. Separation and purification of algae in the fresh water. Environmental Science Survey, 2013, 32(2): 118-121. (in Chinese) 王梅梅, 熊亚南, 刘爱华, 章广玲. 淡水藻类的分离纯化方法探索. 环境科学导刊, 2013, 32(2): 118-121. DOI:10.3969/j.issn.1673-9655.2013.02.031 |
| [23] | Wang CW, Meng Y, Wang TL, Lü RL, Wang CC, Zhang YF. Effect of three bacteriostats on biomass and lipid content of chlorella pyrenoidosa. Journal of Wuhan Institute of Technology, 2014, 36(4): 1-6. (in Chinese) 王存文, 孟阳, 汪铁林, 吕仁亮, 王成成, 张艳芳. 三种抑菌剂对蛋白核小球藻生物量和脂质含量的影响. 武汉工程大学学报, 2014, 36(4): 1-6. DOI:10.3969/j.issn.1674-2869.2014.04.001 |
| [24] | Hong JW, Choi HG, Kang SH, Yoon HS. Axenic purification and cultivation of an arctic cyanobacterium, nodularia spumigena KNUA005, with cold tolerance potential for sustainable production of algae-based biofuel. ALGAE, 2010, 25(2): 99-104. DOI:10.4490/algae.2010.25.2.099 |
| [25] | 尚帅.温度、光照对长江口几种优势藻类生长的影响研究.上海师范大学硕士学位论文, 2017. |
| [26] | Hua RC, Zhang DN. Study on the culture and the Maintenance of the marine Unicellurlar Algae. Journal of Xiamen Fisheries College, 1981(1): 100-111. (in Chinese) 华汝成, 张道南. 海水单细胞藻类的培养与保种. 厦门水产学院学报, 1981(1): 100-111. |
| [27] | Zhou WG, Wang JH, Chen P, Ji CC, Kang QY, Lu B, Li K, Liu J, Ruan R. Bio-mitigation of carbon dioxide using microalgal systems:advances and perspectives. Renewable and Sustainable Energy Reviews, 2017, 76: 1163-1175. DOI:10.1016/j.rser.2017.03.065 |
| [28] | Calvin M. Forty years of photosynthesis and related activities. Photosynthesis Research, 1989, 21(1): 3-16. DOI:10.1007/BF00047170 |
| [29] | Iverson TM. Evolution and unique bioenergetic mechanisms in oxygenic photosynthesis. Current Opinion in Chemical Biology, 2006, 10(2): 91-100. DOI:10.1016/j.cbpa.2006.02.013 |
| [30] | Droop MR. Heterotrophy of carbon//Stewart WP. Algal Physiology and Biochemistry. Oxford, UK: Blackwell Scienti?c, 1974: 530-559. |
| [31] | Kaplan D, Richmond A, Dubinsky Z, Aaronson S. Algal nutrition//Richmond A. Handbook of Microalgal Mass Culture. Boca Raton, FL., USA: CRC Press, 1986: 147-198. |
| [32] | Tsavalos AJ, Day JG. Development of media for the mixotrophic/heterotrophic culture of Brachiomonas submarina. Journal of Applied Phycology, 1994, 6(4): 431-433. DOI:10.1007/BF02182162 |
| [33] | Shang CH, Zhu SN, Wang ZM, Yuan ZH, Xie J. Research Progress on cultivation methods of microalgae. Advances in New and Renewable Energy, 2016, 4(2): 105-110. (in Chinese) 尚常花, 朱顺妮, 王忠铭, 袁振宏, 谢君. 微藻培养方法研究进展. 新能源进展, 2016, 4(2): 105-110. DOI:10.3969/j.issn.2095-560X.2016.02.005 |
| [34] | Bumbak F, Cook S, Zachleder V, Hauser S, Kovar K. Best practices in heterotrophic high-cell-density microalgal processes:achievements, potential and possible limitations. Applied Microbiology and Biotechnology, 2011, 91(1): 31-46. DOI:10.1007/s00253-011-3311-6 |
| [35] | Chen F, Johns MR. Heterotrophic growth of Chlamydomonas reinhardtii on acetate in chemostat culture. Process Biochemistry, 1996, 31(6): 601-604. DOI:10.1016/S0032-9592(96)00006-4 |
| [36] | Gladue RM, Maxey JE. Microalgal feeds for aquaculture. Journal of Applied Phycology, 1994, 6(2): 131-141. DOI:10.1007/BF02186067 |
| [37] | Radmer RJ, Parker BC. Commercial applications of algae:opportunities and constraints. Journal of Applied Phycology, 1994, 6(2): 93-98. DOI:10.1007/BF02186062 |
| [38] | Javanmardian M, Palsson BO. High-density photoautotrophic algal cultures:design, construction, and operation of a novel photobioreactor system. Biotechnology and Bioengineering, 1991, 38(10): 1182-1189. DOI:10.1002/bit.260381010 |
| [39] | Li QL, Li Z, Zhang QH, Liu MY, Zhou ZY, Li HG. Advance in screening and scale cultivation of oil-producing microalgae. China Oils and Fats, 2019, 44(7): 122-127. (in Chinese) 黎秋玲, 李志, 张庆华, 刘孟荧, 周智友, 李汉广. 富油微藻的选育及规模化培养研究进展. 中国油脂, 2019, 44(7): 122-127. |
| [40] | Orús MI, Marco E, Martínez F. Suitability of Chlorella vulgaris UAM 101 for heterotrophic biomass production. Bioresource Technology, 1991, 38(2/3): 179-184. |
| [41] | Huang QS, Jiang FH, Wang LZ, Yang C. Design of photobioreactors for mass cultivation of photosynthetic organisms. Engineering, 2017, 3(3): 318-329. DOI:10.1016/J.ENG.2017.03.020 |
| [42] | Posten C. Design principles of photo-bioreactors for cultivation of microalgae. Engineering in Life Sciences, 2009, 9(3): 165-177. DOI:10.1002/elsc.200900003 |
| [43] | Schoepp NG, Stewart RL, Sun V, Quigley AJ, Mendola D, Mayfield SP, Burkart MD. System and method for research-scale outdoor production of microalgae and cyanobacteria. Bioresource Technology, 2014, 166: 273-281. DOI:10.1016/j.biortech.2014.05.046 |
| [44] | Pulz O. Photobioreactors:production systems for phototrophic microorganisms. Applied Microbiology and Biotechnology, 2001, 57(3): 287-293. DOI:10.1007/s002530100702 |
| [45] | Ketheesan B, Nirmalakhandan N. Development of a new airlift-driven raceway reactor for algal cultivation. Applied Energy, 2011, 88(10): 3370-3376. DOI:10.1016/j.apenergy.2010.12.034 |
| [46] | Liu YH, Huang L, Wang YP, Ruan RS, Zheng HL, Wu XD, Wan YQ. Development of microalgal photobioreactors for mass cultivation. Chinese Journal of Bioprocess Engineering, 2016, 14(1): 65-73. (in Chinese) 刘玉环, 黄磊, 王允圃, 阮榕生, 郑洪立, 巫小丹, 万益琴. 大规模微藻光生物反应器的研究进展. 生物加工过程, 2016, 14(1): 65-73. DOI:10.3969/j.issn.1672-3678.2016.01.013 |
| [47] | Cai MG, Li F. Recent advances in Haematococcus pluvialis scale culture technology. Journal of Xiamen University (Natural Science), 2016, 55(5): 733-741. (in Chinese) 蔡明刚, 李峰. 雨生红球藻规模化培养技术的研发进展. 厦门大学学报(自然科学版), 2016, 55(5): 733-741. |
| [48] | De Bhowmick G, Subramanian G, Mishra S, Sen R. Raceway pond cultivation of a marine microalga of Indian origin for biomass and lipid production:a case study. Algal Research, 2014, 6: 201-209. DOI:10.1016/j.algal.2014.07.005 |
| [49] | Hu B, Zhou WG, Min M, Du ZY, Chen P, Ma XC, Liu YH, Lei HW, Shi J, Ruan R. Development of an effective acidogenically digested swine manure-based algal system for improved wastewater treatment and biofuel and feed production. Applied Energy, 2013, 107: 255-263. DOI:10.1016/j.apenergy.2013.02.033 |
| [50] | 刘玉环, 王允圃, 阮榕生, 巫小丹, 郑洪立, 杨欢.一种仿生型叠层式微藻光合反应器.中国: 104031822A. 2014-09-10. |
| [51] | Grima EM, Camacho FG, Pérez JAS, Fernández FGA, Sevilla JMF. Evaluation of photosynthetic efficiency in microalgal cultures using averaged irradiance. Enzyme and Microbial Technology, 1997, 21(5): 375-381. DOI:10.1016/S0141-0229(97)00012-4 |
| [52] | Soman A, Shastri Y. Optimization of novel photobioreactor design using computational fluid dynamics. Applied Energy, 2015, 140: 246-255. DOI:10.1016/j.apenergy.2014.11.072 |
| [53] | Zou N, Richmond A. Effect of light-path length in outdoor flat plate reactors on output rate of cell mass and of EPA in Nannochloropsis sp. Journal of Biotechnology, 1999, 70(1/3): 351-356. |
| [54] | Molina E, Fernández J, Acién FG, Chisti Y. Tubular photobioreactor design for algal cultures. Journal of Biotechnology, 2001, 92(2): 113-131. DOI:10.1016/S0168-1656(01)00353-4 |
| [55] | Wang B, Lan CQ, Horsman M. Closed photobioreactors for production of microalgal biomasses. Biotechnology Advances, 2012, 30(4): 904-912. DOI:10.1016/j.biotechadv.2012.01.019 |
| [56] | Iluz D, Abu-Ghosh S. A novel photobioreactor creating fluctuating light from solar energy for a higher light-to-biomass conversion efficiency. Energy Conversion and Management, 2016, 126: 767-773. DOI:10.1016/j.enconman.2016.08.045 |
| [57] | Vasumathi KK, Premalatha M, Subramanian P. Parameters influencing the design of photobioreactor for the growth of microalgae. Renewable and Sustainable Energy Reviews, 2012, 16(7): 5443-5450. DOI:10.1016/j.rser.2012.06.013 |
| [58] | Zhu JY, Rong JF, Zong BN. Factors in mass cultivation of microalgae for biodiesel. Chinese Journal of Catalysis, 2013, 34(1): 80-100. DOI:10.1016/S1872-2067(11)60497-X |
| [59] | Ugwu CU, Ogbonna JC, Tanaka H. Design of static mixers for inclined tubular photobioreactors. Journal of Applied Phycology, 2003, 15(2/3): 217-223. DOI:10.1023/A:1023837400050 |
| [60] | Hong ME, Choi YY, Sim SJ. Effect of red cyst cell inoculation and iron(II) supplementation on autotrophic astaxanthin production by Haematococcus pluvialis under outdoor summer conditions. Journal of Biotechnology, 2016, 218: 25-33. DOI:10.1016/j.jbiotec.2015.11.019 |
| [61] | Chen CY, Chang JS, Chang HY, Chen TY, Wu JH, Lee WL. Enhancing microalgal oil/lipid production from Chlorella sorokiniana CY1 using deep-sea water supplemented cultivation medium. Biochemical Engineering Journal, 2013, 77: 74-81. DOI:10.1016/j.bej.2013.05.009 |
| [62] | Grobbelaar JU. Microalgal biomass production:challenges and realities. Photosynthesis Research, 2010, 106(1/2): 135-144. |
| [63] | Niizawa I, Heinrich JM, Irazoqui HA. Modeling of the influence of light quality on the growth of microalgae in a laboratory scale photo-bio-reactor irradiated by arrangements of blue and red LEDs. Biochemical Engineering Journal, 2014, 90: 214-223. DOI:10.1016/j.bej.2014.05.002 |
| [64] | Rawat I, Kumar RR, Mutanda T, Bux F. Dual role of microalgae:phycoremediation of domestic wastewater and biomass production for sustainable biofuels production. Applied Energy, 2011, 88(10): 3411-3424. DOI:10.1016/j.apenergy.2010.11.025 |
| [65] | Christenson L, Sims R. Production and harvesting of microalgae for wastewater treatment, biofuels, and bioproducts. Biotechnology Advances, 2011, 29(6): 686-702. DOI:10.1016/j.biotechadv.2011.05.015 |
| [66] | Danquah MK, Gladman B, Moheimani N, Forde GM. Microalgal growth characteristics and subsequent influence on dewatering efficiency. Chemical Engineering Journal, 2009, 151(1/3): 73-78. |
| [67] | Danquah MK, Ang L, Uduman N, Moheimani N, Forde GM. Dewatering of microalgal culture for biodiesel production:exploring polymer flocculation and tangential flow filtration. Journal of Chemical Technology and Biotechnology, 2009, 84(7): 1078-1083. DOI:10.1002/jctb.2137 |
| [68] | Barros AI, Gon?alves AL, Sim?es M, Pires JCM. Harvesting techniques applied to microalgae:a review. Renewable and Sustainable Energy Reviews, 2015, 41: 1489-1500. DOI:10.1016/j.rser.2014.09.037 |
| [69] | Uduman N, Qi Y, Danquah MK, Forde GM, Hoadley A. Dewatering of microalgal cultures:a major bottleneck to algae-based fuels. Journal of Renewable and Sustainable Energy, 2010, 2(1): 012701. DOI:10.1063/1.3294480 |
| [70] | Horiuchi JI, Ohba I, Tada K, Kobayashi M, Kanno T, Kishimoto M. Effective cell harvesting of the halotolerant microalga Dunaliella tertiolecta with pH control. Journal of Bioscience and Bioengineering, 2003, 95(4): 412-415. DOI:10.1016/S1389-1723(03)80078-6 |
| [71] | Vandamme D, Foubert I, Muylaert K. Flocculation as a low-cost method for harvesting microalgae for bulk biomass production. Trends in Biotechnology, 2013, 31(4): 233-239. DOI:10.1016/j.tibtech.2012.12.005 |
| [72] | Huang ZQ, Cheng C, Liu ZW, Luo WH, Zhong H, He GC, Liang CL, Li LQ, Deng LQ, Fu W. Gemini surfactant:a novel flotation collector for harvesting of microalgae by froth flotation. Bioresource Technology, 2019, 275: 421-424. DOI:10.1016/j.biortech.2018.12.106 |
| [73] | Show KY, Lee DJ. Chapter 5-algal biomass harvesting//Pandey A, Lee DJ, Chisti Y, Soccol CR. Biofuels from Algae. Amsterdam: Elsevier, 2014: 85-110. |
