洪义国1

 , 胡耀豪2, 刘晓晗1,3, 吴佳鹏1
, 胡耀豪2, 刘晓晗1,3, 吴佳鹏1 1. 广州大学大湾区环境研究院, 珠三角水质安全与保护教育部重点实验室, 广东 广州 510006;
2. 中国科学院南海海洋研究所, 热带海洋环境国家重点实验室, 广东 广州 510301;
3. 广州大学环境科学与工程学院, 广东 广州 510006
收稿日期:2020-03-02;修回日期:2020-05-06;网络出版日期:2020-07-02
基金项目:国家自然科学基金(91851111);广东省自然科学基金粤穗联合基金(2019B1515120066)
作者简介:洪义国, 广州大学****, 博导, 香港大学和美国普林斯顿大学访问****。研究方向为微生物生态与生物地球化学。主持承担国家重点基础研究发展计划项目子课题、国家自然科学基金、中国科学院人才专项、广东省自然科学基金重点项目以及广州市科学研究重点项目。发表SCI论文60余篇, 论文总引2300余次, H指数23。曾获得广州市科技进步一等奖, 中国科学院卢嘉锡青年人才奖, 中国科学院院长奖, 中国水产科学研究院科技进步一等奖, 青岛市技术发明奖二等奖。任中国科学院青年创新促进会会员, IBB和Regional Studies in Marine Science编委, 中国生态学会污染生态专业委员会和中国毒理学会环境与生态毒学专业委员会委员, 广东省本科高校海洋科学类专业教学指导委员会委员.
*通信作者:洪义国, Tel/Fax:+86-20-39158007;E-mail:yghong@gzhu.edu.cn.
摘要:氧化亚氮(N2O)是一种重要的温室效应气体,同时也是造成平流层臭氧损耗的主要化合物。海洋是大气中N2O的重要排放源,海洋中的N2O产生和释放主要由微生物的代谢过程介导。本文对海洋N2O的释放通量、海水N2O的分布特征、环境影响因素以及海洋N2O产生的微生物调控机制等几个方面的最新研究进展进行综述,并结合低氧与N2O产生的关系以及近岸海域低氧区的扩大等科学问题,对河口近岸生态系统N2O的释放通量以及其关键微生物过程进行展望。
关键词:N2O的排放硝化过程不完全反硝化过程河口近海环境
N2O emission and related microbial mechanism in the ocean
Yiguo Hong1

 , Yaohao Hu2, Xiaohan Liu1,3, Jiapeng Wu1
, Yaohao Hu2, Xiaohan Liu1,3, Jiapeng Wu1 1. Key Laboratory for Water Quality and Conservation of the Pearl River Delta, Ministry of Education, Institute of Environmental Research at Greater Bay Area, Guangzhou University, Guangzhou 510006, Guangdong Province, China;
2. State Key Laboratory of Tropical Oceanography(LTO), South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510301, Guangdong Province, China;
3. School of Environmental Science and Engineering, Guangzhou University, Guangzhou 510006, Guangdong Province, China
Received: 2 March 2020; Revised: 6 May 2020; Published online: 2 July 2020
*Corresponding author: Yiguo Hong, Tel/Fax: +86-20-39158007; E-mail:yghong@gzhu.edu.cn.
Foundation item: Supported by the National Natural Science Foundation of China (91851111) and by the Natural Science Foundation of Guangdong Province (2019B1515120066)
Abstract: Nitrous oxide (N2O) is a powerful greenhouse gas, and also the main compound causing stratospheric ozone depletion. The ocean is an important source of N2O emission to the atmosphere, and N2O in the ocean is mainly produced by the microbial-mediated nitrogen biogeochemical cycle. This paper firstly reviews the marine N2O emission flux, the distribution characteristics of seawater N2O and environmental impact factors. Then, the microbial processes regulating the N2O production and emission are discussed. At last, we address the N2O biogeochemical process based on the relationship between low oxygen and N2O production in the estuarine and coastal ecosystems.
Keywords: N2O emissionsnitrificationincomplete-denitrificationestuarine and coastal environment
N2O是具有强辐射效应的大气痕量气体,是《京都议定书》中规定的6种典型温室气体之一,虽然浓度较低,但其温室效应却是CO2的约300倍[1-2]。N2O在大气中的生命周期约为114-120年[3]。在大气对流层,由于缺乏显著的大气源汇反应,所以在对流层中几乎观察不到N2O的分布梯度;只有混合输送到大气平流层的N2O才能被光分解,而且与平流层中的单重态氧O (1D)反应形成NO,NO能够催化O3的反应循环,导致臭氧分解和臭氧层的破坏[4]。冰芯数据显示,在公元前1000到1900年间,大气N2O的浓度基本维持在260-275 ppb,但在工业化革命以来,大气N2O浓度以每年0.25%的速度快速增长,目前达到322 ppb[5-7]。大气N2O浓度的增加,已经引起科学界的高度关注。美国国家海洋和大气管理局研究人员利用数学模型推算,发现人类通过使用化肥、化石燃料等每年向大气中排放超过10 Tg N的N2O,如果不采取措施限制其排放,它将成为21世纪破坏性最大的消耗臭氧层的物质[8]。海洋也是向大气释放N2O的重要源,而且随着人类活动导致活性氮的增加,河口近岸N2O的释放通量急剧升高,对全球气候变化具有显著影响。
1 海洋N2O排放与全球气候变化的相关性 通过区域及全球尺度的观测和统计分析,证实了海洋为N2O源。2001年的IPCC的报告显示,海洋N2O的每年自然排放量大约为3 Tg N,占全球自然源排放的31%,占整个排放通量(自然源的排放加人为活动增加的排放)的17%。然而,IPCC的估计并没有考虑到大陆架的近岸海域、河口以及近岸上升流海域的N2O排放。根据近6万个近岸海域N2O的测定数据,Bange等计算的全球近岸区域的N2O的排放大约为每年7.0-11.0 Tg N[9],这表明近岸海域在整个海洋的N2O排放中占有非常大的比重。模型预测也表明,近岸海域的N2O的排放占到全球海洋N2O排放的7%-49%[10-11]。预测数据的差异主要是因为对近岸区域的界定不统一,从3.3%[10]到18.6%[9]。对印度洋西边界的研究发现,在这一区域由于不定时发生的低氧过程,N2O的排放达到每年2.25 Tg N[12]。Babbin等通过对ETNP的氧最小层(Oxygen minimum zone,OMZ)的研究,提出了海洋应该有更大的N2O排放通量[13],仅全球三大OMZ的N2O的排放预测将会达到每年4 Tg N。对秘鲁沿岸上升流海域的估测表明,超饱和的氮氧化物驱动了大约每年约0.2-0.9 Tg N的氮氧化物排放通量[14]。最近的研究也发现,陆海界面高渗透性沉积物是氮素转化的活跃区,也会影响近岸区域N2O的释放通量[15-16]。从上述的研究报告以及最新的研究进展来看,目前我们对海洋N2O排放的估测还是不准确的,尤其是对近岸海洋生态系统N2O的排放,还需要作更广泛和深入的研究工作,以期进一步完善对海洋N2O的排放通量的估测。
人类活动导致了近岸低氧区的不断扩大,加速了氮循环过程,促进了N2O的释放[17]。根据Boyer的统计,在北美州、拉丁美洲、欧洲和非洲大约每年有8-10 Tg人工氮的排入,而亚洲的排入量更高,每年达到15 Tg[18];Arrigo等的研究表明,27%-59%使用的氮肥通过河流冲刷进入加利福尼亚湾,造成54-577 km2浮游植物的大量繁殖,严重恶化了这一海湾的生态环境[19]。Beman等在墨西哥湾深水区发现了大面积缺氧区,并且面积还在不断扩大,被称为“死亡区域(Dead zone)”,主要是密西西比河大量的氮输入引起的[20]。联合国环境规划署(UNEP)的报告指出,2004年全球共有146个死亡区域,2006年就增加到200个,目前报告的全球死亡区域已经超过400个,其中美国的西太平洋海岸、东北大西洋海岸、墨西哥湾、波罗的海、挪威海以及中国的沿海低氧分布较为密集。由于高氮负荷和由此引发的低氧环境,极大的促进了N2O的产生与排放,使得近岸成为N2O释放的热点区域。
2 海洋水体N2O的分布特征及其环境影响因素 2.1 海洋水体N2O的水平及垂直分布特征 综合全球的观测数据,Nevison等绘制了全球海洋表层N2O的分布图,并计算出了全球海洋表层水体N2O饱和度(△pN2O),平均值为103.5%[21]。从图 1可以看出,东北热带太平洋(ETNP)、东南热带太平洋(ETSP)以及阿拉伯海(Ab)等存在典型OMZ的海域具有较高的△pN2O值,但在太平洋和大西洋的北部和南部△pN2O值几乎为零。近岸区域表层水体的N2O浓度也相对较高,河口中有最大的N2O饱和度。对于不同类型的海洋系统,水体中的N2O具有典型不同的垂直分布特征。在阿拉伯海和ETNP具有典型OMZ的海域,N2O的垂直分布都显示出双峰结构:在OMZ的上下边界各存在一个峰值,但在OMZ的核心内N2O的浓度具有显著的低值[22-23]。在太平洋、大西洋以及印度洋的有氧水团中,在次表层水体中观察到一个N2O浓度的峰值,而且与氧气的最小值和硝酸盐的最大值分布相一致[22, 24-26]。在北大西洋和北太平洋2000 m以深的水体中,N2O的最大值不明显,而且随着深度的增加N2O的浓度有略微增加的趋势[27]。在波罗的海、卡里亚科海盆以及萨尼奇海湾入口的无氧水团中,N2O的浓度接近或者低于检测限[22, 28-32]。在典型河口区(例如Chesapeake Bay),N2O的垂直分布与远海及大洋有明显的不同,在底部厌氧区,N2O的浓度几乎为零,随着氧气浓度的升高,N2O的浓度逐渐升高,在表层达到最大值[33]。但是,南海的N2O分布出现明显不同的特征,从表层向下逐渐升高,在800 m左右达到最大值,然后又稍有降低[34]。这些不同的分布特征,是生物、化学以及水文因素综合作用结果,特别是氧气浓度、温度以及营养盐的浓度直接影响生物代谢活性,从而影响N2O的产生和释放。
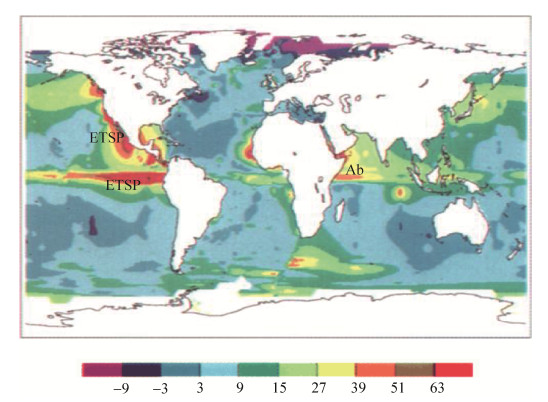 |
| 图 1 全球海洋表层海水N2O饱和度(△pN2O)[21] Figure 1 Global ocean surface water N2O saturation (△pN2O)[21] |
| 图选项 |
2.2 影响海洋水体N2O的分布的环境因素
2.2.1 水体溶解氧(DO)的影响: 通常情况下,海洋水体中N2O浓度与DO浓度呈反比关系。在东北热带太平洋的某些区域,两者的负相关系数可达到0.92[35],说明了海洋中N2O产生与消耗可能受到DO的控制,进而影响海洋中N2O的浓度分布,成为决定海洋N2O源汇过程的一个重要因素。1976年,Yoshinari首次提出了表观N2O量的概念[36],用△N2O来表示(△N2O=CN2O, meossured-CN2O, equilibrium)。△N2O可以表示海洋水体N2O相对于大气N2O平衡浓度的偏离值,在一般海洋水体中△N2O为正值。进一步的研究发现,海洋中△N2O和表观耗氧量(AOU)之间存在正相关关系(△N2O=k× AOU),因此N2O与AOU之间的比值关系是鉴定海洋N2O产生和消耗的一个重要指标。在大部分的海域,△N2O与AOU之间为正相关关系,表明硝化作用是N2O产生的主要过程。△N2O与AOU之间线性关系的斜率值一般在3×10-5-3×10-4之间[21, 23-24, 27, 37],表明1 mol的N2O的形成需要消耗3000到33000 mol的氧分子。因此,在以硝化过程为主导产生N2O的有氧或者低氧环境中,N2O与AOU具有明显的线性关系;同时,N2O与AOU的线性关系也是指示硝化过程产生N2O的重要指标。
在研究中,也要慎重应用以△N2O-AOU的线性关系作为硝化作用形成N2O的指示,例如在海洋深部的水团中,AOU并不代表真正的氧气利用,因为在深水水团形成区域的表层O2的浓度与大气并不平衡,难以知道水团的年龄以及相关的大气N2O的摩尔分数,应用当前的条件来计算显然是不准确的。另外,海洋硝化过程的N2O产率要依赖硝化微生物的丰度和群落结构组成,因此不同区域N2O产率是不统一的。在低氧区通过反硝化过程形成的N2O,能够通过平流输送的方式运送到相邻的有氧硝化层,影响N2O/AOU比值。基于上述讨论的不确定性,在全球海洋N2O分布的模型研究中,使用简单的△N2O-AOU线性关系可能能够模拟小尺度的水体N2O分布特征[37-39]。而在低氧水团(例如东赤道太平洋和阿拉伯海)和无氧水团(如波罗地海和卡里亚科海盆)中,不存在△N2O-AOU的线性关系,表明有更加复杂的基于硝化-反硝化耦合作用的N2O形成和消耗机制。
2.2.2 温度、盐度和大气压对水体溶解N2O的影响: 在一个标准大气压平衡条件下,Weiss和Price给出了计算海水N2O溶解度的多项式方程[40]方程(1-2)
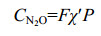 | 公式(1) |
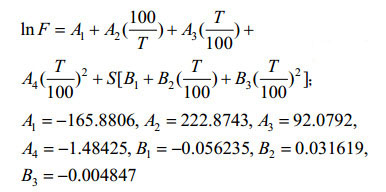 | 公式(2) |
2.2.3 N2O垂直分布与营养盐的关系: N2O最终是由氮素通过微生物的代谢过程转化而来,因此氮素作为底物会直接影响海洋中N2O的浓度分布。由于硝酸盐的再生与O2的消耗呈线性关系,使得AOU与NO3-之间存在共线性关系,因此,N2O垂直分布和NO3-垂直分布存在正相关关系。Walter等在北大西洋的亚热带海域研究中发现,N2O浓度最大值在浅的深度(<1000 m),N2O垂直分布与NO3-垂直分布呈现正相关关系[41];而在热带海域,N2O垂直分布与NO3-垂直分布的正相关关系更加显著。此外,通过对温跃层以下的等密度层进行简单的回归分析,得出△N2O/NO3-这一比值范围约为0.6-0.8。在较早的北大西洋、印度洋以及太平洋的研究中,N2O浓度的最大值处于NO3-的浓度最大值和溶解氧最小值这一区域,大体上符合同一分布模式[22, 24, 26]。而相对于硝酸盐来说,亚硝酸盐与N2O垂直分布的关系尚不明确。Babbin等在ETNP的研究中发现,N2O浓度的最大值和最小值都与亚硝酸盐的最大值和最小值有对应关系[13]。而Arévalo-Martínez等在热带南太平洋缺氧层的研究中则发现,OMZ内部N2O耗竭的深度范围与NO2-最高值的深度范围相同[14],也说明在进一步降低O2浓度的情况下,N2O的消耗会增加。在近岸河口地区,Ji等在Chesapeake bay研究中发现亚硝酸盐与硝酸盐以及N2O均成正相关关系[42]。
2.2.4 N2O垂直分布与表层初级生产力以及有机物之间的关系: 海洋表层初级生产力以及有机物的高低影响海洋N2O的分布,但这种关系往往是间接的。在高表层初级生产力往下输送时,由于有机物的矿化和生物代谢作用,会加速海水中氧气的消耗,逐步形成了OMZ[14, 43]。而在南太平洋的OMZ研究中发现,有机物质的输送加速了OMZ内的氮素循环过程[44]。低氧条件有利于海洋N2O的产生,特别是在OMZ的边缘区域(有氧-无氧界面)[45]。在具有高初级生产力的上升流海洋生态系统,由OMZ边界产生的大量N2O通过向上的垂直输送作用,使得该区域成为海洋N2O排放的热点区域[14, 24]。Suntharalingam等通过建立模型分析,发现海洋表层N2O总体呈现出过饱和状态,海洋N2O排放的热点区域主要集中在表层相对高生产力的区域[46]。而有机物的增加则会通过影响异养反硝化过程影响N2O的累积。Frey等通过对秘鲁海洋低氧水体的研究发现,添加颗粒有机质使反硝化过程中N2O的产量增加了5倍[47],说明了颗粒有机质的输送会造成N2O的产量增加。
3 海洋N2O的产生微生物过程调控机制 N2O的产生与释放是氮素循环过程中的一个重要环节,与微生物的代谢过程密切相关。本领域的研究在近50年来取得了很多重要进展,构建了N2O产生的微生物代谢网络途径(图 2)。但由于N2O产生的生物化学过程的复杂性和环境条件的异质性,有关N2O的产生机制一直存在诸多的疑问。综合目前的研究,海洋N2O的产生主要是基于微生物硝化和反硝化耦合生物地球化学过程驱动的结果。但是从代谢反应的过程看,硝化过程中N2O是其末端产物(副产物),所以并不消耗N2O;而在反硝化过程中,N2O是代谢过程中间产物,产生并同时快速消耗N2O。对于硝化和反硝化作用,究竟哪种途径是N2O产生和释放的主导代谢途径,是科学界一直在不断探究的课题。
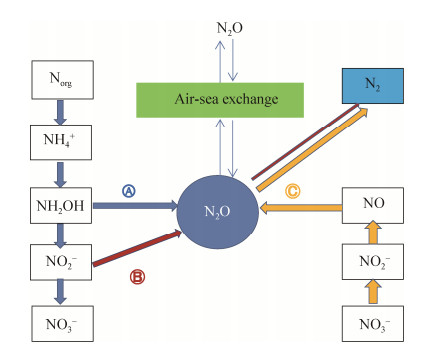 |
| 图 2 海洋N2O产生的主要微生物代谢途径 Figure 2 Microbial pathways for N2O production in the marine environment. A: ammonia oxidation (AO); B: Nitrifier-denitrification (N-DNF); C: Denitrification (DNF) |
| 图选项 |
3.1 硝化过程释放N2O 多项研究结果表明,硝化作用(Nitrification)是海洋N2O产生的重要过程。早在1978年,哈佛大学的Elkins等研究了包括中心太平洋、秘鲁上升流和Chesapeake湾水体中N2O的产生机制,发现△N2O与AOU之间呈典型线性回归关系,因此提出硝化作用是水体中N2O产生的主导途径[33]。而Oudot等对热带大西洋的研究也验证了硝化作用很可能是海洋中N2O产生的主导过程[25]。有关硝化细菌的培养实验表明,在低氧条件下N2O的产率显著提高[48-49],也为海洋N2O产生来源于硝化作用理论提供了重要支持。伍兹霍尔海洋研究所Casciotti率先开展了有关AOA代谢产生N2O的研究,通过对加利福尼亚沿岸上升流的原位N2O产生率的测定表明,AOA确实参与了海洋N2O释放[50]。同位素研究进一步阐明了AOA释放N2O的机制:运用AOA的富集培养测得的N2O的δ15N-N2O值为+8.7‰ vs. AIR,显著高于AOB的δ15N-N2O值,与报道的北太平洋次表层以及全球海洋水体中N2O的δ15N-N2O值基本一致。根据海洋环境中高的AOA丰度、高的硝化率以及适合的同位素信号,推断AOA可能在上层海洋水体N2O的排放中发挥重要作用[51]。这一研究,基本解决了海洋N2O的同位素组成与细菌硝化产生的N2O的同位素组成不一致问题,为海洋N2O释放机制的研究开辟了新的方向。
羟胺的生物及非生物代谢过程与N2O的产生有密切关系。有研究发现,完全硝化细菌(Complete nitrifier)通过羟胺氧化的非生物作用途径产生低量的N2O,可能不是硝化过程释放N2O的主要微生物类群[52]。在对AOB的研究中发现,好氧和厌氧的环境下,羟胺可在HAO的催化下,仅通过失去3个电子就可氧化成NO(羟胺氧化成NO2-需要失去4个电子),NO释放的增加将促进N2O的产生[53]。此外,海洋氨氧化古菌(AOA)的杂合过程(Hybrid N2O formation)在海洋N2O产生中发挥重要作用。在对纯培养菌株Nitrososphaera viennensis EN76T的研究发现,AOA释放关键中间体NO通过与羟胺发生非生物作用从而影响N2O的产生[54]。最近,在ETNP的OMZ研究中,Trimmer等在不同DO条件下,通过15NO2-培养实验以及对AOA功能基因的数据模型分析,发现高N2O是受低氧条件以及高amoA和nirK基因丰度的共同影响,结果表明OMZ区域中AOA可能是通过杂合过程产生N2O[49]。
3.2 反硝化过程释放N2O 除了硝化过程,反硝化过程(Denitrification,DNF)也是研究海洋N2O产生和释放机制需要考虑的微生物过程。在较早的研究中,Hahn等[55]通过对比海洋水体溶解N2O与DO之间的负相关关系,提出海洋中N2O的产生是由微生物反硝化作用形成的观点。但在接下来的一系列研究中,发现海水中通过反硝化作用产生的N2O的量并不显著,不足以对海洋N2O的通量产生很大影响。一般情况下,5 μmol/L的溶解氧浓度是海洋反硝化作用发生的临界值,当环境中溶解氧浓度低于这一临界值时,反硝化反应才有可能发生。在低氧条件下(< 20 μmol/L)的水层,多种与氮循环相关的过程会同时发生,其中包括硝化过程[56],因此DO最低值(并没有低于5 μmol/L临界值)和溶解N2O的浓度最高值相对应存在于同一深度的现象并无法证实海洋反硝化作用是海洋中N2O产生的主导机制。在ETSP缺氧区的研究中,发现15N-NO3-添加直接贡献N2O的产量最大,说明反硝化是N2O来源的主要贡献者[57]。Cohen等在东北赤道太平洋的研究中发现,在150-800 m的水层中,由于高的表层初级生产力输入导致溶解氧被大量消耗,形成所谓的“缺氧水体”,由于溶解氧浓度极低,水体中N2O作为反硝化过程中的电子受体被消耗,从而使其在垂直断面的分布对应深度上形成浓度最低值[32]。
最近,普林斯顿大学Bess Ward实验室通过对东北热带太平洋(ETNP)氧气最小层(OMZ)的深入研究,提出了微生物不完全反硝化作用(Incomplete denitrification,iDNF)在海洋低氧层(OMZ)N2O释放中发挥重要作用的新观点。在OMZ上部的低氧-无氧界面(Suboxic-anoxic interface)这一狭窄的深度空间里,由于N2O还原酶比参与反硝化过程的其他酶对氧气的抑制作用更加敏感,导致N2O的消耗受到抑制[58]。而且,因为反硝化是异养过程,从上层输入最新产生的易利用的有机物也会提高反硝化速率。因此,在低氧条件下,iDNF导致的N2O的释放可能占有很大的通量,但是在绝大多数的海洋生物地球化学和气候模型中却忽视了这一过程。运用在海洋生物地球化学模型中广泛采用的参数,包括生物硝化作用生成N2O、低氧层N2O浓度的提高以及通过反硝化作用的N2O的消耗,建立了一维模型。模型分析中把反硝化作用的N2O产生和消耗分离开来,并且考虑到了氧气依赖的去耦合作用。模型分析表明,反硝化是OMZ上覆低氧水体的一个主要的N2O源[9.3 μmol/(m3·d)],与硝化作用的N2O产生量相当[9.2 μmol/(m3·d)]。而且模型计算出来的N2O的净产生率最大达到0.6 nmol/(L·d),与观察到的值基本一致,其最大的浓度超过110 nmol/L,表明iDNF是一个被忽视的重要的海洋N2O来源途径[13]。纯培养菌株和沉积物的低氧
培养实验室也支持上述观点:随着氧气浓度的增加,虽然反硝化的活性在逐渐下降,但是N2O的产量却能提高到约50%[59]。另外,最近有研究发现,真菌反硝化的N2O产率往往显著高于细菌反硝化,真菌而非细菌可能是沉积物环境中N2O的重要贡献者,尤其是在富营养化系统中其贡献可达70%[60-62]。这些新的发现,使得我们需要重新思考反硝化过程在N2O产生和释放过程的作用,尤其在近岸低氧区不完全反硝化过程可能在N2O的释放中发挥重要作用。
最新研究发现,N2O还原酶具有2个不同的进化分枝:clade Ⅰ和clade Ⅱ,clade Ⅰ N2O还原菌具有完全反硝化途径,而clade Ⅱ N2O还原菌普遍缺少其他反硝化代谢基因,是不完全的反硝化N2O还原菌。对比clade Ⅰ,clade Ⅱ N2O还原菌具有更高的多样性和更强的底物竞争能力,发挥N2O汇的生态功能[63-66]。
3.3 硝化微生物的反硝化作用释放N2O 除了传统的异养反硝化过程,硝化微生物的反硝化作用也是海洋N2O释放的重要过程。有****进一步利用纯培养亚硝化单胞菌(Nitrosomonas europaea)[67]和Nitrosomonas marina C-113a[48]研究了N2O的释放机制,发现释放的N2O有非常低的δ15N值,推测N2O产生的途径不是直接由氨氧化过程而来,而是通过氨的氧化产物NO2-进一步通过反硝化过程产生,这种代谢途径称之为硝化微生物的反硝化作用(Nitrifer-denitrification,N-DNF),特别是低氧条件下发生不完全的硝化微生物的反硝化作用(Incomplete nitrifier-denitrification,N-iDNF),显著增强N2O产生和释放(占到43%- 87%),是海洋N2O产生和释放的重要途径。在低氧条件下,硝化微生物的反硝化作用释放的N2O通量显著增强[68-69]。但这个过程还基本没有在河口-近岸进行系统的研究,且N-iDNF过程较为复杂,关于介导海洋N-iDNF过程的微生物的研究较少,目前尚不明确硝化微生物在该过程中N2O产生的贡献以及产生机制。但基于实验室的培养结果,AOB是能够直接介导N-iDNF过程产生N2O,并且低氧和低有机碳的条件有利于N2O的产生[70]。
3.4 硝化偶联反硝化过程释放N2O途径 在海洋释放N2O的研究中,微生物介导的硝化偶联反硝化作用(Nitrification coupled denitrification,NCD)是一个海洋释放N2O的重要来源。该过程主要由硝化微生物和反硝化微生物协同完成,反硝化微生物所需要的NO3-是由硝化过程产生,因此N2O的最初氮来源应当为NH4+/NH3。Kool等通过对氮氧同位素标记实验的进一步修正,发现NCD过程在N2O的产生的贡献达到34%[71]。在海洋的OMZ区域,特别是有上升流的高初级生产力的区域,NCD过程在海洋N2O释放中扮演着重要角色。在热带南太平洋的秘鲁上升流海岸,Arévalo-Martínez等[14]对水体表层以及垂直剖面的N2O进行了高分辨率准确测量,并结合营养盐以及相关基因丰度的数据,推断在OMZ的上部,N2O的释放主要由NCD贡献,并随着上升流将N2O带上表层从而释放到大气中。不难发现,正是由于OMZ边缘区域有氧-无氧界面的特点,好氧的硝化微生物以及兼性厌氧的反硝化微生物可能共同发挥着协同作用,上层有氧水体中生成的NO3-向下输送,在缺氧边界以及无氧的OMZ中心区域被反硝化细菌所利用。此外,海洋颗粒表面的微氧环境,也是微生物介导硝化偶联反硝化过程释放N2O的重要区域之一[72]。
4 研究展望 人类活动排放的人工活性氮(Anthropogenic reactive nitrogen)导致近岸和河口生态系统的富营养化,使得低氧现象(Hypoxia)逐渐加剧,显著促进了近海N2O的释放[45]。研究已经证实,在几个典型的近岸低氧海域有显著高的N2O饱和度和释放通量,而且N2O释放通量(或饱和度)与水体溶解氧(DO)之间呈现出典型负相关模式表明低氧条件是近海N2O产生与释放的一个关键调控因素。随着近岸海域低氧区的扩大,低氧引发的N2O释放增加是一个全球性的重要生态环境问题,在所有来源的N2O排放通量中占有越来越大的比重。本实验室对夏季珠江河口N2O的排放进行研究,发现珠江河口水体中N2O浓度为4.77-125.8 nmol/L,△N2O最高为S1站点的112.6 nmol/L,呈上游较高中游骤减下游较低的趋势(图 3-A)。在盐度低的上游区域,溶氧值较低(约3.5 mg/L)且N2O浓度处于高值(图 3-B),说明N2O与DO存在着负相关关系。此外,nosZ Ⅰ基因的丰度在珠江河口中存在明显空间差异,微生物介导的N2O消耗的作用不可忽视(图 3-C),应进一步深入弄清微生物在N2O的产生与消耗中的作用机制。
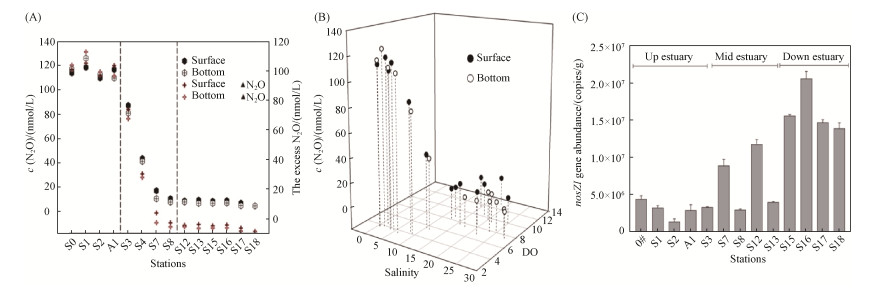 |
| 图 3 夏季珠江河口N2O时空分布和N2O还原基因的丰度 Figure 3 Distribution of N2O and the abundance of nosZ Ⅰ gene in the Pearl River Estuary in summer. A: in-situ N2O; B: the relationship between N2O and DO; C: nosZ Ⅰ gene abundance |
| 图选项 |
在河口-近海区域,N2O释放通量与DO具有典型的负相关模式,这表明在低氧环境中,反硝化过程在N2O的产生和释放中可能发挥重要作用。然而,目前尚不明确河口近海低氧区N2O产生和释放的生物地球化学发生机理,相关的科学问题包括:(1)在从河口到近海的富营养化的低氧区域,AO、DNF和N-DNF过程对总N2O释放通量的贡献率各自有多大?(2) AO、DNF和N-DNF过程产生和释放N2O生物地球化学机制如何?(3)环境条件是如何调控AO、DNF和N-DNF过程产生和释放N2O的?(4)不同的微生物过程产生N2O的分子机制有什么不同?
综合来看,高的碳氮负荷是河口-近海N2O高释放通量的决定性因素,因此减少碳氮的排放是减低河口-近海N2O释放通量的重要措施。虽然有关海洋N2O的研究取得了很多进展,但由于河口近海生态系统的复杂性,其N2O的源汇过程机制还没有得到完全的阐明。通过氮氧稳定同位素与基因组学相结合的方法,分析不同N2O的生物化学途径,剖析其遗传潜能、代谢过程途径及其调控机制,为进一步控制由于人类活动导致的河口-近海N2O释放,具有重要的理论意义。
References
| [1] | Montzka SA, Dlugokencky EJ, Butler JH. Non-CO2 greenhouse gases and climate change. Nature, 2011, 476(7358): 43-50. DOI:10.1038/nature10322 |
| [2] | Ryu Y, Ahn J, Yang JW. High-precision measurement of N2O concentration in ice cores. Environmental Science & Technology, 2018, 52(2): 731-738. |
| [3] | Prather M, Ehhalt DH, Dentener F, Derwent R, Dlugokencky E, Holland E, Isaksen I, Katima J, Kirchhoff V, Matson P, Midgley P, Wang M. Atmospheric chemistry and greenhouse gases//Houghton JT, Ding Y, Griggs DJ. Related Information: Climate Change 2001: Working Group I: the Scientific Basis. Cambridge: Cambridge University Press, 2001. |
| [4] | Crutzen PJ. The influence of nitrogen oxides on the atmospheric ozone content. Quarterly Journal of the Royal Meteorological Society, 1970, 96(408): 320-325. DOI:10.1002/qj.49709640815 |
| [5] | Landman W. Climate change 2007:The physical science basis. South African Geographical Journal, 2010, 92(1): 86-87. |
| [6] | Zaehle S, Ciais P, Friend AD, Prieur V. Carbon benefits of anthropogenic reactive nitrogen offset by nitrous oxide emissions. Nature Geoscience, 2011, 4(9): 601-605. DOI:10.1038/ngeo1207 |
| [7] | Thompson RL, Lassaletta L, Patra PK, Wilson C, Wells KC, Gressent A, Koffi EN, Chipperfield MP, Winiwarter W, Davidson EA, Tian H, Canadell JG. Acceleration of global N2O emissions seen from two decades of atmospheric inversion. Nature Climate Change, 2019, 9(12): 993-998. DOI:10.1038/s41558-019-0613-7 |
| [8] | Ravishankara AR, Daniel JS, Portmann RW. Nitrous oxide (N2O):the dominant ozone-depleting substance emitted in the 21st century. Science, 2009, 326(5949): 123-125. DOI:10.1126/science.1176985 |
| [9] | Bange HW, Rapsomanikis S, Andreae MO. Nitrous oxide in coastal waters. Global Biogeochemical Cycles, 1996, 10(1): 197-207. DOI:10.1029/95GB03834 |
| [10] | Nevison CD, Lueker TJ, Weiss RF. Quantifying the nitrous oxide source from coastal upwelling. Global Biogeochemical Cycles, 2004, 18(1): GB1018. |
| [11] | Seitzinger SP, Kroeze C. Global distribution of nitrous oxide production and n inputs in freshwater and coastal marine ecosystems. Global Biogeochemical Cycles, 1998, 12(1): 93-113. DOI:10.1029/97GB03657 |
| [12] | Naqvi SWA, Jayakumar DA, Narvekar PV, Naik H, Sarma VVSS, D'Souza W, Joseph S, George MD. Increased marine production of N2O due to intensifying anoxia on the Indian continental shelf. Nature, 2000, 408(6810): 346-349. DOI:10.1038/35042551 |
| [13] | Babbin AR, Bianchi D, Jayakumar A, Ward BB. Rapid nitrous oxide cycling in the suboxic ocean. Science, 2015, 348(6239): 1127-1129. DOI:10.1126/science.aaa8380 |
| [14] | Arévalo-Martínez DL, Kock A, L?scher CR, Schmitz RA, Bange HW. Massive nitrous oxide emissions from the tropical south Pacific ocean. Nature Geoscience, 2015, 8(7): 530-533. DOI:10.1038/ngeo2469 |
| [15] | Jiao LJ, Wu JP, He X, Wen XM, Li YB, Hong YG. Significant microbial nitrogen loss from denitrification and anammox in the land-sea interface of low permeable sediments. International Biodeterioration & Biodegradation, 2018, 135: 80-89. |
| [16] | Hong YG, Wu JP, Wilson S, Song B. Vertical stratification of sediment microbial communities along geochemical gradients of a subterranean estuary located at the gloucester beach of Virginia, United States. Frontiers in Microbiology, 2019, 9: 3343. DOI:10.3389/fmicb.2018.03343 |
| [17] | Hong YG, Wu JP, Guan FJ, Yue WZ, Long AM. Nitrogen removal in the sediments of the Pearl River estuary, China:evidence from the distribution and forms of nitrogen in the sediment cores. Marine Pollution Bulletin, 2019, 138: 115-124. DOI:10.1016/j.marpolbul.2018.11.040 |
| [18] | Boyer EW, Howarth RW, Galloway JN, Dentener FJ, Green PA, V?r?smarty CJ. Riverine nitrogen export from the continents to the coasts. Global Biogeochemical Cycles, 2006, 20(1): GB1S91. |
| [19] | Arrigo KR. Marine microorganisms and global nutrient cycles. Nature, 2005, 437(7057): 349-355. DOI:10.1038/nature04159 |
| [20] | Beman JM, Arrigo KR, Matson PA. Agricultural runoff fuels large phytoplankton blooms in vulnerable areas of the ocean. Nature, 2005, 434(7030): 211-214. DOI:10.1038/nature03370 |
| [21] | Nevison CD, Weiss RF, Erickson III DJ. Global oceanic emissions of nitrous oxide. Journal of Geophysical Research:Oceans, 1995, 100(C8): 15809-15820. DOI:10.1029/95JC00684 |
| [22] | Cohen Y, Gordon LI. Nitrous oxide production in the ocean. Journal of Geophysical Research:Oceans, 1979, 84(C1): 347-353. DOI:10.1029/JC084iC01p00347 |
| [23] | Bange HW, Rapsomanikis S, Andreae MO. Nitrous oxide cycling in the Arabian sea. Journal of Geophysical Research:Oceans, 2001, 106(C1): 1053-1065. DOI:10.1029/1999JC000284 |
| [24] | Oudot C, Jean-Baptiste P, Fourré E, Mormiche C, Guevel M, Ternon JF, Le Corre P. Transatlantic equatorial distribution of nitrous oxide and methane. Deep Sea Research Part Ⅰ:Oceanographic Research Papers, 2002, 49(7): 1175-1193. DOI:10.1016/S0967-0637(02)00019-5 |
| [25] | Oudot C, Andrie C, Montel Y. Nitrous oxide production in the tropical Atlantic ocean. Deep Sea Research Part A. Oceanographic Research Papers, 1990, 37(2): 183-202. DOI:10.1016/0198-0149(90)90123-D |
| [26] | Butler JH, Elkins JW, Thompson TM, Egan KB. Tropospheric and dissolved N2O of the west Pacific and east Indian oceans during the El Ni?o southern oscillation event of 1987. Journal of Geophysical Research:Atmospheres, 1989, 94(D12): 14865-14877. DOI:10.1029/JD094iD12p14865 |
| [27] | Bange HW, Andreae MO. Nitrous oxide in the deep waters of the world's oceans. Global Biogeochemical Cycles, 1999, 13(4): 1127-1135. DOI:10.1029/1999GB900082 |
| [28] | Walter S, Breitenbach U, Bange HW, Nausch G, Wallace DWR. Nitrous oxide water column distribution during the transition from anoxic to oxic conditions in the Baltic sea. Biogeosciences Discussions, 2006, 3(3): 729-764. DOI:10.5194/bgd-3-729-2006 |
| [29] | Brettar I, Rheinheimer G. Denitrification in the central baltic:Evidence for H2S-oxidation as motor of denitrification at the oxic-anoxic interface. Marine Ecology Progress Series, 1991, 77(2/3): 157-169. |
| [30] | Hashimoto LK, Kaplan WA, Wofsy SC, McElroy MB. Transformations of fixed nitrogen and N2O in the cariaco trench. Deep Sea Research Part A. Oceanographic Research Papers, 1983, 30(6): 575-590. DOI:10.1016/0198-0149(83)90037-7 |
| [31] | R?nner U. Distribution, production and consumption of nitrous oxide in the Baltic sea. Geochimica et Cosmochimica Acta, 1983, 47(12): 2179-2188. DOI:10.1016/0016-7037(83)90041-8 |
| [32] | Cohen Y. Consumption of dissolved nitrous oxide in an anoxic basin, Saanich Inlet, British Columbia. Nature, 1978, 272(5650): 235-237. DOI:10.1038/272235a0 |
| [33] | Elkins JW, Wofsy SC, McElroy MB, Kolb CE, Kaplan WA. Aquatic sources and sinks for nitrous oxide. Nature, 1978, 275(5681): 602-606. DOI:10.1038/275602a0 |
| [34] | Xu JR, Wang YS, Zhang FQ, Sun CC, Yin JP, Wang QJ, He L. Studies on formation mechanism and distribution of nitrous oxide in northeastern south China sea. Journal of Tropical Oceanography, 2006, 25(4): 66-74. (in Chinese) 徐继荣, 王友绍, 张凤琴, 孙翠慈, 殷建平, 王清吉, 何磊. 南海东北部海水中N2O分布与产生机制的初步研究. 热带海洋学报, 2006, 25(4): 66-74. |
| [35] | Cohen Y, Gordon LI. Nitrous oxide in the oxygen minimum of the eastern tropical north Pacific:Evidence for its consumption during denitrification and possible mechanisms for its production. Deep Sea Research, 1978, 25(6): 509-524. DOI:10.1016/0146-6291(78)90640-9 |
| [36] | Yoshinari T. Nitrous oxide in the sea. Marine Chemistry, 1976, 4(2): 189-202. |
| [37] | Suntharalingam P, Sarmiento JL. Factors governing the oceanic nitrous oxide distribution:Simulations with an ocean general circulation model. Global Biogeochemical Cycles, 2000, 14(1): 429-454. DOI:10.1029/1999GB900032 |
| [38] | Jin X, Gruber N. Offsetting the radiative benefit of ocean iron fertilization by enhancing N2O emissions. Geophysical Research Letters, 2003, 30(24): 2249. |
| [39] | Goldstein B, Joos F, Stocker TF. A modeling study of oceanic nitrous oxide during the younger dryas cold period. Geophysical Research Letters, 2003, 30(2): 1092. |
| [40] | Weiss RF, Price BA. Nitrous oxide solubility in water and seawater. Marine Chemistry, 1980, 8(4): 347-359. DOI:10.1016/0304-4203(80)90024-9 |
| [41] | Walter S, Bange HW, Breitenbach U, Wallace DWR. Nitrous oxide in the north Atlantic ocean. Biogeosciences, 2006, 3(4): 607-619. DOI:10.5194/bg-3-607-2006 |
| [42] | Ji QX, Frey C, Sun X, Jackson M, Lee YS, Jayakumar A, Cornwell JC, Ward BB. Nitrogen and oxygen availabilities control water column nitrous oxide production during seasonal anoxia in the Chesapeake bay. Biogeosciences, 2018, 15(20): 6127-6138. DOI:10.5194/bg-15-6127-2018 |
| [43] | Stramma L, Schmidtko S, Levin LA, Johnson GC. Ocean oxygen minima expansions and their biological impacts. Deep Sea Research Part I:Oceanographic Research Papers, 2010, 57(4): 587-595. DOI:10.1016/j.dsr.2010.01.005 |
| [44] | Kalvelage T, Lavik G, Lam P, Contreras S, Arteaga L, L?scher CR, Oschlies A, Paulmier A, Stramma L, Kuypers MMM. Nitrogen cycling driven by organic matter export in the south Pacific oxygen minimum zone. Nature Geoscience, 2013, 6(3): 228-234. DOI:10.1038/ngeo1739 |
| [45] | Codispoti LA. Interesting times for marine N2O. Science, 2010, 327(5971): 1339-1340. DOI:10.1126/science.1184945 |
| [46] | Suntharalingam P, Sarmiento JL, Toggweiler JR. Global significance of nitrous-oxide production and transport from oceanic low-oxygen zones:a modeling study. Global Biogeochemical Cycles, 2000, 14(4): 1353-1370. DOI:10.1029/1999GB900100 |
| [47] | Frey C, Bange HW, Achterberg EP, Jayakumar A, L?scher CR, Arévalo-Martínez DL, León-Palmero E, Sun MS, Sun X, Xie RC, Oleynik S, Ward BB. Regulation of nitrous oxide production in low-oxygen waters off the coast of Peru. Biogeosciences, 2020, 17(8): 2263-2287. DOI:10.5194/bg-17-2263-2020 |
| [48] | Frame CH, Casciotti KL. Biogeochemical controls and isotopic signatures of nitrous oxide production by a marine ammonia-oxidizing bacterium. Biogeosciences, 2010, 7(9): 2695-2709. DOI:10.5194/bg-7-2695-2010 |
| [49] | Trimmer M, Chronopoulou PM, Maanoja ST, Upstill-Goddard RC, Kitidis V, Purdy KJ. Nitrous oxide as a function of oxygen and archaeal gene abundance in the North Pacific. Nature Communications, 2016, 7: 13451. DOI:10.1038/ncomms13451 |
| [50] | Santoro AE, Casciotti KL, Francis CA. Activity, abundance and diversity of nitrifying archaea and bacteria in the central California current. Environmental Microbiology, 2010, 12(7): 1989-2006. DOI:10.1111/j.1462-2920.2010.02205.x |
| [51] | Santoro AE, Buchwald C, McIlvin MR, Casciotti KL. Isotopic signature of N2O produced by marine ammonia-oxidizing archaea. Science, 2011, 333(6047): 1282-1285. DOI:10.1126/science.1208239 |
| [52] | Kits KD, Jung MY, Vierheilig J, Pjevac P, Sedlacek CJ, Liu SR, Herbold C, Stein LY, Richter A, Wissel H, Bruggemann N, Wagner M, Daims H. Low yield and abiotic origin of N2O formed by the complete nitrifier Nitrospira inopinata. Nature Communications, 2019, 10(1): 1836. DOI:10.1038/s41467-019-09790-x |
| [53] | Caranto JD, Lancaster KM. Nitric oxide is an obligate bacterial nitrification intermediate produced by hydroxylamine oxidoreductase. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(31): 8217-8222. DOI:10.1073/pnas.1704504114 |
| [54] | Kozlowski JA, Stieglmeier M, Schleper C, Klotz MG, Stein LY. Pathways and key intermediates required for obligate aerobic ammonia-dependent chemolithotrophy in bacteria and thaumarchaeota. The ISME Journal, 2016, 10(8): 1836-1845. DOI:10.1038/ismej.2016.2 |
| [55] | Hahn J. The North Atlantic Ocean as a source of atmospheric N2O. Tellus, 1974, 26(1/2): 160-168. |
| [56] | Lam P, Kuypers MMM. Microbial nitrogen cycling processes in oxygen minimum zones. Annual Review of Marine Science, 2011, 3: 317-345. DOI:10.1146/annurev-marine-120709-142814 |
| [57] | Ji QX, Babbin AR, Jayakumar A, Oleynik S, Ward BB. Nitrous oxide production by nitrification and denitrification in the eastern tropical South Pacific oxygen minimum zone. Geophysical Research Letters, 2015, 42(24): 10755-10764. DOI:10.1002/2015GL066853 |
| [58] | K?rner H, Zumft WG. Expression of denitrification enzymes in response to the dissolved oxygen level and respiratory substrate in continuous culture of Pseudomonas stutzeri. Applied and Environmental Microbiology, 1989, 55(7): 1670-1676. DOI:10.1128/AEM.55.7.1670-1676.1989 |
| [59] | Betlach MR, Tiedje JM. Kinetic explanation for accumulation of nitrite, nitric oxide, and nitrous oxide during bacterial denitrification. Applied and Environmental Microbiology, 1981, 42(6): 1074-1084. DOI:10.1128/AEM.42.6.1074-1084.1981 |
| [60] | Wankel SD, Ziebis W, Buchwald C, Charoenpong C, De Beer D, Dentinger J, Xu ZJ, Zengler K. Evidence for fungal and chemodenitrification based N2O flux from nitrogen impacted coastal sediments. Nature Communications, 2017, 8: 15595. DOI:10.1038/ncomms15595 |
| [61] | Nilsson RH, Anslan S, Bahram M, Wurzbacher C, Baldrian P, Tedersoo L. Mycobiome diversity:high-throughput sequencing and identification of fungi. Nature Reviews Microbiology, 2019, 17(2): 95-109. DOI:10.1038/s41579-018-0116-y |
| [62] | Hassett BT, Borrego EJ, Vonnahme TR, R?m? T, Kolomiets MV, Gradinger R. Arctic marine fungi:biomass, functional genes, and putative ecological roles. The ISME Journal, 2019, 13(6): 1484-1496. DOI:10.1038/s41396-019-0368-1 |
| [63] | Chee-Sanford JC, Connor L, Krichels A, Yang WH, Sanford RA. Hierarchical detection of diverse clade Ⅱ (atypical) nosZ genes using new primer sets for classical-and multiplex PCR array applications. Journal of Microbiological Methods, 2020, 172: 105908. DOI:10.1016/j.mimet.2020.105908 |
| [64] | Jones CM, Spor A, Brennan FP, Breuil MC, Bru D, Lemanceau P, Griffiths B, Hallin S, Philippot L. Recently identified microbial guild mediates soil N2O sink capacity. Nature Climate Change, 2014, 4(9): 801-805. DOI:10.1038/nclimate2301 |
| [65] | Jones CM, Graf DRH, Bru D, Philippot L, Hallin S. The unaccounted yet abundant nitrous oxide-reducing microbial community:a potential nitrous oxide sink. The ISME Journal, 2013, 7(2): 417-426. |
| [66] | Conthe M, Wittorf L, Kuenen JG, Kleerebezem R, Van Loosdrecht MCM, Hallin S. Life on N2O:deciphering the ecophysiology of N2O respiring bacterial communities in a continuous culture. The ISME Journal, 2018, 12(4): 1142-1153. DOI:10.1038/s41396-018-0063-7 |
| [67] | Yoshida N. 15N-depleted N2O as a product of nitrification. Nature, 1988, 355(6190): 528-529. |
| [68] | Zhu X, Burger M, Doane TA, Horwath WR. Ammonia oxidation pathways and nitrifier denitrification are significant sources of N2O and NO under low oxygen availability. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(16): 6328-6333. DOI:10.1073/pnas.1219993110 |
| [69] | Shi XZ, Hu HW, Zhu-Barker X, Hayden H, Wang JT, Suter H, Chen DL, He JZ. Nitrifier-induced denitrification is an important source of soil nitrous oxide and can be inhibited by a nitrification inhibitor 3, 4-dimethylpyrazole phosphate. Environmental Microbiology, 2017, 19(12): 4851-4865. DOI:10.1111/1462-2920.13872 |
| [70] | Wrage N, Velthof GL, Van Beusichem ML, Oenema O. Role of nitrifier denitrification in the production of nitrous oxide. Soil Biology and Biochemistry, 2001, 33(12/13): 1723-1732. |
| [71] | Kool DM, Wrage N, Zechmeister-Boltenstern S, Pfeffer M, Brus D, Oenema O, Van Groenigen JW. Nitrifier denitrification can be a source of N2O from soil:a revised approach to the dual-isotope labelling method. European Journal of Soil Science, 2010, 61(5): 759-772. |
| [72] | Bianchi D, Weber TS, Kiko R, Deutsch C. Global niche of marine anaerobic metabolisms expanded by particle microenvironments. Nature Geoscience, 2018, 11(4): 263-268. DOI:10.1038/s41561-018-0081-0 |
