舒为1, 田晓玉2

 , 赵洪伟1
, 赵洪伟1

1. 海南大学生态与环境学院, 海南 海口 570228;
2. 海南师范大学体育学院, 海南 海口 571158
收稿日期:2020-03-13;修回日期:2020-06-18;网络出版日期:2020-07-10
基金项目:海南省重点研发计划(ZDYF2017007)
作者简介:田晓玉, 海南师范大学体育学院教授, 硕士生导师, 体育教育训练学学科带头人。海南省"515人才工程"人选、省级专家。海南师范大学优秀创新创业导师人才库导师, 海南省琼山强制隔离戒毒所聘任戒毒人员"身体康复训练专家"。研究方向:从事运动促进健康防控慢病研究及海洋生态环境变化对人类健康影响因子研究及;
赵洪伟, 海南大学生态与环境学院副教授。2012年获得中国农业大学博士学位(与美国夏威夷大学国家公派联合培养博士生), 2012至2014年, 先后在夏威夷大学从事博士后和在天津大学从事教学科研工作。主要研究方向为环境生态学与生物分析化学。近年主持国家自然科学基金、国防科技创新特区项目、海南省重大科技项目课题、海南省自然科学基金等项目10余项.
*通信作者:田晓玉, E-mail:1158833903@qq.com;
赵洪伟, E-mail:hwzhao@hainanu.edu.cn.
摘要:[目的] 海南海口含有丰富的温泉资源,对温泉微生物多样性进行研究,有助于进一步开发和利用海南温泉微生物资源。[方法] 本文采用Illumina HiSeq高通量测序技术对海口3个温泉[海甸岛荣域温泉(S1)、火山口开心农场温泉(S2)和西海岸海长流温泉(S3)]水样中微生物ITS序列和16S rRNA基因V3-V4区进行测序及生物信息学分析,探究海口市3个不同区域的温泉真菌多样性与细菌多样性。[结果] (1)α多样性分析表明,真菌群落中,S3 > S1 > S2,而在细菌群落中,S2 > S1 > S3。β多样性分析表明,3个温泉真菌群落和细菌群落组成差异皆显著。(2)分类分析表明,温泉真菌群落优势菌门为子囊菌门(Ascomycota)和担子菌门(Basidiomycota),细菌群落优势菌门为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、Thermi、硝化螺旋菌门(Nitrospirae)、绿菌门(Chlorobi)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi)、放线菌门(Actinobacteria)。(3)CCA(Canonical correspondence analysis)分析表明,3个温泉的真菌群落主要影响因子是温度,细菌群落主要影响因子是总磷。[结论] 海南省海口市温泉中含有丰富的微生物资源,其微生物群落组成受多种环境因子影响,且影响真菌和细菌的主要环境因子不同。
关键词:海口温泉高通量测序微生物多样性
Diversity of fungi and bacteria in hot springs in Haikou, Hainan province
Wei Shu1, Xiaoyu Tian2

 , Hongwei Zhao1
, Hongwei Zhao1

1. College of Ecology and Environment, Hainan University, Haikou 570228, Hainan Province, China;
2. College of Physical Education, Hainan Normal University, Haikou 571158, Hainan Province, China
Received: 13 March 2020; Revised: 18 June 2020; Published online: 10 July 2020
*Corresponding author: Xiaoyu Tian, E-mail:1158833903@qq.com;
Hongwei Zhao, E-mail: hwzhao@hainanu.edu.cn.
Foundation item: Supported by the Key Research and Development Project of Hainan Province (ZDYF2017007)
Abstract: [Objective] Haikou is rich in hot spring resources and the research on the microbial diversity of hot springs is conducive to the further development and utilization of the microbial resources in Hainan hot springs. [Methods] Microbial ITS sequences and V3-V4 region of 16S rRNA gene in three hot springs (Rongyu hot spring on haidian island, S1; Happy farm hot spring in the crater, S2; and west coast Haichangliu hot spring, S3) water samples were sequenced by Illumina HiSeq high-throughput sequencing technology and were analyzed by bioinformatics. [Results] Analysis of alpha diversity shows that in the fungal community, S3 > S1 > S2, and in the bacterial community, S2 > S1 > S3. Beta diversity analysis shows that the compositions of fungal and bacterial communities in the three hot springs were significantly different; Classification analysis shows that the dominant phyla of hot spring fungal community were Ascomycota and Basidiomycota and those of hot spring bacterial community were Proteobacteria, Bacteroidetes, Thermi, Nitrospirae, Chlorobi, Firmicutes, Chloroflexi, Actinobacteria; Canonical correspondence analysis shows that temperature was the main influencing factor on fungus community in the three hot springs, and total phosphorus on bacterial community. [Conclusion] Haikou hot springs have abundant microbial resources. The microbial community composition is mainly affected by temperature for fungi and total phosphorus for bacteria.
Keywords: Haikouhot springhigh-throughput sequencingmicrobial diversity
温泉是一种地下自然涌出的泉水,水温较高于周围地区的气温,具有丰富的微生物资源[1]。泉环境与地球早期环境比较接近,独特理化特征促进了特殊微生物群体的形成,嗜热等适合极端环境条件生存的微生物聚集于温泉环境,形成了微生物多样性[2]。对温泉的微生物进行研究有助于认识生命的起源和进化,同时温泉中的微生物具有耐热的生理特性,使其成为各种高温酶的潜在来源而具有较高的应用价值[3-4]。
温泉一直是国内外研究的热点之一。目前国际上对美国黄石国家公园热泉[5-6]、冰岛温泉[7]、日本温泉[8]、泰国温泉[9]、俄罗斯温泉[10]的微生物群落结构与多样性进行了比较深入的研究。而国内****则对云南[11-13]、西藏[14-16]、河北[17]等地区温泉微生物多样性进行了深入研究,如Hou等[12]利用16S rRNA基因测序技术,系统研究云南腾冲热海热泉微生物多样性,认为其优势微生物可能受pH和温度影响;Huang等[16]利用16S rRNA基因系统发育分析方法,对西藏中东部海拔4600 m的10个温泉进行了细菌的多样性研究,发现主要的菌门是变形菌门、厚壁菌门、蓝藻门、绿藻门;张丽娜等[17]通过构建16S rRNA基因克隆文库研究河北温泉,认为温度是影响河北温泉细菌多样性水平的重要因素。但对于海南温泉的微生物多样性研究,还未见报道。此外,目前****对于同一温泉只是集中研究真菌群落或者细菌群落,而对于细菌群落与真菌群落同时研究,还未见报道。
海口位于我国最南端的热带岛屿海南岛,日照时间长,其独特的气候和特殊的地理环境决定了海口温泉微生物资源的特殊性。海口有着丰富的温泉资源,海甸岛荣域温泉、火山口开心农场温泉、西海岸海长流温泉是海口的三大温泉,为碱性温泉,处于热带海洋性季风气候。
本研究选取海南海口海甸岛荣域温泉、火山口开心农场温泉、西海岸海长流温泉等3个温泉,采用高通量测序技术,分析这3个温泉微生物群落(真菌群落和细菌群落)组成和多样性特征,探究海口温泉真菌、细菌多样性的影响因子,为了解热带岛屿温泉微生物多样性提供了基础资料,为进一步开发和利用海南海口温泉微生物资源提供了科学依据,有助于温泉环境中微生物生态学发展。
1 材料和方法 样品采集于2018年5月,来自于海口地区3个不同的温泉:海甸岛荣域温泉(S1) (110.34°E,20.08°N)、火山口开心农场温泉(S2) (110.23°E,19.92°N)和西海岸海长流温泉(S3) (110.19°E,20.06°N)。水样采集后装于无菌瓶中,储存于4 ℃保温箱中,并对样品所处的经纬度进行了GPS定位。返回实验室后,用0.22 μm的无菌滤膜过滤温泉水,在滤膜上富集温泉水中的微生物,?80 ℃保存滤膜,备用。
1.1 温泉理化性质检测 温度、pH等参数现场测定,总磷、硝酸盐氮、钙、镁、硒、镉、铅等参数返回实验室后测定。使用水温计、便携式pH计现场检测温泉样品的温度、pH等参数;根据《水质总磷的测定钼酸铵分光光度法》(GB/T 11893-1989),检测温泉样品的总磷;根据《生活饮用水标准检验方法无机非金属指标》(GB/T 5750.5-2006),检测温泉样品的硝酸盐氮;根据《水质钙和镁的测定原子吸收分光光度法》 (GB/T 11905-1989),检测温泉样品的钙、镁等参数;根据《生活饮用水标准检验方法金属指标》(GB/T 5750.6-2006),检测温泉样品的硒、镉、铅等参数。
1.2 温泉微生物DNA提取 采用MoBio PowerSoil? DNA Isolation Kit提取滤膜上富集的微生物的总DNA,然后利用NanoDrop 2000超微量紫外分光光度计检测DNA的纯度和浓度。
1.3 16S rRNA基因与ITS序列的扩增测序 细菌以16S rRNA基因的V3–V4区为目标序列,用通用引物341F/806R进行扩增。真菌以18S rRNA基因与5.8S rRNA基因之间的内源转录间隔ITS区为目标序列,用通用引物ITS1/ITS2进行扩增。PCR扩增结束后,用2%琼脂糖凝胶电泳进行产物验证。将上述PCR扩增产物,进行产物纯化和均一化,利用双末端测序(Paired-End)的方法,构建成小片段测序文库,建好的文库先进行文库质检,质检合格的文库用Illumina HiSeq2500进行测序。
1.4 基因组数据处理 根据Barcode序列和PCR扩增引物序列从下机数据中拆分出各样品数据,截去Barcode序列和引物序列,对样品的reads进行拼接,得到的拼接序列为原始Tags数据(Raw Tags),Raw Tags经过过滤操作,去掉低质量不符合长度的tag以及嵌合体,得到高质量的Tags数据(Clean Tags)。
1.5 生物信息学分析 使用QIIME软件,对获得的高质量序列,按97%的序列相似度进行归并和OTU (operational taxonomic units,OTU)划分,真菌和细菌分别基于UNITE和Silva参考数据库进行比对,得到每个OTU对应的物种分类信息;根据OTU划分和分类地位鉴定结果,使用QIIME软件,获得每个样本在各分类水平的群落组成;使用QIIME软件分别对每个样本计算Ace指数、Chao1指数、Shannon指数,Simpso指数等4种α多样性指数;使用R软件, 基于UniFrac距离算法PcoA (principal coordinate analysis),进行β多样性分析;使用Canoco软件,采用典范对应分析(Canonical correspondence analysis,CCA)进行温泉理化因子和微生物(真菌和细菌)群落组成的关系分析,本研究的统计分析均采用SPSS v16.0软件进行分析。
2 结果和分析 2.1 海口温泉水样信息 海口地区3个温泉[海甸岛荣域温泉(S1)、火山口开心农场温泉(S2)、西海岸海长流温泉(S3)],温度39.2–46.4 ℃,pH 7.54–8.64,属于碱性温泉,在温度、pH、总磷、硝酸盐氮、钙、镁等理化性质方面都具有差异,硒、镉、铅等理化性质未检出(浓度太低)(表 1)。海甸岛荣域温泉位于海口市美兰区海甸岛,临海;火山口开心农场温泉位于海口市秀英区石山镇施茶村,处于内陆;西海岸海长流温泉,位于海口市秀英区长流镇,临海。
表 1. 温泉的理化性质 Table 1. Physical and chemical properties of the hot springs
| Hot spring | T/℃ | pH | TP/(mg/L) | NN/(mg/L) | Ca/(mg/L) | Mg/(mg/L) | Se/(mg/L) | Cd/(mg/L) | Pb/(mg/L) |
| S1 | 39.2 | 7.54 | 0.13 | 0.3 | 21.0 | 15.1 | < 0.005 | < 0.0005 | < 0.0025 |
| S2 | 43.0 | 8.64 | 0.07 | 1.5 | 32.0 | 7.20 | < 0.005 | < 0.0005 | < 0.0025 |
| S3 | 46.4 | 7.86 | 0.05 | 0.4 | 23.8 | 2.06 | < 0.005 | < 0.0005 | < 0.0025 |
| S1: Rongyu hot spring on haidian island; S2: Happy farm hot spring in the crater; S3: West coast Haichangliu hot spring; T: temperature; TP: total phosphorus; NN: nitrate nitrogen; Ca: calcium; Mg: magnesium; Se: selenium; Cd: cadmium; Pb: plumbum. The same below. | |||||||||
表选项
2.2 温泉样品测序结果 通过对温泉真菌的ITS序列片段测序,经过优化过滤低质量序列,9个温泉样品得到523437条优质序列,温泉样品序列经拆分、去冗余后,在97%的相似度下进行OTU聚类,3个温泉一共获得2271个OTUs;通过对温泉细菌的16S rRNA序列片段测序,经过优化过滤低质量序列,9个温泉样品得到444104条优质序列,温泉样品序列经拆分、去冗余后,在97%的相似度下进行OTU聚类,3个温泉一共获得7044个OTUs。3个温泉细菌群落的优质序列与OTU数目明显高于真菌群落。
从3个温泉真菌与细菌OTU数目Venn图可以看出(图 1-A、图 1-B),西海岸海长流温泉(S3)获得的真菌OTU数目最多(2079),其次是海甸岛荣域温泉(S1) (1418)和火山口开心农场温泉(S2) (985),3个温泉共有的真菌OTU数目仅为389;火山口开心农场温泉(S2)获得的细菌OTU数目最多(5781),其次是海甸岛荣域温泉(S1) (5404)和西海岸海长流温泉(S3) (3156),3个温泉共有的细菌OTU数目仅为993。
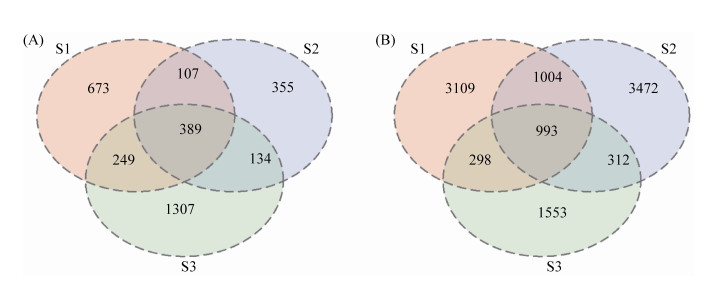 |
| 图 1 三个温泉真菌群落(A)和细菌群落(B) OTU水平韦恩图 Figure 1 OTU horizontal Venn diagram of fungal communities (A) and bacterial communities (B) in three hot springs. |
| 图选项 |
2.3 温泉真菌群落与细菌群落α多样性 对3个温泉真菌与细菌的α多样性进行单因素方差分析(one–way ANOVA)。由表 2可知,西海岸海长流温泉(S3)真菌的Ace指数、Chao1指数、Simpson指数与海甸岛荣域温泉(S1)、火山口开心农场温泉(S2)都具有显著性差异(P < 0.05),3个温泉真菌的Shannon指数都具有显著性差异(P < 0.05),西海岸海长流温泉(S3)真菌的Ace指数、Chao1指数、Shannon指数和Simpson指数>海甸岛荣域温泉(S1)>火山口开心农场温泉(S2);由表 3可知,西海岸海长流温泉(S3)细菌的Ace指数、Chao1指数、Shannon指数、Simpson指数与海甸岛荣域温泉(S1)、火山口开心农场温泉(S2)都具有显著性差异(P < 0.05),火山口开心农场温泉(S2)细菌的Ace指数、Chao1指数、Shannon指数和Simpson指数>海甸岛荣域温泉(S1)>西海岸海长流温泉(S3)。
表 2. 温泉真菌α多样性指数 Table 2. Fungus alpha diversity index of the three hot springs
| Hot spring | Ace index | Chao1 index | Shannon index | Simpson index |
| S1 | 1162.63±208.53a | 1220.18±183.76a | 3.07±0.28a | 0.67±0.03a |
| S2 | 1031.72±78.21a | 1019.99±89.52a | 2.10±0.16b | 0.62±0.06a |
| S3 | 1722.02±247.01b | 1768.78±283.82b | 5.32±0.31c | 0.91±0.02b |
| The value is mean ± standard deviation; Different lowercase letters in the same column indicate significant differences (P < 0.05); The same below. | ||||
表选项
表 3. 温泉细菌α多样性指数 Table 3. Bacterial alpha diversity index of the three hot springs
| Hot spring | Ace index | Chao1 index | Shannon index | Simpson index |
| S1 | 6464.23±1096.19a | 6449.05±1083.43a | 2749.33±309.54a | 0.96±0.01a |
| S2 | 7025.50±918.83a | 6906.44±888.30a | 2769.33±229.00a | 0.97±0.00a |
| S3 | 3970.60±923.26b | 3923.36±1066.60b | 1526.30±276.96b | 0.82±0.03b |
表选项
2.4 温泉真菌群落与细菌群落β多样性 对3个温泉真菌与细菌群落在OTU水平上进行基于unweighted UniFrac距离算法的主坐标分析表明:3个温泉真菌(图 2-A)和细菌(图 2-B)群落距离均较远,且完全分开,群落差异显著。
 |
| 图 2 3个温泉真菌群落(A)和细菌群落(B)基于unweighted UniFrac距离算法的主坐标分析 Figure 2 PCoA analysis of the fungal communities (A) and bacterial communities (B) in the three hot springs based on the unweighted UniFrac distance. |
| 图选项 |
2.5 温泉真菌群落与细菌群落的组成 3个温泉9个样品的OTUs代表序列经比对鉴定得到15门、33纲、82目、168科、298属的温泉真菌物种信息,51门、129纲、208目、217科、290属的温泉细菌物种信息。
在门水平上,将相对丰度低于1%以及在该水平上没有注释结果的真菌或细菌归于Others,3个温泉真菌群落菌门主要属于2个类群(图 3-A),分别是子囊菌门(Ascomycota) (43.88%)、担子菌门(Basidiomycota) (18.37%),3个温泉细菌群落菌门主要属于8个类群(图 3-B),分别是变形菌门(Proteobacteria) (47.32%)、拟杆菌门(Bacteroidetes) (13.23%)、Thermi (10.16%)、硝化螺旋菌门(Nitrospirae) (6.25%)、绿菌门(Chlorobi) (6.19%)、厚壁菌门(Firmicutes) (4.18%)、绿弯菌门(Chloroflexi) (2.06%)、放线菌门(Actinobacteria) (1.22%);在属水平上,将相对丰度低于1%以及在该水平上没有注释结果的真菌或细菌归于Others,3个温泉真菌群落菌属主要属于7个类群(图 3-C),分别是轮枝菌属(Verticillium) (23.24%)、毛孢子菌属(Trichosporon) (11.52%)、Hortaea (7.20%)、Cystobasidium (4.15%)、Gloeotinia (2.72%)、青霉菌属(Penicillium) (1.81%)、Sympodiomycopsis (1.34%),3个温泉细菌群落菌属主要属于8个类群(图 3-D),分别是Vogesella (4.77%)、硝化螺菌属(Nitrospira) (4.17%)、单胞菌属(Sphingomonas) (3.94%)、异常球菌属(Deinococcus) (3.50%)、假单胞菌属(Pseudomonas) (2.39%)、不动杆菌属(Acinetobacter) (1.58%)、苍白杆菌属(Ochrobactrum) (1.29%)、甲基杆菌属(Methylobacterium) (1.24%)。
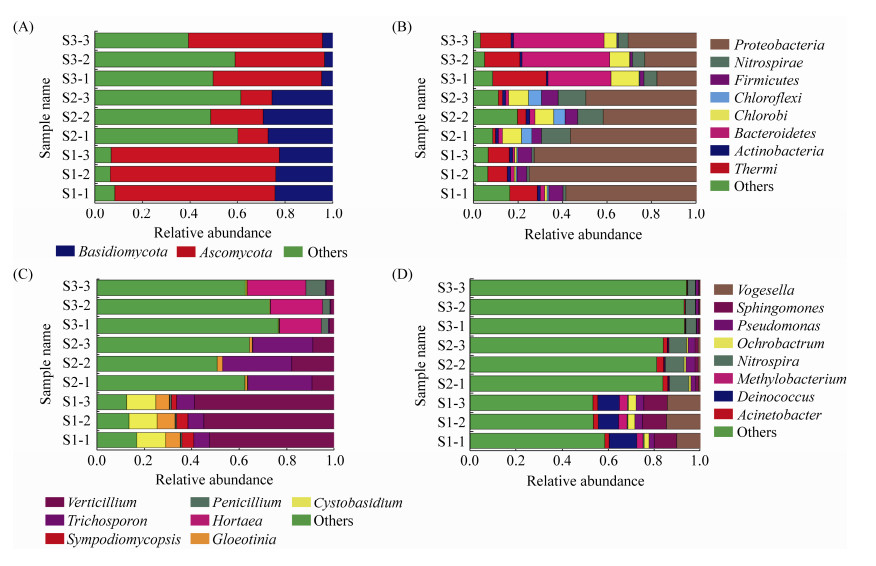 |
| 图 3 3个温泉真菌优势菌门(A)、细菌优势菌门(B)、真菌优势菌属(C)和细菌优势菌属(D)相对丰度 Figure 3 The relative abundance of fungal dominant phylum (A), bacterial dominant phylum (B), fungal dominant genus (C) and bacterial dominant genus (D) in the three hot springs. |
| 图选项 |
2.6 温泉真菌、细菌群落与温泉环境因子的相关性 采用CCA探究影响海南省海口市温泉微生物群落组成的环境因子。选用温度、pH、总磷、硝酸盐氮、钙、镁等6个温泉因子以及相对丰度大于1%的真菌属进行CCA分析,分析发现温度、pH、总磷、硝酸盐氮、镁等5个温泉因子对温泉真菌群落有显著影响(P < 0.05),根据各环境因子在第一轴的投影,温度是影响海南省海口市3个温泉真菌群落组成的主要因子(图 4-A);选用温度、pH、总磷、硝酸盐氮、钙、镁等6个温泉因子以及相对丰度大于1%的细菌属进行CCA分析,分析发现温度、pH、总磷、硝酸盐氮、钙、镁等6个温泉因子都对温泉真菌群落有显著作用(P < 0.05),根据各环境因子在第一轴的投影,总磷是影响海南省海口市3个温泉细菌群落组成的主要因子(图 4-B)。
 |
| 图 4 3个温泉真菌群落组成(A)、细菌群落组成(B)与温泉理化因子间的典范对应分析(CCA) Figure 4 Canonical correspondence analysis (CCA) between physical and chemical factors and fungal communities (A) and bacterial communities (B) of the three hot springs. |
| 图选项 |
根据物种到环境因子的垂直距离越小,影响越大,物种箭头与环境因子箭头的夹角呈锐角,为正相关,呈钝角,为负相关,可知在真菌群落的属水平中,轮枝菌属(Verticillium)、Gloeotinia的主要影响因子是镁,呈正相关;Cystobasidium、Sympodiomycopsis的主要影响因子是总磷,呈正相关;Hortaea、青霉菌属(Penicillium)的主要影响因子是温度,呈正相关;毛孢子菌属(Trichosporon)的主要影响因子是硝酸盐氮,呈正相关(图 4-A)。在细菌群落的属水平中,异常球菌属(Deinococcus)、甲基杆菌属(Methylobacterium)、Vogesella、单胞菌属(Sphingomonas)的主要影响因子是总磷,呈正相关;苍白杆菌属(Ochrobactrum)的主要影响因子是温度,呈负相关;硝化螺菌属(Nitrospira)的主要影响因子是温度,呈正相关;不动杆菌属(Acinetobacter)的主要影响因子是硝酸盐氮,呈正相关;假单胞菌属(Pseudomonas)的主要影响因子是pH,呈正相关(图 4-B)。
3 讨论 3.1 海口温泉微生物多样性 海口3个温泉共聚类为2271个真菌OTUs,7044个细菌OTUs,注释到真菌15个门,细菌51个门,与其他研究相比较,海口温泉微生物群落组成多样性远远高于河南鲁山、云南腾冲等地区。刘开辉等[18]高通量测序分析云南腾冲真菌多样性,研究发现5处热泉共注释到5个真菌门;秦亚玲等[19]高通量测序分析云南腾冲细菌多样性,研究发现3处热泉共聚类为141个OTUs,注释到19个细菌门;刘丽等[20]研究河南鲁山五大温泉水细菌多样性,研究发现五大温泉共聚类为2273个OTUs,注释到40个细菌门。海口温泉微生物群落组成多样性远远高于河南鲁山、云南腾冲等地区,是因为海口温泉与河南鲁山温泉、云南腾冲温泉在温度、pH等理化因子方面有显著差异[18-20]。
海口3个温泉细菌群落组成多样性远远高于真菌群落组成多样性。本研究发现,海口3个温泉的细菌α多样性指数(Ace指数、Chao1指数、Shannon指数和Simpson指数)均远远超过真菌α多样性指数,同时3个温泉细菌群落OTUs总数(7044个)远远高于真菌群落OTU总数(2271个)。与其他研究相比较,具有类似的结果,肖凯等[21]曾对广东金山温泉沉积物中原核与真核微生物多样性进行分析,研究发现金山温泉细菌多样性高于真菌多样性。导致同一温泉细菌多样性高于真菌多样性,是因为细菌的适应能力高于真菌,其sigma70因子能够增强对外界环境胁迫的耐受力和抵抗作用[22]。
在菌门分类水平上,海口3个温泉微生物群落优势菌门基本相似。海口3个温泉真菌群落优势菌门主要属于2个类群:子囊菌门(Ascomycota)、担子菌门(Basidiomycota),但优势菌门的相对丰度在3个温泉中有所差异,其中子囊菌门在海甸岛荣域温泉的相对丰度最高(69.23%),其次是西海岸海长流温泉(46.44%),最后是火山口开心农场温泉(15.95%);担子菌门在火山口开心农场温泉的相对丰度最高(27.38%),其次是海甸岛荣域温泉(23.55%),最后是西海岸海长流温泉(4.2%)。与其他研究相比较,具有类似的结果,如Kambura等[23]曾研究肯尼亚的马加迪湖与小马加迪湖碱性温泉真菌多样性,结果表明子囊菌门、担子菌门为优势菌门;Salano等[24]研究肯尼亚裂谷的苏打湖碱性温泉真菌群落多样性,结果表明子囊菌门(80.33%)、担子菌门(11.48%)为优势菌门;刘开辉等[18]研究云南腾冲热泉真菌群落,发现酸性温泉的优势菌门为子囊菌门、担子菌门。本研究同时发现,海口3个温泉细菌群落最大的优势菌门是变形菌门(Proteobacteria),但其相对丰度在3个温泉中有所差异,变形菌门在海甸岛荣域温泉的相对丰度最高(68.86%),其次是火山口开心农场温泉(49.23%),最后是西海岸海长流温泉(23.79%)。与其他研究相比较,具有类似的结果,如刘丽等[20]研究河南鲁山碱性温泉细菌多样性,发现最大优势菌门为变形菌门;Bohorquez等[25]研究哥伦比亚安迪斯山脉酸性温泉的微生物群落,发现最大的优势菌门为变形菌门。总之,温泉微生物群落的优势菌门相对丰度在不同的生境中差异可能较大,但优势菌门基本相似。温泉真菌群落优势菌门是子囊菌门、担子菌门,是因为子囊菌门、担子菌门具有良好的耐热机制,世界上已报道的耐热真菌共有89种,其中超过一半(49种)属于子囊菌门和担子菌门[26-27]。温泉细菌群落最大优势菌门为变形菌门,是因为变形菌门是细菌域中最为庞大的一个类群,涵盖了极为广泛的代谢类型[28-30]。温泉微生物群落优势菌门的相对丰度在不同的生境中差异较大,是因为温泉微环境的差异,如林白雪[31]曾对厦门近海温泉微生物多样进行研究,发现温泉温度的差异,影响了变形菌门的相对丰度。
在菌属分类水平上,海口3个温泉真菌群落优势菌属有所不同。海甸岛荣域温泉(S1)的优势真菌属是轮枝菌属(Verticillium) (55.44%)、Cystobasidium (12.04%)、毛孢子菌属(Trichosporon) (7.00%)、Gloeotinia (6.48%)、Sympodiomycopsis (4.00%),其中Cystobasidium在火山口开心农场温泉(S2)、西海岸海长流温泉(S3)中含量较低(< 0.6%),是因为CCA分析显示Cystobasidium的主要影响因子是总磷,呈正相关,而在火山口开心农场温泉(S2)、西海岸海长流温泉(S3)中总磷含量极低(≤0.07 mg/L);火山口开心农场温泉(S2)的优势真菌属是毛孢子菌属(Trichosporon) (27.21%)、轮枝菌属(Verticillium) (12.04%)、Gloeotinia (1.43%),其中Gloeotinia在西海岸海长流温泉(S3)中含量较低(< 0.4%),因为CCA分析显示Gloeotinia的主要影响因子是镁,呈正相关,而西海岸海长流温泉(S3)中镁含量最低,仅为2.06 mg/L;西海岸海长流温泉(S3)的优势真菌属Hortaea (21.34%)、青霉菌属(Penicillium) (4.80%)、轮枝菌属(Verticillium) (2.24%),其中青霉菌属(Penicillium)在海甸岛荣域温泉(S1)、火山口开心农场温泉(S2)中含量较低(< 0.6%),是因为CCA分析显示青霉菌属(Penicillium)的主要影响因子是温度,呈正相关,而海甸岛荣域温泉(S1)与火山口开心农场温泉(S2)的温度远远低于西海岸海长流温泉(S3)。与其他研究相比较,发现云南腾冲酸性热泉最大优势真菌属为枝孢属(Cladosporium),碱性热泉(pH=9.05)最大优势真菌属是侧齿霉属(Engyodontiu)[19],与海口温泉明显不同,是因为环境因子影响了温泉微生物群落结构[32-33]。
在菌属分类水平上,海口3个温泉细菌群落优势菌属有所不同。海甸岛荣域温泉(S1)的优势细菌属是Vogesella (13.11%)、单胞菌属(Sphingomonas) (10.06%)、异常球菌属(Deinococcus) (10.05%)、甲基杆菌属(Methylobacterium) (3.22%)、假单胞菌属(Pseudomonas) (3.05%)、苍白杆菌属(Ochrobactrum) (2.87%)、不动杆菌属(Acinetobacter) (2.06%),其中异常球菌属(Deinococcus)、甲基杆菌属(Methylobacterium)、Vogesella在火山口开心农场温泉(S2)、西海岸海长流温泉(S3)中含量较低(< 0.86%),是因为CCA分析显示异常球菌属(Deinococcus)、甲基杆菌属(Methylobacterium)、Vogesella的主要影响因子是总磷,呈正相关,而火山口开心农场温泉(S2)、西海岸海长流温泉(S3)中总磷含量极低(≤0.07 mg/L);火山口开心农场温泉(S2)的优势细菌属是硝化螺菌属(Nitrospira) (8.01%)、假单胞菌属(Pseudomonas) (3.08%)、不动杆菌属(Acinetobacter) (2.32%)、单胞菌属(Sphingomonas) (1.28%),其中单胞菌属(Sphingomonas)在西海岸海长流温泉(S3)中含量较低(< 0.4%),是因为CCA分析显示单胞菌属(Sphingomonas)的主要影响因子是总磷,呈正相关,而西海岸海长流温泉(S3)中总磷含量最低(0.07 mg/L);西海岸海长流温泉(S3)优势细菌属硝化螺菌属(Nitrospira) (4.04%)、假单胞菌属(Pseudomonas) (1.03%),其中硝化螺菌属(Nitrospira)在海甸岛荣域温泉(S1)中含量较低(< 0.5%),是因为CCA分析显示硝化螺菌属(Nitrospira)的主要影响因子是温度,呈正相关,而海甸岛荣域温泉(S1)温度最低(39.2 ℃);假单胞菌属(Pseudomonas)是海口3个温泉共有的优势细菌属,因为CCA分析显示假单胞菌属(Pseudomonas)的主要影响因子是pH,而3个温泉都是弱碱性泉。与其他研究相比较,发现喜玛拉雅北部地区碱性温泉的最大优势细菌属是Paludibacter(66.96%)[34],云南腾冲酸性热泉最大的优势细菌属是酸杆菌属(Acidibacillus) (35.6%)[19],与海口温泉明显不同,是因为温泉间的温度、pH、矿物成分等存在差异,影响了温泉的群落结构[2]。
3.2 海口温泉微生物多样性影响因素 海口3个温泉的温度、pH、总磷、硝酸盐氮、镁、钙等6个理化性质有差异,而温泉的硒、镉、铅等理化性质未检出(浓度太低)。因此选用温度、pH、总磷、硝酸盐氮、镁、钙等6个理化性质进行海口温泉微生物多样性影响因素分析。本研究发现,温度、pH、总磷、硝酸盐氮、镁等5个理化因子都对真菌和细菌群落有显著影响,但影响3个温泉真菌和细菌群落的主要因子是不同的,影响真菌群落的主要因子是温度,而影响细菌群落的主要因子是总磷,是因为真菌与细菌在生物类型、细胞结构、增殖方式等方面有很大的不同[35],所以对同一环境因子的耐受范围不同。同时发现,钙对细菌群落有显著影响(P < 0.05),而对真菌群落无显著影响,是因为钙对细菌有着重要的作用,参与了细菌对温度、盐、渗透压的早期感应以及细胞分裂、细胞分化、基因表达等多种生命过程[36]。影响温泉微生物群落的因子有很多,比如温泉的温度[1]、酸碱度[37]、地理位置[38]、硫、铁、砷等温泉水化学成分[39]。同时发现,不同地域的温泉,其微生物群落的主要影响因子可能不同。Chan等[40]探究影响马来西亚中性温泉微生物多样性的理化因子,发现主要影响因子是温度;Mathur等[39]研究非生物因素对美国黄石国家公园酸性温泉微生物多样性的影响,发现温泉的矿物化学成分是影响细菌群落的主要因子;Uribe-Lorío等[41]探究哥斯达黎加温泉中细菌群落的影响因子,发现pH是主要的影响因子。不同地域温泉微生物群落的主要影响因子不同,与不同地域的温泉微环境存在较大的差异有关,如马来西亚中性温泉、美国黄石国家公园酸性温泉、哥斯达黎加温泉在矿物质成分、温度、pH等方面存在较大差异[39-41]。
4 结论 本文首次采用高通量测序技术分析了海南省海口市温泉的真菌和细菌多样性,发现其温泉中含有丰富的微生物资源,远高于国内其他地区温泉微生物多样性,最大的优势真菌门是子囊菌门(Ascomycota) (43.88%),最大的优势细菌门是变形菌门(Proteobacteria) (47.32%),最大的优势真菌属是轮枝菌属(Verticillium) (23.24%),最大的优势细菌属是Vogesella(4.77%)。所研究的3个温泉间微生物群落优势菌门基本相似,但优势菌属有所不同。分析发现海口温泉真菌群落的主要影响因子是温度,细菌群落的主要影响因子是总磷。本研究为了解我国热带岛屿地热温泉微生物多样性和资源开发利用提供了基础。
References
| [1] | Wang S, Hou WG, Dong HL, Jiang HC, Huang LQ, Wu G, Zhang CL, Song ZQ, Zhang Y, Ren HL, Zhang J, Zhang L. Control of temperature on microbial community structure in hot springs of the Tibetan Plateau. PLoS One, 2013, 8(5): e62901. DOI:10.1371/journal.pone.0062901 |
| [2] | Yu XJ, Wang LL, Jia SJ, Dong QJ. Microbial diversity and enzymes of hot springs. Microbiology China, 2014, 41(1): 130-135. (in Chinese) 于新娟, 王莉莉, 贾盛佼, 董全江. 温泉微生物多样性与酶类分析. 微生物学通报, 2014, 41(1): 130-135. |
| [3] | Cavicchioli R. Extremophiles and the search for extraterrestrial life. Astrobiology, 2002, 2(3): 281-292. DOI:10.1089/153110702762027862 |
| [4] | Demirjian DC, Mor??s-Varas F, Cassidy CS. Enzymes from extremophiles. Current Opinion in Chemical Biology, 2001, 5(2): 144-151. DOI:10.1016/S1367-5931(00)00183-6 |
| [5] | Hugenholtz P, Pitulle C, Hershberger KL, Pace NR. Novel division level bacterial diversity in a Yellowstone hot spring. Journal of Bacteriology, 1998, 180(2): 366-376. DOI:10.1128/JB.180.2.366-376.1998 |
| [6] | Pace NR. A molecular view of microbial diversity and the biosphere. Science, 1997, 276(5313): 734-740. DOI:10.1126/science.276.5313.734 |
| [7] | Hobel CFV, Marteinsson VT, Hreggvidsson Gó, Kristjánsson JK. Investigation of the microbial ecology of intertidal hot springs by using diversity analysis of 16S rRNA and chitinase genes. Applied and Environmental Microbiology, 2005, 71(5): 2771-2776. DOI:10.1128/AEM.71.5.2771-2776.2005 |
| [8] | Ward LM, Idei A, Terajima S, Kakegawa T, Fischer WW, McGlynn SE. Microbial diversity and iron oxidation at Okuoku-hachikurou Onsen, a Japanese hot spring analog of Precambrian iron formations. Geobiology, 2017, 15(6): 817-835. DOI:10.1111/gbi.12266 |
| [9] | Saimmai A, Riansa-Ngawong W, Maneerat S, Dikit P. Microbial diversity analysis of thermophilic hydrogen-producing consortia from hot spring in the south of Thailand and evaluate cashew apple juice as a substrate. Songklanakarin Journal of Science and Technology, 2017, 39(6): 803-812. |
| [10] | Wilkins LGE, Ettinger CL, Jospin G, Eisen JA. Metagenome-assembled genomes provide new insight into the microbial diversity of two thermal pools in Kamchatka, Russia. Scientific Reports, 2019, 9(1): 3059. DOI:10.1038/s41598-019-39576-6 |
| [11] | Liu KH, Ding XW, Salam N, Zhang B, Tang XF, Deng BW, Li WJ. Unexpected fungal communities in the Rehai thermal springs of Tengchong influenced by abiotic factors. Extremophiles, 2018, 22(3): 525-535. DOI:10.1007/s00792-018-1014-y |
| [12] | Hou WG, Wang S, Dong HL, Jiang HC, Briggs BR, Peacock JP, Huang QY, Huang LQ, Wu G, Zhi XY, Li WJ, Dodsworth JA, Hedlund BP, Zhang CL, Hartnett HE, Dijkstra P, Hungate BA, Badger JH. A comprehensive census of microbial diversity in hot springs of Tengchong, Yunnan Province China using 16S rRNA gene pyrosequencing. PLoS One, 2013, 8(1): e53350. DOI:10.1371/journal.pone.0053350 |
| [13] | Sun P, Gu C, Ren F, Dai X, Dong ZY. Prokaryotic microbial phylogenetic diversity of "Eryuan Niujie" hot spring in Yunnan province, China. Acta Microbiologica Sinica, 2010, 50(11): 1510-1518. (in Chinese) 孙盼, 顾淳, 任菲, 戴欣, 董志扬. 云南洱源牛街热泉原核微生物多样性分析. 微生物学报, 2010, 50(11): 1510-1518. |
| [14] | Guo L, Wang GC, Sheng YZ, Sun XY, Shi ZM, Xu QY, Mu WQ. Temperature governs the distribution of hot spring microbial community in three hydrothermal fields, eastern Tibetan Plateau Geothermal Belt, western China. Science of the Total Environment, 2020, 720: 137574. DOI:10.1016/j.scitotenv.2020.137574 |
| [15] | Zhang YM, Wu G, Jiang HC, Yang J, She WY, Khan L, Li WJ. Abundant and rare microbial biospheres respond differently to environmental and spatial factors in Tibetan hot springs. Frontiers in Microbiology, 2018, 9: 2096. DOI:10.3389/fmicb.2018.02096 |
| [16] | Huang QY, Dong CZ, Dong RM, Jiang HC, Wang S, Wang GH, Fang B, Ding XX, Niu L, Li X, Zhang CL, Dong HL. Archaeal and bacterial diversity in hot springs on the Tibetan Plateau, China. Extremophiles, 2011, 15(5): 549-563. DOI:10.1007/s00792-011-0386-z |
| [17] | Zhang LN, Hao CB, Li SY, Zhou X, Feng CP. Bacterial diversity analysis of two hot springs in Chengde, Hebei. Microbiology China, 2011, 38(11): 1618-1625. (in Chinese) 张丽娜, 郝春博, 李思远, 周训, 冯传平. 河北承德地区两个温泉中细菌的多样性分析. 微生物学通报, 2011, 38(11): 1618-1625. |
| [18] | Liu KH, Ding XW, Zhang B, Tang XF, Xiao M, Xian WD, Li WJ. High-throughput sequencing to reveal fungal diversity in hot springs of Rehai at Tengchong in Yunnan. Acta Microbiologica Sinica, 2017, 57(9): 1314-1322. (in Chinese) 刘开辉, 丁小维, 张波, 唐小飞, 肖敏, 鲜文东, 李文均. 高通量测序分析云南腾冲热海热泉真菌多样性. 微生物学报, 2017, 57(9): 1314-1322. |
| [19] | Qin YL, Liang ZL, Song Y, Wang BJ, Liu SJ, Jiang CY. Amplicon-based high-throughput sequencing reveals the microbial diversity in Rehai hot springs, Tengchong, Yunnan Province. Microbiology China, 2019, 46(10): 2482-2493. (in Chinese) 秦亚玲, 梁宗林, 宋阳, 王保军, 刘双江, 姜成英. 高通量测序分析云南腾冲热海热泉微生物多样性. 微生物学通报, 2019, 46(10): 2482-2493. |
| [20] | Liu L, Zhang K, Li BJ, Li MC, Chen Q, Zheng XH, Wang FA, Zhou YX. Bacterial diversity analysis of Five Hot Spring in Henan Lushan. Microbiology China, 2018, 45(6): 1219-1227. (in Chinese) 刘丽, 张科, 李冰洁, 李明灿, 陈秋, 郑新华, 王福安, 周云霞. 河南鲁山五大温泉水细菌多样性分析. 微生物学通报, 2018, 45(6): 1219-1227. |
| [21] | Xiao K, Cao LX, Lu YJ, Zhou SJ. A molecular view of microbial diversity in sediment of the Jinshan hot spring, Guangdong province. Acta Microbiologica Sinica, 2008, 48(6): 717-724. (in Chinese) 肖凯, 曹理想, 陆勇军, 周世宁. 广东金山温泉沉积物中原核与真核微生物多样性初步分析. 微生物学报, 2008, 48(6): 717-724. |
| [22] | Hu L, Tan ZW, Gao C, Tan XY, Tan ZY. Advances in the high efficient regulation of microbiological functions by sigma factors. Chinese Bulletin of Life Sciences, 2018, 30(3): 285-292. (in Chinese) 胡莉, 谭泽文, 郜晨, 谭习羽, 谭志远. Sigma因子高效调控微生物多功能研究进展. 生命科学, 2018, 30(3): 285-292. |
| [23] | Kambura AK, Mwirichia RK, Kasili RW, Karanja EN, Makonde HM, Boga HI. Diversity of fungi in sediments and water sampled from the hot springs of Lake Magadi and Little Magadi in Kenya. African Journal of Microbiology Research, 2016, 10(10): 330-338. DOI:10.5897/AJMR2015.7879 |
| [24] | Salano OA, Makonde HM, Kasili RW, Wangai LN, Nawiri MP, Boga HI. Diversity and distribution of fungal communities within the hot springs of soda lakes in the Kenyan rift valley. African Journal of Microbiology Research, 2017, 11(19): 764-775. |
| [25] | Bohorquez LC, Delgado-Serrano L, López G, Osorio-Forero C, Klepac-Ceraj V, Kolter R, Junca H, Baena S, Zambrano MM. In-depth characterization via complementing culture-independent approaches of the microbial community in an acidic hot spring of the Colombian Andes. Microbial Ecology, 2012, 63(1): 103-115. DOI:10.1007/s00248-011-9943-3 |
| [26] | Mouchacca J. Heat tolerant fungi and applied research:addition to the previously treated group of strictly thermotolerant species. World Journal of Microbiology and Biotechnology, 2007, 23(12): 1755-1770. DOI:10.1007/s11274-007-9426-3 |
| [27] | Mouchacca J. Thermotolerant fungi erroneously reported in applied research work as possessing thermophilic attributes. World Journal of Microbiology and Biotechnology, 2000, 16(8/9): 869-880. DOI:10.1023/A:1008979123304 |
| [28] | Madigan MT, Martinko JM, Parker J. (Brock) Biology of microorganisms. Upper Saddle River, NJ: Prentice Hall, 1997. |
| [29] | Ciccarelli FD, Doerks T, Von Mering C, Creevey CJ, Snel B, Bork P. Toward automatic reconstruction of a highly resolved tree of life. Science, 2006, 311(5765): 1283-1287. DOI:10.1126/science.1123061 |
| [30] | Emerson D, Rentz JA, Lilburn TG, Davis RE, Aldrich H, Chan C, Moyer CL. A novel lineage of proteobacteria involved in formation of marine Fe-oxidizing microbial mat communities. PLoS One, 2007, 2(8): e667. DOI:10.1371/journal.pone.0000667 |
| [31] | 林白雪.厦门近海温泉微生物多样性及热稳定纤维素酶的研究.福建农林大学博士学位论文, 2010. |
| [32] | Xie W, Zhang CL, Wang JX, Chen YF, Zhu YQ, De la Torre JR, Dong HL, Hartnett HE, Hedlund BP, Klotz MG. Distribution of ether lipids and composition of the archaeal community in terrestrial geothermal springs:impact of environmental variables. Environmental Microbiology, 2015, 17(5): 1600-1614. DOI:10.1111/1462-2920.12595 |
| [33] | Colman DR, Feyhl-Buska J, Robinson KJ, Fecteau KM, Xu HF, Shock EL, Boyd ES. Ecological differentiation in planktonic and sediment-associated chemotrophic microbial populations in Yellowstone hot springs. FEMS Microbiology Ecology, 2016, 92(9): fiw137. DOI:10.1093/femsec/fiw137 |
| [34] | Gupta V, Gupta N, Capalash N, Sharma P. Bio-prospecting bacterial diversity of hot springs in Northern Himalayan region of India for laccases. Indian Journal of Microbiology, 2017, 57(3): 285-291. DOI:10.1007/s12088-017-0656-2 |
| [35] | Zhao XP. More comprehensive understanding of the differences between prokaryotic cells and eukaryotic cells. Yinshan Academic Journal, 2015, 29(3): 29-31. (in Chinese) 赵晓平. 应较为全面地理解原核细胞与真核细胞的差异. 阴山学刊(自然科学版), 2015, 29(3): 29-31. |
| [36] | Ren XH, Wang SL, Wen Y, Yang KQ. An update of calcium signaling in bacteria-a review. Acta Microbiologica Sinica, 2009, 49(12): 1564-1570. (in Chinese) 任晓慧, 王胜兰, 文莹, 杨克迁. 细菌中钙信号的作用. 微生物学报, 2009, 49(12): 1564-1570. |
| [37] | Pagaling E, Grant WD, Cowan DA, Jones BE, Ma YH, Ventosa A, Heaphy S. Bacterial and archaeal diversity in two hot spring microbial mats from the geothermal region of Tengchong, China. Extremophiles, 2014, 16(4): 607-618. |
| [38] | Stout LM, Blake RE, Greenwood JP, Martini AM, Rose EC. Microbial diversity of boron-rich volcanic hot springs of Stt. Lucia, Lesser Antilles. FEMS Microbiology Ecology, 2009, 70(3): 402-412. DOI:10.1111/j.1574-6941.2009.00780.x |
| [39] | Mathur J, Bizzoco RW, Ellis DG, Lipson DA, Poole AW, Levine R, Kelley ST. Effects of abiotic factors on the phylogenetic diversity of bacterial communities in acidic thermal springs. Applied and Environmental Microbiology, 2007, 73(8): 2612-2623. DOI:10.1128/AEM.02567-06 |
| [40] | Chan CS, Chan KG, Ee R, Hong KW, Urbieta MS, Donati ER, Shamsir MS, Goh KM. Effects of physiochemical factors on prokaryotic biodiversity in Malaysian circumneutral hot springs. Frontiers in Microbiology, 2017, 8: 1252. DOI:10.3389/fmicb.2017.01252 |
| [41] | Uribe-Lorío L, Brenes-Guillén L, Hernández-Ascencio W, Mora-Amador R, González G, Ramírez-Uma? a CJ, Díez B, Pedrós-Alió C. The influence of temperature and pH on bacterial community composition of microbial mats in hot springs from Costa Rica. Microbiology Open, 2019, 8(10): e893. |
