刘星, 周顺桂


福建农林大学资源与环境学院, 福建 福州 350001
收稿日期:2020-03-23;修回日期:2020-05-15;网络出版日期:2020-07-08
基金项目:国家****科学基金(41925028);国家自然科学基金(91751109)
作者简介:周顺桂, 福建农林大学资源与环境学院教授, 国家****、国家****创新领军人才。2003年获南京农业大学博士学位; 2005年北京大学博士后出站。2005-2014年在广东省生态环境与土壤研究所工作, 任副研究员、研究员、二级研究员; 2014年11月起任福建农林大学****、院长。主要从事土壤微生物电化学、有机固体废物资源化方面的研究。以第一或通讯作者发表SCI论文150余篇, SCI他引6000余次, H指数45。获授权国家发明专利60余件。曾获中国青年科技奖、光华工程科技奖、国家科技进步二等奖(排名第五)、广东省科学技术一等奖(排名第一)、广东省自然科学一等奖(第二)、广东省专利优秀奖(排名第一)、中国产学研合作创新成果奖一等奖(第一).
*通信作者:周顺桂, Tel/Fax:+86-591-86399045;E-mail:sgzhou@fafu.edu.cn.
摘要:微生物胞外呼吸是厌氧环境中控制性能量代谢方式,直接驱动着C、N、S、Fe等关键元素的生物地球化学循环。微生物纳米导线(Microbial nanowires)的发现,被认为是微生物胞外呼吸的里程碑事件,推动了电微生物学(Electromicrobiology)的形成与发展。微生物纳米导线是一类由微生物合成的,具有导电性的纤维状表面附属结构。通过细菌纳米导线,微生物胞内代谢产生的电子可以长距离输送到胞外受体或其他微生物,改变了电子传递链仅仅局限于细胞胞内的认识,从而大大拓展了微生物-胞外环境互作的范围。微生物纳米导线的良好导电性,赋予了其作为天然纳米材料的广阔应用前景。目前,微生物纳米导线的导电机制、生态功能及其在生物材料、生物能源、生物修复及人体健康多领域的应用,已经成为新兴电微生物学的前沿与热点。然而,微生物纳米导线的生物学、生态学功能尚不清楚,它的电子传递机制仍存在分歧。本文在系统性总结微生物纳米导线性质、功能的基础上,以Geobacter sulfurreducens和Shewanella oneidensis纳米导线为模型,详细阐述了纳米导线的组成与结构、表征与测量方法、导电理论(类金属导电学说与电子跃迁学说)及其潜在的应用,最后提出了未来微生物纳米导线研究的重点方向、挑战与机遇。
关键词:电活性微生物微生物纳米导线胞外电子传递胞外呼吸电微生物学
Electrical conductivity and application of microbial nanowires
Xing Liu, Shungui Zhou


College of Resources and Environment, Fujian Agriculture and Forestry University, Fuzhou 350001, Fujian Province, China
Received: 23 March 2020; Revised: 15 May 2020; Published online: 8 July 2020
*Corresponding author: Shungui Zhou, Tel/Fax:+86-591-86399045;E-mail:sgzhou@fafu.edu.cn.
Foundation item: Supported by the National Science Fund for Distinguished Young Scholars of China (41925028) and by the National Natural Science Foundation of China (91751109)
Abstract: The extracellular respiration of microbes is the key energy metabolism in the anaerobic environment, driving the global biogeochemical cycle of some key elements, like C, N, S and Fe. The discovery of microbial nanowire is a milestone in the study of extracellular respiration, which promoted the study of electromicrobiology. Microbial nanowires are conductive filaments growing on the surface of bacteria. They transfer intracellular metabolic electrons outward for the reduction of extracellular electron acceptors promoting extracellular respiration or they transfer electrons to other microbes forming syntrophic cocultures. This process broadens the knowledge on electron transfer in organism and expands the interactions between microorganism and the natural environment. Owing to the excellent conductivity, microbial nanowires have the prospect of a broad application. Studies on the conductivity, ecological functions and the applications in biomaterials, bioenergy, bioremediation and human health of microbial nanowires have been regarded as a pioneering field and the focus of research in electromicrobiology. However, the biological and ecological functions of microbial nanowires are unknown and the mechanism of electron transfer along nanowire is ambiguous. Here, we will begin by summarizing all published microbial nanowires and their reported characteristics and functions. Two representatives of Geobacter sulfurreducnes and Shewanella oneidensis are included to introduce the composition and structure of their microbial nanowires. Furthermore, after presenting the methods and technologies used for conductivity measurement, the conductivity models of microbial nanowires (metabolic-like conductivity and electron hopping) are discussed and compared. We also suggest future studies and applications of microbial nanowires. The problems, challenges and opportunities analyses of microbial nanowire study are also provided.
Keywords: electroactive microbemicrobial nanowireextracellular electron transferextracellular respirationelectromicrobiology
微生物胞外呼吸(Microbial extracellular respiration)是指微生物将胞内代谢产生的电子传递至胞外受体(如铁锰氧化物矿物、腐殖质、电极或某些电子受体微生物等)并获取生命活动所需能量的过程。它与传统胞内呼吸最显著的区别是:胞外呼吸菌氧化电子供体产生的电子可以“穿过”非导电性的细胞膜/壁传递至胞外受体,从而影响碳氮循环、温室气体排放、污染物厌氧降解等关键生物地球化学过程。大量研究表明,胞外呼吸是厌氧环境中控制性微生物代谢途径,是铁锰氧化物异化还原、产甲烷与甲烷厌氧氧化、厌氧氨氧化、重金属脱毒转化等重要生态过程的“引擎”[1-5]。以异化铁还原为代表的胞外呼吸,被认为是远古地球最早的生命呼吸方式[6]。自1987年首株胞外呼吸菌被发现至今,已证实胞外呼吸菌广泛存在于土壤、沉积物、湿地、活性污泥、地下水等各种厌氧环境中,目前已发现的胞外呼吸菌主要分布于细菌域的8个门和古菌域的7个目中,其中地杆菌属(Geobacter)和希瓦氏菌属(Shewanella)是最典型的代表菌属。
微生物纳米导线最初发现于Geobacter sulfurreducens[7]及Shewanella oneidensis[8],它是一类生长于微生物表面的、具有导电性的、长达数十微米的纤维状细丝。鞭毛、菌毛或囊泡形成的纳管等细丝状结构,是最常见的微生物附属物,但它们一般不具备导电性。只有某些特殊微生物(以胞外呼吸菌为代表)表面生长的纳米细丝才具有导电性,并在微生物生命活动中发挥独特作用:如协助微生物胞外三价铁还原[7];促进微生物燃料电池阳极产电[9-10];作为微生物保护屏障沉淀重金属及放射性元素[11-12];与产甲烷菌形成电子互营关系而协同产甲烷[13]。然而,作为新发现的导电生物结构,微生物纳米导线的导电机制、生物学意义、生态学功能尚未被充分研究。特别是,纳米导线作为新兴生物材料,其潜力才刚被认识。基于此,本文将总结过去15年来微生物纳米导线的发现与功能认知过程,并将详细阐述纳米导线研究存在的热点、难点与挑战,探讨微生物表达纳米导线对种群/群落的影响效果与生态价值,同时展望微生物纳米导线的研究机遇及潜在应用前景,期望为各研究同仁提供参考。
1 微生物纳米导线的发现 美国麻省大学阿莫斯特分校的Derek Lovley教授是微生物纳米导线的发现者。自1987年分离到第一株异化铁还原菌Geobacter metallireducens GS15,到2001年建立G. sulfurreducens首个遗传操作系统[14],Lovley教授开创了Geobacter研究的新时代。G. sulfurreducens属于严格厌氧细菌,是Geobacter研究的模式菌种,其通过代谢胞外电子受体进行呼吸。Reguera等发现,G. sulfurreducens在还原水铁矿时大量表达菌毛,并利用菌毛原位还原氧化态电子受体[7],这就暗示胞外电子受体可以从菌毛直接得到电子。Reguera等进一步利用导电原子力显微镜(Atomic Force Microscopy,AFM)测量到菌毛具有径向导电性[7]。这是学术界首次报道微生物纳米导线的导电性并发表于《自然》杂志上。随后,Gorby等报道了不仅Shewanella oneidensis,光合产氧蓝细菌Synechocystis sp. PCC6803及嗜热发酵菌Pelotomaculum thermopropionicum也可以表达导电纳米导线[8]。自此,纳米导线在Geobacter及Shewanella胞外电子传递过程中的重要作用得到越来越多的研究与报道。随着纳米导线导电性表征的新技术、新方法与新理论的发展,新的微生物纳米导线在更多微生物物种中陆续地被发现,比如可以还原三价铁的Rhodopseudomonas palustris[15]、还原硫酸盐的Desulfovibrio desulfuricans[16]、氧化二价铁的Acidithiobacillus ferrooxidans[17]都可以表达导电纳米导线。此外,混合菌生物膜中的微生物纳米导线也被发现并报道。例如,活性污泥接种的微生物燃料电池阳极生物膜以及某些坏死下颌骨表面生长的混合微生物膜中,都大量表达导电纳米导线[18]。目前已报道的天然导电纳米导线及表达菌株,请参见表 1。与此同时,人工设计并合成微生物纳米导线的研究也开始兴起。例如,Tan等通过改变菌毛蛋白中芳香族氨基酸种类,从而在G. sulfurreducens中表达出导电性超高的基因工程纳米导线[19];Liu等通过截短Pseudomonas aeruginosa菌毛蛋白基因,在非导电P. aeruginosa中表达出导电菌毛[20];Cosert等甚至利用异源表达的菌毛蛋白,实现了G. sulfurreducens纳米导线“自下而上”的体外组装[21]。
表 1. 表达微生物纳米导线的微生物菌株及其特征 Table 1. The list of microbes expressing electrically conductive nanowires
| Bacterial Strains | Description | Nanowire diameter/characteristic | Conductivity measurement | Conductivity | Reference |
| Geobacter sulfurreducens | Anaerobic, Metal reducing | 3 nm | Interdigitated microelectrode arrays, single pilus, along length | 51 mS/cm | [23] |
| Shewanella oneidensis MR-1 | Facultative anaerobic | 50–150 nm | Two electrodes, along length | 1 S/cm | [24] |
| Synechocystis sp. PCC 6803 | Photosynthetic, aerobic | 4.5–7.0 nm, type Ⅳ pili | Conductive AFM | NA* | [25] |
| Pelotomaculum thermopropionicum SI | Anaerobic, thermophilic | NA | STM | NA | [8] |
| Acidithiobacillus ferrooxidans | Chemolithoautotrophic, acidophilic iron-oxidizing | NA | Conductive AFM | NA | [17] |
| Aeromonas hydrophila | Facultative anaerobic | 10 nm | Conductive AFM | NA | [26] |
| Microcystis aeruginosa PCC 7806 | Photosynthetic, aerobic | 8.5–11.0 nm, type Ⅳ pili | Conductive AFM | NA | [25] |
| Nostoc punctiforme PCC 73120 | Photosynthetic, aerobic | 6.0–7.5 nm 20–40 nm | Conductive AFM | NA | [27] |
| Rhodopseudomonas palustris RP2 | Anoxic photosynthetic, iron-respiring | 20–40 nm | Two-electrode, along width | 35–72 μS/cm | [15] |
| Desulfovibrio desulfuricans | Anaerobic, sulfate reducing | NA | Conductive AFM, along length | 5.81 S/m | [16] |
| Flexistipes sinusarabici DSM4947 | Anaerobic, moderate halophile and moderate thermophile | NA | Conductive AFM | NA | [28] |
| Calditerrivibrio nitroreducens DSM 19672 | Thermophilic, nitrate-reducing | NA | Conductive AFM | NA | [28] |
| Desulfurivibrio alkaliphilus AHT2 | Anaerobic, haloalkaliphile | NA | Conductive AFM | NA | [28] |
| Syntrophus aciditrophicus | Anaerobic | 4 nm | Four-electrode | 3.27 μS | [29] |
| Methanospirillum hungatei | Methanogenic archaea | 10 nm | Conductive AFM | NA | [30] |
| Geobacter metallireducens GS15 | Anaerobic, iron-respiring | 3 nm | Interdigitated microelectrode arrays, single pilus, along length | 277 S/cm | [19] |
| Multispecies biofilm from BRONJ | Multispecies | 5 nm | Conductive AFM, nanofabricated gold electrodes | 0.05 S/cm | [18] |
| *NA: Not assessed. | |||||
表选项
值得指出得是,以往微生物纳米导线的研究者,往往过度强调其纳米尺寸效应而忽视其最重要的导电特性,从而导致“纳米导线”被滥用。微生物纳米导线作为一种全新的生物结构,在微生物胞外呼吸代谢过程中具有电子传递作用并显著改变周围微环境的电子供给状态。为突出微生物纳米导线卓越的电子传递性能,Lovley教授提议使用“导电菌毛(e-pili)”来代替“微生物纳米导线”[22]。
2 微生物纳米导线的性质与生物学功能 图 1选择性列举了几种微生物纳米线形貌与表达菌种。G. sulfurreducens可以表达两种形式的纳米导线:四型菌毛和OmcS纳米导线。由于这两种形式的纳米导线具有相似的尺寸,所以形貌上往往难以区分。早期研究一直认为G. sulfurreducens纳米导线是四型菌毛[7],直到最近Wang等在Cell发表论文,通过冷冻电镜观察发现细胞色素OmcS聚合也可以形成导电的纳米导线[31]。纳米导线可以促进G. sulfurreducens吸附在固体表面,并且可以作为生物膜支架促进阳极生物膜的形成[32]。此外,因具有导电能力,G. sulfurreducens纳米导线可以通过导出胞内电子加速胞外难溶性电子受体(如铁矿、锰矿、固体电极等)的还原[7, 9, 33]。同时,它可以用于厌氧条件下重金属及放射性元素的还原脱毒,研究表明这可能也是G. sulfurreducens应对环境胁迫的适应机制[12]。另外,Geobacter纳米导线可以介导微生物种间直接电子传递[34]。例如,产甲烷菌一般被认为只能利用简单的有机物(如甲酸、乙酸等)为电子供体产生甲烷,而最近发现Methanosarcina barkeri和Methanosaeta harundinacea也可以直接接收来自Geobacter纳米导线传导的电子用以还原CO2产生甲烷[13, 35]。纳米导线也可以直接介导G. metallireducens与G. sulfurreducens间的种间直接电子传递[34, 36]。然而,我们最近的研究发现Geobacter种间直接电子传递不依赖纳米导线,而是通过胞外细胞色素C完成[37]。此外,Pelotomaculum thermopropionicum与Methanothermobacter thermautotrophicus同样可以形成电子互营关系。其中,P. thermopropionicum可以表达连接两种细菌的导电纳米导线(鞭毛)[8]。同样,在该互营群落中导电鞭毛似乎并没有直接参与种间电子传递(实际上利用H2传递电子)。研究发现鞭毛端部的帽蛋白(FilD)可以促进两菌种间交流与代谢协助,形成紧密的接触从而实现依赖H2的互营群落[38]。相似的,Geobacter也可以表达鞭毛,虽然不具有导电性但依然可以促进微生物燃料电池阳极产电[39]。因此,纳米导线在种间直接电子互营微生物群落中的生物学意义值得进一步研究。
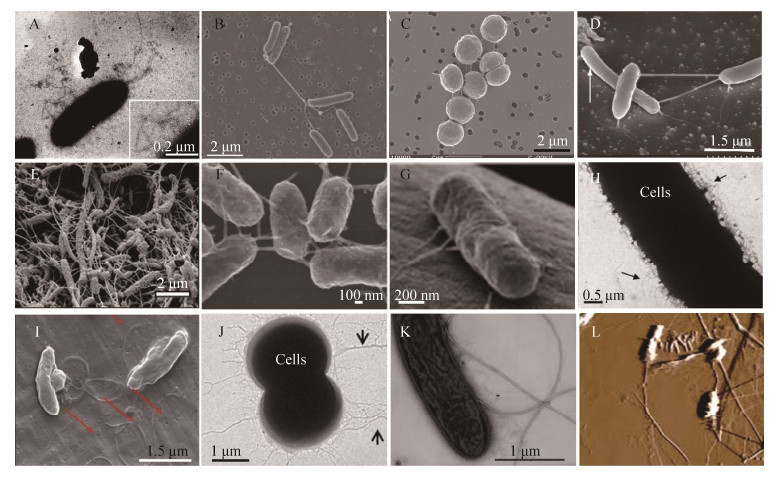 |
| 图 1 各种微生物表达的导电纳米导线 Figure 1 Nanowires from different microbes. A: G. sulfurreducens PCA[7]; B: S. oneidensis MR-1[8]; C: Synechocystis sp. PCC 6803[8]; D: Pe. thermopropionicum[8]; E: Multispecies biofilm observed in bisphosphonate-related osteonecrosis of the jaw[18]; F: Aer. hydrophila[26]; G: D. desulfuricans[16]; H: No. punctiforme PCC 73120[27]; I: R. palustris RP2[15]; J: Mi. aeruginosa PCC 7806[25]; K: G. metallireducens GS15[41]; L: M. hungatei[30]. |
| 图选项 |
Syntrophus aciditrophicus的菌毛属于四型菌毛。最近,Walker等在G. sulfurreducens中异源表达并组装了S. aciditrophicus菌毛,证实了其具有导电性[29]。他们用同样的方法,证实了Flexistipes sinusarabici、Calditerrivibrio nitroreducens、Desulfurivibrio alkaliphilus等菌株的菌毛同样具有导电性,并认为菌毛导电性源自菌毛蛋白中密集分布的芳香族氨基酸残基(占比 > 9%,间距 < 35个氨基酸)[28]。S. aciditrophicus与产甲烷菌通过纳米导线紧密相连。一般认为它们之间通过种间H2或者甲酸传递实现互营产甲烷[40]。最近研究发现S. aciditrophicus纳米导线可以直接传递电子,与产甲烷菌形成直接电子互营[29]。
Acidithiobacillus ferrooxidans与Synechocystis sp. PCC6803的纳米导线也属于四型菌毛。Aci. ferrooxidans菌毛组成成分尚不清楚,可能由PilV和PilW蛋白共同组成。其除了具有辅助细菌运动、粘附功能外,还可以直接传递胞外Fe(Ⅱ)氧化产生的电子[17]。Synechocystis sp.在碳源受限的环境中表达主要由PilA1蛋白组成的纳米导线。Synechocystis sp.纳米导线也依赖芳香族氨基酸实现电子传递[25]。
近期研究发现,Shewanella oneidensis可以表达多种纳米导线,其中由囊泡组成的纳管被研究的最充分,纳管富含细胞色素C,与细胞的周质空间连通[42-43]。另外,Aeromonas hydrophila、Rhodopseudomonas palustris、Desulfovibrio desulfuricans、Nostoc punctiforme都可以表达类似菌毛的纳米导线,但是它们的组成成分目前还不清楚。其中R. palustris纳米导线成束存在[15],而No. punctiforme被鉴定出两种不同尺寸的纳米导线(一种约6.0–7.5 nm粗、0.5–2.0 μm长,另一种约20–40 nm粗、长度大于10 μm)[27]。Aer. hydrophila纳米导线不仅可以传递电子,而且可能具有信号传导作用[26]。R. palustris与D. desulfuricans只在代谢胞外难溶性电子受体的情况下表达纳米导线,这暗示R. palustris和D. desulfuricans纳米导线与G. sulfurreducens纳米导线具有相似的胞外电子传递功能。No. punctiforme纳米导线也被认为具有协助胞外电子传递的作用。Microcystis aeruginosa的纳米导线由蛋白组成但其结构尚不清楚,可能是由两根纳米导线平行排列成的间隙0.5–1.0 nm的簇状纤维结构或者中空管状结构[25]。
最近研究发现古菌也可以表达纳米导线。Methanospirillum hungatei表达的古菌菌毛(Archaellum)也具有导电性并且其导电能力源于其所含的苯丙氨酸残基[30]。具有导电能力的Archaellum的发现,暗示除运动、粘附功能以外,Archaellum可能直接接受胞外电子还原CO2产甲烷。
以往研究中一个普遍的现象是:混菌形成的微生物燃料电池阳极生物膜里往往出现大量的纳米网状细丝连接微生物群落。这些纳米导线组成的网状结构,被认为可以促进微生物代谢阳极[44]。但是,目前只有尺寸上的表征,没有直接的导电性测量数据可以将之归于微生物纳米导线范畴。一个例外的情况是某些坏死下颌骨表面微生物被膜中纳米导线。2013年,Wanger等采用导电AFM证明了这些成分未知的纳米导线确实具有导电性,并初步证明这些纳米导线可能参与了致病微生物群落的稳定性维持、内部信息交流以及致病性产生[18]。最近研究也发现,人体肠道微生物也可能表达导电纳米导线并参与肠道微生物种间及微生物与人体细胞间传递电子。这些研究为理解微生物纳米导线与人体健康的关系,开启了一个全新的视角[45-46]。
3 微生物纳米导线的表征与导电性测量 传统无机纳米材料分析、导电性测量方法被广泛用于微生物纳米导线的表征。相较于无机纳米材料,微生物生长培养基成分复杂、微生物分泌复杂的胞外成分、纳米导线本身可能存在修饰、微生物趋向成膜或聚集生长等因素,都会导致微生物纳米导线的导电性测量难度加大。目前大部分纳米导线都是原位表征,但是为了测量数据的可比性及最终应用,纳米导线的富集、纯化非常重要。在此,将以G. sulfurreducens为代表阐述纳米导线纯化、形貌表征及导电性测量步骤。
3.1 G.sulfurreducens纳米导线的纯化 研究发现,以富马酸为电子受体的G. sulfurreducens需要在亚适温度(25 ℃)或者在电子受体缺乏的情况下,才表达纳米导线(菌毛)[47]。然而,我们发现在该条件下纯化的菌毛无论产率还是纯度都不够稳定。这可能是由于四型菌毛的表达与回收是一个动态的过程[48]。菌毛一般于对数末期或者稳定期前期表达,早于或晚于该生长阶段收集纯化,都可能收集不到菌毛。但是,以电极作为电子受体时G. sulfurreducens可以稳定地表达大量菌毛。我们发现连续流模式下运行的微生物燃料电池,形成的生物膜中具有大量的菌毛[39, 49]。当G. sulfurreducens阳极产电达到最高值时,收集阳极生物膜并悬浮到150 mol/L乙醇胺中(pH=10.5)。使用涡旋振荡器剧烈振荡90 s促进菌毛从细菌表面脱落然后重复离心2次(13000×g,4 ℃,20 min)以分离菌体与细胞碎片。收集上清液,然后加入终浓度10%的硫酸铵,室温静置沉淀菌毛(至少30 min)。之后离心(13000×g,4 ℃,60 min),收集沉淀。使用150 mmol/L乙醇胺(pH=10.5)再次悬浮沉淀然后离心(23000×g,4 ℃,60 min),收集上清。这步可以进一步除去细胞碎片与杂蛋白。再次加入终浓度10%的硫酸铵,室温静置沉淀菌毛(至少30 min)。最后离心(13000×g,4 ℃,60 min)。沉淀即为纯化的菌毛。由于使用了硫酸铵,最后收集的菌毛沉淀中将含有大量的盐离子,可以通过使用超纯水或者Tris溶液洗涤(> 20000×g,30 min,4 ℃)去除。文献[19]中一般最终使用150 mmol/L乙醇胺悬浮菌毛沉淀,而我们发现,直接使用超纯水悬浮不但可以避免因引入杂质离子而干扰下游测试,而且可以避免菌毛聚集成簇[19]。
3.2 纳米导线的表征与导电性测量 大部分微生物纳米导线的直径只有几纳米,扫描电子显微镜(scanning electron microscope,SEM)、透射电子显微镜(transmission electron microscope,TEM)及原子力显微镜(AFM)可用于纳米导线的形貌表征。基于荧光染料显色的荧光显微镜或者激光共聚焦显微镜,也被用于Shewanella纳米导线的观察。需要注意的是,扫描电镜制样复杂,固定、脱水过程易导致胞外多糖类物质皱缩,形成类纳米导线的纤维结构,从而导致对最终结果的误判[50]。透射电镜观察时,虽然可以将细菌直接滴加到铜网上进行观察但是由于纳米导线的低电子密度属性与纳米尺度,研究者往往需要通过负染来增强其电子成像能力。然而,负染的强弱将最终影响纳米导线的成像质量。使用AFM观察的样品,需要投加到表面平整的基底上,一般选用高定向裂解石墨。AFM观察时要求的纳米导线样品纯度高,以防盐离子的结晶、杂蛋白与膜囊泡、胞外聚合物的残留污染针尖与干扰纳米导线的成像。合适的取样时间、增加清洗步骤可有效地降低杂质的污染。由于AFM扫描的范围非常小,提高样品纯度与浓度对于快速定位样品非常有帮助。此外,静电力显微镜可以用来观察电子在纳米导线中的迁移[51]。同步X射线微衍射与摇摆曲线X射线衍射也已被用于分析纳米导线的晶体结构[52]。微纳加工技术与平台的发展,将使得研究者可以随意设计微电极/电极阵列,从而实现对纳米导线进行电学性质的表征。
微生物纳米导线导电能力的测量,主要分为径向与轴向电阻率的测量。径向测量相对简单,但需要有一个表面平整并导电的基底(高定向裂解石墨被广泛使用)。目前导电AFM被广泛用于纳米导线径向导电能力的测量。实际测量时,通过在导电针尖与基底间施加一个小的电压并测量电流响应来计算纳米导线的电阻率。由于导电AFM主要测量的是单点的电阻率,实际测量值要注意避免杂质(比如细胞色素C)的影响。此外,扫描隧道显微镜(Scanning Tunneling Microscope,STM)也可以同时实现纳米导线的成像与径向导电性的定性表征。
纳米导线的轴向导电性测量,一般需要采用纳米微电极/电极阵列,可以在细菌表面原位测量,也可以纯化完之后再测。原位测量虽然可以免去纯化纳米导线的繁琐步骤,但是实际操作中对研究者技术水平要求极高。原位测量首先需要在不导电的基底(一般用二氧化硅片)上修饰导电的微纳电极(图 2-A),然后需要确保纳米导线与电极接触完好[24]。可以设想,恰好能找到一根与电极接触的纳米导线,将是一项非常耗时而且需要运气的工作。通过增加微电极密度,比如制作微电极阵列(图 2-B)或者网格(图 2-C),可显著增加纳米导线与电极接触的概率。利用微机电系统的微纳加工技术,可以在纳米导线上定向沉积导电材料连接纳米导线与微电极[24]。当纳米导线的一端接触微电极后,通过导电AFM针尖在纳米导线的另一端施加一个微小的电压,测量电流大小以计算纳米导线轴向电子传递阻力。对于已经纯化的纳米导线,可以直接使用微电极阵列进行电阻率测量[23]。虽然双电极体系也被用于纳米导线电阻的测量,但四电极测量体系的测量结果更准确而被广泛地使用[53-54]。
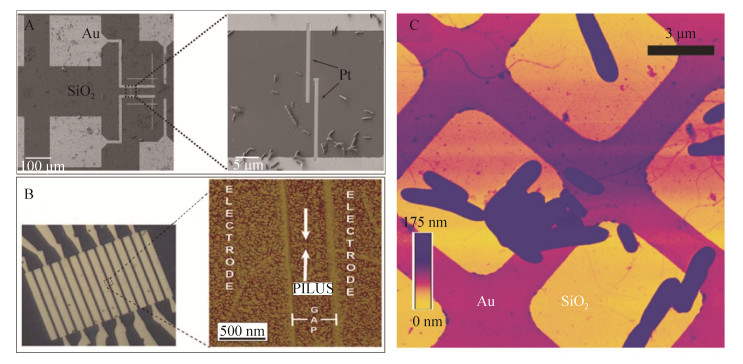 |
| 图 2 纳米导线导电性测量方法 Figure 2 Representative methods used for nanowire conductivity measurement. A: Nanofabricated Pt electrode connects Au electrode with nanowire[24]; B: The array of cross finger Au electrodes[23]; C: Au microgrids electrode deposited on SiO2/Si substrate[24]. |
| 图选项 |
4 微生物纳米导线的导电机制 自发现之日起,微生物纳米导线的导电性就备受争议。随着先进导电性测量方法的采用以及微纳加工技术的引入,学术界逐渐接受微生物纳米导线这种天然生物结构确实具有导电性。然而,尽管越来越多的导电微生物纳米导线被发现,但其电子传输机制仍未形成定论。以G. sulfurreducens和S. oneidensis纳米导线为代表的微生物纳米导线电子传输机制的研究,促进了微生物纳米导线导电理论的形成。
4.1 G.sulfurreducens纳米导线
4.1.1 分子组成与结构:: G. sulfurreducens导电纳米导线的研究,主要集中于菌株PCA和KN400。G. sulfurreducens表面可以表达多种类型的菌毛,而导电菌毛只属于四型菌毛[7, 55]。研究发现G. sulfurreducens导电菌毛主要由单一的菌毛蛋白单体(PilA)构成[49],并且其表面存在糖基化修饰[56]。这种修饰不但可以促进菌毛的表面粘附,有助于生物膜的形成与胞外难溶性电子受体的代谢,而且可以通过提供绝缘的表面协助菌毛在溶液中传递电子[57]。PilA的编码基因是GSU1496,它编码形成N端带前导肽序列的菌毛蛋白前体蛋白,内膜上的多肽酶PilD识别前导肽中的保守甘氨酸与苯丙氨酸位点并完成剪切,最终形成成熟的PilA。Richter等认为,GSU1496会转录形成两种不同长度的mRNA,并最终表达形成两种具有不同长度前导肽序列的菌毛蛋白前体蛋白[58]。虽然这两种前体蛋白最终都将被剪切形成单一长度的PilA,但是Richter等认为不同来源的PilA(长型菌毛蛋白与短型菌毛蛋白)的功能却并不相同。其中,短型菌毛蛋白主要位于胞内,其作用是协助胞外细胞色素C的分泌与维持长型菌毛蛋白的稳定,而长型菌毛蛋白是菌毛结构的主体,它直接影响细菌表面的吸附与胞外电子受体的还原[58]。然而,通过分析Richter使用的突变株,我们发现其所使用的突变策略会严重影响PilA的转录,从而导致不同突变产生不同表型的假象。我们的结果表明PilA事实上只有一种形式的前体蛋白[59]。这一发现为后续在G. sulfurreducens中表达各种异源菌毛蛋白提供了技术支撑[19, 29, 60]。
PilA氨基端含有大片段的疏水结构,导致PilA的纯化、结晶迄今尚未成功。尽管目前尚无PilA晶体结构的报道,但是Reardon等率先采用核磁共振波谱法(Nuclear Magnetic Resonance Spectroscopy,NMR)解析了表面活性剂存在下PilA的结构[61]。与传统四型菌毛蛋白(如绿脓杆菌或淋球菌菌毛蛋白)相比,G. sulfurreducens的PilA具有显著的截短结构,即C端不含由多个β折叠形成的球形结构而仅有一小段无规则结构的多肽链。相应地,G. sulfurreducens PilA呈现出α螺旋结构(图 3-A)。其中N端(α1-N)是疏水的保守区域并包埋于磷脂双分子层中。菌毛蛋白组装时,PilA的α1-N通过疏水作用组装形成菌毛。由于缺少传统菌毛蛋白所拥有的C端球形结构的包裹,PilA的α螺旋C端(α1-C)将裸露在环境中。我们最近的研究发现,在α1-C空间结构中疏水氨基酸会聚集排布在同一个表面[49]。这意味着如果α1-C裸露在水相中将被水分子攻击从而不能稳定地存在。我们同时发现,位于GSU1496下游的GSU1497基因(spC)可以编码形成Spc蛋白,它通过自组装成三聚体(即PilA伴侣蛋白)通过静电力与PilA相互作用以维持PilA的稳定[49]。
 |
| 图 3 G. sulfurreducens纳米导线与电子传递模型 Figure 3 The structure of G. sulfurreducens nanowire and models of electron transfer along nanowire. A: The 3D structure of type Ⅳ PilA from Neisseria gonorrhoeae GC (Left)[68] and G. sulfurreducens (Right)[61]. Aromatic rings were colored in blue. B: Electron microscope image of immunogold-labelled OmcS along G. sulfurreducens pili[69]. C: Proposed electron transfer models for G. sulfurreducens pili. C1: Electrons hopping among cytochromes on pili[70]. C2: The model of "stepping stones"[71]. Electrons were transferred among discrete aromatic rings which was facilitated by c-type cytochromes. C3: Calculated low energy atomic model[67]. Aromatic rings were colored in orange, which formed a continuous electron transfer path along pili. C4: Calculated model by molecular dynamics simulations (tyrosines, yellow; phenyalanines, green)[72]. Aromatic rings were clustered in pili. |
| 图选项 |
G. sulfurreducens导电菌毛直径只有3–5 nm,直接解析其三维结构充满挑战。目前尚无G. sulfurreducens菌毛三维结构的报道,这就直接限制了对于PilA如何在导电菌毛中排列的认知,导致多种菌毛导电机制学派的形成。特别有趣的是,Wang等利用冷冻电镜解析导电菌毛的三维结构,却意外发现了OmcS纳米导线[31]。OmcS纳米导线是由细胞色素OmcS首尾相连形成的具有导电性的纤维状结构,它的直径与导电菌毛相当。每个OmcS含有6个血红素。在OmcS纳米导线中血红素分子连续排列,彼此间距3.5–6 ? ,构成电子传递的通路。Wang等认为,OmcS纳米导线是G. sulfurreducens表面存在的唯一导电结构,PilA不能组装形成菌毛,其作用在于协助OmcS分泌。然而,目前大量而充分的证据表明PilA确实可以组装形成菌毛:(1)使用组氨酸标签标记PilA后G. sulfurreducens表面的纳米导线,可以被抗组氨酸单克隆抗体特异识别[62];(2)克隆PilA编码基因到E. coli菌株,可在E. coli中表达菌毛[63];(3)纯化的PilA可在体外自组装形成导电纳米导线[21]。Lovely认为Wang等仅检测到OmcS纳米导线,是由于使用了特殊菌株及微生物培养条件差异造成的实验误差[47]。最新的冷冻电镜结果表明,G. sulfurreducens表面可以同时存在菌毛及OmcS纳米导线[64]。总之,多数研究者更倾向于认为,G. sulfurreducens可以表达多种纳米导线[47, 54, 64]。
4.1.2 类金属导电性假说:: 2005年Reguera等首次利用导电原子力显微镜测量到G. sulfurreducens菌毛具有径向导电性,并提出导电菌毛假说[7]。2011年Malvankar又首次测量到G. sulfurreducens菌毛具有轴向导电能力,并进一步提出类金属导电性假说[53]。支持该假说论据包括:(1)通过四电极体系测量到菌毛导电率高达6 μs/cm;(2)菌毛的导电性随温度变化的响应与导电有机金属相似,即导电性随着温度降低而升高,但降到T≈260–270 K时进一步降低温度其导电性则降低;(3)降低pH可以实现菌毛的质子掺杂从而提高导电性。然而,此时Malvankar并不知道菌毛轴向导电的电子载体是什么,他猜测组成菌毛的PilA中的芳香族氨基酸的芳香环侧链可以通过彼此堆叠形成电子传递通道。为证明这种猜测,2013年Vargas通过定点突变,将PilA羧基端5个芳香族氨基酸替换成不含芳香环侧链的丙氨酸[65],结果发现缺乏芳香环的PilA组装的菌毛不具有导电性。这就直接证明了芳香环参与了菌毛中的电子传递,尽管随后有人怀疑这种氨基酸替换方式很可能会影响PilA的组装进而影响导电性[66]。由于缺乏菌毛蛋白组装数据,芳香环在导电菌毛中的分布尚不清楚。通过芳香族氨基酸的芳香环彼此堆叠形成导电通路,要求芳香环彼此间距离不能超过4 ? 。同步X射线微衍射与摇摆曲线X射线衍射分析发现菌毛中存在周期性的3.2? 的间隔,而该周期性间隔在缺乏芳香环的菌毛中不存在[52],这进一步表明导电菌毛中芳香环可以彼此堆叠并构成电子传递通路。此外,以P. aeruginosa菌毛结构为模板拟合的G. sulfurreducens菌毛模型[52]和基于PilA组装过程能量最低原理计算的菌毛蛋白组装模型(图 3-C3),都指示菌毛中PilA的芳香环连续堆叠排列[67]。
需要注意的是,在上述研究中,G. sulfurreducens菌毛导电性测试都是在离体干燥条件下进行的,而这种处理可能并不能真实反映实际水溶液体系中菌毛的导电能力。基于这种担忧,Ing等使用插指电极结合电化学方法测量了水溶液中菌毛的导电性[57],结果也证明G. sulfurreducens菌毛具有类金属导电性。此外,Malvanlar等利用静电力显微技术通过AFM针尖将电子直接注入G. sulfurreducens原位生长的菌毛的一端并观察到电子沿菌毛的迅速传递,也进一步为菌毛具有类金属导电性提供了实验证据[51]。
4.1.3 电子跃迁假说:: 电子跃迁传递假说是指菌毛的导电性源自其表面电化学活性分子的电子跃迁传递。按照电化学活性分子的种类,可以分成三种跃迁形式:基于菌毛表面细胞色素C的电子跃迁;基于菌毛中不连续存在的芳香环簇间的电子跃迁;以及细胞色素C与芳香环共同协助的电子跃迁。
基于菌毛表面细胞色素的电子跃迁理论主要源自于G. sulfurreducens导电生物膜的电子传递机制分析。电化学分析表明在G. sulfurreducens阳极生物膜中电子跨膜传递速率受膜内部电化学势梯度影响,并呈现扩散控制行为[73]。Strycharz-Glaven等利用氧化还原聚合物电子传递理论,很好地解释了导电生物膜中的电子传递行为,他认为菌毛只是作为惰性支架,是表面的电活性分子介导了电子沿菌毛的跃迁传递(图 3-C1)[74]。2010年Leang等证实细胞色素C—OmcS结合于菌毛的表面(图 3-B)[69]。基于此,Strycharz-Glaven猜测电活性分子就是OmcS。然而,主张类金属导电理论的Malvanlar认为,菌毛表面OmcS间距离(> 100 nm)远远大于可以发生电子跃迁行为的最大分子间距[75]。事实上,大部分G. sulfurreducens菌毛表面并没有结合OmcS[69]。考虑到OmcS可以组装形成导电纳米线,“电子跃迁理论”似乎实际上描述了生物膜中OmcS纳米导线的电子传递。需要特别说明的是,突变OmcS并不会影响细菌代谢阳极和生物膜导电性[75-76]。Wang等认为可能存在更多种类的细胞色素C纳米线[31]。考虑到Strycharz- Glaven并没有实际测量菌毛的导电性,导电菌毛的“电子跃迁理论”缺乏实验基础。尽管如此,基于菌毛表面细胞色素C的电子跃迁理论,很好地解释了电活性生物膜中电子的传递行为[73]。
G. sulfurreducens菌毛类金属导电模型认为,菌毛中的芳香族氨基酸残基上的芳香环彼此紧密堆叠。而在Feliciano基于分子动力学模拟计算得到的液相G. sulfurreducens菌毛三维模型中(图 3-C4),芳香环彼此间呈现出一种错位排列,并且芳香环间的距离分布并不均匀,一部分芳香环聚集成簇(3.5–5? 间隔)而簇与簇间的距离达到8.5? [72]。基于此,Feliciano提出了依赖不连续芳香环簇的菌毛电子跃传递模型。该模型与实验数据都表明,菌毛的导电能力不只取决于芳香环,而且受到带负电荷的氨基酸的影响。此外,支持该模型证据还包括:(1) Veazey等使用STM观察到G. sulfurreducens菌毛导电行为具有不对称性[77];(2) Lampa-Pastirk甚至观察到了菌毛在热激活条件下的电子跃迁传递行为[78]。
PilA具有协助OmcS与OmcZ分泌的作用[12, 79]。OmcS结合于菌毛的表面,它可以传递菌毛中的电子用于还原水铁矿或者连接菌毛与细菌表面细胞色素C (如OmcB)间的电子传递,而OmcZ可以协助菌毛利用阳极[80],突变OmcS与OmcZ都会影响G. sulfurreducens胞外电子传递[81]。这些证据表明,基于菌毛的胞外电子传递需要胞外细胞色素C的参与。Bonanni基于这些实验结论及结合以Neisserua gonorrhoeae GC菌毛三维结构为模板拟合得到的G. sulfurreducens菌毛蛋白组装模型,提出了菌毛电子传递的“stepping stones”模型(图 3-C2)[71]。该模型认为:(1)菌毛中芳香族氨基酸会成簇聚集并周期性分布,而簇与簇间距离长达15–21 ? ;(2)电子不能通过跃迁的方式在簇间传递但可以依赖菌毛表面结合的细胞色素C实现芳香环簇间电子传递的中继。需要指出的是,Bonanni的“stepping stones”模型也缺乏菌毛导电性测量的实际证据,他本人也承认,目前已知的细胞色素OmcS在菌毛表面分布的距离与频率远远不能满足其作为“stepping stones”的要求[71]。此外,直接显微观察菌毛也检测不到菌毛表面富含细胞色素C[69]。
除了基于细胞色素C的菌毛电子传递假说,其他两种菌毛电子传递假说都强调了PilA中芳香族氨基酸的重要性。在四型菌毛进化中,G. sulfurreducens导电菌毛蛋白代表了一类独特的、独立进化形成的、具有截短结构的四型菌毛蛋白[82-83]。该结构被认为在PilA组装过程中可以有效避免空间位阻效应并利于组装中形成紧密的菌毛结构,从而有助于芳香族氨基酸芳香环的堆叠[53]。然而,我们最近的研究发现,即使恢复G. sulfurreducens PilA“冗余”的C端球型结构域,也不会影响菌毛的导电性[54];G. sulfurreducens菌毛蛋白的进化动力,可能源自呼吸环境中氧化铁的代谢压力[54]。事实上,已有研究表明相较于PilA的结构,PilA中芳香环的密度对导电性的影响更显著[28]。
4.2 S.oneidensis纳米导线
4.2.1 组成与结构:: 2006年,Gorby等率先使用扫描隧道显微镜证明S. oneidensis可以表达导电纳米导线,从而开启S. oneidensis纳米导线研究的序幕[8]。与G. sulfurreducens相似,S. oneidensis也可以表达多种形式的“纳米导线”。研究发现,S. oneidensis可以表达两种形式的四型菌毛:msh和pil。其中pil菌毛(主要由菌毛蛋白PilBac1组成)被认为可以通过依赖芳香族氨基酸间电子跃迁的方式传递电子[84]。然而,抑制该菌毛的表达却促进S. oneidensis代谢阳极[85]。这暗示pil菌毛可能并不具有传递电子的能力。Fitzgerald等验证了Msh菌毛(主要由菌毛蛋白mshA组成)协助S. oneidensis胞外电子传递的能力[86]。结果发现抑制Msh菌毛组成蛋白(MshA-D)表达,仅部分影响S. oneidensis代谢阳极(产电降低20%),但若抑制整个Msh菌毛生物合成系统(MshH-Q)将严重抑制S. oneidensis阳极产电。因此,Msh菌毛生物合成系统及其作用蛋白参与了S. oneidensis胞外电子传递。目前,尚无Msh菌毛纯化与导电性测量的报道,Msh菌毛实际是否导电尚为未知。2010年,EI-Naggar等使用导电AFM结合纳米电极测量到单根S. oneidensis“菌毛”具有轴向导电性,并且证明菌毛导电性与细胞色素C—MtrC和OmcA相关[24]。在随后的工作中,他们发现S. oneidensis外膜与周质空间可以向外延伸形成富含MtrC和OmcA的膜囊泡纳管,并认为这种膜囊泡纳管才是实际上的S. oneidensis纳米导线[43](图 4)。需要说明的是,EI-Naggar并没有测量到这种膜囊泡纳管的轴向电子传递能力及导电性。有趣的是,我们最近发现G. sulfurreducens也可以大量分泌膜囊泡并可以组装形成纳管[87]。它们具有协助G. sulfurreducens胞外电子传递的能力,这暗示G. sulfurreducens囊泡纳管可能是另一种形式的导电纳米线[87]。
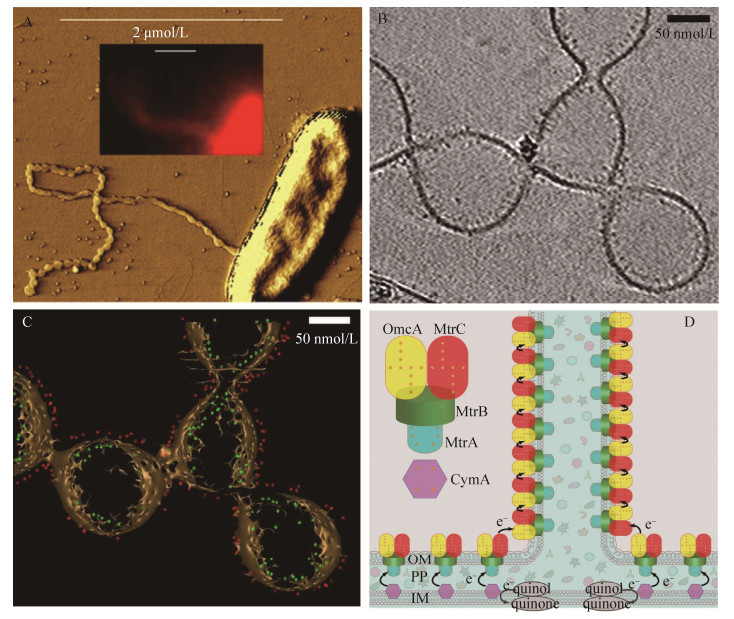 |
| 图 4 S. oneidensis纳米导线与电子传递模型 Figure 4 The nanowire of S. oneidensis and the model of electron transfer along nanowire. A: AFM[43]; B: Electron cryotomography[42]; C: The distribution of c-type cytochromes in nanowire[42]. The red and green dots represent MtrC and MtrA, respectively; D: Electrons are hopping among cytochromes to transfer in nanowire[43]. |
| 图选项 |
4.2.2 电子跃迁传递假说:: 基于理论计算与实际测量结果,Pirbadian等提出S. oneidensis纳米导线导电性源于纳米线上紧密排列(< 0.7 nm)的细胞色素C[88]。在EI-Naggar等于PNAS上发表了一系列关于膜囊泡纳管参与S. oneidensis胞外电子传递的报道后,学术界开始相信,S. oneidensis的导电纳米导线是富含细胞色素C的囊泡纳管,而且电子是通过纳管膜上的细胞色素C以跃迁的方式传递。然而,囊泡纳管膜上的细胞色素C密度与间距并不能支撑有效的电子跃迁[89]。EI-Naggar等认为,膜囊泡纳管中的细胞色素C是纳米导线中电子传递的载体,电子通过跃迁的方式在纳管膜上的细胞色素C间传递,该过程需要可以自由扩散的细胞色素C或者电子中介体协助[42](图 4-D)。值得注意的是,所有S. oneidensis纳米导线导电性测量都是在离体、干燥的条件下,这种处理可能导致纳米导线结构的收缩从而拉近细胞色素C彼此的间距,进而获得导电性[90-91]。因此,S. oneidensis纳米导线尚缺原位导电性测量证据。最近,基于S. oneidensis单根纳米导线在不同湿度条件下的阻抗谱数据测量与分析,Grebenko等发现离子导电也促进了纳米导线的导电[92]。
有趣的是,最初Reguera等(2005)发现S. oneidensis的“菌毛”不具有导电能力[7]。这可能是由于实验条件的差异或者Reguera实际测量的是S. oneidensis表面其他种类的“菌毛”。同样,G. sulfurreducens也可以表达与导电菌毛形貌一样的非导电菌毛。事实上,导电菌毛的表达确实受到外界条件的影响。在G. sulfurreuducens导电菌毛电子传递机理研究中,经常由于实验条件的差异导致数据的不一致性与不可比性。因此,构建一种可以表达、纯化并测量菌毛导电性的统一标准,显得尤为重要。我们已经成功构建了一种在G. sulfurreducens中表达并组装异源菌毛蛋白的地杆菌异源菌毛蛋白表达系统[59],该系统已经广泛用于不同来源菌毛的表达、筛选及导电性的比较[19, 60]。总的来说,不同学派对于G. sulfurreducens菌毛导电机理的争论,将最终促进微生物纳米导线导电理论的成熟并有利于它的实际应用。
5 微生物纳米导线的应用 5.1 生物能源 微生物燃料电池(Microbial Fuel Cell,MFC)是可以收集微生物胞外呼吸代谢产生的电子,从而实现电能输出的装置。事实上,微生物要实现胞外电子传递并不容易。细胞内代谢产生的电子需要穿过非导电的细胞内膜、外膜,跨越细胞壁,甚至要跨过多层细胞才能最终到达电极表面。纳米导线可以长距离传递电子,协助并促进胞外电子传递。因此Leang等率先做了尝试[93]:通过敲除基因GSU1240促进了G. sulfurreducens导电菌毛的表达,将MFC功率密度提高了70%。与地杆菌相比,E. coli具有底物范围广、易于培养等优点,但E. coli产电能力非常弱。因此,研究者期望在E. coli里面表达Shewanella外膜细胞色素C复合体来促进E. coli胞外电子传递,目前已取得有益效果[94-95]。然而,细胞色素C介导的胞外电子传递需要细菌与电极直接接触。考虑到电极面积毕竟有限,该策略限制了生物改造的E. coli产电效率的大幅度提高。因此,在E. coli中表达导电纳米导线,是值得尝试的一种手段。
微生物电合成是利用微生物可以直接吸收电极释放的电子,来还原CO2产生高附加值有机物的方法。利用太阳能电池为微生物电合成提供电源具有巨大的应用潜力,但目前电合成微生物电子利用率低,极大地限制了其发展。促进电合成微生物阴极成膜与电子吸收效率可以促进微生物电合成。诱导电合成微生物表达纳米导线,将有助于阴极成膜以及电子吸收从而大幅提高电合成效率。
产甲烷古菌能直接利用的碳源及电子供体有限,仅包括少数一碳、二碳有机物及氢气。Geobacter可通过纳米导线直接传递电子给产甲烷菌,从而实现协同产甲烷。这相当于扩大了产甲烷菌的底物范围,而且比基于H2的种间互营产甲烷更为有效[96]。基于种间直接电子传递的种间互营产甲烷,广泛存在于厌氧发酵产甲烷发酵系统中,投加导电物质(生物炭[97-98]、磁铁矿[99-100])可以显著加速种间直接电子传递从而促进甲烷的产生。另外,通过诱导纳米导线的表达来促进厌氧产甲烷,可以是未来优选策略。
微生物电发酵是通过电极影响微生物胞内氧化还原平衡进而调控微生物代谢[101]。微生物-电极界面电子交换效率是微生物电发酵的限制因素。一般来说,微生物电发酵需要采用电子介体,但是,电子介体的添加会影响终产物的纯度并增加生产成本[102]。因此,在电发酵微生物中表达导电纳米导线以实现微生物与电极的直接电子交换,将是一种增强微生物电发酵效率的手段(图 5)。
 |
| 图 5 微生物纳米导线的应用 Figure 5 The applications of microbial nanowires. |
| 图选项 |
5.2 生物修复 表达纳米导线是地杆菌适应环境胁迫(包括重金属毒害、营养物缺乏等)的一种生存策略。例如,地杆菌纳米导线不但可以催化重金属的还原沉淀,而且可作为细胞屏障阻止毒性重金属对细胞的侵袭。据报道,G. sulfurreducens纳米导线通过还原可溶性六价铀,生成难溶性四价铀并沉积于纳米导线表面,从而实现铀的富集与固定[12],该过程已经被规模化地应用于铀矿污染地下水的原位修复。研究发现,通过补加乙酸可显著促进Geobacter生长并提高铀污染水体修复效率[103]。此外,Synechocystis的纳米导线可以沉积砷、铬等重金属元素[104],从而可用于重金属污染土壤修复。
5.3 生物材料与生物传感 微生物纳米导线具有优良的电子传递能力与一定的机械强度,可用于构建新型的生物电子器件,代表着未来绿色无污染新材料的发展方向。Sun等率先制备了G. sulfurreducens的纳米导线与聚乙烯醇的复合材料[105]。相比于传统的聚合物导电材料,该复合材料具有可调的导电性、更高的热稳定性与更宽的导电范围。微生物纳米导线一个突出优点是生物相容性,它也可通过基因工程或者蛋白质工程手段进行定向修饰,这就为扩展微生物纳米导线的应用范围提供了无限可能。例如,Tan采用基因工程手段,将G. sulfurreducens菌毛蛋白羧基端的苯丙氨酸与酪氨酸转变为色氨酸,发现可显著增加纳米导线的导电性(≈2000倍)[19],而且改造后增加了氨基酸修饰位点,更有利纳米导线与其他有机无机材料的复合。微生物纳米导线另一个显著特点是,在水溶液中,甚至在有机溶剂、高温或真空等环境中依然具有传递电子能力,这就赋予了它用于生物传感器或生物医学领域的广阔前景。例如,纳米导线导电性受环境温度与pH的影响,可以用于环境温度或者pH的快速传感。特别值得一提的是,2020年Liu等在Nature上报道纳米导线令人兴奋的应用,利用G. sulfurreducens纳米导线的特殊导电属性、纳米尺寸效应及表面化学性质,发明了一种新型“空气发电机”。这种空气发电机装置只需将约10 μm厚的纳米导线薄膜置于空气中即可利用湿度发电,开启了无污染、可再生、低成本的获取新能源的可能[106]。
5.4 人体健康 菌毛具有粘附作用,是某些微生物的重要致病因子。当菌毛具有导电性时,微生物对宿主的致病性可能会更强。Wanger等在导致下颌骨坏死的微生物被膜中,发现了大量的导电纳米导线[18]。他们怀疑导电纳米导线的大量表达是加速下颌骨坏死的重要因子。其原因在于,纳米导线将膜内厌氧微生物代谢产生的电子转移到胞外,导致质子的积累而产生了酸腐蚀。最近的研究也暗示微生物胞外电子传递可能直接影响人体相关疾病的发生[107-108]。纳米导线可以协助人体肠道微生物胞外电子传递、能量交换及信号通讯[109],以微生物纳米导线作为新的药物靶点,将为疾病的预防与治疗提供全新的视角。
6 未来研究方向与展望 微生物纳米导线的发现及机制和功能的研究,开启了电微生物学这一新兴的前沿学科。每一个关于微生物纳米导线的故事,都注定不会平凡,大量研究成果发表在Cell、Nature、Science等顶级期刊上。对微生物纳米导线导电性的探索,正不断激发着研究者对自然界中微生物的重新认识。例如,一般认为S. aciditrophicus通过种间H2传递与其他微生物形成依赖H2的互营代谢群落。然而,Walker等发现S. aciditrophicus菌毛具有导电性,并证明通过导电菌毛的种间直接电子传递,S. aciditrophicus可以与产甲烷微生物实现直接电子互营产甲烷[29]。因此,有必要对传统基于H2或者甲酸的微生物种间互营代谢群落种间电子传递过程与机制进行重新审视。导电微生物纳米导线源自新近的进化事件[82]。Rotaru等在考量引起纳米导线进化的自然选择压力时,发现微生物种间直接电子互营代谢促使了微生物纳米导线的进化产生[110]。可以预想,各种微生物互营代谢群落将为发现新型的微生物纳米导线提供天然的环境。
微生物纳米导线作为天然导电纳米材料,具有良好的生物相容性与生物可降解性。利用微生物分解代谢污染物同时生产导电纳米导线,代表着绿色化学的未来发展方向。但是,目前微生物纳米导线的研究仍处于初级阶段,其导电机制仍不清楚,功能仍待发掘,应用还有待拓展。以高分辨冷冻电镜、超薄切片、同步辐射等为代表的先进生物分子结构分析手段的运用,将为纳米导线电子传递机制的解析提供便利。过去的15年,我们有幸见证了新技术激发下微生物纳米导线导电理论的形成与发展历程。今后物理学、生物学、材料学、电化学等多学科交叉碰撞,最终将导致微生物纳米导线导电理论的成熟及技术的广泛应用。
References
| [1] | Lovley DR. Bug juice:harvesting electricity with microorganisms. Nature Reviews Microbiology, 2006, 4(7): 497-508. DOI:10.1038/nrmicro1442 |
| [2] | Shi L, Dong HL, Reguera G, Beyenal H, Lu AH, Liu J, Yu HQ, Fredrickson JK. Extracellular electron transfer mechanisms between microorganisms and minerals. Nature Reviews Microbiology, 2016, 14(10): 651-662. DOI:10.1038/nrmicro.2016.93 |
| [3] | Lovley DR. Syntrophy goes electric:Direct interspecies electron transfer. Annual Review of Microbiology, 2017, 71(1): 643-664. |
| [4] | Lovley DR. Live wires:direct extracellular electron exchange for bioenergy and the bioremediation of energy-related contamination. Energy & Environmental Science, 2011, 4(12): 4896-4906. |
| [5] | Lovley DR, Ueki T, Zhang T, Malvankar NS, Shrestha PM, Flanagan KA, Aklujkar M, Butler JE, Giloteaux L, Rotaru AE, Holmes DE, Franks AE, Orellana R, Risso C, Nevin KP. Geobacter:The microbe electric's physiology, ecology, and practical applications. Advances in Microbial Physiology, 2011, 59: 1-100. DOI:10.1016/B978-0-12-387661-4.00004-5 |
| [6] | Vargas M, Kashefi K, Blunt-Harris EL, Lovley DR. Microbiological evidence for Fe(Ⅲ) reduction on early Earth. Nature, 1998, 395(6697): 65-67. DOI:10.1038/25720 |
| [7] | Reguera G, Mccarthy KD, Mehta T, Nicoll JS, Tuominen MT, Lovley DR. Extracellular electron transfer via microbial nanowires. Nature, 2005, 435(7045): 1098-1101. DOI:10.1038/nature03661 |
| [8] | Gorby YA, Yanina S, McLean JS, Rosso KM, Moyles D, Dohnalkova A, Beveridge TJ, Chang IS, Kim BH, Kim KS, Culley DE, Reed SB, Romine MF, Saffarini DA, Hill EA, Shi L, Elias DA, Kennedy DW, Pinchuk G, Watanabe K, Ishii S, Logan B, Nealson KH, Fredrickson JK. Electrically conductive bacterial nanowires produced by Shewanella oneidensis strain MR-1 and other microorganisms. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(30): 11358-11363. DOI:10.1073/pnas.0604517103 |
| [9] | Reguera G, Nevin KP, Nicoll JS, Covalla SF, Woodard TL, Lovley DR. Biofilm and nanowire production leads to increased current in Geobacter sulfurreducens fuel cells. Applied and Environmental Microbiology, 2006, 72(11): 7345-7348. DOI:10.1128/AEM.01444-06 |
| [10] | Zhou SG, Tang JH, Yuan Y, Yang GQ, Xing BS. TiO2 nanoparticle-induced nanowire formation facilitates extracellular electron transfer. Environmental Science & Technology Letters, 2018, 5(9): 564-570. |
| [11] | Ortiz-Bernad I, Anderson RT, Vrionis HA, Lovley DR. Vanadium respiration by Geobacter metallireducens:novel strategy for in situ removal of vanadium from groundwater. Applied and Environmental Microbiology, 2004, 70(5): 3091-3095. DOI:10.1128/AEM.70.5.3091-3095.2004 |
| [12] | Cologgi DL, Lampa-Pastirk S, Speers AM, Kelly SD, Reguera G. Extracellular reduction of uranium via Geobacter conductive pili as a protective cellular mechanism. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(37): 15248-15252. DOI:10.1073/pnas.1108616108 |
| [13] | Rotaru AE, Shrestha PM, Liu FH, Shrestha M, Shrestha D, Embree M, Zengler K, Wardman C, Nevin KP, Lovley DR. A new model for electron flow during anaerobic digestion:direct interspecies electron transfer to Methanosaeta for the reduction of carbon dioxide to methane. Energy & Environmental Science, 2014, 7(1): 408-415. |
| [14] | Coppi MV, Leang C, Sandler SJ, Lovley DR. Development of a genetic system for Geobacter sulfurreducens. Applied and Environmental Microbiology, 2001, 67(7): 3180-3187. DOI:10.1128/AEM.67.7.3180-3187.2001 |
| [15] | Venkidusamy K, Megharaj M, Schr? der U, Karouta F, Mohan SV, Naidu R. Electron transport through electrically conductive nanofilaments in Rhodopseudomonas palustris strain RP2. RSC Advances, 2015, 5(122): 100790-100798. DOI:10.1039/C5RA08742B |
| [16] | Eaktasang N, Kang CS, Lim H, Kwean OS, Cho S, Kim Y, Kim HS. Production of electrically-conductive nanoscale filaments by sulfate-reducing bacteria in the microbial fuel cell. Bioresource Technology, 2016, 210: 61-67. DOI:10.1016/j.biortech.2015.12.090 |
| [17] | Li YQ, Li HY. Type Ⅳ pili of Acidithiobacillus ferrooxidans can transfer electrons from extracellular electron donors. Journal of Basic Microbiology, 2014, 54(3): 226-231. DOI:10.1002/jobm.201200300 |
| [18] | Wanger G, Gorby Y, El-Naggar MY, Yuzvinsky TD, Schaudinn C, Gorur A, Sedghizadeh PP. Electrically conductive bacterial nanowires in bisphosphonate-related osteonecrosis of the jaw biofilms. Oral Surgery, Oral Medicine, Oral Pathology Oral Radiology, 2013, 115(1): 71-78. DOI:10.1016/j.oooo.2012.08.446 |
| [19] | Tan Y, Adhikari RY, Malvankar NS, Ward JE, Woodard TL, Nevin KP, Lovley DR. Expressing the Geobacter metallireducens PilA in Geobacter sulfurreducens yields pili with exceptional conductivity. mBio, 2017, 8(1): e02203-16. DOI:10.1128/mBio.02203-16 |
| [20] | Liu X, Wang SW, Xu AM, Zhang L, Liu HS, Ma LZ. Biological synthesis of high-conductive pili in aerobic bacterium Pseudomonas aeruginosa. Applied Microbiology and Biotechnology, 2019, 103(3): 1535-1544. DOI:10.1007/s00253-018-9484-5 |
| [21] | Cosert KM, Castro-Forero A, Steidl RJ, Worden RM, Reguera G. Bottom-up fabrication of protein nanowires via controlled self-assembly of recombinant Geobacter pilins. mBio, 2019, 10(6): e02721-19. DOI:10.1128/mBio.02721-19 |
| [22] | Lovley DR. Electrically conductive pili:Biological function and potential applications in electronics. Current Opinion in Electrochemistry, 2017, 4(1): 190-198. DOI:10.1016/j.coelec.2017.08.015 |
| [23] | Adhikari RY, Malvankar NS, Tuominen MT, Lovley DR. Conductivity of individual Geobacter pili. RSC Advances, 2016, 6(10): 8354-8357. DOI:10.1039/C5RA28092C |
| [24] | El-Naggar MY, Wanger G, Leung KM, Yuzvinsky TD, Southam G, Yang J, Lau WM, Nealson KH, Gorby YA. Electrical transport along bacterial nanowires from Shewanella oneidensis MR-1. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(42): 18127-18131. DOI:10.1073/pnas.1004880107 |
| [25] | Sure S, Torriero AAJ, Gaur A, Li LH, Chen Y, Tripathi C, Adholeya A, Ackland ML, Kochar M. Inquisition of Microcystis aeruginosa and Synechocystis nanowires:characterization and modelling. Antonie Van Leeuwenhoek, 2015, 108(5): 1213-1225. DOI:10.1007/s10482-015-0576-2 |
| [26] | Castro L, Vera M, Mu? oz JA, Blázquez ML, González F, Sand W, Ballester A. Aeromonas hydrophila produces conductive nanowires. Research in Microbiology, 2014, 165(9): 794-802. DOI:10.1016/j.resmic.2014.09.005 |
| [27] | Sure S, Torriero AAJ, Gaur A, Li LH, Chen Y, Tripathi C, Adholeya A, Ackland ML, Kochar M. Identification and topographical characterisation of microbial nanowires in Nostoc punctiforme. Antonie Van Leeuwenhoek, 2016, 109(3): 475-480. DOI:10.1007/s10482-015-0644-7 |
| [28] | Walker DJF, Adhikari RY, Holmes DE, Ward JE, Woodard TL, Nevin KP, Lovley DR. Electrically conductive pili from pilin genes of phylogenetically diverse microorganisms. The ISME Journal, 2018, 12(1): 48-58. DOI:10.1038/ismej.2017.141 |
| [29] | Walker DJF, Nevin KP, Holmes DE, Rotaru AE, Ward JE, Woodard TL, Zhu JX, Ueki T, Nonnenmann SS, McInerney MJ, Lovley DR. Syntrophus conductive pili demonstrate that common hydrogen-donating syntrophs can have a direct electron transfer option. The ISME Journal, 2020, 14(3): 837-846. DOI:10.1038/s41396-019-0575-9 |
| [30] | Walker DJF, Martz E, Holmes DE, Zhou ZM, Nonnenmann SS, Lovley DR. The archaellum of Methanospirillum hungatei is electrically conductive. mBio, 2019, 10(2): e00579-19. DOI:10.1128/mBio.00579-19 |
| [31] | Wang FB, Gu YQ, O'Brien JP, Yi SM, Yalcin SE, Srikanth V, Shen C, Vu D, Ing NL, Hochbaum AI, Egelman EH, Malvankar NS. Structure of microbial nanowires reveals stacked hemes that transport electrons over micrometers. Cell, 2019, 177(2): 361-369. DOI:10.1016/j.cell.2019.03.029 |
| [32] | Reguera G, Pollina RB, Nicoll JS, Lovley DR. Possible nonconductive role of Geobacter sulfurreducens pilus nanowires in biofilm formation. Journal of Bacteriology, 2007, 189(5): 2125-2127. DOI:10.1128/JB.01284-06 |
| [33] | Aklujkar M, Coppi MV, Leang C, Kim BC, Chavan MA, Perpetua LA, Giloteaux L, Liu A, Holmes DE. Proteins involved in electron transfer to Fe(Ⅲ) and Mn(Ⅳ) oxides by Geobacter sulfurreducens and Geobacter uraniireducens. Microbiology, 2013, 159(Pt 3): 515-535. |
| [34] | Summers ZM, Fogarty HE, Leang C, Franks AE, Malvankar NS, Lovley DR. Direct exchange of electrons within aggregates of an evolved syntrophic coculture of anaerobic bacteria. Science, 2010, 330(6009): 1413-1415. DOI:10.1126/science.1196526 |
| [35] | Rotaru AE, Shrestha PM, Liu FH, Markovaite B, Chen SS, Nevin KP, Lovley DR. Direct interspecies electron transfer between Geobacter metallireducens and Methanosarcina barkeri. Applied and Environmental Microbiology, 2014, 80(15): 4599-4605. DOI:10.1128/AEM.00895-14 |
| [36] | Shrestha PM, Rotaru AE, Aklujkar M, Liu FH, Shrestha M, Summers ZM, Malvankar N, Flores DC, Lovley DR. Syntrophic growth with direct interspecies electron transfer as the primary mechanism for energy exchange. Environmental Microbiology Reports, 2013, 5(6): 904-910. DOI:10.1111/1758-2229.12093 |
| [37] | Liu X, Zhuo SY, Rensing C, Zhou SG. Syntrophic growth with direct interspecies electron transfer between pili-free Geobacter species. The ISME Journal, 2018, 12(9): 2142-2151. DOI:10.1038/s41396-018-0193-y |
| [38] | Shimoyama T, Kato S, Ishii SI, Watanabe, K. Flagellum mediates symbiosis. Science, 2009, 323(5921): 1574-1574. DOI:10.1126/science.1170086 |
| [39] | Liu X, Zhuo SY, Jing XY, Yuan Y, Rensing C, Zhou SG. Flagella act as Geobacter biofilm scaffolds to stabilize biofilm and facilitate extracellular electron transfer. Biosensors and Bioelectronics, 2019, 146: 111748. DOI:10.1016/j.bios.2019.111748 |
| [40] | Jackson BE, Bhupathiraju VK, Tanner RS, Woese CR, McInerney MJ. Syntrophus aciditrophicus sp. nov., a new anaerobic bacterium that degrades fatty acids and benzoate in syntrophic association with hydrogen-using microorganisms. Archives of Microbiology, 1999, 171(2): 107-114. DOI:10.1007/s002030050685 |
| [41] | Childers SE, Ciufo S, Lovley DR. Geobacter metallireducens accesses insoluble Fe(Ⅲ) oxide by chemotaxis. Nature, 2002, 416(6882): 767-769. DOI:10.1038/416767a |
| [42] | Subramanian P, Pirbadian S, El-Naggar MY, Jensen GJ. Ultrastructure of Shewanella oneidensis MR-1 nanowires revealed by electron cryotomography. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(14): E3246-E3255. DOI:10.1073/pnas.1718810115 |
| [43] | Pirbadian S, Barchinger SE, Leung KM, Byun HS, Jangir Y, Bouhenni RA, Reed SB, Romine MF, Saffarini DA, Shi L, Gorby YA, Golbeck JH, El-Naggar MY. Shewanella oneidensis MR-1 nanowires are outer membrane and periplasmic extensions of the extracellular electron transport components. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(35): 12883-12888. DOI:10.1073/pnas.1410551111 |
| [44] | Sure S, Ackland ML, Torriero AAJ, Adholeya A, Kochar M. Microbial nanowires:an electrifying tale. Microbiology, 2016, 162(12): 2017-2028. DOI:10.1099/mic.0.000382 |
| [45] | Wang W, Du YH, Yang S, Du XC, Li M, Lin BQ, Zhou J, Lin LY, Song YL, Li J, Zuo XL, Yang CY. Bacterial extracellular electron transfer occurs in mammalian gut. Analytical Chemistry, 2019, 91(19): 12138-12141. DOI:10.1021/acs.analchem.9b03176 |
| [46] | Ericsson AC, Davis DJ, Franklin CL, Hagan CE. Exoelectrogenic capacity of host microbiota predicts lymphocyte recruitment to the gut. Physiological Genomics, 2015, 47(7): 243-252. DOI:10.1152/physiolgenomics.00010.2015 |
| [47] | Lovley DR, Walker DJF. Geobacter protein nanowires. Frontiers in Microbiology, 2019, 10: 2078. DOI:10.3389/fmicb.2019.02078 |
| [48] | Craig L, Forest KT, Maier B. Type Ⅳ pili:dynamics, biophysics and functional consequences. Nature Reviews Microbiology, 2019, 17(7): 429-440. DOI:10.1038/s41579-019-0195-4 |
| [49] | Liu X, Zhan J, Jing XY, Zhou SG, Lovley DR. A pilin chaperone required for the expression of electrically conductive Geobacter sulfurreducens pili. Environmental Microbiology, 2019, 21(7): 2511-2522. DOI:10.1111/1462-2920.14638 |
| [50] | Dohnalkova AC, Marshall MJ, Arey BW, Williams KH, Buck EC, Fredrickson JK. Imaging hydrated microbial extracellular polymers:comparative analysis by electron microscopy. Applied and Environmental Microbiology, 2011, 77(4): 1254-1262. DOI:10.1128/AEM.02001-10 |
| [51] | Malvankar NS, Yalcin SE, Tuominen MT, Lovley DR. Visualization of charge propagation along individual pili proteins using ambient electrostatic force microscopy. Nature Nanotechnology, 2014, 9(12): 1012-1017. DOI:10.1038/nnano.2014.236 |
| [52] | Malvankar NS, Vargas M, Nevin K, Tremblay PL, Evans-Lutterodt K, Nykypanchuk D, Martz E, Tuominen MT, Lovley DR. Structural basis for metallic-like conductivity in microbial nanowires. mBio, 2015, 6(2): e00084-15. DOI:10.1128/mBio.00084-15 |
| [53] | Malvankar NS, Vargas M, Nevin KP, Franks AE, Leang C, Kim BC, Inoue K, Mester T, Covalla SF, Johnson JP, Rotello VM, Tuominen MT, Lovley DR. Tunable metallic-like conductivity in microbial nanowire networks. Nature Nanotechnology, 2011, 6(9): 573-579. DOI:10.1038/nnano.2011.119 |
| [54] | Liu X, Ye Y, Xiao K, Rensing C, Zhou SG. Molecular evidence for the adaptive evolution of Geobacter sulfurreducens to perform dissimilatory iron reduction in natural environments. Molecular Microbiology, 2020, 113(4): 783-793. DOI:10.1111/mmi.14443 |
| [55] | Klimes A, Franks AE, Glaven RH, Tran H, Barrett CL, Qiu Y, Zengler K, Lovley DR. Production of pilus-like filaments in Geobacter sulfurreducens in the absence of the type Ⅳ pilin protein PilA. FEMS Microbiology Letters, 2010, 310(1): 62-68. DOI:10.1111/j.1574-6968.2010.02046.x |
| [56] | Richter LV, Franks AE, Weis RM, Sandler SJ. Significance of a posttranslational modification of the PilA protein of Geobacter sulfurreducens for surface attachment, biofilm formation, and growth on insoluble extracellular electron acceptors. Journal of Bacteriology, 2017, 199(8): e00716-16. DOI:10.1128/JB.00716-16 |
| [57] | Ing NL, Nusca TD, Hochbaum AI. Geobacter sulfurreducens pili support ohmic electronic conduction in aqueous solution. Physical Chemistry Chemical Physics, 2017, 19(32): 21791-21799. DOI:10.1039/C7CP03651E |
| [58] | Richter LV, Sandler SJ, Weis RM. Two isoforms of Geobacter sulfurreducens PilA have distinct roles in pilus biogenesis, cytochrome localization, extracellular electron transfer, and biofilm formation. Journal of Bacteriology, 2012, 194(10): 2551-2563. DOI:10.1128/JB.06366-11 |
| [59] | Liu X, Tremblay PL, Malvankar NS, Nevin KP, Lovley DR, Vargas M. A Geobacter sulfurreducens strain expressing Pseudomonas aeruginosa type Ⅳ pili localizes OmcS on pili but is deficient in Fe(Ⅲ) oxide reduction and current production. Applied and Environmental Microbiology, 2014, 80(3): 1219-1224. DOI:10.1128/AEM.02938-13 |
| [60] | Tan Y, Adhikari RY, Malvankar NS, Ward JE, Nevin KP, Woodard TL, Smith JA, Snoeyenbos-West OL, Franks AE, Tuominen MT, Lovley DR. The low conductivity of Geobacter uraniireducens pili suggests a diversity of extracellular electron transfer mechanisms in the genus Geobacter. Frontiers in Microbiology, 2016, 7: 980. |
| [61] | Reardon PN, Mueller KT. Structure of the type Ⅳa major pilin from the electrically conductive bacterial nanowires of Geobacter sulfurreducens. Journal of Biological Chemistry, 2013, 288(41): 29260-29266. DOI:10.1074/jbc.M113.498527 |
| [62] | Ueki T, Walker DJF, Tremblay PL, Nevin KP, Ward JE, Woodard TL, Nonnenmann SS, Lovley DR. Decorating the outer surface of microbially produced protein nanowires with peptides. ACS Synthetic Biology, 2019, 8(8): 1809-1817. DOI:10.1021/acssynbio.9b00131 |
| [63] | Ueki T, Walker DJF, Woodard TL, Nevin KP, Nonnenmann SS, Lovley DR. An Escherichia coli chassis for production of electrically conductive protein nanowires. ACS Synthetic Biology, 2020, 9(3): 647-654. DOI:10.1021/acssynbio.9b00506 |
| [64] | Filman DJ, Marino SF, Ward JE, Yang L, Mester Z, Bullitt E, Lovley DR, Strauss M. Cryo-EM reveals the structural basis of long-range electron transport in a cytochrome-based bacterial nanowire. Communications Biology, 2019, 2(1): 219. DOI:10.1038/s42003-019-0448-9 |
| [65] | Vargas M, Malvankar NS, Tremblay PL, Leang C, Smith JA, Patel P, Synoeyenbos-West O, Nevin KP, Lovley DR. Aromatic amino acids required for pili conductivity and long-range extracellular electron transport in Geobacter sulfurreducens. mBio, 2013, 4(2): e00105-13. DOI:10.1128/mBio.00105-13 |
| [66] | Boesen T, Nielsen LP. Molecular dissection of bacterial nanowires. mBio, 2013, 4(3): e00270-13. DOI:10.1128/mBio.00270-13 |
| [67] | Xiao K, Malvankar NS, Shu CJ, Martz E, Lovley DR, Sun X. Low energy atomic models suggesting a pilus structure that could account for electrical conductivity of Geobacter sulfurreducens pili. Scientific Reports, 2016, 6: 23385. DOI:10.1038/srep23385 |
| [68] | Craig L, Pique ME, Tainer JA. Type Ⅳ pilus structure and bacterial pathogenicity. Nature Reviews Microbiology, 2004, 2(5): 363-378. DOI:10.1038/nrmicro885 |
| [69] | Leang C, Qian XL, Mester T, Lovley DR. Alignment of the c-type cytochrome OmcS along pili of Geobacter sulfurreducens. Applied and Environmental Microbiology, 2010, 76(12): 4080-4084. DOI:10.1128/AEM.00023-10 |
| [70] | Malvankar NS, Lovley DR. Microbial nanowires:a new paradigm for biological electron transfer and bioelectronics. ChemSusChem, 2012, 5(6): 1039-1046. DOI:10.1002/cssc.201100733 |
| [71] | Bonanni PS, Massazza D, Busalmen JP. Stepping stones in the electron transport from cells to electrodes in Geobacter sulfurreducens biofilms. Physical Chemistry Chemical Physics, 2013, 15(25): 10300-10306. DOI:10.1039/c3cp50411e |
| [72] | Feliciano GT, Steidl RJ, Reguera G. Structural and functional insights into the conductive pili of Geobacter sulfurreducens revealed in molecular dynamics simulations. Physical Chemistry Chemical Physics, 2015, 17(34): 22217-22226. DOI:10.1039/C5CP03432A |
| [73] | Bond DR, Strycharz-Glaven SM, Tender LM, Torres CI. On electron transport through Geobacter biofilms. ChemSuschem, 2012, 5(6): 1099-1105. DOI:10.1002/cssc.201100748 |
| [74] | Strycharz-Glaven SM, Snider RM, Guiseppi-Elie A, Tender LM. On the electrical conductivity of microbial nanowires and biofilms. Energy & Environmental Science, 2011, 4(11): 4366-4379. |
| [75] | Malvankar NS, Tuominen MT, Lovley DR. Lack of cytochrome involvement in long-range electron transport through conductive biofilms and nanowires of Geobacter sulfurreducens. Energy & Environmental Science, 2012, 5(9): 8651-8659. |
| [76] | Richter H, Nevin KP, Jia HF, Lowy DA, Lovley DR, Tender LM. Cyclic voltammetry of biofilms of wild type and mutant Geobacter sulfurreducens on fuel cell anodes indicates possible roles of OmcB, OmcZ, type Ⅳ pili, and protons in extracellular electron transfer. Energy & Environmental Science, 2009, 2(5): 506-516. |
| [77] | Veazey JP, Reguera G, Tessmer SH. Electronic properties of conductive pili of the metal-reducing bacterium Geobacter sulfurreducens probed by scanning tunneling microscopy. Physical Review E, 2011, 84(6): 060901. DOI:10.1103/PhysRevE.84.060901 |
| [78] | Lampa-Pastirk S, Veazey JP, Walsh KA, Feliciano GT, Steidl RJ, Tessmer SH, Reguera G. Thermally activated charge transport in microbial protein nanowires. Scientific Reports, 2016, 6(1): 23517. DOI:10.1038/srep23517 |
| [79] | Liu X, Zhuo SY, Rensing C, Zhou SG. Syntrophic growth with direct interspecies electron transfer between pili-free Geobacter species. The ISME Journal, 2018, 12(9): 2142-2151. DOI:10.1038/s41396-018-0193-y |
| [80] | Nevin KP, Kim BC, Glaven RH, Johnson JP, Woodard TL, Methé BA, DiDonato RJ Jr, Covalla SF, Franks AE, Liu AN, Lovley DR. Anode biofilm transcriptomics reveals outer surface components essential for high density current production in Geobacter sulfurreducens fuel cells. PLoS One, 2009, 4(5): e5628. DOI:10.1371/journal.pone.0005628 |
| [81] | Holmes DE, Chaudhuri SK, Nevin KP, Mehta T, Methé BA, Liu AN, Ward JE, Woodard TL, Webster J, Lovley DR. Microarray and genetic analysis of electron transfer to electrodes in Geobacter sulfurreducens. Environmental Microbiology, 2006, 8(10): 1805-1815. DOI:10.1111/j.1462-2920.2006.01065.x |
| [82] | Holmes DE, Dang Y, Walker DJF, Lovley DR. The electrically conductive pili of Geobacter species are a recently evolved feature for extracellular electron transfer. Microbial Genomics, 2016, 2(8): e000072. |
| [83] | Shu CJ, Xiao K, Yan Q, Sun X. Comparative analysis of type Ⅳ pilin in Desulfuromonadales. Frontiers in Microbiology, 2016, 7: 2080. |
| [84] | Gorgel M, Ulstrup JJ, B? ggild A, Jones NC, Hoffmann SV, Nissen P, Boesen T. High-resolution structure of a type Ⅳ pilin from the metal-reducing bacterium Shewanella oneidensis. BMC Structural Biology, 2015, 15: 4. DOI:10.1186/s12900-015-0031-7 |
| [85] | Bouhenni RA, Vora GJ, Biffinger JC, Shirodkar S, Brockman K, Ray R, Wu P, Johnson BJ, Biddle EM, Marshall MJ, Fitzgerald LA, Little BJ, Fredrickson JK, Beliaev AS, Ringeisen BR, Saffarini DA. The role of Shewanella oneidensis MR-1 outer surface structures in extracellular electron transfer. Electroanalysis, 2010, 22(7/8): 856-864. |
| [86] | Fitzgerald LA, Petersen ER, Ray RI, Little BJ, Cooper CJ, Howard EC, Ringeisen BR, Biffinger JC. Shewanella oneidensis MR-1 Msh pilin proteins are involved in extracellular electron transfer in microbial fuel cells. Process Biochemistry, 2012, 47(1): 170-174. |
| [87] | Liu X, Jing XY, Ye Y, Zhan J, Ye J, Zhou SG. Bacterial vesicles mediate extracellular electron transfer. Environmental Science & Technology Letters, 2020, 7(1): 27-34. |
| [88] | Pirbadian S, El-Naggar MY. Multistep hopping and extracellular charge transfer in microbial redox chains. Physical Chemistry Chemical Physics, 2012, 14(40): 13802-13808. DOI:10.1039/c2cp41185g |
| [89] | Polizzi NF, Skourtis SS, Beratan DN. Physical constraints on charge transport through bacterial nanowires. Faraday Discussions, 2012, 155: 43-62. DOI:10.1039/C1FD00098E |
| [90] | Lovley DR. e-Biologics:Fabrication of sustainable electronics with "Green" biological materials. mBio, 2017, 8(3): e00695-17. DOI:10.1128/mBio.00695-17 |
| [91] | Malvankar NS, Lovley DR. Microbial nanowires for bioenergy applications. Current Opinion in Biotechnology, 2014, 27: 88-95. DOI:10.1016/j.copbio.2013.12.003 |
| [92] | Grebenko A, Dremov V, Barzilovich P, Bubis A, Sidoruk K, Voeikova T, Gagkaeva Z, Chernov T, Korostylev E, Gorshunov B, Motovilov K. Impedance spectroscopy of single bacterial nanofilament reveals water-mediated charge transfer. PLoS One, 2018, 13(1): e0191289. DOI:10.1371/journal.pone.0191289 |
| [93] | Leang C, Malvankar NS, Franks AE, Nevin KP, Lovley DR. Engineering Geobacter sulfurreducens to produce a highly cohesive conductive matrix with enhanced capacity for current production. Energy & Environmental Science, 2013, 6(6): 1901-1908. |
| [94] | Goldbeck CP, Jensen HM, TerAvest MA, Beedle N, Appling Y, Hepler M, Cambray G, Mutalik V, Angenent LT, Ajo-Franklin CM. Tuning promoter strengths for improved synthesis and function of electron conduits in Escherichia coli. ACS Synthetic Biology, 2013, 2(3): 150-159. DOI:10.1021/sb300119v |
| [95] | Jensen HM, TerAvest MA, Kokish MG, Ajo-Franklin CM. CymA and exogenous flavins improve extracellular electron transfer and couple It to cell growth in Mtr-expressing Escherichia coli. ACS Synthetic Biology, 2016, 5(7): 679-688. DOI:10.1021/acssynbio.5b00279 |
| [96] | Nagarajan H, Embree M, Rotaru AE, Shrestha PM, Feist AM, Palsson BO, Lovley DR, Zengler K. Characterization and modelling of interspecies electron transfer mechanisms and microbial community dynamics of a syntrophic association. Nature Communications, 2013, 4(1): 2809. DOI:10.1038/ncomms3809 |
| [97] | Zhao ZQ, Zhang YB, Holmes DE, Dang Y, Woodard TL, Nevin KP, Lovley DR. Potential enhancement of direct interspecies electron transfer for syntrophic metabolism of propionate and butyrate with biochar in up-flow anaerobic sludge blanket reactors. Bioresource Technology, 2016, 209: 148-156. DOI:10.1016/j.biortech.2016.03.005 |
| [98] | Lee JY, Lee SH, Park HD. Enrichment of specific electro-active microorganisms and enhancement of methane production by adding granular activated carbon in anaerobic reactors. Bioresource Technology, 2016, 205: 205-212. DOI:10.1016/j.biortech.2016.01.054 |
| [99] | Lei YQ, Wei LX, Liu TY, Xiao YY, Dang Y, Sun DZ, Holmes DE. Magnetite enhances anaerobic digestion and methanogenesis of fresh leachate from a municipal solid waste incineration plant. Chemical Engineering Journal, 2018, 348: 992-999. DOI:10.1016/j.cej.2018.05.060 |
| [100] | Lee J, Koo T, Yulisa A, Hwang S. Magnetite as an enhancer in methanogenic degradation of volatile fatty acids under ammonia-stressed condition. Journal of Environmental Management, 2019, 241: 418-426. |
| [101] | Rago L, Pant D, Schievano A. Advanced bioprocessing for alternative fuels, biobased chemicals, and bioproducts. Cambridge, United Kingdom: Woodhead Publishing, 2019. |
| [102] | Engel M, Holtmann D, Ulber R, Tippk? tter N. Increased biobutanol production by mediator-less electro-fermentation. Biotechnology Journal, 2019, 14(4): 1800514. DOI:10.1002/biot.201800514 |
| [103] | Anderson RT, Vrionis HA, Ortiz-Bernad I, Resch CT, Long PE, Dayvault R, Karp K, Marutzky S, Metzler DR, Peacock A, White DC, Lowe M, Lovley DR. Stimulating the in situ activity of Geobacter species to remove uranium from the groundwater of a uranium-contaminated aquifer. Applied and Environmental Microbiology, 2003, 69(10): 5884-5891. DOI:10.1128/AEM.69.10.5884-5891.2003 |
| [104] | Sure SK, Ackland ML, Gaur A, Gupta P, Adholeya A, Kochar M. Probing synechocystis-arsenic interactions through extracellular nanowires. Frontiers in Microbiology, 2016, 7: 1134. |
| [105] | Sun YL, Tang HY, Ribbe A, Duzhko V, Woodard TL, Ward JE, Bai Y, Nevin KP, Nonnenmann SS, Russell T, Emrick T, Lovley DR. Conductive composite materials fabricated from microbially produced protein nanowires. Small, 2018, 14(44): 1802624. DOI:10.1002/smll.201802624 |
| [106] | Liu XM, Gao HY, Ward JE, Liu XR, Yin B, Fu TD, Chen JH, Lovley DR, Yao J. Power generation from ambient humidity using protein nanowires. Nature, 2020, 578(7796): 550-554. DOI:10.1038/s41586-020-2010-9 |
| [107] | Light SH, Su L, Rivera-Lugo R, Cornejo JA, Louie A, Iavarone AT, Ajo-Franklin CM, Portnoy DA. A flavin-based extracellular electron transfer mechanism in diverse Gram-positive bacteria. Nature, 2018, 562(7725): 140-144. DOI:10.1038/s41586-018-0498-z |
| [108] | Pankratova G, Leech D, Gorton L, Hederstedt L. Extracellular electron transfer by the gram-positive bacterium Enterococcus faecalis. Biochemistry, 2018, 57(30): 4597-4603. DOI:10.1021/acs.biochem.8b00600 |
| [109] | Reguera G. When microbial conversations get physical. Trends in Microbiology, 2011, 19(3): 105-113. DOI:10.1016/j.tim.2010.12.007 |
| [110] | Rotaru AE, Woodard TL, Nevin KP, Lovley DR. Link between capacity for current production and syntrophic growth in Geobacter species. Frontiers in Microbiology, 2015, 6: 744. |
