张圣洁1, 蔡中华1, 朱伟胜2, 曾艳华1, 周进1


1. 清华大学深圳国际研究生院, 海洋科学与技术学部, 广东 深圳 518055;
2. 深圳市朗诚科技股份有限公司, 广东 深圳 518055
收稿日期:2019-10-17;修回日期:2019-12-14;网络出版日期:2020-05-19
基金项目:国家自然科学基金(41976126)
*通信作者:Zhou Jin, Tel: +86-755-26036359; E-mail:zhou.jin@sz.tsinghua.edu.cn.
摘要:微藻向细胞周围释放营养物质而形成了独特的藻际微环境,吸引了大量细菌的定殖。藻际环境中藻菌关系错综复杂,其间充斥着多样的物质交换与信息交流。以胞外聚合物(extracellular polymeric substances,EPS)为代表的有机质在其中起着纽带作用。微藻和细菌都可以产生EPS,其过程受多种因素的调节。EPS在藻际环境中具有重要的生态功能,包括参与生物被膜(biofilm)的形成,影响藻菌共生关系的建立以及调节藻际微生物群落组成等。此外,EPS中的一大类别透明胞外聚合物颗粒(transparent exopolymer particles,TEP)还介导了海洋溶解有机碳向颗粒有机碳的转化,参与了海洋碳循环过程。本文以EPS的产生、组成以及对碳转化的影响为重点,综述了其在藻际生态位(Niche)中的生态功能,以期为深入理解藻际环境中的有机质特征和藻菌共生关系提供理论依据。
关键词:胞外聚合物藻际环境藻菌关系生物被膜碳循环
Advances in extracellular polymeric substances in phycosphere environment
Shengjie Zhang1, Zhonghua Cai1, Weisheng Zhu2, Yanhua Zeng1, Jin Zhou1


1. Ocean Science and Technology Division, Shenzhen International Graduate School, Tsinghua University, Shenzhen 518055, Guangdong Province, China;
2. Shenzhen Lightsun Technology Company Limited, Shenzhen 518055, Guangdong Province, China
Received: 17 October 2019; Revised: 14 December 2019; Published online: 19 May 2020
Foundation item: Supported by the National Natural Science Foundation of China (41976126)
Abstract: Microalgae releases extracellular substances around the cell to form a unique algal microenvironment called "phycosphere niche" that attracts a large number of bacteria to colonize. The algae-bacteria interactions are very complex involving multiply material exchanges and information communication. Among the algae-bacterial relationship, extracellular polymeric substances (EPS) serve as a bridge for matter flux. Both microalgae and bacteria can produce EPS, and the production process is regulated by many factors. In the phycosphere environment, EPS play important ecological roles, such as participating in the formation of biofilm, affecting the algae-bacterial symbiotic structure and regulating the composition of microbial communities. In addition, as an important member of EPS, transparent exopolymer particles (TEP) mediate the conversion of dissolved organic carbon into particulate organic carbon. This profile made TEP is an important regulator, participating in marine carbon cycle. In this review, we focus on phycosphere niche, and summarise the newest advance in EPS production, composition and effect factors. Meanwhile, the ecological roles of EPS in marine carbon cycle have also been discussed, to provide reference for better understanding the organic matter properties and algae-bacterial behavior in the phycosphere environment.
Keywords: extracellular polymeric substances (EPS)phycospherealgae-bacteria interactionsbiofilmcarbon cycle
海洋覆盖了地球表面71%的面积,具有很强的吸收和储存二氧化碳的能力,是地球上最重要的碳库之一,每年从大气中吸收的净碳量可达22亿t。海洋中的初级生产者可通过光合作用积累大量的生物质,其中仅浮游植物一项就贡献了全球40%–50%的初级生产力[1]。在浮游植物(如藻类)的生存环境中,存在着与土壤“根际环境” (rhizosphere)类似的“藻际环境”(phycosphere),它是指以藻细胞为中心向外延伸一定范围的微型生态位,在这一生态位中藻类向细胞周围释放营养物质,从而形成了以藻为核心的共生区域[2]。由于藻际环境中有机物质丰富,从而吸引了大量细菌的聚集,形成了藻际微生物群落。“藻-菌”之间充斥着大量的物质、信息与能量流,藻菌互作是藻际环境中一对复杂的关系,包括互利、共生、拮抗与互害等[3]。在这个过程中,藻际有机质是连接藻类与共生微生物的枢纽,其中的一大类别即是胞外聚合物(extracellular polymeric substances,EPS)。需要指出的是,一些文献中EPS也指胞外多糖(exopolysaccharide)。由于胞外聚合物涵盖了胞外多糖,因此,本文中的EPS指代胞外聚合物。
EPS是指微生物在生长过程中释放到周围环境中的有机聚合物,具有高黏性的特点。藻际环境中的EPS由微藻和细菌共同产生,在藻际环境中发挥多样的生态功能,例如为微藻和藻际细菌提供营养物质,供其维持正常的生理活动;在藻细胞周围形成囊鞘,帮助其抵御外界压力;EPS也是藻际细菌生物被膜(biofilm)的重要结构组分,可以固定生物被膜细胞,促进细胞间的通讯及基因交换。此外,EPS还参与物质循环过程,以碳元素为例,EPS中的一大类别透明胞外聚合物颗粒(transparent exopolymer particles,TEP)是连接颗粒有机碳(particulate organic carbon,POC)与溶解有机碳(dissolved organic carbon,DOC)两大有机碳库的纽带,对海洋碳循环有重要意义。
目前,已有不少****针对EPS做了大量研究,对其来源及组成有了比较清晰的认知,但很少有研究将EPS与藻际环境相结合,研究其在藻际环境中的归趋及功能。本文聚焦于藻际微环境,尝试梳理藻际环境中EPS的来源、组成以及影响因素,重点关注其在藻际环境中发挥的生态功能,并对EPS在碳循环中的作用进行了总结。论文旨在综述已有的知识,为今后深入认识藻际环境中EPS的作用提供理论依据。
1 藻际EPS的特性与组成 1.1 特性 EPS是指在一定环境条件下,由微生物向细胞外分泌的一些高分子聚合物,其成分与微生物的胞内成分相似,主要包括多糖、蛋白质、核酸等,详见表 1所示。实际上,藻类向胞外分泌单糖与氨基酸等小分子物质的速率要远远大于其分泌大分子物质的速率,但由于细菌会优先消耗易于利用的单糖和氨基酸用于其生长与繁殖,因而藻际环境中单糖和氨基酸的含量要远远低于多糖与蛋白质的含量。藻际环境中EPS主要由浮游植物分泌而来,少量来自海洋细菌;前者聚合物的产量为0.5–20.0 g/L,后者的产量为0.2–71.0 g/L。由于聚合物具有黏性特质,藻类在海洋环境中并非以分散的个体形式存在,而是以生物被膜、生物垫(microbial mat)、颗粒、絮凝体等聚集体形式存在[4]。除了细胞相互聚集之外,海洋环境中的一些腐殖质颗粒和碎屑也可以吸附到其周围,形成以藻细胞为中心的营养体[5],如图 1所示。
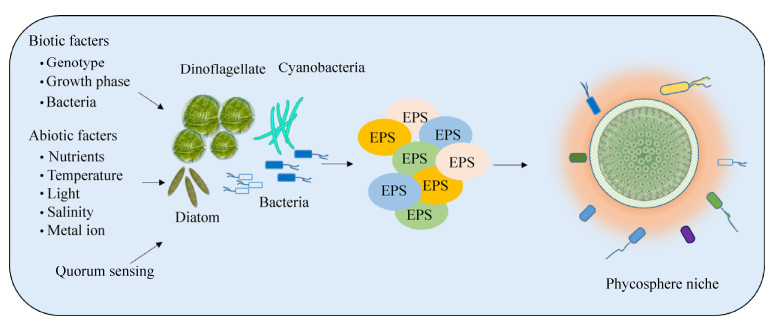 |
| 图 1 藻际环境与EPS示意图[6] Figure 1 Schematic illustration of the phycosphere environment and EPS[6]. |
| 图选项 |
1.2 组成
1.2.1 多糖: 胞外多糖是藻际EPS中最丰富也是最重要的组分,占EPS总量的40%–95%[5]。胞外多糖根据其结构组成可以分为三类:(1)同多糖:由一种结构单元组成;(2)杂多糖:由两种及以上复杂程度不同的结构单元组成;(3)无规则结构的多糖[7]。少数微藻产生同多糖,如环沟藻的胞外多糖为半乳糖的均聚物[8];其他微藻的胞外多糖均为杂多糖,单体组成更为复杂,包括葡萄糖、半乳糖、岩藻糖、鼠李糖、甘露糖、木糖、阿拉伯糖以及糖类衍生物等[4]。与藻类相比,海洋细菌产生的胞外多糖一般是由3–4种单体(如戊糖、己糖、氨基糖或者糖醛酸)组成的杂多糖[9],分子量通常为1×105–3×105 Da[10]。细菌胞外多糖最主要的特征是糖醛酸含量较高,特别是D-葡萄糖醛酸与D-半乳糖醛酸,这赋予其聚合阴离子的性质,有利于它在海洋系统中发挥生态功能,包括微生物粘附、生物被膜的形成、烃油的乳化以及调节重金属和微量金属营养素的流动性等。除了常见的单糖分子之外,胞外多糖中还可能存在有机(乙酰基、琥珀酰基、丙酮酰基)或者无机(硫酸盐、磷酸盐)取代基,这些基团可显著影响胞外聚合物的结构、理化性质、生物活性,包括分子量、糖残基、硫酸化水平、多糖骨架中硫酸酯基团的分布以及抗菌活性等[4]。
1.2.2 蛋白质: 蛋白质是继胞外多糖之后EPS中的第二大组分,占EPS总重的1%以上,这一比例在一些可形成糖蛋白的藻类中会更高。不同物种的蛋白质组成不同,微藻胞外蛋白中主要有丙氨酸、甘氨酸、缬氨酸、丝氨酸、天冬氨酸以及谷氨酸等[11]。通常,微藻胞外蛋白按照其功能可分为细胞外酶和非酶促结构蛋白。细胞外酶参与生物的降解,包括多糖、蛋白质和核酸等,这表明EPS可能是潜在的胞外能量来源。目前已经在衣藻(Chlamydomonas coccoides)、角毛藻(Chaetoceros didymus)[12]以及球藻(Chlorella sphaerkii)[13]的生长过程中发现了蛋白酶的产生。微藻释放的其他细胞外酶如碱性磷酸酶、β-D葡糖苷酶和几丁质酶可通过促进氮和碳的可利用性来影响微藻的生长和信号传导。而非酶促结构蛋白是EPS基质网络的重要组成部分,它可以与胞外多糖或其他胞外组分相互作用形成稳定的聚合物基质,如通过寡糖糖基化形成糖蛋白,或者被脂肪酸取代形成脂蛋白,它们在细胞表面和EPS之间形成连接,参与多糖基质网络的形成[14]。
1.2.3 脱氧核糖核酸: EPS中还存在胞外脱氧核糖核酸(extracellularDNA,eDNA),是生物被膜基质的重要结构组分。以往的研究认为eDNA来自细胞裂解,而Whitchurch等[15]的研究表明eDNA可能来自膜囊泡,它是细菌建立生物被膜初级阶段的必需成分,作为细胞间连接体起作用。eDNA还具有抗菌活性,通过螯合脂多糖和细胞外膜的阳离子引起细胞裂解[16]。此外,沉积物中的eDNA浓度通常比水相中的浓度高3–4个数量级,这表明eDNA在沉积物环境某些元素(如磷)的循环中起重要作用[17]。
1.2.4 其他成分: 除了上述组分之外,EPS中还含有少量的脂质、腐殖质以及无机成分。脂质、脂质衍生物以及脂多糖主要参与粘附过程[14];腐殖质主要影响EPS的生物降解性能以及吸附能力;而无机成分主要来自于外周水体无机盐的吸附过程。
2 藻际EPS产生过程的影响因素 EPS的产生受多种因素的影响,按大类可以分成生物因素和非生物因素两大类。除此之外,一些化学信号也可以调节EPS的产生,如群体感应信号(quorum sensing,QS)。
2.1 生物因素 生物因素主要指微生物种类及所处的生长阶段。不同种类的微藻产生的EPS组成不同,同一种类不同生长阶段的藻类产生的EPS也不同。以硅藻为例,虽然其种类繁多,但是所有硅藻产生的胞外多糖都有共同的特征,即都是硫酸化杂多糖。就单体组成而言,葡萄糖是筒柱藻(Cylindrotheca fusiformis)的胞外多糖的主要单体之一[18],而在颗石藻(Coccolithophore)和普林藻(Prymnesiophyte)的胞外多糖中阿拉伯糖占比更高[19]。就生长阶段而言,Fukao等[20]研究发现,格氏圆筛藻(Coscinodiscus granii)主要在生长期产生EPS;中肋骨条藻(Skeletonema costatum)在生长期产生的EPS量很少,衰亡期产生的EPS量最多;而南极棕囊藻(Phaeocystis antarctica)[21]在生长期、平台期和衰亡期都可以产生EPS。
此外,微藻分泌物的数量和质量受共生菌及其环境营养物的调控。Bruckner等[22]从底栖生物膜中分离出硅藻与共生细菌,共培养后发现硅藻的生长和EPS分泌受细菌的强烈影响。与无菌对照培养物相比,实验组不仅EPS产量存在10%以上的差异,还发现了特异性胞外蛋白的存在。将细菌培养上清添加到硅藻培养物后获得了类似的结果,这表明来自细菌的可溶物调控了硅藻EPS的分泌。G? rdes等[23]研究了粘附性海洋杆菌(Marinobacter adhaerens HP15)对威氏海链藻(Thalassiosira weissflogii)分泌TEP的影响,发现在营养充足的条件下,细菌的存在会刺激TEP的产生。此外,一些产毒藻类也会影响EPS的分泌。以微囊藻毒素为例,当惠氏微囊藻(Microcystis wesenbergii)[24]、小球藻(Chlorella vulgaris)以及四尾栅藻(Scenedesmus quadricauda)[25]暴露于微囊藻毒素时,胞外多糖分泌增加,且产量呈现剂量效应。
2.2 非生物因素 非生物因素主要指营养可利用性、温度、盐度、光照以及重金属浓度等。
微藻分泌EPS的原因多样,其中可能涉及藻细胞与周围环境之间由浓度梯度驱动的被动扩散过程,也可能存在“光合作用溢出”现象[26]。光合作用溢出是指微藻通过光合作用固定的碳比其生长所消耗的碳更多,在营养限制的条件下,微藻将光合作用固定的过量碳渗出有助于维持细胞化学剂量比(Redfield比率C:N:P=106:16:1)。研究表明,氮限制与磷限制都可不同程度地增强藻类的EPS合成能力,这也从侧面印证了这个观点。氮缺乏刺激了蓝藻所有碳水化合物(胞内、荚膜、可溶性碳水化合物)的产生,其中胞外多糖(包括荚膜和可溶性碳水化合物)的平均生产率为115 mg/(L?d)[27];三角褐指藻(Phaeodactylum tricornutum)在磷酸盐限制条件下在整个生长过程中分泌的碳水化合物含量显著增加[28]。温度控制理论中发现温度对藻类EPS合成的影响取决于具体的物种,如对于鱼腥藻(Anabaena sp. ATCC 33047),温度升高(30 ℃/35 ℃–40 ℃/45 ℃)可提高EPS产量[29];而对于念珠藻(Nostoc sp. PCC 7936),温度升高(30 ℃–35 ℃)则不会影响EPS产量[30];对于螺旋藻(Spirulina sp.),温度超过30 ℃,EPS合成反而会降低[31]。与温度类似,光照对EPS的影响也与物种有关。舟形藻(Navicula perminuta)在黑暗中培养3 d后持续分泌EPS[32],而Cherrier等[33]的研究则发现浮游植物对有机质的胞外释放与光量呈正相关。除了温度和光照,盐度和重金属浓度也可以调节EPS的合成,与前者不同的是,它们对EPS的分泌一般是正向影响,即这些环境胁迫在一定程度上可以刺激微藻EPS的分泌。
2.3 信号调节 除了受到环境因子和微生物生长阶段的影响之外,EPS的产生也受到化学信号的调节,如群体感应(QS),它是响应细胞密度的一种调节方式。QS细菌产生并释放被称为自诱导物的化学信号分子,其浓度随细胞密度的增加而增加,达到一定的阈值时会介导细菌基因表达的改变,进而引起细菌表型的改变[34]。不同种类的细菌产生的信号分子种类不同,已发现的信号分子种类有酰基-高丝氨酸内酯(acyl-homoserine lactone,AHL)、自诱导剂(autoinducer-2,AI2)、扩散信号因子(diffusive signaling factors,DSF)以及自诱导肽(autoinducing peptides,AIP)等。QS现象最先由Nealson等在两种发光弧菌(Vibrio fischeri和Vibrio harveyi)中发现,他们证实控制发光的酶由荧光素酶结构操纵子编码,而生物发光仅在高细胞密度环境下自诱导物信号分子发生积累时产生[35]。随后在很多细菌中都发现了由QS系统参与调节的多种生理活动,包括生物发光、毒力因子表达、抗生素合成、孢子产生、EPS分泌以及生物被膜形成等[34]。
信号分子对EPS的调节经常发生在生物被膜的形成过程中。在这一过程中,EPS的功能是将细胞粘附到膜表面。首先,附着基质表面通过弱的相互作用力(如范德华力、疏水作用力等)吸引微生物靠近并建立连接,在这个阶段适度的剪切力可以将微生物从表面脱离,因此被称为“可逆吸附”[36]。随着时间的推移,可逆吸附在偶极-偶极相互作用、氢键以及离子键的作用下转变成不可逆吸附;同时,细胞发生聚集并释放信号分子,待信号分子积累到一定浓度,激活QS系统,产生EPS增加微生物的聚合度,并介导生物被膜的成熟。Gram[37]等在从海雪(Marine snow)以及硅藻(海链藻Thalassiosira rotula和中肋骨条藻Skeletonema costatum)中分离的玫瑰杆菌(Roseobacter)、α-变形菌(α-Proteobacteria)、γ-变形菌(γ-Proteobacteria)等海洋微生物中发现了AHL,这些信号分子可能控制EPS表型性状,包括组成成分、胞外酶产生以及多聚物的空间排列等。van Mooy等在束毛藻(Trichodesmium)中也检测到了AHL的存在,这些细菌利用AHL信号控制EPS的致密程度和碱性磷酸酶(alkalinephosphatases,APases)的活性,从而调节磷酸盐的获取[38]。
3 藻际环境中EPS的功能 微藻和细菌是藻际环境中微生物群落的重要组成部分,两者之间会发生复杂的相互作用,但最根本的还是资源供求关系,藻际环境中的营养物质循环维护了藻菌关系的持续与稳定。但藻际环境中的EPS除了充当最基本的营养基础之外,还发挥其他的功能,如影响藻际细菌生物被膜的形成、藻菌共生关系的建立以及调节藻际微生物群落组成等。
3.1 EPS对生物被膜的影响 生物被膜(biofilm)是指粘附于某种表面基质而形成的微生物聚集体,其中的微生物个体常嵌入在EPS基质中。聚集体包括两种,其一是表面附着生物被膜,仅最内层与基质接触;其二是絮状物,即无附着基的可移动生物被膜[39]。在生物被膜中微生物仅占膜干重的不到10%,剩余90%基本为EPS基质[14],这一高干重比决定了EPS的重要性。首先,生物被膜的形成过程中,各类微生物需要形成菌落而有序共存,而EPS的存在能帮助微生物建立稳定的空间结构,调节膜内的微环境并促进生物被膜的成熟[40]。此外,EPS基质由聚合物分子组成,相邻分子之间有充满水的孔隙,聚合物包埋在水溶剂中以形成三维水凝胶网络,这有利于细胞与周围介质进行物质交换并维持热力学平衡。最后,EPS可通过共价键或者阳离子桥(例如Ca2+、Mg2+)连接形成复杂的网络,通过膨胀或收缩改变膜的尺寸和密度以响应外界环境的变化[41]。总结已有的文献,可以看出EPS是生物被膜形成的基础,它为生物被膜的三维结构提供支架、维持膜的稳定性,是决定膜理化性质以及生理活性的关键组分,各项具体功能如表 1所示。
表 1. 生物被膜中EPS的成分及其在生物被膜形成和发展中的作用 Table 1. Components of EPS in biofilms and their function in biofilm formation and development
| Component | Function | References |
| Exopolysaccharide | ???Adhesion ???Aggregation of bacteria ???cells ???Cohesion of biofilms ???Retention of water ???Protective barrier ???Sorption ???Nutrient source ???Sink for excess energy ???Binding of enzymes | [14, 42-44] |
| Proteins | ???Adhesion ???Aggregation of bacteria ???cells ???Cohesion of biofilms ???Protective barrier ???Sorption ???Enzymatic activity ???Nutrient source ???Electron donor or acceptor ???Binding of enzymes | [14, 42] |
| eDNA | ???Adhesion ???Aggregation of bacteria ???cells ???Cohesion of biofilms ???Nutrient source ???Exchange of genetic information | [14, 16, 42, 45] |
| Other components | ???Adhesion ???Sorption ???Nutrient source ???Electron donor or acceptor | [14, 42] |
表选项
3.2 EPS对藻菌共生关系的影响 趋化性是藻际微环境中微生物获取营养的一种重要方式,EPS的存在为趋化行为提供了便利。微流体趋化试验研究了3种海洋细菌(假单胞菌Pseudoalteromonas haloplanktis,溶藻弧菌Vibrio alginolyticus,富硅菌Silicibacter sp. TM1040)对聚球藻(Synechococcus elongatus)化学产物的趋化反应。结果表明这3种细菌对聚球藻分泌的产物产生了强烈而快速的趋化应答,其中,假单胞菌趋化能力最强,其在微藻胞外产物带(product zone)内累积,浓度是对照组的9倍[46]。导致这一结果的原因是微藻胞外产物带中高浓度的EPS诱使了趋化运动的发生。Smriga等也发现,对硅藻而言,当藻细胞密度低时,非运动型寡营养细菌占主导地位;而在藻类爆发期间,运动的共生细菌占主导地位。这主要是由于爆发期高浓度的EPS为细菌的运动充当了“诱饵”[47]。因此,细菌的趋化性受EPS的调节并可以通过EPS浓度梯度与藻类建立共生关系。
除了趋化作用,异养细菌还可通过各种机制吸收营养,如主动运输和选择扩散。藻际环境中溶解的小分子物质(如单糖、氨基酸等)虽然产生速率高,但也更易于被微生物利用。相反,多糖、蛋白质等大分子物质因扩散速度慢,且不易被利用,因而容易在藻际环境中积累。以胞外多糖为例,其首先由胞外水解酶水解,从而产生低聚糖或单体供细菌利用。虽然大部分细菌基因组均含有控制胞外酶产生的基因[48],但只有少量的细菌种类可以成功表达这种基因,释放胞外水解酶。EPS的存在能加速胞外水解酶的产生与释放,利于藻际共生环境中大分子物质的周转。此外,微藻并非是藻际环境中胞外多糖的唯一来源,细菌也可以产生胞外多糖,其主要特征是糖醛酸占比较高(20%–50%)[49]。这种高糖醛酸比例能更有效地抵抗微生物的矿化作用,使得胞外多糖在藻际环境中存在更长时间,可为不同种类的细菌所利用,延长了藻际环境的物质供给,维护了共生关系的持续性。
3.3 EPS影响藻际微生物群落 由于不同藻类在不同的生理阶段会释放不同的有机质,且异养细菌摄取和再矿化各种底物的能力各异,很多研究表明藻际环境微生物群落结构可能在很大程度上受到藻类物种组成及其EPS的影响[3]。具体体现在EPS与藻际细菌群落均表现出明显的季节性演替模式,夏季随着浮游植物的增殖EPS的分泌量增加,出现了不同的细菌种类,代表性指示种有黄杆菌(Flavobacterium)、γ-变形菌(γ-Proteobacteria)与玫瑰杆菌(Roseobacter);而冬季时期,浮游植物丰度低也与黄杆菌的低份额相对应[50]。此外,一些研究关注了实验室条件下EPS对异养细菌群落的影响,Haynes等比较了富含硅藻EPS的沉积物与对照组间细菌群落的变化,发现实验初始阶段(0–2 d)细菌群落无显著差异,随着实验的进行(4–10 d),富含EPS的沉积物中细菌数量明显增加,尤其是γ-变形菌相对丰度增加[51]。与之相似,Bohórquez等研究了潮间带沉积物不同EPS组分的降解速率及其对沉积物中异养细菌群落的影响,发现与对照组相比,细菌生物量在9 d内增加了4–6倍,拟杆菌和疣微菌相对丰度显著增加[52]。这表明,EPS是藻际细菌群落结构的直接调节者,它驱动了微生物的演替与时空变化。
4 藻际EPS对碳循环的影响 浮游植物作为海洋中最重要的初级生产力贡献者,其通过光合作用、呼吸作用以及自身的生消过程极大地驱动了海洋碳循环的进程。而EPS作为浮游植物(藻类)释放的一类富含碳的有机物的重要组分,在碳循环的过程中扮演着重要角色。
4.1 EPS是DOC与POC之间的桥梁 海洋中的有机质以颗粒有机物(POM)与溶解有机物(DOM)两种形式存在,为海洋中的异养微生物提供碳源和能源。海洋中的DOM碳储量约为662 Gt[53],远远高于POM碳储量的30 Gt[54]。要了解海洋生物化学循环过程,厘清DOM向POM转化的途径和机制十分必要。最初,在水生生态系统中,细菌摄取被认为是DOM转化为POM的主要途径。然而在1963年,Riley[55]和Baylor[56]等发现了通过鼓泡从DOM中形成POM的非生物过程。虽然这一发现在当时并未引起足够的重视,但随着TEP的发现,证实了它是DOM转化为POM的重要途径。TEP是由酸性多糖组成,在光学显微镜下不可见,但可用阿尔新蓝染色的一类特殊EPS[57]。TEP在水体中广泛存在,粒径 > 5 μm的TEP颗粒浓度为1–8000个/mL,粒径介于2–5 μm时浓度为3000–40000个/mL[58]。TEP在原位的峰值浓度通常与浮游植物的大量繁殖相关,特别是在以硅藻或棕囊藻为主的暴发期中。并且,在近岸及大洋环境中,TEP在透光带中的浓度最高,这与浮游植物的聚集带相似,表明TEP的时空分布与浮游植物存在某种关联。TEP主要通过凝胶颗粒自发形成,与微生物活性无关。TEP前体由直径为1–3 nm、长度为100 nm的原纤维组成。在指数生长期间,浮游植物细胞将纤维状TEP前体从其细胞表面释放到水中,这种纤维状聚合物通过凝胶化(游离聚合物的组装)和退火方式形成亚微米凝胶,然后再进一步凝固形成更大的聚集体并最终形成TEP (图 2)[58]。阳离子如Ca2+能促进或稳定凝胶,而在螯合剂EDTA (0.1–1.0 mol/L)作用下则迅速崩解[57]。这种作用能决定TEP的有无并直接影响DOM与POM之间的转化。
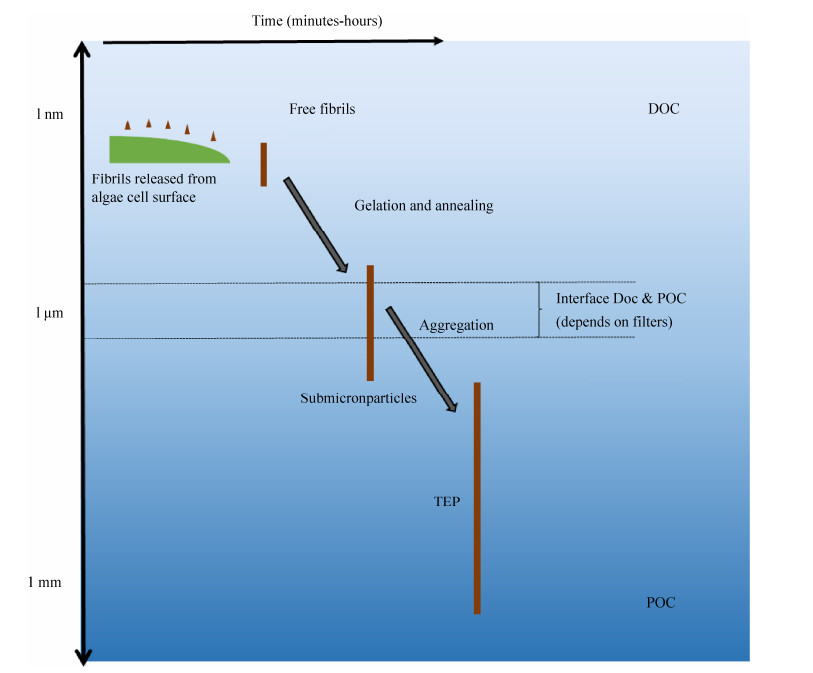 |
| 图 2 TEP的形成过程[58] Figure 2 The formation of TEP[58]. |
| 图选项 |
4.2 EPS对碳通量的影响 海洋“生物泵”是将光合作用产生的有机质通过下沉颗粒、平流或溶解有机质的垂直混合以及动物运输等方式从表层输送至深海的过程[59]。据估计,生物泵每年从海洋的上层水域中去除碳总量超过100亿t。海雪是尺寸 > 500 μm的宏观有机聚集体,由海洋中的碎屑颗粒、无机颗粒、藻类以及其他微生物[37]聚集而成,是生物泵的主要组成部分。迄今为止已知的海雪聚集体基质,无论其来源和组成如何,都含有TEP成分[60]。TEP与其他颗粒物质一起凝结形成团聚体,达到临界质量后在重力的作用下逐渐下沉至深海,从而增加碳的封存通量。但是,生物泵的效率较低,一般来说,约5%–25%的净初级生产力从透光层输出,最终只有 < 3%的净初级生产力到达深海。
然而,后续研究发现,TEP的密度(700–840 kg/m3)远低于海水的密度(1020–1030 kg/m3)[61],这使得TEP在海水中的归趋需要重新审视。决定材料在海水中下沉速度的因素包括其尺寸、孔隙率和密度。聚集体的密度随TEP和固体颗粒的密度而变化,并且还与TEP与固体颗粒占聚集体的比例有关。Alonso-Gonzalez等[62]研究发现,聚集体在夏季/秋季的下沉速度(< 11 m/d)远远低于冬季/春季(> 326 m/d)。这可能是由于夏季TEP在表层水中积累,聚集体中TEP的相对比例较高所致。TEP的低密度特性不仅可以影响海洋聚集体的下沉速度,甚至可能导致碳的向上通量,使得TEP在海水次表层(距海水表面50–100 μm)的积累。
5 小结与展望 EPS是连接藻菌关系的重要纽带,微藻和藻际细菌分泌EPS归根究底是为了提高其代谢效率,增强其对复杂环境变化的适应性。要深刻理解藻菌互作,对EPS的研究是必不可少的工作。虽然目前对EPS的产生、功能以及对海洋碳循环的影响有了些许认识,但仍有很多方面还需要进一步深入,如(1)目前对EPS来源的认识还停留在有限的物种,且对于其分泌的分子途径还有待细化;(2)近年来全球海域赤潮频发,EPS含量与赤潮生消阶段是否存在相关性,是否可以开发EPS作为生物标志物(biomarker)预测赤潮的发生;(3)除了微藻和细菌,病毒也是未来关注的重点。虽然目前尚未有研究表明病毒与EPS有直接关系,但是病毒与微藻、细菌均关系紧密,病毒与EPS是否存在直接或间接关系也是值得深入的问题。最后,从藻际环境理解EPS的生态功能是一种微观尺度,在宏观尺度上是否具有普适性、其异同点是什么,抑或也是有趣的议题。
References
| [1] | Field CB, Behrenfeld MJ, Randerson JT, Falkowski P. Primary production of the biosphere: Integrating terrestrial and oceanic components. Science, 1998, 281(5374): 237-240. DOI:10.1126/science.281.5374.237 |
| [2] | Zhang ZH, Tang LL, Zhang YY. Algae-bacteria interactions and their ecological functions in the ocean. Microbiology China, 2018, 45(9): 2043-2053. (in Chinese) 张增虎, 唐丽丽, 张永雨. 海洋中藻菌相互关系及其生态功能. 微生物学通报, 2018, 45(9): 2043-2053. |
| [3] | Zhou J, Lin GH, Cai ZH. Roles of microbes in matter cycles in phycosphere niche. Chinese Journal of Applied Ecology, 2016, 27(8): 2708-2716. (in Chinese) 周进, 林光辉, 蔡中华. 微生物在藻际环境中的物质循环作用. 应用生态学报, 2016, 27(8): 2708-2716. |
| [4] | Xiao R, Zheng Y. Overview of microalgal extracellular polymeric substances (EPS) and their applications. Biotechnology Advances, 2016, 34(7): 1225-1244. DOI:10.1016/j.biotechadv.2016.08.004 |
| [5] | Flemming HC, Wingender J. Relevance of microbial extracellular polymeric substances (EPSs) - Part I: Structural and ecological aspects. Water Science and Technology, 2001, 43(6): 1-8. DOI:10.2166/wst.2001.0326 |
| [6] | Jimoh TA, Keshinro MO, Cowan KA. Microalgal-bacterial flocs and extracellular polymeric substances: two essential and valuable products of integrated algal pond systems. Water, Air, and Soil Pollution, 2019, 230(4): 95. |
| [7] | Sutherland IW. Microbial exopolysaccharides - structural subtleties and their consequences. Pure and Applied Chemistry, 1997, 69(9): 1911-1918. DOI:10.1351/pac199769091911 |
| [8] | Nomoto K, Yokokura T, Satoh H, Mutai M. Antitumor activity of chlorella extract, PCM-4, by oral administration. Gan to Kagaku Ryoho. Cancer & Chemotherapy, 1983, 10(3): 781-785. |
| [9] | Decho AW. Microbial exopolymer secretions in ocean environments: their role(s) in food webs and marine processes. Oceanography and Marine Biology, 1990, 28: 73-153. |
| [10] | Sutherland IW. Bacterial exopolysaccharides--their nature and production. Antibiotics and Chemotherapy, 1989, 42: 50-55. DOI:10.1159/000417603 |
| [11] | Chentir I, Hamdi M, Doumandji A, HadjSadok A, Ouada HB, Nasri M, Jridi M. Enhancement of extracellular polymeric substances (EPS) production in Spirulina (Arthrospira sp.) by two-step cultivation process and partial characterization of their polysaccharidic moiety. International Journal of Biological Macromolecules, 2017, 105: 1412-1420. DOI:10.1016/j.ijbiomac.2017.07.009 |
| [12] | Paul C, Pohnert G. Induction of protease release of the resistant diatom Chaetoceros didymus in response to lytic enzymes from an algicidal bacterium. PLoS One, 2013, 8(3): e57577. DOI:10.1371/journal.pone.0057577 |
| [13] | Kellam SJ, Walker JM. An extracellular protease from the alga Chlorella sphaerkii. Biochemical Society Transactions, 1987, 15(3): 520-521. DOI:10.1042/bst0150520 |
| [14] | Flemming HC, Wingender J. The biofilm matrix. Nature Reviews Microbiology, 2010, 8(9): 623-633. DOI:10.1038/nrmicro2415 |
| [15] | Whitchurch CB, Tolker-Nielsen T, Ragas PC, Mattick JS. Extracellular DNA required for bacterial biofilm formation. Science, 2002, 295(5559): 1487-1487. DOI:10.1126/science.295.5559.1487 |
| [16] | Mulcahy H, Charron-Mazenod L, Lewenza S. Extracellular DNA chelates cations and induces antibiotic resistance in Pseudomonas aeruginosa biofilms. PLoS Pathogens, 2008, 4(11): e1000213. DOI:10.1371/journal.ppat.1000213 |
| [17] | Dell'Anno A, Corinaldesi C. Degradation and turnover of extracellular DNA in marine sediments: Ecological and methodological considerations. Applied and Environmental Microbiology, 2004, 70(7): 4384-4386. DOI:10.1128/AEM.70.7.4384-4386.2004 |
| [18] | Magaletti E, Urbani R, Sist P, Ferrari CR, Cicero AM. Abundance and chemical characterization of extracellular carbohydrates released by the marine diatom Cylindrotheca fusiformis under N- and P-limitation. European Journal of Phycology, 2004, 39(2): 133-142. DOI:10.1080/0967026042000202118 |
| [19] | Hahnke S, Sperling M, Langer T, Wichels A, Gerdts G, Beardsley C, Brinkhoff T, Simon M. Distinct seasonal growth patterns of the bacterium Planktotalea frisia in the North Sea and specific interaction with phytoplankton algae. FEMS Microbiology Ecology, 2013, 86(2): 185-199. DOI:10.1111/1574-6941.12151 |
| [20] | Fukao T, Kimoto K, Kotani Y. Production of transparent exopolymer particles by four diatom species. Fisheries Science, 2010, 76(5): 755-760. DOI:10.1007/s12562-010-0265-z |
| [21] | Hong Y, Smith WO, White AM. Studies on transparent exopolymer particles (TEP) produced in the Ross Sea (Antarctica) and by Phaeocystis antarctica (Prymnesiophyceae). Journal of Phycology, 1997, 33(3): 368-376. DOI:10.1111/j.0022-3646.1997.00368.x |
| [22] | Bruckner CG, Rehm C, Grossart HP, Kroth PG. Growth and release of extracellular organic compounds by benthic diatoms depend on interactions with bacteria. Environmental Microbiology, 2011, 13(4): 1052-1063. DOI:10.1111/j.1462-2920.2010.02411.x |
| [23] | G? rdes A, Ramaye Y, Grossart H-P, Passow U, Ullrich MS. Effects of Marinobacter adhaerens HP15 on polymer exudation by Thalassiosira weissflogii at different N:P ratios. Marine Ecology Progress Series, 2012, 461: 1-14. DOI:10.3354/meps09894 |
| [24] | Gan NQ, Xiao Y, Zhu L, Wu ZX, Liu J, Hu CL, Song LR. The role of microcystins in maintaining colonies of bloom-forming Microcystis spp. Environmental Microbiology, 2012, 14(3): 730-742. DOI:10.1111/j.1462-2920.2011.02624.x |
| [25] | Mohamed ZA. Polysaccharides as a protective response against microcystin-induced oxidative stress in Chlorella vulgaris and Scenedesmus quadricauda and their possible significance in the aquatic ecosystem. Ecotoxicology, 2008, 17(6): 504-516. DOI:10.1007/s10646-008-0204-2 |
| [26] | Thornton DCO. Dissolved organic matter (DOM) release by phytoplankton in the contemporary and future ocean. European Journal of Phycology, 2014, 49(1): 20-46. DOI:10.1080/09670262.2013.875596 |
| [27] | Dephilippis R, Margheri MC, Pelosi E, Ventura S. Exopolysaccharide production by a unicellular cyanobacterium isolated from a hypersaline habitat. Journal of Applied Phycology, 1993, 5(4): 387-394. DOI:10.1007/BF02182731 |
| [28] | Abdullahi AS, Underwood GJC, Gretz MR. Extracellular matrix assembly in diatoms (bacillariophyceae). V. Environmental effects on polysaccharide synthesis in the model diatom, Phaeodactylum tricornutum. Journal of Phycology, 2006, 42(2): 363-378. DOI:10.1111/j.1529-8817.2006.00193.x |
| [29] | Moreno J, Vargas MA, Olivares H, Rivas J, Guerrero MG. Exopolysaccharide production by the cyanobacterium Anabaena sp. ATCC 33047 in batch and continuous culture. Journal of Biotechnology, 1998, 60(3): 175-182. DOI:10.1016/S0168-1656(98)00003-0 |
| [30] | Otero A, Vincenzini M. Nostoc (Cyanophyceae) goes nude: Extracellular polysaccharides serve as a sink for reducing power under unbalanced C/N metabolism. Journal of Phycology, 2004, 40(1): 74-81. DOI:10.1111/j.0022-3646.2003.03-067.x |
| [31] | Nicolaus B, Panico A, Lama L, Romano I, Manca MC, De Giulio A, Gambacorta A. Chemical composition and production of exopolysaccharides from representative members of heterocystous and non-heterocystous cyanobacteria. Phytochemistry, 1999, 52(4): 639-647. DOI:10.1016/S0031-9422(99)00202-2 |
| [32] | Smith DJ, Underwood GJC. The production of extracellular carbohydrates by estuarine benthic diatoms: The effects of growth phase and light and dark treatment. Journal of Phycology, 2000, 36(2): 321-333. |
| [33] | Cherrier J, Valentine S, Hamill B, Jeffrey WH, Marra JF. Light-mediated release of dissolved organic carbon by phytoplankton. Journal of Marine Systems, 2015, 147: 45-51. DOI:10.1016/j.jmarsys.2014.02.008 |
| [34] | Miller MB, Bassler BL. Quorum sensing in bacteria. Annual Review of Microbiology, 2001, 55(1): 165-199. DOI:10.1146/annurev.micro.55.1.165 |
| [35] | Nealson KH, Hastings JW. Bacterial bioluminescence: its control and ecological significance. Microbiological Reviews, 1979, 43(4): 496-518. DOI:10.1128/MMBR.43.4.496-518.1979 |
| [36] | Bhaskar PV, Bhosle NB. Microbial extracellular polymeric substances in marine biogeochemical processes. Current Science, 2005, 88(1): 45-53. |
| [37] | Gram L, Grossart HP, Schlingloff A, Kiorboe T. Possible quorum sensing in marine snow bacteria: Production of acylated homoserine lactones by Roseobacter strains isolated from marine snow. Applied and Environmental Microbiology, 2002, 68(8): 4111-4116. DOI:10.1128/AEM.68.8.4111-4116.2002 |
| [38] | Van Mooy BAS, Hmelo LR, Sofen LE, Campagna SR, May AL, Dyhrman ST, Heithoff A, Webb EA, Momper L, Mincer TJ. Quorum sensing control of phosphorus acquisition in Trichodesmium consortia. ISME Journal, 2012, 6(2): 422-429. DOI:10.1038/ismej.2011.115 |
| [39] | Flemming HC, Wingender J, Szewzyk U, Steinberg P, Rice SA, Kjelleberg S. Biofilms: an emergent form of bacterial life. Nature Reviews Microbiology, 2016, 14(9): 563-575. DOI:10.1038/nrmicro.2016.94 |
| [40] | Costerton JW, Lewandowski Z, Caldwell DE, Korber DR, Lappin-Scott HM. Microbial biofilms. Annual Review of Microbiology, 1995, 49(1): 711-745. DOI:10.1146/annurev.mi.49.100195.003431 |
| [41] | He XY, Wang JP, Abdoli L, Li H. Mg2+/Ca2+ promotes the adhesion of marine bacteria and algae and enhances following biofilm formation in artificial seawater. Colloids and Surfaces B: Biointerfaces, 2016, 146: 289-295. DOI:10.1016/j.colsurfb.2016.06.029 |
| [42] | Flemming HC, Neu TR, Wozniak DJ. The EPS matrix: The "House of Biofilm cells". Journal of Bacteriology, 2007, 189(22): 7945-7947. DOI:10.1128/JB.00858-07 |
| [43] | Limoli DH, Jones CJ, Wozniak DJ. Bacterial extracellular polysaccharides in biofilm formation and function. Microbiology Spectrum, 2015, 3(3): MB-0011-2014. |
| [44] | Vu B, Chen M, Crawford RJ, Ivanova EP. Bacterial extracellular polysaccharides involved in biofilm formation. Molecules, 2009, 14(7): 2535-2554. DOI:10.3390/molecules14072535 |
| [45] | Okshevsky M, Meyer RL. The role of extracellular DNA in the establishment, maintenance and perpetuation of bacterial biofilms. Critical Reviews in Microbiology, 2015, 41(3): 341-352. |
| [46] | Seymour JR, Ahmed T, Durham WM, Stocker R. Chemotactic response of marine bacteria to the extracellular products of Synechococcus and Prochlorococcus. Aquatic Microbial Ecology, 2010, 59(2): 161-168. |
| [47] | Smriga S, Fernandez VI, Mitchell JG, Stocker R. Chemotaxis toward phytoplankton drives organic matter partitioning among marine bacteria. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(6): 1576-1581. DOI:10.1073/pnas.1512307113 |
| [48] | Zimmerman AE, Martiny AC, Allison SD. Microdiversity of extracellular enzyme genes among sequenced prokaryotic genomes. ISME Journal, 2013, 7(6): 1187-1199. DOI:10.1038/ismej.2012.176 |
| [49] | Zhang ZL, Chen Y, Wang R, Cai RH, Fu YN, Jiao NZ. The fate of marine bacterial exopolysaccharide in natural marine microbial communities. PLoS One, 2015, 10(11): e0142690. DOI:10.1371/journal.pone.0142690 |
| [50] | Mühlenbruch M, Grossart HP, Eigemann F, Voss M. Mini-review: Phytoplankton-derived polysaccharides in the marine environment and their interactions with heterotrophic bacteria. Environmental Microbiology, 2018, 20(8): 2671-2685. DOI:10.1111/1462-2920.14302 |
| [51] | Haynes K, Hofmann TA, Smith CJ, Ball AS, Underwood GJC, Osborn AM. Diatom-derived carbohydrates as factors affecting bacterial community composition in estuarine sediments. Applied and Environmental Microbiology, 2007, 73(19): 6112-6124. DOI:10.1128/AEM.00551-07 |
| [52] | Bohórquez J, McGenity TJ, Papaspyrou S, García-Robledo E, Corzo A, Underwood GJC. Different types of diatom-derived extracellular polymeric substances drive changes in heterotrophic bacterial communities from intertidal sediments. Frontiers in Microbiology, 2017, 8: 245. |
| [53] | Hansell DA, Carlson CA, Repeta DJ, Schlitzer R. Dissolved organic matter in the ocean: a controversy stimulates new insights. Oceanography, 2009, 22(4): 202-211. DOI:10.5670/oceanog.2009.109 |
| [54] | Post WM, Peng TH, Emanuel WR, King AW, Dale VH, DeAngelis DL. The global carbon cycle. American Scientist, 1990, 78(4): 310-326. |
| [55] | Riley GA. Organic aggregates in seawater and the dynamics of their formation and utilization. Limnology and Oceanography, 1963, 8(4): 372-381. DOI:10.4319/lo.1963.8.4.0372 |
| [56] | Sutcliffe WH Jr, Baylor ER, Menzel DW. Sea surface chemistry and langmuir circulation. Deep Sea Research and Oceanographic Abstracts, 1963, 10(3): 233-236. DOI:10.1016/0011-7471(63)90359-0 |
| [57] | Alldredge AL, Passow U, Logan BE. The abundance and significance of a class of large, transparent organic particles in the ocean. Deep Sea Research Part I: Oceanographic Research Papers, 1993, 40(6): 1131-1140. DOI:10.1016/0967-0637(93)90129-Q |
| [58] | Passow U. Transparent exopolymer particles (TEP) in aquatic environments. Progress in Oceanography, 2002, 55(3/4): 287-333. |
| [59] | Turner JT. Zooplankton fecal pellets, marine snow, phytodetritus and the ocean's biological pump. Progress in Oceanography, 2015, 130: 205-248. DOI:10.1016/j.pocean.2014.08.005 |
| [60] | Passow U, Shipe RF, Murray A, Pak DK, Brzezinski MA, Alldredge AL. The origin of transparent exopolymer particles (TEP) and their role in the sedimentation of particulate matter. Continental Shelf Research, 2001, 21(4): 327-346. DOI:10.1016/S0278-4343(00)00101-1 |
| [61] | Azetsu-Scott K, Passow U. Ascending marine particles: Significance of transparent exopolymer particles (TEP) in the upper ocean. Limnology and Oceanography, 2004, 49(3): 741-748. DOI:10.4319/lo.2004.49.3.0741 |
| [62] | Alonso-González IJ, Arístegui J, Lee C, Sanchez-Vidal A, Calafat A, Fabrés J, Sangrá P, Masqué P, Hernández-Guerra A, Benítez-Barrios V. Role of slowly settling particles in the ocean carbon cycle. Geophysical Research Letters, 2010, 37(13): L13608. |
