宋凯#, 郭晓春#, 陈博, 何亚文


上海交通大学生命科学技术学院, 微生物代谢国家重点实验室, 代谢与发育科学国际合作联合实验室, 上海 200240
收稿日期:2020-09-17;修回日期:2020-11-02;网络出版日期:2020-11-18
基金项目:国家重点研发计划(2018YFA0901901);国家自然科学基金(31972231,31772121)
*通信作者:何亚文, Tel/Fax:+86-21-34205709;E-mail:yawenhe@sjtu.edu.cn.
#共同第一作者。
摘要:黄单胞菌是一类引起多种作物病害的病原细菌总称。它们利用自身产生的DSF(Diffusible signaling factor)-家族群体感应(quorum sensing,QS)信号分子感应群体密度,调控致病相关基因的表达。当黄单胞菌培养达到对数生长后期时,培养体系中DSF信号分子浓度迅速降低,呈现一种典型的群体感应信号反转(turnover)现象。编码脂酰辅酶A连接酶的基因rpfB在黄单胞菌生长后期表达量显著提高,敲除rpfB导致DSF生物合成显著提高,因此,RpfB参与DSF-家族QS信号分子的降解,在群体感应后期引导黄单胞菌退出群体感应状态。DSF信号通过RpfC/RpfG双组分系统、环二鸟苷酸和全局性转录因子Clp负调控rpfB的表达。DSF群体感应信号关键降解基因rpfB存在于多种细菌中,表明该信号反转机制相对保守,但其调控的生物学功能因菌而异。
关键词:黄单胞菌群体感应信号反转DSFRpfB
Molecular mechanisms and biological significance of the naturally occurring turnover of DSF-family quorum sensing signal in the phytopathogen Xanthomonas
Kai Song#, Xiaochun Guo#, Bo Chen, Ya-Wen He


State Key Laboratory of Microbial Metabolism, Joint International Research Laboratory of Metabolic & Developmental Sciences, School of Life Sciences & Biotechnology, Shanghai Jiao Tong University, Shanghai 200240, China
Received: 17 September 2020; Revised: 2 November 2020; Published online: 18 November 2020
*Corresponding author: Ya-Wen He, Tel/Fax:+86-21-34205709;E-mail:yawenhe@sjtu.edu.cn.
Foundation item: Supported by the Research Grants of the National Key R&D Program of China (2018YFA0901901) and by the National Natural Science Foundation of China (31972231, 31772121)
#These authors contributed equally to this work.
Abstract: Xanthomonas represents a range of bacterial species that cause diseases in a variety of crops. They produce and use DSF (Diffusible signaling factor)-family quorum sensing (QS) signal to sense cell population to regulate the expression of virulence genes. At post-logic growth phase, the levels of DSF-family signal decreased rapidly, indicating a naturally occurring signal turnover phenomenon in Xanthomonas. The expression levels of rpfB that encodes a putative fatty acyl CoA ligase, significantly increased at logarithmic growth phase. Deletion of rpfB significantly increased the production of DSF-family signal. Therefore, RpfB is involved in the degradation of DSF-family signals, including Xcc to exit from the quorum sensing phase at post-QS phase. DSF-family signal negatively regulates rpfB expression via rpfC/rpfG two-component signaling system, cyclic di-GMP and the global regulator Clp. The RpfB-dependent naturally DSF turnover system is present in a range of bacterial species, representing a conserved mechanism for QS signal turnover. However, the RpfB-regulated biological roles differ from species to species.
Keywords: Xanthomonasquorum sensingnaturally occurring signal turnoverDSFRpfB
群体感应(quorum sensing,QS),是指微生物通过感应自身合成和分泌的信号分子间接感应群体密度,并启动相关基因表达的一种独特通讯机制。不同微生物产生的群体感应信号分子不完全一样,目前公认的微生物群体感应信号分子主要包括酰基高丝氨酸内酯类(N-acylhomoserine lactones,AHLs)、自诱导物2 (Autoinducer,AI-2)、DSF (diffusible signaling factor)家族信号分子、环肽类(cyclic peptides)、丁内酯类(butyrolactones)和喹诺酮类(quinolones)等[1]。完整的微生物群体感应过程基本上分为3个时期:(1)群体感应前期(Pre-QS phase):微生物在增殖过程中合成和分泌QS信号分子,信号分子胞外浓度随着群体密度增加而积累,为进入群体感应状态做准备。(2)群体感应期(QS phase):当胞外QS信号分子浓度达到某一阈值,可以被微生物相应的受体感应,启动相关基因表达和蛋白质合成,行使相关的生物学功能。(3)群体感应后期(Post-QS phase):群体感应期是一个高度耗能过程,不能够持续太久;当必要的生理活动完成以后,微生物需要尽快退出这种高耗能状态,恢复到群体感应前的状态或转入另外一种低耗能状态,才能有效生存和适应环境[2-3]。微生物在在群体感应后期退出群体感应状态的分子机制因不同系统而异,目前初步阐明的机制主要分为两类:(1)微生物在感应后期迅速表达特异的降解酶,降解群体感应信号;(2)微生物通过转录水平降低信号合成酶基因表达,减少群体感应信号的生物合成[1, 3]。
黄单胞菌是黄单胞菌属(Xanthomonas)细菌的统称,因其合成芳烃多烯类黄色色素而得名。据统计,黄单胞菌属有26个种、50多个亚种,大部分成员是植物病原细菌,可以侵染400多种主粮和经济作物,包括水稻、小麦、柑橘、番茄、胡椒、木薯、香蕉、大豆、十字花科蔬菜和油料作物等[4-5]。野油菜黄单胞菌野油菜致病变种(Xanthomonas campestris pv. campestris,简称Xcc)是十字花科植物黑腐病致病菌,Xanthomonas oryzae pv. oryzae (Xoo)是水稻白叶枯病的致病菌;两者都是分子植物病理学研究领域的模式菌株[6]。Xcc和Xoo产生的QS信号分子主要包括DSF、BDSF、CDSF和IDSF等一类中链不饱和脂肪酸,统称为DSF-家族群体感应信号分子[7-9] (图 1)。经过20多年的深入研究,Xcc和Xoo中DSF-家族信号分子的传导途径、生物合成与调控机制以及调控的生物学功能基本上得以阐明[3, 10-15]。
 |
| 图 1 从黄单胞菌培养体系中分离和鉴定的DSF-家族群体感应信号分子[3] Figure 1 The DSF-family quorum sensing signals identified from Xanthomonas cultures[3]. |
| 图选项 |
早在1997年,Barber等[16]就观察到Xcc中存在群体感应信号反转现象。然而直到2014年以后,RpfB-依赖的群体感应信号反转机制在Xcc和Xoo中才分别得以阐明。本文综述了黄单胞菌群体感应信号反转现象的发现、分子机制、调控机制和生物学意义,并展望了未来有待回答的关键科学问题。
1 黄单胞菌中群体感应信号反转现象的发现 在DSF的化学结构鉴定之前,Barber等[16]和Slater等[17]就发现在Xcc培养过程中,DSF活性在静止生长早期水平较高,随后则快速降低;Wang等[7]鉴定了DSF的化学结构后,进一步证实了DSF信号分子浓度在Xcc生长早期至对数期较低,随后迅速升高,在后期又迅速降低;在Xoo KACC10331培养过程中,He等[8]发现BDSF水平在静止生长早期达到高峰,随后降低。这些现象都表明黄单胞菌中存在天然的群体感应信号反转机制。
2 RpfB参与DSF-家族信号分子的降解 在Xcc基因组中,rpfB基因位于DSF信号分子关键合成酶基因rpfF上游,编码一个脂酰辅酶A连接酶。早期研究分析了rpfB突变体的表型,推测RpfB参与DSF信号分子的生物合成[16-17]。但是,在Xcc rpfB突变体中回补表达rpfB基因不能恢复DSF的生物合成,说明RpfB不参与DSF信号分子的生物合成,早期观察到的结果很可能是由于突变rpfB影响了rpfF的表达。Almeida等[18]利用薄层色谱分析苛养木杆菌(Xylella fastidiosa) rpfB突变体的全脂肪酸图谱,发现RpfB影响DSF类脂肪酸的分布,推测RpfB可能参与DSF信号分子的加工过程。Bi等[19]对RpfB蛋白进行更加详细的生化和遗传分析,发现rpfB可以替代大肠杆菌β-氧化途径中的脂酰辅酶A连接酶(Fatty acyl Coenzyme A Ligase,FCL)基因fadD;并且Xcc中rpfB缺失突变体不能在以脂肪酸作为唯一碳源的培养基中生长,这些结果说明RpfB具有脂酰辅酶A连接酶活性。在体外反应条件下,纯化的RpfB能够将不同链长的脂肪酸转变为其辅酶A酯,因此Bi等[19]认为经RpfB激活的脂酰辅酶A酯在体内可能被菌株用于膜脂合成,也可能经脂肪酸β-氧化途径被进一步代谢。但是,在体外酶活性检测实验中,RpfB催化DSF和BDSF信号分子形成DSF-CoA和BDSF-CoA的活性很弱,因此,作者推测RpfB通过拮抗DSF合成酶RpfF的硫酯酶活性而在XCC致病机制中发挥重要作用[19]。
为了进一步研究RpfB的酶活性,Zhou等[9]建立了基于液相色谱—质谱(LC-MS)联用方法定量检测DSF。利用该检测方法,Zhou等[9]重复了Bi等[19]所做的RpfB体外酶活实验,证实在体外条件下纯化的RpfB对DSF和BDSF的活性很弱。但敲除Xcc或Xoo中的rpfB能够显著增加DSF和BDSF的生物合成,在Xcc中过表达rpfB或fadD则显著降低这两种信号分子的生物合成;rpfB过表达菌株能快速降解外源添加的DSF和BDSF,而敲除株则无降解能力[9, 20]。点突变连接酶活性必需氨基酸残基E365显著影响RpfB降解DSF信号分子的活性。上述结果表明:在Xcc和Xoo中RpfB参与DSF和BDSF信号分子的降解,其FCL活性是DSF信号降解所必需的。我们最近的结果也表明:Xcc中参与脂肪酸β-氧化的基因也是降解DSF所必需的。因此,脂肪酸β-氧化途径是DSF降解的重要途径之一。
在体外和活体条件下,RpfB对DSF家族信号分子表现出不同活性的原因尚待进一步研究。Zhou等[3]推测至少存在两种可能性,一是RpfB作用于DSF和BDSF需要其它因子,例如辅酶、金属离子或特殊盐离子,这些因子可能仅存在于黄单胞菌胞内;二是RpfB在体内和体外反应体系中具备不同的构象,具有不同的酶活性。明确哪种可能性将有助于更深入了解RpfB依赖的信号反转机制。
3 DSF信号传导途径负调控rpfB的表达 Zhou等[13]和Wang等[20]利用实时定量荧光PCR和Western Blot方法分别检测了Xcc和Xoo生长过程中rpfB的表达水平,发现其表达模式与生长时期密切相关。在对数生长中期(接种后12 h),rpfB mRNA水平较低;至对数生长后期(接种后24 h),mRNA水平显著提高;在稳定生长早期(接种后36 h)仍保持高转录水平,之后rpfB mRNA水平下降。RpfB蛋白水平在对数生长中期较低,在对数生长后期轻微增加,直到稳定生长早期,蛋白水平达到最大值,随后降低。rpfB这种周期表达模式与DSF信号分子的含量随生长周期变化的趋势一致,进一步支持了RpfB参与DSF信号降解的结论。
RpfF是DSF信号分子生物合成途径中的关键酶。在DSF-缺失的rpfF突变体中,rpfB mRNA水平和RpfB蛋白水平明显高于野生型XC1菌株。外源添加不同浓度DSF到突变体ΔrpfF中也影响rpfB的表达:当外源DSF浓度在0.5-2.5 μmol/L之间时,rpfB的表达量低于野生型水平;当外源DSF浓度高于10.0 μmol/L时,DSF显著诱导rpfB的转录,其mRNA水平和蛋白水平明显高于野生型XC1菌株。但是,添加DSF到DSF-缺失的双突变菌株ΔrpfCΔrpfF中却对rpfB的表达无明显差异。由此可见,DSF信号分子并不直接调控RpfB的表达,而是依赖其信号传导途径[13]。
在Xcc和Xoo中,DSF群体感应信号传导途径包括RpfC/RpfG双组分系统、二级信使环二鸟苷酸(cyclic-di-GMP)和全局性转录因子Clp等[3, 12, 21]。早期S1核酸酶保护实验发现rpfC突变导致rpfB表达上调[17];进一步敲除Xcc和Xoo中的rpfC、rpfG或clp后,rpfB的转录水平和蛋白水平都显著提高,在Δclp突变株体内rpfB的表达水平最高。体外电泳迁移率变动分析(EMSA)实验结果进一步证实Clp能够直接结合在rpfB基因的启动子区域,结合位点为AATGC-N6-GCATC基序(Xcc:AATGC-tgctgc-GCATC,Xoo:AATGC- tgatct-GCATC)[13, 20]。
4 黄单胞菌侵染寄主植物过程中进入和退出群体感应生理状态模式图 综合已有研究结果,Zhou等[3]将植物病原黄单胞菌在寄主植物体内侵染增殖过程中的群体感应分为3个时期,提出了如下模式图:(1)群体感应前期(Pre-QS phase):黄单胞菌群体密度和胞外DSF浓度均低于特定的阈值,DSF信号分子不足以激活其受体RpfC,RpfC通过其REC结构域与DSF合成酶RpfF结合形成复合体,阻止DSF合成前体进入RpfF,将DSF的生物合成限制在低水平;细胞内高水平的二级信使c-di-GMP与转录因子Clp结合;此复合体一方面结合到rpfB基因启动子区域,抑制rpfB转录;另一方面,结合了c-di-GMP的Clp不能与致病相关基因(如engXCA)的启动子区域结合,致病基因也不表达。(2)群体感应期(QS phase):黄单胞菌胞外DSF浓度达到阈值,DSF分子被RpfC受体感应;RpfC先自我磷酸化,再通过磷酸化接力机制磷酸化RpfG,激活其磷酸二酯酶活性,降解c-di-GMP为GMP;没有c-di-GMP结合的Clp紧密结合在致病基因engXCA的启动子区域,启动致病因子开始表达;没有c-di-GMP结合的Clp从rpfB启动子区脱落下来,rpfB转录得以启动。(3)群体感应后期(Post-QS phase):黄单胞菌生活空间扩大导致DSF群体密度被部分稀释,DSF信号同时被RpfB-依赖的途径降解,胞外DSF密度迅速下降到阈值以下,导致RpfC去磷酸化,与RpfF重新结合;去磷酸化的RpfG失去c-di-GMP磷酸二酯酶活性,胞内c-di-GMP逐步恢复;结合于engXCA启动子区域的Clp减少,部分Clp/c-di-GMP复合体恢复结合于rpfB的启动子区域,导致rpfB和engXCA的表达水平都显著降低(图 2)。
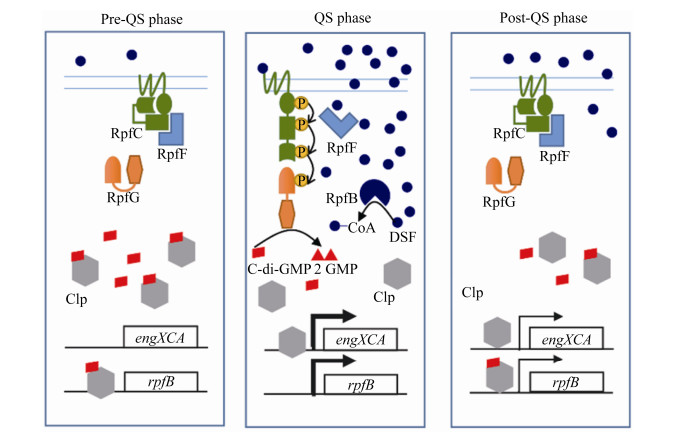 |
| 图 2 黄单胞菌进入和退出群体感应生理状态机制模式图[3] Figure 2 Proposed Model for Xcc entering into and exiting from quorum sensing phase[3]. |
| 图选项 |
5 DSF群体感应信号反转的生物学意义 Xcc是一类引起维管束病害的病原菌,进入十字花科植物后在其维管束内有限的空间内繁殖。我们最近的研究结果表明:BDSF是Xcc侵染大白菜叶片过程中产生的主要群体感应信号分子,在体外BDSF与DSF分子表现出相似的致病因子诱导功能[22]。进入植物维管束后,Xcc开始快速繁殖;当Xcc群体密度达到所需阈值时,通过群体感应机制产生大量的胞外酶和胞外多糖;胞外酶能降解植物细胞获取营养,扩大Xcc生存空间,促进Xcc在维管束内的侵染;胞外多糖能够帮助Xcc抵抗植物免疫反应和堵塞植物水分等的运输[12, 23]。当Xcc获得了足够的营养和生长空间,需要及时退出群体感应状态,停止合成胞外多糖和胞外酶,进入增殖状态。DSF信号反转的这种生物学功能得到系列实验结果的支持:敲除Xcc分离株“XC1”和“8004”中的rpfB后,Xcc不能退出群体感应状态,其胞外蛋白酶、淀粉酶和纤维素酶活性以及胞外多糖产量持续增加,对萝卜叶片的致病性都显著增加;过表达rpfB则显著降低了胞外酶和胞外多糖的产量以及对萝卜叶片的致病性[13]。
Xoo引起水稻叶片维管束病害,分离株“PXO99A”中rpfB的生物学功能与上述Xcc中rpfB的功能稍有不同。敲除rpfB显著降低Xoo胞外淀粉酶和胞外多糖的合成,减弱对水稻品种IRBB3和IR24的致病性,但胞外蛋白酶和纤维素酶的活性与野生型菌株无明显差别[20]。在“PXO99A”野生型中敲除rpfB不影响菌黄素的生物合成,在rpfB和rpfC双敲突变体中敲除rpfB显著降低菌黄素的产量[20]。这些结果充分证明RpfB依赖的群体感应信号反转机制与病原菌的致病性和环境适应性密切相关,DSF信号反转的生物学功能很可能因菌而异。
6 DSF信号合成与降解基因存在于多种微生物中 rpfB、rpfF、rpfC、rpfG基因簇和clp存在于所有已测序的黄单胞菌属(Xanthomonas)细菌中。同源的基因簇也存在于苛养木杆菌(Xylella fastidiosa)、寡养单胞菌(Stenotrophomonas maltophilia)、溶杆菌(Lysobacter dokdonensis) DS-58、褐色假黄单胞菌(Pseudoxanthomonas spadix) BDA-59中,说明这些非黄单胞菌属细菌可能也利用这种机制进入和退出群体感应状态。最近,Li等[24]在产酶溶杆菌中鉴定了2个RpfB同源蛋白,参与脂肪酸代谢,影响代谢产物HSAF的生物合成。此外,鞭毛甲基小杆菌(Methylobacillus flagellatus)和脱氮硫杆菌(Thiobacillus denitrificans)中,甚至在铜绿假单胞菌(Pseudomonas aeruginosa)和伯克霍尔德菌(Burkholderia cenocepacia)中也存在RpfB的同源蛋白[3]。由此可见,RpfB依赖的群体感应信号反转现象可能存在于多种细菌中,具有一定的保守性。
7 总结和展望 植物病原黄单胞菌在侵染过程中能产生和利用DSF-家族群体感应信号分子感应群体密度,调控致病因子表达,降解植物细胞,获得生长所需营养和空间。在群体感应后期,又能够及时诱导具有脂酰辅酶A连接酶活性的RpfB表达,降解DSF信号,退出群体感应状态,恢复增殖状态。通过这种周期性致病因子表达调控机制,黄单胞菌能够在植物体内引起系统侵染,造成病害。
目前,植物病原黄单胞菌如何进入群体感应状态的分子机制相对比较明确,但是黄单胞菌如何退出DSF-依赖的群体感应状态研究才刚刚开始。虽然已经明确了脂酰辅酶A连接酶RpfB是群体感应信号降解所需的关键酶,但还有一系列科学问题有待我们进一步回答:
(1) RpfB的生化活性、催化机理和结构基础需要深入研究。RpfB蛋白在体内和体外反应条件下对DSF群体感应信号分子表现出不同酶活性的根本原因是什么?
(2) RpfB降解DSF的通路尚未完全阐明。DSF-家族群体感应信号属于中链脂肪酸,RpfB与脂肪酸β-氧化途径中的FadD活性相似,DSF降解是否也是通过β-氧化途径?如果是,是经脂肪酸β-氧化途径彻底降解为乙酰辅酶A参与三羧酸循环,还是以中间代谢产物脂酰辅酶A的形式被其它途径利用?
(3) 除了DSF信号传导途径外,是否还有其它信号传导系统或基因也参与调控DSF信号降解?Xcc胞内有30多套基因编码二级信使c-di-GMP代谢相关的酶,是否其中有基因参与调控群体感应信号降解?除了转录因子Clp外,是否还有其它转录因子通过其它未知途径调控rpfB的表达?
(4) 在黄单胞菌侵染植物过程中,植物源代谢产物是否影响DSF-依赖的群体感应及群体感应信号反转?DSF-依赖的群体感应及其信号反转机制是否可以用作作物病害防控的新靶标?
References
| [1] | Grandclément C, Tannières M, Moréra S, Dessaux Y, Faure D. Quorum quenching: role in nature and applied developments. FEMS Microbiology Reviews, 2016, 40(1): 86-116. DOI:10.1093/femsre/fuv038 |
| [2] | Zhang HB, Wang LH, Zhang LH. Genetic control of quorum-sensing signal turnover in Agrobacterium tumefaciens. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(7): 4638-4643. DOI:10.1073/pnas.022056699 |
| [3] | Zhou L, Zhang LH, Cámara M, He YW. The DSF family of quorum sensing signals: diversity, biosynthesis, and turnover. Trends in Microbiology, 2017, 25(4): 293-303. DOI:10.1016/j.tim.2016.11.013 |
| [4] | Ferreira-Tonin M, Rodrigues-Neto J, Harakava R, Lanza Destéfano SA. Phylogenetic analysis of Xanthomonas based on partial rpoB gene sequences and species differentiation by PCR-RFLP. International Journal of Systematic and Evolutionary Microbiology, 2012, 62(Pt 6): 1419-1424. |
| [5] | Feng J. Recent advances in taxonomy of plant pathogenic bacteria. Scientia Agricultura Sinica, 2017, 50(12): 2305-2314. (in Chinese) 冯洁. 植物病原细菌分类最新进展. 中国农业科学, 2017, 50(12): 2305-2314. DOI:10.3864/j.issn.0578-1752.2017.12.011 |
| [6] | Mansfield J, Genin S, Magori S, Citovsky V, Sriariyanum M, Ronald P, Dow M, Verdier V, Beer SV, Machado MA, Toth I, Salmond G, Foster GD. Top 10 plant pathogenic bacteria in molecular plant pathology. Molecular Plant Pathology, 2012, 13(6): 614-429. DOI:10.1111/j.1364-3703.2012.00804.x |
| [7] | Wang LH, He YW, Gao YF, Wu JE, Dong YH, He CZ, Wang SX, Weng LX, Xu JL, Tay L, Fang RX, Zhang LH. A bacterial cell-cell communication signal with cross-kingdom structural analogues. Molecular Microbiology, 2004, 51(3): 903-912. |
| [8] | He YW, Wu JE, Cha JS, Zhang LH. Rice bacterial blight pathogen Xanthomonas oryzae pv. oryzae produces multiple DSF-family signals in regulation of virulence factor production. BMC Microbiology, 2010, 10(1): 187. DOI:10.1186/1471-2180-10-187 |
| [9] | Zhou L, Yu YH, Chen XP, Diab AA, Ruan LF, He J, Wang HH, He YW. The multiple DSF-family QS signals are synthesized from carbohydrate and branched-chain amino acids via the FAS elongation cycle. Scientific Reports, 2015, 5(1): 13294. DOI:10.1038/srep13294 |
| [10] | He YW, Wang C, Zhou L, Song HW, Dow JM, Zhang LH. Dual signaling functions of the hybrid sensor kinase RpfC of Xanthomonas campestris involve either phosphorelay or receiver domain-protein interaction. Journal of Biological Chemistry, 2006, 281(44): 33414-33421. DOI:10.1074/jbc.M606571200 |
| [11] | He YW, Ng AYJ, Xu M, Lin K, Wang LH, Dong YH, Zhang LH. Xanthomonas campestris cell-cell communication involves a putative nucleotide receptor protein Clp and a hierarchical signalling network. Molecular Microbiology, 2007, 64(2): 281-292. DOI:10.1111/j.1365-2958.2007.05670.x |
| [12] | He YW, Zhang LH. Quorum sensing and virulence regulation in Xanthomonas campestris. FEMS Microbiology Reviews, 2008, 32(5): 842-857. DOI:10.1111/j.1574-6976.2008.00120.x |
| [13] | Zhou L, Wang XY, Sun S, Yang LC, Jiang BL, He YW. Identification and characterization of naturally occurring DSF-family quorum sensing signal turnover system in the phytopathogen Xanthomonas. Environmental Microbiology, 2015, 17(11): 4646-4658. DOI:10.1111/1462-2920.12999 |
| [14] | Cai Z, Yuan ZH, Zhang H, Pan Y, Wu Y, Tian XQ, Wang FF, Wang L, Qian W. Fatty acid DSF binds and allosterically activates histidine kinase RpfC of phytopathogenic bacterium Xanthomonas campestris pv. campestris to regulate quorum-sensing and virulence. PLoS Pathogens, 2017, 13(3): e1006304. |
| [15] | Song K, Zhou L, He YW. Research progress in the biosynthetic pathway and regulatory mechanisms of DSF-family quorum sensing signals. Microbiology China. (in Chinese) 宋凯, 周莲, 何亚文. DSF-家族群体感应信号生物合成途径与调控机制研究进展. 微生物学通报. DOI:10.13344/j.microbiol.china.200710 |
| [16] | Barber CE, Tang JL, Feng JX, Pan MQ, Wilson TJG, Slater H, Dow JM, Williams P, Daniels MJ. A novel regulatory system required for pathogenicity of Xanthomonas campestris is mediated by a small diffusible signal molecule. Molecular Microbiology, 1997, 24(3): 555-566. DOI:10.1046/j.1365-2958.1997.3721736.x |
| [17] | Slater H, Alvarez-Morales A, Barber CE, Daniels MJ, Dow JM. A two-component system involving an HD-GYP domain protein links cell-cell signalling to pathogenicity gene expression in Xanthomonas campestris. Molecular Microbiology, 2000, 38(5): 986-1003. |
| [18] | Almeida RPP, Killiny N, Newman KL, Chatterjee S, Ionescu M, Lindow SE. Contribution of rpfB to cell-to-cell signal synthesis, virulence, and vector transmission of Xylella fastidiosa. Molecular Plant-Microbe Interactions, 2012, 25(4): 453-462. DOI:10.1094/MPMI-03-11-0074 |
| [19] | Bi HK, Yu YH, Dong HJ, Wang HH, Cronan JE. Xanthomonas campestris RpfB is a fatty Acyl-CoA ligase required to counteract the thioesterase activity of the RpfF Diffusible Signal Factor (DSF) synthase. Molecular Microbiology, 2014, 93(2): 262-275. DOI:10.1111/mmi.12657 |
| [20] | Wang XY, Zhou L, Yang J, Ji GH, He YW. The RpfB-Dependent Quorum Sensing Signal Turnover system is required for adaptation and virulence in rice bacterial blight pathogen Xanthomonas oryzae pv. oryzae. Molecular Plant-Microbe Interactions, 2016, 29(3): 220-230. DOI:10.1094/MPMI-09-15-0206-R |
| [21] | Deng YY, Wu JE, Tao F, Zhang LH. Listening to a new language: DSF-based quorum sensing in Gram-negative bacteria. Chemical Reviews, 2011, 111(1): 160-173. |
| [22] | Diab AA, Cao XQ, Chen H, Song K, Zhou L, Chen B, He YW. BDSF is the predominant in-planta quorum-sensing signal used during Xanthomonas campestris Infection and pathogenesis in chinese cabbage. Molecular Plant-Microbe Interactions, 2019, 32(2): 240-254. DOI:10.1094/MPMI-07-18-0197-R |
| [23] | He YW, Xu M, Lin K, Ng YJA, Wen CM, Wang LH, Liu ZD, Zhang HB, Dong YH, Dow JM, Zhang LH. Genome scale analysis of diffusible signal factor regulon in Xanthomonas campestris pv. campestris: identification of novel cell-cell communication-dependent genes and functions. Molecular Microbiology, 2006, 59(2): 610-622. DOI:10.1111/j.1365-2958.2005.04961.x |
| [24] | Li KH, Hou RX, Xu HY, Wu GC, Qian GL, Wang HH, Liu FQ. Two functional fatty acyl Coenzyme A ligases affect free fatty acid metabolism to block biosynthesis of an antifungal antibiotic in Lysobacter enzymogenes. Applied and Environmental Microbiology, 2020, 86(10): e00309-20. |
