祝友朋1,2, 韩长志1,3


1. 西南林业大学生物多样性保护学院, 云南 昆明 650224;
2. 西南林业大学研究生院, 云南 昆明 650224;
3. 云南省森林灾害预警与控制重点实验室, 云南 昆明 650224
收稿日期:2020-03-16;修回日期:2020-06-17;网络出版日期:2020-08-17
基金项目:云南省应用基础研究计划(2018FG001-028);国家自然科学基金(31960314);西南林业大学大学生创新创业项目(2018Y012)
*通信作者:韩长志. Tel/Fax:+86-871-63862918; E-mail:hanchangzhi2010@163.com.
摘要:[目的] G蛋白信号调控因子(RGS)作为G蛋白信号转导途径的负调控因子,在植物病原菌的致病性和有性生殖调控方面发挥着重要作用。研究真菌中RGS蛋白类型与其理化性质及特征的关系,为今后深入开展不同真菌中具有不同类别RGS的功能解析打下坚实的理论基础。[方法] 前期对模式生物、病原菌、非致病菌等49个真菌中229个RGS蛋白序列进行找寻,并根据其保守结构域和同源性确定RGS类型有DEP-RGS、RGS-TM、PXA-RGS-PX、RGS、RGS-PAS-PAC、TM-RGS等6类。利用蛋白质数据库、ProtComp v9.0、PHD以及MEME等网站对上述RGS蛋白进行理化性质、亚细胞定位以及二级结构、基序等特征分析。[结果] 上述不同类别的RGS蛋白具有明显的类别特征性,同时,也具有以下共同特征:理论等电点集中在6.01-7.00;不稳定性系数集中在40.01-60.00;95%以上的RGS蛋白属于亲水性蛋白;亲水性最强氨基酸残基存在较多的是R、D、E、Q、N;疏水性最强氨基酸残基存在较多的L、A、V、F、I;二级结构组成特征为b折叠较少;转运肽情况尚未明确;亚细胞定位多集中在细胞核。[结论] 真菌中6类RGS蛋白的理化性质具有一定的共同特征,但不同类别的RGS蛋白也具有明显的类别特征,主要表现在保守结构域、二级结构、等电点、转运肽和亚细胞定位情况。
关键词:真菌G蛋白信号调控因子理化性质关系解析生物信息学
Relationship between RGS protein types and physicochemical properties in fungi
Youpeng Zhu1,2, Changzhi Han1,3


1. College of Biodiversity Conservation, Southwest Forestry University, Kunming 650224, Yunnan Province, China;
2. Graduate School of Southwest Forestry University, Kunming 650224, Yunnan Province, China;
3. The Key Laboratory of Forest Disaster Warning and Control of Yunnan Province, Kunming 650224, Yunnan Province, China
Received: 16 March 2020; Revised: 17 June 2020; Published online: 17 August 2020
*Corresponding author: Han Changzhi. Tel/Fax:+86-871-63862918; E-mail:hanchangzhi2010@163.com.
Foundation item: Supported by the Yunnan Province Applied Basic Research Program Project, China (2018FG001-028), by the National Natural Science Foundation of China (31960314) and by the Southwest Forestry University Students' Innovation and Entrepreneurship Project, China (2018Y012)
Abstract: [Objective] As a negative regulator of G protein signal transduction pathway, G protein signal regulator factor plays an important role in the pathogenicity asexual reproduction regulation of plant pathogens. To identify the relationship between RGS protein types and their physicochemical properties in fungi. [Methods] We analyzed 229 of previously identified RGS protein sequences in 49 fungi including model organism, pathogenic bacteria and non-pathogenic bacteria, and identified 6 proteins according to their conserved domains, such as DEP-RGS, RGS-TM, PXA-RGS-PX, RGS, RGS-PAS-PAC and TM-RGS. We used the protein database, ProtComp v9.0, PHD and MEME to analyze the physicochemical properties, subcellular localization, secondary structure and motif of the above RGS proteins. [Results] The above-mentioned different types of RGS proteins had obvious characteristic futures, and following common characteristics: theoretical isoelectric point was between 6.01 and 7.00, instability coefficients were between 40.01 and 60.00, more than 95% of RGS proteins were hydrophilic protein, the strongest hydrophilic amino acid residues were arginine, aspartic acid, glutamic acid, glutamine, asparagine, the strongest hydrophobic amino acid residues were leucine, alanine, valine, phenylalanine, isoleucine, the secondary structure was characterized by less Beta strand, situation for the transit peptide situation is unclear, and subcellular location is more concentrated in the nucleus. [Conclusion] The physicochemical properties of the six RGS proteins have some common characteristics, but different types of RGS proteins also have obvious category characteristics, mainly in the conserved domain, secondary structure, isoelectric point, transport peptide and subcellular localization.
Keywords: fungusG protein signal regulator factorphysical and chemical propertiesrelationship analysisbioinformatics
G蛋白信号途径作为真菌中诸多细胞信号转导途径之一,参与调控真菌生长发育、生殖以及侵染致病等相关过程[1]。G蛋白信号调控因子(regulators of G-protein signaling,RGS)作为该途径的负调控因子[2],主要功能是通过促进Gα偶联的GTP水解,使Gα和Gβγ亚基发生重新聚合[3–5],导致G蛋白失活而实现快速关闭G蛋白信号途径[6]。国内外****就众多模式生物真菌中含有的RGS数量和功能开展了诸多研究工作,明确酿酒酵母Saccharomyces cerevisiae S288c有4个RGS蛋白(Sst2、Res2、Rax1和Mdm1),影响着有性生殖、细胞极性和细胞遗传[7–8];构巢曲霉Aspergillus nidulans有5个RGS蛋白(FIbA、RgsA、RgsB、RgsC和GprK),影响着营养生长、压迫反应、无性产孢、气生菌丝和色素的产生[9–11];同时,对于植物病原真菌中RGS蛋白开展了诸多研究工作,明确稻瘟病菌Magnaporthe oryzae有8个RGS蛋白[12](MoRGS1–MoRGS8),影响着营养生长、有性/无性产孢、附着胞分化和侵染菌丝的生长[13–14];轮枝镰孢菌Fusarium verticillioides有6个RGS蛋白(RgsA、ResB、ResC1、RgsC2、FlbA1和FlbA2),影响着分生孢子的形成和伏马菌素B1的合成[15];玉米赤霉菌Gibberella zeae有7个RGS蛋白(FgFIbA、FgFIbB、FgRgsA、FgRgsB、FgRgsB2、FgRgsC和FgGprK),影响着营养生长、毒素产生、有性/无性产孢和致病性[16];新型隐球菌Cryptococcus neoformans有3个(Crg1、Crg2和Crg3)[17];禾谷炭疽菌Colletotrichum graminicola有6个(CgRGS1–CgRGS6)[18];希金斯炭疽菌C. higginsianum有5个(ChRGS1– ChRGS5)[19];以及引起橡胶炭疽病的胶孢炭疽菌(C. gloeosporioides) RGS数量有10个(CgRGS1– CgRGS10),影响着营养生长、分生孢子产生、细胞壁完整性及致病力[20–22]。上述研究已明确RGS在真菌的菌丝发育、产孢、次生代谢产物及色素合成,以及致病性和有性生殖调控等方面发挥着重要作用[23]。另外,南京农业大学张正光教授研究团队在稻瘟病菌M. oryzae中,通过对RGS结构域互换载体、并将其回补到相应的基因敲除突变体中,明确该菌中RGS7保守结构域能够恢复RGS1突变体的缺陷表型,说明RGS1和RGS7蛋白中的RGS结构域所具有的功能是一致的,尽管如此,将其他6个RGS结构域替换RGS1的保守结构域后发生了定位的变化,并不能恢复缺陷突变体的表型[14]。然而,上述研究更多关注的是某种真菌中RGS的数量和功能等方面的研究,尚未见不同RGS类型与其理化性质及特征关系的研究。
同时,学术界对于生物中RGS蛋白的分类依据主要为RGS蛋白氨基酸之间同源性和保守结构域的差异性[24]。前人根据RGS氨基酸同源性,把30多种RGS蛋白分为了6个亚家族[24],不同的亚家族含有不同的结构域。前期,本研究团队以49个全基因组序列已经释放的真菌(构巢曲霉A. nidulans、土曲霉A. terreus、棒曲霉A. clavatus、烟曲霉A. fumigatus、费氏曲霉A. fischeri、米曲霉A. oryzae、黄曲霉A. flavus、黑曲霉A. niger、假禾谷镰刀菌Fusarium pseudograminearum、轮枝镰刀菌F. verticillioides、藤黑镰孢菌F. fujikuroi、腐皮镰刀菌F. solain、尖孢镰刀菌F. oxysporum、禾谷镰刀菌F. graminearum、里氏木霉Trichoderma reesei、绿木霉T. virens、禾谷炭疽菌C. graminicola、希金斯炭疽菌C. higginsianum、西瓜炭疽菌C. orbiculare、胶孢炭疽菌C. gloeosporioides、大丽轮枝菌Verticillium dahlia、毕赤酵母Komagataella pastoris、解脂耶氏酵母Yarrowia lipolytica、棉阿舒囊霉Ashbya gossypii、酿酒酵母S. cerevisiae、日本裂殖酵母Schizosaccharomyces japonicus、粟酒裂殖酵母S. pombe、低温裂殖酵母S. cryophilus、八孢裂殖酵母S. octosporus、松杨栅锈菌Melampsora laricipopulina、小麦秆锈病菌Puccinia graminis、叶锈菌Puccinia triticina、圆核腔菌Pyrenophora teres、小麦颖枯病菌Parastagonospora nodorum、小球腔菌Leptosphaeria maculans、小麦全蚀病菌Gaeumannomyces graminis、稻瘟菌M. oryzae、草坪斑枯病菌Magnaporthe poae、玉米丝黑穗病菌Sporisorium reilianum、玉米黑粉菌Ustilago maydis、核盘菌Sclerotinia sclerotiorum、灰霉菌Botrytis cinerea、松穴褥盘孢菌Dothistroma septosporum、小麦叶枯病菌Zymoseptoria tritici、粗糙脉孢霉Neurospora crassa、银耳Cryptococcus neoformans、松露Tuber melanosporum、禾本科布氏白粉菌Blumeria graminis、花药黑粉菌Microbotryum violaceum)为研究对象,利用OrthoVenn2进行RGS同源基因比对、根据酿酒酵母S. cerevisiae S288C的4个RGS氨基酸序列在线BLASTp比对以及NCBI数据库关键词检索等方法,并通过SMART进行保守结构域分析,得到229个RGS蛋白序列,并根据RGS中保守结构域和同源性进行分类,可以划分为6类(Ⅰ–Ⅵ型),保守结构域类型分别为RGS-TM、DEP-RGS、PXA-RGS-PX、RGS、RGS-PAS-PAC、TM-RGS,其数量分别为56、58、46、44、17、8个。其中,DEP结构域是一个由约80个氨基酸残基组成的球形结构域,主要功能是将含有DEP结构域的蛋白质靶向特定的亚细胞膜位点,在靶向G蛋白偶联的信号传导途径中发挥选择性作用;PX结构域是一个长约120个氨基酸残基组成的能够与磷脂结合的序列,作为分拣信号将RGS蛋白定位到不同的地方,发挥多种功能,如细胞信号传导、水泡运输、蛋白质分选和脂质修饰等,而PXA结构域能够与PX结合,在液泡形态分化和将蛋白定位在液泡中发挥着作用;PAS结构域则参与许多信号蛋白的传递,被用作信号传感器,PAC域出现在所有已知PAS域的C末端,有助于PAS结构域折叠[25]。本研究基于此,对49个真菌中6类共229个RGS蛋白的理化性质、不稳定系数、疏水性、二级结构、转运肽及亚细胞定位、基序等特性开展生物信息学预测分析,明确不同RGS类型与其理化性质及特征关系,以期为今后深入开展植物病原丝状真菌中的RGS功能解析打下坚实的理论基础。
1 材料和方法 1.1 RGS蛋白序列来源 前期所明确的49个真菌中229个RGS蛋白序列。
1.2 RGS蛋白理化性质分析 运用蛋白质数据库分析RGS蛋白的理化性质[26],包括理论等电点、不稳定性系数、总亲水性等;采用PHD分析RGS蛋白的二级结构[27];采用Protscale分析RGS蛋白的疏水性;采用TargetP 1.1 Server分析RGS蛋白的转运肽[28];采用ProtComp v9.0分析RGS蛋白的亚细胞定位情况;采用MEME分析RGS蛋白的motif,然后对分析数据进行整理归纳[29]。
2 结果和分析 2.1 不同类别RGS蛋白具有不同的motif 根据RGS中保守结构域和同源性进行分类,可以划分为6类(Ⅰ–Ⅵ型),保守结构域类型分别为RGS-TM、DEP-RGS、PXA-RGS-PX、RGS、RGS-PAS-PAC、TM-RGS,然后对不同类别的RGS蛋白序列开展MEME分析,结果表明6类RGS蛋白具有不同的motif (图 1)。就不同类别的RGS而言,在基序组成方面不尽相同,主要表现为:Ⅰ型为QQRSVDYLDFWLDVAQHMSLCRHY VRELRRS和EDDGRDDPEVFDVAKDYVFQAM ERDAFPGFLRMKALGNLVP;Ⅱ型为DGIKEILAQAYGIYNAFLAPGSPCELNIDHQLRNSLATRMTKAVGQDVAM;Ⅲ型为DVLRDASGLSYFME FMDRQRLMPLVQFWLVVDGFRNPLEDD;Ⅳ型为RPSLDEILABTAPPPWTLSAFMAYLSQNHCL ETLEFTLDAKRYRKTYEEL和YIJPCAPREVNLPSEVRDRLLRLPCSPTPPHPSELDEAVRIVYELMEESV;Ⅴ型为PDFFGPEIFQVVLHNPTTSHQ LLKFAESRGCGENVEFLKKI和ESVEQRIARDI YPAFVRHQLALSASRALA;Ⅵ型为ELTRERFNRALRIYTEFISPRHAEFPJNJASQDLKKLEDIFERAARILYG和DRVQYWGDIPESFGPNVFDDA ZESIKYLVLTNTWPKFVKER。
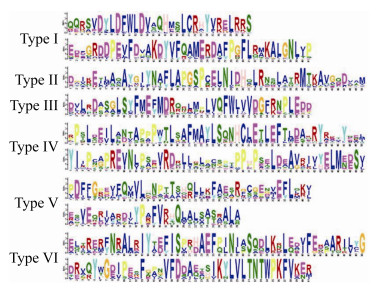 |
| 图 1 不同类别RGS蛋白的motif对比分析 Figure 1 Comparative analysis of motif of different classes of RGS proteins. |
| 图选项 |
2.2 理论等电点集中在6.01–7.00 一般而言,蛋白分子在等电点以两性离子的形式存在,其溶解度最小,有助于蛋白质的分离、提纯及变性。通过对229个RGS蛋白所具有的理论等电点数值进行分析,明确Ⅳ型RGS蛋白茄腐镰刀菌Fusarium solan I (NechaG95673)具有最低理论等电点值,为5.00;Ⅰ型RGS蛋白大丽轮枝菌Verticillium dahliae (VDAG_02225)具有最高理论等电点值,为10.02。进一步将全部RGS蛋白以理论等电点1.00为1个间隔单位,对其进行归类分析,结果表明,RGS蛋白理论等电点主要集中于6.01–7.00,数量为73个,所占比例为31.88%;其次是理论点为8.01–9.00的RGS蛋白,数量为55个,所占比例为24.02%。同时,对属于酸性蛋白(理论等电点小于6.01)的RGS蛋白进行统计,其数量为44个,所占比例为19.21%;对属于中性蛋白(理论等电点位于6.01–8.00)的RGS蛋白进行统计,其数量为89个,所占比例为38.86%;对属于碱性蛋白(理论等电点大于8.00)的RGS蛋白进行统计,其数量为96个,所占比例为41.92%,上述结果表明真菌中RGS蛋白多为碱性蛋白。同时,按RGS蛋白类型进行分类统计发现,Ⅰ型RGS蛋白酸性蛋白、中性蛋白、碱性蛋白分布较为均匀,所占比值为1:1.12:1.18;Ⅱ型RGS蛋白多为碱性蛋白,所占比例为72.41%;Ⅲ型RGS蛋白多为中性蛋白,所占比例为69.57%;Ⅳ型RGS蛋白多为酸性和中性蛋白,所占比例都为40.91%;Ⅴ型RGS蛋白多为碱性蛋白,所占比例为76.47%;Ⅵ型RGS蛋白多为碱性蛋白,所占比例为87.50% (图 2),上述结果表明,真菌中不同类型RGS蛋白具有不同类型的酸碱蛋白集中度。
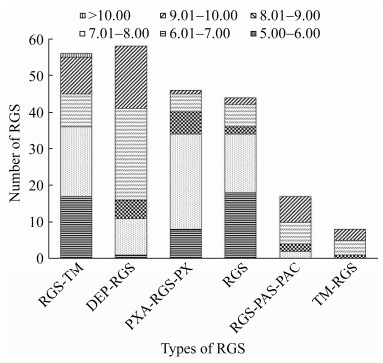 |
| 图 2 不同类型RGS蛋白理论等电点对比分析 Figure 2 Comparative analysis of theoretical isoelectric points of different types of RGS proteins. |
| 图选项 |
2.3 不稳定性系数集中在40.01–60.00 蛋白的不稳定系数是衡量蛋白在体外的稳定性的重要指标。对229个RGS蛋白的不稳定性系数进行统计分析,结果表明,RGS蛋白的不稳定性系数集中在40.01–60.00,其数量为163个,所占比例为71.18%。同时,对上述蛋白中不稳定性系数小于40.01 (稳定蛋白)进行分析,其数量为16个,所占比例为6.99%,且主要集中在Ⅱ型RGS蛋白中;其次对不稳定性系数大于40.01 (不稳定蛋白)的RGS蛋白进行分析,其数量为213个,所占比例为93.01% (图 3)。上述结果表明,RGS蛋白大多属于不稳定蛋白。
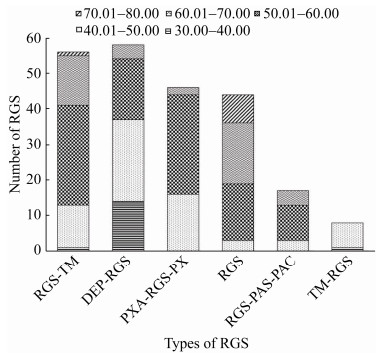 |
| 图 3 不同类型RGS蛋白不稳定系数对比分析 Figure 3 Comparative analysis of instability coefficients of different types of RGS proteins. |
| 图选项 |
2.4 RGS蛋白多属于亲水性蛋白 蛋白的氨基酸的亲水性和疏水性的相互作用在维持蛋白质结构稳定时发挥着重要的作用,因此对RGS蛋白的亲水性进行统计分析。结果表明,RGS蛋白多数属于亲水性蛋白(亲水性值小于0),其数量为222个,所占比例为96.94%;同时,对疏水性蛋白(亲水性值大于0)的RGS蛋白进行统计,其数量为7个,所占比例为3.06%。上述结果表明,RGS蛋白多数属于亲水性蛋白。另外,按RGS蛋白类型进行分类统计发现,6类RGS蛋白多数都属于亲水性蛋白,其中Ⅱ型、Ⅲ型、Ⅳ型和Ⅴ型RGS蛋白都为亲水性蛋白。
此外,对RGS蛋白的疏水性进行统计分析,结果与亲水性分析一致。对RGS蛋白亲水性最强氨基酸残基、疏水性最强氨基酸残基种类进行统计分析,明确前者有16种氨基酸残基,缺少C (半胱氨酸)、I (异亮氨酸)、V (缬氨酸)、W (色氨酸)等4种氨基酸残基,存在较多的是R (精氨酸)、D (天冬氨酸)、E (谷氨酸)、Q (谷氨酰胺)、N (天冬酰胺)等5种氨基酸残基,所占比例分别为22.74%、12.64%、10.11%、9.75%、9.03% (图 4);后者有16种氨基酸残基,缺少K (赖氨酸)、N、Q、W等4种氨基酸残基,存在较多的是L (亮氨酸)、A (丙氨酸)、V (缬氨酸)、F (苯丙氨酸)、I (异亮氨酸)等5种氨基酸残基,所占比例分别为30.36%、13.77%、11.74%、11.34%、10.12% (图 4)。
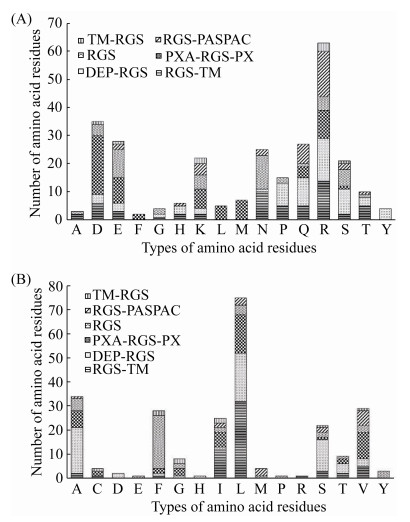 |
| 图 4 不同类型RGS蛋白亲水性最强和疏水性最强氨基酸残基的分布 Figure 4 Distribution of the most hydrophilic and the most hydrophobic amino acid residues in different types of RGS proteins. A: amino acid residue with the strongest hydrophilicity; B: amino acid residue with the strongest hydrophobic. |
| 图选项 |
按RGS蛋白类型进行分类统计发现,6类RGS蛋白中亲水性最强氨基酸残基、疏水性最强氨基酸残基存在较多的都一致,但亲水性最强氨基酸残基中仅Ⅲ型RGS蛋白存在F、L、M (甲硫氨酸),疏水性最强氨基酸残基中仅Ⅰ型RGS蛋白存在R,Ⅱ型RGS蛋白存在D、H (组氨酸),Ⅳ型RGS蛋白存在E、P (脯氨酸)。
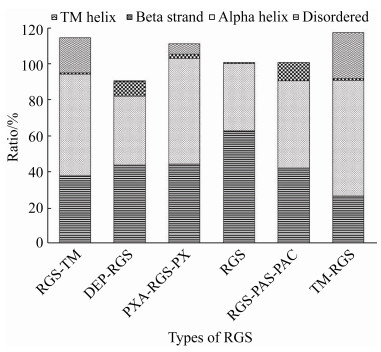
2.5 二级结构组成特征为β折叠较少 蛋白的不同结构决定了蛋白可以发挥不同的生物学功能,因此对RGS蛋白进行二级结构预测并统计分析,结果表明,RGS蛋白含有无规则卷曲、α螺旋、β折叠、TM (跨膜螺旋)结构,所占比例分别是45.57%、48.10%、3.68%、6.79%,所占比值为1︰1.055︰0.081︰0.149。同时,对RGS蛋白中的酸性蛋白、中性蛋白及碱性蛋白二级结构组成进行统计分析,就无规则卷曲、α螺旋、β折叠、TM等结构组成比例而言,明确在酸性蛋白中所占比例分别为48.05%、49.50%、1.05%、8.61%;在中性蛋白中所占比例分别为45.85%、50.99%、3.06%、6.69%;在碱性蛋白中所占比例分别为45.15%、45.81%、5.51%、6.19% (图 5)。因此,RGS蛋白中酸性蛋白、中性蛋白及碱性蛋白二级结构组成都以无规则卷曲、α螺旋为主,β折叠较少。同时,按RGS蛋白类型进行分类统计发现,就无规则卷曲、α螺旋、β折叠、TM结构组成比例而言,Ⅰ型RGS蛋白中所占比例分别为38.25%、56.02%、0.80%、19.34%;Ⅱ型RGS蛋白中所占比例分别为43.90%、38.21%、8.19%、0.10%;Ⅲ型RGS蛋白中所占比例分别为44.43%、58.61%、2.37%、5.70%;Ⅳ型RGS蛋白中所占比例分别为62.86%、37.20%、0.68%、0.00%;Ⅴ型RGS蛋白中所占比例分别为42.53%、48.00%、10.29%、0.00%;Ⅵ型RGS蛋白中所占比例分别为26.88%、64.00%、1.13%、25.38%。因此,6种RGS蛋白的二级结构组成特征都是无规则卷曲和α螺旋较多,但Ⅱ型、Ⅳ型和Ⅴ型3种RGS蛋白的二级结构组成中不含有TM。
 |
| 图 5 不同类别RGS蛋白二级结构组成对比分析 Figure 5 Comparative analysis of the secondary structure of different types of RGS proteins. |
| 图选项 |
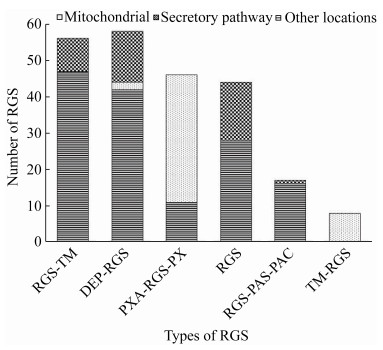
2.6 转运肽情况尚不明确 对RGS蛋白的转运肽预测分析,明确RGS蛋白的线粒体靶向肽预测值、信号肽预测值、定位情况和预测可靠性。其中在定位情况中,有144个定位在其他位置,45个定位在分泌通路、40个定位在线粒体,所占比例分别为62.88%、19.65%、17.47% (图 6)。同时,按RGS蛋白类型进行分类统计发现,Ⅰ型、Ⅱ型、Ⅳ型和Ⅴ型RGS蛋白定位集中在其他位置,Ⅲ型和Ⅵ型RGS蛋白定位集中在分泌通路,除Ⅲ型和Ⅵ型RGS蛋白外,其余4种RGS都没有定位在分泌通路(图 6)。
 |
| 图 6 不同类别RGS蛋白转运肽的分布情况 Figure 6 Distribution of different types of RGS protein transport peptides. |
| 图选项 |
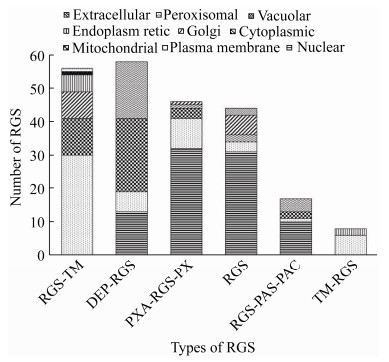
2.7 亚细胞定位多集中在细胞核 对RGS蛋白的亚细胞定位分析,明确RGS蛋白亚细胞定位情况,主要集中在细胞核、细胞质膜和线粒体,其数量分别为86、55、38,所占比例分别为37.55%、24.02%、16.59%。同时,按RGS蛋白类型进行分类统计发现,Ⅰ型和Ⅵ型RGS蛋白亚细胞定位情况集中在细胞质膜,数量分别为30、6个;Ⅱ型RGS蛋白亚细胞定位情况集中在线粒体和细胞质,数量分别为22、17个;Ⅲ型、Ⅳ型和Ⅴ型RGS蛋白亚细胞定位情况集中在细胞核,数量分别为32、31、10。另外I型RGS蛋白亚细胞定位分别有1个定位在液泡和过氧化物酶,Ⅵ型RGS蛋白亚细胞定位有2个定位在细胞外(图 7)。
 |
| 图 7 不同类别RGS蛋白亚细胞定位的分布情况 Figure 7 Distribution of subcellular localization of different classes of RGS proteins. |
| 图选项 |
3 讨论和结论 3.1 讨论 前人研究发现,RGS蛋白无论是在真菌生长发育的过程中,还是在定殖植物的过程中,均发挥着重要作用;就植物病原丝状真菌而言,其在实现对植物侵染的过程中,会分泌大量的效应分子与植物中的防卫反应相关蛋白发生相互作用[4, 30–31],从而在植物中实现定殖、扩展等过程[32]。前期研究明确植物病原菌中的RGS数量明显高于其他真菌,同时,明确半活体营养型病原菌中的RGS数量既高于死体营养型病原菌,也高于活体营养型病原菌,进一步对比分析RGS蛋白类型,发现Ⅴ型和Ⅵ型的RGS主要集中在半活体营养型病原菌和死体营养型病原菌。此外,还明确部分植物病原菌(主要包括花药黑粉菌M. violaceum、西瓜炭疽菌C. orbiculare、禾谷炭疽菌C. graminicola、希金斯炭疽菌C. higginsianum、松穴褥盘孢菌D. septosporum、大丽轮枝菌V. dahlia)具有多个Ⅰ型RGS蛋白,以及包括禾谷镰刀菌F. graminearum、藤黑镰刀菌F. fujikuroi、尖孢镰刀菌F. oxysporum、假禾谷镰刀菌F. pseudograminearum、串珠镰刀菌F. verticillioides、腐皮镰刀菌F. solain等植物病原菌具有多个Ⅱ型RGS蛋白。本研究对于真菌中RGS的理化性质分析,发现同一真菌同类型RGS蛋白的亚细胞定位位置和转运肽相同,但pH值、亲水性最强氨基酸残基和疏水性最强氨基酸残基存在较大的差异,推测该蛋白在植物病原菌的营养生长、致病性等方面发挥着互补性。
对全部RGS展开遗传关系分析,发现Ⅰ型和Ⅳ型RGS的亲缘关系较近,而Ⅱ型、Ⅲ型和Ⅵ型亲缘关系较近,Ⅴ型单独一支。本研究中则通过对上述6类RGS蛋白的理化性质进行对比分析,发现同类别RGS蛋白的理化性质具有一定的共同性,但6类RGS蛋白之间相互进行比较时,不同类别的RGS蛋白则具有明显的类别特征,具体而言:在理论等电点中Ⅰ型RGS蛋白酸性蛋白、中性蛋白、碱性蛋白分布较为均匀,Ⅱ型、Ⅴ型和Ⅵ型RGS蛋白多为碱性蛋白,Ⅲ型RGS蛋白多为中性蛋白,Ⅳ型RGS蛋白多为酸性和中性蛋白。在亲水性最强氨基酸残基中,仅Ⅲ型RGS蛋白存在F、L、M,疏水性最强氨基酸残基中仅Ⅰ型RGS蛋白存在R,Ⅱ型RGS蛋白存在D、H,Ⅳ型RGS蛋白存在E、P。同时,在蛋白质二级结构解析中,Ⅱ型、Ⅳ型和Ⅴ型等3种RGS蛋白均不含TM结构,而Ⅱ型和Ⅴ型RGS蛋白的主要功能是将RGS蛋白定位到不同的亚细胞膜位点,是否能推测出Ⅳ型RGS蛋白的功能与其类似有待于进一步验证。在转运肽定位中Ⅲ型和Ⅵ型RGS蛋白则集中在分泌通路,其余4类RGS均未定位在分泌通路上,推测与功能有关,Ⅲ型RGS蛋白具有PX结构域和PXA结构域,将RGS蛋白定位到不同的地方,发挥多种功能,如细胞信号传导、膜泡运输、蛋白质分选和脂质修饰等。前人研究发现,在玉米赤霉菌G. zeae、轮枝镰孢菌F. verticillioides和稻瘟病菌M. oryzae等植物病原菌中,该蛋白缺失则影响着上述病原菌分生孢子的产生和毒力等功能,同时,在酿酒酵母S. cerevisiae中,此RGS蛋白作用则是在高温情况下维持细胞核和线粒体的遗传等。Ⅵ型RGS蛋白在N端具有TM结构域,但功能未见报道。在亚细胞定位中Ⅰ型和Ⅵ型RGS蛋白集中在细胞质膜,Ⅱ型RGS蛋白则集中在线粒体和细胞质,而且Ⅱ型RGS蛋白中部分蛋白具有很好的稳定性。Ⅲ型、Ⅳ型和Ⅴ型RGS蛋白集中在细胞核。另外Ⅰ型RGS蛋白分别有1个定位在液泡和过氧化物酶,Ⅵ型RGS蛋白有2个定位在细胞外,蛋白的亚细胞定位和稳定性之间是否具有一定联系有待于进一步验证。
为了进一步解析真菌中RGS蛋白类型与其理化性质之间的关系,笔者试图将49个真菌按模式生物、病原菌、非致病菌进行分类统计,然而,令人遗憾的是,并未发现不同类型RGS蛋白在理化性质方面表现出明显的规律性,该尝试也充分说明了RGS蛋白理化性质在不同群体真菌中的稳定性特点,从而在不同生物中有效地保证了其在G蛋白信号途径中发挥负调控的作用,也从侧面说明了真菌中RGS的变化主要体现在数量的多寡、种类之间的差异性。
3.2 结论 本研究明确49个真菌中229个RGS蛋白具有以下特征:理论等电点集中在6.01–7.00,不稳定性系数集中在40.01–60.00,95%以上的RGS蛋白属于亲水性蛋白,亲水性最强氨基酸残基存在较多的是R、D、E、Q、N,疏水性最强氨基酸残基存在较多的L、A、V、F、I,二级结构组成特征为β折叠较少,转运肽情况尚未明确,亚细胞定位多集中在细胞核。该研究为今后深入开展植物病原丝状真菌中的RGS功能解析打下坚实的理论基础。
References
| [1] | Han CZ, Yang B. Mapping and bioinformatics analysis on G protein signaling pathway related protein of Colletotrichum graminicola. Beijing: Science Press, 2016. (in Chinese) 韩长志, 杨斌. G蛋白信号途径相关蛋白生物信息学:以禾谷炭疽菌为例. 北京: 科学出版社, 2016. |
| [2] | Ross EM, Wilkie TM. GTPase-activating proteins for heterotrimeric G proteins:regulators of G protein signaling (RGS) and RGS-like proteins. Annual Review of Biochemistry, 2000, 69: 795-827. DOI:10.1146/annurev.biochem.69.1.795 |
| [3] | Asli A, Sadiya I, Avital-Shacham M, Kosloff M. "Disruptor" residues in the regulator of G protein signaling (RGS) R12 subfamily attenuate the inactivation of Gα subunits. Science Signaling, 2018, 11(534): eaan3677. DOI:10.1126/scisignal.aan3677 |
| [4] | Alqinyah M, Hooks SB. Regulating the regulators:epigenetic, transcriptional, and post-translational regulation of RGS proteins. Cellular Signalling, 2018, 42: 77-87. DOI:10.1016/j.cellsig.2017.10.007 |
| [5] | McPherson KB, Leff ER, Li MH, Meurice C, Tai S, Traynor JR, Ingram SL. Regulators of g-protein signaling (RGS) proteins promote receptor coupling to g-protein-coupled inwardly rectifying potassium (GIRK) channels. The Journal of Neuroscience, 2018, 38(41): 8737-8744. DOI:10.1523/JNEUROSCI.0516-18.2018 |
| [6] | Abramow-Newerly M, Roy AA, Nunn C, Chidiac P. RGS proteins have a signalling complex:interactions between RGS proteins and GPCRs, effectors, and auxiliary proteins. Cellular Signalling, 2006, 18(5): 579-591. DOI:10.1016/j.cellsig.2005.08.010 |
| [7] | Dohlman HG, Song J, Ma D, Courchesne WE, Thorner J. Sst2, a negative regulator of pheromone signaling in the yeast Saccharomyces cerevisiae:expression, localization, and genetic interaction and physical association with Gpa1(the G-protein alpha subunit). Molecular and Cellular Biology, 1996, 16(9): 5194-5209. DOI:10.1128/MCB.16.9.5194 |
| [8] | Wang YC, Geng ZY, Jiang DW, Long FF, Zhao Y, Su H, Zhang KQ, Yang JK. Characterizations and functions of regulator of G protein signaling (RGS) in fungi. Applied Microbiology and Biotechnology, 2013, 97(18): 7977-7987. DOI:10.1007/s00253-013-5133-1 |
| [9] | Yu JH. Heterotrimeric G protein signaling and RGSs in Aspergillus nidulans. Journal of Microbiology, 2006, 44(2): 145-154. |
| [10] | Yu JH, Wieser J, Adams TH. The Aspergillus FlbA RGS domain protein antagonizes G protein signaling to block proliferation and allow development. The EMBO Journal, 1996, 15(19): 5184-5190. DOI:10.1002/j.1460-2075.1996.tb00903.x |
| [11] | Han KH, Seo JA, Yu JH. Regulators of G-protein signalling in Aspergillus nidulans:RgsA downregulates stress response and stimulates asexual sporulation through attenuation of GanB (Gα) signalling. Molecular Microbiology, 2004, 53(2): 529-540. |
| [12] | Zhang HF, Tang W, Liu KY, Huang Q, Zhang X, Yan X, Chen Y, Wang JS, Qi ZQ, Wang ZY, Zheng XB, Wang P, Zhang ZG. Correction:eight RGS and RGS-like proteins orchestrate growth, differentiation, and pathogenicity of Magnaporthe oryzae. PLoS Pathogens, 2019, 15(11): e1008187. DOI:10.1371/journal.ppat.1008187 |
| [13] | 韩秀秀.受COS1转录调控的稻瘟病菌基因RGS1和CMR1的功能鉴定.海南大学硕士学位论文, 2013. |
| [14] | 乐鑫怡.稻瘟病菌RGS家族蛋白RGS结构域的功能解析及Dynamin家族蛋白MoDnm2、MoDnm3的生物学功能研究.南京农业大学硕士学位论文, 2017. |
| [15] | Mukherjee M, Kim JE, Park YS, Kolomiets MV, Shim WB. Regulators of G-protein signalling in Fusarium verticillioides mediate differential host-pathogen responses on nonviable versus viable maize kernels. Molecular Plant Pathology, 2011, 12(5): 479-491. |
| [16] | Park AR, Cho AR, Seo JA, Min K, Son H, Lee J, Choi GJ, Kim JC, Lee YW. Functional analyses of regulators of G protein signaling in Gibberella zeae. Fungal Genetics and Biology, 2012, 49(7): 511-520. DOI:10.1016/j.fgb.2012.05.006 |
| [17] | Wang P, Cutler J, King J, Palmer D. Mutation of the regulator of G protein signaling Crg1 increases virulence in Cryptococcus neoformans. Eukaryotic Cell, 2004, 3(4): 1028-1035. DOI:10.1128/EC.3.4.1028-1035.2004 |
| [18] | Han CZ. Bioinformatics analysis on regulators of G-protein signaling in Colletotrichum graminicola. Microbiology China, 2014, 41(8): 1582-1594. (in Chinese) 韩长志. 禾谷炭疽菌RGS蛋白生物信息学分析. 微生物学通报, 2014, 41(8): 1582-1594. |
| [19] | Han CZ. Bioinformatics analysis on regulators of G-protein signaling in Colletotrichum higginsianum. Biotechnology, 2014, 24(1): 36-41. (in Chinese) 韩长志. 希金斯炭疽菌RGS蛋白生物信息学分析. 生物技术, 2014, 24(1): 36-41. |
| [20] | 吴曼莉.橡胶树胶孢炭疽菌G蛋白信号调控因子CgRGS1、CgRGS2和CgRGS7的克隆及生物学功能.海南大学硕士学位论文, 2017. |
| [21] | Wu ML, Li XY, Zhang N, Xu S, Liu ZQ. Gene cloning and biological function of CgRGS2 in Colletotrichum gloeosporioides. Acta Microbiologica Sinica, 2017, 57(1): 66-76. (in Chinese) 吴曼莉, 李晓宇, 张楠, 徐爽, 柳志强. 胶孢炭疽菌CgRGS2基因的克隆及生物学功能. 微生物学报, 2017, 57(1): 66-76. |
| [22] | Xu S, Ke ZJ, Zhang K, Liu ZQ, Li XY. Biological function of a regulator of G-protein signaling CgRGS3 in Colletotrichum gloeosporioides. Acta Phytophylacica Sinica, 2018, 45(4): 827-835. (in Chinese) 徐爽, 柯智健, 张凯, 柳志强, 李晓宇. 胶孢炭疽菌G蛋白信号调控因子CgRGS3的生物学功能. 植物保护学报, 2018, 45(4): 827-835. |
| [23] | Choi YH, Lee MW, Igbalajobi OA, Yu JH, Shin KS. Transcriptomic and functional studies of the RGS protein rax1 in Aspergillus fumigatus. Pathogens, 2020, 9(1): 36. |
| [24] | Zheng B, De Vries L, Farquhar MG. Divergence of RGS proteins:evidence for the existence of six mammalian RGS subfamilies. Trends in Biochemical Sciences, 1999, 24(11): 411-414. |
| [25] | Zhao Y, Wang YC, Jiang DW, Su H, Yang JK. Advances in functional research of RGS proteins in fungi. Microbiology China, 2014, 41(4): 712-718. (in Chinese) 赵勇, 王云川, 蒋德伟, 苏浩, 杨金奎. 真菌G蛋白信号调控蛋白的功能研究进展. 微生物学通报, 2014, 41(4): 712-718. |
| [26] | Wilkins MR, Gasteiger E, Bairoch A, Sanchez JC, Williams KL, Appel RD, Hochstrasser DF. Protein identification and analysis tools in the ExPASy server//Link AJ. 2-D Proteome Analysis Protocols. Totowa: Humana Press, 1999: 531-552. |
| [27] | Kelley LA, Mezulis S, Yates CM, Wass MN, Sternberg MJ. The Phyre2 web portal for protein modeling, prediction and analysis. Nature Protocols, 2015, 10(6): 845-858. |
| [28] | Emanuelsson O, Brunak S, von Heijne G, Nielsen H. Locating proteins in the cell using TargetP, SignalP and related tools. Nature Protocols, 2007, 2(4): 953-971. |
| [29] | Bailey TL, Boden M, Buske FA, Frith M, Grant CE, Clementi L, Ren JY, Li WW, Noble WS. MEME SUITE:tools for motif discovery and searching. Nucleic Acids Research, 2009, 37(S2): W202-W208. |
| [30] | Salem-Mansour D, Asli A, Avital-Shacham M, Kosloff M. Structural motifs in the RGS RZ subfamily combine to attenuate interactions with Gα subunits. Biochemical and Biophysical Research Communications, 2018, 503(4): 2736-2741. |
| [31] | Lou F, Abramyan TM, Jia HY, Tropsha A, Jones AM. An atypical heterotrimeric Gα protein has substantially reduced nucleotide binding but retains nucleotide-independent interactions with its cognate RGS protein and Gβγ dimer. Journal of Biomolecular Structure and Dynamics, 2019. DOI:10.1080/07391102.2019.1704879 |
| [32] | Han CZ, Xu X. Advance in functional research of secreted protein and CAZymes in plant pathogenic filamentous fungus. Journal of Nanjing Forestry University (Natural Sciences Edition), 2017, 41(5): 152-160. (in Chinese) 韩长志, 许僖. 植物病原丝状真菌分泌蛋白及CAZymes的研究进展. 南京林业大学学报(自然科学版), 2017, 41(5): 152-160. |
