来守超1,2, 方晓瑜1,2, 涂波1,2, 陈浩3, 邓泽3, 李贵中3, 陈振宏3, 张辉1,2, 承磊1,2


1. 农业部沼气科学研究所, 四川 成都 610041;
2. 农业部农村可再生能源开发利用重点实验室, 四川 成都 610041;
3. 中国石油勘探开发研究院, 河北 廊坊 065007
收稿日期:2019-06-29;修回日期:2019-09-30;网络出版日期:2020-03-06
基金项目:国家科技重大专项(2016ZX05041001-003);中国农业科学院科技创新工程(CAAS-ASTIP-2016-BIOMA)
*通信作者:承磊, Tel:+86-28-85226085;Fax:+86-28-85215106;E-mail:chenglei@caas.cn.
摘要:内蒙古自治区二连盆地、海拉尔盆地是我国重要的煤层气产区,其中生物成因煤层气是煤层气的重要来源,但复杂物质转化产甲烷相关微生物群落结构及功能尚不清楚。[目的] 研究煤层水中的微生物代谢挥发性脂肪酸产甲烷的生理特征及群落特征。[方法] 以内蒙古自治区二连盆地和海拉尔盆地的四口煤层气井水作为接种物,分别添加乙酸钠、丙酸钠和丁酸钠厌氧培养;定期监测挥发性脂肪酸降解过程中甲烷和底物的变化趋势,应用高通量测序技术,分析原始煤层气井水及稳定期产甲烷菌液的微生物群落结构。[结果] 除海拉尔盆地H303煤层气井微生物不能代谢丙酸外,其他样品均具备代谢乙酸、丙酸和丁酸产生甲烷的能力,其生理生态参数存在显著差异,产甲烷延滞期依次是乙酸 < 丁酸 < 丙酸;最大比产甲烷速率和底物转化效率依次是丙酸 < 乙酸 < 丁酸。富集培养后,古菌群落结构与煤层气井水的来源显著相关,二连盆地优势古菌为氢营养型产甲烷古菌Methanocalculus(相对丰度13.5%-63.4%)和复合营养型产甲烷古菌Methanosarcina(7.9%-51.3%),海拉尔盆地的优势古菌为氢营养型产甲烷古菌Methanobacterium(24.3%-57.4%)和复合营养型产甲烷古菌Methanosarcina(29.6%-66.5%);细菌群落则与底物类型显著相关,硫酸盐还原菌Desulfovibrio(12.0%-41.0%)、互营丙酸氧化菌Syntrophobacter(39.6%-75.5%)和互营丁酸菌Syntrophomonas(8.5%-21.9%)分别在乙酸钠、丙酸钠和丁酸钠处理组显著富集。[结论] 煤层气井水微生物可降解挥发性脂肪酸(乙酸、丙酸和丁酸)并具有产甲烷潜力;乙酸可能被古菌直接代谢产甲烷,而丙酸和丁酸通过互营细菌和产甲烷古菌代谢产甲烷。Desulfovibrio、Syntrophobacter和Syntrophomonas分别在乙酸、丙酸和丁酸代谢过程中发挥了重要作用。这些结果为煤层气生物强化开采提供了一定的微生物资源基础。
关键词:生物成因煤层气挥发性脂肪酸产甲烷厌氧培养高通量测序互营代谢
Methanogenic potential and community structure of coalbed-methane production water microbiome
Shouchao Lai1,2, Xiaoyu Fang1,2, Bo Tu1,2, Hao Chen3, Ze Deng3, Guizhong Li3, Zhenhong Chen3, Hui Zhang1,2, Lei Cheng1,2


1. Biogas Institute of Ministry of Agriculture, Chengdu 610041, Sichuan Province, China;
2. Key Laboratory of Development and Application of Rural Renewable Energy, Ministry of Agriculture, Chengdu 610041, Sichuan Province, China;
3. Research Institute of Petroleum Exploration & Development, Langfang 065007, Hebei Province, China
Received: 29 June 2019; Revised: 30 September 2019; Published online: 6 March 2020
*Corresponding author: Cheng Lei, Tel:+86-28-85226085;Fax:+86-28-85215106;E-mail:chenglei@caas.cn.
Foundation item: Supported by the National Key R & D Program of China (2016ZX05041001-003) and by the Agricultural Science and Technology Innovation Project of Chinese Academy of Agricultural Sciences (CAAS-ASTIP-2016-BIOMA)
Abstract: Biogenetic coalbed methane is a significant composition in Erlian and Hailar basins. However, little information is available how biogenetic coalbed methane is generated. [Objective] To evaluate the methanogenic potential of volatile fatty acids by the coalbed-methane production water microbiome, and to observe the shift of microbial community structure involved. [Methods] Simulation experiments were performed by inoculating coalbed-methane production water from four coalbed methane wells of Erlian and Hailar basins. Acetate, propionate and butyrate were selected as substrates. Methane production and substrate utilization were measured over time. The microbial communities of coalbed methane production water and enrichment cultures after incubation were analyzed through high-throughput sequencing of 16S rRNA gene. [Results] With the exception of H303 coalbed water without propionate degradation, all coalbed water microbiomes had the ability to degrade acetate, propionate and butyrate under methanogenic degradation. The maximum specific methane production rate, substrate conversion ratio and lag-phase period exhibited great difference in different volatile fatty acid group. The maximum specific methane production rate and substrate conversation ratio was highest in the butyrate group and the lag-phase was the shortest with acetate addition. High-throughput sequencing analysis reveals that the archaeal community structure of enrichment cultures was significantly correlated with the source of coalbed water. The predominant archaeal groups of Erlian basin were hydrogenotrophic Methanocalculus (13.5%-63.4%) and Methanosarcina (7.9%-51.3%). The predominant archaea of Hailar basin were hydrogenotrophic Methanobacterium (24.3%-57.4%) and Methanosarcina (29.6%-66.5%). The enriched bacterial community structure is significantly correlated with substrates, sulfate-reducing Desulfovibrio (12.0%-41.0%), syntrophic propionate-degrading Syntrophobacter (39.63%-75.45%) and syntrophic butyrate-degrading Syntrophomonas (8.5%-21.9%) were enriched in acetate, propionate and butyrate group, respectively. [Conclusion] The coalbed-methane production water microbiome possessed potential of methanogenic volatile fatty acid degradation, among which acetate was probably fermented by methanogens, propionate and butyrate are consumed by syntrophic bacteria Syntrophobacter and Syntrophomonas respectively. This result will contribute to the development research of microbial enhanced methane recovery from coalbed.
Keywords: biogenetic coalbed methanevolatile fatty acidmethanogenesisanaerobic incubationhigh-throughput sequencingsyntrophic metabolism
煤层气是煤化过程中由地质作用和(或)微生物降解产生的非常规天然气,主要成分是甲烷(含量一般大于90%),其次是二氧化碳和氮气,部分煤层气中含有微量气态烃(C2–C4烷烃)[1-2]。生物成因煤层气约占煤层气储量的15%–30%,是煤层气的重要组成部分,它可以分为原生煤层气和次生煤层气[3-4]。原生煤层气产生于煤化作用早期,由于早期煤层含气性较差,大部分原生煤层气泄露到空气中而难以保存,次生煤层气主要来自煤炭生物降解[3-4]。煤炭由复杂多变的杂环化合物组成,主要包括芳香族和木质素衍生的氮、硫、氧化合物[5-6]。一般观点认为,生物成因煤层气由水解细菌、发酵细菌、互营细菌和产甲烷古菌等各种不同功能微生物,通过多种生化代谢反应,降解煤炭有机质组分,产生甲烷和二氧化碳[5-6]。微生物通过延胡索酸激活、羟基化、甲基化和羧基化等厌氧代谢新机制,降解转化煤炭化合物,并产生中间代谢产物挥发性脂肪酸(如乙酸、丙酸和丁酸)[5-6]。标准热力学状态下,挥发性脂肪酸的厌氧降解是热力学不利的反应(△Go’ > 0) (表 1),需要互营细菌和产甲烷古菌耦联,才能完成产甲烷代谢[7]。已有报道表明,在地下煤层中可以实时通过微生物代谢产生生物成因煤层气,未来可通过生物强化进行煤炭的生物气化开采利用[2]。但是,对于煤层水微生物是否能够代谢挥发性脂肪酸产生甲烷,以及哪些微生物能够参与此过程,目前还鲜有报道。
表 1. 挥发性脂肪酸降解的吉普斯自由能变化[7-8] Table 1. The Gibbs free energy of volatile fatty acid degradation[7-8]
| Substrate | Reaction | △Go’ /(kJ/mol) |
| Anaerobic oxidation | ||
| CH3COOH | CH3COO–+H++2H2O→2CO2+4H2 | +95 |
| CH3CH2COOH | CH3CH2COO–+2H2O→CH3COO–+CO2+3H2 | +72 |
| C4H8O2 | C4H7O2–+2H2O→2CH3COO–+H++2H2 | +48 |
| Methanogenesis | ||
| CH3COOH | CH3COOH+2H2O→CH4+HCO3– | –36 |
| CH3CH2COOH | CH3CH2COO–+H2O→7/4CH4+5/4HCO3–+1/4H+ | –56.4 |
| C4H8O2 | C4H7O2–+H++H2O→5/2CH4+3/2CO2 | –88.5 |
表选项
内蒙古自治区二连和海拉尔盆地的煤层气总储量高达2.8×1012 m3,占全国可开采资源总量的9.6%,是国内主要的煤层气矿区[9]。两地的煤炭成熟度较低,属于利于产生生物气的低变质煤炭。二连盆地煤炭的镜质组反射率(R°)为0.33%–0.88%,褐煤占95%以上,整体属褐煤的变质阶段,海拉尔盆地多数煤层(伊敏组和大上端)的煤炭R° < 0.7%,属于褐煤-气煤的变质阶段[10-11]。两地地下径流活跃,水循环条件良好,且煤层水矿化度不超过6.4 g/L,适宜煤层微生物生长繁殖[10, 12]。煤层气组分及甲烷碳氢同位素特征是判定生物成因煤层气的重要指标[6],生物成因煤层气多属于干气,微生物代谢的同位素分馏作用,导致生物成因煤层气甲烷的碳同位素偏轻[4]。二连盆地和海拉尔盆地的煤层气甲烷含量分别为75%–92%和10.4%–87.1%,二连盆地的δ13CH4为–60.3‰––65.3‰[10, 12-13]。群落结构分析显示该地的煤层水中存在产甲烷古菌,模拟培养也证实了煤层气井水中的微生物具备降解煤炭产甲烷代谢能力[13-14]。这些证据都表明二连盆地和海拉尔盆地实时产生煤层气的可能性。
在煤层气开采过程中,会带出地下煤层的缝隙水,其中蕴藏的微生物在一定程度上反映地下煤层微生物特征[15]。因此,本研究以二连和海拉尔盆地的煤层气井水作为接种物,分别以乙酸、丙酸和丁酸盐作为碳源,通过厌氧模拟培养和色谱分析,阐明不同煤层水降解挥发性脂肪酸产甲烷的潜力和效率;应用高通量测序和生物信息学方法,分析挥发性脂肪酸代谢产甲烷过程的主要细菌和古菌群落特征。
1 材料和方法 1.1 材料 接种物:二连盆地位于我国内蒙古自治区中部,海拉尔盆地分别位于我国内蒙古自治区东北部。从二连和海拉尔盆地的煤层气井收集新鲜煤层水,并保存到无菌的塑料瓶中(2.5 L/瓶),快递运输到实验室后4 ℃保藏,并在7 d内进行培养。
1.2 厌氧模拟培养实验 在N2保护下,分装煤层水样品到厌氧试管中,氮吹20–30 min后,添加0.5 g/L半胱氨酸盐酸盐,再添加乙酸钠、丙酸钠和丁酸钠,对煤层水中的产甲烷体系进行预培养。进一步采用稳定期的产甲烷菌液作为接种物(接种量为20%),进行传代培养。传代培养选择无机盐培养基(g/L)[14]:NaCl 0.5,MgCl2·6H2O 0.5,CaCl2·2H2O 0.1,NH4Cl 0.3,KCl 0.5,KH2PO4 0.2,半胱氨酸盐酸盐0.5。具体实验设计如下:(1)不添加任何碳源的对照组;(2)添加乙酸钠(终浓度0.02 mol/L);(3)添加丙酸钠(终浓度0.02 mol/L);(4)添加丁酸钠(终浓度0.02 mol/L);空白对照组3个重复,实验组5个重复,培养前调pH 7.0–7.2。样品置于35℃静止暗培养,定期检测甲烷产量及底物消耗量;采集稳定期的产甲烷菌体,用于微生物群落结构分析。产甲烷菌系的生长特征,可以通过最大比甲烷产生速率(μmax)来比较分析[16],本文中的μmax根据Originpro 8.5中的Slogistic 1功能模块计算(Origin Lab, USA)。
1.3 甲烷含量测定 采用气相色谱(安捷伦7820A,美国)定时测定气体组分;色谱配置Porapak Q型不锈钢柱(内径2 mm,长度3 m),进样口温度、柱温和检测器(TCD)温度分别为105 ℃、80℃和130℃,载气为高纯氢气(99.999%),柱流量为30 mL/min,采用VICI样品针取上空气体0.2 mL,采用校正面积归一法测定气体相对含量;进一步通过甲烷与氮气的相对比例计算甲烷摩尔量。
1.4 挥发性脂肪酸测定 气相色谱仪(安捷伦7890A,美国)定期检测菌液中的短链挥发性脂肪酸含量,其配置及设定参数为:InertCap-FFAP (长度30 m,内径320 μm)型色谱柱,程序升温柱箱,即80 ℃保持1 min,然后以18 ℃/min的速度,升温至180 ℃,保持2.5 min;进样口(气化室)温度210 ℃,进样分流比1:10;氢火焰离子检测器(FID),检测器温度250 ℃。高纯氮气(99.999%)为载气,高纯氢气(99.999%)为燃气,空气流速350 mL/min,氢气流速27 mL/min,尾吹氮气36 mL/min。
1.5 微生物群落结构测定 收集原始煤层气井水(50 mL/井)及稳定期的产甲烷菌液(2 mL瓶),15000 r/min离心5 min,弃上清,获得沉淀菌体。使用细菌基因组抽提试剂盒(上海生工,中国)提取菌体DNA。通过Nano Vue Plus超微量分光光度计(GE,美国)测定DNA浓度和纯度。分别扩增细菌和古菌16S rRNA基因,其中细菌通用引物为bac341F/bac806R[17],古菌通用引物为arch519F/arch915R[18](表 2)。PCR扩增程序:95 ℃ 5 min;94 ℃ 60 s,57 ℃ 45 s,72 ℃ 60 s,34个循环;72 ℃ 10 min,16 ℃ 5 min。在Hiseq-PE 250测序平台测序,测序数据处理流程:剔除长度 < 200 bp且平均质量(Q)得分 < 30的序列,嵌合体的检测及剔除使用Usearch V8的功能Uchime,参考序列数据库为SILVIA;质量控制完成后,使用QIIME (V1.9.0)进行分析,以序列相似度97%为一个操作分类单元(OTU),使用RDP数据库进行物种注释[19]。提交测序数据到NCBI (National Center for Biotechnology Information),古菌和细菌的测序数据的序列号分别为SUB5613336和SUB5594810。
表 2. 本研究所涉及引物序列 Table 2. Primers used in this study
| Primer | Forward primer (5′→3′) | Reverse primer (5′→3′) |
| bac341F/bac806R | CCTAYGGGRBGCASCAG | GGACTACNNGGGTATCTAAT |
| arc519F/arc915R | CAGCCGCCGCGGTAA | GTGCTCCCCCGCCAATTCCT |
表选项
2 结果和分析 2.1 煤层水微生物降解挥发性脂肪酸产甲烷趋势与特征 从二连盆地和海拉尔盆地各收集了2口煤层气井水样品,编号分别为JM2和JM4、H301和H303。厌氧模拟培养85 d后,除海拉尔盆地的煤层水H303不能代谢丙酸钠产甲烷以外,四口井的煤层水都可以降解乙酸、丙酸和丁酸,并产生甲烷(图 1)。它们利用相同底物产甲烷的延滞期类似,乙酸钠代谢产甲烷的延滞期平均为(5.7±0.4) d,其次是以丁酸钠组的产甲烷延滞期为(10.3±2.8) d,丙酸钠代谢产甲烷的延滞期最长,达到了(63.8±2.5) d (表 3)。煤层水微生物利用丁酸钠的最大比产甲烷速率(μmax)最高,平均为(0.44±0.09) d–1,其次为乙酸钠[μmax为(0.27±0.17) d–1],而丙酸钠μmax只有(0.1±0.03) d–1 (表 3)。煤层水微生物代谢挥发性脂肪酸产甲烷的转化效率也存在差异,其中丙酸钠平均转化率最低,只有78.4%±17.5%,其次为乙酸钠(转化率为89.3%±15.3%),丁酸钠几乎被完全转化(转化率101.9%±14.52%) (表 3)。
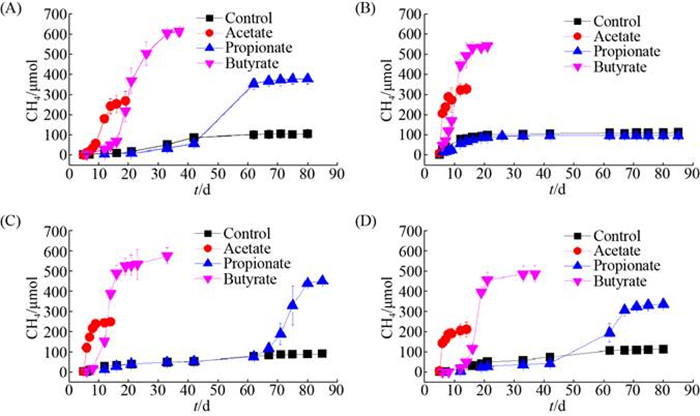 |
| 图 1 煤层水微生物代谢挥发性脂肪酸产甲烷趋势 Figure 1 Methane production from volatile fatty acids degradation by coalbed microbiota. A: H301; B: H303; C: JM2; D: JM4. |
| 图选项 |
表 3. 煤层水菌群代谢挥发性脂肪酸产甲烷的生理特征 Table 3. Physiological properties of coalbed microbiota during methanogenic degradation of volatile fatty acids
| Coalbed water | Substrate | Net methane/μmol | Substrate consumption/μmol | Maximum specific growth rate /d–1 | Lag phase/day | Percent conversion/% |
| H301 | Acetate | 207.7±19.1 | 208.65±6.17 | 0.59±0.04 | 6 | 99.5±7.8 |
| H301 | Propionate | 293.1±86.4 | 230.46±0 | 0.09±0.01 | 62 | 72.7±21.4 |
| H301 | Butyrate | 472.7±74.4 | 162.94±0 | 0.29±0.03 | 12 | 116.1±18.3 |
| H303 | Acetate | 211.9±42.1 | 223.5±1.2 | 0.16±0.02 | 5 | 94.9±19.1 |
| H303 | Propionate | – | – | – | – | – |
| H303 | Butyrate | 411.8±27.2 | 173.07±0 | 0.46±0.02 | 6 | 95.2±6.3 |
| JM2 | Acetate | 201.5±12.3 | 225.54±4.82 | 0.29±0.03 | 6 | 89.3±4.9 |
| JM2 | Propionate | 359.9±49.0 | 228.83±6.18 | 0.13±0.01 | 67 | 89.8±11.5 |
| JM2 | Butyrate | 436.1±70.6 | 162.94±0 | 0.54±0.03 | 12 | 107.1±17.3 |
| JM4 | Acetate | 166.9±33.3 | 224.94±0 | 0.14±0.02 | 6 | 74.2±14.8 |
| JM4 | Propionate | 266.7±65.3 | 213.82±0 | 0.08±0 | 62 | 71.3±17.5 |
| JM4 | Butyrate | 382.8±36.7 | 162.94±0 | 0.46±0.01 | 12 | 93.9±9.0 |
| –: no growth. | ||||||
表选项
2.2 古菌群落结构 测序培养前后的古菌16S rRNA基因,共获得有效序列条数922740条,每个样品的平均有效测序条数为17410,可分为309个OTU (表 4)。其中丙酸钠组的OTU数最大(81±11个),乙酸钠和丁酸钠组的OTU平均只有63个(表 4),但是不同处理组之间的香农指数非常接近(表 4)。
表 4. 煤层水初始状态及富集培养后的古菌测序信息 Table 4. Sequencing information of the archaeal communities in the original coalbed water and the enrichment cultures
| Coalbed water | Treatment | OTU | Sequence | Shannon index |
| H301 | Initail state | 36 | 5338 | 1.23 |
| H301 | Control | 84±10 | 16894±2224 | 1.69±0.09 |
| H301 | Acetate | 72±6 | 18546±534 | 1.34±0.04 |
| H301 | Propionate | 79±3 | 18659±2394 | 1.5±0.12 |
| H301 | Butyrate | 55±5 | 15646±5864 | 1.2±0.18 |
| H303 | Control | 84±8 | 19466±2206 | 1.24±0.06 |
| H303 | Acetate | 59±14 | 16477±2043 | 1.03±0.01 |
| H303 | Propionate | 73±15 | 19287±884 | 1.23±0.11 |
| H303 | Butyrate | 61±2 | 12265±7092 | 1.27±0.04 |
| JM2 | Control | 73±22 | 14676±721 | 0.95±0.27 |
| JM2 | Acetate | 68±8 | 18471±703 | 1.41±0.13 |
| JM2 | Propionate | 88±11 | 20805±833 | 1.63±0.05 |
| JM2 | Butyrate | 61±12 | 17147±7181 | 1.31±0.14 |
| JM4 | Initail state | 36 | 3458 | 1.04 |
| JM4 | Control | 73±6 | 15287±1025 | 1.42±0.07 |
| JM4 | Acetate | 57±9 | 9517±3449 | 1.31±0.12 |
| JM4 | Propionate | 83±8 | 23166±1285 | 1.33±0.05 |
| JM4 | Butyrate | 63±27 | 20024±6681 | 1.05±0.11 |
表选项
PCA聚类分析发现,古菌群落与煤层水的来源显著相关,无论是否添加挥发性脂肪酸,海拉尔盆地的煤层水样品H301和H303组分布在左侧,二连盆地的煤层水样品JM2和JM4组分布在右侧(图 2)。添加不同类型的挥发性脂肪酸,海拉尔煤层水的古菌群落结构相似度明显高于二连盆地(图 2),表明二连盆地的古菌群落更易受到底物富集影响。
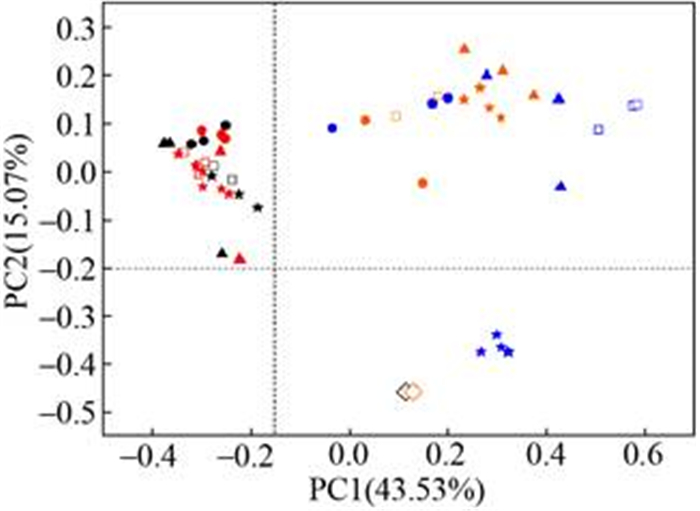 |
| 图 2 古菌群落结构的PCA分析 Figure 2 PCA analysis of archaea community structure. Black, red, blue and orange represent H301, H303, JM2 and JM4 respectively. ◇: initial state; □: control group; ●: acetate group; ★: propionate; ▲: butyrate group. |
| 图选项 |
群落结构分析发现,海拉尔盆地H301的优势古菌为Methanobacterium (相对丰度86.6%),二连盆地JM4的优势古菌为Methanocalculus (相对丰度64.3%)和Methanobacterium (相对丰度30.8%) (图 3),它们都具有还原CO2产生甲烷的能力[20]。添加挥发性脂肪酸富集培养后,Methanobacterium仍然是海拉尔煤层水中的优势古菌之一,相对丰度为24.3%–57.4%,此外复合营养型的产甲烷古菌Methanosarcina相对丰度也达到了29.7%–66.5%,这两种古菌的丰度超过了75.1% (图 3)。富集培养后,Methanocalculus仍然是二连盆地煤层水中的优势古菌之一(13.5%–63.4%),复合营养型Methanosarcina相对丰度升高到7.9%–51.3%,这两种微生物的丰度之和为21.4%–88.7% (图 3)。除H301的丙酸钠组外,添加丙酸钠后,Methanofollis在三口井的相对丰度都升到了15.6%–45.6% (图 3)。在乙酸钠组中的Methanoarcina丰度都明显高于丙酸钠、丁酸钠和对照组(图 3),表明Methanoarcina直接参与了乙酸钠的产甲烷代谢反应。
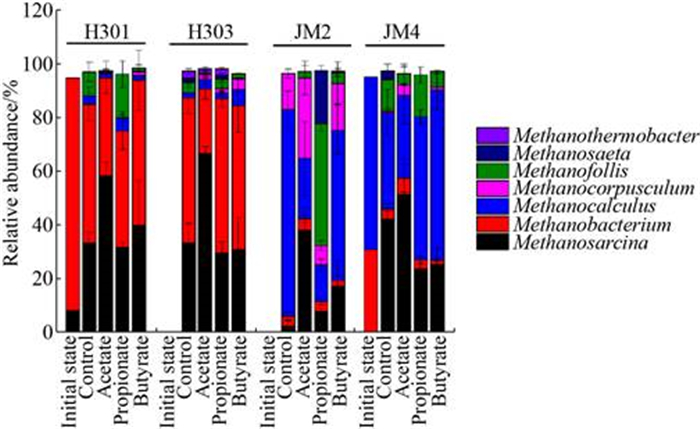 |
| 图 3 不同煤层水及富集物中的古菌群落结构(只展示了相对丰度≥1%的OTU) Figure 3 Archaeal community structure of coalbed production water and treatments. OTUs with relative abundance≥1% were shown in the figure. |
| 图选项 |
2.3 细菌群落结构 在细菌域中,有效测序条数为741507,单个样品平均测序条数为13482,细菌总共划分成1832个OTU (表 5)。H301、JM2、JM4的初始状态和丁酸钠处理组中的香农指数值为2.75–3.47,而丙酸钠处理的香农指数则分布于1.46–2.65 (表 5)。
表 5. 煤层水初始状态及富集培养后细菌测序数据 Table 5. Sequencing information of the bacterial communities in the original coalbed water and the enrichment cultures
| Coalbed water | Treatment | OTU | Sequence | Shannon index |
| H301 | Initial state | 270 | 17173 | 3.2 |
| H301 | Control | 312±21 | 17339±12 | 2.83±0.08 |
| H301 | Acetate | 387±65 | 17323±26 | 2.76±0.14 |
| H301 | Propionate | 275±33 | 17355±6 | 1.83±0.09 |
| H301 | Butyrate | 338±38 | 17333±22 | 3.04±0.1 |
| H303 | Initial state | 313 | 17059 | 2.75 |
| H303 | Control | 351±50 | 17338±14 | 2.84±0.16 |
| H303 | Acetate | 335±15 | 17334±17 | 2.83±0.14 |
| H303 | Propionate | 347±36 | 17336±11 | 2.88±0.16 |
| H303 | Butyrate | 309±11 | 17351±6 | 2.75±0.0009 |
| JM2 | Initial state | 230 | 17317 | 2.91 |
| JM2 | Control | 346±74 | 17295±22 | 2.54±0.59 |
| JM2 | Acetate | 345±35 | 17330±23 | 2.76±0.3 |
| JM2 | Propionate | 254±17 | 17353±6 | 1.46±0.15 |
| JM2 | Butyrate | 501±222 | 17305±32 | 3.47±0.86 |
| JM4 | Initial state | 397 | 17099 | 3.2 |
| JM4 | Control | 347±24 | 17326±4 | 2.53±0.13 |
| JM4 | Acetate | 428±129 | 17272±90 | 2.98±0.21 |
| JM4 | Propionate | 326±37 | 17327±31 | 2.65±0.06 |
| JM4 | Butyrate | 350±37 | 17312±57 | 3.02±0.28 |
表选项
初始状态的H301、JM2、JM4细菌群落结构相似度较高,聚集在一起,而H303的初始细菌群落则明显偏离(图 4)。厌氧培养后,不同处理组的细菌群落聚成四类:添加不同碳源的H303组聚为一类(图 4),H301、JM2、JM4的乙酸钠和丁酸钠组聚为一类,并且与原始煤层水的细菌群落结构最为接近(图 4),但是添加丙酸钠后的群落结构明显偏离初始状态,并聚为一簇(图 4)。不添加底物的对照组聚为一簇,部分与乙酸钠和丁酸钠组重叠(图 4)。
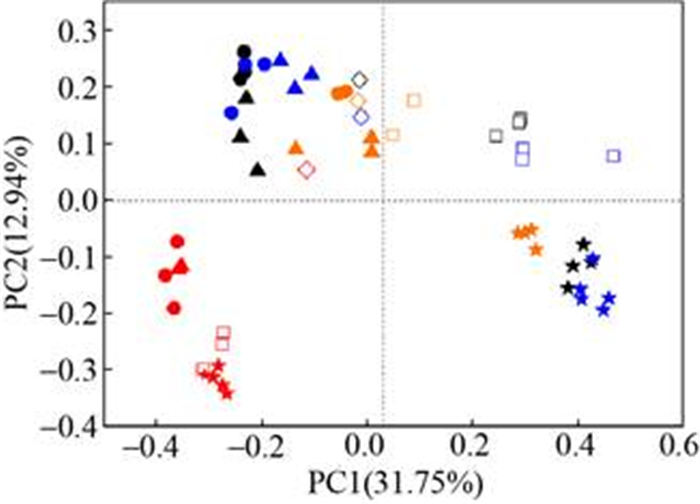 |
| 图 4 细菌群落结构的PCA分析 Figure 4 PCA analysis of bacteria community structure. Black, red, blue and orange represent H301, H303, JM2 and JM4 respectively. ◇: initial state; □: control group; ●: acetate group; ★: propionate; ▲: butyrate group. |
| 图选项 |
原始煤层水中细菌群落组成差别明显,H301的优势细菌是Hydrogenophaga (21.4%)和Rhizobium (25.6%),H303的优势细菌是Paludibacter(39.2%)和Pseudomonas (18.0%),JM2的优势细菌是Methylomonas (44.0%),JM4的优势细菌是Methylomonas (24.4%)和Hydrogenophaga (13.4%) (图 5)。富集培养后,乙酸钠处理组的优势细菌为Desulfovibrio (12.0%–41.0%) (图 5)。除此之外,JM4的乙酸钠处理组中的Candidatus Endomicrobium相对丰度升到18.9%±5.4%,它在原始煤层水和对照组中的丰度均低于1% (图 5)。除不具有丙酸代谢能力的H303,丙酸钠组的优势细菌是互营丙酸降解菌Syntrophobacter,它的相对丰度为39.6%–75.5% (图 5)。丁酸钠组中的优势细菌为Desulfovibrio (相对丰度14.7%–30.8%)和互营丁酸氧化菌Syntrophomonas (相对丰度8.5%–21.9%) (图 5)[21]。
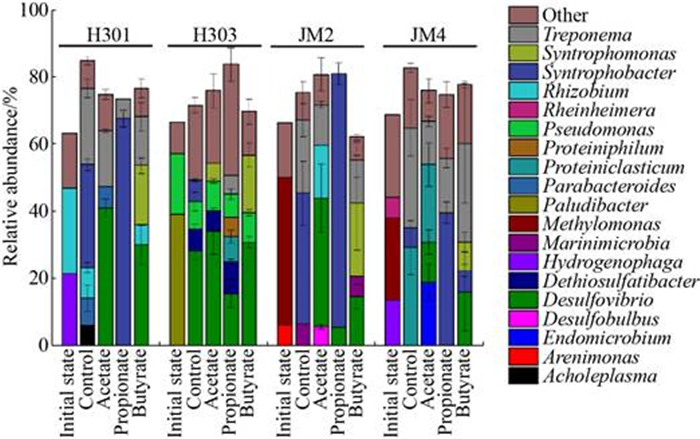 |
| 图 5 细菌群落结构(只展示相对丰度≥5%的OTU类群) Figure 5 Bacteria community structure. OTUs with relative abundance≥5% were shown in the figure. |
| 图选项 |
3 讨论和结论 本研究发现二连和海拉尔盆地的煤层水微生物具有代谢乙酸、丙酸和丁酸产甲烷的潜力。在产甲烷条件下,理论上有两条途径可以代谢乙酸产生甲烷:乙酸营养型产甲烷古菌直接裂解乙酸,将乙酸甲基碳转换为甲烷;另外一条途径是通过乙酸互营氧化,先产生氢和二氧化碳,再通过氢营养型产甲烷古菌转化为甲烷,这需要互营乙酸氧化菌和氢营养型产甲烷古菌共同参与[8, 22]。古菌群落结构分析显示,添加乙酸钠培养后,氢营养型产甲烷古菌相对丰度明显降低,而复合营养型产甲烷古菌Methanosarcina则被明显富集(图 2),细菌群落中也未发现互营乙酸氧化细菌(图 5)。因此,我们推测乙酸主要被产甲烷古菌直接转化为甲烷。但是,氢营养型产甲烷古菌也存在于乙酸钠处理组,表明乙酸互营氧化产甲烷途径可能也参与了乙酸代谢。至于这两种途径对乙酸代谢产生甲烷的贡献率,还有待于进一步研究。丙酸和丁酸代谢产甲烷过程,必须通过互营细菌和产甲烷古菌的合作[8, 22]。研究发现丙酸代谢产甲烷的延滞期和产甲烷速率都低于丁酸代谢产甲烷(图 1),这可能与互营代谢的热力学特征有关,丙酸互营降解的第一步较丁酸降解,在热力学上更不利(表 1)。此外,丙酸钠处理组的细菌群落与其他处理组和初始状态的群落结构相似度最低(图 4和图 5),表明煤层微生物为了适应丙酸代谢,需要剧烈调整群落结构,这可能也会影响丙酸代谢速率。
添加乙酸、丙酸和丁酸处理后,煤层水细菌和古菌群落结构变化趋势显著不同,古菌群落结构与样品来源地有关(图 2)。如海拉尔煤层水中优势古菌是Methanobacterium,添加挥发性脂肪酸后,优势古菌仍然是Methanobacterium (图 3)。类似的趋势也发生在二连盆地煤层水中,Methanocalculus是原始煤层水样品和富集培养后的优势古菌,此外Methanosarcina的丰度在所有处理组都显著增加(图 3)。细菌群落变化与挥发性脂肪酸添加类型有关,在乙酸钠组中,Desulfovibrio丰度显著上升,Desulfovibrio在硫酸盐还原条件下,具有化能异养潜力,可以不完全代谢复杂碳水化合物,如代谢乳酸产生乙酸,Desulfovibrio也可以与产甲烷古菌共培养,代谢乳酸、乙醇等简单化合物产生甲烷[23-24]。部分Desulfovibrio具有利用H2作为电子供体的能力,当它与Methanosarcina barkeri共培养条件下,虽然不能直接利用乙酸或甲醇,但是Methanosarcina或Methanosaeta代谢乙酸和/或甲醇过程中产生的H2,却可以被Desulfovibrio利用[25-26]。因此,在乙酸钠组中出现的Desulfovibrio,可能会竞争性利用乙酸氧化产生的低浓度H2生长。在丙酸钠和丁酸钠组中富集的Desulfovibrio,可能也是通过类似的策略获得了生长。互营丙酸降解菌Syntrophobacter在丙酸钠组中被显著富集,而在丁酸钠组,互营代谢C4–C18脂肪酸的Syntrophomonas被显著富集[8, 22],表明煤层水微生物通过互营方式代谢丙酸和丁酸。
煤炭生物气化需要不同功能的微生物参与完成,前人研究发现在煤层中存在丰富多样的细菌和古菌[6]。模拟培养也证明煤层微生物具有产甲烷代谢功能,但是这些研究多采用煤炭或产甲烷前体物作为底物,评价不同煤阶煤炭的产气潜力及产甲烷途径[14, 27-29]。挥发性脂肪酸是煤炭降解的重要中间代谢产物及限速步骤[22]。但是迄今为止,关于煤层微生物代谢挥发性脂肪酸研究鲜有报道。本研究通过厌氧模拟培养和微生物群落分析,证实了来自地下煤层中的煤层气井采出液中,存在互营挥发性脂肪酸代谢产甲烷菌系。这些研究进一步证实了通过激活或强化原位煤层中的微生物代谢功能,进行煤层气生物强化开发的可行性,并且对煤层中微生物功能微生物群落的分析和产甲烷潜力的评估,也为下一步开展生物强化煤层气开采研究提供了理论依据。
References
| [1] | Colosimo F, Thomas R, Lloyd JR, Taylor KG, Boothman C, Smith AD, Lord R, Kalin RM. Biogenic methane in shale gas and coal bed methane:a review of current knowledge and gaps. International Journal of Coal Geology, 2016, 165: 106-120. DOI:10.1016/j.coal.2016.08.011 |
| [2] | Park SY, Liang YN. Biogenic methane production from coal:a review on recent research and development on microbially enhanced coalbed methane (MECBM). Fuel, 2016, 166: 258-267. DOI:10.1016/j.fuel.2015.10.121 |
| [3] | Scott AR, Kaiser WR, Ayers Jr WB. Thermogenic and secondary biogenic gases, San Juan Basin, Colorado and New Mexico-implications for coalbed gas producibility. AAPG Bulletin, 1994, 78(8): 1186-1209. |
| [4] | Ju YW, Li QG, Yan ZF, Sun Y, Bao Y. Origin types of CBM and their geochemical research progress. Journal of China Coal Society, 2014, 39(5): 806-815. (in Chinese) 琚宜文, 李清光, 颜志丰, 孙盈, 鲍园. 煤层气成因类型及其地球化学研究进展. 煤炭学报, 2014, 39(5): 806-815. |
| [5] | Iram A, Akhtar K, Ghauri MA. Coal methanogenesis:a review of the need of complex microbial consortia and culture conditions for the effective bioconversion of coal into methane. Annals of Microbiology, 2017, 67(3): 275-286. DOI:10.1007/s13213-017-1255-5 |
| [6] | Str?po? D, Mastalerz M, Dawson K, Macalady J, Callaghan AV, Wawrik B, Turich C, Ashby M. Biogeochemistry of microbial coal-bed methane. Annual Review of Earth and Planetary Sciences, 2011, 39: 617-656. DOI:10.1146/annurev-earth-040610-133343 |
| [7] | Schink B. Energetics of syntrophic cooperation in methanogenic degradation. Microbiology and Molecular Biology Reviews, 1997, 61(2): 262-280. DOI:10.1128/.61.2.262-280.1997 |
| [8] | Zhang X, Zhang H, Cheng L. Key players involved in methanogenic degradation of organic compounds:progress on the cultivation of syntrophic bacteria. Acta Microbiologica Sinica, 2019, 59(2): 211-223. (in Chinese) 张雪, 张辉, 承磊. 获取有机物厌氧降解产甲烷过程中关键功能类群——互营细菌培养物. 微生物学报, 2019, 59(2): 211-223. |
| [9] | Zhang DY, Zhu J, Zhao XL, Gao X, Geng M, Chen G, Jiao J, Liu ST. Dynamic assessment of coalbed methane resources and availability in China. Journal of China Coal Society, 2018, 43(6): 1598-1604. (in Chinese) 张道勇, 朱杰, 赵先良, 高煖, 庚勐, 陈刚, 焦健, 刘思彤. 全国煤层气资源动态评价与可利用性分析. 煤炭学报, 2018, 43(6): 1598-1604. |
| [10] | Sun FJ, Li WZ, Sun QP, Sun B, Tian WG, Chen YJ, Chen ZH. Low-rank coalbed methane exploration in Jiergalangtu sag, Erlian Basin. Acta Petrolei Sinica, 2017, 38(5): 485-492. (in Chinese) 孙粉锦, 李五忠, 孙钦平, 孙斌, 田文广, 陈彦君, 陈振宏. 二连盆地吉尔嘎朗图凹陷低煤阶煤层气勘探. 石油学报, 2017, 38(5): 485-492. |
| [11] | Lu SF, Shen JN, Wang ZP, Li C. Resource evaluation of coalbed gas and potential analysis in Hailar Basin. Coal Geology & Exploration, 2003, 31(6): 28-31. (in Chinese) 卢双舫, 申家年, 王振平, 李椿. 海拉尔盆地煤层气资源评价及潜力分析. 煤田地质与勘探, 2003, 31(6): 28-31. DOI:10.3969/j.issn.1001-1986.2003.06.009 |
| [12] | Liu HL, Li JM, Wang HY, Zhao QB. Exploring foreground of low rank coal basins in eastern inner mongolia of China. Natural Gas Geoscience, 2005, 16(6): 771-775. (in Chinese) 刘洪林, 李景明, 王红岩, 赵庆波. 内蒙古东部低煤阶含煤盆地群的煤层气勘探前景. 天然气地球科学, 2005, 16(6): 771-775. DOI:10.3969/j.issn.1672-1926.2005.06.018 |
| [13] | Sun QP, Wang SW, Tian WG, Sun B, Chen YJ, Yang Q, Chen H, Yang MF, Qi L. Accumulation patterns of low-rank coalbed methane gas in the Jiergalangtu Sag of the Erlian Basin. Natural Gas Industry, 2018, 38(4): 59-66. (in Chinese) 孙钦平, 王生维, 田文广, 孙斌, 陈彦君, 杨青, 陈浩, 杨敏芳, 祁灵. 二连盆地吉尔嘎朗图凹陷低煤阶煤层气富集模式. 天然气工业, 2018, 38(4): 59-66. |
| [14] | He Q, Ding C, Li GZ, Chen H, Cheng L, Zhang H. Methane-generating potential of coal samples with different maturity. Acta Microbiologica Sinica, 2013, 53(12): 1307-1317. (in Chinese) 何乔, 丁晨, 李贵中, 陈浩, 承磊, 张辉. 不同成熟度煤样产甲烷潜力. 微生物学报, 2013, 53(12): 1307-1317. |
| [15] | Beckmann S, Luk AWS, Gutierrez-Zamora ML, Chong NHH, Thomas T, Lee M, Manefield M. Long-term succession in a coal seam microbiome during in situ biostimulation of coalbed-methane generation. The ISME Journal, 2019, 13(3): 632-650. DOI:10.1038/s41396-018-0296-5 |
| [16] | Powell GE. Interpreting gas kinetics of batch cultures. Biotechnology Letters, 1983, 5(7): 437-440. DOI:10.1007/BF00132224 |
| [17] | Yu Y, Lee C, Kim J, Hwang S. Group-specific primer and probe sets to detect methanogenic communities using quantitative real-time polymerase chain reaction. Biotechnology and Bioengineering, 2005, 89(6): 670-679. DOI:10.1002/bit.20347 |
| [18] | Herfort L, Kim JH, Coolen MJL, Abbas B, Schouten S, Herndl GJ, Sinninghe Damsté JS. Diversity of Archaea and detection of crenarchaeotal amoA genes in the rivers Rhine and Têt. Aquatic Microbial Ecology, 2009, 55(2): 189-201. |
| [19] | Tu B, Domene X, Yao MJ, Li CN, Zhang SH, Kou YP, Wang YS, Li XZ. Microbial diversity in Chinese temperate steppe:unveiling the most influential environmental drivers. FEMS Microbiology Ecology, 2017, 93(4): fix031. DOI:10.1093/femsec/fix031 |
| [20] | Cheng L, Zheng ZZ, Wang C, Zhang H. Recent advances in methanogens. Microbiology China, 2016, 43(5): 1143-1164. (in Chinese) 承磊, 郑珍珍, 王聪, 张辉. 产甲烷古菌研究进展. 微生物学通报, 2016, 43(5): 1143-1164. |
| [21] | Zhang CY, Liu XL, Dong XZ. Syntrophomonas curvata sp. nov., an anaerobe that degrades fatty acids in co-culture with methanogens. International Journal of Systematic and Evolutionary Microbiology, 2004, 54(3): 969-973. DOI:10.1099/ijs.0.02903-0 |
| [22] | Sieber JR, McInerney MJ, Gunsalus RP. Genomic insights into syntrophy:the paradigm for anaerobic metabolic cooperation. Annual Review of Microbiology, 2012, 66: 429-452. DOI:10.1146/annurev-micro-090110-102844 |
| [23] | McInerney MJ, Bryant MP. Anaerobic degradation of lactate by syntrophic associations of methanosarcina barkeri and Desulfovibrio species and effect of H2 on acetate degradation. Applied and Environmental Microbiology, 1981, 41(2): 346-354. DOI:10.1128/AEM.41.2.346-354.1981 |
| [24] | Tatton MJ, Archer DB, Powell GE, Parker ML. Methanogenesis from ethanol by defined mixed continuous cultures. Applied and Environmental Microbiology, 1989, 55(2): 440-445. DOI:10.1128/AEM.55.2.440-445.1989 |
| [25] | Phelps TJ, Conrad R, Zeikus JG. Sulfate-dependent interspecies H2 transfer between Methanosarcina barkeri and Desulfovibrio vulgaris during coculture metabolism of acetate or methanol. Applied and Environmental Microbiology, 1985, 50(3): 589-594. DOI:10.1128/AEM.50.3.589-594.1985 |
| [26] | Ozuolmez D, Na H, Lever MA, Kjeldsen KU, J rgensen BB, Plugge CM. Methanogenic archaea and sulfate reducing bacteria co-cultured on acetate:teamwork or coexistence?. Frontiers in Microbiology, 2015, 6: 492. |
| [27] | Davis KJ, Barnhart EP, Fields MW, Gerlach R. Biogenic coal-to-methane conversion efficiency decreases after repeated organic amendment. Energy & Fuels, 2018, 32(3): 2916-2925. |
| [28] | Guo HG, Yu ZS, Thompson IP, Zhang HX. A contribution of hydrogenotrophic methanogenesis to the biogenic coal bed methane reserves of Southern Qinshui Basin, China. Applied Microbiology and Biotechnology, 2014, 98(21): 9083-9093. DOI:10.1007/s00253-014-5908-z |
| [29] | Papendick SL, Downs KR, Vo KD, Hamilton SK, Dawson GKW, Golding SD, Gilcrease PC. Biogenic methane potential for Surat Basin, Queensland coal seams. International Journal of Coal Geology, 2011, 88(2/3): 123-134. |
