商振达1,2, 商鹏1,3, 刘锁珠1,2, 谭占坤1,2, 王宏辉1,2, 孔庆辉1


1. 西藏农牧学院动物科学学院, 西藏 林芝 860000;
2. 西藏高原饲料加工工程研究中心, 西藏 林芝 860000;
3. 藏猪协作研究中心, 西藏 林芝 860000
收稿日期:2020-05-12;修回日期:2020-07-22;网络出版日期:2020-02-10
基金项目:西藏自治区厅校联合基金[XZ2019ZRG-55(Z)]; 中央引导地方项目(YDZX20195400004426);中央财政支持地方高校发展专项资金(ZZXT2019-02);中央支持地方高校改革发展资金(2018XZ503118003)
*通信作者:孔庆辉, Tel/Fax: +86-894-5822924;E-mail: 770337011@qq.com.
摘要:[目的] 肠道是动物的主要消化器官,同时也是机体抵抗外源病原菌的重要屏障,已有研究表明,动物的品种、饲养方式、生长阶段均会影响动物的肠道菌群结构,但对舍饲和放牧饲养条件下藏猪的肠道菌群结构,以及藏猪和长白、约克与杜洛克三元杂交猪(DLY猪)的肠道菌群结构是否有差异,尚未见报道。[方法] 本研究选取6-7月龄的放牧藏猪、舍饲藏猪和DLY猪的小肠组织,分别采用组织切片法测定各试验猪的肠道形态、酶活性测定试剂盒测定肠道内容物的消化酶活性,高通量测序法测定肠道微生物。[结果] DLY猪小肠的肌层厚度和绒毛高度高于藏猪,而隐窝深度低于藏猪;舍饲藏猪和放牧藏猪的小肠形态没有显著变化。DLY猪小肠的胰蛋白酶活性高于藏猪,而淀粉酶活性低于藏猪。三组猪小肠微生物的优势菌门均为Proteobacteria、Firmicutes和Bacteroidetes;藏猪的优势菌属为Ralstonia和Escherichia,而DLY猪的优势菌属为Ralstonia和Bradyrhizobium,但含量却存在显著性差异。舍饲藏猪与放牧藏猪肠道菌群结构相似度较高,而藏猪与DLY猪肠道菌群结构相似度较低。[结论] 放牧藏猪、舍饲藏猪和DLY猪的小肠形态、消化酶活性和肠道菌群结构均存在显著性差异。
关键词:藏猪DLY猪小肠形态消化酶活性肠道微生物多样性
Intestinal morphology, digestive enzymes and bacterial diversity of Tibetan pigs
Zhenda Shang1,2, Peng Shang1,3, Suozhu Liu1,2, Zhankun Tan1,2, Honghui Wang1,2, Qinghui Kong1


1. College of Animal Science, Tibet Agricultural & Animal Husbandry University, Nyingchi 860000, Tibet, China;
2. Tibetan Plateau Feed Processing Research Center, Nyingchi 860000, Tibet, China;
3. Tibetan Pig Collaborative Research Center, Nyingchi 860000, Tibet, China
Received: 12 May 2020; Revised: 22 July 2020; Published online: 10 February 2020
*Corresponding author: Qinghui Kong, Tel/Fax: +86-894-5822924; E-mail: 770337011@qq.com.
Foundation item: Supported by the Tibet Autonomous Region Department and College Joint Foundation-Key Project[XZ2019ZRG-55(Z)], by the Central Government Guides Local Projects (YDZX20195400004426), by the Central Government Supports Local Universities in Special Development Fund Projects (ZZXT2019-02) and by the Central Government Supports Local Universities in Reform and Development Fund Projects (2018XZ503118003)
Abstract: [Objective] The intestinal tract comprises the main digestive organs of animals and is an important barrier that confers organism resistance to exogenous pathogens. The intestinal flora of animals is reportedly related to animal species, feeding methods and growth stage. However, it is unclear whether the intestinal bacteria of house-feeding Tibetan, grazing Tibetan and Landrace, York and Duroc (DLY) three-way hybrid pigs differ. [Methods] The intestinal tissues of 6-month-old to 7-month-old grazing Tibetan, house-feeding Tibetan and DLY pigs were selected. The intestinal morphology of each pig was determined by tissue section method. The digestive enzyme activity of intestinal contents was determined by using an enzyme activity assay kit. The intestinal microbiota was examined through high-throughput sequencing technology. [Results] The muscular thickness and villus height of duodenum, jejunum and ileum of DLY pigs were significantly higher than those of Tibetan pigs. The crypt depth of the duodenum, jejunum and ileum of DLY pigs was significantly lower than that of Tibetan pigs. The intestinal morphology was not significantly different between grazing and house-feeding Tibetan pigs. The trypsin activity in the small intestines of DLY pigs was remarkably higher than that of Tibetan pigs, whereas the amylase activity in the small intestines of DLY pigs was noticeably lower than that of Tibetan pigs. The dominant phyla in all three groups were Proteobacteria, Firmicutes and Bacteroidetes. The dominant genera in Tibetan pigs were Ralstonia and Escherichia, whereas the dominant genera in DLY pigs were Ralstonia and Bradyrhizobium, but the contents were significantly different. The similarity of the intestinal bacterial community structure between house-feeding and grazing Tibetan pigs was higher than that between Tibetan and DLY pigs. [Conclusion] Significant differences in intestinal morphology, digestive enzyme activity and intestinal microbial structure were observed among grazing Tibetan, house-feeding Tibetan and DLY pigs.
Keywords: Tibetan pigsDLY pigsintestinal morphologydigestive enzymeintestinal microbial diversity
藏猪不仅是世界上少有的高原型猪种,也是我国重点保护的地方品种[1-2]。由于藏猪长期生存于高寒、低氧、强紫外线的自然环境中,赋予了藏猪耐粗饲、耐高寒、抗病力强、肉质细嫩以及鬓毛粗长等独特的经济性状[3-4]。但是,恶劣的自然条件加之粗放的饲养管理,同时也导致藏猪的生长速度缓慢、繁殖性能较低[5-6]。因此,研究如何提高藏猪的生产性能,对高原畜牧业发展具有重要意义。
肠道是动物的主要消化器官,同时也是机体抵抗外源病原菌的重要屏障[7-9]。肠道的健康和营养物质消化吸收有着密切的关系,其粘膜结构与功能的完整性是动物体充分吸收营养物质的重要保障[10]。动物肠道上皮由粘膜层、粘膜下层、肌层和浆膜层组成。肠道的粘膜层有很多特殊的结构,如褶皱、绒毛和微绒毛,这些结构能够增加肠道表面积,从而促进机体对营养物质的吸收[11]。绒毛高度、隐窝深度和多种消化酶活性是衡量肠道粘膜正常功能的重要指标。绒毛增高,肠道内皮表面积增大,隐窝变浅,肠道上皮细胞的成熟率上升。因此,绒毛高度和隐窝深度的比值能够反映肠道的吸收功能[12-13]。肠道微生物在维持肠道稳态和宿主健康中起着至关重要的作用。肠道微生物的种类和结构特征与动物体的生长发育、生理代谢和机体免疫均有重要关系[14]。
当前,大量研究表明,动物肠道对动物的生长发育具有重要作用[15-16],但对藏猪的肠道形态和肠道微生物研究相对较少。为此,本研究对舍饲藏猪、放牧藏猪和DLY猪的小肠形态、消化酶活性和肠道微生物进行对比分析,探讨饲养方式和品种对藏猪的肠道结构和消化吸收功能的影响,为藏猪的饲养管理提供参考。
1 材料和方法 1.1 试验动物及样品处理 本研究分别选取5头体重为41.00±6.18 kg月龄为7月的放牧藏猪(FZD组)、5头体重为72.75±5.75 kg月龄为7月的舍饲藏猪(SZD组),以及5头体重为107.37±7.50 kg月龄为6月的舍饲DLY猪(DLY猪为利用长白、约克与杜洛克猪,进行三元杂交生产的商品猪)(SDD组)进行试验。整个饲养过程中,舍饲藏猪和DLY猪均饲喂基础日粮,放牧藏猪主要采食紫花苜蓿、灰蓼头草等牧草;早晚归牧后少量补饲玉米(表 1和表 2)。三组试验动物停食24 h后屠宰,快速采集十二指肠、空肠和回肠,将采集的各肠段组织样用生理盐水冲洗,迅速放入4%的福尔马林溶液中固定,用来测定各肠段的组织形态;同时分别采集2份各肠段组织样品,装入50 mL冻存管中,放入液氮中速冻,用来测定各肠段消化酶的活性和肠道微生物。
表 1. 基础饲粮组成成分 Table 1. Composition of the basal diet
| Ingredients | Maize/% | Soybean meal/% | Bran/% | Fishmeal/% | Premix/% | Chlortetracycline/(mg/kg) |
| Content | 60 | 25 | 10 | 1 | 4 | 940 |
| ??The premix provided the following per kg of diets: VA 65–200 KIU, VD3 15.0–62.5 KIU, VE≥150 mg, VK3 20–75 mg, VB1≥12.5 mg, VB2≥37.5 mg, VB6≥17.5 mg, VB12≥0.125 mg, Nicotinamide≥237.5 mg, Pantothenic acid≥140 mg, Folic acid≥140 mg, d-Biotin≥0.5 mg, Choline Chloride≥2500 mg, Cu 250–1562 mg, Fe 750–3750 mg, Zn 625–1375 mg, Mn 200–1875 mg, I 3.75–50.00 mg, Se 1.50–6.25 mg, Ca 5.0%–10.0%, Total P≥1.0%, NaCl 3.0%–7.0%, Lysine≥1.5%, Phytase > 6250 U. | ||||||
表选项
表 2. 基础日粮和饲草料主要化学成分 Table 2. The main chemical composition of basic diets and forage
| Item | Basic diets | Alfalfa | Chenopodium glaucum | Maize |
| Dry matter/(g/kg FW) | 876.66 | 282.64 | 326.68 | 198.64 |
| Crude protein/(g/kg DM) | 218.56 | 204.59 | 144.14 | 86.10 |
| Ether extract/(g/kg DM) | 81.82 | 53.74 | 63.28 | 75.24 |
| Crude fiber/(g/kg DM) | 132.7 | 285.5 | 251.2 | 288.10 |
| Water soluble carbohydrate/(g/kg DM) | 69.28 | 48.74 | 38.23 | 240.60 |
| Crude ash/(g/kg DM) | 94.32 | 75.62 | 80.56 | 64.86 |
表选项
1.2 肠道形态测定 用4%多聚甲醛固定24 h后的肠段组织样本,经流水冲洗30 min,进行组织修块,放入组织包埋塑料筐中进行脱水24 h,透明35 min,浸蜡3 h,最后包埋组织块于石蜡中。采用Leica RM2235切片机将组织切成5 μm厚的薄片,在温水中将组织展平后捞在载玻片上,60 ℃烘烤切片2 h。切片经二甲苯脱蜡后,流水洗涤20 min,苏木素染色30 min,流水洗涤20 min,盐酸酒精分化,伊红染色5 min,最后梯度酒精脱水,二甲苯透明后用树脂胶封片。显微成像系统对组织样品拍照,采用Image Pro Plus 6.0对各肠段的绒毛高度、隐窝深度和肌层厚度进行测量,并计算出绒隐比。
1.3 消化酶活性的测定 分别采用南京建成科技有限公司生产的脂肪酶测试盒(商品批号:20191108)、α淀粉酶试剂盒(商品批号:20191115)和胰蛋白酶测试盒(商品批号:20191114)测定各试验动物十二指肠、空肠和回肠组织上清液中的脂肪酶、淀粉酶和胰蛋白酶活性,严格按照试剂盒说明书进行操作。
1.4 肠道微生物测定 取每只试验猪的十二指肠、空肠和回肠各0.5 g混合装入5 mL的灭菌试管中,作为小肠样品。使用QIAGEN公司的QIAamp Fast DNA Stool Mini试剂盒提取小肠微生物的总DNA。以提取的基因组DNA为模板,使用上游引物(F341:ACTCCTAC GGGAGGCAGCA)和下游引物(R518:GGACTAC HVGGGTWTCTAAT)对细菌V3-V4区进行PCR扩增。将PCR扩增所获得的产物通过2%琼脂糖凝胶电泳进行检测,并对目标片段进行切胶回收。采用Illumina公司的TruSeq Nano DNA LT Library Prep Kit制备测序文库。采用Agilent High Sensitivity DNA Kit对文库在Agilent Bioanalyzer上进行质检。将合格的文库使用MiSeq测序仪进行2×300 bp的双端测序(上海派森诺生物科技股份有限公司)。
1.5 数据统计分析 对前述获得的序列按97%的序列相似度进行归并和操作分类单元(operational taxonomic unit,OTUs)划分[17],并选取每个OTU中丰度最高的序列作为该OTU的代表序列。将OTU代表序列与对应数据库(Greengenes)的模板序列相比对[18],获取每个OTU所对应的分类学信息。利用5种度量指数(Chao1、Shannon、Simpson、Pielou_e和Observed_species)来计算微生物菌群的多样性、丰富度和均匀度;通过主成分分析(principal component analysis,PCA)考察不同样本之间群落结构的相似性[19];使用IBM SPSS Statistics软件对试验数据进行单因素方差分析。
2 结果和分析 2.1 不同试验组猪小肠形态测定结果 3个试验组猪小肠形态的测定结果显示,不同试验组猪小肠的肌层厚度不同,其中DLY猪空肠和回肠的肌层厚度显著高于放牧藏猪和舍饲藏猪(P < 0.05),而放牧藏猪和舍饲藏猪小肠肌层厚度没有显著性差异(P > 0.05);DLY猪小肠的绒毛高度显著高于放牧藏猪和舍饲藏猪,而隐窝深度显著低于放牧藏猪和舍饲藏猪(P < 0.05);相应的,DLY猪小肠的绒隐比显著高于藏猪(P < 0.05);舍饲藏猪回肠的绒毛高度显著高于放牧藏猪,而隐窝深度显著低于放牧藏猪(P < 0.05)(表 3)。
表 3. 不同试验组猪肠道形态的测定结果 Table 3. The measurement result of intestinal morphology in different groups (μm)
| Items | Intestinal tract | Groups | ||
| FZD | SZD | SDD | ||
| Muscular thickness | Duodenum | 402.37±38.38Ba | 404.76±42.28Ba | 552.02±114.32Ba |
| Jejunum | 243.43±27.55Aa | 259.10±11.52Aa | 380.99±34.86Ab | |
| Ileum | 511.45±30.08Ca | 552.57±24.39Ca | 693.60±64.44Cb | |
| Villus height | Duodenum | 567.29±23.12Ba | 542.18±18.90Ba | 645.04±29.80Bb |
| Jejunum | 455.36±13.79Aa | 460.85±20.31Aa | 532.50±39.99Ab | |
| Ileum | 495.37±35.71Aa | 518.04±49.62ABab | 580.08±25.61Ab | |
| Crypt depth | Duodenum | 338.30±15.73Cb | 323.76±19.53Cb | 243.31±14.41Ba |
| Jejunum | 269.46±10.72Bb | 257.99±21.56Bb | 148.87±7.77Aa | |
| Ileum | 211.97±26.13Ab | 203.37±11.27Aab | 168.36±19.28Aa | |
| V/C | Duodenum | 1.67±0.01Aa | 1.67±0.04Aa | 2.65±0.21Ab |
| Jejunum | 1.69±0.02Aa | 1.79±0.07Aa | 3.57±0.08Bb | |
| Ileum | 2.35±0.25Ba | 2.54±0.10Ba | 3.48±0.52Bb | |
| Values with different little letters show significant differences among different groups in the same intestinal segment (P < 0.05), values with different capital letters show significant difference among different intestinal segment in the same groups (P < 0.05), the same as below. | ||||
表选项
除此之外,研究还发现,肠段不同其肠道形态也不同。藏猪回肠的肌层厚度显著高于十二指肠和空肠,藏猪十二指肠的隐窝深度和绒毛高度显著高于空肠和结肠(P < 0.05);DLY猪回肠的肌层厚度显著高于十二指肠和空肠(P < 0.05),DLY猪十二指肠的隐窝深度和绒毛高度高于回肠和空肠(P < 0.05)。
2.2 不同试验组猪肠道消化酶测定结果 比较不同试验组猪小肠各消化酶活性可知,DLY猪空肠和回肠的胰蛋白酶活性显著高于藏猪,DLY猪十二指肠脂肪酶活性显著低于藏猪,而DLY猪十二指肠、空肠和回肠的淀粉酶活性显著低于藏猪(P < 0.05);而比较放牧藏猪和舍饲藏猪时发现,舍饲藏猪和放牧藏猪小肠的胰蛋白酶、脂肪酶和淀粉酶活性均无显著差异(P > 0.05)(表 4)。
表 4. 不同试验组猪肠道消化酶活性的测定结果 Table 4. The measurement result of intestinal digestive enzymes activities in different groups (U/g)
| Items | Intestinal tract | Groups | ||
| FZD | SZD | SDD | ||
| Trypsin | Duodenum | 12826.66±2164.93Aa | 11555.55±1942.11Aa | 15369.88±2036.22Aa |
| Jejunum | 16524.44±1114.37Ba | 17680.00±2773.33Ba | 21724.44±1778.95Bb | |
| Ileum | 11093.33±1040.00Aa | 13057.77±1971.22Aa | 17217.77±3557.91ABb | |
| Lipase | Duodenum | 2.05±0.30Bb | 2.53±0.32Bb | 1.45±0.23Aa |
| Jejunum | 1.42±0.16Aa | 1.51±0.12Aa | 1.51±0.23Aa | |
| Ileum | 1.54±0.14Aa | 1.73±0.16Aa | 1.60±0.13Aa | |
| Amylase | Duodenum | 4.25±0.28Ab | 4.30±0.03Ab | 3.08±0.40Aa |
| Jejunum | 4.48±0.27Ab | 4.13±0.38Ab | 3.44±0.15Aa | |
| Ileum | 4.33±0.25Ab | 4.27±0.31Ab | 3.60±0.17Aa | |
表选项
相同试验组不同肠段中各消化酶活性比较显示,其中DLY猪和藏猪空肠的胰蛋白酶活性显著高于十二指肠和回肠,放牧藏猪和舍饲藏猪十二指肠的脂肪酶活性显著高于空肠和回肠(P < 0.05);DLY猪、舍饲藏猪和放牧藏猪十二指肠、空肠和回肠的淀粉酶活性无显著差异(P > 0.05)(表 4)。
2.3 不同试验组猪肠道微生物测定结果
2.3.1 肠道细菌群落多样性分析: 舍饲藏猪、放牧藏猪和DLY猪肠道细菌Alpha多样性指数如表 5所示,Good’s coverage分析表明,每个分组中测得了99%的细菌种类。Simpson和Shannon指数在舍饲藏猪、放牧藏猪和DLY猪间存在显著性差异,说明三组猪肠道细菌多样性存在显著差异;Chao1和Observed species指数在三组猪之间存在显著性差异,说明三组猪肠道细菌丰富度存在显著差异;而Pielou’s evenness指数在舍饲藏猪、放牧藏猪和DLY猪间也存在显著性差异,说明三组猪肠道均匀度也存在显著差异。
表 5. 不同试验组猪肠道样品Alpha多样性指数表 Table 5. Number of alpha diversity indices of pig intestinal samples in different groups
| Groups | Chao1 | Simpson | Shannon | Pielou_e | Observed_species | Goods_coverage |
| FZD | 99.92±12.73ab | 0.72±0.03b | 2.88±0.19ab | 0.46±0.07ab | 85.84±19.05ab | 0.99 |
| SFD | 82.67±12.90a | 0.67±0.05a | 2.47±0.64a | 0.40±0.07a | 71.84±10.62a | 0.99 |
| SDD | 109.38±19.75b | 0.75±0.02b | 3.27±0.40b | 0.49±0.03b | 96.92±12.50b | 0.99 |
| Values with different little letters show that the indices had significant differences among different groups (P < 0.05). | ||||||
表选项
使用主坐标分析法(PCoA)检验舍饲藏猪、放牧藏猪和DLY猪肠道细菌群落结构差异,在PCoA图中,每个点代表一个样本,不同颜色的点指示不同的样本(组)。坐标轴括号中的百分比代表了对应的坐标轴所能解释的样本差异数据的比例。两点在坐标轴上的投影距离越近,表明这2个样本在相应维度中的群落组成越相似。舍饲藏猪和放牧藏猪组间样本距离较近,而与DLY猪组间距离较远,说明舍饲藏猪和放牧藏猪肠道细菌群落结构较为相似,而与DLY猪之间存在显著差异(图 1)。
 |
| 图 1 不同试验组肠道细菌群落PCoA图 Figure 1 PCoA of pig intestinal bacterial population structures in different groups. |
| 图选项 |
2.3.2 肠道细菌群落组成分析: 从15个猪小肠样本中共检测出11个门、20个纲、34个目、57个科和64个属的微生物。在细菌门分类水平上,所有样本中相对含量大于0.1%的细菌门共有7个,分别为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、梭杆菌门(Fusobacteria)、放线菌门(Actinobacteria)、软壁菌门(Tenericutes)和栖热菌门(Deinococcus-Thermus)。其中变形菌门、厚壁菌门和拟杆菌门为所有样品中的优势菌群(相对含量大于1.0%),在不同猪肠道中3种菌门所占比例分别为:放牧藏猪75.39%、10.82%和8.89%,舍饲藏猪88.08%、4.26%和3.91%,DLY猪82.58%、9.27%和3.25% (图 2)。
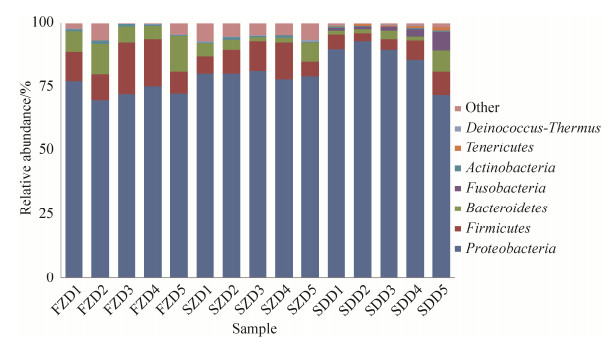 |
| 图 2 不同试验组猪肠道样品门分类水平物种组成 Figure 2 Pig intestinal bacterial compositions at phylum level in different groups. |
| 图选项 |
在细菌属分类水平上,所有样本中相对含量大于1.0%的细菌属共有8个,依次为青枯菌属(Ralstonia)、埃希氏菌属(Escherichia)、慢生根瘤菌属(Bradyrhizobium)、乳酸菌属(Lactobacillus)、普雷沃氏菌属(Prevotella)、链球菌属(Streptococcus)、梭菌属(Clostridium)和苍白杆菌属(Ochrobactrum)。放牧藏猪小肠属水平的优势菌依次为青枯菌属(42.45%)、埃希氏菌属(20.57%)和普雷沃氏菌属(7.43%);舍饲藏猪小肠属水平的优势菌依次为青枯菌属(52.75%)、埃希氏菌属(16.00%)和乳酸菌属(4.86%);DLY猪小肠属水平的优势菌依次为青枯菌属(38.38%)、慢生根瘤菌属(29.99%)和埃希氏菌属(6.75%)(图 3)。
 |
| 图 3 不同试验组猪肠道样品属分类水平物种组成 Figure 3 Pig intestinal bacterial compositions at genus level in different groups. |
| 图选项 |
2.3.3 肠道细菌群落组间差异分析: 对舍饲藏猪、放牧藏猪和DLY猪小肠主要菌群的丰度进行差异性分析。结果得到,在门水平上,变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、梭杆菌门(Fusobacteria)和软壁菌门(Tenericutes)的相对丰度在舍饲藏猪、放牧藏猪和DLY猪之间具有显著性差异。与舍饲藏猪对比,放牧藏猪中变形菌门的含量降低,而厚壁菌门的含量升高;DLY猪中,变形菌门的含量升高,而厚壁菌门的含量下降。放牧藏猪小肠中拟杆菌门的含量显著高于舍饲藏猪和DLY猪(P < 0.05),而舍饲藏猪和DLY猪小肠中拟杆菌门的含量没有显著性变化(P > 0.05)。值得注意的是,只有DLY猪种检测到了梭杆菌门和软壁菌门,而在舍饲藏猪和放牧藏猪中没有检查到该两种菌门(图 4)。
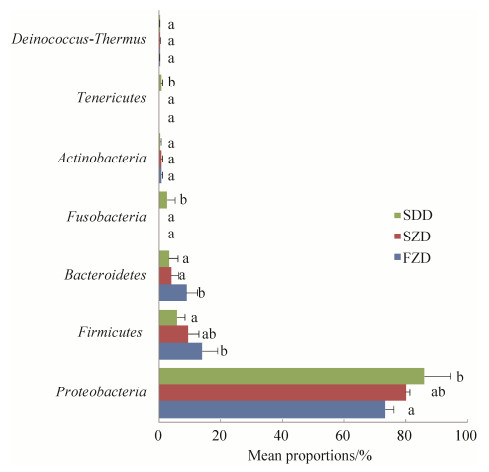 |
| 图 4 不同试验组猪肠道细菌门水平差异检验 Figure 4 Statistical comparison of pig intestinal bacteria at phylum level among different groups. |
| 图选项 |
在属水平上,埃希氏菌属(Escherichia)、慢生根瘤菌属(Bradyrhizobium)、普雷沃氏菌属(Prevotella)、梭菌属(Clostridium)和苍白杆菌属(Ochrobactrum)的相对丰度在3组之间具有显著性差异。DLY猪小肠中埃希氏菌属的含量低于舍饲藏猪和放牧藏猪,而慢生根瘤菌属的含量高于舍饲藏猪和放牧藏猪。放牧藏猪小肠中普雷沃氏菌属含量高于舍饲藏猪,而舍饲藏猪小肠中普雷沃氏菌属含量高于DLY猪。除此之外,放牧藏猪梭菌属的含量高于舍饲藏猪和DLY猪,DLY猪苍白杆菌属的含量高于放牧藏猪和舍饲藏猪(图 5)。
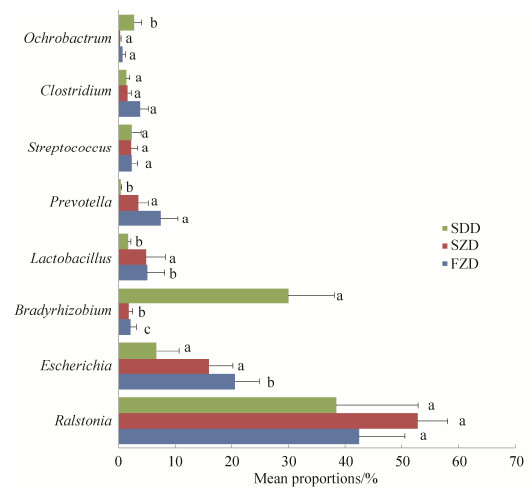 |
| 图 5 不同试验组猪肠道细菌属水平差异检验 Figure 5 Statistical comparison of pig intestinal bacteria at genus level among different groups. |
| 图选项 |
3 讨论和结论 肠道的发育与动物的营养吸收密切相关,尤其是绒毛高度、隐窝深度和肌层厚度是衡量肠道消化吸收的重要指标[10]。绒毛高度增高,可以增加小肠与肠道内容物的接触面积,并对消化酶的活性具有重要意义。藏猪为西藏高原特有猪种,现在阶段对藏猪肠道的研究主要集中于肠道微生物的研究[20-21],而对饲养方式和品种对藏猪肠道形态和消化酶活性的研究较少。因此,本研究对藏猪和DLY的肠道形态和消化酶活性进行研究。研究得到,DLY猪小肠的肌层厚度和绒毛高度均高于藏猪,而隐窝深度低于藏猪,相应的DLY猪小肠的绒隐比也显著高于藏猪。DLY猪小肠的胰蛋白酶活性高于藏猪,而DLY猪小肠的淀粉酶活性低于藏猪。除此之外,本研究还发现,放牧藏猪和舍饲藏猪的小肠形态和三种酶活性均没有显著差异。由此表明,猪的品种不同,其肠道形态和消化酶活性不同,而饲养方式不同并没有明显改变藏猪的肠道形态和消化酶活性。
动物的肠道微生物对动物的生长发育和免疫功能具有重要的调节作用[22-23]。本研究通过高通量测序技术分析了舍饲藏猪、放牧藏猪和DLY猪小肠的菌群结构特征。由PcoA主成分分析得到,舍饲藏猪与放牧藏猪小肠微生物的相似性较高,而藏猪与DLY猪小肠微生物的相似性较低,这表明,藏猪群体内肠道微生物多样性的相似性高于藏猪与DLY猪间的相似性,这与肖文萍等[24]对藏猪与长白猪肠道菌群结构的研究结果相一致。在门分类水平上,变形菌门、厚壁菌门和拟杆菌门均为舍饲藏猪、放牧藏猪和DLY猪的优势菌门,这与杨伟平对藏猪、任敏敏等对金华猪以及徐蛾等对大约克猪肠道菌群的研究结果相一致[25-27]。但变形菌门、厚壁菌门和拟杆菌门的含量在三组猪间存在显著差异。放牧藏猪小肠变形菌门的含量低于舍饲藏猪和DLY猪,而舍饲藏猪小肠变形菌门的含量低于DLY猪。变形菌门包含沙门氏菌、幽门螺杆菌、大肠杆菌、霍乱弧菌等多种致病菌[28],由此表明,藏猪小肠中致病菌的数量低于DLY猪,而放牧饲养可以降低藏猪小肠中致病菌的数量,这可能与藏猪的抵抗力强和基础日粮含有一定量的金霉素有关,金霉素虽具有抑制病原性微生物的作用,但长期使用后也可以导致动物对多种致病菌产生耐药性[29]。大量研究表明,厚壁菌门是动物肠道利用纤维的主要菌群,拟杆菌门是动物肠道促进碳水化合物分解的主要菌群[30-31]。放牧藏猪厚壁菌门和拟杆菌门含量高于舍饲藏猪,而舍饲藏猪厚壁菌门含量高于DLY猪,这说明,放牧藏猪对饲料中粗纤维和碳水化合物的分解能力强于舍饲藏猪,而藏猪对纤维的降解能力强于DLY猪,这可能与放牧藏猪长期采食粗纤维含量较高的饲料以及藏猪具有一定的耐粗饲特性有关[3]。
在属分类水平上,藏猪和DLY猪的优势菌属均为的青枯菌属、埃希氏菌属、慢生根瘤菌属、乳酸菌属、普雷沃氏菌属、链球菌属、梭菌属和苍白杆菌属,这与白浩男[32]对藏猪盲肠内容物菌群结构的研究结果不同,这可能与动物的肠道部位不同,其肠道菌群结构不同有关。有报道表明,青枯菌是导致植物青枯病的致病菌[33],但在动物肠道中还未见该菌属的报道。本研究得到,青枯菌属为藏猪和DLY猪小肠中含量最多的菌属,而之前关于藏猪肠道微生物的研究中并未检查到该菌属的存在[25, 32],这可是由于本研究所用饲料成分受到青枯菌属的感染所导致,但该菌对藏猪和DLY猪的具体影响有待进一步研究。埃希氏菌属是动物肠道中常见的有益菌群,可以通过合成多种维生素等重要生理功能来提高动物肠道的免疫水平,抵御病原菌的侵入[34],研究得到藏猪小肠中埃希氏菌属的含量高于DLY猪,表明藏猪的抵抗力和肠道免疫水平强于DLY猪。慢生根瘤菌属可以利用各种碳水化合物和有机酸作为碳源,但其不能利用纤维素和淀粉,普雷沃氏菌属对淀粉和植物多糖的降解至关重要[35],还具有很强的黏蛋白质分解能力。梭菌属可以降解食物中的大豆纤维和麦芽糖等物质[36],本研究得到藏猪小肠中普雷沃氏菌属和梭菌属的含量高于DLY猪,而DLY猪小肠中慢生根瘤菌属含量高于藏猪,这表明,藏猪对饲料中纤维、淀粉和麦芽糖等物质的降解能力强于DLY猪。除此之外,本研究还发现苍白杆菌属的含量在DLY猪小肠中的含量高于藏猪,但其具体功能有待进一步研究。
综上所述,本研究得到DLY猪的肠道形态更完整、绒毛高度更高,提高了胰蛋白酶活性,增强了DLY猪对蛋白质的消化吸收能力。藏猪淀粉酶活性、拟杆菌门、厚壁菌门和梭菌属的丰度均高于DLY猪,这可能是由于藏猪肠道中分解纤维和碳水化合物的细菌提高了淀粉酶活性,使藏猪对饲料中粗纤维和碳水化合物的分解能力强于DLY猪。藏猪小肠普雷沃氏菌属的丰度高于DLY猪,而胰蛋白酶活性低于DLY猪,这可能是由于普雷沃氏菌属丰度代偿增高是对肠道低胰蛋白酶活性的补偿。
References
| [1] | Wu SM, Ciren D, Huang SY, Xu MJ, Ga G, Yan C, Mahmoud MS, Zou FC, Zhu XQ. First report of Toxoplasma gondii prevalence in Tibetan pigs in Tibet, China. Vector-Borne and Zoonotic Diseases, 2012, 12(8): 654-656. DOI:10.1089/vbz.2012.0968 |
| [2] | Li K, Lan YF, Luo HQ, Shahzad M, Zhang H, Wang L, Zhang LH, Liu DY, Liu XY, Hao YN, Sizhu SL, Li JK. Prevalence of three Oesophagostomum spp. from Tibetan pigs analyzed by genetic markers of nad1, cox3 and ITS1. Acta Parasitologica, 2017, 62(1): 90-96. |
| [3] | Yang SL, Zhang H, Mao HM, Yan DW, Lu SX, Lian LS, Zhao GY, Yan YL, Deng WD, Shi XW, Han SX, Li S, Wang XJ, Gou X. The local origin of the Tibetan pig and additional insights into the origin of Asian pigs. PLoS One, 2011, 6(12): e28215. DOI:10.1371/journal.pone.0028215 |
| [4] | Huang YW, Meng XJ. Novel strategies and approaches to develop the next generation of vaccines against porcine reproductive and respiratory syndrome virus (PRRSV). Virus Research, 2010, 154(1/2): 141-149. |
| [5] | Wang SR, Yuan XJ, Dong ZH, Li JF, Guo G, Bai YF, Zhang JY, Shao T. Characteristics of isolated lactic acid bacteria and their effects on the silage quality. Asian-Australasian Journal of Animal Sciences, 2017, 30(6): 819-827. |
| [6] | Chen L, Guo G, Yuan XJ, Shimojo M, Yu CQ, Shao T. Effect of applying molasses and propionic acid on fermentation quality and aerobic stability of total mixed ration silage prepared with whole-plant corn in Tibet. Asian-Australasian Journal of Animal Sciences, 2014, 27(3): 349-356. DOI:10.5713/ajas.2013.13378 |
| [7] | Burkey TE, Skjolaas KA, Minton JE. Porcine mucosal immunity of the gastrointestinal tract. Journal of Animal Science, 2009, 87(4): 1493-1501. DOI:10.2527/jas.2008-1330 |
| [8] | Looft T, Allen HK, Cantarel BL, Levine UY, Bayles DO, Alt DP, Henrissat B, Stanton TB. Bacteria, phages and pigs: the effects of in-feed antibiotics on the microbiome at different gut locations. The ISME Journal, 2014, 8(8): 1566-1576. DOI:10.1038/ismej.2014.12 |
| [9] | Kim HB, Borewicz K, White BA, Singer RS, Sreevatsan S, Tu ZJ, Isaacson RE. Microbial shifts in the swine distal gut in response to the treatment with antimicrobial growth promoter, Tylosin. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(38): 15485-15490. DOI:10.1073/pnas.1205147109 |
| [10] | Houshmand M, Azhar K, Zulkifli I, Bejo MH, Kamyab A. Effects of non-antibiotic feed additives on performance, immunity and intestinal morphology of broilers fed different levels of protein. South African Journal of Animal Science, 2012, 42(1): 22-32. |
| [11] | Xu ZR, Hu CH, Xia MS, Zhan XA, Wang MQ. Effects of dietary fructooligosaccharide on digestive enzyme activities, intestinal microflora and morphology of male broilers. Poultry Science, 2003, 82(6): 1030-1036. DOI:10.1093/ps/82.6.1030 |
| [12] | Segawa S, Fujiya M, Konishi H, Ueno N, Kobayashi N, Shigyo T, Kohgo Y. Probiotic-derived polyphosphate enhances the epithelial barrier function and maintains intestinal homeostasis through integrin-p38 MAPK pathway. PLoS One, 2011, 6(8): e23278. DOI:10.1371/journal.pone.0023278 |
| [13] | Li XL, Li JT, Pan SD, Wu CD. Effects of fermented feed on morphology of small intestine of weaned piglets. Feed Industry, 2014, 35(4): 38-41. (in Chinese) 李旋亮, 李建涛, 潘树德, 吴长德. 发酵饲料对断奶仔猪肠道肠黏膜形态的影响. 饲料工业, 2014, 35(4): 38-41. |
| [14] | Yurist-Doutsch S, Arrieta MC, Vogt SL, Finlay BB. Gastrointestinal microbiota-mediated control of enteric pathogens. Annual Review of Genetics, 2014, 48: 361-382. DOI:10.1146/annurev-genet-120213-092421 |
| [15] | Gill SR, Pop M, DeBoy RT, Eckburg PB, Turnbaugh PJ, Samuel BS, Gordon JI, Relman DA, Fraser-Liggett CM, Nelson KE. Metagenomic analysis of the human distal gut microbiome. Science, 2006, 312(5778): 1355-1359. DOI:10.1126/science.1124234 |
| [16] | Hooper LV, Macpherson AJ. Immune adaptations that maintain homeostasis with the intestinal microbiota. Nature Reviews Immunology, 2010, 10(3): 159-169. DOI:10.1038/nri2710 |
| [17] | Bokulich NA, Subramanian S, Faith JJ, Gevers D, Gordon JI, Knight R, Mills DA, Caporaso JG. Quality-filtering vastly improves diversity estimates from Illumina amplicon sequencing. Nature Methods, 2013, 10(1): 57-59. DOI:10.1038/nmeth.2276 |
| [18] | Langille MGI, Zaneveld J, Caporaso JG, McDonald D, Knights D, Reyes JA, Clemente JC, Burkepile DE, Thurber RLV, Knight R, Beiko RG, Huttenhower C. Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences. Nature Biotechnology, 2013, 31(9): 814-821. DOI:10.1038/nbt.2676 |
| [19] | Ramette A. Multivariate analyses in microbial ecology. FEMS Microbiology Ecology, 2007, 62(2): 142-160. DOI:10.1111/j.1574-6941.2007.00375.x |
| [20] | 辛海云. 藏猪肠道中拮抗致病菌微生物的筛选及其抗菌肽研究. 西北农林科技大学博士学位论文, 2017. |
| [21] | Xiao WP, Liu HY, Zhao HB, Bai L, Peng JY, Liu XQ, Wang JG, Song YX, Cao BY. Research of phytivorous mechanism of Tibet pig-analyses of intestinal canal microorganism diversity. Chinese Journal of Veterinary Science, 2013, 33(3): 472-476. (in Chinese) 肖文萍, 刘海艳, 赵海波, 白龙, 彭甲银, 刘雪青, 王建刚, 宋宇轩, 曹斌云. 藏猪食草机理的研究——藏猪肠道微生物的多样性分析. 中国兽医学报, 2013, 33(3): 472-476. |
| [22] | Dethlefsen L, McFall-Ngai M, Relman DA. An ecological and evolutionary perspective on human-microbe mutualism and disease. Nature, 2007, 449(7164): 811-818. DOI:10.1038/nature06245 |
| [23] | Eckburg PB, Bik EM, Bernstein CN, Purdom E, Dethlefsen L, Sargent M, Gill SR, Nelson KE, Relman DA. Diversity of the human intestinal microbial flora. Science, 2005, 308(5724): 1635-1638. |
| [24] | 肖文萍. 藏猪肠道微生物多样性的研究. 西北农林科技大学硕士学位论文, 2012. |
| [25] | 杨伟平. 藏猪肠道细菌群落组成与纤维素分解菌的研究. 西北农林科技大学博士学位论文, 2015. |
| [26] | Ren MM, Yang H, Xiang Y, Zhang XJ, Xu E, Shen LL, Xiao YP. Effects of dietary fiber levels on growth performance, microbial community structure and short-chain fatty acid content in cecum of Jinhua pigs. Chinese Journal of Animal Nutrition, 2020, 32(6): 2575-2585. (in Chinese) 任敏敏, 杨华, 项云, 章啸君, 徐娥, 申露露, 肖英平. 饲粮纤维水平对金华猪生长性能、盲肠菌群结构和短链脂肪酸含量的影响. 动物营养学报, 2020, 32(6): 2575-2585. |
| [27] | Xu E, Yang H, Liu XT, Ren MM, Shen LL, Lv WT, Xiao YP. Study on bacterial community structure and short chain fatty acid content in different parts of intestines of Yorkshire pigs. Chinese Journal of Animal Nutrition, 2019, 31(10): 4509-4518. (in Chinese) 徐娥, 杨华, 刘秀婷, 任敏敏, 申露露, 吕文涛, 肖英平. 大约克猪肠道不同部位的菌群结构和短链脂肪酸含量研究. 动物营养学报, 2019, 31(10): 4509-4518. |
| [28] | Minamoto Y, Otoni CC, Steelman SM, Büyükleblebici O, Steiner JM, Jergens AE, Suchodolski JS. Alteration of the fecal microbiota and serum metabolite profiles in dogs with idiopathic inflammatory bowel disease. Gut Microbes, 2015, 6(1): 33-47. DOI:10.1080/19490976.2014.997612 |
| [29] | Dong YJ, Chen J, Yang XP, Han YD, Wu Q, Wang LS. Effect of Chinese herbal preparations instead of chlorotetracycline on the growth performance of piglet. Modern Journal of Animal Husbandry and Veterinary Medicine, 2019(6): 32-35. (in Chinese) 董延江, 陈稼, 杨小萍, 韩业东, 吴倩, 王连山. 复方中草药替代金霉素对仔猪生长性能的影响. 现代畜牧兽医, 2019(6): 32-35. |
| [30] | Brulc JM, Antonopoulos DA, Miller MEB, Wilson MK, Yannarell AC, Dinsdale EA, Edwards RE, Frank ED, Emerson JB, Wacklin P, Coutinho PM, Henrissat B, Nelson KE, White BA. Gene-centric metagenomics of the fiber-adherent bovine rumen microbiome reveals forage specific glycoside hydrolases. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(6): 1948-1953. DOI:10.1073/pnas.0806191105 |
| [31] | Spence C, Wells WG, Smith CJ. Characterization of the primary starch utilization operon in the obligate anaerobe Bacteroides fragilis: regulation by carbon source and oxygen. Journal of Bacteriology, 2006, 188(13): 4663-4672. DOI:10.1128/JB.00125-06 |
| [32] | 白浩男. 藏猪肠道细菌多样性研究与益生菌筛选. 西北农林科技大学硕士学位论文, 2019. |
| [33] | Tan SP, Sun WX, Liu RJ. Combination of Glomus spp. and Bacillus sp. M3-4 promotes plant resistance to bacterial wilt in potato. Acta Phytopathologica Sinica, 2015, 45(6): 661-669. (in Chinese) 谭树朋, 孙文献, 刘润进. 球囊霉属真菌与芽孢杆菌M3-4协同作用降低马铃薯青枯病的发生及其机制初探. 植物病理学报, 2015, 45(6): 661-669. |
| [34] | Meganathan R. Biosynthesis of menaquinone (vitamin K2) and ubiquinone (coenzyme Q): a perspective on enzymatic mechanisms. Vitamins & Hormones, 2001, 61: 173-218. |
| [35] | Ivarsson E, Roos S, Liu HY, Lindberg JE. Fermentable non-starch polysaccharides increases the abundance of Bacteroides-Prevotella-Porphyromonas in ileal microbial community of growing pigs. Animal, 2014, 8(11): 1777-1787. DOI:10.1017/S1751731114001827 |
| [36] | Louis P, Flint HJ. Diversity, metabolism and microbial ecology of butyrate-producing bacteria from the human large intestine. FEMS Microbiology Letters, 2009, 294(1): 1-8. DOI:10.1111/j.1574-6968.2009.01514.x |
