顾美英1, 古丽尼沙·沙依木1, 张志东1, 朱静1, 刘晓静1, 唐琦勇1, 欧提库尔·玛合水提1, 宋素琴1, 冯雷2, 唐光木2, 徐万里2


1. 新疆农业科学院微生物应用研究所, 新疆特殊环境微生物实验室 新疆 乌鲁木齐 830091;
2. 新疆农业科学院土壤肥料与农业节水研究所 新疆 乌鲁木齐 830091
收稿日期:2020-03-09;修回日期:2020-05-18;网络出版日期:2020-07-08
基金项目:新疆农业科学院重点项目前期预研专项(XJZDY-004);天山雪松计划(2017XS26);国家重点研发计划(2018YFC1603400)
*通信作者:徐万里. E-mail:363954019@qq.com.
摘要:[目的] 黑果枸杞是我国荒漠区特有的药用盐生植物,本研究分析了黑果枸杞不同组织中内生细菌群落多样性特征及分布规律。[方法] 应用Illumina MiSeq高通量测序技术对黑果枸杞内生细菌的16S rRNA V5-V7区域序列进行测定,并分析群落组成、多样性及功能等生物学信息。[结果] 黑果枸杞不同组织内生细菌群落多样性及功能均有较大的差异。花、叶、果、茎和根产生的OTUs分别是182、173、119、187和254,群落多样性表现为根>花>果、茎>叶。从门水平上看,变形菌门是优势菌门,在不同组织中均有分布,花、叶、果、茎和根中的相对丰度分别为87.66%、41.51%、81.76%、97.67%和61.85%。在属水平上显示内生细菌的分布表现出器官差异性。花部能够准确分类的优势菌属为沙雷氏菌属和不动杆菌属,相对丰度分别为11.57%和8.55%。叶部为红球菌属和慢生根瘤菌属,相对丰度分别为29.68%和5.53%。果实中为泛菌属、红球菌属和沙雷氏菌属,相对丰度分别为23.12%、5.52%和4.29%。茎部为沙雷氏菌属和假单胞菌属,相对丰度分别为12.03%和17.71%。根部为盐单胞菌属、Fodinicurvata和Lipingzhangella,相对丰度分别为24.18%、5.16%和4.86%。在不同组织中分布较广的盐单胞菌、沙雷氏菌、不动杆菌、红球菌、泛菌等菌属均具有较高耐盐性和促生、生防、降解有机污染物及抗氧化等功能。PICRUSt功能预测分析显示,黑果枸杞组织中内生细菌功能中涉及丰富的多糖、萜类和酮类、酶及维他命等次生代谢产物的生物合成。[结论] 黑果枸杞内生细菌具有丰富的群落和功能多样性,拥有多种益生功能性状,也含有多个与人和植物体代谢相关的功能信息。不同组织优势菌属和功能信息各有不同,其中根部的内生细菌物种最丰富,花部和茎部参与各种代谢调控的细菌丰度最高。此外,不同组织中还含有大量未知种属的微生物类群,这些都为内生细菌功能利用和挖掘新的有益微生物资源提供广阔的发展空间。
关键词:黑果枸杞不同组织内生细菌多样性MiSeq高通量测序功能预测
Diversity and function analysis of endophytic bacterial community in different tissues of Lycium ruthenicum Murr.
Meiying Gu1, Shayimu Gulinisha1, Zhidong Zhang1, Jing Zhu1, Xiaojing Liu1, Qiyong Tang1, Mahmut Outikuer1, Suqin Song1, Lei Feng2, Guangmu Tang2, Wanli Xu2


1. Xinjiang Laboratory of Special Environmental Microbiology, Institute of Microbiology, Xinjiang Academy of Agricultural Sciences, Urumqi 830091, Xinjiang Uygur Autonomous Region, China;
2. Institute of Soil Fertilizer and Agricultural Water Conservation, Xinjiang Academy of Agricultural Sciences, Urumqi 830091, Xinjiang Uygur Autonomous Region, China
Received: 9 March 2020; Revised: 18 May 2020; Published online: 8 July 2020
*Corresponding author: Xu Wanli. E-mail:363954019@qq.com.
Foundation item: Supported by the Special Foundation for Pre-research of Key Program from Xinjiang Academy of Agricultural Sciences (XJZDY-004), by the Tianshan Pine Plan (2017XS26) and by the National Key Research and Development Program of China (2018YFC1603400)
Abstract: [Objective] Lycium ruthenicum Murr. is an important medicinal and halophyte plant of Solanaceae family in desert regions of China. Our study aims to reveal the diversity and distribution of endophytic bacterial community in different tissues of Lycium ruthenicum Murr.. [Methods] Through high-throughput sequencing technology, sequences at V5-V7 regions of endophytic bacteria 16S rRNA gene in different tissues of Lycium ruthenicum Murr. were amplified, and community composition, diversity and function were analyzed by bioinformatics. [Results] The diversity and function of endophytic bacterial community in different tissues of Lycium ruthenicum Murr. were significantly different. The OTUs (operational taxonomic units) of flower, leaf, fruit, stem and root were 182, 173, 119, 187 and 254, respectively. The community diversity index showed that root > flower > fruit, stem > leaf. At the level of phylum, Proteobacteria was the dominant group, which was simultaneously found in different tissues. The relative abundances of flower, leaf, fruit, stem and root were 87.66%, 41.51%, 81.76%, 97.67% and 61.85%, respectively. At genus level, the distribution of endophytic bacteria displayed difference in different tissues. Serratia and Acinetobacter were the dominant groups in flower, with relative abundances of 11.57% and 8.55%, respectively. Rhodococcus and Bradyrhizobium were the dominant groups in leaf, with relative abundances of 29.68% and 5.53%, respectively. Pantoea, Rhodococcus and Serratia were the dominant groups in fruit, with relative abundances of 23.12%, 5.52% and 4.29%, respectively. Serratia and Pseudomonas were the dominant groups in stem, with relative abundances of 12.03% and 17.71%, respectively. Halomonas, Fodinicurvata and Lipingzhangella were the dominant groups in roots, with relative abundances of 24.18%, 5.16% and 4.86%, respectively. Some dominant microbial groups, such as Halomonas, Serratia, Acinetobacter, Rhodococcus, Pantoea etc., exhibited functional characteristics related to salt tolerance, promoting growth, biological control, degradation of toxic and harmful substances and anti-oxidation etc. PICRUSt function prediction analysis showed that the functions of endophytic bacteria in different tissues were involved in the biosynthesis of secondary metabolites such as polysaccharides, terpenes, ketones, enzymes and vitamins etc. [Conclusion] The endophytic bacteria of Lycium ruthenicum Murr. had rich community and functional diversity. They also contained a variety of probiotics and functional information related to human and plant metabolism. The dominant bacteria genera and functional information of different tissues were different, among which the endophytic bacteria species in the root were the most abundant, and the bacteria involved in various metabolic functions in the flower and stem were the highest. In addition, there were a large number of unknown species and genera in tissues, which provided a broad development space to explore functional utilization of endophytic bacteria and find new microbial resources.
Keywords: Lycium ruthenicum Murr.different tissuesendophytic bacteriadiversityMiSeq high-throughput sequencingfunction prediction
植物体内蕴含着丰富的微生物多样性。植物内生细菌是植物组织内正常存在的微生态群落,它们共生在植物体内,经过长时间协同进化,与寄主植物之间建立了和谐共处的平衡关系[1]。
环境条件和宿主基因型决定内生细菌的遗传多样性[2]。研究表明内生细菌与宿主的共生关系,一方面内生细菌通过分泌代谢产物,提高宿主植物对生态环境的适应性,促进植物生长,另一方面植物提供给内生菌生存必需的生态环境、营养成分和能量物质等[3]。内生细菌通过产生信息传导通路或参与其生物合成代谢,和宿主植物产生相同或相似的次生代谢产物,包括生物碱类、萜类、甾体、有机酸、肽类、酮类和醌类等活性产物[4–5]。内生细菌还具有溶磷、解钾、固氮等作用以及产生铁载体、抗菌活性物质和植物生长激素来促进宿主植物生长、营养物质积累和提高抗逆性(抗病虫害、高温、盐碱或干旱等)[6–7]。此外由于外界环境的改变以及非寄主生物入侵内生细菌会产生一些非专一性的有毒物质或溶解酶,对宿主植物细胞组成、植物的生理功能以及对其敏感的非宿主生物造成毒害损伤或抑制作用[8]。目前内生细菌已成为生物防治中有潜力的微生物肥料、农药或作为潜在的生防载体菌而加以利用。除此之外,部分内生菌具有抗重金属、耐高盐的特性,这有利于重污染地区生物治理,盐生植物改良盐碱地,保护环境等[9–10]。
目前越来越多研究关注由盐生植物内生菌通过渗透胁迫和离子胁迫的调控来缓解高盐对植物的胁迫,提高植物的耐盐性[11]。同时由于内生细菌具有与宿主相同或相似的功能,如改善渗透压、抗氧化、激素信号传导和产生次级代谢产物等,来提高盐生植物养分的吸收效率、促进生长[12–13]。黑果枸杞(Lycium ruthenicum Murr.)为茄科、枸杞属多年生灌木,是一种分布于我国西北干旱区的耐盐植物。因其富含多酚、黄酮、甜菜碱、糖蛋白等各种保健功能成分而受到广泛青睐,尤其是花青素的研究最多[14]。目前对黑果枸杞微生物的研究主要集中在根际土壤微生物、可培养内生菌多样性及抗逆和促生功能等方面[15–17]。由于大部分的内生菌是不可培养或难以培养的,因此通过培养法获得的实验结果不能全面地反映植物内生细菌的群落组成。随着高通量测序技术的引入,植物内生微生物群落多样性探索大大加快。采用免培养技术直接从DNA层面解析内生微生物群落中的种群组成,这为深入了解植物内生微生物群落多样性提供了更广阔、更准确的信息数据[18]。本试验以黑果枸杞根、茎、叶、花和果等不同组织为研究对象,采用高通量测序技术,分析南疆黑果枸杞不同组织内生细菌物种组成、群落结构及多样性的变化规律,旨在更加全面、准确地反映黑果枸杞内生细菌在不同组织中的分布和差异,丰富和完善黑果枸杞内生细菌种质资源,为进一步探讨内生细菌的抗逆及促生长等生态功能提供理论依据。
1 材料和方法 1.1 采集地概况 野生黑果枸杞样品于2018年8月采自新疆喀什地区疏勒县,地理位置坐标为76°29′27′′E,39°16′05′′N,海拔1200 m。该地区位于新疆西南部,地处塔里木盆地西缘喀什噶尔绿洲中部,属暖温带大陆性干旱型气候,年平均气温11.7 ℃,极端最高气温40.1 ℃,年平均降水量65 mm,年平均蒸发量2604.9 mm,蒸降比为40倍。平均年内大风12–44 d,干热风14次。在干旱高温多干热风的气候条件下土壤水分运动上升占绝对优势,导致土体上部盐分的累积,形成大面积的盐化土和盐土[19]。
1.2 样品采集 采用不同分布多位点采集5株生长良好的黑果枸杞植株,取样时将整个植株小心挖出,不要伤害根系,立即放入无菌样品袋中,4 ℃环境下保存,于48 h内进行表面消毒处理。黑果枸杞花、叶、果、茎和根不同组织样品分别命名为H、Y、G、J和R。
1.3 表面消毒 表面消毒具体参考刘晓静等的方法[20]。将黑果枸杞花、叶、果、茎和根不同组织分别称取相同重量后,自来水流水冲洗10 min,无菌纸吸干水分,75%无水乙醇处理4 min,经无菌水洗涤后,用3% H2O2浸泡3 min,再用无菌水冲洗3–4次,最后一遍无菌水洗涤液经涂板检测无菌后,无菌条件下进行内生细菌DNA的提取。
1.4 基因组DNA的提取及扩增测序 采用ZR-96 Bacterial DNA Kit提取总DNA,用0.8%琼脂糖凝胶电泳检测所提取DNA的纯度和浓度后送北京诺禾致源生物信息科技有限公司进行高通量测序。通过Illumina MiSeq平台,利用16S rDNA通用引物,对16S rRNA基因的V5–V7可变区扩增,进行细菌的高通量测序。由于16S rRNA V3–V4区域序列进行内生细菌高通量测序时存在一定比例宿主叶绿体和线粒体序列的污染,因此本研究采用V5–V7区序列,以剔除宿主叶绿体和线粒体序列的干扰,使细菌多样性分析更为准确、可靠[21]。16S rRNA基因通用引物为799F (AACMGGATTAGATACCCKG),1193R (ACGTCATCCCCACCTTCC)。25 μL PCR反应体系:5.0 μL 5×FastPfu缓冲液,2 μL 2.5 mmol/L dNTPs,1.0 μL引物F (10 μmol/L),1.0 μL引物R (10 μmol/L),0.25 μL FastPfu聚合酶,1.0 μL DNA模板(0.2 ng/μL)。PCR反应条件:95 ℃ 3 min;95 ℃ 30 s, 55 ℃ 30 s,72 ℃ 30 s,27个循环;72 ℃ 10 min;4 ℃保存。
1.5 数据处理、内生细菌群落多样性分析及功能预测 测序结束后,对原始序列进行数据拆分、PE Reads拼接、Tags过滤和Tags去嵌合体序列后得到最终的有效序列。然后基于有效数据进行OTUs (operational taxonomic units)聚类和物种分类分析,并将OTU和物种注释结合,从而得到每个样品的OTUs和分类谱系的基本分析结果。应用Mothur软件对内生细菌菌群OTUs在各个分类水平上的丰度、多样性指数等进行统计分析,得到群落样本的主要分布特征[22]。采用PICRUSt软件进行功能和代谢途径预测,将现有的16S rRNA基因测序数据与KEGG数据库对比,比较功能基因在生物代谢通路上的丰度差异,从而获得黑果枸杞不同组织内生细菌群落功能预测信息[23]。
2 结果和分析 2.1 黑果枸杞不同组织内生细菌操作分类单元(OTU)及其多样性分析 本研究采用高通量测序技术对黑果枸杞植株不同组织内生细菌群落多样性进行了分析,明确黑果枸杞不同组织部位内生细菌群落结构组成特点和多样性指数分析,结果见表 1。黑果枸杞花、叶、果、茎和根不同组织内生细菌产生的原始序列质控后获得V5–V7区有效序列总数分别为40465、36438、64478、68060和70303 (表 1)。在97%的序列相似性水平上,这些有效序列产生的OTUs分别是182、173、119、187和254。其中根部获得的有效序列数最多,产生的OTUs也最多。基于OTU数及相对丰度,对黑果枸杞不同组织内生细菌进行多样性分析,结果表明黑果枸杞不同组织内生细菌多样性指数存在一定的差异,不同组织的Shannon指数和Simpson指数分别在2.441–6.037和0.561–0.968之间,其中根部的内生细菌多样性最高,花部的内生细菌多样性次之,接下来是果部和茎部,叶部最低。
表 1. 黑果枸杞不同组织内生细菌群落多样性指数分析 Table 1. Diversity index of endophytic bacterial community in different tissues of Lycium ruthenicum Murr.
| Sample | Number of valid sequences | Number of OTUs | Shannon index | Simpson index | Coverage/% |
| H | 40465 | 182 | 3.432 | 0.803 | 100.00 |
| Y | 36438 | 173 | 2.441 | 0.561 | 100.00 |
| G | 64478 | 119 | 2.983 | 0.810 | 99.90 |
| J | 68060 | 187 | 2.955 | 0.720 | 99.90 |
| R | 70303 | 254 | 6.037 | 0.968 | 100.00 |
表选项
2.2 黑果枸杞不同组织内生细菌种群归类分析 种群归类显示黑果枸杞不同组织所得OTU序列分属11个可归类细菌门及17个可归类细菌纲。在目及以下分类阶层,已归类的OTU总计分布于49个细菌目、86个细菌科及187个细菌属。黑果枸杞不同组织中测得的各级细菌分类阶层总数也明显不同(表 2),花和根中的内生细菌种类较高,其次是叶和茎,果中内生细菌种类最少。
表 2. 黑果枸杞不同组织内生细菌群落细菌学分类阶层总数 Table 2. Total numbers of bacterial taxa detected in different tissues of Lycium ruthenicum Murr.
| Sample | Phylum | Class | Order | Family | Genus |
| H | 6 | 10 | 32 | 59 | 107 |
| Y | 6 | 11 | 32 | 53 | 93 |
| G | 6 | 8 | 24 | 44 | 75 |
| J | 6 | 9 | 29 | 46 | 85 |
| R | 9 | 13 | 38 | 53 | 107 |
表选项
2.3 黑果枸杞不同组织内生细菌OTU分布 花、叶、果、茎和根细菌文库共有OTU的数量为37个,主要包括:Actinobacteria门的Rhodococcus属,5个组织中分别占2.68%、29.68%、5.52%、0.17%和2.04%;Proteobacteria门的Pantoea属和Serratia属,分别占0.40%、1.60%、23.12%、1.91%、0.02%和11.57%、1.62%、4.29%、12.03%、0.13%;Proteobacteria门的2个未知属,分别占51.16%、3.88%、30.62%、49.53%、0.36%和6.75%、1.85%、20.89%、4.99%、0.06%。特有的OTU数量花、叶、果、茎和根中分别为34、26、13、17和75个(图 1),但除Actinobacteria门的Streptomonospora属在根中占1.40%外,其余占比均低于1%。由此可以看出,黑果枸杞不同组织独有的内生细菌群体种群组成存在较大差异,表现出部分细菌种群的组织专一性。其中根中内生细菌特有OTU数目最多,其次是花和叶,茎和果中最少。除共有物种和独有物种外,不同组织之间均有相同或相似物种。
 |
| 图 1 黑果枸杞不同组织内生细菌群落OTU分布韦恩图 Figure 1 Venn diagram of OTUs distribution of endophytic bacterial community detected in different tissues of Lycium ruthenicum Murr.. |
| 图选项 |
2.4 不同组织黑果枸杞内生细菌群落组成及差异分析
2.4.1 不同组织黑果枸杞内生细菌群体门水平的优势种群分析: 所测5个不同组织样品中占优势的可归类细菌群落(OTU至少在1个组织中丰度≥1%)共分布6个门(图 2),包括变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、柔膜菌门(Tenericutes)和异常球菌-栖热菌门(Deinococcus-Thermus)。不同组织其优势细菌门差异很大,其中花、果和茎中变形菌门为优势细菌门,丰度分别为87.66%、81.76%和97.67%;叶中优势细菌门为变形菌门和放线菌门,丰度分别为41.51%和33.76%;根中优势细菌门为变形菌门、放线菌门和厚壁菌门,丰度分别为61.85%、17.39%和11.44%。
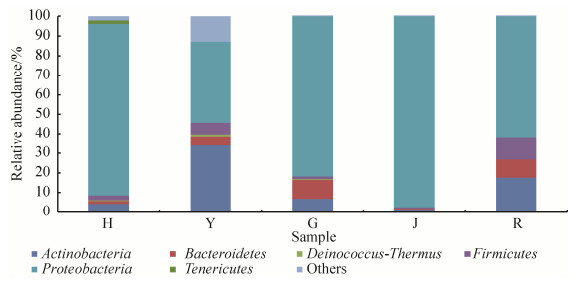 |
| 图 2 黑果枸杞不同组织内生细菌群落优势细菌门组成 Figure 2 Dominant bacterial phyla detected from endophytic bacterial community in different tissues of Lycium ruthenicum Murr.. |
| 图选项 |
2.4.2 不同组织黑果枸杞内生细菌纲水平的优势种群组成分析: 黑果枸杞不同组织内生细菌可归类微生物群落OTU共归于11个纲(≥1%)。各优势细菌纲数目、组成及其丰度随不同组织而异(图 3),其中花中γ-变形菌纲(Gammaproteobacteria)占绝对优势,丰度为84.80%;叶中α-变形菌纲(Alphaproteobacteria)、γ–变形菌纲和未鉴定出的放线菌纲为优势细菌门,其丰度分别为11.91%、29.48%和33.18%;果中γ-变形菌纲占绝对优势,丰度为81.13%,拟杆菌纲(Bacteroidia)丰度为9.91%;茎中γ-变形菌纲占绝对优势,丰度为94.62%;根中γ-变形菌纲丰度最高为42.31%,α-变形菌纲丰度为19.18%,芽孢杆菌纲(Bacilli)丰度为11.44%,未鉴定出的放线菌纲丰度为16.96%。
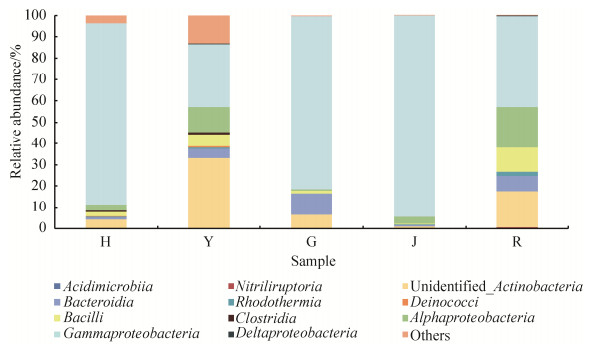 |
| 图 3 黑果枸杞不同组织内生细菌群落优势细菌纲组成 Figure 3 Dominant bacterial classes detected from endophytic bacterial community in different tissues of Lycium ruthenicum Murr.. |
| 图选项 |
2.4.3 不同组织黑果枸杞内生细菌群体优势细菌属的组成: 选取在属分类水平上相对丰度排名前26的菌群,生成物种相对丰度分布图(图 4),分析黑果枸杞不同组织的细菌菌群分布和变化情况。结果表明,根的细菌菌群种类和丰度均要显著高于其他组织,种类由高到低分别为根 > 叶 > 茎、花、果。
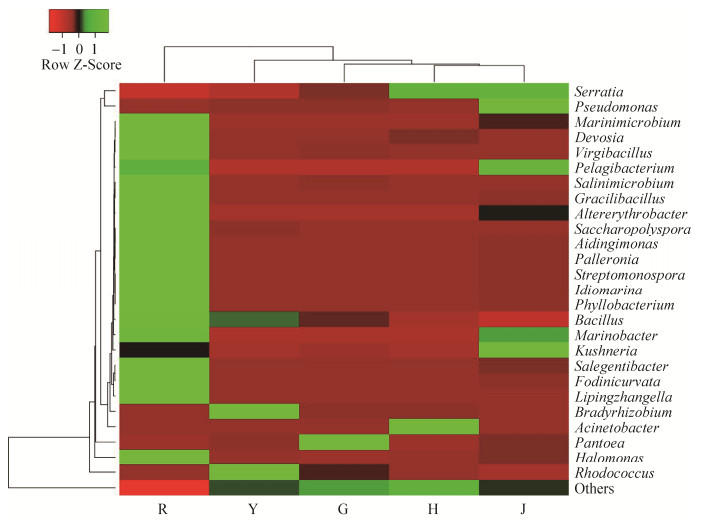 |
| 图 4 黑果枸杞不同组织内生细菌属水平的相对丰度热图 Figure 4 Heatmap of the relative abundance of genera identified from endophytic bacterial community in different tissues of Lycium ruthenicum Murr.. |
| 图选项 |
花部内生细菌在属水平上,相对丰度≥1%的有6个属,其中能够准确分类的属有3个,分别是沙雷氏菌属(Serratia)、不动杆菌属(Acinetobacter)和红球菌属(Rhodococcus),分别占11.57%、8.55%和2.68%。但花中还含有大量未知的内生细菌菌属,其中59.73%为变形菌门Enterobacteriaceae科未知属种。
叶部内生细菌在属水平上,相对丰度≥1%的有12个属,其中能够准确分类的属有7个,分别是红球菌属(Rhodococcus)、慢生根瘤菌属(Bradyrhizobium)、短波单胞菌属(Brevundimonas)、沙雷氏菌属(Serratia)、泛菌属(Pantoea)、戴尔福特菌属(Delftia)和两面神菌属(Janibacter),分别占29.68%、5.53%、2.34%、1.62%、1.60%、1.22%和1.01%。此外还含有12.6%未知门的内生细菌、5.73%的Proteobacteria门Enterobacteriaceae科未知属种。
果实中有6个相对丰度≥1%的属,其中能够准确分类的属有3个,分别是泛菌属(Pantoea)、红球菌属(Rhodococcus)和沙雷氏菌属(Serratia),分别占23.12%、5.52%和4.29%,而Proteobacteria门Enterobacteriaceae科未知属,占比为51.51%。
茎部有8个相对丰度≥1%的属,其中能够准确分类的属有6个,分别是沙雷氏菌属(Serratia)、假单胞菌属(Pseudomonas)、Kushneria、泛菌属(Pantoea)、盐单胞菌属(Halomonas)和海杆菌属(Marinobacter),分别占12.03%、17.71%、2.18%、1.91%、1.59%和1.26%。其余为Proteobacteria门Enterobacteriaceae科未知属,占比为54.52%。
根部的内生细菌种类较为丰富,有19个相对丰度≥1%的属,其中能够准确分类的属有18个,分别是盐单胞菌属(Halomonas)、Fodinicurvata、Lipingzhangella、需盐杆菌属(Salegentibacter)、Gracilibacillus、叶杆菌属(Phyllobacterium)、Idiomarina、Salinimicrobium、Palleronia、交替红杆菌(Altererythrobacter)、红球菌属(Rhodococcus)、Aidingimonas、Fodinicurvata、糖多孢菌(Saccharopolyspora)、链单孢菌属(Streptomonospora)、枝芽孢杆菌属(Virgibacillus)、海杆菌属(Marinobacter)和德沃斯氏菌属(Devosia),分别占24.18%、5.16%、4.86%、3.65%、3.13%、2.50%、2.42%、2.22%、2.07%、2.07%、2.04%、1.91%、1.87%、1.80%、1.40%、1.29%、1.25%和1.03%。Proteobacteria门Enterobacteriaceae科未知属,占比为1.04%。
2.5 不同组织黑果枸杞内生细菌群体聚类分析 主成分分析表明(图 5),主成分分析1 (PC1)和主成分分析2 (PC2)的样品差异性贡献率分别达到49.15%和21.73%,合计为70.88%,是差异的主要来源。黑果枸杞不同组织内生细菌群落多样性差异较大,其中花分布在第一象限,根分布在第二象限,其余茎、叶、果均分布于第四象限。
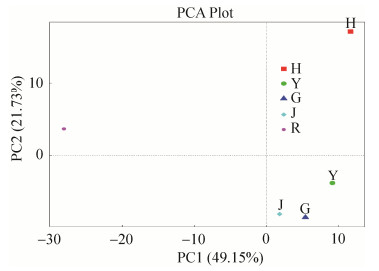 |
| 图 5 黑果枸杞不同组织内生细菌群落PCA图 Figure 5 The PCA analysis of endophytic bacterial community in different tissues of Lycium ruthenicum Murr.. |
| 图选项 |
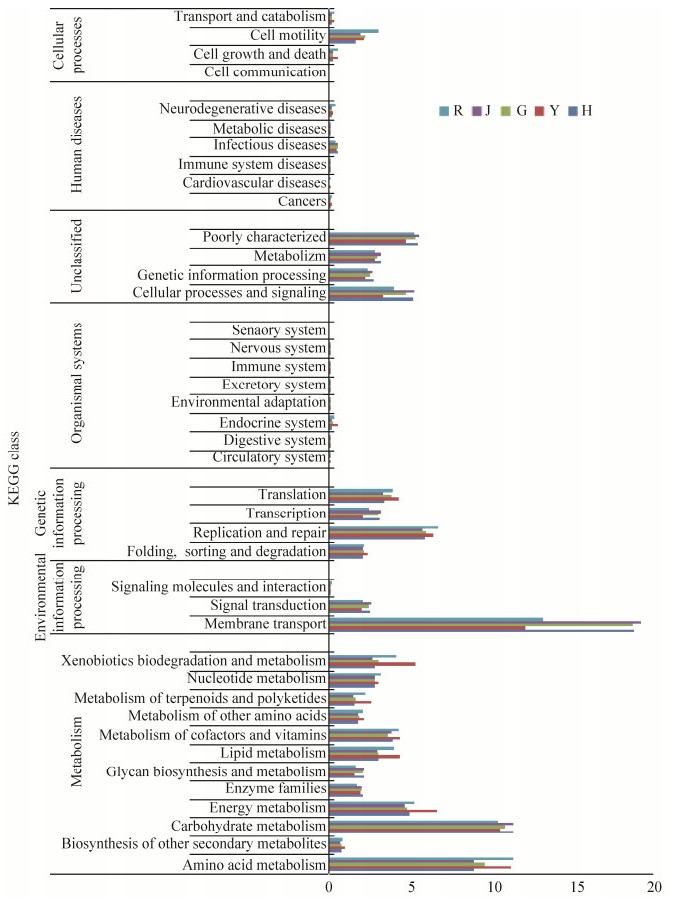
2.6 不同组织黑果枸杞内生细菌功能基因预测 为了探究黑果枸杞不同组织内生细菌的功能变化情况,本研究采用PICRUSt软件进行菌群预测分析(图 6)。将预测得到的功能基因家族与KEGG数据库(Kyoto encyclopedia of genes and genomes)比对发现,在第一等级功能层上,所有菌群的基因序列注释到的功能可分为6类,其中新陈代谢(metabolism)、环境信息加工(environmental information processing)和遗传信息加工(genetic information processing)为其主要组成,相对丰度分别为44.41%–53.45%、13.88%–21.44%和14.02%–14.95%。对预测基因第二等级功能层进行分析表明,该功能层共有41个子功能组成。其中参与新陈代谢的菌群中,以参与氨基酸代谢(amino acid metabolism)、碳水化合物代谢(carbohydrate metabolism)和能量代谢(energy metabolism)的菌群为主;参与环境信息加工的菌群中,参与膜转运(membrane transport)的类群具有明显优势,其次是参与信号传导(signal transduction)的类群;参与遗传信息加工的菌群中,复制和修复机制(replication and repair)的类群为主要类群。说明黑果枸杞不同组织内生细菌参与了各种代谢通路、合成通路、膜转运、信号传递以及细胞周期相关通路,其中还有一些细菌与人类疾病相关。此外,不同组织序列预测结果中也出现了相对丰度较高的具有多糖生物合成和代谢(1.54%–2.12%)、萜类和酮类化合物代谢(1.50%–2.56%)、产酶家族(1.72%–2.01%)、维他命及辅助因子代谢(3.59%–4.28%)和外来物质的分解和代谢(2.65%–5.22%)等有益功能信息。不同组织由于其内生细菌多样性不同,导致其预测功能上的差异,其中花和茎部中参与各种功能活动的内生细菌物种相对丰度最高,其次是叶和果部内生细菌的物种,根部调控各种代谢的内生细菌物种相对丰度最低。
 |
| 图 6 黑果枸杞不同组织内生细菌PICRUSt功能基因预测 Figure 6 PICRUSt functional gene prediction of endophytic bacterial community in different tissues of Lycium ruthenicum Murr.. |
| 图选项 |
3 讨论 植物对逆境的抗性或耐性除来自于植物基因组本身外,内生菌对宿主逆境胁迫的适应也具有重要影响,宿主植物不同组织、不同生长阶段与内生菌数量和种群分布有很密切的关系[24–25]。适宜的植物内环境,其内生细菌多样性丰富,优势度低,细菌种类分布均匀。盐生植物在进化过程中形成了适应盐分胁迫的各种机制,而内生菌可作为植物缓解盐碱压力的有用工具,具有广阔的应用前景[26–27]。作为世界上三大碱性土壤指示植物和先锋植物之一的黑果枸杞,其内生细菌在逆境胁迫条件下,也形成了特有、丰富的生物多样性和生态功能。
对健康植物的研究表明不同组织中内生细菌具有差异性和专一性[28–29]。本研究高通量测序结果表明,黑果枸杞根部的内生细菌多样性最高,花部的内生细菌多样性次之,接下来是果部和茎部,叶部最低,这与Liu等对黑果枸杞可培养内生菌的研究结果相似[17];对小麦、巨菌草及水稻的研究也表明根部的内生细菌多样性均高于其他组织[30–32]。但铁皮石斛的叶片内生细菌多样性最高,其次为根,最低为茎[33]。内生菌是由土壤、空气中微生物入侵与宿主协同进化而来,这些因素共同造成了内生细菌分布的专一性。京白梨树不同组织具有独特的细菌种类,果、叶、花和茎中蓝细菌门为优势细菌门,而变形菌门和放线菌门在根中最丰富[34]。本研究中,不同组织独有的内生细菌群体种群组成存在较大差异。其中根中内生细菌特有OTU数目最多,其次是花和叶,茎和果中最少。变形菌门为所有组织中的优势菌群,放线菌门在叶和根中也占较大比例,各组织中菌属种类较多,差异较大;而可培养内生菌则显示各组织中的优势菌群为放线菌门,根、茎的主要菌属为链霉菌属,叶为考克氏菌属[17]。由此可以看出,传统培养方法与高通量测序结果有所不同,黑果枸杞中还存在大量未被培养出的微生物类型,需对可培养细菌进行深入的研究。
研究表明盐碱、干旱、高温等气候条件适合于变形杆菌和放线菌等细菌生存与繁殖,这与大多数植物内生细菌的研究结果类似[35],这可能是内生菌对植物适应外界环境导致的内部微环境变化的一种响应,但相关机制还应作更进一步研究。变形菌门在农业、工业、医药、环保等领域具有重要应用价值,广泛用于固氮作用、土壤修复、病虫害防治、污染物降解等[36],放线菌可以产生大量的、种类繁多的抗生素,是非常重要的生防微生物[37]。随着研究的深入,植物内生细菌在生物防治及生理生态方面的作用被挖掘。对林木的芽、种子和花进行了内生细菌定植及功能的研究发现,芽内生细菌与根内生细菌具有共同的促生长机制,如产生植物生长激素的能力;此外,一些芽内生菌可能通过产生腺嘌呤衍生物或细菌光合作用影响植物生长[38]。黑果枸杞可培养内生菌表明链霉菌和芽孢杆菌具有较高的促生作用[17]。本研究高通量测序表明,黑果枸杞不同组织中分布较广的盐单胞菌、沙雷氏菌、不动杆菌、红球菌、泛菌等菌属均具有较高耐盐、促生和抗菌性能,可促进黑果枸杞的生长和防治病虫害,所得的菌群丰度变化可为挖掘黑果枸杞具有特定应用价值的微生物种质资源指明方向。研究表明盐单胞菌菌株有明显的促生、抗菌、抗氧化作用,多糖提取物有明显的免疫保护作用,具有潜在的药用研究价值[39]。泛菌具有产多糖、溶磷、产IAA、产铁载体、拮抗病原真菌等特性,促进植物生长发育[40]。沙雷氏菌的代谢产物具有多种生物活性作用,如抗癌、抗微生物、抗疟疾、抗霉、免疫抑制的作用[41]。不动杆菌在解磷、降解有机污染物等方面的功能明显[42]。红球菌可产类胡萝卜素、各种酶制剂、维生素、有机酸等活性物质,具有代谢多样性和对多变环境条件的独特适应能力,在生物修复、生物转化和生物催化中具有潜在的应用前景[43–44]。此外,在不同组织中还含有大量未知种属的微生物类群,这些都为挖掘在盐渍化土壤修复、环境、医药等方面均有重要应用价值的新有益微生物资源提供了广阔发展空间。
PICRUSt基因功能预测分析表明,黑果枸杞内生细菌中与新陈代谢相关的功能基因相对丰度最高,在其生长过程中发挥着重要作用。同时由于黑果枸杞含有丰富的氨基酸、脂肪、维生素、花青素、多糖和总黄酮等活性成分,黑果枸杞内生细菌基因中也包含有氨基酸类、脂类、维生素、多糖、萜类和酮类及其他次生代谢产物等与植物成分生物合成有关的通路。因此通过获得不同组织中内生细菌与黑果枸杞中有效化学成分合成的相关基因信息,能为协调黑果枸杞中有效成分的生物合成和运输分解,为充分挖掘内生细菌资源,提高药用植物品质提供一定的参考依据。而根部调控各种代谢的内生细菌物种相对丰度较低,这与群落多样性研究结果存在差异。内生细菌定殖受宿主植物调控,组织结构不同,含有的化学成分也不同,内生细菌数量与其呈正相关[5]。可能由于根中含有的活性成分相对较低,故根部虽然内生细菌多样性较高,但参与调控代谢这些活性成分的细菌种类和数量相对较少的缘故,相关研究还需深入进行验证。
此外黑果枸杞内生细菌基因中还含有一些与疾病相关的基因,但这部分基因的相对丰度较低。由于内生细菌与植物之间长期共生,一般情况下不会引起植物发生病变[45]。黑果枸杞这些内生细菌是否具有潜在致病性,还有待下一步深入研究。
References
| [1] | Suryanarayanan TS, Gopalan V, Shaanker RU, Sengupta A, Ravikanth G. Translating endophyte research to applications: prospects and challenges//de Azevedo JL, Quecine MC. Diversity and Benefits of Microorganisms from the Tropics. Cham: Springer, 2017: 343-365. |
| [2] | Liu XZ, Zhao ZL, Li SB, Zhang LX, Tian YX, Sun FR. The community structure and diversity of the endophytes in American ginseng. Acta Microbiologica Sinica, 2015, 55(3): 330-340. (in Chinese) 刘学周, 赵智灵, 李绍宾, 张连学, 田义新, 孙福仁. 西洋参内生菌群落结构与多样性. 微生物学报, 2015, 55(3): 330-340. |
| [3] | Wang YB, Zhang WX, Ding CJ, Su XH. Community structure and niche differentiation of endophytic microbiome in Populus alba×P. berolinensis under different ecological environment. Scientia Silvae Sinicae, 2020, 56(2): 48-60. (in Chinese) 王颜波, 张伟溪, 丁昌俊, 苏晓华. 不同生态环境下银中杨内生菌群落结构及生态位变异. 林业科学, 2020, 56(2): 48-60. |
| [4] | Singh S, Pandey SS, Shanker K, Kalra A. Endophytes enhance the production of root alkaloids ajmalicine and serpentine by modulating the terpenoid indole alkaloid pathway in Catharanthus roseus roots. Journal of Applied Microbiology, 2020, 128(4): 1128-1142. |
| [5] | Chen X, Li Q, Cao QQ, Huang CP. Community structure of cultivable endophytes in different organs of Gentiana straminea maxim and its correlation with the content of gentiopicrin. Journal of Food Science and Biotechnology, 2019, 38(4): 21-29. (in Chinese) 陈昕, 李琪, 曹倩倩, 黄春萍. 麻花秦艽不同组织部位可培养内生菌群结构及其与龙胆苦苷含量的相关性. 食品与生物技术学报, 2019, 38(4): 21-29. |
| [6] | Sexton WK, Fidero M, Spain JC, Jiang L, Bucalo K, Cruse-Sanders JM, Pullman GS. Characterization of endophytic bacterial communities within greenhouse and field-grown rhizomes of three rare pitcher plant species (Sarracenia oreophila, S. leucophylla, and S. purpurea spp. venosa) with an emphasis on nitrogen-fixing bacteria. Plant and Soil, 2020, 447(1/2): 257-279. DOI:10.1007/s11104-019-04372-8 |
| [7] | Cheng L. Diversity and biological function of endophytic bacteria in Leontopodium nanum of Qinghai-Tibetan Plateau. Journal of Southern Agriculture, 2019, 50(10): 2222-2233. (in Chinese) 程亮. 青藏高原矮火绒草内生细菌多样性及生物功能分析. 南方农业学报, 2019, 50(10): 2222-2233. DOI:10.3969/j.issn.2095-1191.2019.10.11 |
| [8] | Fang ZJ, Zhang XX, Ma LA. Research advances in the studies of plant entophytic. Journal of Yangtze University (Natural Science Edition), 2018, 15(10): 41-45. (in Chinese) 方珍娟, 张晓霞, 马立安. 植物内生菌研究进展. 长江大学学报(自科版), 2018, 15(10): 41-45. DOI:10.3969/j.issn.1673-1409.2018.10.012 |
| [9] | Shahzad R, Bilal S, Imran M, Khan AL, Alosaimi AA, Al-Shwyeh HA, Almahasheer H, Rehman S, Lee IJ. Amelioration of heavy metal stress by endophytic Bacillus amyloliquefaciens RWL-1 in rice by regulating metabolic changes:potential for bacterial bioremediation. The Biochemical Journal, 2019, 476(21): 3385-3400. DOI:10.1042/BCJ20190606 |
| [10] | Vaishnav A, Shukla AK, Sharma A, Kumar R, Choudhary DK. Endophytic bacteria in plant salt stress tolerance:current and future prospects. Journal of Plant Growth Regulation, 2019, 38(2): 650-668. DOI:10.1007/s00344-018-9880-1 |
| [11] | Tian R, Yu ZC, Li ZY, Wang XL, Wang B. Diversity of endophytic and rhizospheric bacteria of Suaeda heteroptera Kitag from Panjin Delta in Liaoning Province. Microbiology China, 2016, 43(7): 1462-1472. (in Chinese) 田锐, 于子超, 李作扬, 王绪磊, 王斌. 辽宁盘锦三角洲翅碱蓬根系及内生细菌群落多样性. 微生物学通报, 2016, 43(7): 1462-1472. |
| [12] | 田雪莹.砂引草内生菌多样性及一株内生菌Alternaria sp. P8次级代谢产物研究.中国农业科学院硕士学位论文, 2018. |
| [13] | 王卫霞.新疆几种典型荒漠植物根际微生物特征及内生固氮菌的分离、促生性能研究.新疆农业大学硕士学位论文, 2009. |
| [14] | Wang FL, Wang Q, Li AD, Yu QS, Chai CW, Hu XK, Wang YQ, Wang YY, Yang XH, Jin CD. Summary of present research on Lycium ruthenicum of medicinal plant in desert area. Soil and Water Conservation in China, 2019(5): 57-60. (in Chinese) 王方琳, 王祺, 李爱德, 尉秋实, 柴成武, 胡小柯, 王昱淇, 汪媛艳, 杨晓寒, 靳承东. 荒漠区药用植物黑果枸杞研究现状综述. 中国水土保持, 2019(5): 57-60. |
| [15] | Li Y, He XM, Yang XD, Zhang XN, Lü GH. The microbial community diversity of the rhizosphere and bulk soils of Lycium ruthenicum in different habitats. Acta Ecologica Sinica, 2018, 38(17): 5983-5995. (in Chinese) 李岩, 何学敏, 杨晓东, 张雪妮, 吕光辉. 不同生境黑果枸杞根际与非根际土壤微生物群落多样性. 生态学报, 2018, 38(17): 5983-5995. |
| [16] | Gu MY, Tang GM, Feng L, Sun NC, Ma HG, Liao N, Xu WL. Relativity study on antioxidant composition of wild Lycium ruthenicum Murr. and soil physico-chemical properties and microbial characteristics in Southern Xinjiang. Xinjiang Agricultural Sciences, 2017, 54(10): 1930-1940. (in Chinese) 顾美英, 唐光木, 冯雷, 孙宁川, 马海刚, 廖娜, 徐万里. 南疆野生黑果枸杞果实抗氧化成分与土壤理化性质、微生物特征的相关性. 新疆农业科学, 2017, 54(10): 1930-1940. |
| [17] | Liu YH, Wei YY, Mohamad OAA, Salam N, Zhang YG, Guo JW, Li L, Egamberdieva D, Li WJ. Diversity, community distribution and growth promotion activities of endophytes associated with halophyte Lycium ruthenicum Murr. , 3 Biotech, 2019, 9(4): 144. DOI:10.1007/s13205-019-1678-8 |
| [18] | Tamo?iūn? I, Andriūnait? E, Stanys V, Baniulis D. Exploring diversity of bacterial endophyte communities using advanced sequencing technology//Kumar V, Prasad R, Kumar M, Choudhary DK. Microbiome in Plant Health and Disease. Singapore: Springer, 2019: 447-481. |
| [19] | Wang F. Preliminary analysis of reason for alkaline land. Heilongjiang Science and Technology of Water Conservancy, 2012, 40(11): 230-231. (in Chinese) 王丰. 盐碱地的成因初步分析. 黑龙江水利科技, 2012, 40(11): 230-231. |
| [20] | Liu XJ, Zhu J, Chu M, Tang QY, Gu MY, Wang B, Zhu X, Zhang ZD. Changes in carbon metabolism characteristics and community composition of endophytic bacteria in postharvest kuqa-grown apricot. Food Science, 2018, 39(22): 141-146. (in Chinese) 刘晓静, 朱静, 楚敏, 唐琦勇, 顾美英, 王博, 朱璇, 张志东. 库车小白杏采后内生细菌群落代谢特征及结构组成的变化. 食品科学, 2018, 39(22): 141-146. |
| [21] | Cheng DD, Zhao J, Tian ZS. Composition and diversity of bacterial community of the alien invasive plant (Conyza canadensis L.). Safety and Environmental Engineering, 2019, 26(2): 16-24. (in Chinese) 程丹丹, 赵菁, 田忠赛. 入侵植物小蓬草的细菌群落组成和多样性研究. 安全与环境工程, 2019, 26(2): 16-24. |
| [22] | Schloss PD, Westcott SL, Ryabin T, Hall JR, Hartmann M, Hollister EB, Lesniewski RA, Oakley BB, Parks DH, Robinson CJ, Sahl JW, Stres B, Thallinger GG, van Horn DJ, Weber CF. Introducing mothur:open-source, platform- independent, community-supported software for describing and comparing microbial communities. Applied and Environmental Microbiology, 2009, 75(23): 7537-7541. |
| [23] | Langille MGI, Zaneveld J, Caporaso JG, McDonald D, Knights D, Reyes JA, Clemente JC, Burkepile DE, Thurber RLV, Knight R, Beiko RG, Huttenhower C. Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences. Nature Biotechnology, 2013, 31(9): 814-821. |
| [24] | Dastogeer KMG, Li H, Sivasithamparam K, Jones MGK, Wylie SJ. Host specificity of endophytic mycobiota of wild Nicotiana plants from arid regions of northern Australia. Microbial Ecology, 2018, 75(1): 74-87. |
| [25] | Zhang Y, Yu XX, Zhang WJ, Lang DY, Zhang XJ, Cui GC, Zhang XH. Interactions between endophytes and plants:beneficial effect of endophytes to ameliorate biotic and abiotic stresses in plants. Journal of Plant Biology, 2019, 62(1): 1-13. DOI:10.1007/s12374-018-0274-5 |
| [26] | Zhao S, Zhou N, Zhao ZY, Zhang K, Tian CY. Endophytic bacterial diversity and dynamics in root of Salicornia europaea estimated via high throughput sequencing. Acta Microbiologica Sinica, 2016, 56(6): 1000-1008. (in Chinese) 赵帅, 周娜, 赵振勇, 张科, 田长彦. 基于高通量测序分析盐角草根部内生细菌多样性及动态规律. 微生物学报, 2016, 56(6): 1000-1008. |
| [27] | Moghaddam MSH, Safaie N, Soltani J, Pasdaran A. Endophytic association of bioactive and halotolerant Humicola fuscoatra with halophytic plants, and its capability of producing anthraquinone and anthranol derivatives. Antonie van Leeuwenhoek, 2020, 113(2): 279-291. DOI:10.1007/s10482-019-01336-x |
| [28] | Carper DL, Carrell AA, Kueppers LM, Frank AC. Bacterial endophyte communities in Pinus flexilis are structured by host age, tissue type, and environmental factors. Plant and Soil, 2018, 428(1/2): 335-352. |
| [29] | Mintoo MN, Mishra S, Dantu PK. Isolation and characterization of endophytic bacteria from Piper longum. Proceedings of the National Academy of Sciences, India Section B: Biological Sciences, 2019, 89(4): 1447-1454. DOI:10.1007/s40011-018-01064-8 |
| [30] | Kiani T, Khan SA, Noureen N, Yasmin T, Zakria M, Ahmed H, Mehboob F, Farrakh S. Isolation and characterization of culturable endophytic bacterial community of stripe rust-resistant and stripe rust-susceptible Pakistani wheat cultivars. International Microbiology, 2019, 22(2): 191-201. |
| [31] | Lin BS, Song ZZ, Zhang LL, Fan JL, Lin ZX. Composition diversity and differences of endophytic bacteria in root, stem and leaf at different growth stages of Pennisetum sp.. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2018, 47(3): 352-360. (in Chinese) 林标声, 宋昭昭, 张丽丽, 范锦琳, 林占熺. 巨菌草不同生长时期根、茎、叶内生细菌组成的多样性及差异. 福建农林大学学报(自然科学版), 2018, 47(3): 352-360. |
| [32] | Sha YX. Diversity of bacterial endophytic community in different rice tissues. Acta Microbiologica Sinica, 2018, 58(12): 2216-2228. (in Chinese) 沙月霞. 不同水稻组织内生细菌的群落多样性. 微生物学报, 2018, 58(12): 2216-2228. |
| [33] | Chen ZB, Li B, Gao X, Wang DB, Jin S, Guo LH. High throughput analysis of the endophytic bacterial community in different parts of Dendrobium candidum. Journal of Henan Agricultural Sciences, 2017, 46(11): 98-102, 112. (in Chinese) 陈泽斌, 李冰, 高熹, 王定斌, 靳松, 郭丽红. 铁皮石斛不同部位内生细菌群落高通量分析. 河南农业科学, 2017, 46(11): 98-102, 112. |
| [34] | Ren F, Dong W, Yan DH. Endophytic bacterial communities of Jingbai Pear trees in north China analyzed with Illumina sequencing of 16S rDNA. Archives of Microbiology, 2019, 201(2): 199-208. |
| [35] | Zhao S, Zhou N, Zhao ZY, Zhang K, Wu GH, Tian CY. Estimation of endophytic bacterial diversity in root of halophytes in Northern Xinjiang by high throughput sequencing. Acta Microbiologica Sinica, 2016, 56(10): 1583-1594. (in Chinese) 赵帅, 周娜, 赵振勇, 张科, 吴国华, 田长彦. 新疆北部主要盐生植物根部内生细菌群落结构的高通量分析. 微生物学报, 2016, 56(10): 1583-1594. |
| [36] | Song ZQ, Wang L, Liu XH, Liang F. The diversities of Proteobacteria in four acidic hot springs in Yunnan. Journal of Henan Agricultural University, 2016, 50(3): 376-382. (in Chinese) 宋兆齐, 王莉, 刘秀花, 梁峰. 云南4处酸性热泉中的变形菌门细菌多样性. 河南农业大学学报, 2016, 50(3): 376-382. |
| [37] | Menendez E, Carro L. Actinobacteria and their role as plant probiotics//Giri B, Prasad R, Wu QS, Varma A. Biofertilizers for Sustainable Agriculture and Environment. Cham: Springer, 2019: 333-351. |
| [38] | Pirttil? AM. Endophytic bacteria in tree shoot tissues and their effects on host//Pirttil? A, Frank A. Endophytes of Forest Trees. Dordrecht: Springer, 2011: 139-149. |
| [39] | Fariq A, Yasmin A, Jamil M. Production, characterization and antimicrobial activities of bio-pigments by Aquisalibacillus elongatus MB592, Salinicoccus sesuvii MB597, and Halomonas aquamarina MB598 isolated from Khewra Salt Range. Pakistan Extremophiles, 2019, 23(4): 435-449. |
| [40] | Ansari FA, Ahmad I. Isolation, functional characterization and efficacy of biofilm-forming rhizobacteria under abiotic stress conditions. Antonie van Leeuwenhoek, 2019, 112(12): 1827-1839. DOI:10.1007/s10482-019-01306-3 |
| [41] | Singh RP, Jha PN. Alleviation of salinity-induced damage on wheat plant by an ACC deaminase-producing halophilic bacterium Serratia sp. SL-12 isolated from a salt lake. Symbiosis, 2016, 69(2): 101-111. DOI:10.1007/s13199-016-0387-x |
| [42] | Dahal RH, Chaudhary DK, Kim J. Acinetobacter halotolerans sp. nov., a novel halotolerant, alkalitolerant, and hydrocarbon degrading bacterium, isolated from soil. Archives of Microbiology, 2017, 199(5): 701-710. |
| [43] | Cappelletti M, Zampolli J, di Gennaro P, Zannoni D. Genomics of Rhodococcus//Alvarez H. Biology of Rhodococcus. Cham: Springer, 2019: 23-60. |
| [44] | 张帝.红球菌产类胡萝卜素代谢通路的探究.上海海洋大学硕士学位论文, 2016. |
| [45] | 王娜.乌头内生细菌群落结构及其与宿主生物碱合成关系研究.陕西师范大学硕士学位论文, 2014. |
