丁红秀1, 李忠莹1, 刘俊1, 沙小梅1, 张露1, 涂宗财1,2


1. 江西师范大学国家淡水鱼加工技术研发专业中心, 江西 南昌 330022;
2. 南昌大学食品与科学技术国家重点实验室, 江西 南昌 330047
收稿日期:2020-07-08;修回日期:2020-10-06;网络出版日期:2021-01-22
基金项目:国家现代农业产业技术体系专项基金(CARS-45);江西省重点研发计划(20192ACB60005)
*通信作者:涂宗财, Tel: +86-791-88120965/88127901;E-mail: tuzc_mail@aliyun.com.
摘要:[目的] 分析不同生境来源的草鱼前肠、中肠和后肠的微生物组成和群落特征。[方法] 利用16S rRNA高通量测序技术比较河流、湖泊、高密度池塘养殖与水库低密度养殖4种不同生境来源的草鱼其前、中、后肠的微生物组成和群落特征。[结果] Venn图、稀释性曲线和Alpha指数分析结果显示,前肠微生物群落多样性以养殖生境草鱼更高,而后肠微生物群落多样性以自然生境草鱼更高。不同生境草鱼前肠微生物组成和群落特征差异较大,自然生境的草鱼前肠微生物优势菌群都是不动杆菌属和贪铜菌属;高密度池塘养殖生境优势菌群是鲸杆菌属、希瓦氏菌属;低密度水库养殖生境的草鱼前肠优势菌群是链球菌属、消化链球菌属等。[结论] 不同生境的环境因子不同,养殖方式不同,饵料不同,导致草鱼前肠微生物组成和群落特征的差异较大,该结果可为草鱼肠道微生物的研究提供基础数据。高密度养殖生境的草鱼存在潜在的感染风险,建议优化养殖模式以减少有害菌的产生。
关键词:草鱼生境肠道微生物高通量测序
Comparison of intestinal microbiome composition and community characteristics of grass carp from different habitats
Hongxiu Ding1, Zhongying Li1, Jun Liu1, Xiaomei Sha1, Lu Zhang1, Zongcai Tu1,2


1. National R&D Center for Freshwater Fish Processing, Jiangxi Normal University, Nanchang 330022, Jiangxi Province, China;
2. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, Jiangxi Province, China
Received: 8 July 2020; Revised: 6 October 2020; Published online: 22 January 2021
*Corresponding author: Zongcai Tu, Tel: +86-791-88120965/88127901; E-mail: tuzc_mail@aliyun.com.
Foundation item: Supported by the Earmarked Fund for China Agriculture Research System (CARS-45) and by the Key R&D Program Projects in Jiangxi Province (20192ACB60005)
Abstract: [Objective] To analyze the microbiome composition and community characteristics of the foregut, midgut and hindgut of grass carp from different habitats. [Methods] The 16S rRNA high-throughput sequencing technology was applied to analyze the microbial composition and community characteristics of the foregut, midgut and hindgut of grass carp from four habitats, including river, lake, high-density pond culture and low-density reservoir culture. [Results] Venn diagram, Rarefaction Curve and Alpha index showed that microbial diversity of the foregut was higher in the cultured habitats than natural habitats (river and lake), whereas the diversity of the hindgut microbial community had the opposite trend. The microbial composition and community characteristics of the foregut of grass carp in different habitats varied greatly: the dominant microflora in the foregut was Acinetobacter and Cupriavidus in natural habitats, Cetobacterium and Shewanella in high-density culture pond, and Streptococcus and Peptostreptococcus in low-density culture reservoir. [Conclusion] The great differences in foregut microbial composition and community characteristics of grass carp were due to the difference of environmental factors, culture methods and diets. Our findings can provide basic data for the study of intestinal microorganisms of grass carp. There is a potential risk of infection for grass carp in high-density culture habitats, suggesting that the culture density should be controlled as much as possible in the culture of grass carp.
Keywords: grass carphabitatsgut microbeshigh-throughput sequencing
鱼类肠道微生物是鱼体消化系统中的重要组成部分,在长期的自然进化过程中鱼类与其消化道微生物之间相互适应形成了复杂的共生关系[1]。鱼体为肠道微生物提供栖息生长环境,而肠道微生物对鱼体的发育、营养、免疫和生理健康等方面具有不可替代的作用,复杂的肠道微生物群落的存在保障鱼类的营养吸收、肠道免疫和肠道生理调节[2-3]。研究表明,鱼类肠道微生物组成易受很多因素的影响而发生变化,如鱼的种类、食性、饵料以及各种环境因子等[4-6]。在不同的生境压力下,鱼类的肠道微生物区系组成不同[7]。环境中的微生物、水体盐度、水温、鱼类摄食的饵料、药物、鱼类不同的生理状态和发育阶段均会对鱼类肠道微生物群落产生影响,尤其是水环境中的微生物种类多样性、群落组成及水质因子等因素会直接影响鱼类其肠道微生物群落结构[8-10]。
草鱼(Ctenopharyngodon idellus)作为我国“四大家鱼”之一,也是我国淡水养殖的主要鱼种。研究发现,草鱼肠道中含有核心微生物区系,由变形菌门、厚壁菌门和放线菌门组成,这些肠道微生物在草鱼营养代谢方面发挥了重要的作用[11]。目前该方面的研究多以整个鱼肠道为材料,对其肠道微生物群落结构和肠道微生物菌落进行分离与鉴定[12-14]。鱼类肠道不同区段生理生化条件差异会导致肠道不同区段微生物群落结构不同[15-16],本文采用细菌16S rRNA高通量测序技术分析不同生境来源的草鱼前肠、中肠、后肠微生物组成和群落特征,描述和比较不同生境来源草鱼肠道不同区段微生物组成区系,以探讨生境与草鱼肠道微生物之间的关系,为相关研究提供基础理论支撑。
1 材料和方法 1.1 实验材料
1.1.1 仪器与试剂: (1) 仪器:Nanodrop NC2000超微量分光光度计,美国Thermo Scientific公司;DYY-6C型电泳仪,中国北京六一生物科技有限公司;PCR扩增仪,美国ABI公司;FLx800型酶标仪,美国Bio-Tek公司;Centrifuge5424R型高速台式冷冻离心机,德国Eppendorf公司;BSC-1300型无菌操作台,苏州安洋科技发展有限公司。
(2) 试剂:M0491L扩增聚合酶,购于美国NEB公司;DNA抽提试剂盒,购于美国Omega Bio-Tek公司;AM9870琼脂糖凝胶电泳缓冲液,购于美国Invitrogen公司。
1.1.2 样品采集: 在河流自然生境(江西九江永修县吴城镇赣江段)、湖泊自然生境(江西南昌进贤县青岚湖)、高密度池塘养殖生境(2000尾/亩)和低密度水库养殖生境(300–1000尾/亩)这4种不同生境中随机选取3尾草鱼,体重为(1.09±0.24) kg,体长为(37.73±2.42) cm。致死后,用75%酒精对鱼体表面进行擦拭消毒,迅速在无菌操作台内解剖,用剪刀从肛门前缘沿体腔壁上沿呈弧形剪开,分别取出草鱼的前肠、中肠、后肠[17],3尾鱼相同区段的肠道混合为一个样本,以减少个体间变异的影响。用镊子除去附着于肠道表面的脂肪,并用灭菌过的生理盐水冲洗数遍后放入5 mL的无菌EP管中,于–80 ℃冰箱中保存备用。
1.2 DNA提取和PCR扩增 用DNA提取试剂盒提取草鱼肠道微生物总DNA,同时采用Nanodrop对DNA进行定量,通过1.2%琼脂糖凝胶电泳检测DNA提取质量。
PCR扩增引物:16S rRNA V3–4区通用引物,前引物序列:5′-ACTCCTACGGGAGGCAGCA-3′,后引物序列:5′-GGACTACHVGGGTWTCTAAT-3′;扩增体系(25 μL):5×reaction buffer 5 μL、5×GC buffer 5 μL、dNTPs (2.5 mmol/L) 2 μL、Forward primer (10 μmol/L) 1 μL、Reverse primer (10 μmol/L) 1 μL,DNA模板2 μL、Q5 DNA Polymerase 0.25 μL、双蒸水8.75 μL;PCR程序:98 ℃ 2 min;98 ℃ 15 s,55 ℃ 30 s,72 ℃ 30 s,25–30个循环;72 ℃ 5 min,10 ℃直到停止。PCR扩增产物通过磁珠纯化回收,Microplate reader (Bio Tek,FLx800)荧光定量,构建测序文库后在Illumina MiSeq/NovaSeq平台进行高通量测序。
1.3 测序数据分析 测得序列用DADA2方法采用QIIME2软件进行序列去噪,与Greengenes数据库(Release 13.8,http://greengenes.secondgenome.com/)进行比对,对OTU (operational taxonomic units)序列进行物种注释分析,R软件计算并制作稀释性曲线图、Venn图和群落组成成分图和热图,采用Alpha多样性进行各项指数计算,分析样本间物种多样性。
2 结果和分析 2.1 测序质量和Venn图分析 按1.2所述方法提取的草鱼肠道微生物总DNA经过1.2%凝胶电泳检测质量较好,PCR扩增后得到16S rRNA V3–4可变区的基因片段约为500 bp,回收扩增产物后进行高通量测序,利用测得序列进行随机抽样,以抽到的序列数与它们所能代表的OTU数量构建稀释曲线,如图 1所示,随着所测序列数量的增加,各组样品的OTU数量也随之增大,但增大的幅度呈递减趋势,曲线都趋于平缓,说明测序质量较好,测序量基本能反映不同生境草鱼肠道微生物群落的组成和种类。
 |
| 图 1 不同生境样品高通量测序结果的稀释曲线 Figure 1 The rarefaction curve of high-through sequencing result of samples from different habitats. F, J, C and H represent the low-density reservoir culture, the high-density pond culture, the river and the lake habitats, respectively. The numbers 1, 2 and 3 represent the foregut, midgut and hindgut of grass carp, respectively. |
| 图选项 |
由不同生境草鱼肠道样品的OTU数量绘制Venn图。如图 2所示,河流自然生境、湖泊自然生境、高密度池塘养殖生境和低密度水库养殖生境草鱼前肠的OTU数量分别为443、248、742、514个,共有的OTU数量有16个,特有OTU数分别为318、139、557、276,分别占各自所有OTU总数的71.78%、56.05%、75.07%、53.70%。4种生境草鱼中肠各获得136、345、479、254个OTU,其特有OTU数占各自所有OTU总数的41.18%、69.86%、79.75%、50.20%。4种生境草鱼后肠共获得454、392、191、191个OTU,其后肠特有OTU数占各自所有OTU总数的72.47%、64.54%、47.64%、66.49%。
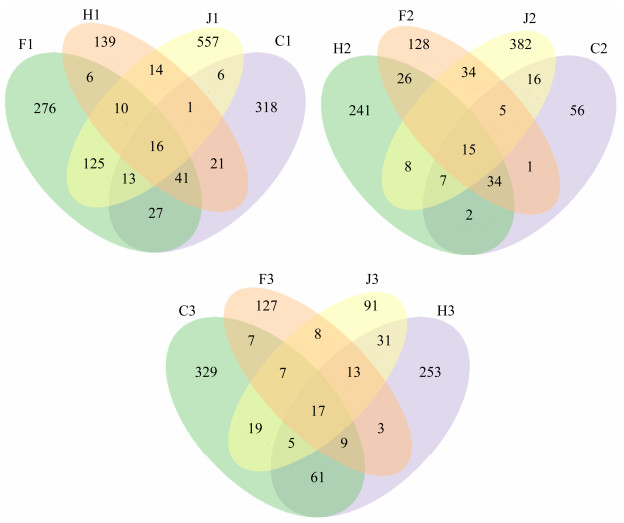 |
| 图 2 不同生境样品OTU分布Venn图 Figure 2 OTU Venn analysis of samples from different habitats. F, J, C and H represent the low-density reservoir culture, the high-density pond culture, the river and the lake habitats, respectively. The numbers 1, 2 and 3 represent the foregut, midgut and hindgut of grass carp, respectively. |
| 图选项 |
2.2 肠道微生物群落Alpha多样性分析 根据各个生境中草鱼肠道微生物OTU数量,对其进行Alpha指数分析。Chao1和Observed species指数表征丰富度,指数值越高,表明群落的丰富度越高;以Shannon和Simpson指数表征物种多样性,指数值越高,表明群落的多样性越高。如表 1所示,每个样品的Coverage均达到了99.9%以上,说明检测结果可靠。比较4种生境的草鱼肠道微生物群落Alpha指数发现,前肠微生物群落各项指数都是养殖生境的最高,高密度池塘养殖草鱼前肠微生物群落Chao1、Observed species、Shannon以及Simpson指数分别为744.80、740.4、0.94、5.70;低密度水库养殖为519.66、510.2、0.91、5.16。河流自然生境草鱼前肠指数值略高于湖泊自然生境。不同生境草鱼中肠微生物群落多样性也是养殖生境高于自然生境。后肠与前肠、中肠情况恰好相反,微生物丰富度和多样性最高的是自然生境,河流自然生境草鱼后肠微生物群落Alpha指数值分别为459.56、454.50、0.89和4.58,而养殖生境较低。
表 1. 不同生境草鱼肠道微生物多样性指数 Table 1. Functional diversity of gut microbial community of grass carp in different habitats
| Sample | Reads | OTU | Chao1 | Observed species | Simpson | Shannon | Coverage |
| C1 | 91517 | 443 | 460.21 | 446.9 | 0.92 | 5.21 | 0.9993 |
| C2 | 74719 | 136 | 142.29 | 136.3 | 0.58 | 2.16 | 0.9997 |
| C3 | 83688 | 454 | 459.56 | 454.5 | 0.89 | 4.58 | 0.9995 |
| H1 | 95920 | 248 | 263.93 | 246.5 | 0.36 | 1.38 | 0.9992 |
| H2 | 107066 | 345 | 378.09 | 348.1 | 0.58 | 2.57 | 0.9989 |
| H3 | 77523 | 392 | 396.53 | 390.0 | 0.82 | 3.85 | 0.9995 |
| J1 | 85194 | 742 | 744.80 | 740.4 | 0.94 | 5.70 | 0.9993 |
| J2 | 88750 | 479 | 502.41 | 481.2 | 0.89 | 4.37 | 0.9989 |
| J3 | 96064 | 191 | 202.06 | 189.3 | 0.87 | 3.32 | 0.9996 |
| F1 | 82696 | 514 | 519.66 | 510.2 | 0.91 | 5.16 | 0.9992 |
| F2 | 80774 | 254 | 267.54 | 256.2 | 0.60 | 2.86 | 0.9995 |
| F3 | 86489 | 191 | 202.42 | 189.2 | 0.83 | 3.51 | 0.9995 |
| F, J, C and H represent the low-density reservoir culture, the high-density pond culture, the river and the lake habitats, respectively. The numbers 1, 2 and 3 represent the foregut, midgut and hindgut of grass carp, respectively. | |||||||
表选项
2.3 肠道微生物群落结构和组成分析 图 3为门水平上细菌相对丰度图。由图 3可知,4种生境的草鱼肠道微生物主要由拟杆菌门、厚壁菌门、梭杆菌门和变形菌门组成,但各菌门的比例存在一定的差异。不同生境草鱼肠道的不同区段优势菌群不同,前肠的主要优势菌群是变形菌门,河流自然生境和湖泊自然生境中的草鱼前肠微生物中变形菌门占比较高,其占比分别为89.45%和98.58%。低密度水库养殖生境的草鱼前肠优势菌群是厚壁菌门,占比47.81%,其次是变形菌门40.92%。除湖泊自然生境外,其他3种生境草鱼中肠和后肠的优势菌群都是梭杆菌门,湖泊自然生境中的草鱼中肠微生物以变形菌门占比最高,为91.68%。
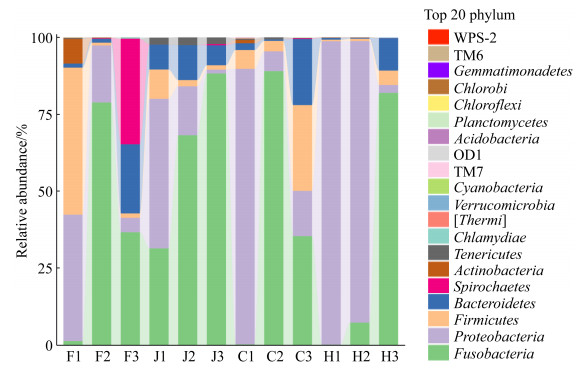 |
| 图 3 门水平上微生物相对丰度 Figure 3 Microbial community structure of different samples in phylum. F, J, C and H represent the low-density reservoir culture, the high-density pond culture, the river, and the lake habitats, respectively. The numbers 1, 2 and 3 represent the foregut, midgut and hindgut of grass carp, respectively. |
| 图选项 |
在属的分类水平上,选取丰度最高的20种属进行相对丰度计算。如图 4所示,4种生境的草鱼前肠优势菌群差异明显。两种自然生境的草鱼前肠微生物群落占优势的菌群都是不动杆菌属和贪铜菌属;高密度池塘养殖生境中占比最大的是鲸杆菌属,为31.29%;低密度水库养殖生境的草鱼前肠优势菌群是链球菌属、消化链球菌属、肠杆菌属和放线菌属,分别占细菌总数的6.65%、6.50%、5.85%和5.77%。除湖泊自然生境的草鱼外,其他3种生境草鱼中肠的优势菌群都是鲸杆菌属;而湖泊自然生境最丰富的是弧菌属,占7.40%,其次是鲸杆菌,占7.03%;不同生境草鱼后肠优势菌群是鲸杆菌属,其次是拟杆菌属,但4种生境下所占比例不同;鲸杆菌属在高密度池塘养殖生境草鱼后肠占比最高,为88.11%。
 |
| 图 4 属水平上微生物相对丰度 Figure 4 Microbial community structure of different samples in genus. F, J, C and H represent the low-density reservoir culture, the high-density pond culture, the river and the lake habitats, respectively. The numbers 1, 2 and 3 represent the foregut, midgut and hindgut of grass carp, respectively. |
| 图选项 |
2.4 肠道微生物群落相对丰度 对草鱼肠道微生物在属水平上进行群落组分相似度的聚类式热图统计分析,能更加详细看出不同生境的草鱼肠道微生物群落结构具有明显差异。如图 5所示,水库低密度养殖草鱼前肠的肠杆菌属、链球菌属、放线菌属等丰度显著高于其他生境中的草鱼前肠。河流自然生境的草鱼前肠丰度较高的菌群有嗜糖假单胞菌、贪铜菌属、鞘氨醇单胞菌属等。气单胞菌属、柠檬酸杆菌属和希瓦氏菌属在高密度池塘养殖生境草鱼前肠丰度值较高。与前肠相比,不同生境草鱼中肠微生物菌群丰度差异不大,只有湖泊自然生境草鱼中肠里的弧菌属和河流生境草鱼中肠里的Epulopiscium菌丰度值显著高于其他生境的草鱼。从肠道微生物菌落的丰度值可看出,草鱼前肠的菌群丰度差异大于中肠大于后肠,不同生境草鱼前肠微生物菌落差异较大,中肠和后肠微生物组成与群落结构具有较高的相似性。对不同生境的草鱼肠道样本间进行聚类分析发现,4种生境之间草鱼肠道微生物组成与群落结构差异较大,肠道样本之间没有明显聚集成支。
 |
| 图 5 微生物群落热图分析 Figure 5 Microbial community heatmap analysis. F, J, C and H represent the low-density reservoir culture, the high-density pond culture, the river and the lake habitats, respectively. The numbers 1, 2 and 3 represent the foregut, midgut and hindgut of grass carp, respectively. |
| 图选项 |
3 讨论 鱼类的肠道微生物多种多样,对鱼类自身的免疫力、养分吸收和消化有深刻影响[2]。本文采用细菌16S rRNA高通量测序技术分析了4种不同生境来源的草鱼其不同区段肠道微生物的结构组成,研究结果显示不同生境肠道特有的OTU数量多,说明不同生境草鱼肠道的细菌群落组成存在一定的差异。有研究表明,鱼类的肠道微生物群落组成受生境和肠道不同区段的影响[18]。本文分析不同生境草鱼肠道的细菌群落组成和肠道微生物多样性发现,就前肠而言,养殖生境草鱼肠道微生物多样性和丰富度高于自然生境;就后肠而言,自然生境草鱼肠道微生物多样性和丰富度高于养殖生境,说明草鱼肠道不同区段微生物组成不同,对生境的反应也不同。
本文研究发现不同生境草鱼肠道微生物组成主要有4种类群,分别是拟杆菌门、厚壁菌门、梭杆菌门和变形菌门,以往研究也表明变形菌门、厚壁菌门、拟杆菌门是鱼类肠道微生物中常见的优势菌群[19-20]。涂宗财等[21]研究发现,异育银鲫肠道微生物具有一个不受重金属铜影响的“核心菌群”。本研究发现不同生境草鱼肠道优势菌群相同,表明草鱼肠道微生物可能存在一个“核心菌群”,推测生境对草鱼肠道微生物群落主要组成影响不大。不同生境、肠道不同区段这4种菌群所占比例不同,4种生境草鱼前肠微生物群落占比最大的都是变形菌门。变形菌门是细菌中最大的门,也是各种水体中占优势的菌门,广泛存在于各种不同生境中[22-23]。鱼类受水环境因子的影响,这可能是前肠变形菌门占比较大的主要原因,尤其是两种自然生境的草鱼前肠变形菌门的占比分别达到89.45%和98.58%,其次是高密度池塘养殖生境占48.6%。由此可见生境对肠道微生物的组成存在一定影响。与前肠不同,草鱼中、后肠优势菌群是梭杆菌门、厚壁菌门和拟杆菌门,这与郝耀彤等[16]关于草鱼肠道不同部位微生物对食物改变适应性变化的研究结果相似。
在属水平上,不同生境草鱼前肠微生物群落组成差异较大,河流自然生境和低密度水库养殖生境的草鱼前肠发现大量未被知晓的菌群。分析不同生境草鱼肠道微生物群落相对丰度也发现,不同生境草鱼前肠样本间距离较远。研究表明高密度池塘养殖生境的草鱼前肠中占比最大的是鲸杆菌属,其次是希瓦氏菌属。比较肠道微生物群落相对丰度也证明,希瓦氏菌属在高密度池塘养殖生境草鱼前肠丰度值较高。希瓦氏菌属主要发现在有腐败趋势的鱼类体内,是一种潜在致病菌[24],说明高密度养殖生境有潜在的患病隐患。造成前肠微生物组成差异大的原因除了不同生境的环境因子不同,另一原因可能是食物类型不同,目前有研究证明鱼类摄食不同类型的食物可以改变肠道微生物菌群结构。王颖等[25]发现,饲料中添加芽孢杆菌、乳酸菌以及酵母菌等组成的微生物制剂可以增加草鱼肠道菌群多样性和丰富度。周文豪等[26]对比摄食不同饵料对草鱼肠道菌群影响,发现摄食不同饲料草鱼的肠道细菌数量和菌群组成均明显受到影响。草鱼属于无胃鱼类,前肠较为膨大,在消化系统中起到类似胃的作用,食物进入食道,先在前肠初步消化[27],所以不同生境草鱼前肠微生物群落组成差异较大。相较于前肠,不同生境草鱼的中肠和后肠优势菌均为鲸杆菌属和拟杆菌属,微生物群落结构相似度很高,对其进行聚类分析,相较于前肠,不同生境草鱼中、后肠样本间距离较近。表明成年草鱼肠道中、后段微生物群落的组成相对稳定。
鱼类赖于生活的水环境中微生物群落组成、多样性、丰富度及食物种类与来源等因素会直接影响鱼类其肠道微生物群落组成和结构,河流或湖泊自然生境水体体量大,水流相对通畅,水质清澈,水体中有机质含量相对较少,不适合微生物的滋生,生长于其中的草鱼以各种高等水生植物为食,食物来源丰富。人工养殖环境水域面积一般较小,水体流动性差或无流动性,加上人工配合饲料的投放,水体有机质丰富,生活于其中的草鱼以饲料为食,食物来源单一。本文选取两种自然生境和两种养殖生境中草鱼为样本,对其肠道不同部位的微生物群落组成、结构、多样性等进行分析,揭示了不同生境中草鱼肠道不同部位的微生物组成及群落特征,研究结果表明不同生境中草鱼肠道尤其是前肠微生物组成存在差异,显示生境差异确实影响了草鱼肠道微生物群落结构特征,可为鱼类肠道微生物与生境之间关系的相关研究提供参考。此外,研究还发现,高密度养殖生境草鱼前肠微生物中希瓦氏菌属占比较大,显示存在潜在的患病隐患,建议在草鱼养殖过程中尽量控制养殖密度,改善养殖方式以减少有害菌的产生。
References
| [1] | Gao QX, Wu TX, Wang JB. Advance in research on symbiotic relationship between intestinal bacterial and their host. Chinese Journal of Animal Nutrition, 2010, 22(3): 519-526. (in Chinese) 高权新, 吴天星, 王进波. 肠道微生物与寄主的共生关系研究进展. 动物营养学报, 2010, 22(3): 519-526. |
| [2] | Ganguly S, Prasad A. Microflora in fish digestive tract plays significant role in digestion and metabolism. Reviews in Fish Biology and Fisheries, 2012, 22(1): 11-16. DOI:10.1007/s11160-011-9214-x |
| [3] | Zhang ML, Du ZY. Review and perspective: function of intestinal microbiota in aquatic animals. Journal of East China Normal University (Natural Science), 2016(1): 1-8. (in Chinese) 张美玲, 杜震宇. 水生动物肠道微生物研究进展. 华东师范大学学报(自然科学版), 2016(1): 1-8. |
| [4] | Jin YX, Wu SS, Zeng ZY, Fu ZW. Effects of environmental pollutants on gut microbiota. Environmental Pollution, 2017, 222: 1-9. DOI:10.1016/j.envpol.2016.11.045 |
| [5] | Li CY, Xu YJ, Liu XZ, Yang HJ, Shi B, Shi XY, Zhu XW. Comparative analysis of composition, diversity and origin of intestinal bacterial community in pond-and indoor tank-culture Japanese flounder (Paralichthys olivaceus). Journal of Fisheries of China, 2015, 39(2): 245-255. (in Chinese) 李存玉, 徐永江, 柳学周, 杨洪军, 史宝, 史学营, 朱学武. 池塘和工厂化养殖牙鲆肠道菌群结构的比较分析. 水产学报, 2015, 39(2): 245-255. |
| [6] | Zhai WY, Guo AN. Research progress on the fish intestinal microbiota. Henan Fisheries, 2016(4): 18-21, 40. (in Chinese) 翟万营, 郭安宁. 鱼类肠道微生物研究进展. 河南水产, 2016(4): 18-21, 40. |
| [7] | Wong S, Rawls JF. Intestinal microbiota composition in fishes is influenced by host ecology and environment. Molecular Ecology, 2012, 21(13): 3100-3102. DOI:10.1111/j.1365-294X.2012.05646.x |
| [8] | Zheng TT, Tu ZC, Tang PP, Zhang L, Sha XM, Wang H. Effect of sulfadiazine on the gut microbiota of Carassius auratus gibelio. Acta Microbiologica Sinica, 2018, 58(10): 1754-1763. (in Chinese) 郑婷婷, 涂宗财, 唐平平, 张露, 沙小梅, 王辉. 水环境中磺胺嘧啶对异育银鲫肠道微生物的影响. 微生物学报, 2018, 58(10): 1754-1763. |
| [9] | Wang AR, Ran C, Ring? E, Zhou ZG. Progress in fish gastrointestinal microbiota research. Reviews in Aquaculture, 2018, 10(3): 626-640. DOI:10.1111/raq.12191 |
| [10] | Tarnecki AM, Burgos FA, Ray CL, Arias CR. Fish intestinal microbiome: diversity and symbiosis unravelled by metagenomics. Journal of Applied Microbiology, 2017, 123(1): 2-17. DOI:10.1111/jam.13415 |
| [11] | Wu SG, Wang GT, Angert ER, Wang WW, Li WX, Zou H. Composition, diversity, and origin of the bacterial community in grass carp intestine. PLoS One, 2012, 7(2): e30440. DOI:10.1371/journal.pone.0030440 |
| [12] | Li XH, Yu YH, Li C, Yan QY. Comparative study on the gut microbiotas of four economically important Asian carp species. Science China Life Sciences, 2018, 61(6): 696-705. DOI:10.1007/s11427-016-9296-5 |
| [13] | Li TT, Long M, Gatesoupe FJ, Zhang QQ, Li AH, Gong XN. Comparative analysis of the intestinal bacterial communities in different species of carp by pyrosequencing. Microbial Ecology, 2015, 69(1): 25-36. DOI:10.1007/s00248-014-0480-8 |
| [14] | Han SF, Liu YC, Zhou ZG, He SX, Cao YA, Shi PJ, Yao B, Ring? E. Analysis of bacterial diversity in the intestine of grass carp (Ctenopharyngodon idellus) based on 16S rDNA gene sequences. Aquaculture Research, 2010, 42(1): 47-56. DOI:10.1111/j.1365-2109.2010.02543.x |
| [15] | Zhang Z, Li B, Wang YG, Liao MJ, Wang L, Rong XJ. The microflora structure in digestive tract of half-smooth tongue sole (Cynoglossus semilaevis gunther) cultured in outdoor pond basing on high-through sequencing technique. Acta Hydrobiologica Sinica, 2015, 39(1): 38-45. (in Chinese) 张正, 李彬, 王印庚, 廖梅杰, 王岚, 荣小军. 基于高通量测序的池塘养殖半滑舌鳎消化道菌群的结构特征分析. 水生生物学报, 2015, 39(1): 38-45. |
| [16] | Hao YT, Wu SG, Wang GT, Zou H, Li WX. Study on the adaptation changes of intestinal microbiota in Ctenopharyngodon idellus fed on different diets. Freshwater Fisheries, 2015, 45(3): 46-51, 101. (in Chinese) 郝耀彤, 吴山功, 王桂堂, 邹红, 李文祥. 草鱼肠道微生物对食物改变适应性变化的研究. 淡水渔业, 2015, 45(3): 46-51, 101. |
| [17] | Ni DS, Wang JG. Biology and diseases of grass carp. Beijing: Science Press, 1999. (in Chinese) 倪达书, 汪建国. 草鱼生物学与疾病. 北京: 科学出版社, 1999. |
| [18] | Ni JJ, Yan QY, Yu YH, Zhang TL. Fish gut microecosystem: a model for detecting spatial pattern of microorganisms. Chinese Journal of Oceanology and Limnology, 2014, 32(1): 54-57. DOI:10.1007/s00343-014-3072-z |
| [19] | Roeselers G, Mittge EK, Stephens WZ, Parichy DM, Cavanaugh CM, Guillemin K, Rawls JF. Evidence for a core gut microbiota in the zebrafish. The ISME Journal, 2011, 5(10): 1595-1608. DOI:10.1038/ismej.2011.38 |
| [20] | Li XM, Yan QY, Xie SQ, Hu W, Yu YH, Hu ZH. Gut microbiota contributes to the growth of fast-growing transgenic common carp (Cyprinus carpio L.). PLoS One, 2013, 8(5): e64577. DOI:10.1371/journal.pone.0064577 |
| [21] | Tu ZC, Pang JJ, Wang H, Zhang L, Sha XM. Effect of heavy metal Cu on Allogynogenetic Carassius auratus intestinal microorganism. Acta Microbiologica Sinica, 2017, 57(7): 1060-1068. (in Chinese) 涂宗财, 庞娟娟, 王辉, 张露, 沙小梅. 水环境中重金属铜对异育银鲫肠道微生物的影响. 微生物学报, 2017, 57(7): 1060-1068. |
| [22] | Sheng P, Yu YZ, Tian XJ, Huang JL, Zhang ZH, Ding JN. Bacterial diversities and compositions in seven different estuarine water columns of Poyang Lake. Research of Agricultural Modernization, 2016, 37(3): 606-612. (in Chinese) 圣平, 于一尊, 田晓娟, 黄江丽, 张志红, 丁建南. 鄱阳湖7个河口水体中细菌多样性和组成特征. 农业现代化研究, 2016, 37(3): 606-612. |
| [23] | Yan QY, Li JJ, Yu YH, Wang JJ, He ZL, Van Nostrand JD, Kempher ML, Wu LY, Wang YP, Liao LJ, Li XH, Wu S, Ni JJ, Wang C, Zhou JZ. Environmental filtering decreases with fish development for the assembly of gut microbiota. Environmental Microbiology, 2016, 18(12): 4739-4754. DOI:10.1111/1462-2920.13365 |
| [24] | Zheng ZX, Zhou D, Feng JL, Jin RY, Dai ZY. Microflora composition variation in mackerel (Pneumatophorus japonicas) stored in refrigerated seawater, and isolation and identification of the dominant spoilage bacteria. Modern Food Science and Technology, 2016, 32(4): 81-86. (in Chinese) 郑振霄, 周聃, 冯俊丽, 金仁耀, 戴志远. 冷海水保藏下鲐鱼(Pneumatophorus japonicus)菌相变化规律及优势腐败菌的分离鉴定. 现代食品科技, 2016, 32(4): 81-86. |
| [25] | Wang Y, Song M, Zhang JH, Zhou QB, Zhang ZZ, Wang ZR, Yang ZQ. Effects of probiotics level on growth performance and intestinal flora in grass carp Ctenopharyngodon idellus. Fisheries Science, 2020, 39(1): 12-21. (in Chinese) 王颖, 宋明, 张锦华, 周秋白, 张正洲, 王自蕊, 杨竹青. 微生态制剂对草鱼生产性能和肠道菌群的影响. 水产科学, 2020, 39(1): 12-21. |
| [26] | Zhou WH, Chen XX, Zhang DX, Chen CF. A prelimilary study on the influence of different feeding stuff on intestinal microflora of grass carp (Ctenopharyngodon idellus). Journal of Huazhong Agricultural University, 1998, 17(3): 252-256. (in Chinese) 周文豪, 陈孝煊, 张冬晓, 陈昌福. 摄食不同饵料对草鱼肠道菌群影响的研究. 华中农业大学学报, 1998, 17(3): 252-256. |
| [27] | Ozaki H. Physiology of fish digestion (Volume 1). Wu SZ, trans. Shanghai: Shanghai Scientific & Technical Publishers, 1983. (in Chinese) 尾崎久雄. 鱼类消化生理(上册). 吴尚忠, 译. 上海: 上海科学技术出版社, 1983. |
