崔灿1, 杨海涛2, 王泽方1


1. 天津大学生命科学学院, 结构生物学实验中心, 天津 300072;
2. 上海科技大学生命科学与技术学院, 上海免疫化学研究所, 上海 201210
收稿日期:2020-03-09;修回日期:2020-05-16;网络出版日期:2020-07-08
基金项目:国家自然科学基金(31970048,81601593)
*通信作者:王泽方, E-mail:zefangwang@tju.edu.cn.
摘要:在过去的10年中,以新德里金属β-内酰胺酶-1(NDM-1)为代表的金属β-内酰胺酶在全球范围内广泛传播,对公共卫生安全产生了较大的威胁。尤其是近些年这些酶的突变体的出现使得耐药菌给人类健康造成了更加复杂和困难的挑战。目前,临床上仍然缺乏有效的治疗药物和手段。研发有效广谱的抑制剂成为解决此问题的重点。因此本文将针对NDM-1及其相关抑制剂复合物的三维结构解析工作进行综述,希望从生物学机制研究的角度带给相关研究人员一点启发和帮助。
关键词:新德里β内酰胺酶-1金属β-内酰胺酶抑制剂抑制机制复合物晶体结构
Research progress in structure, function and inhibition mechanism of NDM-1
Can Cui1, Haitao Yang2, Zefang Wang1


1. Experimental Center of Structural Biology, School of Life Sciences, Tianjin University, Tianjin 300072, China;
2. Shanghai Institute for Advanced Immunochemical Studies, School of Life Science and Technology, Shanghai Tech University, Shanghai 201210, China
Received: 9 March 2020; Revised: 16 May 2020; Published online: 8 July 2020
*Corresponding author: Zefang Wang, E-mail:zefangwang@tju.edu.cn.
Foundation item: Supported by the National Natrual Science Foundation of China (31970048, 81601593)
Abstract: In the past decade, metallo-β-lactamases, represented by New Delhi metallo-β-lactamases (NDM-1), have been widely spread around the world, threatening public health and safety. Especially in recent years, the emergence of mutants of these enzymes has caused more complex and difficult challenges to human health. At present, there is still a lack of effective treatment drugs and means. The key to solve this problem is to develop effective broad-spectrum inhibitors of the enzyme. Therefore, we review the three-dimensional structure analysis of NDM-1 and its related inhibitor complexes, to give some inspiration and to help relevant researchers from the perspective of biological mechanism research.
Keywords: NDM-1metallo-β-lactamasesinhibitorsinhibition mechanismcrystal structure of protein
在过去的10年中,新德里金属β-内酰胺酶-1 (NDM-1)成为“超级细菌”的代言人,并在全球范围内广泛传播。2008年,NDM-1首次在印度新德里的一名瑞典病人身上被发现;2010年8月,全世界开始大规模暴发“超级细菌”传染病疫情,短短两个月便已传播至南亚、东亚地区,欧洲地区以及北美地区并引发公众恐慌。由于NDM-1拥有比其他金属内酰胺酶更加广谱的底物范围,甚至可以水解抗生素的最后一道防线——碳青霉烯类抗生素,导致人类在对抗NDM-1“超级细菌”时缺乏合适的抗生素,从而造成了许多人的死亡。这次疫情的暴发,经过了Kumarasamy等的报道[1],才真正引起国际性的关注。科学家们从世界各地检测出许多携带NDM-1的菌株以及NDM-1的亚型,至今为止,已经有29种NDM亚型(NDM-1-NDM-29)被发现,这些突变体的出现使得耐药菌给人类健康造成了更加复杂和困难的挑战[2],极可能对公共卫生安全构成越来越严重的威胁[3]。目前,针对NDM-1的研究已经不少,但在临床上仍然缺乏有效的治疗药物和手段。利用X射线衍射技术,对蛋白质晶体进行结构解析,可以提供直观、精确的结构生物学证据,并在此基础上为新型药物或抑制剂的研发提供严谨的结构模型,在生物学和医药学上具有重要的研究价值。因此,针对NDM-1及其相关复合物的三维结构进行解析工作,可以从生物学机制的角度带给相关研究人员一点启发和帮助。
1 NDM的特点 1.1 遗传特点 NDM-1是一种分子量约为27.5 kDa的单链金属β-内酰胺酶,由270个氨基酸组成,其N端有一个约2.85 kDa大小的信号肽,可以水解几乎所有种类的β-内酰胺类抗生素。甚至还可以水解令多数细菌敏感的碳青霉烯类抗生素。最初发现该蛋白由储存于肺炎克雷伯杆菌质粒上的blaNDM-1基因编码[4],通过对抗性菌株的分离发现其基因既可以通过质粒进行无性繁殖,也十分容易因为质粒的接合转移、重排等作用变得更加多样。而Walsh等[5]发现,这种基因不仅可以在肠杆菌中传播,甚至可以传播至其他菌种,但其基因稳定性和耐药性在不同菌种中有较大差异。此外,当温度在30 ℃时,该基因的结合和转移都更容易发生,Pfeifer等[6]发现鲍曼不动杆菌中的blaNDM-1能够借助IS26、IS930和转座酶等可移动元件整合到染色体上以提高基因的稳定性。以上研究揭示了其传播速度较其他耐药基因更加迅速的种种原因。因此我们可以得出结论,该基因可以利用质粒快速进行跨菌种传播,还能够在转座因子和转座酶的帮助下整合到细菌的染色体上,使遗传和耐药性更加稳定。
1.2 结构特点 在结构上,NDM-1属于金属β-内酰胺酶(MBLs) 3个亚类(B1,B2,B3)中与临床关系特别紧密的B1类,且被囊括在由Neuwald等在1997年提出并定义的金属依赖型水解酶家族(MBL super family)中[7-9]。
NDM-1的氨基酸序列与许多其他B1-MBLs亚类的氨基酸序列差异非常明显(图 1),但是他们之间的三维结构非常相似,呈现明显的独特而保守的αβ/βα汉堡夹心结构。相较于丝氨酸β-内酰胺酶(SBLs),以NDM-1为代表的MBLs,其底物更加混杂,水解能力更强。Guo等解析的NDM-1的高分辨率晶体结构(图 2,1.91?,PDB:3S0Z)显示,NDM-1晶体属于空间群I422,每个不对称单元含有1个分子[10]。一般从N端起将其二级结构分别命名为α1-α7、β1-β12。3段loop区L3(P67-F70)、L7和L10构成了NDM-1活性口袋的主体,可将其分为左右2个结构域,活性中心的2个Zn(Ⅱ)处于口袋底部。为了方便分析,一般将由Hisl20、Hisl22、His189所组成的组氨酸结合位点配位的(Ⅱ)编号为Zn1,与Cys208和His250所组成的半胱氨酸结合位点配位的(Ⅱ)编号为Zn2,这2个Zn(Ⅱ)距离为3.2 ?,通过Aspl24侧链相互连接[11]。
 |
| 图 1 NDM-1与其他MBLs的序列比对及最大似然法进化树 Figure 1 Sequence alignment and molecular phylogenetic analysis by maximum likelihood method between NDM-1 and other MBLs. The tree is drawn to scale, with branch lengths measured in the number of substitutions per site. The analysis involved 5 amino acid sequences. All positions containing gaps and missing data were eliminated. There were a total of 192 positions in the final dataset. Evolutionary analyses were conducted in MEGA7. |
| 图选项 |
相较于丝氨酸β-内酰胺酶(SBLs),NDM-1活性位点比较深。参与底物结合识别的发夹L3环的特征在于存在与底物疏水取代基相互作用的疏水残基(Leu65、Met67、Phe70和Val73),而L10环包括配位Zn2的残基(Cys208)以及与底物羧基相互作用的残基(Lys211和Asn220)[12]。这都说明,不同于SBLs由四联体S70XXK73、三联体S130DN132、K234TG236以及Ω环组成的较为固定而保守的结合口袋[13](图 3),NDM-1的结合口袋虽然被多个环路包围,使活性位点处于口袋“底部”较深的位置,但其位置仍然处于蛋白的表层,且口袋大而灵活,其活性中心的Zn(Ⅱ),也可与环境溶剂直接接触。
 |
| 图 3 kpc-2(SBLs)活性口袋示意图 Figure 3 Schematic diagram of kpc-2 (SBLS) active pocket. |
| 图选项 |
1.2.1 特殊氨基酸残基序列: 通过结构比对可以看出(图 4),相较于其他MBLs,NDM-1具有一些特殊的氨基酸链。
 |
| 图 4 NDM-1与VIM-1结构比对 Figure 4 Comparison of NDM-1 and VIM-1 structures. |
| 图选项 |
其一是Phe163-Asn166。这个区域位于NDM-1的左右2个结构域之间,在其他MBLs中是从没有过的。从序列比对的结果也同样可以得到这个结论。虽然从结构分析来看,这段氨基酸链距活性中心较远,参与直接催化的可能性十分低。但在Yong等[4]的研究中认为,这段氨基酸链存在于将蛋白左右两部分相连的Loop环上,使得NDM-1结构更松散灵活,却没有影响其结构的稳定。因此很可能是NDM-1比其他MBLs具有更广泛耐药性的原因之一。
其二是NDM-1特有的是Tyr229残基(图 5)。这个残基是被酶活性位点的底部覆盖的,因此有人推断这个残基因为被覆盖隔离导致在酶活反应中没有起直接的作用,后来此推断从Y229W突变活性测试中已得到证明[14]。但是,Tyr229、Leu209和Glyl88在酶活位点附近形成的氢键表明,Tyr229在维持酶活位点构象稳定中起到了重要的作用。与活性口袋柔性大的特点可能有比较重要的关系。
 |
| 图 5 Tyr229、Leu209和Glyl88在酶活位点附近形成的氢键 Figure 5 Hydrogen bond formed near the active site of tyr229, leu209 and glyl88. |
| 图选项 |
其三是L1 Loop区的特殊构象(图 6)。相较于其他MBLs,NDM-1结构中唯一比较特殊的是其L1 Loop区具有一个灵活的弯曲构象。在B1亚群,例如BcⅡ中,L1 Loop区是由N-末端的61-65位氨基酸所组成的Loop环区域[15]。这个Loop环能够与带有疏水性侧链的抑制剂和底物连接,在酶活口袋中组成一个隧道形的狭窄裂口,将位于活性位点的底物“锁住”。而在NDM-1中,通过蛋白结构图我们可以清楚地看到,对应L1区的Met67-Gly71区域,相较于其他MBLs伸展的状态,NDM-1这段弯曲构象的Loop区域可以使其在与底物结合过程中更加灵活。因此推断,这个特殊构象是允许NDM-1与底物结合时不受底物R基团大小影响的原因之一[16]。
 |
| 图 6 BCⅡ酶L1区域(蓝色),NDM-1酶L1区域(红色) Figure 6 BC Ⅱ enzyme L1 region (blue), NDM-1 enzyme L1 region (red). |
| 图选项 |
1.2.2 独特的二聚体结构: 其他临床上重要的MBLs是可溶性周质酶,而NDM-1是锚定在革兰氏阴性细菌外膜中的脂蛋白。这种独特的细胞定位使NDM-1在感染部位免疫系统反应引起的Zn(Ⅱ)匮乏时具有更强的稳定性,使得酶活性不被抑制。一些研究表明,当NDM-1在嵌入细胞膜状态和均一状态下的时候,其晶体由于疏水作用和分子间作用力便会呈现二聚体的结构形式(图 7)[17-18]。因此推测,NDM-1这种二聚体的形式亦是导致其耐药性更加广谱、水解能力更强的原因之一。
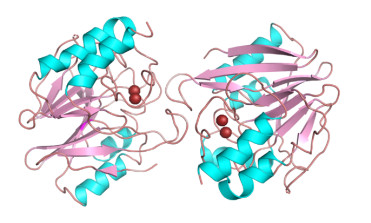 |
| 图 7 NDM-1的二聚体结构[17-18] Figure 7 Dimer structure of NDM-1[17-18]. |
| 图选项 |
2 NDM-1的水解机制的特点 NDM-1拥有广泛的水解底物,且催化效率极高,因此其活性位点的关键残基如何发挥功能及水解的实际过程都是研究的重点[19]。目前蛋白数据库(Protein Data Bank)中已经公布的NDM-1相关晶体有83种,包括数十种NDM-1与水解底物、抑制剂的复合物及个别的突变体。这些复合物晶体都为阐明NDM-1的水解机制提供了重要证据,随着对NDM-1基础研究的逐渐深入,其实际水解过程也逐渐被揭开。
2.1 特殊的水解过程 NDM-1的活性口袋包含2个对于酶活性不可或缺的Zn(Ⅱ)(图 2)[20-21],研究中多将Zn(Ⅱ)作为NDM-1等金属β-内酰胺酶的催化中心来进行研究[22]。根据1999年提出的双锌金属β-内酰胺酶的作用机制[23-24],结合X射线晶体学研究中NDM-1与氨苄青霉素水解产物[25]、美罗培南水解产物等复合物晶体结构的直接证据[26],现在普遍认为其水解过程主要分为两步,亲核攻击和质子转移。
 |
| 图 2 NDM-1二级结构顺序及离子结合位点 Figure 2 Number of NDM-1 secondary structure and ions binding site. |
| 图选项 |
首先由2个Zn(Ⅱ)结合的水或者氢氧根作为亲核试剂攻击β-内酰胺环的羰基碳,使环断裂,同时形成短暂的四面体构象[27]。此处晶体中观察到的Zn(Ⅱ)结合的水或者氢氧根后被证实主要与pH值有关(图 8);然后,Zn2通过金属配位键与中间体结合,起到稳定作用,最后质子经过转移和内酰胺环上的N结合,形成稳定开环的代谢产物。在水解过程中,Zn1与Zn2在酶进行底物识别时发挥的核心作用不同[20],一般认为Zn1主要保持其四面体配体的羟基对内酰胺环上羰基碳的亲核攻击的正确方向,而Zn2更多的是给β-内酰胺环的氮原子上的孤电子对提供轨道[12, 28]。
 |
| 图 8 NDM-1水解机制 Figure 8 Hydrolysis mechanism of NDM-1. |
| 图选项 |
2.2 活性位点的关键残基 然而由于NDM-1的底物众多[19],参与水解过程的活性位点关键残基在不同NDM-1与水解底物的复合物晶体中呈现不同构象,导致研究者对于NDM-1水解不同底物的实际过程产生了不同的猜想。主要在于NDM-1对这些不同底物水解的高催化效率是否反映在催化的类似顺序和结构要求上,即是否使用相同的催化机制来实现每一类的水解。
为了验证活性位点残基对β-内酰胺类抗生素水解的重要性,Sun等构建了随机单密码子文库[29],以NDM-1活性位点及其附近的31个残基为目标,通过对筛选出的抗代表性抗生素的随机单密码子突变文库进行深度测序,发现NDM-1对青霉素或头孢菌素的水解有严格的序列要求。其中,必需锌配体残基包括组氨酸位点(His116、His118和His196)和半胱氨酸位点(Asp120、Cys221和His263)(图 9)。而残基Asp84、Asp199和Lys121在NDM-1中的功能虽然尚不清楚,但也被认定为对NDM-1水解所有被测抗生素的功能是必需的。对NDM-1结构的分析表明,这些氨基酸残基的侧链和主链基团与多个残基形成氢键,并在活性部位起到连接环结构的作用(图 10)。Asp84与His55、Val113、Thr115和Lys121形成氢键,Asp199与Ala117、Ser141和Thr197相互作用,而Lys121与His118和Ser262形成氢键。分析可知,MBLs的金属结合位点完全建立在Loop和连接二级结构的弯(turn)上,由Asp84、Asp199和Lys121残基介导的环间相互作用可能在维持NDM-1环的位置和稳定性方面发挥关键作用。
 |
| 图 9 NDM-1-β-内酰胺酶结构图 Figure 9 Structural diagram of NDM-1-β-lactamase. Showing the positions of essential residues, substrate specific residues and nonessential residues. The essential, substrate specific and nonessential residues are labeled red, yellow and green, respectively, while the zinc atoms are represented as gray spheres. |
| 图选项 |
 |
| 图 10 NDM-1活性位点上连接Loop的氢键网络 Figure 10 Hydrogen bonding network connecting loop on NDM-1 active site. |
| 图选项 |
结果显示,青霉素和头孢菌素水解所需的残基位置是碳青霉烯水解所需残基位置的子集。这说明,虽然所有底物的催化作用都使用一个共同的残基核心,但水解碳青霉烯需要一组额外的残基来达到与青霉素和头孢菌素相当的催化效率。此外,他们通过这个实验还发现了一些非必需氨基酸残基,但这些氨基酸残基主要位于活性位点的外围,不与锌离子或结合底物相互作用(图 11)。这说明NDM-1的水解功能可以耐受多种氨基酸替换,而不会损害其水解任何被测β-内酰胺抗生素的功能。这也说明了NDM-1广泛的底物分布,可能完全是由碳青霉烯类化合物的选择性压力演变而来的。因此根据NDM-1水解碳青霉烯的严格序列限制去设计抑制剂,可能在恢复碳青霉烯抗生素效用方面会有很好的效果。
 |
| 图 11 NDM-1与水解产物氨苄青霉素、美罗培复合物结构 Figure 11 Structure of NDM-1, ampicillin and meropenem. |
| 图选项 |
2.3 特殊的底物结合模式 近年来,各种β-内酰胺抗生素与NDM-1酶活性位点的分子对接(molecular docking)研究获得了一些有意思的成果[19]。对接底物的构象揭示了两种主要的底物结合方式,即“S”和“I”构象。“S”型中,β-内酰胺环的羰基氧与Zn1配位,稠环羧酸酯与Zn2配位,桥联水/羟基定位亲核攻击,因此该构象是利于催化的构象。“I”模式中,稠合环的羧酸与Zn1和Zn2配位,取代水/羟基,并使β-内酰胺酰胺基团远离金属离子,从而产生抑制结合模式。有趣的是,对于适配性良好的底物,“S”构型相较于“I”构型有巨大的优势;而对于适配性较差的底物,如单β-内酰胺环的底物氨曲南,几乎所有对接结构均取代了质子供体水/羟基,而处于“I”模式。该结果表明,单β-内酰胺环的底物不会被NDM-1水解,因为它们与桥接在Zn1和Zn2之间的磺酸酯基结合并置换作为质子供体的水,使得反应无法进行。这说明,NDM-1的结合机制十分灵活,也是其底物如此广泛的可能原因之一。同时,基于其两种结合模式的研究,可以针对性地进行抑制剂先导物的筛选,加快寻找有效抑制剂的进程。
3 NDM-1抑制剂复合物 从NDM-1横空出世到如今的10年时间里,人们作出了许多努力来获得有关NDM-1的清晰结构[30],以阐明其作用机理,并确定与底物相互作用的残基,这些残基为药物设计提供了明确的目标。
针对当下的困境,寻找广谱的有效抑制剂,是最经济、最快速的方法。其中从上市药物和成分明确的天然产物中筛选的思路是如今最常用的[31-32]。对于SBLs,现在已经发现了几种基于明确抑制机理的抑制剂,并已经用于临床治疗,但临床上仍缺少对NDM-1有特异性的高效抑制剂[33-34]。有效的MBLs抑制剂的缺乏可能主要归因于3个原因:不同MBLs类之间的活性位点的结构多样性,活性位点入口处环结构的灵活可变性,以及多种NDM-1变体的存在。在近几年中,NDM-1通过在不同位置进行单突变或双突变已经进化出了20多个新变体[35],这些变体通常会增强自身在Zn(Ⅱ)匮乏状态下的水解性能[36]。但是,考虑到大多数底物-蛋白质相互作用涉及2个锌离子,以及MBLs结合位点的特殊性质可能会部分干扰有效特异性抑制剂的设计。因此,要成功地指导临床上有效抑制剂的合理设计,完全了解催化机理及底物结合位点的可变性是非常必要的。现在,尽管已经公开了许多分子作为NDM-1的抑制剂,但只得到了少数的复合物晶体,因此限制了我们对已报道的抑制剂的结合方式与作用机理的了解。据统计,到目前为止,虽然文献中已经报道了525种NDM-1抑制剂,然而有明确复合物结构的抑制剂只有很少一部分,且主要为卡托普利衍生物复合物(2016)、Bi(Ⅲ)化合物复合物(2019)、异芳基膦酸盐衍生物复合物(2019)和四唑类化合物复合物(2019)。因此对NDM-1的抑制机制的讨论将主要围绕以上4种复合物结构展开。
3.1 L-卡托普利 卡托普利是一种被广泛作为血管紧张素转化酶(ACE)抑制剂使用的上市药物,可以用于高血压的治疗。Guo等[10]观察到D-卡托普利(图 12)对NDM-1具有很强的抑制能力,其IC50为7.9 μmol/L,而L型对映异构体的效价低了25倍[37]。但由于他们未能取得复合物结构,因此无法直接说明卡托普利的抑制机制。
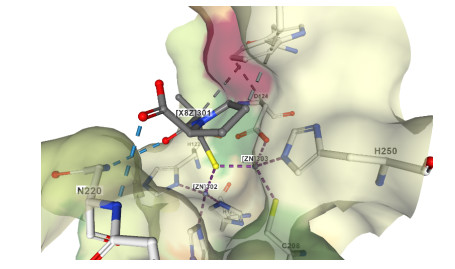 |
| 图 12 D-卡托普利及其与NDM-1复合物晶体 Figure 12 Crystal of D-captopril and its complex with NDM-1. |
| 图选项 |
King等[38]通过质谱及X射线晶体学分析解析了L-卡托普利与NDM-1结合的第一个晶体结构。在X射线结构中,L-卡托普利的巯基部分插入2个Zn(Ⅱ)之间,取代了水分子,并作为NDM-1的竞争性抑制剂起到了抑制作用。此外,Asn220是对底物结合和中间产物稳定至关重要的残基(图 13),该分子的疏水部分与L3环相互作用,亲水部分与Asn220形成氢键,因此推断其与Asn220的结合间接参与了对NDM-1活性的抑制,且这种结合方式类似于NDM-1水解青霉素时的结合机制(PDB编码4HL2),具有较好的特异性。所以,巯基衍生物为寻找NDM-1抑制剂提供了理想的方向。
 |
| 图 13 NDM-1与B1、B2和B3亚类金属β-内酰胺酶的序列比对 Figure 13 Sequence alignment of NDM-1 with B1, B2 and B3 metalloid β-lactamases. |
| 图选项 |
后来,虽然Brem等[39]对4种卡托普利立体异构体以及卡托普利衍生物1的D和L对映体,抑制NDM-1及其他MBLs (IMP-1,VIM-2和SPM-1)的研究证实了立体异构体对于提高针对MBLs的效能和选择性的重要性,但D-卡托普利仍然是最活跃的NDM-1立体异构体。但是,长期使用卡托普利的副作用较大[40],对肾脏负担较重,所以在临床用药上存在很大制约,将其在临床上作为抑制剂进行广泛使用也就无从谈起。因此,研究人员不得不继续寻找潜在的NDM-1抑制剂。
3.2 Bi(Ⅲ)化合物 Wang等[41]筛选出了第一个非常可能成为广谱抑制剂的Bi(Ⅲ)化合物,这是一种原本用于治疗由幽门螺旋杆菌导致的慢性胃炎的药物,名称为胶体次硝酸铋(CBS)[42]。该化合物在体外试验中恢复了美罗培南(MER)对NDM-1阳性大肠杆菌(NDM-HK)的杀菌活性。结果分析发现,这种化合物可以与不同类型的MBLs不可逆结合,从而起到抑制作用。
X射线证实了Bi(Ⅲ)与蛋白质的结合,且表明在晶格中存在Bi(Ⅲ)而不存在Zn(Ⅱ)。通过反常信号对结构进行精细化修饰,Bi(Ⅲ)取代2个Zn(Ⅱ)在活性位点的结合表现出2个可供选择的构象。一种是Bi(Ⅲ)位于2个Zn(Ⅱ)之间(图 14-A),稍微类似天然NDM-1结构的Zn1位点,这种主要构象的占有率为0.5。另一种则是除了与Zn1配位的残基(His120和His189)外,Cys208以及最初与Zn2结合的Asp124也参与和Bi(Ⅲ)配位,并与水分子形成了三角棱柱形几何结构(图 14-B)。这种次要构象中,Bi(Ⅲ)位于天然NDM-1结构的Zn2位点附近,且趋势较小(仅占0.1),Bi(Ⅲ)与His250、Cys208、Asp124和水分子形成扭曲的四面体几何形状。
 |
| 图 14 Bi(Ⅲ)化合物与NDM-1的复合物及其抑制机制 Figure 14 Compounds of Bi (Ⅲ) and NDM-1 and their inhibition mechanism. A: Superimposition of Bi-bound NDM-1 (cyan) with native Znbound NDM-1 (orange). Structural alignment was done over Cα residues using SSM algorithm in Coot and the images were generated using PyMOL. The two structures can be superimposed well with a rmsd value of 0.18 ?. B: The active site of Bi-bound NDM-1 with the anomalous density peak of Bi shown in purple mesh contoured at 15.0σ. C: The active site of native Zn-bound NDM-1 with two Zn(Ⅱ) ions shown as gray spheres and the bridging hydroxyl nucleophile as a red sphere. D: An overlay image comparing the relative position of Bi(Ⅲ) (purple sphere) with the two Zn(Ⅱ) ions (gray spheres). Bi(Ⅲ) is located in between the two Zn(Ⅱ) ions slightly closer to Zn1. |
| 图选项 |
对结构分析发现,Bi(Ⅲ)与氨基酸侧链的键长总体上比Zn(Ⅱ)长(图 14-D),这与Bi(Ⅲ)的较大离子半径一致[比Zn(Ⅱ)(0.74 ?)高1.03 ?]。晶体学数据结果与他们的生物物理特征相符,即1个Bi(Ⅲ)离子取代了2个Zn(Ⅱ),同时他们通过对晶体结构的分析认为Cys208对于Bi(Ⅲ)与NDM-1的结合至关重要。
在对幽门螺杆菌相关疾病的临床应用治疗中发现,铋类药物如CBS和RBC,即使在长期使用后也不会产生耐药性,且与抗生素的联合应用显著提高了耐药幽门螺杆菌的根除率[43-44]。这种独特的性质可能赋予Bi(Ⅲ)化合物处理细菌耐药性问题的能力。目前,欧洲数据显示,CBS在治疗消化性溃疡疾病的推荐剂量下,每日接受CBS治疗剂量约为480 mg当量的氧化铋(Bi2O3),最多可持续8周,无中毒记录,也没有与CBS相关的其他严重不良反应[44]。此外,由于大多数有机MBLs抑制剂是通过与MBLs的活性中心的Zn(Ⅱ)结合使酶失活,使得这种抑制剂存在一定临床风险,因此难以发展成为MBLs的广谱抑制剂。相比之下,Bi(Ⅲ)化合物通过以Bi(Ⅲ)离子取代Zn(Ⅱ)与活性部位半胱氨酸的临界残基结合使酶失活的独特抑制机制,与以往报道的基于有机分子的抑制剂全然不同。作为一种被批准的上市药物,这种广谱MBLs抑制剂与抗生素联合治疗,无疑将为MBLs阳性菌感染的治疗开辟了新的视野。
3.3 香豆素的商业类似物 Pemberton等[45]为了寻找对内酰胺酶具有广谱抗性的抑制剂,先对SBLs (KPC-2)进行抑制剂筛选并得到了结构,发现香豆素(coumarin)、紫杉叶素(二氢槲皮素,DHQ)和喹啉类似物(quinoline analogs)等几种杂芳基膦酸盐,其中香豆素的几种商业类似物具有很好的抑制效果。
这些类似物中,几乎所有的化合物都被证实具有针对KPC-2、NDM-1的抑制效果,但不同取代位点和不同取代基会造成抑制效果的明显差异。研究发现,NDM-1结构中揭示了一个十分有意思且出乎意料的现象,即NDM-1结合不同底物时有不同的姿态:一种指向远离V73的环羰基(形态1,化合物1,图 15-A),另一个朝向它(形态2,化合物6,图 15-B)。两种姿态相比较,形态2对于具有C5取代基的化合物更具亲和力,因为它允许与H122进行其他相互作用[例如,与化合物6中的-Me进行π-σ相互作用(距离3.67 ?),图 15-B]。NDM-1中靠近H122的小口袋类似于KPC-2中与W105相邻的缝,类似地容纳C5取代基。还要注意的是,NDM-1中F70的侧链显示出显著的构象迁移性,从而实现了与C7-Me 1形成有利的CH-π相互作用(图 15-A)。总体而言,NDM-1活性位点的相对开放性和M67-F70环的柔韧性适应不同的结合方向,具体取决于配体取代模式。此外,新的复合物结构揭示了几个疏水残基对配体结合的贡献,其中NDM-1中的特定残基F70,其构象的灵活性为小分子识别提供了重要的适应性。
 |
| 图 15 NDM-1和化合物1、化合物6的复合结构 Figure 15 Complex structure of NDM-1 with compound 1 & compound 6. A: NDM-1 and compound 1 (PDB No. 6d1a); B: NDM-1 and compound 6 (PDB No. 6d1d). |
| 图选项 |
此外,通过对先导化合物的优化及与β-内酰胺酶的结合研究[33, 46]可以得出结论,随着抑制剂疏水表面积的增加,抑制剂与活性口袋的结合会更紧密,KPC-2、NDM1和VIM-2的活性之间的相关性突显了配体结合特征的这种相似性。同时,抑制剂对NDM-1的抑制效力始终比KPC-2或VIM-2弱10倍以上,这表明,随着这些化合物朝着更高级的先导化合物优化,进一步了解和开发化合物结合/抑制机制是需要继续重点研究的。且由于这些酶识别的底物是相似的,因此杂芳基膦酸盐支架被设计成针对碳青霉烯酶广谱抑制剂是非常有前景的。
3.4 四唑类双活性化合物 四唑类双活性化合物(CN4H2)的广谱抑制性是Torelli等[47]发现的,四唑(tetrazoles)是一种杂环化合物(图 16-C),含有一个四氮的五元环,可以作为羧酸酯基的生物电子等排体,用作血管紧张素Ⅱ受体(Angiotensin type 2 receptor,AT2 receptor)的拮抗剂以治疗高血压、糖尿病肾病和充血性心力衰竭等疾病。他们利用β内酰胺类抗生素的水解底物、筛选出的6种四唑类化合物以及合成的其中两种小分子的外消旋体,通过X-ray晶体衍射手段解析了他们抑制CTX-M-14、KPC-2和NDM-1的机制。
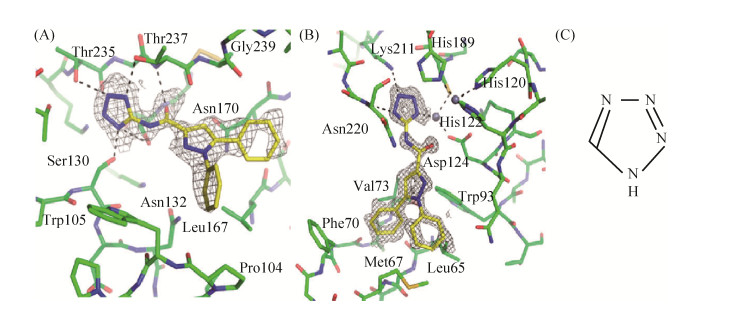 |
| 图 16 化合物7与KPC-2和NDM-1的复合晶体结构 Figure 16 Composite crystal structure of compound 7 with kpc-2 and NDM-1. A: KPC-2; B: NDM-1, black dotted line indicates hydrogen bond or coordination bond with metal ion; C: tetrazoles structure. |
| 图选项 |
他们比较了碳青霉烯酶KPC-2、NDM-1和非碳青霉烯酶CTX-M-14与配体的结合特性。值得注意的是,与CTX-M-14相比,KPC-2被β-内酰胺抗生素水解产物(产物抑制)以及从CTX-M-14的分子对接中选择的一系列新的四唑类抑制剂更为强烈地抑制。
结合复合物晶体结构来看,这些数据表明由于其疏水性的增强,KPC-2活性位点与底物和小分子配体形成良好相互作用的能力也增强了。这种性质在金属碳青霉烯酶中更为明显,例如NDM-1也被一些新的四唑化合物所抑制,包括一种对KPC-2和NDM-1都表现出类似的高亲和力的化合物(图 16)。
以上共同结果表明,抑制剂疏水表面的大小与疏水性的强弱对其本身与活性位点的结合十分重要。此外,碳青霉烯酶的活性通过广泛的β-内酰胺底物范围赋予生产者进化优势,但同时这也造成了碳青霉烯酶机制上的致命弱点。即这种特性可用于寻找和设计新型抑制剂。这些复合物结构,首次证明了非共价抑制剂是如何被设计来同时靶向抑制SBLs和MBLs。尽管目前化合物的活性相对较低,但这些研究仍然表明,通过寻找先导物,β-内酰胺抗生素水解产物作为碳青霉烯酶广谱抑制剂具有十分重要的参考价值。
4 结论 寻找到一种能够恢复现有β-内酰胺类抗生素对NDM-1表达菌株活性的广谱抑制剂,对人类健康、社会资源的持续使用及其经济效应的影响是十分重大的[48]。可惜的是,尽管多年来世界各地的研究人员都投入了巨大的努力,但新公开的NDM-1抑制剂还是没有达到临床使用阶段。困难主要在于,一是NDM-1水解机制的灵活多变;二是已发现抑制剂的特异性及毒性问题[49];三则是NDM-1越来越多的变体加重了耐药菌感染的威胁,使得实际上针对NDM-1相对开放的活性口袋进行分子设计与开发变得相当困难。鉴于NDM-1活性位点的特殊性及附近Loop区的灵活多变,在采用基于结构的药物设计方法时往往没有效果。同时,一些结构和研究表明,某些NDM变异体已经进化出具有高催化效率的单锌酶功能(例如NDM-15)[36]。这些发现揭示了NDM为克服β-内酰胺抗生素的选择性压力和锌缺乏时对酶活的影响,逐渐通过突变变异体来优化水解机制,给临床特效药的研发带来更多更频繁的困难。因此,针对NDM-1抑制剂缺乏的现状,除了利用荧光底物对天然产物、上市药物进行高通量筛选以寻找可能抑制剂的常规思路,其实在最近几年中,根据蛋白晶体结构,通过计算机辅助进行药物虚拟筛选的方法也成为越来越常用的手段,在研发速度及效率方面提供了很强的助力[50-51]。所以,当我们越多获得分辨率越高的NDM-1及复合物的晶体结构,越有利于我们找到NDM-1与底物结合机制的正确方向。这种研究手段上的进步对于其他许多面临药物缺乏困境的疾病也具有重要的意义。但是,从先导化合物的发现到新发药物的筛选体系的建立,到临床致病菌抑制效果的评价,再到临床实验的转化等许多问题还有待解决,只有新发药物从实验室到临床的路径越快被打通,才能真正尽早帮助到深受耐药菌感染威胁的人们。
所以,研究、解析NDM-1类金属β-内酰胺酶活性位点中现有抑制剂的3D结构及机制,加深对受体灵活结构与广谱水解能力的关系的理解,开发新的抑制剂,对解决现阶段面临的问题至关重要。同时,NDM所属的金属依赖型水解酶在结构上的高度保守性和活性口袋的灵活性,以及广泛的水解底物,为寻找NDM及其突变体的抑制剂提供了新的思路。最后值得注意的是,细菌耐药性的广泛产生源于抗生素的滥用,例如肺炎克雷伯菌对于NDM-1耐药菌检出率较高及持续增加的地区,临床应该给予更多的关注,抗生药物应用的管理及加强医院感染的防控手段应当更加严格。
References
| [1] | Kumarasamy KK, Toleman MA, Walsh TR, Bagaria J, Butt F, Balakrishnan R, Chaudhary U, Doumith M, Giske CG, Irfan S, Krishnan P, Kumar AV, Maharjan S, Mushtaq S, Noorie T, Paterson DL, Pearson A, Perry C, Pike R, Rao B, Ray U, Sarma JB, Sharma M, Sheridan E, Thirunarayan MA, Turton J, Upadhyay S, Warner M, Welfare W, Livermore DM, Woodford N. Emergence of a new antibiotic resistance mechanism in india, pakistan, and the UK: a molecular, biological, and epidemiological study. The Lancet Infectious Diseases, 2010, 10(9): 597-602. DOI:10.1016/S1473-3099(10)70143-2 |
| [2] | Dortet L, Poirel L, Nordmann P. Worldwide dissemination of the ndm-type carbapenemases in gram-negative bacteria. Biomed Research International, 2014, 2014: 249856. |
| [3] | Bahr G, Vitor-Horen L, Bethel CR, Bonomo RA, González LJ, Vila AJ. Clinical evolution of new delhi metallo-β-lactamase (NDM) optimizes resistance under Zn(Ⅱ) deprivation. Antimicrobial Agents and Chemotherapy, 2018, 62(1): e01849-17. |
| [4] | Yong D, Toleman MA, Giske CG, Cho HS, Sundman K, Lee K, Walsh TR. Characterization of a new metallo-β-lactamase Gene, blaNDM-1, and a novel erythromycin esterase gene carried on a unique genetic structure in Klebsiella pneumoniae sequence type 14 from india. Antimicrobial Agents and Chemotherapy, 2009, 53(12): 5046-5054. DOI:10.1128/AAC.00774-09 |
| [5] | Walsh TR, Weeks J, Livermore DM, Toleman MA. Dissemination of ndm-1 positive bacteria in the new delhi environment and its implications for human health: an environmental point prevalence study. The Lancet Infectious Diseases, 2011, 11(5): 355-362. |
| [6] | Pfeifer Y, Wilharm G, Zander E, Wichelhaus TA, G?ttig S, Hunfeld KP, Seifert H, Witte W, Higgins PG. Molecular characterization of blaNDM-1 in an Acinetobacter baumannii strain isolated in germany in 2007. Journal of Antimicrobial Chemotherapy, 2011, 66(9): 1998-2001. DOI:10.1093/jac/dkr256 |
| [7] | Cornaglia G, Giamarellou H, Rossolini GM. Metallo-β-lactamases: a last frontier for β-lactams?. The Lancet Infectious Diseases, 2011, 11(5): 381-393. |
| [8] | Rolain JM, Parola P, Cornaglia G. New delhi metallo-beta-lactamase (NDM-1): towards a new pandemia?. Clinical Microbiology and Infection, 2010, 16(12): 1699-1701. DOI:10.1111/j.1469-0691.2010.03385.x |
| [9] | Bebrone C. Metallo-β-lactamases (classification, activity, genetic organization, structure, zinc coordination) and their superfamily. Biochemical Pharmacology, 2007, 74(12): 1686-1701. DOI:10.1016/j.bcp.2007.05.021 |
| [10] | Guo Y, Wang J, Niu GJ, Shui WQ, Sun Y, Zhou HG, Zhang YZ, Yang C, Lou ZY, Rao ZH. A structural view of the antibiotic degradation enzyme NDM-1 from a superbug. Protein & Cell, 2011, 2(5): 384-394. |
| [11] | Jacquin O, Balbeur D, Damblon C, Marchot P, De Pauw E, Roberts GCK, Frère JM, Matagne A. Positively cooperative binding of zinc ions to Bacillus cereus 569/H/9 β-lactamase Ⅱ suggests that the binuclear enzyme is the only relevant form for catalysis. Journal of Molecular Biology, 2009, 392(5): 1278-1291. |
| [12] | Zhang HM, Hao Q. Crystal structure of NDM-1 reveals a common β-lactam hydrolysis mechanism. FASEB Journal, 2011, 25(8): 2574-2582. DOI:10.1096/fj.11-184036 |
| [13] | Matagne A, Frère J M. Contribution of mutant analysis to the understanding of enzyme catalysis: the case of class Aβ-lactamases. Biochimica et Biophysica Acta (BBA) - Protein Structure and Molecular Enzymology, 1995, 1246(2): 109-127. DOI:10.1016/0167-4838(94)00177-I |
| [14] | 王静.超级细菌新德里金属β-内酰胺酶NDM-1的结构与功能研究.南开大学硕士学位论文, 2012. |
| [15] | Walsh TR, Hall L, Assinder SJ, Nichols WW, Cartwright SJ, MacGowan AP, Bennett PM. Sequence analysis of the L1 metallo-β-lactamase from Xanthomonas maltophilia. Biochimica et Biophysica Acta (BBA) - Gene Structure and Expression, 1994, 1218(2): 199-201. DOI:10.1016/0167-4781(94)90011-6 |
| [16] | Malabanan MM, Amyes TL, Richard JP. A role for flexible loops in enzyme catalysis. Current Opinion in Structural Biology, 2010, 20(6): 702-710. DOI:10.1016/j.sbi.2010.09.005 |
| [17] | King D, Strynadka N. Crystal structure of new delhi metallo-β-lactamase reveals molecular basis for antibiotic resistance. Protein Science, 2011, 20(9): 1484-1491. DOI:10.1002/pro.697 |
| [18] | González LJ, Bahr G, Nakashige TG, Nolan EM, Bonomo RA, Vila AJ. Membrane anchoring stabilizes and favors secretion of new delhi metallo-β-lactamase. Nature Chemical Biology, 2016, 12(7): 516-522. DOI:10.1038/nchembio.2083 |
| [19] | Yuan QH, He L, Ke HM. A potential substrate binding conformation of β-lactams and insight into the broad spectrum of NDM-1 activity. Antimicrob Agents Chemother, 2012, 56(10): 5157-5163. DOI:10.1128/AAC.05896-11 |
| [20] | Wang ZG, Fast W, Valentine AM, Benkovic SJ. Metallo-β-lactamase: structure and mechanism. Current Opinion in Chemical Biology, 1999, 3(5): 614-622. DOI:10.1016/S1367-5931(99)00017-4 |
| [21] | Wommer S, Rival S, Heinz U, Galleni M, Frere JM, Franceschini N, Amicosante G, Rasmussen B, Bauer R, Adolph HW. Substrate-activated zinc binding of metallo-β-lactamases: physiological importance of the mononuclear enzymes. The Journal of Biological Chemistry, 2002, 277(27): 24142-24147. DOI:10.1074/jbc.M202467200 |
| [22] | Dal Peraro M, Vila AJ, Carloni P, Klein ML. Role of zinc content on the catalytic efficiency of B1 metallo β-lactamases. Journal of the American Chemical Society, 2007, 129(10): 2808-2816. DOI:10.1021/ja0657556 |
| [23] | Bounaga S, Laws AP, Galleni M, Page MI. The mechanism of catalysis and the inhibition of the bacillus cereus zinc-dependent β-lactamase. Biochemical Journal, 1998, 331(3): 703-711. DOI:10.1042/bj3310703 |
| [24] | Tioni MF, Llarrull LI, Poeylaut-Palena AA, Marti MA, Saggu M, Periyannan GR, Mata EG, Bennett B, Murgida DH, Vila AJ. Trapping and characterization of a reaction intermediate in carbapenem hydrolysis by B. cereus metallo-β-lactamase. Journal of the American Chemical Society, 2008, 130(47): 15852-15863. DOI:10.1021/ja801169j |
| [25] | Zhang HM, Ma GX, Zhu YF, Zeng LX, Ahmad A, Wang CZ, Pang B, Fang HY, Zhao LQ, Hao Q. Active-site conformational fluctuations promote the enzymatic activity of NDM-1. Antimicrobial Agents and Chemotherapy, 2018, 62(11): e01579-18. |
| [26] | Feng H, Liu XH, Wang S, Fleming J, Wang DC, Liu W. The mechanism of ndm-1-catalyzed carbapenem hydrolysis is distinct from that of penicillin or cephalosporin hydrolysis. Nature Communications, 2017, 8: 2242. DOI:10.1038/s41467-017-02339-w |
| [27] | Page MI, Badarau A. The mechanisms of catalysis by metallo β-lactamases. Bioinorganic Chemistry and Applications, 2008, 2008: 576297. |
| [28] | Thomas PW, Zheng M, Wu SS, Guo H, Liu DL, Xu DG, Fast W. Characterization of purified new delhi metallo-β- lactamase-1. Biochemistry, 2011, 50(46): 10102-10113. DOI:10.1021/bi201449r |
| [29] | Sun ZZ, Hu LY, Sankaran B, Prasad BVV, Palzkill T. Differential active site requirements for ndm-1 β-lactamase hydrolysis of carbapenem versus penicillin and cephalosporin antibiotics. Nature Communications, 2018, 9: 4524. DOI:10.1038/s41467-018-06839-1 |
| [30] | Khan AU, Maryam L, Zarrilli R. Structure, genetics and worldwide spread of new delhi metallo-β-lactamase (NDM): a threat to public health. BMC Microbiology, 2017, 17: 101. |
| [31] | Klingler FM, Wichelhaus TA, Frank D, Cuesta-Bernal J, El-Delik J, Muller HF, Sjuts H, Gottig S, Koenigs A, Pos KM, Pogoryelov D, Proschak E. Approved drugs containing thiols as inhibitors of metallo-β-lactamases: strategy to combat multidrug-resistant bacteria. Journal of Medicinal Chemistry, 2015, 58(8): 3626-3630. DOI:10.1021/jm501844d |
| [32] | Ejim L, Farha MA, Falconer SB, Wildenhain J, Coombes BK, Tyers M, Brown ED, Wright GD. Combinations of antibiotics and nonantibiotic drugs enhance antimicrobial efficacy. Nature Chemical Biology, 2011, 7(6): 348-350. |
| [33] | Bush K, Bradford PA. Interplay between β-lactamases and new β-lactamase inhibitors. Nature Reviews Microbiology, 2019, 17(5): 295-306. |
| [34] | Rotondo CM, Wright GD. Inhibitors of metallo-β-lactamases. Current Opinion in Microbiology, 2017, 39: 96-105. |
| [35] | Mitra S, Mukherjee S, Naha S, Chattopadhyay P, Dutta S, Basu S. Evaluation of co-transfer of plasmid-mediated fluoroquinolone resistance genes and blaNDM gene in enterobacteriaceae causing neonatal septicaemia. Antimicrobial Resistance & Infection Control, 2019, 8: 46. DOI:10.1186/s13756-019-0477-7/fulltext.html |
| [36] | Cheng ZS, Thomas PW, Ju LC, Bergstrom A, Mason K, Clayton D, Miller C, Bethel CR, VanPelt J, Tierney DL, Page RC, Bonomo RA, Fast W, Crowder MW. Evolution of new delhi metallo-β-lactamase (NDM) in the clinic: effects of NDM mutations on stability, zinc affinity, and mono-zinc activity. The Journal of Biological Chemistry, 2018, 293(32): 12606-12618. |
| [37] | Li NN, Xu YT, Xia Q, Bai CG, Wang TY, Wang L, He DD, Xie NN, Li LX, Wang J, Zhou HG, Xu F, Yang C, Zhang Q, Yin Z, Guo Y, Chen Y. Simplified captopril analogues as ndm-1 inhibitors. Bioorganic & Medicinal Chemistry Letters, 2014, 24(1): 386-389. |
| [38] | King DT, Worrall LJ, Gruninger R, Strynadka NCJ. New delhi metallo-β-lactamase: structural insights into β-lactam recognition and inhibition. Journal of the American Chemical Society, 2012, 134(28): 11362-11365. |
| [39] | Brem J, van Berkel SS, Zollman D, Lee SY, Gileadi O, McHugh PJ, Walsh TR, McDonough MA, Schofield CJ. Structural basis of metallo-β-lactamase inhibition by captopril stereoisomers. Antimicrobial Agents and Chemotherapy, 2016, 60(1): 142-150. |
| [40] | Hahn J, Nordmann-Kleiner M, B?nner C, Kojda G, Hoffmann TK, Greve J. The influence of ACE inhibition on C1-inhibitor: a biomarker for ACE inhibitor-induced angioedema?. Biomedicine Hub, 2019, 4(2): 1-9. |
| [41] | Wang RM, Lai TP, Gao P, Zhang HM, Ho PL, Woo PCY, Ma GX, Kao RYT, Li HY, Sun HZ. Bismuth antimicrobial drugs serve as broad-spectrum metallo-β-lactamase inhibitors. Nature Communications, 2018, 9: 439. |
| [42] | Gisbert JP. Helicobacter pylori eradication: a new, single-capsule bismuth-containing quadruple therapy. Nature Reviews Gastroenterology & Hepatology, 2011, 8(6): 307-309. |
| [43] | Barry NPE, Sadler PJ. Exploration of the medical periodic table: towards new targets. Chemical Communications, 2013, 49(45): 5106-5131. |
| [44] | Li HY, Sun HZ. Recent advances in bioinorganic chemistry of bismuth. Current Opinion in Chemical Biology, 2012, 16(1/2): 74-83. |
| [45] | Pemberton OA, Jaishankar P, Akhtar A, Adams JL, Shaw LN, Renslo AR, Chen Y. Heteroaryl phosphonates as noncovalent inhibitors of both serine- and metallocarbapenemases. Journal of Medicinal Chemistry, 2019, 62(18): 8480-8496. |
| [46] | Tehrani KHMET, Martin NI. β-lactam/β-lactamase inhibitor combinations: an update. MedChemComm, 2018, 9(9): 1439-1456. |
| [47] | Torelli NJ, Akhtar A, DeFrees K, Jaishankar P, Pemberton OA, Zhang XJ, Johnson C, Renslo AR, Chen Y. Active-site druggability of carbapenemases and broad-spectrum inhibitor discovery. ACS Infectious Diseases, 2019, 5(6): 1013-1021. |
| [48] | Palzkill T. Metallo-β-lactamase structure and function. Annals of the New york Academy of Sciences, 2013, 1277(1): 91-104. |
| [49] | Linciano P, Cendron L, Gianquinto E, Spyrakis F, Tondi D. Ten years with new delhi metallo-β-lactamase-1 (NDM-1): from structural insights to inhibitor design. ACS Infectious Diseases, 2019, 5(1): 9-34. |
| [50] | Spyrakis F, Celenza G, Marcoccia F, Santucci M, Cross S, Bellio P, Cendron L, Perilli M, Tondi D. Structure-based virtual screening for the discovery of novel inhibitors of new delhi metallo-β-lactamase-1. ACS Medicinal Chemistry Letters, 2018, 9(1): 45-50. |
| [51] | Erlanson DA, Fesik SW, Hubbard RE, Jahnke W, Jhoti H. Twenty years on: the impact of fragments on drug discovery. Nature Reviews Drug Discovery, 2016, 15(9): 605-619. |
