吕洁婷#, 孙静#, 郑光辉, 韩月, 成炯泽, 宋厚辉

 , 程昌勇
, 程昌勇

浙江农林大学动物科技学院·动物医学院, 浙江省畜禽绿色生态健康养殖应用技术研究重点实验室, 浙江 杭州 311300
收稿日期:2020-06-20;修回日期:2020-08-29;网络出版日期:2021-03-01
基金项目:国家自然科学基金(31872620, 31770040, 31972648);浙江省自然科学基金(LZ19C180001, LQ19C180002, LQ20C010001)浙江农林大学本科生科研训练项目(2020KX0160)
*通信作者:程昌勇, E-mail: lamge@zafu.edu.cn;
宋厚辉, E-mail: songhh@zafu.edu.cn.
#共同第一作者。
摘要:[目的] 本文旨在构建单核细胞增多性李斯特菌谷胱甘肽还原酶(glutathione reductase,GR)基因lmo1433(gr)缺失株,并研究GR在细菌生长和运动过程中发挥的作用及与谷氧还蛋白(glutaredoxin,Grx)系统间的调控关系,探究GR参与细菌抗氧化应激和致病力的生物学功能,为阐明氧化还原蛋白介导细菌环境适应和宿主内感染的机制奠定分子基础。[方法] 利用细菌遗传操作系统构建获得gr缺失株及回补株后,通过分子生物学和感染生物学手段,比较野生株和突变株的运动性、生长能力、抗氧化应激、细胞黏附、侵袭和增殖能力;利用整合型质粒构建带GR启动子的荧光报告系统,并结合荧光定量分析GR受Grx调控的情况。[结果] 缺失gr后李斯特菌在体外培养基中的生长能力未受明显影响,但在半固体培养基中的运动能力却显著增强;缺失gr后细菌在铜离子、镉离子以及肼中抗氧化应激能力增强,在H2O2中无差异;缺失gr后细胞黏附、侵袭和增殖能力均显著增强;荧光报告系统定量分析发现grx缺失后gr的启动子活性显著增强,表明Grx参与对GR的转录负调控。[结论] 本研究首次证实了单增李斯特菌谷胱甘肽还原酶GR能调控细菌的运动能力,并且缺失GR增强了李斯特菌的抗氧化应激和感染宿主能力;首次证实了GR的自身转录受Grx负调控,但具体分子机制有待于深入探究。本研究有助于深入理解单增李斯特菌氧化还原蛋白的调控关系以及通过参与诸多生物学过程介导细菌体外环境适应及宿主内感染的分子机制,为防控胞内菌感染提供了新策略。
关键词:单核细胞增多性李斯特菌谷胱甘肽还原酶运动性氧化应激耐受细菌感染
Characterization of the glutathione reductase from Listeria monocytogenes
Jieting Lv#, Jing Sun#, Guanghui Zheng, Yue Han, Jiongze Cheng, Houhui Song

 , Changyong Cheng
, Changyong Cheng

Key Laboratory of Applied Technology on Green-Eco-Healthy Animal Husbandry of Zhejiang Province, College of Animal Science and Technology & College of Veterinary Medicine, Zhejiang A & F University, Hangzhou 311300, Zhejiang Province, China
Received: 20 June 2020; Revised: 29 August 2020; Published online: 1 March 2021
*Corresponding author: Changyong Cheng, lamge@zafu.edu.cn;
Houhui Song, songhh@zafu.edu.cn.
Foundation item: Supported by the National Natural Science Foundation of China (31872620, 31770040, 31972648), by the Natural Science Foundation of Zhejiang Province (LZ19C180001, LQ19C180002, LQ20C010001) and by the Scientific Research Training Program for Undergraduate of Zhejiang A & F University (2020KX0160)
#These authors contributed equally to this work.
Abstract: [Objective] The important foodborne bacterial pathogen Listeria monocytogenes uses the glutaredoxin (Grx) system to defend the oxidative stress during environmental adaption. Here, we explore biological characteristics of the glutathione reductase (GR) during bacterial infection. [Methods] We constructed the gr deletion and complementation strains to compare the abilities in bacterial growth, motility, oxidative tolerance and cellular infection. Besides, the gr promoter-based fluorescent report system (FRS) was genetically obtained to further study regulation of gr by Grx. [Results] Our data show that deletion of gr did not affect bacterial growth but enhanced the capability of swarming. Additionally, lack of gr significantly increased oxidative tolerance of bacteria under Cu2+ and Cd2+ stress, as well as increased efficiencies of intracellular infection in Caco-2 and RAW264.7 cells. Importantly, transcription of gr was negatively regulated by Grx. [Conclusion] The glutathione reductase plays a critical role in bacterial flagella-based swarming motility and correlates a regulatory relationship with the Grx system. Also, GR plays a non-classical role in bacterial oxidative resistance and intracellular infection. This study will expand our understanding of the redox regulatory mechanisms exploited by intracellular bacteria during adaption outside the environment and inside the host, which provides novel strategies to prevent and control the foodborne diseases.
Keywords: Listeria monocytogenesglutathione reductaseswarming motilityoxidative tolerancebacterial infection
单核细胞增多性李斯特菌(Listeria monocytogenes,简称单增李斯特菌)是一种人兽共患革兰氏阳性胞内菌[1]。它能适应高盐、极寒、酸性等应激环境,易感者为孕妇、老人、免疫力低下等人群[2]。李斯特菌主要在加工、储存、运输过程中污染肉、蛋、奶等产品。人感染李斯特菌后轻则腹泻、呕吐,重则流产、脑膜炎甚至致死。1964年至2010年间,中国28个省份分别报告了147例临床病例,479例李斯特菌分离株和82例与暴发相关的病例,而2011年至2017年中国报告了562名李斯特菌病患者,表明过去十年中患者人数急剧增加[3]。2018年有报道称在中国因食品中污染单增李斯特菌的平均患病率约为4.4%,其中侵袭性李斯特菌病的致死率大于25%[4]。在各种食品中,肉类和家禽产品的李斯特菌感染率最高,约为8.9%。因为目前中国是世界上最大的肉类生产国和肉类消费国,所以深入研究李斯特菌对于保障食品安全及控制食源性疾病具有重大意义[5-6]。
单增李斯特菌内存在一种由lmo1433基因编码的谷胱甘肽还原酶(glutathione reductase,GR)。GR属于谷氧还蛋白(Grx)系统成员,该系统由烟酰胺腺嘌呤二核苷酸磷酸(NADPH)、GR、谷胱甘肽(GSH)和Grx组成[7-8]。单增李斯特菌通过细胞内的Trx和Grx这两套氧化还原稳态系统来应对宿主释放的超氧化物并修复被破坏的二硫键[9]。Trx的主要功能是还原蛋白二硫键[10-11],Grx在结构和功能上与Trx相似,除二硫化物-二硫醇交换机制外,Grx还可通过一硫醇机制催化底物的还原。Grx可通过可逆性谷胱甘肽酰化来调节许多蛋白质的活性,例如Ras、Fas、ASK1、NF-κB和procaspase-3,这些蛋白在控制细胞凋亡中都起到重要作用。Grx系统和Trx系统具有多种生物学活性,包括DNA合成的调控、抗氧化应激的防御、细胞周期和细胞凋亡的介导[12],抑制Trx系统或使GSH耗竭,均可引起ROS升高,诱导细胞死亡[13]。GR能在NADPH作为唯一还原力和电子供体时,将氧化性谷胱甘肽(G-S-S-G)转化为还原性谷胱甘肽(G-SH),从而保持G-SH/G-S-S-G比例的平衡,起到维持细胞内G-SH含量的作用[14-15];GR通过催化谷胱甘肽还原,降低细胞内ROS水平来抵抗细胞内的氧化应激[16-20]。细菌通过一系列毒力因子感染细胞,我们猜测,GR可能调控了细菌毒力因子而使细菌更不易被宿主感知并清除。本实验室先前通过转录组测序发现,缺失Grx后GR转录水平显著上调,并且缺失Grx能增强抗氧化应激和感染细胞能力[21]。本研究为探究谷氧还蛋白系统应激作用机制奠定了基础,并为深入阐明李斯特菌Grx系统通过氧化还原作用介导细菌体外环境适应及宿主内感染的分子机制奠定了重要基础。
另外,本研究首次发现,缺失GR影响了李斯特菌的运动性。细菌运动性与鞭毛合成有关,李斯特菌在37 ℃以上环境中不合成鞭毛,而在30 ℃以下环境下才合成鞭毛[22-23]。李斯特菌鞭毛合成的主要受调控因子MogR和GmaR的控制[24-25]。MogR能够结合并占据鞭毛基因的启动子区使转录因子无法结合于此,从而导致鞭毛基因转录受到遏制[26]。GmaR是一种糖基转移酶,在30 ℃下能与MogR形成稳定的复合物从而阻止MogR对鞭毛基因的遏制,促进鞭毛合成;而在37 ℃环境下GmaR不稳定易被降解从而无法阻止MogR对鞭毛转录的抑制[27-28]。GmaR转录又受到DegU调控[29],DegU为双组分应答调节剂,具有受体域[30],该受体域可以不依赖磷酸化状态的方式来激活鞭毛运动性的表达[31]。FlhB、FliM和FliY是鞭毛分泌系统(T3SS)成分蛋白,也参与调节鞭毛相关基因的转录,进而影响鞭毛合成和细菌运动[32]。此外,本实验室前期研究发现,李斯特菌的另一重要氧化还原家族蛋白TrxA可以通过氧化还原修饰与MogR相互作用,使MogR分子内和分子间二硫键能正确折叠并维持其功能和活性,进而参与鞭毛基因的转录调控及鞭毛的合成。本文首次发现,李斯特菌GR同样参与调控李斯特菌的鞭毛合成及运动性,完善了李斯特菌借助氧化还原酶系统参与细菌鞭毛合成和运动的相关系统研究,但GR与鞭毛合成调控涉及的具体分子机制是否类似于TrxA或者还存在其他的未知机制仍有待深入研究。
1 材料和方法 1.1 材料
1.1.1 菌株、质粒及引物: 本研究用到的菌株及质粒均为本实验室保存,主要包括:单增李斯特菌EGD-e、大肠杆菌DH5α和BL21、温度敏感性载体pKSV7、整合型穿梭载体pIMK2及游离复制型载体pAM401。BHI培养基(brain heart infusion,BHI)用于李斯特菌培养,LB培养基用于大肠杆菌培养,除特殊说明外,菌培养条件均为37 ℃振荡培养。试验涉及引物见表 1。
表 1. 本研究所用引物 Table 1. Primers used in this study. The restriction enzyme sites are underlined
| Primers | Sequences (5'→3') | Products/bp |
| pSL2501-a-front | CACCATCTCTTGAAACAATGATGGCG | |
| pSL2501-Fwd-a | CCGGAATTCCGAAATTTTAGAATATAAAAATGATAAAATGACGGCCG | 527 |
| pSL2501-b | TTCACTAAGAAAATGAGCCTAAATCACTCCTTCTTAGCTTGTTTTCCC | |
| pSL2501-c | ATTTAGGCTCATTTTCTTAGTGAAGAAGCAGATTATATGATAAATTACA | 526 |
| pSL2501-Rev-d | AAACTGCAGCGACCGTCACAGTAGTGATTTTTTTCT | |
| pSL2856-Fwd | GGCGAGCTCCGGCTTTGAATGGGCGAAATTAAAAC | 1555 |
| pSL2856-Rev | CGGGGTACCCTAGTTCAAAGCAGTTAAGTCACTTGCT | |
| pSL2506-a | CGCGGATCCCGGCTTTGAATGGGCGAAATTAAAAC | 219 |
| pSL2506-b | GTTCTTCTCCTTTACTCATCTAAATCACTCCTTCT | |
| pSL2506-c | CTAAGAAGGAGTGATTTAGATGAGTAAAGGAGAAGAAC | 736 |
| pSL2506-d | ACGCGTCGACTTATTTGTATAGTTCATCCATGCCATGTGTAATCC | |
| pKSV7-M13-Fwd | GCGATTAAGTTGGGTAACGCC | 1113 |
| pKSV7-M13-Rev | GCGGATAACAATTTCACACAGGA |
表选项
1.1.2 试剂: BHI和LB培养基分别购于Oxoid公司、生工生物工程(上海)股份有限公司;胎牛血清(fetal bovine serum,FBS)、DMEM培养基(Dulbecco’s Modified Eagle Medium,DMEM)和胰酶(0.25% Trypsin-EDTA)购自Thermo Fisher Scientific;KOD plus Neo PCR酶、限制性核酸内切酶、BCA蛋白浓度测定试剂盒、PCR产物纯化回收试剂盒以及质粒提取试剂盒分别购自Toyobo、NEB、碧云天公司、上海慧凌生物科技有限公司、天根生化科技有限公司。本研究所用化学试剂均为国产分析纯。
1.2 Δgr重组缺失质粒构建 从NCBI数据库下载gr基因序列(基因序列号:985502)及其上下游基因序列,通过Snapgene软件在gr基因上下游各约500 bp处设计引物(pSL2501-Fwd-a/pSL2501-b和pSL2501-c/pSL2501- Rev-d)扩增同源臂序列。利用重叠PCR方法将上下游同源臂扩增连接获得用于同源重组的重组片段,克隆至pKSV7载体中,获得重组质粒pSL2501,并经测序正确后转化至DH5α中(图 1)。
 |
| 图 1 gr缺失株重组质粒的构建策略 Figure 1 Construction strategy of the recombinant plasmid pSL2501 for gr gene deletion. |
| 图选项 |
1.3 Δgr缺失株筛选和验证 将上述重组质粒pSL2501电转入EGD-e感受态中,通过温度和氯霉素抗性双重选择压力进行同源重组克隆筛选,利用引物(pSL2501-a-front/ pSL2501-Rev-d)对筛选出的重组克隆进行PCR验证,最终经测序验证,所缺失的基因序列与预期设计相符后得到Δgr缺失株。
1.4 CΔgr重组质粒的构建 从Biocyc、Promoter3.0网站分别查询到gr为单转录本且得到gr启动子后,通过Snapgene在gr基因上游启动子区及下游设计引物(pSL2856-Fwd/pSL2856-Rev)并扩增序列,克隆至pIMK2载体,获得重组质粒pSL2856,并经测序正确后转化至大肠杆菌DH5α中(图 2)。
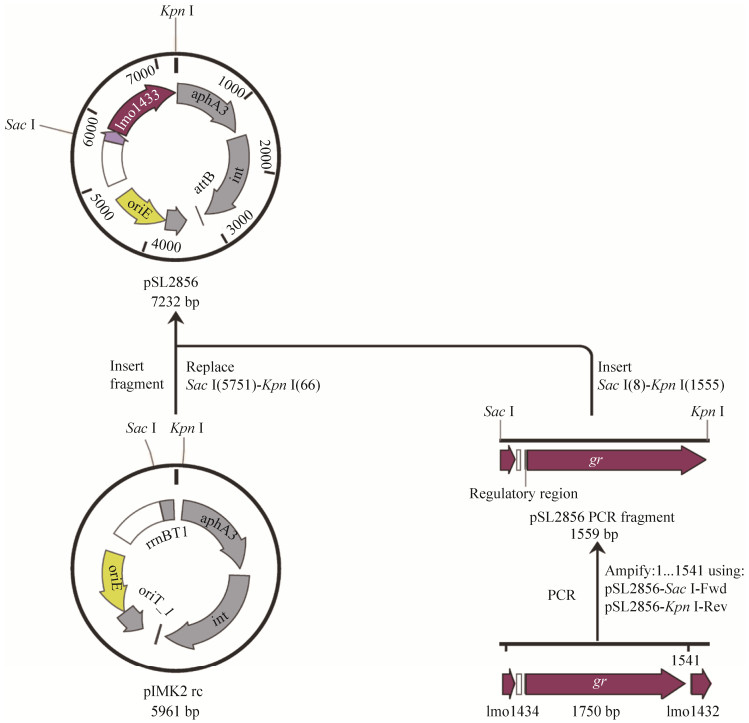 |
| 图 2 gr回补株重组质粒的构建策略 Figure 2 Construction strategy of the recombinant plasmid pSL2856 for gr gene complementation. |
| 图选项 |
1.5 Δgr感受态的制备 Δgr过夜培养后,1:100转接至100 mL (终浓度为0.5 mol/L蔗糖及BHI)新鲜培养基中,培养至OD600约为0.2后加入青霉素G (终浓度为20 μg/mL),37 ℃振荡培养2 h后,4 ℃离心(转速为3750 r/min) 10 min后用预冷的1 mmol/L 4-羟乙基哌嗪乙磺酸缓冲液洗3次后,最后用缓冲液(含1 mmol/L 4-羟乙基哌嗪乙磺酸及0.5 mol/L蔗糖)重悬,–80 ℃保CΔgr回补株构建:将2 μg pSL2856质粒电转至Δgr感受态中,电转参数设置为25 μF、200 Ω及2500 V,37 ℃静置培养,通过挑取单菌落进行PCR验证获得阳性克隆后,最终经测序验证基因序列与预期设计相符后得到CΔgr回补株。
1.6 荧光素酶报告基因(GFP) 质粒构建 通过Snapgene软件在gr基因上游启动子区及pFL251质粒分别设计引物(pSL2506-a/pSL2506-b和pSL2506-c/pSL2506-d)扩增序列,利用重叠PCR方法将gr启动子和GFP连接获得用于同源重组片段,插入游离型载体pAM401载体,获得重组质粒pSL2506,并经测序正确后转化至大肠杆菌DH5α (图 3)。再将pSL2506电转入EGD-e和缺失株Δgrx,即得携带GFP报告基因的菌株。
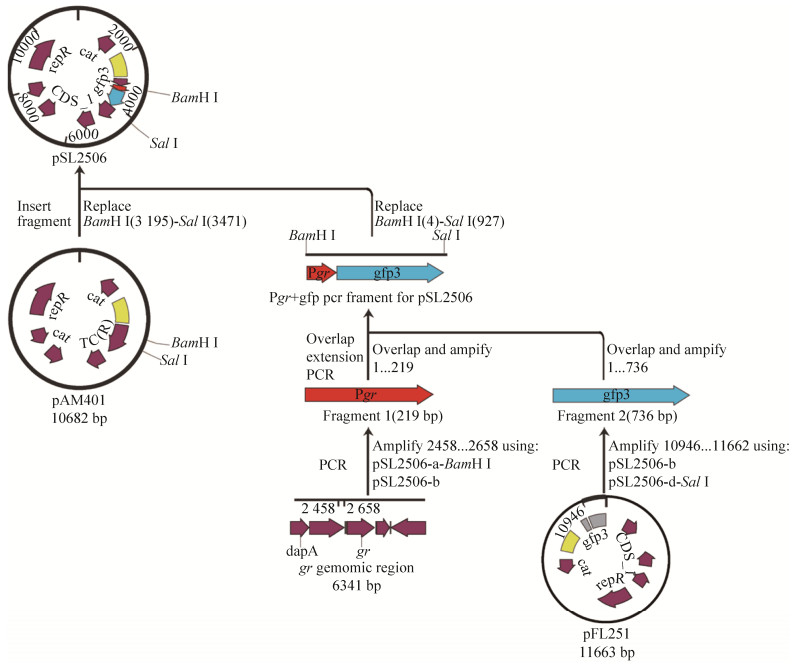 |
| 图 3 Grx调控gr基因的荧光素酶报告基因构建策略 Figure 3 The strategy of the fluorescent reporter system for studying the regulation of gr by Grx. |
| 图选项 |
1.7 荧光的定性与定量检测 将上述携带GFP报告基因的两个菌株培养过夜,调OD600至0.6后,取等量菌液滴于载玻片固定并用荧光显微镜测荧光强度。取等量菌液加入96孔板中并用酶标仪测量荧光强度(条件为Em/Ex=535/485 nm),未含GFP报告基因的EGD-e和Δgrx的荧光强度作为阴性对照,数据采用GraphPad Prism软件分析作图。
1.8 生长曲线的测定 将EGD-e、Δgr和CΔgr振荡培养过夜,调OD600至0.6,起始菌液稀释100倍后,加入96孔板中于30 ℃或37 ℃静置培养,每隔1 h测定OD600,连续测定12 h并绘制生长曲线。
1.9 运动性试验 将EGD-e、Δgr和CΔgr 37 ℃振荡培养过夜,调OD600至0.6,取灭菌牙签蘸取少量菌液,穿刺接种于TSA半固体培养基(0.25%琼脂、2%氯化钠及1.5%胰蛋白胨)中,分别于30 ℃和37 ℃静置培养,12、24、36、48 h后观察细菌运动圈。
1.10 氧化应激试验 将EGD-e、Δgr和CΔgr 37 ℃振荡培养过夜,调OD600至0.6,记为10–0,用磷酸盐缓冲液稀释至10–6,并依次点于含有氧化剂的BHI固体培养基上,37 ℃静置培养过夜后观察并拍照。氧化应激以H2O2为直接氧化剂,肼(Diamide)为硫醇特异性氧化剂,铜(Copper chloride,Cu)、镉(Cadmium chloride,Cd)等二价金属离子为氧化活性胁迫性氧化剂。H2O2、Diamide、Cd2+、Cu2+浓度分别为5.00、1.50、0.75和0.50 mmol/L。
1.11 人肠上皮细胞(Caco-2) 粘附和侵袭试验及鼠巨噬细胞(RAW264.7) 增殖试验 将EGD-e、Δgr和CΔgr 37 ℃振荡培养过夜,Caco-2和RAW264.7细胞铺板密度均为106,细菌和细胞比例(MOI)分别为10:1和1:5。将EGD-e、Δgr和CΔgr按MOI加入24孔培养板后放置于细胞培养箱,0.5 h后拿出培养板用10 mmol/L磷酸盐缓冲液洗3遍,并用400 μL冰水及100 μL胰酶吹打裂解,稀释到合适梯度涂布至BHI培养基中。Caco-2细胞的另一个24孔培养板在EGD-e、Δgr和CΔgr加入1.5 h后用10 mmol/L磷酸盐缓冲液洗3次,用50 μg/mL庆大霉素杀菌1.5 h后(同0.5 h裂解操作),稀释到合适梯度涂布至BHI培养基中;RAW264.7细胞另3个24孔培养板在EGD-e、Δgr和CΔgr加入1 h后用10 mmol/L磷酸盐缓冲液洗3次,用50 μg/mL庆大霉素杀菌1 h后,记为2 h,在2 h、5 h和8 h后(同0.5 h裂解操作)稀释到合适梯度涂布至BHI培养基中,在37 ℃培养过夜后进行菌落计数,用Graphpad软件进行作图并分析差异性。
2 结果和分析 2.1 Δgr及CΔgr重组菌的验证 根据Δgr重组质粒(图 1,方法同1.3)构建方法,引物如表 1,Δgr上游同源臂条带为524 bp (图 4-A,列1),下游同源臂为523 bp (图 4-A,列2)。重叠PCR得1012 bp目的片段(图 4-A, 列3)。用引物(pSL2501-a/pSL2501-d)扩增电转入EGD-e感受态的pSL2501菌落得到1012 bp的阳性克隆(图 4-B,列1)。42 ℃同源重组后,用引物(pSL2501-a- front/pSL2501-d)扩增菌落得到1212 bp阳性克隆(图 4-B,列2)。在30 ℃传代丢失pKSV7质粒后,用引物(pKSV7-M13-Fwd/pKSV7-M13-Rev)验证菌落无条带(图 4-B,列3),说明质粒已丢失。
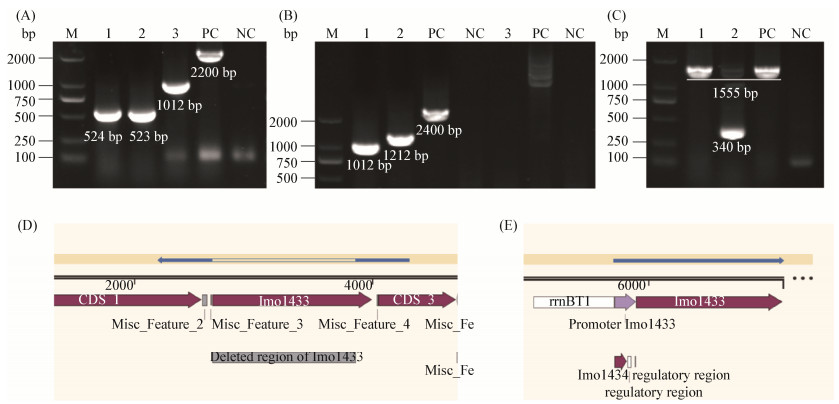 |
| 图 4 缺失株构建重组质粒(A)、缺失株Δgr(B)及回补株CΔgr(C)的PCR验证及测序结果(D–E) Figure 4 Confirmation of gr deletion plasmid (A), and the deletion (B) and complementation (C) strains by PCR and sequencing analysis (D–E). A: lane 1–3: PCR fragments of homologous arms from EGD-e; B: lane 1–3: PCR screening for the gr deletion colonies; C: 1: PCR fragment from pSL2856; 2: electroporation of pSL2856. M: DL2000 DNA marker; PC: positive control; NC: negative control. |
| 图选项 |
根据CΔgr重组质粒(图 2,方法同1.4)构建方法,用引物(pSL2856-Fwd-Sac I/pSL2856-Rev-Kpn I)扩增菌落,得到CΔgr重组质粒目的片段1555 bp (图 4-C,列1)。用引物(pSL2856-Fwd-Sac I/pSL2856- Rev-Kpn I)扩增电转入Δgr感受态的pSL2856单菌落,得到阳性条带1555 bp (图 4-C,列2),因为电转后的模板中含框内敲除的Δgr,所以用引物(pSL2856-Fwd-Sac I/pSL2856-Rev-Kpn I)扩增还可得启动子区与gr下游片段共340 bp (图 4-C,列2)。经测序验证Δgr (图 4-D)、CΔgr (图 4-E)所构基因序列与预期设计相符后得到Δgr缺失株和CΔgr回补株。
2.2 GR生长曲线测定 图 5为EGD-e、Δgr、CΔgr在30 ℃ (图 5-A)及37 ℃ (图 5-B)培养时的生长曲线。结果显示,突变株与EGD-e生长曲线无明显差异,说明GR并不影响李斯特菌的正常生长。
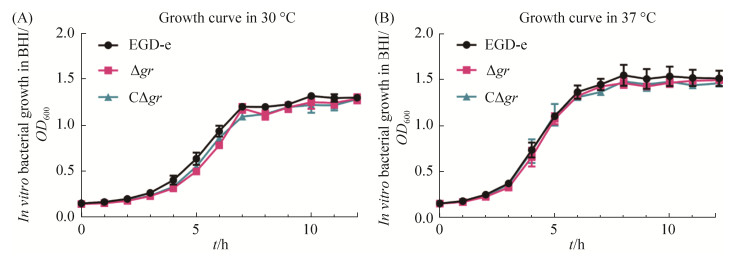 |
| 图 5 EGD-e、Δgr和CΔgr在30 ℃(A)及37 ℃(B)环境中的生长曲线测定 Figure 5 In vitro growth of the wild-type EGD-e, Δgr, and CΔgr in BHI broth at 30 ℃ (A) or 37 ℃ (B). Data are expressed as means±SE of three independent experiments. |
| 图选项 |
2.3 GR运动性试验分析 在30 ℃条件下的各时间段,Δgr与EGD-e和CΔgr相比运动圈均明显增大(图 6-A),在37 ℃时EGD-e、Δgr和CΔgr均无明显运动圈(图 6-B),李斯特菌在30 ℃以上会失去鞭毛。利用GraphPad Prism软件分析30 ℃各时间段Δgr与EGD-e和CΔgr (图 6-C)以及37 ℃ (图 6-D)运动圈直径可得,在30 ℃下,Δgr的运动圈直径显著大于EGD-e和CΔgr,说明李斯特菌缺失GR后鞭毛运动性增强,推测缺失GR可能影响了鞭毛基因的转录水平并且在李斯特菌鞭毛系统中起到负调控的作用。
 |
| 图 6 EGD-e、Δgr和CΔgr在30 ℃(A和C)及37 ℃(B和D)环境中的运动能力分析 Figure 6 Motility assay of the wild-type EGD-e, Δgr, and CΔgr at 30 ℃ (A) or 37 ℃ (B). A, B: swarming assay; C, D: quantification of swarming size. ***: P < 0.001; **: P < 0.01;*: P < 0.05. |
| 图选项 |
2.4 绿色荧光蛋白(GFP) 荧光释放量定性及定量验证 本研究构建了含有gr启动子区的荧光报告子(图 3,方法同1.6),通过荧光释放强度判断gr转录水平。定性结果显示,在荧光显微镜下,含gr启动子的荧光报告质粒的Δgrx与含gr启动子的荧光报告质粒的EGD-e相比,荧光显著增强(图 7-A)。荧光定量检测显示Δgrx荧光检测数值显著高于EGD-e (图 7-B,P < 0.01)。定性与定量检测结果一致,证实了grx缺失导致单增李斯特菌gr基因转录水平上调,也证明了grx与gr启动子之间存在调控关系,为进一步探究相关机制奠定基础。
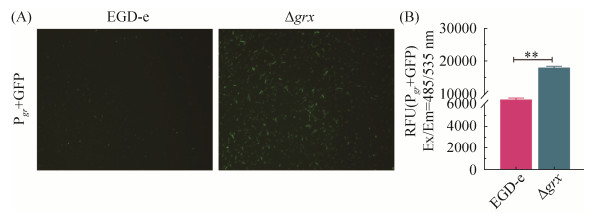 |
| 图 7 gr荧光报告系统在EGD-e和缺失株Δgrx中的荧光强度(A)及基于酶标仪的定量分析(B) Figure 7 Fluorescence analyzed by microscopy (A) and quantified by ELISA (B) of the gr promoter-based fluorescent reporter in EGD-e and Δgrx mutant. **: P < 0.01. |
| 图选项 |
2.5 GR抗氧化应激能力分析 已知谷氧还蛋白Grx具有抗氧化应激能力,为进一步探究受Grx调控的GR是否也具有抗氧化应激能力,我们采用氧化应激试验,检测三种菌株在不同氧化应激条件下(H2O2、Cu2+、Cd2+和Diamide)的生长能力,结果显示,在5 mmol/L H2O2培养条件下,三种菌株的生长状况无差异(图 8-A),在含0.5 mmol/L的Cu2+、0.75 mmol/L的Cd2+和1.5 mmol/L及以上浓度的Diamide培养条件下,Δgr生长能力相较于EGD-e和CΔgr均显著增强(图 8-B,8-C,8-D)。以上结果表明,GR对金属离子氧化剂Cu2+、Cd2+和巯基特异性氧化剂Diamide均敏感,GR缺失后抗氧化能力显著增强,这一结果与已知Grx系统抗氧化的结论[9]相反,2.4试验结果表明,GR受Grx负调控,而缺失Grx已被证实可以增加氧化应激的耐受性[21],我们猜测李斯特菌能通过缺失GR而代偿性地上调某些与氧化耐受性相关的氧化酶来增加其自身对于氧化耐受性的能力,而GR能够负调控细菌氧化应激的耐受性。
 |
| 图 8 EGD-e、Δgr和CΔgr在H2O2 (A)、Cu2+ (B)、Cd2+ (C)和Diamide (D)氧化应激条件下稀释点板 Figure 8 Oxidative tolerance of wild-type EGD-e and gr mutants exposed to different concentrations of H2O2 (A), Cu2+ (B), Cd2+ (C) or Diamide (D). |
| 图选项 |
2.6 上皮细胞Caco-2黏附和侵袭试验及巨噬细胞RAW264.7增殖试验分析 单增李斯特菌在进入消化道后,首先入侵肠道上皮细胞,上述试验结果表明,GR缺失后细菌抗氧化能力显著增强,为进一步探究GR对于细菌感染细胞生物学所起到的功能,我们首先检测了3种菌株在Caco-2中的黏附、侵袭能力。试验结果显示在Caco-2细胞中,Δgr的黏附率(图 9-A)及侵袭率(图 9-B)均显著多于EGD-e和CΔgr (P < 0.05)。细菌入侵巨噬细胞后,细胞会立即释放大量ROS抵御细菌入侵,可见细菌的抗氧化能力对于是否能成功感染宿主细胞极其重要[33]。为进一步探究GR在细胞增殖中所发挥的作用,我们检测了3种菌株在RAW264.7中的增殖能力,试验结果显示,在RAW264.7细胞内增殖0.5 h、2 h、5 h和8 h后,Δgr的增殖率均显著多于EGD-e和CΔgr (图 9-C),细胞试验结果与氧化应激结果一致。上述结果证明,GR能介导细菌毒力因子调控,从而影响细菌细胞感染的能力。
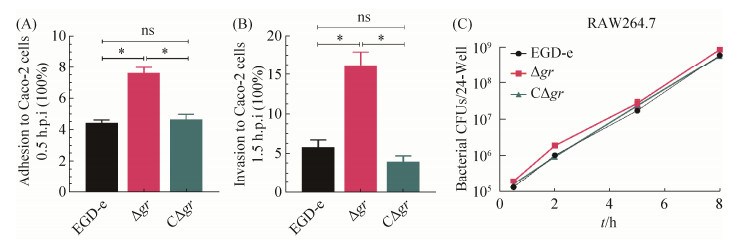 |
| 图 9 EGD-e、Δgr和CΔgr在Caco-2的黏附率(A)和侵袭率(B)及RAW264.7增殖(C)分析 Figure 9 Analysis of adhesion (A) and invasion (B) in Caco-2 and infection of wild-type EGD-e and gr mutants in RAW264.7 macrophages (C). |
| 图选项 |
3 讨论 本研究构建了gr基因的缺失株、回补株及荧光素酶报告基因,并通过分子生物学、应激生物学、细胞生物学等手段,比较单核细胞增多性李斯特菌和突变株间的运动性、体外生长能力、抗氧化应激能力、细胞黏附、侵袭、增殖能力及生物学特性,结果显示,缺失GR后细菌的运动性、抗氧化应激、细胞感染能力均能显著增强,本研究为下一步深入研究鞭毛调控系统、谷氧还蛋白系统应激作用机制等奠定了扎实的基础。
本文证实了缺失GR不影响李斯特菌生长速率,但在30 ℃时能使细菌的运动性增强这一现象,我们推测GR影响了鞭毛相关基因表达水平。细菌运动性受到温度以及鞭毛这两部分的控制,单增李斯特菌在37 ℃以上温度不形成鞭毛,而在30 ℃以下温度形成鞭毛[23]。degU基因能结合gmaR的启动子fliN-gmaR使下游基因转录,gmaR能与mogR结合,mogR在高温时通过结合鞭毛基因的启动子区可使鞭毛基因转录受到遏制。有报道称,TrxA与鞭毛关键蛋白MogR之间存在互作,参与鞭毛合成[12]。谷胱甘肽合成酶负责铜绿假单胞菌中GSH的生物合成,缺失谷胱甘肽合成酶后影响铜绿假单胞菌鞭毛的形成[34]。谷胱甘肽合成酶和GR均与谷胱甘肽有关,但从目前来看两者的调控方式以及发挥的功能均不同。GR是谷氧还蛋白系统(Grx)中重要的一部分,和谷氧还蛋白一同参与细菌的氧化还原修饰,并且能将氧化型的谷胱甘肽还原为还原性的谷胱甘肽。而谷胱甘肽合成酶(GshF)不属于谷氧还蛋白系统,主要参与细菌中谷胱甘肽的合成,并且GshF会受到谷胱甘肽的反馈抑制。因而,可以简单概括为:GshF主要参与细菌中GSH的来源,而GR以及Grx属于GSH发挥功能的“载体”。基于我们的研究初步证实,GR和GshF调控李斯特菌鞭毛合成的作用方式完全相反。缺失GshF鞭毛运动性降低,而本文缺失GR能使鞭毛运动性增强,两者对于细菌运动性的贡献完全相反。缺失gshF后,鞭毛合成促进基因gmaR以及鞭毛丝蛋白基因flaA的转录水平显著降低;鞭毛抑制基因mogR以及鞭毛分泌系统蛋白基因fliI、fliP、fliQ等转录水平却上调,从而综合引起鞭毛合成受阻,运动能力下降。相反,缺失GR导致运动能力增强,且鞭毛基因转录水平升高,我们推测GR可能也通过抑制DegU及GmaR的转录从而增强MogR对鞭毛合成抑制,也可能通过调节Grx系统相关基因来控制鞭毛运动性,比如GR催化GSH还原为鞭毛基因的氧化还原修饰提供环境。但具体的分子机制尚待进一步研究。因此,我们后续将针对GR、Grx系统相关基因以及GshF在调控鞭毛基因合成及运动中的差异机制进行深入探索,为完善李斯特菌氧化还原蛋白家族调控修饰细菌在环境适应和宿主感染过程发挥的机理奠定基础。
此前本实验室将EGD-e和Δgr进行转录组分析得知,缺失grx后,gr转录水平差异显著[21]。本研究通过构建gr的荧光报告子导入到Δgrx中,通过荧光定性和定量试验证明了GR自身转录水平确实受Grx的负调控。Grx系统由NADPH、GR、谷胱甘肽(GSH)、Grx组成[7-8]。GR和Grx的活性位点均包含保守的基序Cys-XX-Cys,蛋白质的巯基-二硫键氧化还原状态的变化对于控制蛋白质功能也很重要。细菌Grx系统在环境适应和宿主感染过程中具有功能多样性。Grx能在DTT作为供体的情况下有效催化胰岛素的巯基-二硫键氧化还原,缺失Grx可提高细菌耐受性和存活力,促进细菌在细胞内的增殖能力。缺乏gshB会导致生长速率降低,并对氧化应激敏感性更高。GSH可以减少细胞二硫键,GR可还原谷胱甘肽二硫化物[35-36]。GR不仅能通过催化GSH还原从而在氧化还原调节中起到重要作用,还能促进中性粒细胞杀菌活性[37-38]。本研究证实,GR自身转录水平受Grx的负调控,而GR与Grx在氧化应激、胞内侵袭、侵袭、增殖、运动性等功能上均表现出相似的特性。缺失GR后细菌毒力增强,我们推测,GR可能通过降低细菌的毒力而更好地减少宿主对它的抵抗,增强隐蔽性,有利于其长期定植于细胞中。基于此研究基础,我们推测GR生物学特性与Grx相似,且Grx已证实对细菌毒力因子内化素A和内化素B存在影响,我们猜测GR也介导了细菌毒力因子的调控,为了证实这一猜想,下一步我们将深入探索GR与Grx系统调控关联机制并研究GR如何通过Grx系统调控细菌毒力因子、鞭毛系统、氧化应激的相关机制。本研究有助于深入理解李斯特菌氧化还原系统重要蛋白的调控关系以及通过参与诸多生物学过程介导细菌在宿主内外环境中的适应机制,对于防控食源性胞内菌感染和保障人类公共卫生具有重要意义。
References
| [1] | Radoshevich L, Cossart P. Listeria monocytogenes: towards a complete picture of its physiology and pathogenesis. Nature Reviews Microbiology, 2018, 16(1): 32-46. DOI:10.1038/nrmicro.2017.126 |
| [2] | Roberts BN, Chakravarty D, Gardner III JC, Ricke SC, Donaldson JR. Listeria monocytogenes response to anaerobic environments. Pathogens, 2020, 9(3): 210. DOI:10.3390/pathogens9030210 |
| [3] | Chen YT, Chen MT, Wang J, Wu QQ, Cheng JH, Zhang JM, Sun QF, Xue L, Zeng HY, Lei T, Pang R, Ye QH, Wu S, Zhang SH, Wu HM, Li WZ, Kou XY. Heterogeneity, characteristics, and public health implications of Listeria monocytogenes in Ready-to-Eat Foods and pasteurized milk in China. Frontiers in Microbiology, 2020, 11: 642. DOI:10.3389/fmicb.2020.00642 |
| [4] | Yin YL, Doijad S, Wang WP, Lian K, Pan XZ, Koryciński I, Hu YC, Tan WJ, Ye SY, Wang ZG, Pan ZM, Chakraborty T, Jiao XA. Genetic diversity of Listeria monocytogenes isolates from invasive listeriosis in China. Foodborne Pathogens and Disease, 2020, 17(3): 215-227. DOI:10.1089/fpd.2019.2693 |
| [5] | Kühn S, Enninga J. The actin comet guides the way: how Listeria actin subversion has impacted cell biology, infection biology and structural biology. Cellular Microbiology, 2020, 22(4): e13190. |
| [6] | Soni DK, Ahmad R, Dubey SK. Biosensor for the detection of Listeria monocytogenes: emerging trends. Critical Reviews in Microbiology, 2018, 44(5): 590-608. DOI:10.1080/1040841X.2018.1473331 |
| [7] | Couto N, Wood J, Barber J. The role of glutathione reductase and related enzymes on cellular redox homoeostasis network. Free Radical Biology and Medicine, 2016, 95: 27-42. DOI:10.1016/j.freeradbiomed.2016.02.028 |
| [8] | Ji M, Barnwell CV, Grunden AM. Characterization of recombinant glutathione reductase from the psychrophilic Antarctic bacterium Colwellia psychrerythraea. Extremophiles, 2015, 19(4): 863-874. DOI:10.1007/s00792-015-0762-1 |
| [9] | Allen EMG, Mieyal JJ. Protein-thiol oxidation and cell death: regulatory role of glutaredoxins. Antioxidants & Redox Signaling, 2012, 17(12): 1748-1763. |
| [10] | Ouyang Y, Peng Y, Li J, Holmgren A, Lu J. Modulation of thiol-dependent redox system by metal ions via thioredoxin and glutaredoxin systems. Metallomics, 2018, 10(2): 218-228. DOI:10.1039/C7MT00327G |
| [11] | Lu J, Holmgren A. Thioredoxin system in cell death progression. Antioxidants & Redox Signaling, 2012, 17(12): 1738-1747. |
| [12] | Cheng CY, Dong ZM, Han X, Wang H, Jiang L, Sun J, Yang YC, Ma TT, Shao CY, Wang XD, Chen ZW, Fang WH, Freitag NE, Huang HR, Song HH. Thioredoxin a is essential for motility and contributes to host infection of Listeria monocytogenes via redox interactions. Frontiers in Cellular and Infection Microbiology, 2017, 7: 287. DOI:10.3389/fcimb.2017.00287 |
| [13] | Gellert M, Richter E, Mostertz J, Kantz L, Masur K, Hanschmann EM, Ribback S, Kroeger N, Schaeffeler E, Winter S, Hochgr?fe F, Schwab M, Lillig CH. The cytosolic isoform of glutaredoxin 2 promotes cell migration and invasion. Biochimica et Biophysica Acta (BBA)-General Subjects, 2020, 1864(7): 129599. DOI:10.1016/j.bbagen.2020.129599 |
| [14] | Aydemir D, Hashemkhani M, Durmusoglu EG, Acar HY, Ulusu NN. A new substrate for glutathione reductase: glutathione coated Ag2S quantum dots. Talanta, 2019, 194: 501-506. DOI:10.1016/j.talanta.2018.10.049 |
| [15] | Plancarte A, Nava G, Munguia JA. A new thioredoxin reductase with additional glutathione reductase activity in Haemonchus contortus. Experimental Parasitology, 2017, 177: 82-92. DOI:10.1016/j.exppara.2017.04.006 |
| [16] | Michie KL, Dees JL, Fleming D, Moustafa DA, Goldberg JB, Rumbaugh KP, Whiteley M. Role of Pseudomonas aeruginosa glutathione biosynthesis in lung and soft tissue infection. Infection and Immunity, 2020, 88(6): e00116-20. |
| [17] | Malik WA, Wang XG, Wang XL, Shu N, Cui RF, Chen XG, Wang DL, Lu XK, Yin ZJ, Wang JJ, Ye WW. Genome-wide expression analysis suggests glutaredoxin genes response to various stresses in cotton. International Journal of Biological Macromolecules, 2020, 153: 470-491. DOI:10.1016/j.ijbiomac.2020.03.021 |
| [18] | Baldissera MD, Souza CF, Parmeggiani B, Leipnitz G, Verdi CM, Santos RCV, Stefani LM, Baldisserotto B. The disturbance of antioxidant/oxidant balance in fish experimentally infected by Aeromonas caviae: relationship with disease pathophysiology. Microbial Pathogenesis, 2018, 122: 53-57. DOI:10.1016/j.micpath.2018.06.011 |
| [19] | Liu HJ, Wang X, Yang ZL, Ren LL, Qian TT. Identification and biochemical characterization of the glutathione reductase family from Populus trichocarpa. Plant Science, 2020, 294: 110459. DOI:10.1016/j.plantsci.2020.110459 |
| [20] | Fan HJ, Tan ZB, Wu YT, Feng XR, Bi YM, Xie LP, Zhang WT, Ming Z, Liu B, Zhou YC. The role of ginsenoside Rb1, a potential natural glutathione reductase agonist, in preventing oxidative stress-induced apoptosis of H9C2 cells. Journal of Ginseng Research, 2020, 44(2): 258-266. DOI:10.1016/j.jgr.2018.12.004 |
| [21] | Sun J, Hang Y, Han Y, Zhang X, Gan L, Cai C, Chen ZW, Yang Y, Song QJ, Shao CY, Yang YC, Zhou YS, Wang XD, Cheng CY, Song HH. Deletion of glutaredoxin promotes oxidative tolerance and intracellular infection in Listeria monocytogenes. Virulence, 2019, 10(1): 910-924. DOI:10.1080/21505594.2019.1685640 |
| [22] | Eshwar AK, Guldimann C, Oevermann A, Tasara T. Cold-shock domain family proteins (Csps) are involved in regulation of virulence, cellular aggregation, and flagella-based motility in Listeria monocytogenes. Frontiers in Cellular and Infection Microbiology, 2017, 7: 453. DOI:10.3389/fcimb.2017.00453 |
| [23] | Gründling A, Burrack LS, Bouwer HGA, Higgins DE. Listeria monocytogenes regulates flagellar motility gene expression through MogR, a transcriptional repressor required for virulence. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(33): 12318-12323. DOI:10.1073/pnas.0404924101 |
| [24] | Kamp HD, Higgins DE. A protein thermometer controls temperature-dependent transcription of flagellar motility genes in Listeria monocytogenes. PLoS Pathogens, 2011, 7(8): e1002153. DOI:10.1371/journal.ppat.1002153 |
| [25] | Bigot A, Pagniez H, Botton E, Fréhel C, Dubail I, Jacquet C, Charbit A, Raynaud C. Role of FliF and FliI of Listeria monocytogenes in flagellar assembly and pathogenicity. Infection and Immunity, 2005, 73(9): 5530-5539. DOI:10.1128/IAI.73.9.5530-5539.2005 |
| [26] | Shen A, Higgins DE, Panne D. Recognition of AT-rich DNA binding sites by the MogR repressor. Structure, 2009, 17(5): 769-77. DOI:10.1016/j.str.2009.02.018 |
| [27] | Kamp HD, Higgins DE. Transcriptional and post-transcriptional regulation of the GmaR antirepressor governs temperature-dependent control of flagellar motility in Listeria monocytogenes. Molecular Microbiology, 2009, 74(2): 421-435. DOI:10.1111/j.1365-2958.2009.06874.x |
| [28] | Zhang T, Bae D, Wang C. Listeria monocytogenes DNA glycosylase AdlP affects flagellar motility, biofilm formation, virulence, and stress responses. Applied and Environmental Microbiology, 2016, 82(17): 5144-5152. DOI:10.1128/AEM.00719-16 |
| [29] | Shen A, Higgins DE. The MogR transcriptional repressor regulates nonhierarchal expression of flagellar motility genes and virulence in Listeria monocytogenes. PLoS Pathogens, 2006, 2(4): e30. DOI:10.1371/journal.ppat.0020030 |
| [30] | Gueriri I, Cyncynatus C, Dubrac S, Arana AT, Dussurget O, Msadek T. The DegU orphan response regulator of Listeria monocytogenes autorepresses its own synthesis and is required for bacterial motility, virulence and biofilm formation. Microbiology, 2008, 154(Pt 8): 2251-2264. |
| [31] | Gueriri I, Bay S, Dubrac S, Cyncynatus C, Msadek T. The Pta-AckA pathway controlling acetyl phosphate levels and the phosphorylation state of the DegU orphan response regulator both play a role in regulating Listeria monocytogenes motility and chemotaxis. Molecular Microbiology, 2008, 70(6): 1342-1357. DOI:10.1111/j.1365-2958.2008.06496.x |
| [32] | Cheng CY, Wang H, Ma TT, Han X, Yang YC, Sun J, Chen ZW, Yu HF, Hang Y, Liu FD, Fang WH, Jiang LL, Cai C, Song HH. Flagellar basal body structural proteins FlhB, FliM, and FliY are required for flagellar-associated protein expression in Listeria monocytogenes. Frontiers in Microbiology, 2018, 9: 208. DOI:10.3389/fmicb.2018.00208 |
| [33] | Reniere ML. Reduce, induce, thrive: bacterial redox sensing during pathogenesis. Journal of Bacteriology, 2018, 200(17): e00128-18. |
| [34] | Zhang YN, Zhang C, Du X, Zhou Y, Kong WN, Lau GW, Chen GK, Kohli GS, Yang L, Wang TT, Liang HH. Glutathione activates type III secretion system through vfr in Pseudomonas aeruginosa. Frontiers in Cellular and Infection Microbiology, 2019, 9: 164. DOI:10.3389/fcimb.2019.00164 |
| [35] | Wang J, Pan S, Berk BC. Glutaredoxin mediates akt and eNOS activation by flow in a glutathione reductase-dependent manner. Arteriosclerosis Thrombosis and Vascular Biology, 2007, 27(6): 1283-1288. DOI:10.1161/ATVBAHA.107.144659 |
| [36] | Li KY, Hein S, Zou WX, Klug G. The glutathione-glutaredoxin system in Rhodobacter capsulatus: part of a complex regulatory network controlling defense against oxidative stress. Journal of Bacteriology, 2004, 186(20): 6800-6808. DOI:10.1128/JB.186.20.6800-6808.2004 |
| [37] | Kim VY, Batty A, Li JH, Kirk SG, Crowell SA, Jin Y, Tang J, Zhang J, Rogers LK, Deng HX, Nelin LD, Liu YS. Glutathione reductase promotes fungal clearance and suppresses inflammation during systemic Candida albicans infection in mice. The Journal of Immunology, 2019, 203(8): 2239-2251. DOI:10.4049/jimmunol.1701686 |
| [38] | Meyer Y, Belin C, Delorme-Hinoux V, Reichheld JP, Riondet C. Thioredoxin and glutaredoxin systems in plants: molecular mechanisms, crosstalks, and functional significance. Antioxidants & Redox Signaling, 2012, 17(8): 1124-1160. |
