兰仙软1, 王雨坤1, 吴昊鸣1, 卢姗2,3, 仇金凤1, 李茹1,2

 , 陈保善2,3,4
, 陈保善2,3,4

1. 广西大学生命科学与技术学院, 广西 南宁 530004;
2. 亚热带农业生物资源保护与利用国家重点实验室, 广西 南宁 530004;
3. 广西甘蔗生物学重点实验室, 广西 南宁 530004;
4. 广西大学农学院, 广西 南宁 530004
收稿日期:2020-04-19;修回日期:2020-07-31;网络出版日期:2020-08-10
基金项目:国家自然科学基金(31872635);广西甘蔗生物学重点实验室自主课题(2018-266-Z01)
*通信作者:Tel/Fax: +86-771-3225260; 李茹, E-mail: liruonly@163.com;
陈保善, E-mail: chenyaoj@gxu.edu.cn.
摘要:[目的] 甘蔗鞭黑粉菌(Sporisorium scitamineum)引起的甘蔗黑穗病是我国甘蔗生产重要的病害。示踪甘蔗鞭黑粉菌侵染甘蔗的过程将有助于揭示其致病性和甘蔗抗黑穗病机制,为抗病品种的选育以及黑穗病的防治奠定基础。[方法] 利用农杆菌介导的遗传转化技术对甘蔗鞭黑粉菌进行黄色荧光标记,对转化子进行配合及致病力检测,将标记菌株接种甘蔗感病品种ROC22及抗病品种中蔗1号、中蔗6号和中蔗9号并进行早期可视化观察。[结果] 组成型表达的eYFP不影响标记菌株的配合及致病能力,而且黄色荧光性状能通过冬孢子稳定遗传。激光共聚焦显微观察表明,注射接种病原菌第5天,在感病品种ROC22的生长点已可见荧光菌丝及少量聚集状菌丝体,在抗病品种中蔗1号、中蔗6号和中蔗9号中可见少量单一丝状菌丝,无聚集状菌丝体。接种后35 d,在ROC22中可见大量聚集状菌丝体,但在中蔗品种中的聚集状菌丝体明显较少,而以中蔗1号最少。[结论] 成功构建了甘蔗鞭黑粉菌侵染甘蔗的荧光示踪系统,并发现中蔗系列品种存在抑制甘蔗鞭黑粉菌菌丝体在细胞间扩展的机制。
关键词:甘蔗鞭黑粉菌荧光标记甘蔗侵染
Visualization of the early infection stage of Sporisorium scitamineum in sugarcane cultivars
Xianruan Lan1, Yukun Wang1, Haoming Wu1, Shan Lu2,3, Jinfeng Qiu1, Ru Li1,2

 , Baoshan Chen2,3,4
, Baoshan Chen2,3,4

1. College of Life Science and Technology, Guangxi University, Nanning 530004, Guangxi Zhuang Autonomous Region, China;
2. State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources, Nanning 530004, Guangxi Zhuang Autonomous Region, China;
3. Guangxi Key Laboratory of Sugarcane Biology, Nanning 530004, Guangxi Zhuang Autonomous Region, China;
4. College of Agriculture, Guangxi University, Nanning 530004, Guangxi Zhuang Autonomous Region, China
Received: 19 April 2020; Revised: 31 July 2020; Published online: 10 August 2020
*Corresponding author: Tel/Fax: +86-771-3225260; Ru Li, E-mail: liruonly@163.com;
Baoshan Chen, E-mail: chenyaoj@gxu.edu.cn.
Foundation item: Supported by the National Natural Science Foundation of China (31872635) and by the Guangxi Key Laboratory of Sugarcane Biology (2018-266-Z01)
Abstract: [Objective] Sporisorium scitamineum isa pathogenic fungus that causes sugarcane smut, the most important disease of sugarcane in China. Tracing the infection progression of the disease will help to reveal the mechanism of resistance to smut and lay a foundation for the selection of resistant cultivars and the control of smut. [Methods] We labeled the basidiospores of the pathogen with a gene that encodes the enhanced yellow fluorescent protein (eYFP) by Agrobacterium tumefaciens-mediated transformation (ATMT). We tested the mating and pathogenicity of the transformants. To visualize the early stage of infection, we injected the eYFP-tagged strains into smut susceptible sugarcane cultivar ROC22 and smut resistant cultivar Zhongzhe 1, Zhongzhe 6, Zhongzhe 9. [Results] The eYFP-tagged strains were indistinguishable to the wild-type strain in mating and pathogenicity, and the fluorescence was able to inherit into the teliospores. Laser confocal microscopic examination showed that at 5 days post inoculation, a few aggregated as well as separated mycelia were observed in the susceptible sugarcane cultivar ROC22, but only a small amount of single mycelium was found at the same time in the resistant Zhongzhe cultivars. Much more aggregated mycelia were found at 35 days post infection in ROC22 than in Zhongzhe cultivars, with the lowest number in Zhongzhe 1. [Conclusion] A fluorescent tracer system for sugarcane infection by S. scitamineum was successfully constructed, and there may be a mechanism to constrain the mycelial growth of S. scitamineum in Zhongzhe cultivars.
Keywords: Sporisorium scitamineumfluorescence labelsugarcaneinfection
甘蔗黑穗病(sugarcane smut disease)是一种在世界范围内广泛发生的甘蔗真菌性病害[1]。染病甘蔗最明显的特征为蔗稍抽出长而细的黑色鞭状物,而在尚未出现黑鞭前,染病甘蔗表现为蔗种萌芽早,主轴叶片细长直立,叶色淡绿,茎细长,分蘖增多[2-3]。甘蔗黑穗病严重影响甘蔗产量以及蔗汁质量,一旦大面积暴发将会造成严重的经济损失[4]。引起甘蔗黑穗病的病原菌是担子菌亚门黑粉菌属的甘蔗鞭黑粉菌(Sporisorium scitamineum),该菌生活史可分为3个不同的阶段:单倍体酵母样孢子、双核菌丝和二倍体冬孢子[5]。其中单倍体孢子不具备侵染甘蔗的能力,而由不同交配型单倍体进行有性配合后形成的双核菌丝体具有致病性,能穿透植物组织进行侵染[5-6]。侵染菌丝吸取寄主体内的营养物质并随着蔗株生长点向上生长而逐渐向上蔓延,最终在蔗稍抽出黑鞭,黑鞭中充满大量的冬孢子。病菌冬孢子可随气流进行远距离传播,亦可落入土壤长期存活[7]。冬孢子在适宜的环境条件下萌发出长短不一的担子,每个担子细胞又可以产生1至数个单倍体担孢子,异型担孢子配合后可再次侵染蔗株完成其生活史[8-9]。
甘蔗抗病品种的培育是目前控制甘蔗黑穗病最为经济有效的手段[10]。雷敬超等对甘蔗常用亲本黑穗病抗性进行了调查,筛选出了大量优质抗病育种材料[11]。熊国如等对23个甘蔗品种进行黑穗病抗性鉴定,发现云蔗99-596、粤甘42、桂糖29和福农39具有良好的黑穗病抗性[12]。最近由本实验室培育的甘蔗新品种(系)中蔗1号、中蔗6号和中蔗9号具有高产、高糖、耐旱、耐寒等优点,并且拥有很好的黑穗病抗性[13]。目前甘蔗响应黑粉菌侵染的机制尚未明确,有关黑粉菌侵染甘蔗过程的研究还比较少。为方便示踪甘蔗鞭黑粉菌对甘蔗的侵染过程,本研究构建了黑粉菌强启动子启动的黄色荧光蛋白eYFP表达的表达载体,利用根癌农杆菌介导的转化技术将eYFP报告基因表达载体转化至甘蔗鞭黑粉菌[14],获得了能持续稳定表达黄色荧光蛋白的甘蔗鞭黑粉菌标记菌株JG35-eYFP和JG36-eYFP。利用这一对荧光标记菌株对抗病、感病甘蔗的生长点进行侵染,并对侵染的早期阶段进行可视化研究,以期初步解析中蔗系列品种甘蔗的抗病机制。
1 材料和方法 1.1 试验材料
1.1.1 材料与菌株: 供试甘蔗品种有ROC22、中蔗1号、中蔗6号和中蔗9号。其中ROC22为高感黑穗病的广西主栽甘蔗品种,中蔗1号、中蔗6号和中蔗9号为本实验室近年来自主培育的甘蔗新品种(系),具有很强的黑穗病抗性。供试菌株有甘蔗鞭黑粉菌单倍体JG35、JG36,农杆菌AGL1,均为本实验室保存。
1.1.2 载体: 双元载体pEX1-GAP-eGFP由华南农业大学姜子德教授惠赠。
1.1.3 试剂: In-Fusion HD Cloning Kit、Prime STAR Max Premix (2×) DNA聚合酶、TaKaRa MiniBEST Plant Genomic DNA Extraction Kit购自TaKaRa公司;质粒小提试剂盒、普通琼脂糖凝胶DNA回收试剂盒购自天根公司;快速限制性内切酶购自赛默飞公司;其余试剂均为国产分析纯。
1.2 含eYFP报告基因重组质粒的构建 根据本实验室前期甘蔗鞭黑粉菌转录组测序结果,选取在甘蔗鞭黑粉菌生长发育的各个时期(单倍体、冬孢子产生初期、中期及后期)都高效表达的基因g6182的启动子序列。分别用PCR获得启动子片段及eYFP片段,通过融合PCR[15]得到融合片段RB1-Pg6182-eYFP。用PmeⅠ和PacⅠ对双元载体pEX1-GAP-eGFP进行酶切,切除GAP-eGFP片段,并使用In-Fusion克隆技术将融合片段RB1-Pg6182-eYFP连入双元载体中,转化大肠杆菌DH5α感受态细胞。提取质粒用PmeⅠ和PacⅠ进行酶切鉴定,并经测序后保存正确的重组质粒pEX1-RB1-Pg6182-eYFP。本研究所用引物见表 1。
表 1. 本研究所用引物 Table 1. Primers used in this study
| Primer | Sequence (5′→3′) | Description |
| RB1-pEX1-F | TGTCAAACACTGATAGTTTAAACTGAAGGCGGGAAACGACAAT | Fusion PCR |
| RB1-g6182-R | AATCAGCAGTGCCACGCTCTAACATTCGCTGTTTCTTCGGTCAGTCT | g6182 fragment amplification |
| g6182-RB1-F | AAAAGACTGACCGAAGAAACAGCGAATGTTAGAGCGTGGCACTGCTG | g6182 fragment amplification |
| g6182-eYFP-R | ACAGCTCCTCGCCCTTGCTCACCATGTTGGCAGTGTATAGTTTGTGTGGA | eYFP fragment amplification |
| eYFP-g6182-F | TCCACACAAACTATACACTGCCAACATGGTGAGCAAGGGCGAGG | eYFP fragment amplification |
| eYFP-pEX1-R | ACATCATAGGGGTAGTTAATTAATTACTTGTACAGCTCGTCCATGCC | Fusion PCR |
| g6182-F | ATGTTAGAGCGTGGCACTGCTG | g6182 PCR verification |
| g6182-R | GTTGGCAGTGTATAGTTTGTGTGGA | |
| eYFP-F | ATGGTGAGCAAGGGCGAGG | eYFP PCR verification |
| eYFP-R | TTACTTGTACAGCTCGTCCATGCC |
表选项
1.3 农杆菌介导的甘蔗鞭黑粉菌遗传转化 利用甘油法制备农杆菌AGL1感受态细胞,并用电脉冲法将重组质粒转化进入AGL1中[12]。将重组AGL1转接到5 mL含有50 μg/mL利福平(rifampicin,Rif)和50 μg/mL壮观霉素(spectinomycin,Spec)的基础培养基(minimal media,MM)中,培养2 d至OD600=0.9 (28 ℃、200 r/min),经诱导培养基IM (induce media,IM)稀释至OD600=0.15,添加乙酰丁香酮(acetosyringone,As)至终浓度为终浓度为200 μmol/L后在黑暗28 ℃、200 r/min条件下,诱导培养至OD600=0.5左右。另外在YEPSA平板上划线活化甘蔗鞭黑粉菌单倍体菌株JG35和JG36,并用新鲜的YEPS液体培养基培养菌株至OD600=1.0。
将诱导培养至OD600值为0.5的重组AGL1菌液与OD600值为1.0的JG35、JG36分别等体积混合,涂布到铺有混合纤维素微孔滤膜(孔径为0.45 μm)的含有终浓度为200 μmol/L的乙酰丁香酮的诱导培养基(induce media,IM)平板上,于黑暗条件下,28 ℃倒置培养2–3 d;再将微孔滤膜转移至含300 μg/mL头孢噻肟钠(cefotaxime,Cef)和200 μg/mL潮霉素(hygromycin,Hyg)的YEPS平板上,28 ℃避光倒置培养9 d至长出转化子。
1.4 甘蔗鞭黑粉菌黄色荧光蛋白标记转化子的鉴定 在激光共聚焦显微镜下观察转化子,将能产生黄色荧光的菌落转移到YEPS平板(含300 μg/mL Cef+200 μg/mL Hyg)上进行二次筛选。筛选后的阳性转化子利用TaKaRa MiniBEST Plant Genomic DNA Extraction Kit进行DNA提取,用引物g6182-F/R进行PCR验证转化子中是否含有g6182启动子序列,用引物eYFP-F/R进行PCR验证转化子是否具有黄色荧光蛋白基因。
1.5 甘蔗鞭黑粉菌黄色荧光蛋白标记菌株配合能力的检测 分别活化菌株JG35、JG36、JG35-eYFP和JG36-eYFP,挑取单菌落于YEPS液体培养基中进行扩大培养,在28 ℃、200 r/min条件下培养2 d后,采用正交试验进行配合,分别取等体积菌液按照JG35+JG36、JG35+JG35、JG35+JG36-eYFP、JG35+JG35-eYFP、JG36+JG36、JG36+JG35、JG36+JG36-eYFP、JG36+JG35-eYFP、JG35-eYFP+ JG36、JG35-eYFP+JG35、JG35-eYFP+JG36-eYFP、JG35-eYFP+JG35-EyfpJG36-eYFP+JG36、JG36-eYFP+JG35、JG36-eYFP+JG36-eYFP、JG36-eYFP+ JG35-eYFP两两混匀,然后取10 μL混合液点在YEPS平板上,放置于28 ℃培养箱倒置培养,每12 h观察配合菌落生长情况,持续观察3 d。
1.6 甘蔗鞭黑粉菌黄色荧光蛋白标记菌株的菌丝荧光观察 将含有eYFP报告基因的不同交配型黑粉菌单倍体进行有性配合,于28 ℃培养箱中培养至菌落表面产生白色菌丝,挑取菌丝于荧光显微镜下观察。同时以野生型单倍体配合形成的双核菌丝作为对照。
1.7 甘蔗鞭黑粉菌黄色荧光蛋白标记冬孢子的荧光观察 用含eYFP报告基因的黑粉菌(JG35-eYFP+ JG36-eYFP)接种甘蔗品种ROC22,60 d后采集发病黑鞭中的冬孢子。将冬孢子接种于50 μL含有50 μg/mL氨苄西林(ampicillin,Amp),50 μg/mL卡那霉素(kanamycin,Kan)和150 μg/mL Cef的YEPS液体培养基中,28 ℃、200 r/min进行培养,分别取培养0 h和6 h的样品进行荧光观察。同时吸取20 μL冬孢子稀释液划线于含有100 μg/mL Amp、100 μg/mL Kan、300 μg/mL Cef和200 μg/mL Hyg的YEPS固体培养基中,28 ℃培养72 h。挑取平板上的单菌落进行显微观察。
1.8 甘蔗鞭黑粉菌黄色荧光蛋白标记菌株在甘蔗体内的行为观察 将活化好的甘蔗鞭黑粉菌黄色荧光蛋白标记菌株单菌落接种到YEPS液体培养基,28 ℃、200 r/min培养2 d,取20 mL菌液,按1︰1的比例与对应交配型的单倍体菌株混匀后,用注射接种的方法接种生长至五叶期的甘蔗植株茎尖生长点附近,每株接种1次,每次接种100 μL混合菌液,阳性对照为野生型单倍体菌株JG35+ JG36混合液,阴性对照为灭菌蒸馏水,每接种处理重复3次。于接种后5日、35日从甘蔗植株上采样,对茎尖分生组织部位进行切片,在激光共聚焦显微镜下,观察甘蔗鞭黑粉菌在甘蔗体内的行为。
2 结果和分析 2.1 甘蔗鞭黑粉菌黄色荧光蛋白标记菌株的构建及单倍体荧光稳定性 构建含有强启动子序列和eYFP的重组载体pEX1-RB1-Pg6182-eYFP,分别转化至JG35和JG36,分别随机挑取30个转化子进行荧光观察。结果如图 1-A所示,转化子JG35-eYFP和JG36-eYFP在荧光显微镜下均能发出强烈的黄色荧光,而野生型对照菌株JG35和JG36都没有荧光信号。进一步对转化子进行PCR鉴定(图 1-B),以eYFP基因引物对eYFP-F/R进行PCR,在JG35-eYFP和JG36-eYFP转化菌株中均可扩增出720 bp的目的片段,而在野生型JG35和JG36及空载体pEX1中均扩增不出目的片段;以启动子序列引物g6182-F/R进行PCR,在JG35-eYFP和JG36-eYFP转化菌株中均可扩增出1500 bp的目的片段,而在野生型JG35和JG36及空载体pEX1中均扩增不出目的片段。研究结果说明该荧光报告基因已经转入到真菌中,获得了含有黄色荧光蛋白标记的甘蔗鞭黑粉菌单倍体菌株。
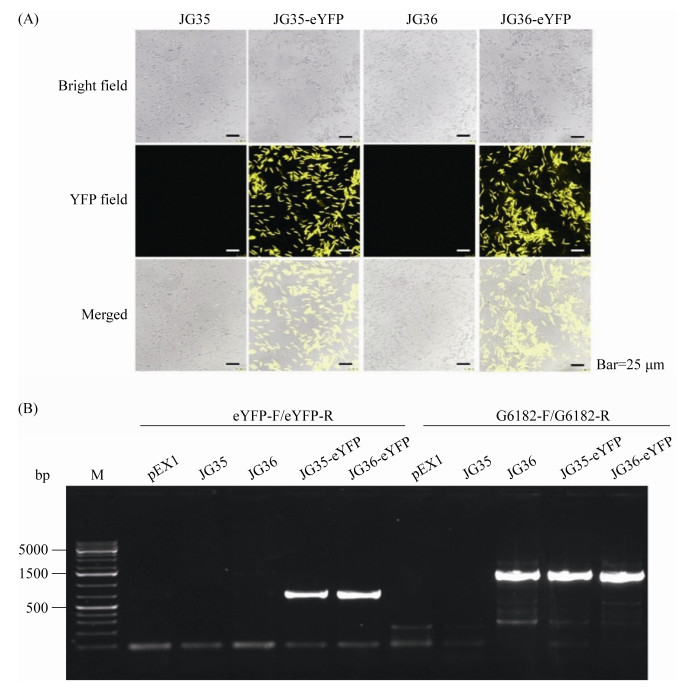 |
| 图 1 含eYFP报告基因的甘蔗鞭黑粉菌转化子的荧光观察及PCR检测 Figure 1 Yellow fluorescence observation and PCR analysis of S. scitamineum transformants with eYFP reporter gene. A: yellow fluorescence observed in S. scitamineum transformants with eYFP reporter gene; B: the PCR analysis of S. scitamineum transformants with eYFP reporter; M: 1 kb plus DNA ladder. |
| 图选项 |
2.2 黄色荧光蛋白标记的甘蔗鞭黑粉菌的配合能力 将含eYFP报告基因的黑粉菌单倍体和野生型单倍体进行有性配合,由图 2-A可看出JG35-eYFP、JG36-eYFP与异型单倍体均能正常配合,形成白色绒毛状菌落,说明eYFP基因不影响其配合能力,仍可产生正常的双核菌丝。将含eYFP报告基因的黑粉菌双核菌丝体与野生型黑粉菌双核菌丝体置于荧光显微镜下进行观察发现,含eYFP报告基因的双核菌丝可以发出明显的黄色荧光信号,而野生型菌株的双核菌丝无黄色荧光信号(图 2-B)。说明eYFP报告基因能在甘蔗黑粉菌的双核菌丝阶段内稳定表达。
 |
| 图 2 含eYFP报告基因的甘蔗鞭黑粉菌配合能力检测及菌丝体中荧光观察 Figure 2 Mating analysis and yellow fluorescence observation of S. scitamineum with eYFP reporter gene. A: mating behavior of S. scitamineum with eYFP reporter gene; B: yellow fluorescence observed in the fungal hyphae of S. scitamineum with eYFP reporter gene. |
| 图选项 |
2.3 黄色荧光蛋白标记的甘蔗鞭黑粉菌的致病能力及冬孢子荧光观察 用含eYFP报告基因的黑粉菌接种甘蔗品种ROC22的生长点,60 d后甘蔗出现明显的黑穗病症状,病株长势矮小,在病株的蔗稍部位长出一条“黑鞭”,其形态特征与野生型菌株接种后长出的黑鞭无差异(图 3-A)。在荧光显微镜下观察发现,黑鞭上白色部位没有黄色荧光信号,灰色部位有少量黄色荧光冬孢子,黑色部位表现很强的黄色荧光信号。说明从白色部位到黑色部位的黑粉菌冬孢子逐渐增多,而且荧光报告基因在冬孢子时期也能稳定高效表达(图 3-A)。进一步对冬孢子在培养基中萌发前后进行观察,发现无论是冬孢子萌发形成的菌丝,还是冬孢子萌发后经减数分裂生成的单倍体孢子,在荧光显微镜下均有黄色荧光信号,说明黄色荧光蛋白在黑粉菌冬孢子到单倍体时期都能稳定表达,黄色荧光性状能通过冬孢子稳定遗传(图 3-B)。
 |
| 图 3 含eYFP报告基因的甘蔗鞭黑粉菌的黑鞭与冬孢子中的荧光观察 Figure 3 Yellow fluorescence observed in the black whip and teliospores of S. scitamineum with eYFP reporter gene. A: yellow fluorescence observed in the different parts of the black whip with eYFP reporter gene; B: yellow fluorescence observed in S. scitamineum teliospores with eYFP reporter gene. Teliospores were incubated in YEPS media and imaged at 0 h, 6 h and 72 h, post-inoculation. |
| 图选项 |
2.4 黄色荧光蛋白标记的甘蔗鞭黑粉菌侵染甘蔗的早期可视化观察 将含eYFP报告基因黑粉菌的异形交配型单倍体混合后注射接种甘蔗抗病品种(中蔗1号、中蔗6号、中蔗9号)及感病品种ROC22的生长点。接种后5 d,在接种口周围取样观察,发现在4个甘蔗品种中都能清楚观察到黑粉菌黄色荧光菌丝,菌丝沿细胞间隙生长。在感病品种ROC22号中菌丝扩散程度大,可见少量聚集状菌丝体;在抗病品种中蔗1、6、9号甘蔗中可见少量单一丝状,无聚集状菌丝体(图 4-A)。
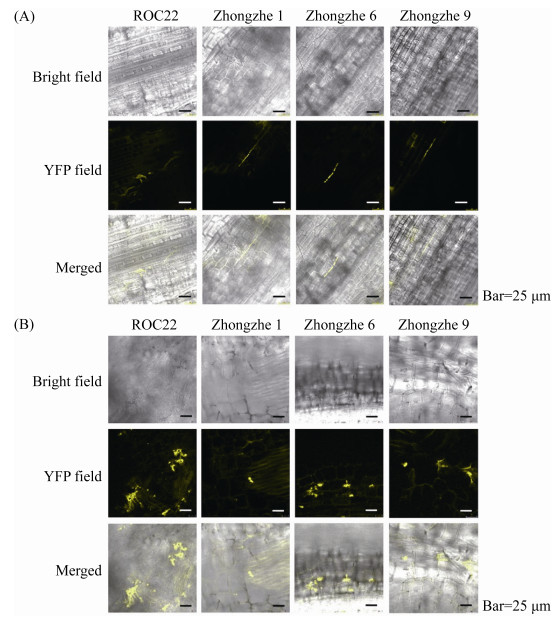 |
| 图 4 含eYFP报告基因的甘蔗鞭黑粉菌侵染甘蔗的早期可视化观察 Figure 4 Visualization of the early stage infection with an eYFP-tagged S. scitamineum in sugarcane cultivars. A: visualization of different sugarcane cultivars at day 5 post-inoculation; B: visualization of different sugarcane cultivars at day 35 post-inoculation. |
| 图选项 |
接种后35 d,取样观察发现4个甘蔗品种体内的菌丝形态发生变化,菌丝不再单一,变成高度螺旋盘绕的菌丝体。在ROC22中可见大量聚集状菌丝体,但在中蔗品种中的聚集状菌丝体明显较少,而以中蔗1号最少(图 4-B)。上述结果表明,中蔗系列品种存在抑制甘蔗鞭黑粉菌菌丝体在细胞间扩展的机制。
3 讨论 荧光报告基因具有分子量小、对活细胞无毒性、易被检测、易于区别、荧光稳定和直观可视性等优点,目前在生命科学等领域被广泛应用[16]。将荧光报告基因同目的基因相连接,通过产生的荧光可以直观观测到目的基因的表达情况。2016年,Yan等[17]成功向甘蔗鞭黑粉菌中导入了荧光蛋白GFP和RFP,构建了含GFP与RFP的双色成像报告系统,并用于对甘蔗鞭黑粉菌整个生命周期的发育进行观察。但该系统未能在甘蔗体内成功应用,作者推测是由于甘蔗组织自发的荧光作用较强导致。Carvalho等[18]用GFP标记甘蔗鞭黑粉菌研究其完整的真菌生命周期,发现GFP标记的黑粉菌能够感染甘蔗组织,产生有活性的冬孢子并定植甘蔗体内,然而他们未对菌丝在甘蔗体内的侵染过程进行连续示踪。
最近由本实验室培育的甘蔗新品种(系)中蔗1号、中蔗6号和中蔗9号具有很好的黑穗病抗性,但其抗病机制还未明确[13]。如果能构建一个在甘蔗体内高效表达荧光信号的黑粉菌标记菌株,就可以为研究中蔗系列甘蔗对黑穗病的抗病机制提供有力的工具。朱丽萍等曾对eGFP、mCherry、YFP、wGFP、RFP 5种荧光基因在甲基营养菌Methylobacterium extorquens AM1中表达的强度进行对比,结果发现YFP表现出更好的荧光特性,表达强度最明显[19]。Day等报道增强型黄色荧光蛋白eYFP是荧光最强、应用最广泛的荧光蛋白之一[20]。因此本研究选用eYFP作为报告基因导入甘蔗鞭黑粉菌构建荧光报告菌株。
启动子在基因转录调控中占有核心地位,决定基因的表达水平[21]。为了降低植物本身自发荧光的干扰,构建在甘蔗鞭黑粉菌各个生命周期都高效表达报告基因的标记菌株,我们选用了一个甘蔗鞭黑粉菌各个时期都能高效表达的基因的组成型启动子来启动报告基因的表达。本实验室前期转录组测序结果发现,甘蔗鞭黑粉菌的g6182基因在各个生命时期的表达量都很高,由此推测调控该基因表达的上游启动子是一个高效表达的组成型启动子。利用该基因的CDS序列,我们获取该基因上游1500 bp的启动子序列,用于启动下游荧光报告基因的表达。
通过对eYFP标记的黑粉菌株进行有性配合及致病力检测表明,eYFP的组成型表达不影响甘蔗鞭黑粉菌的配合及致病能力。而且荧光显微观察结果也表明eYFP报告基因在黑粉菌单倍体孢子、双核菌丝体、二倍体冬孢子3个生命周期中都能稳定高效表达,说明本研究构建的荧光报告系统是一个高效的、稳定的组成型表达系统,可以用于示踪甘蔗鞭黑粉菌侵染甘蔗的过程。
将成功构建的eYFP报告菌株通过注射接种的方式对本实验室选育的中蔗系列品种甘蔗进行了侵染实验,初步观察结果表明,在接种后5 d以及35 d的甘蔗组织内均可以观察到较强的发黄色荧光信号的黑粉菌,并且基本无植物背景干扰。在接种后5 d及35 d时,中蔗系列品种体内黑粉菌量较少,菌丝(体)扩散程度低;而感病品种ROC22甘蔗体内菌丝量相对较多且菌丝扩散程度大。由于本研究采用的是注射接种的方式进行黑粉菌侵染,黑粉菌进入甘蔗体内时已经突破了外层的物理屏障,但依然在中蔗系列甘蔗中形成的菌丝较少,因此初步推测中蔗系列品种甘蔗体内可能产生某种(些)化合物抑制了菌丝的扩散。已有研究表明,抗病品种甘蔗的抗病性与其自身产生的多胺含量[22-23]、酚类物质[24]、内源激素[25]和糖蛋白[26]等有关。中蔗系列甘蔗的抗病机制是否也是这些物质,需进一步实验证明。
迄今为止对甘蔗鞭黑粉菌侵染甘蔗过程的报道仍很少,本研究构建的荧光报告系统的荧光蛋白表达量和荧光强度均优于之前报道的荧光标记系统,可用于示踪甘蔗鞭黑粉菌侵染甘蔗的过程,有助于在细胞生物学层面揭示致病性和甘蔗抗黑穗病机制,为抗病品种的选育以及黑穗病的防治奠定基础。
致谢
感谢华南农业大学姜子德教授惠赠的双元载体pEX1-GAP-eGFP。
References
| [1] | Singh N, Somai BM, Pillay D. Smut disease assessment by PCR and microscopy in inoculated tissue cultured sugarcane cultivars. Plant Science, 2004, 167(5): 987-994. DOI:10.1016/j.plantsci.2004.05.006 |
| [2] | Xiong GR, Zhang SZ. Study on sugarcane smut. Plant Diseases and Pests, 2012, 3(2): 12-14. |
| [3] | Wei DD, Li MQ, Zhang ZW. The research progress on fungal diseases and biological control of sugarcane. Popular Science & Technology, 2017, 19(5): 100-103. (in Chinese) 魏栋栋, 李梦茜, 张振旺. 甘蔗真菌病病害及生物防治的研究进展. 大众科技, 2017, 19(5): 100-103. |
| [4] | Wang WZ, Yang BP, Xiong GR, Feng CL, Cai WW, Wang JG, Zhao TT, Zhang SZ. Influence of planting of sugarcane seeds carrying smut fungus on cane yield and sugar content. Chinese Journal of Tropical Crops, 2014, 35(9): 1683-1687. (in Chinese) 王文治, 杨本鹏, 熊国如, 冯翠莲, 蔡文伟, 王俊刚, 赵婷婷, 张树珍. 带黑穗病菌蔗种的种植对蔗茎产量和蔗糖分的影响. 热带作物学报, 2014, 35(9): 1683-1687. |
| [5] | Taniguti LM, Schaker PDC, Benevenuto J, Peters LP, Carvalho G, Palhares A, Quecine MC, Nunes FRS, Kmit MCP, Wai A, Hausner G, Aitken KS, Berkman PJ, Fraser JA, Moolhuijzen PM, Coutinho LL, Creste S, Vieira MLC, Kitajima JP, Monteiro-Vitorello CB. Complete genome sequence of Sporisorium scitamineum and biotrophic interaction transcriptome with sugarcane. PLoS One, 2015, 10(6): e0129318. DOI:10.1371/journal.pone.0129318 |
| [6] | Wei JJ, Song XP, Wei CY, Zhang XQ, Huang WH, Yan MX. Research progress on sugarcane smut and its control. Guangdong Agricultural Sciences, 2019, 46(4): 81-88. (in Chinese) 韦金菊, 宋修鹏, 魏春燕, 张小秋, 黄伟华, 颜梅新. 甘蔗黑穗病及其防治研究进展. 广东农业科学, 2019, 46(4): 81-88. |
| [7] | Lu WJ, Li WF, Huang YK. Research advances on sugarcane smut disease occurrence and control. Sugar Crops of China, 2008(3): 64-66. (in Chinese) 卢文洁, 李文风, 黄应昆. 甘蔗黑穗病发生及防治研究进展. 中国糖料, 2008(3): 64-66. |
| [8] | Sundar AR, Barnabas EL, Malathi P, Viswanathan R. A mini-review on smut disease of sugarcane caused by Sporisorium scitamineum//Mworia J. Botany. London: InTech, 2012: 107-128. |
| [9] | Bakkeren G, K?mper J, Schirawski J. Sex in smut fungi: structure, function and evolution of mating-type complexes. Fungal Genetics and Biology, 2008, 45(1): S15-S21. |
| [10] | Peters LP, Carvalho G, Vilhena MB, Creste S, Azevedo RA, Monteiro-Vitorello CB. Functional analysis of oxidative burst in sugarcane smut-resistant and -susceptible genotypes. Planta, 2017, 245(4): 749-764. DOI:10.1007/s00425-016-2642-z |
| [11] | Lei JC, Zhang BQ, Gao LH, Tang SY, Jing Y, Zhou S, Gao YJ. Preliminary survey on smut disease of commonly-used sugarcane parents. Sugar Crops of China, 2018, 40(5): 30-33. (in Chinese) 雷敬超, 张保青, 高丽花, 唐仕云, 经艳, 周珊, 高轶静. 甘蔗常用亲本黑穗病抗性初步调查. 中国糖料, 2018, 40(5): 30-33. |
| [12] | Xiong GR, Cai WW, Wang WZ, Wu SR, Yang BP, Zhang SZ. Evaluation of 23 sugarcane varieties for smut resistance. Sugar Crops of China, 2016, 38(1): 13-14, 18. (in Chinese) 熊国如, 蔡文伟, 王文治, 伍苏然, 杨本鹏, 张树珍. 23个甘蔗品种对甘蔗黑穗病的抗性测定. 中国糖料, 2016, 38(1): 13-14, 18. |
| [13] | Zhang SS, Zhang PR, Lan XR, Li R, Huang YZ, Chen BS. Identification of smut resistance in sugarcane Zhongzhe cultivars. Sugar Crops of China, 2019, 41(1): 37-40. (in Chinese) 张姗姗, 张沛然, 兰仙软, 李茹, 黄有总, 陈保善. 中蔗系列甘蔗品种的黑穗病抗性鉴定. 中国糖料, 2019, 41(1): 37-40. |
| [14] | Sun LH, Yan MX, Ding ZJ, Liu YB, Du MG, Xi PG, Liao JL, Ji LH, Jiang ZD. Improved dominant selection markers and co-culturing conditions for efficient Agrobacterium tumefaciens-mediated transformation of Ustilago scitaminea. Biotechnology Letters, 2014, 36(6): 1309-1314. DOI:10.1007/s10529-014-1486-5 |
| [15] | Li M, Yang Q. A rapid method for generation of homologous recombinant fragments-fusion PCR. China Biotechnology, 2007, 27(8): 53-58. (in Chinese) 李敏, 杨谦. 一种高效构建同源重组DNA片段的方法——融合PCR. 中国生物工程杂志, 2007, 27(8): 53-58. |
| [16] | Lorang JM, Tuori RP, Martinez JP, Sawyer TL, Redman RS, Rollins JA, Wolpert TJ, Johnson KB, Rodriguez RJ, Dickman MB, Ciuffetti LM. Green fluorescent protein is lighting up fungal biology. Applied and Environmental Microbiology, 2001, 67(5): 1987-1994. DOI:10.1128/AEM.67.5.1987-1994.2001 |
| [17] | Yan MX, Cai EP, Zhou JN, Chang CQ, Xi PG, Shen WK, Li LY, Jiang ZD, Deng YZ, Zhang LH. A dual-color imaging system for sugarcane smut fungus Sporisorium scitamineum. Plant Disease, 2016, 100(12): 2357-2362. DOI:10.1094/PDIS-02-16-0257-SR |
| [18] | Carvalho G, Quecine MC, Longatto DP, Peters LP, Almeida JR, Shyton TG, Silva MML, Crestana GS, Creste S, Monteiro-Vitorello CB. Sporisorium scitamineum colonisation of sugarcane genotypes susceptible and resistant to smut revealed by GFP-tagged strains. Annals of Applied Biology, 2016, 169(3): 329-341. DOI:10.1111/aab.12304 |
| [19] | Zhu LP, Liu CC, Song SZ, Diao B. Identification of the optimal fluorescent protein reporter gene in Methylobacterium extorquens AM1. Biotechnology Bulletin, 2019, 35(4): 43-50. (in Chinese) 朱丽萍, 刘聪聪, 宋书真, 刁斌. 甲基营养菌Methylobacterium extorquens AM1中最适荧光蛋白报告基因的鉴定. 生物技术通报, 2019, 35(4): 43-50. |
| [20] | Day RN, Davidson MW. The fluorescent protein palette: tools for cellular imaging. Chemical Society Reviews, 2009, 38(10): 2887-2921. DOI:10.1039/b901966a |
| [21] | Sun XH, Chen MJ, Pan YJ. A brief account of promoter cloning. Acta Edulis Fungi, 2002, 9(3): 57-62. (in Chinese) 孙晓红, 陈明杰, 潘迎捷. 启动子克隆概述. 食用菌学报, 2002, 9(3): 57-62. |
| [22] | Pi?on D, De Armas R, Vicente C, Legaz ME. Role of polyamines in the infection of sugarcane buds by Ustilago scitaminea spores. Plant Physiology and Biochemistry, 1999, 37(1): 57-64. DOI:10.1016/S0981-9428(99)80067-9 |
| [23] | Sánchez-Elordi E, de los Ríos LM, Vicente C, Legaz ME. Polyamines levels increase in smut teliospores after contact with sugarcane glycoproteins as a plant defensive mechanism. Journal of Plant Research, 2019, 132(3): 405-417. DOI:10.1007/s10265-019-01098-7 |
| [24] | de Armas R, Santiago R, Legaz ME, Vicente C. Levels of phenolic compounds and enzyme activity can be used to screen for resistance of sugarcane to smut (Ustilago scitaminea). Australasian Plant Pathology, 2007, 36(1): 32-38. DOI:10.1071/AP06077 |
| [25] | Mo FL, Yang LT, Pan RK, Song XP, Li YR. Changes of endogenous hormone content in sugarcane under smut pathogen stress. Journal of Southern Agriculture, 2012, 43(11): 1676-1681. (in Chinese) 莫凤连, 杨丽涛, 潘如科, 宋修鹏, 李杨瑞. 甘蔗黑穗病菌胁迫对甘蔗内源激素含量的影响. 南方农业学报, 2012, 43(11): 1676-1681. |
| [26] | Sánchez-Elordi E, Balu?ka F, Echevarría C, Vicente C, Legaz ME. Defence sugarcane glycoproteins disorganize microtubules and prevent nuclear polarization and germination of Sporisorium scitamineum teliospores. Journal of Plant Physiology, 2016, 200: 111-123. DOI:10.1016/j.jplph.2016.05.022 |
