金虹云1#, 潘梦瑶1#, 王明亮2#, 闫琴3, 李耀星3, 赵锐1, 张恒1, 白芃3

 , 刘威4
, 刘威4

1. 山西医科大学汾阳学院临床系, 山西 汾阳 032200;
2. 山西医科大学汾阳学院科技中心, 山西 汾阳 032200;
3. 山西医科大学汾阳学院基础医学部, 山西 汾阳 032200;
4. 山西医科大学汾阳学院医学检验系, 山西 汾阳 032200
收稿日期:2019-09-15;修回日期:2019-12-14;网络出版日期:2020-03-10
基金项目:国家自然科学基金(31501175);山西省高等学校大学生创新创业训练项目(2018810,2019821);山西医科大学汾阳学院科技发展重点基金(2018C02)
*通信作者:白芃, Tel:+86-358-2100375, E-mail:932626@163.com;
刘威, Tel:+86-358-7235034, E-mail:liuwei@sxmu.edu.cn.
#并列第一作者
摘要:[目的] 研究东方醋杆菌(Acetobacter orientalis)和短小乳杆菌(Lactobacillus brevis)通过氧气浓度调控黑腹果蝇(Drosophila melanogaster)产卵的偏嗜性,并研究其对后代存活率和发育历期的生物学意义。[方法] 利用双相选择装置解析果蝇产卵行为。利用分光光度仪和pH计测量细菌的OD值与pH值。通过改变果蝇的视觉、味觉和嗅觉感官以检测介导果蝇产卵行为的感觉系统。用后代的发育历期与存活率评价其生物学意义。[结果] 果蝇产卵对东方醋杆菌具有趋避性,产卵指数为-0.76,对短小乳杆菌具有趋向性,产卵指数为0.5,并且二者接种比例决定了果蝇的产卵选择。氧气作为一个调节因子,可改变果蝇对东方醋杆菌和短小乳杆菌的产卵偏嗜性。氧气是东方醋杆菌生长必需的条件,有氧培养的OD值为1.3,而无氧培养的OD值为0.4。氧气是短小乳杆菌生长非必需的条件,有氧和无氧培养的OD值均为2.2。破坏嗅觉可严重地影响果蝇对细菌的产卵偏嗜性。东方醋杆菌和短小乳杆菌均促进了果蝇的生长,分别提高存活率1倍和1.5倍,分别缩短果蝇发育历期1 d和2 d。[结论] 东方醋杆菌和短小乳杆菌可影响果蝇产卵偏嗜性,并且二者比例决定了果蝇的最终产卵选择。东方醋杆菌和短小乳杆菌通过感知氧气浓度的改变而进行不同的代谢方式,从而进一步调节果蝇产卵选择。嗅觉系统介导果蝇对东方醋杆菌和短小乳杆菌的产卵选择行为,从而提高后代存活率和缩短发育时间。
关键词:氧气东方醋杆菌短小乳杆菌产卵偏嗜性存活率发育历期
Symbiotic bacteria regulate Drosophila oviposition preference by oxygen concentration
Hongyun Jin1#, Mengyao Pan1#, Mingliang Wang2#, Qin Yan3, Yaoxing Li3, Rui Zhao1, Heng Zhang1, Peng Bai3

 , Wei Liu4
, Wei Liu4

1. Department of Clinical Medical, Fenyang College, Shanxi Medical University, Fenyang 032200, Shanxi Province, China;
2. Technology Center, Fenyang College, Shanxi Medical University, Fenyang 032200, Shanxi Province, China;
3. Department of Faculty of Basic Medicine, Fenyang College, Shanxi Medical University, Fenyang 032200, Shanxi Province, China;
4. Department of Medical Laboratory Science, Fenyang College, Shanxi Medical University, Fenyang 032200, Shanxi Province, China
Received: 15 September 2019; Revised: 14 December 2019; Published online: 10 March 2020
*Corresponding author: Peng Bai, Tel: +86-358-2100375, E-mail: 932626@163.com;
Wei Liu, Tel: +86-358-7235034, E-mail: liuwei@sxmu.edu.cn.
Foundation item: Supported by the National Natural Science Foundation of China (31501175), by the Innovation and Entrepreneurship Training Program for College Students in Shanxi Province (2018810, 2019821) and by the Key Fund for Science and Technology Development of Fenyang College, Shanxi Medical University (2018C02)
#These authors contributed equally to this work.
Abstract: [Objective] We studied how Acetobacter orientalis and Lactobacillus brevis regulate the oviposition preference of Drosophila melanogaster by oxygen concentration and further explored the biological significance of this phenomenon through the survival rate and developmental duration of offspring. [Methods] The egg-laying behavior of Drosophila melanogaster was analyzed by using a double selection device. The OD value and pH value of bacteria were measured by spectrophotometer and pH meter. The system that mediates the oviposition preference of Drosophila was detected by altering the visual, taste and olfactory senses of Drosophila. The biological significance was evaluated by the developmental duration and survival rate of offspring. [Results] Drosophila melanogaster tended to avoid laying egg on the side of Acetobacter orientalis, the oviposition index was -0.76, but liked to lay egg on the side of Lactobacillus brevis, and the oviposition Index was 0.5, the ratio of the two bacteria determined the oviposition selection of Drosophila melanogaster. Anaerobic environment reversed the oviposition preference to Acetobacter orientalis and Lactobacillus brevis. The OD value of Acetobacter orientalis was 1.3 in aerobic environment but 0.4 in anaerobic environment. The OD value of Lactobacillus brevis was 2.2 in both aerobic and anaerobic environment. Disrupting the sense of smell affected the Drosophila's oviposition to bacteria. Both Acetobacter orientalis and Lactobacillus brevis promoted the growth of Drosophila under anaerobic and aerobic environment, increased the survival rate by 1 and 1.5 times respectively, and shortened the development period of Drosophila by 1 and 2 days respectively. [Conclusion] Both Acetobacter orientalis and Lactobacillus brevis affected the oviposition preference of Drosophila, and the ratio of them determined the final oviposition selection. Acetobacter orientalis and Lactobacillus brevis had different metabolic modes by sensing the change of oxygen, and further regulated the oviposition preference of Drosophila. Olfactory system mediated the oviposition selection behavior of Drosophila melanogaster. Both Acetobacter orientalis and Lactobacillus brevis improved the survival rate of offspring and shorten the development duration.
Keywords: oxygenAcetobacter orientalisLactobacillus brevisoviposition preferencesurvival ratedevelopment duration
自然界的生态环境变化多端,动物需要根据环境条件调整其行为,这对生物的生存和繁衍具有决定性作用[1]。由于幼虫的易感性和活动受限,雌果蝇选择合适的地点产卵对后代的生存和发育尤为重要[2]。果蝇是一种半腐生昆虫,倾向于在微生物发酵过的食物上产卵,以提高后代存活率[3]。成熟的果实在微生物作用下发生腐烂,腐烂的果实为黑腹果蝇生长、发育和繁殖提供了所需的营养物质。微生物发酵过程改变了食物的气味和味道,而这二者对生物追踪食物和选择产卵地点至关重要[4]。果蝇在采食微生物的同时,周身和肠道也携带大量微生物,可通过果蝇作为生物媒介传播到新的环境,以进一步扩大果蝇和共生微生物的生存领地[5]。综上,果蝇与微生物有密切的共生关系,微生物群对果蝇的生理、营养获取、衰老、行为和抗感染能力等方面均产生影响[6]。然而目前对微生物如何影响宿主的行为研究甚少,亟待深入研究。
野生和实验室饲养的果蝇体内共同含有20多种微生物,主要为醋酸杆菌属Acetobacter和乳杆菌属Lactobacillus[7]。东方醋杆菌为变形杆菌门一种好氧菌,而短小乳杆菌为厚壁菌门一种兼性厌氧菌[8]。腐烂食物表面通常富含氧气,可以满足好氧菌的生长和繁殖。在内部,氧气被细菌逐渐消耗,变为少氧或无氧的环境。所以东方醋杆菌多分布在腐烂食物的表面,有利于其利用氧气进行生长和繁殖,同时不断消耗氧气,为厌氧菌创造生存和生长条件。而短小乳杆菌多分布在腐烂食物内部,在氧气匮乏的条件下,可以从好氧呼吸转变为厌氧呼吸[9]。因此,好氧菌和厌氧菌的分布存在着空间差异,氧气是一个影响该分布的重要非生物因子。对于原生生物来说,感应氧气的存在并迁移到更有利的环境,对其生存至关重要[10]。
生物氧气感知通路获得2019年诺贝尔生理学或医学奖。获奖者深刻地揭示了哺乳细胞感知和适应氧气变化,奠定了氧调节细胞代谢和生理功能的基础,也为抗击贫血、癌症和许多其他疾病的新策略铺平了道路。同理,微生物也可以感知氧气的变化而改变自身的代谢,甚至影响周围环境和生物。基于此,我们对微生物如何在氧气调控下影响果蝇行为却知之甚少。根据东方醋杆菌和短小乳杆菌对氧气需求不同的特性,利用双相选择产卵器,本文探讨氧气通过调控东方醋杆菌和短小乳杆菌生长而调节果蝇产卵偏嗜性,并进一步研究其作用机制及生物学意义。
1 材料和方法 1.1 果蝇品系和培养条件 野生型黑腹果蝇D. melanogaster品系为Oregon R (OR)和Canston S (CS)。突变体Orco2来自Bloomington果蝇品系库。突变体Orco2对绝大多数气味丧失感知[11]。果蝇常规饲养培养基为玉米-酵母培养基(酵母粉24 g/L,玉米粉70 g/L,蔗糖50 g/L,琼脂15 g/L,蒸馏水1 L)[12],为避免酵母对果蝇产卵行为的影响,利用水解酪蛋白代替酵母,其配方为:酪蛋白15 g/L,玉米粉70 g/L,蔗糖50 g/L,琼脂15 g/L,蒸馏水1 L[13]。所有果蝇均在温度25 ℃、相对湿度60%的条件下培养,光周期为12L:12D[5]。
无菌和悉生果蝇依次使用Walch消毒液、次氯酸和75%乙醇消毒,获得无菌卵,建立无菌体系(Germ free,GF)。在无菌体系基础上,于第二天在果蝇培养基中加入1 OD (约108 CFU)单株菌,建立悉生果蝇。两种果蝇的具体建立方法详见文献[14]。
1.2 主要试剂与仪器
1.2.1 试剂: 次氯酸钠(Sigma),Walch消毒液(威莱),无水乙醇(方正,≥99.7%)
1.2.2 仪器: 冷冻离心机(上海力申,Neofuge 13R),分光光度仪(岛津,UV-1800),真空机(Deli,14885),高压灭菌锅(松下,mLS-3781-PC)
1.3 菌株及体外培养
1.3.1 菌株: 东方醋杆菌(Acetobacter orientalis)和短小乳杆菌(Lactobacillus brevis)均源自西安的野生果蝇,由本实验室分离而得。
1.3.2 体外培养: 将东方醋杆菌按2.5%的比例注入AC培养基中,将短小乳杆菌按同等比例注入MRS肉汤培养基中,于35 ℃条件下培养。AC培养基配方为:甘露醇25 g/L,酵母提取物5 g/L,蛋白胨3 g/L,蒸馏水1 L。MRS肉汤培养基来自北京奥博星生物科技公司(AOBOX)。加热煮沸溶解,121 ℃条件下高压灭菌15 min。固体培养基为对应液体培养基添加1.5% (W/V)琼脂。
1.4 果蝇产卵行为检测 实验采用高度和直径分别为80 mm和60 mm的中空透明圆柱体产卵装置(图 1-A),底部嵌入可供产卵的培养皿[15]。培养皿中装有高压灭菌后的果蝇食物,均匀地分为两半,一侧为细菌发酵48 h后的食物(实验组),另一侧为加入等量水的食物(对照组)。每次实验收集20头雌果蝇和3– 5头雄果蝇于装置中,酵母膏育肥1 d,待果蝇产卵12 h后分别统计两侧卵的数量。产卵指数(OI)=(实验组卵数–对照组卵数)/(实验组卵数+对照组卵数)。
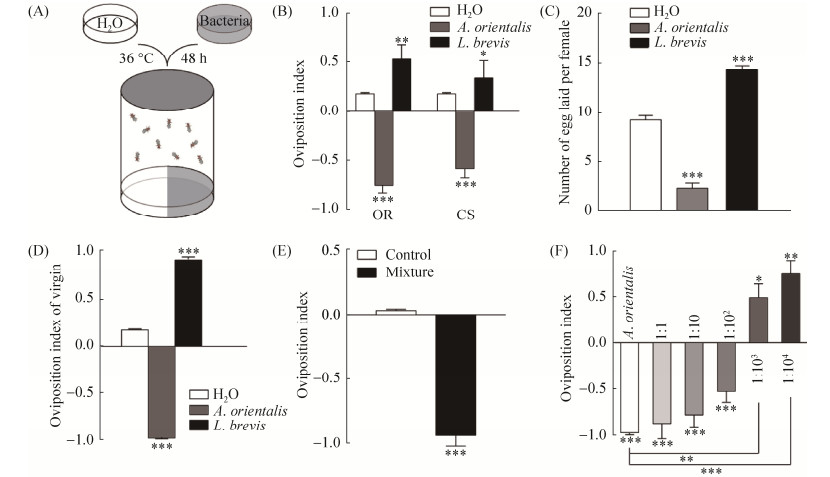 |
| 图 1 东方醋杆菌和短小乳杆菌的组合影响果蝇产卵选择 Figure 1 Effects of A. orientalis and L. brevis combination on the ovipositional decision of D. melanogaster. A: A diagram of the oviposition preference assay. The surface of fly diet was added with bacteria to generate a fermented diet for 48 ?h in the incubator, while the control was used with H2O. Egg-laying preference was assayed using a two-choice chamber. B: The quantification of ovipositional preference for fly food fermented by A. orientalis and L. brevis using wild-type Oregon R (OR) and Canston S (CS). C: Effect of A. orientalis and L. brevis on D. melanogaster fecundity. D: Effects of mating on Drosophila oviposition preference for A. orientalis and L. brevis. E: The ovipositional preference for the equal mixture of A. orientalis and L. brevis. F: The ovipositional preference for the mixtures of A. orientalis and L. brevis under aerobic conditions. Values represent mean±SEM. Single sample t-test. *: 0.01 < P < 0.05; **: 0.001 < P < 0.01; ***: P < 0.001 |
| 图选项 |
1.5 菌体细胞或代谢产物选择试验 用移液枪取1.5 mL菌液,60000 r/min离心3 min,取上清液并转移到新EP管中,即为代谢产物。用PBS洗涤菌体细胞3次,加入100 μL ddH2O,于–80 ℃冷冻,待其融化后再用液氮重复速冻1次,即为菌体细胞。将涂有上清液和菌体细胞的食物分别与对照食物构成双选择食物,检测果蝇的产卵偏嗜性。
1.6 氧气条件控制装置
1.6.1 液体培养: 将AC培养基和MRS肉汤培养基等量地分装,倒入200 mL发酵瓶或50 mL离心管中,向发酵瓶中通CO2气体1 min,重复3次后封口,构成无氧液体培养装置;由于离心管不完全密封,故而构成有氧液体培养装置。
1.6.2 固体发酵: 在固体食物表面加入100 μL细菌菌液(1 OD,细菌数量约为108 CFU)涂布后倒置放入充满CO2的真空密封袋中,封口,构成无氧发酵装置。
1.6.3 氧气浓度控制: 气体总体积为100 mL,按照实验所需的比例,用注射器向真空袋中通CO2,封口。在本实验中,将空气与二氧化碳比例分为4/0、4/1、3/2、2/3、1/4、0/4六组,空气中氧气约占21%,所对应的氧气浓度依次为21%、16.8%、12.6%、8.4%、4.2%、0%。本实验共抽取5管气体,分别按需要的比例抽注CO2和空气,保证各组气体总体积一致。
1.7 改变果蝇感觉器官
1.7.1 果蝇视觉对产卵选择性检测: :将雌果蝇置于完全黑暗的环境中,检测其产卵选择,并与光照环境中产卵选择比较。
1.7.2 果蝇味觉对产卵选择性检测: 果蝇味觉主要存在于初级味觉结构上,包括唇瓣、前足、翼缘和产卵器等[16]。利用黑腹果蝇前足手术,用解剖镊除去OR果蝇1/4前足(第一对胸足跗节),使其部分味觉感受器丧失,待果蝇恢复24 h后检测其产卵决策行为。
1.7.3 果蝇嗅觉对产卵选择性检测: 利用两种方式:(1)果蝇突变体Orco2对绝大多数气味丧失感知;(2)果蝇的嗅觉感受器主要存在于果蝇的触角中,摘除果蝇触角后,果蝇完全丧失嗅觉[17]。
1.8 存活率和发育历期 将果蝇放至涂有酵母膏的葡萄汁琼脂培养基上产卵,收集8 h内产的卵,分别放至无菌、有氧发酵和无氧发酵的食物上,每日记录果蝇成蛹和羽化成虫的数量(n=40),以及每组各自成蛹和羽化的平均时间。存活率=成蛹或羽化的数目/40×100%。
1.9 数据分析 使用Excel软件整理分析数据,计算平均值(Mean)与标准误(SEM),对各处理组间的差异进行t检验分析(Student t-test)。相关图的制作在Graphpad和Adobe Illustrator软件中完成。
2 结果和分析 2.1 东方醋杆菌和短小乳杆菌的组合影响果蝇产卵选择 研究表明,细菌可以改变果蝇的产卵选择[18]。本实验采用产卵双相选择装置探究两种菌对果蝇产卵的影响(图 1-A)。为排除遗传背景的干扰,使用OR和CS两种果蝇品系。结果表明,果蝇对东方醋杆菌和短小乳杆菌分别表现为产卵趋避和趋向性(图 1-B),产卵指数(OI)分别为–0.76和0.5,并且两种品系的果蝇结果类似。在单选择产卵装置中,每头雌性果蝇在对照食物、东方醋杆菌和短小乳杆菌食物上的平均产卵量分别为9.3粒、2.3粒和14.4粒(图 1-C),进一步说明东方醋杆菌抑制果蝇产卵,而短小乳杆菌促进果蝇产卵。处女蝇对东方醋杆菌和短小乳杆菌的产卵指数分别为–0.97和0.93 (图 1-D),说明果蝇的产卵选择行为不受交配行为的影响。
两种细菌产生了相反的产卵偏嗜性,故将两种菌混合,模拟自然界混合菌对果蝇产卵选择的影响。两种菌1:1混合后,果蝇表现出产卵避性,OI为–0.94 (图 1-E),表明果蝇对东方醋杆菌的产卵避性大于对短小乳杆菌的产卵趋向性。随着短小乳杆菌浓度逐渐提高,果蝇的产卵避性逐渐降低,直至短小乳杆菌的数量为东方醋杆菌的103倍时,果蝇表现为产卵趋向性(图 1-F)。上述结果说明,细菌种类和比例最终决定了果蝇的产卵选择。
2.2 氧气改变果蝇对混合细菌的产卵偏嗜性 东方醋杆菌和短小乳杆菌分别为好氧菌和厌氧菌,所以推测氧气可作为一个非生物因子间接改变果蝇产卵偏嗜性。与有氧环境下的结果相反,果蝇对无氧培养的东方醋杆菌和短小乳杆菌分别表现出产卵趋向性和产卵避性,OI分别为0.31和–0.77 (图 2-A)。与图 1-F相比,无氧培养的混合菌逆转了果蝇产卵偏嗜性,并且其趋向性随短小乳杆菌浓度的升高而逐渐降低。当短小乳杆菌的数量为东方醋杆菌的105倍时,果蝇产卵转变为趋避性(图 2-B),说明氧气可作为一个重要因子改变混合菌对果蝇产卵选择的影响。
为此进一步探究不同氧气浓度下细菌对果蝇产卵偏嗜性的影响,采用前述方法将空气与CO2按不同比例混合。结果显示,果蝇对东方醋杆菌的产卵避性随氧气浓度的减少而逐渐降低,直至转变为无氧条件下的产卵趋向性(图 2-C)。同理,果蝇对短小乳杆菌的产卵趋向性逐渐减弱,随着O2浓度进一步地降低,这种产卵趋避性更加明显(图 2-D)。综上,随着O2浓度的降低,果蝇对东方醋杆菌的产卵避性和对短小乳杆菌的产卵趋向性逐渐降低甚至逆转(图 2-C和D)。
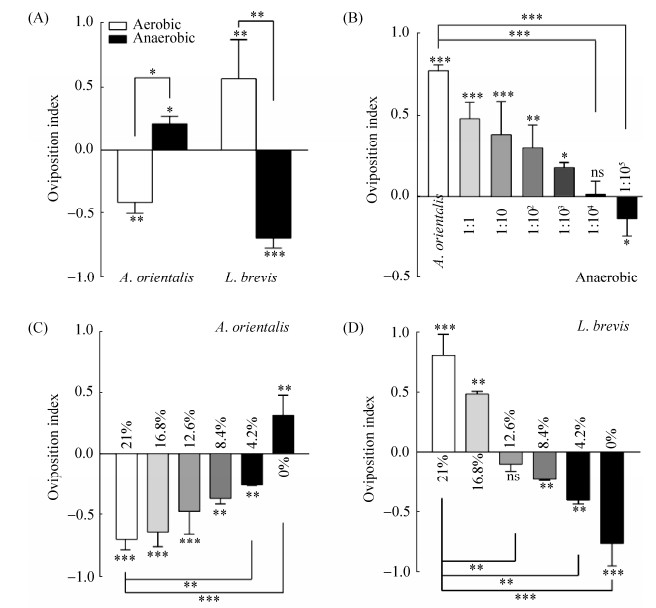 |
| 图 2 氧气改变果蝇对混合细菌的产卵偏嗜性 Figure 2 Oxygen affects the oviposition preference of Drosophila to combined bacteria. A: The oviposition preference of D. melanogaster to A. orientalis and L. brevis was changed by anaerobic fermentation. B: The two bacteria mixed in different proportions affected the ovipositional preference of Drosophila. C: The Drosophila oviposition preference for fly food fermented with A. orientalis under different oxygen concentrations. D: The Drosophila oviposition preference for fly food fermented with L. brevis under different oxygen concentrations. Values represent mean±SEM. ns: P > 0.05; *: 0.01 < P < 0.05;**: 0.001 < P < 0.01; ***: P < 0.001 |
| 图选项 |
2.3 氧气影响细菌生长 生物的基本代谢过程需要O2,其在ATP形成过程中充当电子受体[19]。氧气可作为非生物因子而影响细菌,从而间接地影响果蝇的产卵选择,为此进一步验证氧气可影响东方醋杆菌和短小乳杆菌的生长。结果显示,东方醋杆菌在有氧条件下生长迅速,OD峰值为1.3,而在无氧条件下生长缓慢,OD峰值为0.4 (图 3-A)。短小乳杆菌有别于东方醋杆菌,在有氧与无氧条件下OD峰值均为2.2 (图 3-D)。为了探究细菌在固体食物中的生长情况,涂板计数细菌数量(colony-forming units,CFU)。随着时间延长,东方醋杆菌有氧组的数量显著多于无氧组(图 3-B),而短小乳杆菌在有氧与无氧条件下数量相当(图 3-E),说明好氧菌东方醋杆菌需要氧气才能生长,而短小乳杆菌的生长不完全依赖于氧气。细菌的生长一般伴随着有机酸的产生,结果显示,东方醋杆菌在有氧条件下pH显著地降低,并且很快低于无氧培养的pH值(图 3-C),而短小乳杆菌在有氧与无氧条件下pH曲线降低类似(图 3-F)。综上所述,氧气是东方醋杆菌生长必需的条件,是短小乳杆菌生长非必需的条件。
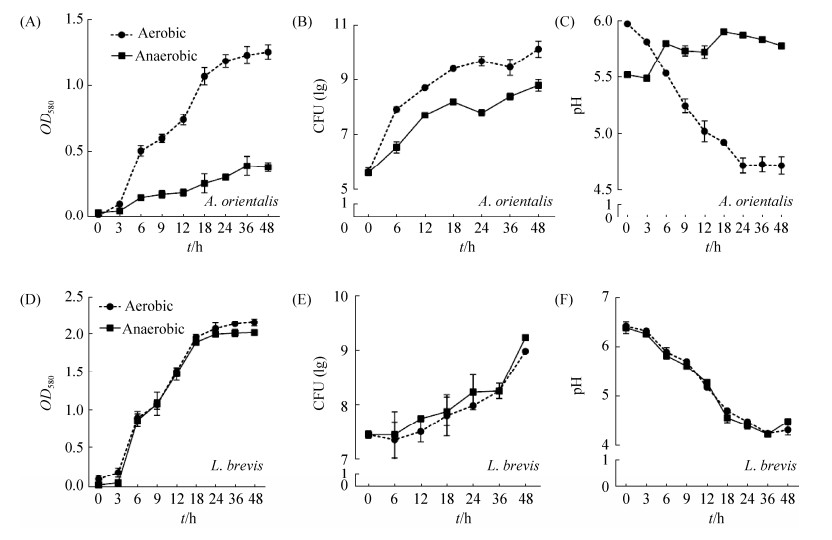 |
| 图 3 氧气影响细菌生长 Figure 3 Effects of oxygen on bacterial growth. A, D: OD value of A. orientalis and L. brevis under aerobic and anaerobic conditions. B, E: Colony-Forming Units (CFU) of A. orientalis and L. brevis in solid medium under aerobic and anaerobic conditions. C, F: pH value of A. orientalis and L. brevis under aerobic and anaerobic conditions. Values represent mean±SEM |
| 图选项 |
2.4 细菌代谢产物影响果蝇产卵偏嗜性 细菌对果蝇产卵偏嗜性的影响可能源于两个方面:细菌细胞和细菌代谢产物。为此,分别检测果蝇对菌体细胞本身和细菌代谢产物的产卵偏嗜性。结果显示,在有氧和无氧条件下,雌果蝇产卵对两种细菌细胞均不表现出偏嗜性(图 4-A和B),说明果蝇对东方醋杆菌和短小乳杆菌的产卵选择并非源于细菌细胞自身。进一步探究这种产卵行为是否来自细菌所产生的代谢产物。结果表明,有氧条件下,雌果蝇对东方醋杆菌代谢产物表现出产卵趋避性(图 4-A),对短小乳杆菌代谢产物表现出产卵趋向性(图 4-B);无氧条件则正好相反。这与上述实验结果一致,说明果蝇对东方醋杆菌和短小乳杆菌的产卵选择来自于它们的代谢产物。
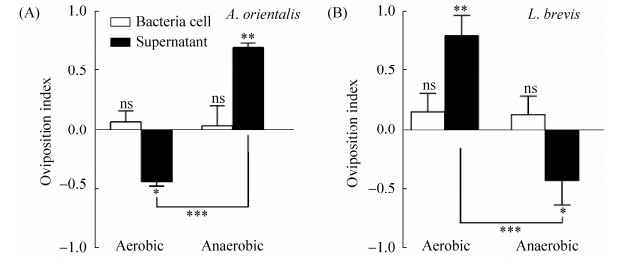 |
| 图 4 细菌代谢产物影响果蝇产卵偏嗜性 Figure 4 Effects of bacterial metabolites on Drosophila oviposition preference. A: The egg-laying preference of Drosophila to A. orientalis cells and its metabolites under aerobic and anaerobic conditions. B: The preference of Drosophila to L. brevis cells and its metabolites under aerobic and anaerobic conditions. Values represent mean±SEM. ns: P > 0.05; *: 0.01 < P < 0.05; **: 0.001 < P < 0.01; ***: P < 0.001 |
| 图选项 |
2.5 嗅觉系统介导黑腹果蝇的产卵选择 果蝇可通过多种感官来感知外界环境[13]。本实验通过改变果蝇的视觉、味觉和嗅觉感官来检测介导果蝇产卵行为的感觉系统。为检测视觉效应的影响,在自然光环境和完全黑暗的环境中分别进行产卵测试。结果表明,黑暗处理组与自然光处理组在有氧(图 5-A和C)和无氧(图 5-B和D)条件下均无明显差异。果蝇前腿含有丰富的味觉感受器,能感受味觉刺激。摘除果蝇1/4前腿以探究味觉系统的影响。结果显示,摘除前腿组与对照组在有氧(图 5-A和C)和无氧(图 5-B和D)条件下均无显著差异。说明视觉系统和味觉系统不影响果蝇对两种菌的产卵选择。Orco2突变体失去了对绝大多数气味的感知能力[11]。结果显示,Orco2突变体与OR果蝇存在差异(0.01 < P < 0.05)。果蝇的嗅觉感受器主要存在于触角中[17],摘除果蝇触角后,果蝇完全丧失嗅觉。结果显示,摘除触角后,有氧组果蝇对东方醋杆菌的产卵避性反应完全消失(P < 0.001)(图 5-A),对短小乳杆菌表现为产卵趋避性(P < 0.01)(图 5-C)。上述结果说明嗅觉系统介导果蝇对东方醋杆菌和短小乳杆菌的产卵偏嗜性。
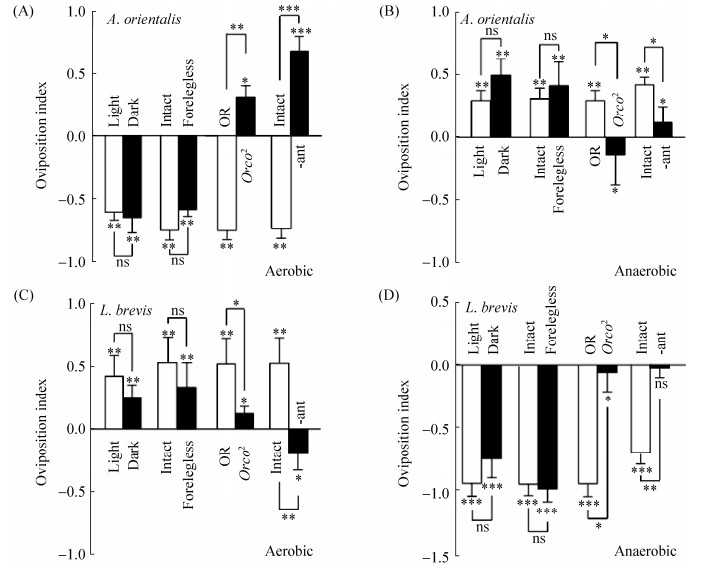 |
| 图 5 嗅觉系统介导黑腹果蝇的产卵选择 Figure 5 The olfactory system mediated oviposition preference of Drosophila melanogaster. A–D: Screening of candidate sensory modalities for oviposition decision for fermentation. For vision, WT flies in darkness were used; for olfaction, abactinal females (-ant) and Orco2 mutants were used for gustation, the forelegs that contain gustatory sensilla were surgically ablated. Data in the figure are mean±SEM. Single sample t-test. ns: P > 0.05; *: 0.01 < P < 0.05; **: 0.001 < P < 0.01; ***: P < 0.001 |
| 图选项 |
2.6 东方醋杆菌和短小乳杆菌对果蝇后代存活率和发育历期的影响 雌果蝇选择合适的地点产卵,以提高后代存活率和适应性[17]。为此,本实验观察细菌对果蝇蛹和成虫发育的影响。结果表明,与对照组相比,东方醋杆菌和短小乳杆菌显著地提高了果蝇的成蛹率和成虫率(图 6-A和D),明显地缩短了成蛹和成虫的发育时间(图 6-B和E),说明这两种菌可提高果蝇适合度和促进果蝇的生长。然而,有氧组和无氧组并无明显差异(图 6-A,B,E和D)。据此推测,果蝇幼虫的翻动解除了厌氧条件对东方醋杆菌的生长限制,并且迅速增加食物载菌量,满足了果蝇的发育生长需求。结果与预期一致,果蝇幼虫快速地增加了无氧组东方醋杆菌数量(图 6-C),而不能再增加无氧组短小乳杆菌数量(图 6-F)。
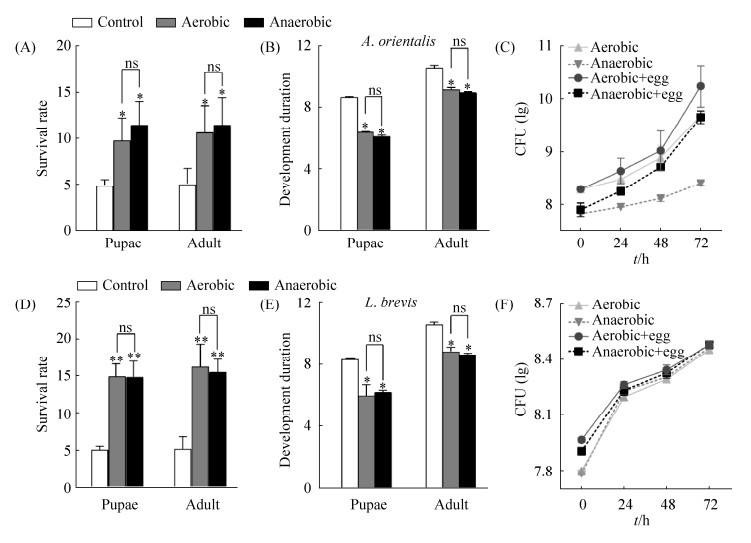 |
| 图 6 东方醋杆菌和短小乳杆菌对果蝇后代存活率和发育历期的影响 Figure 6 Effects of A. orientalis and L. brevis on the survival rate and development duration of Drosophila offspring. A, D: A. orientalis and L. brevis promoted the survival rate of pupae and adult. B, E: A. orientalis and L. brevis shortened the development duration of pupae and adult. C: Drosophila larvae and A. orientalis synergized to reshape the anaerobic environment. F: Drosophila larvae and L. brevis synergized to reshape the anaerobic environment. Data in the figure are mean±SEM. ns: P > 0.05; *: 0.01 < P < 0.05; **: 0.001 < P < 0.01 |
| 图选项 |
3 讨论 自然界或生物体内共生的微生物能够影响宿主的多种行为,包括交配和产卵行为[20]。选择合适的繁殖地点对生物种群的延续至关重要,雌性果蝇会选择在后代存活率最高的地方产卵[21]。本研究发现,有氧条件下,黑腹果蝇对东方醋杆菌和短小乳杆菌分别具有产卵避性和产卵趋向性(图 1)。改变细菌所处的氧气环境可改变甚至逆转果蝇对细菌的产卵偏嗜性(图 2)。氧气作为一个非生物因素,直接影响菌群的分布与生长代谢。微生物群多为好氧和厌氧菌,微生物群和氧化化学反应都调节菌落内的氧水平,从而影响整个微生物群落的组成和分布[22]。东方醋杆菌仅在有氧环境下才能很好地生长,而短小乳杆菌在有氧和无氧条件下均能很好地生长(图 3)。东方醋杆菌分布于含氧丰富的生态部位,以氧为末端电子受体,将乙醇和糖转化为相应的醛类、酮类和有机酸[23]。而短小乳杆菌在缺氧或少氧条件下可以转变为无氧代谢[9],代谢的变化使之能耐受低氧胁迫,有机酸含量也随之变化[24]。缺氧诱导细胞凋亡,也触发适应机制,以确保细胞存活[25]。上述结果表明,氧气可作为一个重要因子,通过控制细菌的生长而调控果蝇的产卵选择。因此,控制氧气环境供应有助于微生物群维持宿主的正常状态。
生物通过多种感官来感知外界环境[26],并识别和躲避潜在的危险,从而提高种群的存活率和生存能力[27]。雌果蝇利用感觉器官来感知食物以及其他有害物种的存在,从而选择最佳的产卵地点[28]。本实验发现,果蝇对东方醋杆菌和短小乳杆菌的产卵选择来自于它们的代谢产物(图 4),嗅觉系统介导这种产卵现象(图 5)。果实在微生物的作用下腐烂,并释放挥发性化学物质,黑腹果蝇对这些气味的感知和趋性使其成功定位腐烂果实[28]。在哺乳动物中,由微生物群的代谢产物调节着成年动物的新陈代谢和幼年动物的生长发育。在人体中,肠道微生物群通过调节适当的碳水化合物和脂质代谢来确保我们健康[8]。东方醋杆菌和短小乳杆菌作为共生菌,对果蝇的生长发育也有着重要的影响。本实验中,加入东方醋杆菌和短小乳杆菌后,果蝇后代的存活率显著提高,发育历期明显缩短(图 6)。我们推测:无氧条件只能抑制细菌生长,但不会杀死细菌,当细菌从无氧环境转移至有氧环境中后,被抑制的细菌又能快速生长。幼虫在生长的过程中,会不断地翻滚食物,从而解除厌氧条件对细菌的生长限制,并且迅速增加食物载菌量,满足了果蝇的发育生长需求。氧气条件影响着微生物的生长代谢,而微生物又进一步影响宿主及其后代的生长发育。
我们的研究结果表明,氧气作为一个调控因子,可通过影响细菌代谢以进一步调节宿主的产卵行为。本研究有利于推动果蝇行为学的发展,对肠道微生物相关研究有一定的借鉴意义。但有氧代谢和无氧代谢下具体的产物成分差异犹未可知,宿主与微生物相互作用的潜在分子机制尚不清楚[29]。同时,本研究基于2种细菌模拟的天然微生物群,然而天然微生物群成分和组成比例更加复杂和动态变化,代谢产物也更加复杂多样,所以影响果蝇产卵的因素会更多,需要进一步研究去解析。
References
| [1] | Hamby KA, Bellamy DE, Chiu JC, Lee JC, Walton VM, Wiman NG, York RM, Biondi A. Biotic and abiotic factors impacting development, behavior, phenology, and reproductive biology of Drosophila suzukii. Journal of Pest Science, 2016, 89(3): 605-619. DOI:10.1007/s10340-016-0756-5 |
| [2] | Yang CH, Belawat P, Hafen E, Jan LY, Jan YN. Drosophila egg-laying site selection as a system to study simple decision-making processes. Science, 2008, 319(5870): 1679-1683. DOI:10.1126/science.1151842 |
| [3] | Lee WJ, Brey PT. How microbiomes influence metazoan development:insights from History and Drosophila modeling of gut-microbe interactions. Annual Review of Cell and Developmental Biology, 2013, 29: 571-592. DOI:10.1146/annurev-cellbio-101512-122333 |
| [4] | Liu W, Jiang FF, Bi XL, Zhang YQ. Drosophila FMRP participates in the DNA damage response by regulating G2/M cell cycle checkpoint and apoptosis. Human Molecular Genetics, 2012, 21(21): 4655-4668. DOI:10.1093/hmg/dds307 |
| [5] | Gilbert DG. Dispersal of yeasts and bacteria by Drosophila in a temperate forest. Oecologia, 1980, 46(1): 135-137. DOI:10.1007/BF00346979 |
| [6] | Capo F, Charroux B, Royet J. Bacteria sensing mechanisms in Drosophila gut:Local and systemic consequences. Developmental & Comparative Immunology, 2016, 64: 11-21. |
| [7] | Cox CR, Gilmore MS. Native microbial colonization of Drosophila melanogaster and its use as a model of Enterococcus faecalis pathogenesis. Infection and Immunity, 2007, 75(4): 1565-1576. DOI:10.1128/IAI.01496-06 |
| [8] | Wong ACN, Vanhove AS, Watnick P. The interplay between intestinal bacteria and host metabolism in health and disease:lessons from Drosophila melanogaster. Disease Models & Mechanisms, 2016, 9(3): 271-281. |
| [9] | Marchant HK, Ahmerkamp S, Lavik G, Tegetmeyer HE, Graf J, Klatt JM, Holtappels M, Walpersdorf E, Kuypers MMM. Denitrifying community in coastal sediments performs aerobic and anaerobic respiration simultaneously. The ISME Journal, 2017, 11(8): 1799-1812. DOI:10.1038/ismej.2017.51 |
| [10] | West CM, Blader IJ. Oxygen sensing by protozoans:how they catch their breath. Current Opinion in Microbiology, 2015, 26: 41-47. DOI:10.1016/j.mib.2015.04.006 |
| [11] | Larsson MC, Domingos AI, Jones WD, Chiappe ME, Amrein H, Vosshall LB. Or83b encodes a broadly expressed odorant receptor essential for Drosophila olfaction. Neuron, 2004, 43(5): 703-714. DOI:10.1016/j.neuron.2004.08.019 |
| [12] | Shin SC, Kim SH, You H, Kim AC, Lee KA, Yoon JH, Ryu JH, Lee WJ. Drosophila microbiome modulates host developmental and metabolic homeostasis via insulin signaling. Science, 2011, 334(6056): 670-674. DOI:10.1126/science.1212782 |
| [13] | Li YJ, Su WZ, Zhu XF, Hui XL, Fan XG, Yao H, Chang XJ, Liu W. Isolation of Acetobacter orientalis and their promotion of the growth and development of Drosophila melanogaster. Acta Microbiologica Sinica, 2017, 57(10): 1536-1545. (in Chinese) 李玉娟, 苏琬真, 朱旭峰, 惠新琳, 樊晓光, 姚红, 常新剑, 刘威. 一株东方醋酸杆菌分离与其促进果蝇生长发育. 微生物学报, 2017, 57(10): 1536-1545. |
| [14] | Brummel T, Ching A, Seroude L, Simon LF, Benzer S. Drosophila lifespan enhancement by exogenous bacteria. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(35): 12974-12979. DOI:10.1073/pnas.0405207101 |
| [15] | Joseph RM, Devineni AV, King IFG, Heberlein U. Oviposition preference for and positional avoidance of acetic acid provide a model for competing behavioral drives in Drosophila. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(27): 11352-11357. DOI:10.1073/pnas.0901419106 |
| [16] | Ling F, Dahanukar A, Weiss LA, Kwon JY, Carlson JR. The molecular and cellular basis of taste coding in the legs of Drosophila. Journal of Neuroscience, 2014, 34(21): 7148-7164. DOI:10.1523/JNEUROSCI.0649-14.2014 |
| [17] | Chen Y, Amrein H. Enhancing perception of contaminated food through acid-mediated modulation of taste neuron responses. Current Biology, 2014, 24(17): 1969-1977. DOI:10.1016/j.cub.2014.07.069 |
| [18] | Liu W, Zhang K, Li EH, Xu HZ, Zhang C. Escherichia coli alters the oviposition preference in Drosophila. Acta Entomologica Sinica, 2017, 60(2): 173-179. (in Chinese) 刘威, 张珂, 李恩惠, 徐皓哲, 张策. 大肠杆菌改变果蝇产卵偏嗜性. 昆虫学报, 2017, 60(2): 173-179. |
| [19] | Wang GL, Jiang BH, Rue EA, Semenza RG. Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension. Proceedings of the National Academy of Sciences of the United States of America, 1995, 92(12): 5510-5514. DOI:10.1073/pnas.92.12.5510 |
| [20] | Sharon G, Sampson TR, Geschwin DH, Mazmanian SK. The central nervous system and the gut microbiome. Cell, 2016, 167(4): 915-932. DOI:10.1016/j.cell.2016.10.027 |
| [21] | Soto EM, Betti MIL, Hurtado J, Hasson E. Differential responses to artificial selection on oviposition site preferences in Drosophila melanogaster and D. simulans. Insect Science, 2015, 22(6): 821-828. |
| [22] | Friedman ES, Bittinger K, Esipova TV, Hou LK, Chau L, Jiang J, Mesaros C, Lund PJ, Liang X, FitzGerald GA, Goulian M, Lee D, Garcia BA, Blair IA, Vinogradov SA, Wu GD. Microbes vs. chemistry in the origin of the anaerobic gut lumen. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(16): 4170-4175. |
| [23] | Wang B, Shao YC, Chen FS. Overview on mechanisms of acetic acid resistance in acetic acid bacteria. World Journal of Microbiology and Biotechnology, 2015, 31(2): 255-263. |
| [24] | Vitor SC, Sodek L. Products of anaerobic metabolism in waterlogged roots of soybean are exported in the xylem. Plant Science, 2019, 284: 82-90. DOI:10.1016/j.plantsci.2019.03.023 |
| [25] | Martorell L, Gentile M, Rius J, Rodríguez C, Crespo J, Badimon L, Martínez-González J. The hypoxia-inducible factor 1/NOR-1 axis regulates the survival response of endothelial cells to hypoxia. Molecular and Cellular Biology, 2009, 29(21): 5828-5842. DOI:10.1128/MCB.00945-09 |
| [26] | O'Farrell F, Kylsten P. A mis-expression study of factors affecting Drosophila PNS cell identity. Biochemical and Biophysical Research Communications, 2008, 370(4): 657-662. DOI:10.1016/j.bbrc.2008.04.030 |
| [27] | Kacsoh BZ, Lynch ZR, Mortimer NT, Schlenke TA. Fruit flies medicate offspring after seeing parasites. Science, 2013, 339(6122): 947-950. DOI:10.1126/science.1229625 |
| [28] | Billeter JC, Wolfner MF. Chemical cues that guide female reproduction in Drosophila melanogaster. Journal of Chemical Ecology, 2018, 44(9): 750-769. DOI:10.1007/s10886-018-0947-z |
| [29] | Sommer F, B?ckhed F. The gut microbiota-masters of host development and physiology. Nature Reviews Microbiology, 2013, 11(4): 227-238. DOI:10.1038/nrmicro2974 |
