张鹏#, 王龙#, 谢明杰


辽宁师范大学生命科学学院, 辽宁省生物技术与分子药物研发重点实验室, 辽宁 大连 116081
收稿日期:2018-09-28;修回日期:2018-12-15;网络出版日期:2019-03-11
基金项目:辽宁省教育厅科学研究一般项目(L201683675);辽宁省自然科学基金(201602462)
*通信作者:谢明杰, Tel:+86-411-85827188, E-mail:xmj1222@sina.com.
#并列第一作者
摘要:无机磷酸盐(Pi)在菌体遗传、能量代谢及细胞内的信号传导等生物过程中发挥重要的作用。在细菌中,主要由磷酸盐特殊转运系统(Pst)和磷酸盐转运系统(Pit)来完成对Pi的吸收和利用。其中,Pst是在低磷胁迫下转运Pi的关键系统。近年来的研究表明,Pst系统除在调控Pi的代谢和平衡中发挥重要作用外,还介导细菌耐药、产毒和侵袭等。Pst系统是ABC转运蛋白家族的一种,一般由PstS、PstC、PstA、PstB和PhoU 5个蛋白组成。其中,PstS和PstB蛋白是该系统中的关键蛋白。本文重点对PstS和PstB调控Pi转运和介导细菌耐药的分子机制进行综述,旨在为深入研究该系统与细菌耐药的关系,以及研发以PstS和PstB为靶点的新药提供参考。
关键词:磷酸盐特殊转运系统PstS蛋白PstB蛋白耐药机制
Regulating inorganic phosphate transport and mediating bacterial resistance by PstS and PstB
Peng Zhang#, Long Wang#, Mingjie Xie


Key Laboratory of Biotechnology and Drug Discovery of Liaoning Province, College of Life Sciences, Liaoning Normal University, Dalian 116081, Liaoning Province, China
Received: 28 September 2018; Revised: 15 December 2018; Published online: 11 March 2019
*Corresponding author: Mingjie Xie, Tel:+86-411-85827188, E-mail:xmj1222@sina.com.
Foundation item: Supported by the Liaoning Provincial Department of Education General Scientific Research Project (L201683675) and by the Liaoning Natural Science Foundation Project (201602462)
#These authors contributed equally to this work
Abstract: Inorganic phosphate (Pi) plays an important role in the biological processes such as bacterial heredity, energy metabolism and intracellular signaling. Two major bacterial Pi import systems exist in bacteria, Pst and Pit. The Pst system is highly efficient at transporting Pi, particularly in cells growing under low-Pi concentrations. In recent years, studies have found that in addition to regulating metabolism and balance of Pi, Pst system also mediates drug resistance, toxicity and invasion of bacteria. The Pst system is a member of the ABC transporter family, generally consists of five distinct proteins of PstS, PstC, PstA, PstB and PhoU. Among them, PstS and PstB are key proteins in the Pst system. This article reviews the molecular mechanisms of Pi transport and bacterial resistance of PstS and PstB, and the relationship between Pst system and bacterial resistance as well as PstS/PstB-targeted development to manufacture new drug.
Keywords: phosphate special transport systemPstS proteinPstB proteinresistance mechanism
磷的吸收和利用在生物体遗传、能量代谢、细胞膜的完整性和细胞内信号传递等生物过程中发挥着重要的作用。在长期的进化过程中,生物体形成了复杂的磷酸盐系统来调控磷元素的代谢和平衡[1-2]。在细菌中,主要由磷酸盐特殊转运系统(phosphate specific transport,Pst)和磷酸盐转运系统(Pi transport,Pit)来完成对无机磷酸盐(inorganic phosphates,Pi)的吸收和利用,其中Pst系统是Pi吸收转运的关键系统[3]。该系统是细菌在低Pi环境下,以高亲和力结合Pi,并将其转运至细胞质内的磷酸盐转运系统。它是ABC转运蛋白家族的一种,具有ABC转运家族蛋白的典型特征。包含3个结构域,分别是底物结合结构域、跨膜结构域和ATP结合结构域。在E. coli等大部分细菌中,Pst系统一般由PstS、PstC、PstA、PstB和PhoU 5个蛋白组成。其中,PstS为外周结合蛋白,该蛋白与Pi具有极高的亲和性,负责感知和结合周质空间的Pi;PstC和PstA为整合膜蛋白,其功能是在细胞膜上构成转运Pi的跨膜通道;PstB为ATP结合蛋白,位于胞质侧,是ATP的结合位点,其功能是水解ATP,释放能量,为Pi的转运提供动力。PhoU是位于细胞质内的调控蛋白,在Pi转运过程中发挥负调控作用。有研究显示,该蛋白也参与Pi的运输过程[4-5]。但在少部分细菌的Pst系统中尚未发现有PhoU蛋白[6]。近年来的研究结果显示,Pst系统除参与细菌的Pi转运外,在介导细菌耐药、产毒和侵袭等方面也发挥着重要的调节作用[7]。如,AVI Neznansky等的研究结果显示,当将pstS基因敲除后,可显著降低生物被膜(biofilm,BF)的形成能力或通过降低hilA等侵袭基因的表达量,来减轻致病菌对宿主细胞的感染[8-9]。Chakraborti等的研究结果显示,PstB蛋白表达量的增加,能显著增强结核分枝杆菌(M. tuberculosis)对氟喹诺酮的抗性。与对照组相比,该菌对药物的最低抑菌浓度从0.5 μg/mL提高到了64 μg/mL[10]。鉴于PstS和PstB在Pst系统中的重要作用,本文对这两种蛋白的结构及其在调控Pi转运和介导细菌耐药的分子机制进行综述,旨在为深入研究Pst系统与细菌耐药的关系,以及研发以PstS和PstB为靶点的新药提供参考。
1 PstS和PstB蛋白结构 1.1 PstS蛋白结构 PstS蛋白是由332个氨基酸残基组成的多肽链,由pstS基因编码,相对分子质量为35.1 kDa,等电点为8.99,其功能主要是结合周质空间的Pi。该蛋白包括2个相似的球状结构域和一个磷酸盐结合位点。其中,2个球状结构域是PstS蛋白的基本骨架,共由12个α螺旋和11个β折叠组成,中间以双铰链连接。磷酸盐结合位点是PstS蛋白的活性中心,位于2个球状结构域中间。该结合位点由10个氨基酸组成,与球状结构域中的1, 2, 6-α螺旋的N末端相连,可通过氢键和疏水作用与非溶剂化的Pi结合[11]。
不同菌株的PstS蛋白的结构大致相同,其不同之处主要是PstS蛋白N端环状结构的有无。已有的研究结果显示,G+一般含有该环状结构,而G–一般缺失。但有研究表明,绿脓假单胞菌(Pseudomonas aeruginosa,PA) PstS蛋白的N端含有该环状结构,且该结构在BF的形成起着至关重要的作用。当将DelN′基因敲除后,其BF的生物量降低了62%。但该环状结构的有无对PstS结合Pi没有影响[8]。
1.2 PstB蛋白结构 PstB蛋白是由2个相同的核苷酸结合域(nucletide binding domain,NBD)组成的二聚体,由pstB基因编码(图 1)。该蛋白由400个氨基酸残基长多肽链组成,相对分子质量为30 kDa,等电点为6.5[12]。PstB作为Pst系统的能量中心,其功能的发挥与NBD对ATP的结合和水解密切相关。每个NBD包括RecA-like亚结构域和螺旋亚结构域。RecA-like亚结构域是ATP的结合核心,主要是结合并稳定ATP分子,以及参与ATP的水解。包括序列都十分保守的Walker A和Walker B两个模体以及A和H两个环(loop)区。其中,Walker A模体含有一个保守的赖氨酸,该模体可通过赖氨酸的酰胺基及侧链的氨基与ATP的α、β、γ磷酸基团之间的静电作用来结合ATP;Walker B模体含有一个保守的天冬氨酸,该模体通过天冬氨酸来定位镁离子,并且在镁离子的介导下通过氢键结合ATP。A环包含一个高度保守的芳香族残基(通常是酪氨酸),其功能主要是稳定Walker A和Walker B两个模体对ATP的结合。H环包含一个保守的组氨酸,其功能主要是将催化ATP水解所需要的氨基酸残基、水分子和镁离子连接起来,形成一个催化活性中心。α-螺旋亚结构域是ABC转运蛋白特有的特征性模体,其功能与ATP水解偶联底物跨膜转运有关,主要是将ATP水解释放的能量传递到跨膜结构域(transmembrane domain,TMD)[13]。该结构域含有ABC Signature模体,位于α-螺旋的N端,其功能主要是使该段螺旋的偶极矩接近ATP的γ-磷酸基团,影响ATP的结合和水解[14]。Schmees等的研究结果显示,当ABC Signature模体发生突变后,与对照组相比,突变体菌株水解ATP的活性下降了70%[15]。
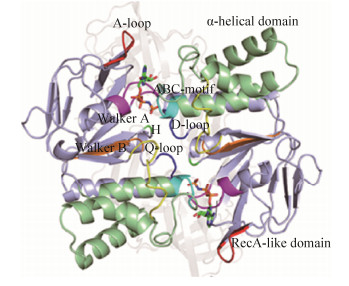 |
| 图 1 PstB蛋白结构示意图 Figure 1 The structural representation of PstB protein. Prasinous: α-helical domain; dusty blue: RecA-like domain; red: A-loop; rosy: Walker A; orange: Walker B; blue: D-loop; green: H-loop; light blue: ABC motif; yellow: Q-loop |
| 图选项 |
两个NBD间由Q-环和D-环连接。其中Q环由非常保守的8个氨基酸组成,在Q环的N端含有1个谷氨酸,与ATP的γ磷酸相结合。Q环可与Walker A、Walker B和H环形成一个腔隙,ATP分子位于其中。D环由6个保守的氨基酸组成,D环和ABC Signature模体形成的腔隙与另一个NBD中的Walker A、Walker B、H环和Q环形成的腔隙,组成一个“ATP三明治”结构,以增强ATP自由能的释放,促进底物的转运[16]。
2 PstS调控磷转运和介导细菌耐药的机制 2.1 PstS调控Pi转运的机制 大量研究表明,细菌的信号转导通路都是利用磷酸转移的机制进行传导,这样的信号转导系统称为双组分调控系统。大肠杆菌的双组分调控系统由磷酸盐敏感受体激酶(histidine kinase,PhoR)和转录激活应答元件(response regulator,PhoB)两部分组成,该系统可通过感知环境中磷离子水平的变化来调控下游基因的表达,进而促进或抑制Pi的吸收[17-18]。其中,PhoR是负责检测胞外环境Pi浓度的感应原件,由细胞外结构域、跨膜结构域以及细胞质结构域组成,其末端的氨基酸与细胞膜相连。PhoB是摄取Pi的应答原件,一般位于细胞质内,其C端含有与DNA结合的保守结构域。pstS基因是Pho Regulon的下游基因,其编码的PstS蛋白是Pi的高亲和受体,主要负责外界Pi的摄取,是Pst系统中Pi转运的第一步,参与对外界Pi浓度的感知以及对PhoR活性的调控。当外界的Pi浓度较高时,Pst系统中的PstSCAB可通过PhoU与PhoR形成复合物,阻止PhoR组氨酸激酶的自磷酸化,使其不能将磷酸化基团转移给PhoB,并通过抑制Pho Regulon相关基因(pstS和pstB等)的表达,阻碍细菌对Pi的摄取[19]。杨雪等的研究结果表明,当溶磷菌wjl (phosphorus solubilizing bacteria)处于高浓度的Pi环境时,PstS蛋白的表达量大幅降低,与Pi的结合率降低,与低浓度的Pi环境相比,降低了88.2%[6]。当外界Pi浓度较低时,PstSCAB和PhoU复合物与PhoR蛋白分离,PhoR自身的组氨酸磷酸化,并将产生的磷酸化基团转移到PhoB上。磷酸化的PhoB与Pho box (由2个保守的7-bp核苷酸重复单元和1个不保守的4-bp核苷酸单元组成)的DNA特定序列结合后,可募集RNA聚合酶,并通过与RNA聚合酶δ70亚基发生相互作用,来调控磷酸盐调节单元(Pho Regulon)中至少31个基因的转录,如,编码高亲和力的转运复合物(pstSCAB-phoU)以促进细菌对Pi的摄取[20](图 2)。Neznasky等的研究结果显示,PA的pstS基因敲除后,其对磷的结合能力很弱或不能与磷结合,使菌株一直处于Pi饥饿的状态。其中,在1 μm Pi的条件下,pstS基因敲除株与Pi的结合率较野生型菌株相比下降了约90%[8]。Luz等表明,肺炎链球菌(Streptococcus pneumoniae) pstS基因的缺失也会大幅度减少该菌对Pi的摄取。与对照菌株相比,pstS基因缺失菌株对Pi的摄取能力下降了约45%[21]。丙酮丁醇梭菌(Clostridium acetobutylicum)pstS基因的表达量增加后可促进菌体对Pi的吸收[22]。
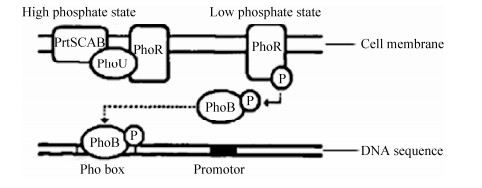 |
| 图 2 大肠杆菌PhoR/PhoB双组分系统调节模式 Figure 2 Two-component system regulation mode of E. coli PhoR/PhoB |
| 图选项 |
2.2 PstS介导细菌耐药的机制 已有的研究结果表明,细菌的主动外排系统和BF的形成是导致细菌产生多重耐药的主要原因。目前认为,PstS主要是通过影响细菌生物被膜的形成来介导细菌耐药。Neznansky等的实验结果显示,当将PA菌株的pstS基因敲除后,该菌株形成BF的能力显著降低。与野生型菌株相比,pstS基因敲除株形成BF的量减少了74%[8]。May等的生物膜微滴定结果显示,奇异变形杆菌HI4320 (Proteus mirabilis HI4320)的pstS基因发生突变后,pstS基因突变株产生的菌落数较野生型菌株相比减少了约87%,形成BF的量由野生型菌株的1.21 μm3/μm2降低至0.04 μm3/μm2,厚度由25 μm降低至5.63 μm[7]。上述研究结果表明,PstS能通过促进BF的形成来介导细菌耐药。
关于PstS影响BF形成的分子机制,一种观点认为,PstS可通过感知外界Pi浓度的变化,作为一种信号来调控PhoB/R双组分系统,进而影响BF的形成。Monds等的研究表明,在低Pi浓度情况下,铜绿Pfo-1的PstSCAB和PhoU形成的复合物与PhoR蛋白分离,通过激活PhoB/R双组分调控系统,可降低c-di-GMP的水平[23]。LapA蛋白是BF形成初期的重要粘附蛋白,其主要作用为介导细菌和物质表面之间的接触、粘附。该蛋白受c-di-GMP水平调控,当c-di-GMP的水平降低时,LapA蛋白表达量减少,从而影响BF的形成[24-25]。但在外界Pi浓度较高时,PhoB/R双组分系统被抑制,c-di-GMP水平提高,LapA蛋白表达量增加,可促进BF的形成。另一种观点认为,PstS是作为粘附素的组成成分之一,通过增加或减少其表达量,来影响BF的形成,与PstS和Pi的结合与转运无关。Yarden等发现,PA的耐药株可分泌大量的PstS蛋白,在BF形成的粘附阶段发挥重要作用。当将pstS基因被敲除后,因不能合成大量的粘附素,使BF的形成受到抑制。当将PA14菌株中的pstS基因过表达后,其所产生的粘附素的量约是对照组菌株的5倍,能促进BF的形成[26-27]。本实验室利用iTRAQ技术检测了染料木素对MRSA41577蛋白表达的影响,实验结果显示,染料木素作用MRSA41577菌株16 h后,与对照组相比,PstS蛋白的表达量下降了约0.51倍。也有****认为,PstS对BF形成的影响是上述两种分子机制的组合[8]。
3 PstB调控Pi转运和介导细菌耐药的机制 3.1 PstB调控Pi转运的机制 PstB蛋白是位于胞内的ATP结合蛋白,其实质上是一个ATP酶,在磷的转运过程中,其主要作用是结合并水解ATP,通过能量变化来促进或抑制Pst系统对Pi的摄取和转运。PstB蛋白具有保守的核苷酸结合位点,由pstB基因编码,也受双组分系统的调控。当pstB基因发生突变后,其水解ATP的能力下降,整个系统转运磷的能力也显著降低。Cox等的研究结果表明,PstB蛋白模体上的两个关键氨基酸残基(Gly-48和Lys-49)是Pi转运所必需的。当对PstB的两个关键氨基酸残基进行定点诱变后(Gly-48→Ile、Lys-49→Gln),突变株对Pi的摄取率与野生型菌株相比下降了约96%[28]。肺炎链球菌的pstB基因发生突变后,在不同的Pi浓度下,均可降低其对Pi的摄取。其中,在Pi的浓度为30 mmol/L时,pstB基因突变株与对照组相比,对磷的摄取率减少了约70%[29]。Sarin等的研究结果显示,将结核分枝杆菌D188K的pstB基因突变后,该突变株几乎不表现任何ATP酶的活性。其中,在0.5 mmol/L ATP的条件下,pstB基因突变株水解ATP的活性较野生型菌株相比下降了约88%[30]。
3.2 PstB介导耐药的机制 关于PstB介导细菌耐药的作用机制,目前认为主要作为能量源介导细菌耐药。即PstB与PstS、PstA、PstC形成一个ATP结合盒转运子,通过水解ATP作为能量源将PstS识别的底物泵出胞外,使胞内的药物浓度降低,导致细菌耐药[31]。PstB蛋白的表达受pstB基因调控,当pstB的表达量增加时,细菌的耐药性增强,反之,耐药性减弱。王前等的研究结果显示,高耐氧氟沙星的结核分枝杆菌的pstB基因转录水平比对照组高16倍[32]。在耐氟喹诺酮的耻垢分枝杆菌(Mycobacterium smegmatis)中,其pstB基因转录水平也比野生型菌株高。当将耻垢分枝杆菌的pstB基因敲除后,与野生型菌株相比,pstB基因敲除株对氟喹诺酮类药物的敏感性增加了2倍以上[10]。本实验室的研究结果显示,当染料木素作用MRSA41577菌株16 h后,pstB基因的表达量与对照组相比,下降了约51%,MRSA对氟喹诺酮类药物的敏感性显著增强。但也有****推测,PstB蛋白介导细菌耐药的原因,与PstB的过表达可以向菌体内转运更多的Pi,为细菌提供好的营养有关[32]。
4 展望 PstS和PstB蛋白除参与细菌Pi的吸收和转运外,在介导细菌耐药方面也发挥着重要作用。以往的研究主要集中在PstS和PstB蛋白调控Pi吸收和转运方面的作用机制,对其介导细菌耐药的研究相对较少。细菌耐药性是目前临床医学面临的严峻问题,其中,BF的形成和主动外排系统是导致细菌耐药的主要原因[33]。近年来的研究表明,PstS介导细菌耐药主要是通过调控PhoB/R双组分系统,降低c-di-GMP的水平,影响细菌BF的形成;PstB则是通过水解ATP所释放的能量,将药物泵出胞外来介导细菌耐药。由此推测,PstS和PstB蛋白可能是与细菌耐药相关蛋白。
新药开发的首要任务是寻找和确定分子药靶,目前,以多药耐药基因为代表的ABC转运体已成为筛选新药的靶点之一[34]。Pst系统是ABC转运蛋白家族的一种,具有ABC转运家族蛋白的典型特征,因此,以PstS和PstB为靶点可作为逆转细菌耐药的途径之一。但目前关于PstS和PstB介导细菌耐药的具体作用机制尚不明确,二者在调控Pi的转运和介导细菌耐药之间的交互作用及机制也不十分清楚,这些都有待于进一步深入的研究。此外,由于ATP是细胞内绝大多数生命活动的直接能源物质,而PstB是一种ATP酶,如果以其为药物的作用靶点,是否会影响机体的能量代谢也是需要考虑的问题。
References
| [1] | Tischler AD, Leistikow RL, Ramakrishnan P, Voskuil MI, McKinney JD. Mycobacterium tuberculosis phosphate uptake system component PstA2 is not required for gene regulation or virulence. PLoS One, 2016, 11(8). |
| [2] | Hudek L, Premachandra D, Webster WAJ, Br?u L. Role of phosphate transport system component PstB1 in phosphate internalization by nostoc punctiforme. Applied and Environmental Microbiology, 2016, 82(21): 6344-6356. DOI:10.1128/AEM.01336-16 |
| [3] | Brokaw AM, Eide BJ, Muradian M, Boster JM, Tischler AD. Mycobacterium smegmatis PhoU proteins have overlapping functions in phosphate signaling and are essential. Frontiers in Microbiology, 2017, 8: 2523. DOI:10.3389/fmicb.2017.02523 |
| [4] | Kortstee GJJ, Appeldoorn KJ, Bonting CFC, van Niel EWJ, van Veen HW. Biology of polyphosphate-accumulating bacteria involved in enhanced biological phosphorus removal. FEMS Microbiology Reviews, 1994, 15(2/3): 137-153. |
| [5] | Yuan ZC, Zaheer R, Finan TM. Regulation and properties of PstSCAB, a high-affinity, high-velocity phosphate transport system of Sinorhizobium meliloti. Journal of Bacteriology, 2006, 188(3): 1089-1102. DOI:10.1128/JB.188.3.1089-1102.2006 |
| [6] | Yang X, Yue ST, Wu ZH, Fu L, Yu RJ, Yang MY. Identification of the Pst system of phosphate solubilizing bacteria Pseudomonas sp. wj1 and functional analysis of pstS gene.. Journal of China Agricultural University, 2018, 23(6): 40-48. (in Chinese) 杨雪, 岳胜天, 武志海, 付丽, 于人杰, 杨美英. 溶磷菌Pseudomonas sp. wj1的Pst系统鉴定及pstS基因功能分析. 中国农业大学学报, 2018, 23(6): 40-48. |
| [7] | O'May GA, Jacobsen SM, Longwell M, Stoodley P, Mobley HLT, Shirtliff ME. The high-affinity phosphate transporter Pst in Proteus mirabilis HI4320 and its importance in biofilm formation. Microbiology, 2009, 155: 1523-1535. DOI:10.1099/mic.0.026500-0 |
| [8] | Neznansky A, Blus-Kadosh I, Yerushalmi G, Banin E, Opatowsky Y. The Pseudomonas aeruginosa phosphate transport protein PstS plays a phosphate-independent role in biofilm formation. The FASEB Journal, 2014, 28(12): 5223-5233. DOI:10.1096/fj.14-258293 |
| [9] | Lucas RL, Lostroh CP, DiRusso CC, Spector MP, Wanner BL, Lee CA. Multiple factors independently regulatehilA and invasion gene expression in Salmonella enterica serovar typhimurium. Journal of bacteriology, 2000, 182(7): 1872-1882. DOI:10.1128/JB.182.7.1872-1882.2000 |
| [10] | Bhatt K, Banerjee SK, Chakraborti PK. Evidence that phosphate specific transporter is amplified in a fluoroquinolone resistant Mycobacterium smegmatis. European Journal of Biochemistry, 2000, 267(13): 4028-4032. DOI:10.1046/j.1432-1327.2000.01437.x |
| [11] | Vyas NK, Vyas MN, Quiocho FA. Crystal structure of M. tuberculosis ABC phosphate transport receptor: specificity and charge compensation dominated by ion-dipole interactions. Structure, 2003, 11(7): 765-774. DOI:10.1016/S0969-2126(03)00109-6 |
| [12] | Chan FY, Torriani A. PstB protein of the phosphate-specific transport system of Escherichia coli is an ATPase. Journal of Bacteriology, 1996, 178(13): 3974-3977. DOI:10.1128/jb.178.13.3974-3977.1996 |
| [13] | ter Beek J, Guskov A, Slotboom DJ. Structural diversity of ABC transporters. Journal of General Physiology, 2014, 143(4): 419-435. DOI:10.1085/jgp.201411164 |
| [14] | Higgins CF, Linton KJ. The ATP switch model for ABC transporters. Nature Structural & Molecular Biology, 2004, 11(10): 918-926. |
| [15] | Schmees G, Stein A, Hunke S, Landmesser H, Schneider E. Functional consequences of mutations in the conserved 'signature sequence' of the ATP-binding-cassette protein Malk. European Journal of Biochemistry, 1999, 266(2): 420-430. DOI:10.1046/j.1432-1327.1999.00871.x |
| [16] | Jones PM, George AM. The ABC transporter structure and mechanism: perspectives on recent research. Cellular and Molecular Life Sciences, 2004, 61(6): 682-699. DOI:10.1007/s00018-003-3336-9 |
| [17] | Zschiedrich CP, Keidel V, Szurmant H. Molecular mechanisms of two-component signal transduction. Journal of Molecular Biology, 2016, 428(19): 3752-3775. DOI:10.1016/j.jmb.2016.08.003 |
| [18] | Pontes MH, Groisman EA. Protein synthesis controls phosphate homeostasis. Genes & Development, 2018, 32(1): 79-92. |
| [19] | Monds RD, Newell PD, Schwartzman JA, O'Toole GA. Conservation of the Pho regulon in Pseudomonas fluorescens Pf0-1. Applied and Environmental Microbiology, 2006, 72(3): 1910-1924. DOI:10.1128/AEM.72.3.1910-1924.2006 |
| [20] | Wightman B, Ha I, Ruvkun G. Posttranscriptional regulation of the heterochronic gene lin-14by lin-4 mediates temporal pattern formation in C. elegans. Cell, 1993, 75(5): 855-862. DOI:10.1016/0092-8674(93)90530-4 |
| [21] | Luz DE, Nepomuceno RSL, Spira B, Ferreira RCC. The Pst system of Streptococcus mutans is important for phosphate transport and adhesion to abiotic surfaces. Molecular Oral Microbiology, 2012, 27(3): 172-181. DOI:10.1111/j.2041-1014.2012.00641.x |
| [22] | Fischer RJ, Oehmcke S, Meyer U, Mix M, Schwarz K, Fiedler T, Bahl H. Transcription of the pst operon of Clostridium acetobutylicum is dependent on phosphate concentration and pH. Journal of Bacteriology, 2006, 188(15): 5469-5478. DOI:10.1128/JB.00491-06 |
| [23] | Monds RD, Newell PD, Gross RH, O'Toole GA. Phosphate-dependent modulation of c-di-GMP levels regulates Pseudomonas fluorescens Pf0-1 biofilm formation by controlling secretion of the adhesin LapA. Molecular Microbiology, 2007, 63(3): 656-679. |
| [24] | Sprecher KS, Hug I, Nesper J, Potthoff E, Mahi MA, Sangermani M, Kaever V, Schwede T, Vorholt J, Jenal U. Cohesive properties of the Caulobacter crescentus holdfast adhesin are regulated by a novel c-di-GMP effector protein. mBio, 2017, 8(2): e00294-17. |
| [25] | Valentini M, Filloux A. Biofilms and cyclic di-GMP (c-di-GMP) signaling: lessons from Pseudomonas aeruginosa and other bacteria. Journal of Biological Chemistry, 2016, 291(24): 12547-12555. DOI:10.1074/jbc.R115.711507 |
| [26] | Neznansky A, Opatowsky Y. Expression, purification and crystallization of the phosphate-binding PstS protein from Pseudomonas aeruginosa. Acta Crystallographica. Section F, Structural Biology Communications, 2014, 70: 906-910. |
| [27] | Shah M, Zaborin A, Alverdy JC, Scott K, Zaborina O. Localization of DING proteins on PstS-containing outer-surface appendages of Pseudomonas aeruginosa. FEMS Microbiology Letters, 2014, 352(1): 54-61. DOI:10.1111/1574-6968.12368 |
| [28] | Cox GB, Webb D, Rosenberg H. Specific amino acid residues in both the PstB and PstC proteins are required for phosphate transport by the Escherichia coli Pst system. Journal of Bacteriology, 1989, 171(3): 1531-1534. DOI:10.1128/jb.171.3.1531-1534.1989 |
| [29] | Novak R, Cauwels A, Charpentier E, Tuomanen E. Identification of a Streptococcus pneumoniae gene locus encoding proteins of an ABC phosphate transporter and a two-component regulatory system. Journal of Bacteriology, 1999, 181(4): 1126-1133. |
| [30] | Sarin J, Aggarwal S, Chaba R, Varshney GC, Chakraborti PK. B-subunit of phosphate-specific transporter from Mycobacterium tuberculosis is a thermostable ATPase. Journal of Biological Chemistry, 2001, 276(48): 44590-44597. DOI:10.1074/jbc.M105401200 |
| [31] | Surin BP, Rosenberg H, Cox GB. Phosphate-specific transport system of Escherichia coli: nucleotide sequence and gene-polypeptide relationships. Journal of Bacteriology, 1985, 161(1): 189-198. |
| [32] | Wang Q, Song YY, Chi JY, Wang YF, Zhao YL. Study on the mechanism of drug resistance in mono ofloxacin-resistant Mycobacterium tuberculosis. Chinese Journal of Antituberculosis, 2014, 36(5): 350-355. (in Chinese) 王前, 宋媛媛, 池俊英, 王玉峰, 赵雁林. 单耐氧氟沙星的结核分枝杆菌耐药机制研究. 中国防痨杂志, 2014, 36(5): 350-355. DOI:10.3969/j.issn.1000-6621.2014.05.011 |
| [33] | Li XZ, Plésiat P, Nikaido H. The challenge of efflux-mediated antibiotic resistance in Gram-negative bacteria. Clinical Microbiology Reviews, 2015, 28(2): 337-418. DOI:10.1128/CMR.00117-14 |
| [34] | Mahmood HY, Jamshidi S, Mark J, Rahman KM. Current advances in developing inhibitors of bacterial multidrug efflux pumps. Current Medicinal Chemistry, 2016, 23(10): 1062-1081. DOI:10.2174/0929867323666160304150522 |
