朝木丽格1, 额尔敦宝力高2, 黄天鹏1, 吴咪1, 贺海燕1, 金凤3, 格日勒图1


1. 内蒙古农业大学兽医学院, 内蒙古 呼和浩特 010018;
2. 呼伦贝尔市新巴尔虎右旗克尔伦苏木畜牧兽医站, 内蒙古 呼伦贝尔 021312;
3. 内蒙古农业大学动物科学学院, 内蒙古 呼和浩特 010018
收稿日期:2018-07-24;修回日期:2018-11-21;网络出版日期:2019-03-12
基金项目:国家自然科学基金(31660709);十三五重点研发计划(SKLVEB2013KFKT020);内蒙古自治区创新引导奖励资金项目
*通信作者:格日勒图, Tel/Fax: +86-471-4308182; E-mail: geriletusy@imau.edu.cn.
摘要:[目的] 本试验以源自呼伦贝尔地区的优势蜱种草原革蜱为材料,从其体内分离得到可疑细菌,应用常规方法和分子生物学方法对该菌株进行分离及鉴定,并对其致病性进行探索,为内蒙古地区蜱虫生物多样性和环境相关性研究奠定了基础。[方法] 首先,通过形态学观察,生理生化试验、药物敏感试验以及16S rRNA序列分析,并构建系统发育树,确定该菌株的分类地位;其次对昆明小鼠进行致病性实验。[结果] 该菌株革兰氏染色呈G+杆菌,在高盐培养基(5% NaCl)和pH为9的碱性培养基中生长良好;该菌对不同糖类发酵能力非常有限,只利用部分糖类(如西蒙氏枸橼酸盐试验结果为阳性)产气,但是不产酸;对个别化学药(如环丙沙星)和多数抗生素(如复方新诺明、庆大霉素、红霉素及头孢噻肟等)显示为敏感,而对抗生素卡那霉素和阿莫西林表现为耐药性;经16S rRNA基因序列和系统发育树分析发现,该菌株与GenBank数据库中已注册的多株Oceanobacillus oncorhynchi的同源性为99%以上;该菌在血平板溶血试验中呈现出不完全α溶血,而感染昆明小鼠,观察7 d无明显致病性。[结论] 本试验首次分离鉴定了一株蜱源性O.oncorhynchi,并对上述菌株重新命名为O.oncorhynchi IMH,并在GenBank中进行注册(LC213016.1),更加丰富了GenBank中相关数据。
关键词:呼伦贝尔草原革蜱Oceanobacillus oncorhynchi IMH分离与鉴定16S rRNA
Isolation and identification of a tick-borne salt and alkali tolerant bacterium Oceanobacillus oncorhynchi IMH
Chaomulige1, Eerdunbaoligao2, Tianpeng Huang1, Mi Wu1, Haiyan He1, Feng Jin3, Geriletu1


1. College of Veterinary, Inner Mongolia Agricultural University, Hohhot 010018, Inner Mongolia Autonomous Region, China;
2. Animal Husbandry and Veterinary Station from Keerlun Sumu of Xin Barag Right Banner in Hulunbuir, Hulunbuir 021312, Inner Mongolia Autonomous Region, China;
3. College of Animal Science, Inner Mongolia Agricultural University, Hohhot 010018, Inner Mongolia Autonomous Region, China
*Corresponding author: Geriletu, Tel/Fax: +86-471-4308182; E-mail: geriletusy@imau.edu.cn.
Foundation item: Supported by the National Natural Science Foundation of China (31660709), by the 13th Five-Year Key R & D Program (SKLVEB2013KFKT020) and by the Inner Mongolia Autonomous Region Science and Technology Innovation Guide Incentive Funds Project
Abstract: [Objective] In this study, an unknown bacterium was isolated from Dermacentor nuttalli-a dominant tick species in the area of Hulunbuir. Then we identified the bacterium by molecular biology. We also explored its pathogenicity. [Methods] First, through conventional morphological observation, physiological and biochemical analysis, drug sensitivity test, 16S rRNA gene sequence analysis and constructing phylogenetic tree, we confirmed the taxonomic status of the bacterium. Then we did pathogenicity experiment on mice. [Results] This bacterium was Gram-positive and grew well in high-salt medium (5% NaCl) and alkaline medium (pH 9), but its ability was limited to ferment sugar, instead it only used some sugar (Simon's citrate test showed positive results) to make aerogenesis but not acid. It is sensitive for individual chemicals like ciprofloxacin, and most antibiotics like neomycin, gentamicin, erythromycin and cefotaxime, whereas it was resistance to kanamycin and amoxicillin. From the analysis of the 16S rRNA gene sequence and the phylogenetic trees, we found that the homology of this bacterial strain and Oceanobacillus oncorhynchi from the GenBank database (GenBank:GQ121034.1) is over 99%. Besides, this bacterial strain shows incomplete hemolysis and no obvious pathogenicity was observed in Kunming mice 7 days after infection. [Conclusion] A tick-borne O. ncorhynchi strain was isolated, identified and named O. oncorhynchi IMH and registered in Genbank (No. LC213016.1), which enriched the relevant data in GenBank.
Keywords: HulunbuirDermacentor nuttalliOceanobacillus oncorhynchi IMHisolation and identification16S rRNA
蜱虫是一类主要寄生在哺乳动物、鸟类和爬行类等脊椎动物体表并进行专性吸血的特殊节肢动物,属于专性、非永久性的体外寄生虫,其中最常见且造成危害最为严重的是硬蜱[1]。硬蜱常寄生在家畜的体表,并通过直接叮咬的方式对其宿主皮肤造成炎症反应,使动物感到不安、疼痛,且引起过敏性皮炎和伤口蛆病等[2]。更为重要的是硬蜱还属于很多种人和动物重要疾病病原体的传播媒介和贮存宿主,包括细菌、病毒、立克次体和原虫等病原体[3-8]。近年来,随着全球气候异常变化,各类媒介生物活动范围与频率均在增加,导致各类动物疫病流行都有新变化,特别是蜱传疾病在中国几乎所有的省、自治区、直辖市都有发生,也呈现出逐年递增的态势[9]。
小鳟鱼大洋芽孢杆菌(O. oncorhynchi)是属厚壁菌门(Firmicutes)芽孢杆菌科(Bacillaceae)大洋芽孢杆菌属(Oceanobacillus sp.),是一类专性需氧或兼性厌氧并具有专性嗜碱或兼性嗜碱性耐盐菌,该类菌可从深海沉积物、淡水鱼、盐田、藻丛、淡水昆虫中才能分离到。据马含笑等报道[10],从腐败肉块和肠中分离得到小蹲鱼大洋芽孢杆菌,该菌在平板上的单菌落特征为边缘波状,菌落表面形态圆形,菌落隆起,呈现白色。目前还未有一例关于蜱源性小蹲鱼大洋芽孢杆菌的报道。
本研究从呼伦贝尔地区进行蜱虫样本采集,并对其所携带的微生物种类进行探究。经检测后发现,我们首次在草原革蜱体内检测到了小鳟鱼大洋芽孢杆菌(O. oncorhynchi)的特异性基因并对该菌进行分离,而后对其生理生化以及分子生物学特性进行分析,成功构建系统发育树确定了其分类地位,最后对其进行动物回归实验研究。本次研究为内蒙古地区媒介生物蜱虫的生物多样性和环境相关性研究积累了基础数据。
1 材料和方法 1.1 材料
1.1.1 蜱虫的采集: 选取呼伦贝尔地区牧业四旗随机设立15个采样点(图 1中15个采样点用地名首个拼音大写字母表示),其中新巴尔虎左旗4个采样点(吉苏木、新宝东苏木、阿木古郎镇和乌苏木)、新巴尔虎右旗8个采样点(呼伦镇、布尔敦苏木、口岸镇、汉乌拉苏木、赛罕塔拉、克尔伦镇、贝尔苏木和宝格达乌拉苏木)、鄂温克旗1个采样点(孟根朝鲁苏木)和陈巴尔虎旗2个采样点(巴镇和宝日希勒矿区),采样点均在距呼伦湖和贝尔湖6–106 km。采用常规方法在羊(未药浴)的体表随机采集饱血蜱或半饱血蜱虫样本,将活蜱样品放入塞有棉塞的无菌试管中带回实验室。
 |
| 图 1 蜱虫采样点及其数量 Figure 1 Sampling sites and quantities of ticks |
| 图选项 |
1.1.2 实验动物: 40只20日龄左右雌性昆明小鼠,体重均在20 g左右,购自内蒙古大学实验动物中心。将昆明小鼠于实验室正常饲养5 d (20日龄小鼠每日饲料5–7 g/只,每日饮水量4–6 mL/只),淘汰部分体貌或发育异常的小鼠后,剩余小鼠再进行下一步试验。
1.1.3 主要试剂: 细菌基因组DNA提取试剂盒(天根生化科技有限公司);胶回收试剂盒(Axygen);质粒提取试剂盒(Axygen);pMD19-T载体,Ex Taq酶(TaKaRa);普通琼脂培养基、MH琼脂培养基和明胶培养基(本研究室自行制备),血琼脂培养基(广东环凯微生物科技有限公司),麦康凯培养基(广东环凯微生物科技有限公司);药敏纸片(杭州滨和微生物试剂有限公司);大肠杆菌DH5α感受态细胞(本实验室保存)。
1.2 细菌的分离与纯培养 将各地采集的蜱虫样本中随机选取3–5个蜱虫样本,用酒精棉进行体表擦拭后,依次经过75%、50%、30%酒精洗涤1 h,再用无菌PBS洗涤3次,每次10 min。经处理后的蜱虫用无菌剪刀、镊子分为几部分,用接种环沾取其横断面并划线接种于普通营养琼脂培养基,将培养皿倒置于37 ℃恒温箱中,培养24–36 h后取出。挑取单菌落接种于液体培养基中,200 r/min、37 ℃过夜培养,得到细菌的纯培养物备于进一步菌种鉴定。
1.3 细菌形态特征的观察 对各地分离的液态培养24 h的菌液进行10倍梯度稀释,分别取100 μL菌液涂布于普通琼脂固体培养基,37 ℃条件培养24 h。对菌落形态进行观察和拍照。将分离纯化后的细菌进行革兰氏染色,在显微镜下观察细菌的形态特征。
1.4 细菌生长曲线的绘制 浓度为1.0×106 CFU/mL的细菌培养液,以1%的接种量接种于普通肉汤培养基中,37 ℃、200 r/min振荡培养,分别选取0、2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、44、46、48、50、52 h时间点取样并测定培养液的OD600值,以未接种的普通肉汤培养基作空白对照。以培养时间为横坐标,OD600值为纵坐标绘制细菌生长曲线,本试验共进行3次重复试验并统计分析。
1.5 细菌培养特性试验
1.5.1 细菌耐盐试验: 将培养的菌液接种到3.5 mL普通肉汤培养基中(pH 7.4±0.2),并使培养基中的盐浓度分别达到0、0.5%、1.0%、2.5%、5.0%、7.5%、10.0%,200 r/min、37 ℃培养过夜。次日分别测取OD600值,共进行3次重复试验并统计分析。
1.5.2 细菌耐碱试验: 将培养的菌液接种到3.5 mL普通肉汤培养基中,并使培养基中的pH值分别为6、7、8、9。接种后以200 r/min、37 ℃培养过夜。次日分别测取OD600值,共进行3次重复试验并统计分析。
1.5.3 细菌溶血性试验: 无菌接种环取一环分离菌采用划线法接种于血平板,倒置于37 ℃恒温箱中培养20 h,观察细菌溶血情况。
1.5.4 细菌生化试验: 取纯培养物接种于细菌生化鉴定管中,参照《伯杰氏系统细菌学手册》中的芽孢杆菌科的鉴定内容[11],参照《兽医微生物学实验教程》中描述的常规方法[12]进行试验。其中糖发酵试验:产酸产气者记为“⊕”,产酸者记为“+”,不发酵者记为“–”;氧化酶试验:将1%四甲基对苯二胺溶液2–3滴加在滤纸上,用牙签挑取1个菌落到纸上涂布,5–10 s内菌落由粉红到黑色变化者为阳性,记为“+”,无变化者为阴性,记为“–”;吲哚试验:供试菌的蛋白胨水培养物中滴加对二氨基苯甲醛时,形成玫瑰吲哚而呈红色者为阳性反应,记为“+”,无变化者为阴性,记为“–”;明胶试验:将供试菌穿刺于明胶培养基中,在22 ℃下培养18–24 h后观察到明胶液化者为阳性反应,记为“+”,无变化者为阴性,记为“–”;枸橼酸盐利用试验:将供试菌接种于含有枸橼酸钠的琼脂斜面培养基,37 ℃下培养48–72 h后观察到培养基由草绿色变为深蓝色者为阳性反应,记为“+”,无变化者为阴性,记为“–”。
1.6 药物敏感性试验 按照纸片琼脂扩散法[13],将供试菌的浓度稀释为1×108 CFU/mL到2×108 CFU/mL,使用灭菌棉拭子轻沾菌液,均匀涂布于MH琼脂(MHA)平板,药敏片覆盖于平板表面,平板放入37 ℃恒温培养箱中,24 h后取出平板,测量多种药物的抑菌圈直径,依据杭州滨和微生物试剂有限公司试剂盒说明书规定,作为判定细菌对药物敏感性的标准:S为敏感(d≥20);I为中度敏感(14 < d < 20);R为耐药(0≤d≤14)。
1.7 细菌16S rRNA基因扩增及序列分析
1.7.1 引物设计: PCR扩增引物参照《现代微生物学实验技术》中细菌的16S rRNA基因的通用引物PF:5′-AGAGTTTGATCMTDDCTCAG-3′ (M = C/A);PR:5′-ACGGYTACCTTGTTACGACTT-3′ (Y = C/T),以上引物由上海桑尼科技有限公司合成。
1.7.2 细菌16S rRNA基因扩增与测序: 按照细菌基因组DNA抽提试剂盒所述方法提取分离菌株的基因组DNA,并保存于?20 ℃以备后续试验使用。设定PCR体系为50 μL:2×Es Taq MasterMix 25 μL,模板5 μL,上、下游引物各2 μL,ddH2O 16 μL。PCR扩增程序:94 ℃ 5 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 1 min,共30个循环;72 ℃ 7 min。PCR产物胶回收,目的片段连接到pMD-19T载体,连接产物转化到大肠杆菌DH5α感受态细胞,对重组质粒进行测序。
1.7.3 细菌遗传进化树的绘制: 测序结果经NCBI网站(https://www.ncbi.nlm.nih.gov/)的BLAST检索系统,对供试菌测序后的16S rRNA序列与同属的不同细菌在GenBank中的相关序列进行BLAST和比对,选取相似性最高者为参考序列,利用MEGA 6.0软件中NJ法构建系统发育树,采用Kimura 2-parameter作为模型,自举复制(bootstrap replication) 1000次,检验模型稳定性,得到进化树。
1.8 动物实验 将筛选出的21只20日龄小鼠(20±2 g/只),在实验室饲养5 d,对小鼠进行观察、测体温无异常后随机分7组,每组3只。实验组中取供试菌株的纯培养物(培养时间分别为24、48、72 h,细菌数量为5.8×109 CFU/mL),进行小鼠腹腔注射及口腔灌服,对照组分别腹腔注射及灌服相应未接菌的纯培养基,每次注射量为0.2 mL,而每次口服量为1 mL,每2 h时进行1次观察,持续1周,各组共做3次重复实验。记录小鼠体温及体重变化和观察小鼠的精神状态、呕吐及腹泻状况。对于死亡小鼠的心、肝、脾、肺、肾进行肉眼观察,并记录其主要的病理变化。
1.9 统计学分析方法 本试验统计分析采用单因素方差分析,应用SAS 9.4软件中的ANOVA方法计算均值±SD和P值:P < 0.01为差异极显著(表示为**),P < 0.05为差异显著(表示为*),P > 0.05为差异不显著(未加任何标记)。
2 结果和分析 2.1 细菌形态与菌落特性 在新巴尔虎右旗和左旗各采样点(共12个采样点)内采集的蜱虫样本中随机选取3至5个蜱虫样本,均分离到可疑细菌生长的菌落,将可疑的供试菌在普通琼脂培养基上长速缓慢,需在37 ℃培养24–36 h,即可长出呈现透明、中间凹陷的饼状小菌落(图 2),而在高盐琼脂培养基(5% NaCl)上生长良好,37 ℃培养24 h即可长出,边缘波状,菌落表面形态圆形,菌落隆起,呈现白色(图 3)。经革兰氏染色呈革兰氏阳性,杆状,单个存在或链状排列(图 4)。
 |
| 图 2 普通琼脂培养基生长特性(36 h) Figure 2 Growth characteristics of common agar medium (36 h) |
| 图选项 |
 |
| 图 3 高盐培养基生长特性(24 h) Figure 3 Growth characteristics of high salt medium (24 h) |
| 图选项 |
 |
| 图 4 分离菌在光学显微镜下(×1000) Figure 4 The result of isolate by oil microscope (×1000) |
| 图选项 |
2.2 细菌生长曲线结果 供试菌在培养4–5 h左右后进入对数增长期,并持续到22 h左右,26–42 h进入稳定期,而后菌株进入衰亡期(图 5)。在试验组3次重复试验的数据中除了仅有2处数据差异显著(P < 0.05)以外,其余各个检测时间点3组数据差异不显著(P > 0.05),而对照组所有检测时间点数据均差异不显著(P > 0.05),均显示良好的重复性。
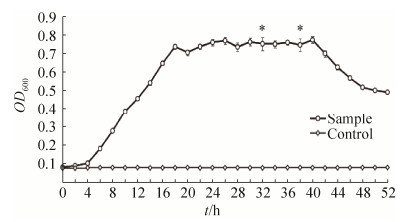 |
| 图 5 分离菌的生长曲线 Figure 5 Growth curve of the isolate |
| 图选项 |
2.3 细菌耐盐耐碱实验结果 供试菌在pH为6的培养条件下,生长缓慢,当pH为9的培养条件下生长却良好,为兼性嗜碱菌(图 6),当NaCl浓度从2.5%至5.0%增加时,供试菌株的生长情况大幅度提高,当NaCl浓度从5.0%至7.5%继续增加时,供试菌株的生长情况大幅度降低,NaCl浓度为5.0%时,供试菌的生长盐浓度最为适宜(图 7)。在该试验中,所有检测点3组数据均显示差异不显著(P > 0.05),显示良好的重复性。
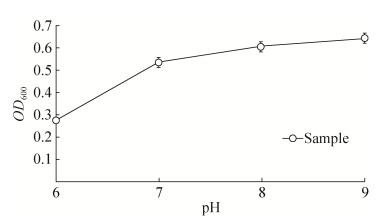 |
| 图 6 pH对分离菌的生长影响 Figure 6 pH curve of the isolate |
| 图选项 |
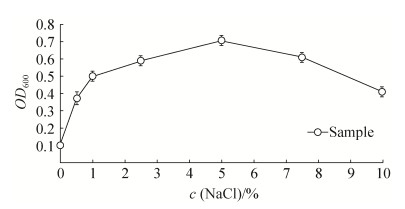 |
| 图 7 盐浓度对分离菌的生长影响 Figure 7 Effect of salt concentration of the isolate |
| 图选项 |
2.4 生化试验结果 供试菌株对蔗糖、甘露醇、麦芽糖、乳糖、葡萄糖等糖分解试验为阴性;吲哚试验、明胶液化试验、氧化酶试验等结果均为阴性;西蒙氏枸橼酸盐试验结果为阳性(表 1),该结果提示,供试菌主要生化培养特性与已见报道的小鳟鱼大洋芽孢杆菌(O. oncorhynchi)相符[14]。
表 1. 分离菌株生化特性检测结果 Table 1. Detection results of biochemical characteristics of isolated strains
| Characteristics | Isolate |
| Maltose | – |
| Glucose | – |
| Lactose | – |
| Mannitol | – |
| Saccharose | – |
| Oxidase | – |
| Indol | – |
| Gelatin | – |
| Simmons citrate | + |
| +: Positive; –: Negative. | |
表选项
2.5 药敏试验结果 供试菌株对抗菌药物的药敏试验结果显示(表 2),该菌株对环丙沙星、复方新诺明、庆大霉素、红霉素及头孢噻肟敏感(d≥20),对抗生素卡那霉素和阿莫西林不敏感(0≤d≤14),对青霉素中度敏感(14 < d < 20)。
表 2. 分离菌株药敏试验结果 Table 2. Drug sensitivity test results of isolated strains
| Antibiotics | Contents/ (μg/piece) | Isolate | |
| Diameter of bacteriostasis circle | Sensitivity | ||
| Ciprofloxacin | 5.00 | 35±1 | S |
| Kanamycin | 30.00 | 0 | R |
| Sulfamethoxazole | 23.75 | 30±1 | S |
| Amoxicillin | 10.00 | 8±1 | R |
| Gentamicin | 10.00 | 25±1 | S |
| Erythrocin | 15.00 | 34±1 | S |
| Cefotaxime | 30.00 | 40±1 | S |
| Penicillin | 10.00 | 19±1 | I |
| “S” is sensitive; “I” is medium sensitive, and “R” is resistance. | |||
表选项
2.6 溶血试验结果 供试菌经24 h培养,血培养基上呈现不完全α溶血现象,显示类似于致病性菌的培养特性(图 8)。
 |
| 图 8 分离菌的溶血试验 Figure 8 Hemolysis test result of isolate |
| 图选项 |
2.7 PCR扩增片段及系统发育树分析 采用通用引物和常规PCR方法扩增出16S rRNA基因目的条带,对扩增产物纯化胶回收后,进行测序和BLAST分析。结果显示,供试菌的16S rRNA基因序列与GenBank数据库中注册的我国各地分离株小鳟鱼大洋芽孢杆菌的同源性为99%,在进化树上处在同一进化分支上,显示很好的类聚(图 9)。该项结果与上述的生化实验鉴定结果吻合。
 |
| 图 9 基于16S rRNA基因序列的系统发育树 Figure 9 Phylogenetic tree based on 16S rRNA gene sequences |
| 图选项 |
2.8 动物试验结果 用供试菌株不论是腹腔注射还是口服方式攻毒后的实验小鼠与对照组的小鼠体温无明显差异,均为36.0±0.4 ℃,体重趋于增长,但是各组间无明显变化;在攻毒结束后6 h内小鼠出现短暂的精神萎靡,但未出现持续的严重的其他神经症状,并无呕吐和拉稀症状,随后逐渐恢复正常精神状态;剖检观察与对照组小鼠比较未见任何异常变化,各组织脏器肉眼观察无异常病变。
3 讨论 蜱虫不仅是许多种脊椎动物体表的暂时性寄生虫,并能传播多种原虫、细菌和病毒性疾病[6],如常见的有莱姆病(Lyme disease)、森林脑炎(Russion spring-summer encephalitis)、出血热(Hemorrhagic fever)、立克次体(Rickettsia)、Q热(Q fever)、鼠疫(Plague)、野兔热(Tularaemia)、布鲁斯菌病(Brucellosis)等[15-21]。此外,蜱虫的活动周期具有显著的地方和季节特性[22],可能蜱种的生物多样性及其体内微生物种群的变化,与局部地理环境的气候变化具有一定联系。为此,本试验主要以呼伦贝尔地区优势蜱种草原革蜱作为试验材料,对其体内存在的可疑细菌进行分离与鉴定,并对所得分离菌株的生长条件、培养特性及致病性进行初步性探索研究。从新巴尔虎右旗8个采集点和左旗4个采集点的蜱虫样本中随机筛选的几个蜱虫体内中均能分离到O. oncorhynchi,并经过生理生化实验和16S rRNA基因分子生物学方法鉴定该菌株的种型,并重新命名为O. oncorhynchi IMH,重新注册于GenBank,注册号为No. LC213016.1。在这些地区所有蜱虫样本中该分离菌的分布率和蜱体内的丰度未得到完全可靠的实验结果,而陈巴尔虎旗和鄂温克旗2个地区的3个采样点未进行分离工作,这些工作需要进一步完善。此外,虽然我们对蜱虫体进行了非常严格的消毒和无菌操作,也不能完全排除污染问题,即分离菌株到底是外源菌还是内源菌还需要进一步证实,不论是内源菌还是外源菌的跟踪蜱虫活动规律都具有一定意义。
在相似研究工作中,除了O. oncorhynchi IMH,在新巴尔虎右旗和新巴尔虎左旗2个区各采样点也能分离出粪产碱杆菌(Alcaligenes faecalis)、粪肠球菌(Enterococcus faecalis)以及巨球菌(Megasphaera)等与环境密切相关的微生物,甚至也分离出布鲁斯菌(Brucella)等病原微生物,但是目前我们所得实验数据很难准确定位这些菌群在蜱体内所分布的丰度和比例,阐明该问题所需要的数据量会更大。众所周知,蜱虫除了叮咬哺乳动物和人类以外,还可以叮咬两栖动物(如蛙和蛇类)[23]。据文献报道,研究者从蛙体内分离鉴定出了布鲁斯菌[24],推测这很有可能由蜱传播所致。这充分表明蜱虫在不同环境中,能够携带的微生物种类(包括病原体)和传播能力在不断加强。在本研究中,我们首次从蜱体内分离和鉴定的O. oncorhynchi IMH是一类海洋微生物,有趣的是新巴尔虎右旗和左旗境内有内蒙古地区最大的内陆湖-呼伦湖和贝尔湖,采样点均距两个湖区约6–106 km,所以这种生态环境及生物物种之间肯定有内在联系。但是我们还没有足够证据阐明这些问题,需要进一步深入探究。O. oncorhynchi IMH的典型的形态特征与部分培养特性与张琦等[25]报道的基本一致,是一类耐盐的微生物,当盐浓度达到5%时,分离株生长情况最佳,但是耐碱性试验只有我们的结果显示,培养基pH值达到9以上,分离株菌生长良好,反而pH值小于7则分离株菌生长不佳;而本试验分离株生化实验结果显示,不利用多种糖类,除了枸橼酸利用实验结果阳性以外,其中个别实验结果与上述文献报道的结果不一致,如O. oncorhynchi IMH的明胶实验结果为阴性,显示出菌株的新特征。该分离株药敏试验结果显示,对氨基糖苷类抗生素(如卡那霉素)和β-内酰胺类抗生素(如阿莫西林) 2种产生耐药性以外对其他化学药物和抗生物均表现为敏感,该试验结果与牛天琦等[25]报道的鸡粪便中分离的O. oncorhynchi株所产生的广泛性耐药谱不一致。O. oncorhynchi IMH株在血平板上呈现α溶血,提示该菌株具有相似致病性细菌的特性,但是我们未查见国内外文献关于该分离株致病性实验方面的研究报道。我们尝试该菌的不同时间段的纯培养物,以不同方式投给昆明小白鼠进行动物实验,但是连续观察7 d发现,分离菌株不论什么途径给小鼠,除了短暂的精神萎靡外,未发现任何可疑症状,如体重和体温均没有变化。安乐死亡的小鼠经剖检后,实质脏器也没有任何肉眼可见的病理变化,该菌株是否有释放的毒力因子蛋白?该菌对小鼠腹腔注射和灌胃,7 d内未观察到死亡,这种短时间的观察不足以说明一些慢性发病的情况,其机制问题仍需要深入研究。从进化树上分析,该菌与国内外各地分离株O. oncorhynchi处在同一个分支,属于小鳟鱼大洋芽孢杆菌,与本试验中所描述的细菌形态、菌落特征及生化实验结果完全吻合。
本试验首次从蜱虫体内分离得到与环境相关的微生物,即O. oncorhynchi IMH的成功分离,发现了其独特的来源及培养特性,为进一步探明其与宿主蜱的生物多样性及环境相关性研究提供了基础数据。
References
| [1] | Eisen L. Pathogen transmission in relation to duration of attachment by Ixodes scapularis ticks. Ticks and Tick-borne Diseases, 2018, 9(3): 535-542. DOI:10.1016/j.ttbdis.2018.01.002 |
| [2] | Dantas-Torres F, Chomel BB, Otranto D. Ticks and tick-borne diseases: a one health perspective. Trends in Parasitology, 2012, 28(10): 437-446. DOI:10.1016/j.pt.2012.07.003 |
| [3] | Boldbaatar B, Jiang RR, von Fricken ME, Lkhagvatseren S, Nymadawa P, Baigalmaa B, Wang YW, Anderson BD, Jiang JF, Gray GC. Distribution and molecular characteristics of rickettsiae found in ticks across Central Mongolia. Parasites & Vectors, 2017, 10: 61. |
| [4] | Karnath C, Obiegala A, Speck S, Essbauer S, Derschum H, Scholz H, Kiefer D, Tserennorov D, Dashdavaa O, Tsogbadrakh N, Jigjav B, Pfeffer M. Detection of Babesia venatorum, Anaplasma phagocytophilum and Candidatus Neoehrlichia mikurensis in Ixodes persulcatus ticks from Mongolia. Ticks and Tick-borne Diseases, 2016, 7(2): 357-360. DOI:10.1016/j.ttbdis.2015.12.007 |
| [5] | Baráková I, Derdáková M, Selyemová D, Chvostá? M, ?pitalská E, Rosso F, Collini M, Rosà R, Tagliapietra V, Girardi M, Ramponi C, Hauffe HC, Rizzoli A. Tick-borne pathogens and their reservoir hosts in northern Italy. Ticks and Tick-borne Diseases, 2018, 9(2): 164-170. DOI:10.1016/j.ttbdis.2017.08.012 |
| [6] | Ebani VV, Bertelloni F, Mani P. Molecular survey on zoonotic tick-borne bacteria and chlamydiae in feral pigeons (Columba livia domestica). Asian Pacific Journal of Tropical Medicine, 2016, 9(4): 324-327. DOI:10.1016/j.apjtm.2016.03.005 |
| [7] | Wattanamethanont J, Kaewthamasorn M, Tiawsirisup S. Natural infection of questing ixodid ticks with protozoa and bacteria in Chonburi Province, Thailand. Ticks and Tick-borne Diseases, 2018, 9(3): 749-758. DOI:10.1016/j.ttbdis.2018.02.020 |
| [8] | Cross ST, Kapuscinski ML, Perino J, Maertens BL, Weger-Lucarelli J, Ebel GD, Stenglein MD. Co-infection patterns in individual Ixodes scapularis ticks reveal associations between viral, eukaryotic and bacterial microorganisms. Viruses, 2018, 10(7): 388. DOI:10.3390/v10070388 |
| [9] | Liu W. Emerging tick borne agents in China. Infectious Disease Information, 2017, 30(1): 11-14. (in Chinese) 刘玮. 中国新发蜱媒病原体概况. 传染病信息, 2017, 30(1): 11-14. |
| [10] | 马含笑.真空包装熟肉制品中兼性厌氧污染微生物生物防腐技术的研究.石河子大学硕士学位论文, 2011: 45–50. |
| [11] | 布瑞德.伯杰氏系统细菌学手册.第9版. 1986: 741–801. |
| [12] | 胡桂学, 陈金顶, 彭远义. 兽医微生物学实验教程. 第2版. 北京: 中国农业大学出版社, 2015: 49-61. |
| [13] | Liu HZ, Yang Y, Xu JL. Analysis of slip agar diffusion method for antimicrobial susceptibility test. The Chinese and Foreign Health Abstract, 2013(12): 154-155. (in Chinese) 刘海珠, 杨燕, 徐建利. 纸片琼脂扩散法检测抗菌药物敏感试验方法分析. 中外健康文摘, 2013(12): 154-155. DOI:10.3969/j.issn.1672-5085.2013.12.167 |
| [14] | 牛天琦.鸡粪中多重耐药细菌的分离鉴定及介导抗性基因水平转移元件的检测.河南师范大学硕士学位论文, 2015: 17–38. |
| [15] | Eisen RJ, Eisen L. The blacklegged tick, Ixodes scapularis: an increasing public health concern. Trends in Parasitology, 2018, 34(4): 295-309. DOI:10.1016/j.pt.2017.12.006 |
| [16] | Moming A, Yue XH, Shen S, Chang CC, Wang C, Luo T, Zhang YF, Guo R, Hu ZH, Zhang YJ, Deng F, Sun SR. Prevalence and phylogenetic analysis of Crimean-Congo hemorrhagic fever virus in ticks from different ecosystems in Xinjiang, China. Virologica Sinica, 2018, 33(1): 67-73. DOI:10.1007/s12250-018-0016-3 |
| [17] | Wang Q, Zhao SS, Wureli H, Xie SS, Chen CF, Wei QQ, Cui BY, Tu CC, Wang YZ. Brucella melitensis and B. abortus in eggs, larvae and engorged females of Dermacentor marginatus. Ticks and Tick-borne Diseases, 2018, 9(4): 1045-1048. DOI:10.1016/j.ttbdis.2018.03.021 |
| [18] | Hubálek Z, Rudolf I. Francisella tularensis prevalence and load in Dermacentor reticulatus ticks in an endemic area in Central Europe. Medical and Veterinary Entomology, 2017, 31(2): 234-239. DOI:10.1111/mve.2017.31.issue-2 |
| [19] | Raulf MK, Jordan D, Fingerle V, Strube C. Association of Borrelia and Rickettsia spp. and bacterial loads in Ixodes ricinus ticks. Ticks and Tick-borne Diseases, 2018, 9(1): 18-24. DOI:10.1016/j.ttbdis.2017.10.014 |
| [20] | Bush LM, Vazquez-Pertejo MT. Tick borne illness—Lyme disease. Disease-a-Month, 2018, 64(5): 195-212. DOI:10.1016/j.disamonth.2018.01.007 |
| [21] | Pukhovskaya NM, Morozova OV, Vysochina NP, Belozerova NB, Bakhmetyeva SV, Zdanovskaya NI, Seligman SJ, Ivanov LI. Tick-borne encephalitis virus in arthropod vectors in the Far East of Russia. Ticks and Tick-borne Diseases, 2018, 9(4): 824-833. DOI:10.1016/j.ttbdis.2018.01.020 |
| [22] | Egyed L, él? P, Sréter-Lancz Z, Széll Z, Balogh Z, Sréter T. Seasonal activity and tick-borne pathogen infection rates of Ixodes ricinus ticks in Hungary. Ticks and Tick-borne Diseases, 2012, 3(2): 90-94. DOI:10.1016/j.ttbdis.2012.01.002 |
| [23] | Sumrandee C, Baimai V, Trinachartvanit W, Ahantarig A. Hepatozoon and Theileria species detected in ticks collected from mammals and snakes in Thailand. Ticks and Tick-borne Diseases, 2015, 6(3): 309-315. DOI:10.1016/j.ttbdis.2015.02.003 |
| [24] | O'Callaghan D, Whatmore AM. Brucella genomics as we enter the multi-genome era. Briefings in Functional Genomics, 2011, 10(6): 334-341. DOI:10.1093/bfgp/elr026 |
| [25] | 张琦.四川泡菜中嗜盐微生物的分离与鉴定.西华大学硕士学位论文, 2013: 24–25. |
