范文胜#, 唐宁#, 董志华, 陈基明, 张文, 赵长润, 韦天超, 磨美兰

 , 韦平
, 韦平

广西大学动物科学技术学院, 广西 南宁 530005
收稿日期:2018-04-28;修回日期:2018-07-06;网络出版日期:2018-08-14
基金项目:国家自然科学基金(31360611);广西科技重大专项(桂科AA17204057);广西自然科学基金(2014GXNSFDA118011);广西研究生教育创新计划(YCBZ2018003)
*通信作者:磨美兰, Tel/Fax: +86-771-3238118; E-mail:momeilan@163.com
韦平, E-mail:pingwei8@126.com
#共同第一作者
摘要:[目的] 对从广西某鸭场发生呼吸道感染的11天龄樱桃谷肉鸭分离到的病毒株进行鉴定,并探索此鸭源病毒分离株的遗传变异情况。[方法] 通过血凝试验、鸡胚接种实验、3'端非编码区(3'UTR)基因扩增与序列测定对分离株进行鉴定,并对该分离株的结构基因S1、E、M和N分别进行序列测定以及相似性、系统进化树分析和血清型鉴定。[结果] 血凝试验为阴性,接种鸡胚盲传5代后出现侏儒胚,3'UTR基因测序结果表明为传染性支气管炎病毒(IBV)序列。该分离株S蛋白的裂解位点为RRSRR,S1、E、M和N基因与IBV毒株H120、4/91、LTD3核苷酸相似性分别为:78.6%–99.7%、85.4%–100.0%、91.6%–93.2%、86.7%–91.7%。除N基因存在点突变外,S1、E和M基因均存在氨基酸的突变、插入和(或)缺失。系统进化树分析显示,其S1基因属于4/91型,E、M和N基因均为LDT3型。血清型分析表明,该分离株的血清型不同于疫苗株H120和4/91。[结论] 此鸭源病毒分离株为IBV,且该分离株的基因型与血清型均发生了变异。本研究结果暗示禽类传染性支气管炎的防控面临着更严峻的挑战。
关键词:鸭传染性支气管炎病毒分离鉴定基因型血清型
Identification and analysis of structural protein genes and serotype of an infectious bronchitis virus in ducks
Wensheng Fan#, Ning Tang#, Zhihua Dong, Jiming Chen, Wen Zhang, Changrun Zhao, Tianchao Wei, Meilan Mo

 , Ping Wei
, Ping Wei

College of Animal Science and Technology, Guangxi University, Nanning 530005, Guangxi Zhuang Autonomous Region, China
Received 28 April 2018; Revised 6 July 2018; Published online 14 August 2018
*Corresponding author: Meilan Mo, Tel/Fax: +86-771-3238118; E-mail: momeilan@163.com
Ping Wei, E-mail: pingwei8@126.com
Supported by the National Natural Science Foundation of China (31360611), by the Guangxi Special Funding on Science and Technology Research (AA17204057), by the Guangxi Natural Science Foundation (2014GXNSFDA118011) and by the Innovation Project of Guangxi Graduate Education (YCBZ2018003)
#These authors contributed equally to this work
Abstract: [Objective] It is to identify and explore the genetic variation of an infectious bronchitis virus isolated from 11-day-old cherry valley ducks that developed suspected respiratory infection in Guangxi province. [Methods] The virus was identified by hemagglutinin test, chicken embryo inoculation and gene sequence analysis of the 3? untranslated region (UTR). The S1, E, M, and N genes of the virus were amplified by reverse transcriptase polymerase chain reaction (RT-PCR), cloned, sequenced, similarity comparison, phylogenetic tree and serotype analyais was conducted. [Results] The hemagglutination test was negative and dwarf embryo appeared after 5 passages of inoculation of chicken embryos. The sequencing result of 3?UTR gene indicated the virus was IBV. The sequence of cleavage site within S protein of the virus was RRSRR. The nucleotide similarities of S1, E, M, and N genes with those of H120, 4/91 and LTD3 reference strains were 78.6%-99.7%, 85.4%-100.0%, 91.6%-93.2% and 86.7%-91.7%, respectively. Compared with the reference strains, there is no insertion or deletion in N gene of the virus except mutations. However, substitutions, insertions and (or) deletions were found in S1, E, M genes of the isolated strain. According to the phylogenetic tree analysis, it was clustered into 4/91-type based on S1 gene and LDT3-type based on E, M and N genes. The serotype analysis showed that the serotype of the isolated strain was different from vaccine strains H120 and 4/91. [Conclusion] The strain isolated from ducks was IBV and the isolated strain existed variation both in structural genes and serotype. The present study suggests that the prevention and control of IB in poultry is facing more severe challenges.
Keywords: duckinfectious bronchitis virusisolation and identificationgenotypeserotype
冠状病毒可引起人与动物的呼吸道感染[1]。根据抗原与遗传相关性,冠状病毒可分为4个属:Alpha-冠状病毒属,Beta-冠状病毒属,Gamma-冠状病毒属,Delta-冠状病毒属。传染性支气管炎病毒(infectious bronchitis virus,IBV)属于套式病毒目冠状病毒科Gamma-冠状病毒属的代表种[2-4]。IBV引起的鸡传染性支气管炎(infectious bronchitis,IB)是一种急性、高度接触性的呼吸道疾病[3],给养禽业造成严重的经济损失。
IBV基因组全长约27.6 kb,基因组结构为5′-UTR-1a/1ab-S-3a-3b-E-M-5a-5b-N-3′UTR,含有4个结构蛋白基因,即纤突(spike,S)蛋白、小膜(small envelope,E)蛋白、膜(membrane,M)蛋白以及核衣壳(nucleocapsid,N)蛋白[5-6]。其中S蛋白由S1和S2两个亚蛋白基因构成,S1蛋白含有与病毒中和、血凝抑制抗体、细胞吸附、组织亲和性、毒力、血清型特异性的抗原位点,是IBV蛋白中变异程度最大的结构蛋白[7-9]。N蛋白是唯一位于膜内的蛋白,主要与病毒核酸结合形成核衣壳,能特异性结合到引导RNA上,参与病毒RNA的合成、转录和翻译,在细胞免疫中起重要作用[10]。N蛋白基因普遍存在氨基酸的替换,导致其抗原表位功能的变化,从而影响IBV的生物学特性。M蛋白主要参与病毒复制、基因组变异并刺激机体白细胞产生干扰素,对IBV的感染性起决定作用[11]。E蛋白主要参与IBV的出芽和装配[12]。
IBV基因组十分容易发生变异,导致IBV血清型众多复杂,目前全球报道的血清型超过50种[13-14],且不同血清型间交叉保护作用强弱不一,给本病的防控带来很大的困难。相关研究表明,目前国内大部分IBV流行株与常用疫苗株血清型不同[2]。本课题组研究表明,广西存在多个血清型IBV流行,且大部分流行株的血清型不同于疫苗株,已形成自己独特的流行血清型[9, 15]。此外,研究表明,基于S1基因的基因分型与血清分型有一定相关性,但不是完全吻合[14-15]。因此,及时了解IBV流行株的基因变异和抗原变化,对防控该病具有非常重要的现实意义。
研究发现[16-19],IBV不仅能够感染各种日龄、品种的鸡,而且可以感染鸭、鹅等各种家禽。2000年以来陆续报道从孔雀、鹌鹑、野生水禽中分离到IBV样病毒[3, 12, 20-21]。上述研究表明,IBV的感染宿主谱在不断扩展,也对防控该病提出了新的挑战。
2017年7月广西某鸭场的11天龄樱桃谷肉鸭发生呼吸道疾病。本研究从发病的樱桃谷肉鸭中分离到一株病毒。通过血凝试验、鸡胚接种实验、RT-PCR和基因序列分析,证实了此鸭源病毒为IBV。进一步对该分离毒株的结构基因(S1、E、M和N)序列及血清型进行研究,旨在了解该分离株的基因和抗原变异情况,揭示IBV的流行态势变化及变异规律,为IB的防控提供重要参考。
1 材料和方法 1.1 病料来源及背景 2017年7月广西某鸭场的11天龄樱桃谷肉鸭发生呼吸道疾病,1%左右的小鸭出现脚软等临床症状,但鸭群基本不死亡,剖检可见支气管有透明的粘液,该鸭场2日龄免疫鸭病毒性肝炎和鸭细小病毒卵黄抗体,9日龄免疫禽流感H5、H9二价弱毒疫苗,未免疫IBV疫苗。
1.2 试验鸡胚 9日龄SPF鸡胚购自北京梅里亚维通实验动物技术有限公司。
1.3 菌种、载体及试剂 rTaq DNA聚合酶(5 U/μL)、M-MLV逆转录酶(200 U/μL)、RNasin (RNA抑制剂)、随机引物、5×RT Buffer、dNTPs (10 mmol/L)、10×PCR Buffer (Mg2+)、克隆载体pMD18-T和2000 bp DNA Ladder Marker购自大连宝生物生物有限公司;DH5α感受态细胞由本课题组制备保存;总RNA抽提试剂盒、高纯度质粒提取试剂盒、胶回收试剂盒购自宝日医生物技术(北京)有限公司。其余所用试剂为国产分析纯。
1.4 单因子血清 7种IBV血清型的单因子血清由本课题组制备保存[15],分别为:GX-YL5 (血清1型)、GX-C (血清2型)、H120 (血清3型)、GX-YL1 (血清4型)、GX-NN7 (血清5型)、GX-YL9 (血清6型)、GX-NN12 (血清7型)。
1.5 病毒的分离 无菌采集发病鸭的支气管、肾脏等组织,与灭菌生理盐水按照1:3比例充分研磨,反复冻融3次,5000 r/min离心5 min取上清,无菌检测后加入双抗至终浓度100 U/mL,–20 ℃保存病料。应用本课题组建立的IBV疫苗株与地方流行毒株鉴别诊断方法[8],针对IBV 3′UTR基因的特异性引物对病料进行RT-PCR扩增,PCR产物回收纯化测序;并将病料接种9日龄SPF鸡胚,无菌收集尿囊液,进行血凝试验。盲传5代,观察鸡胚病变。
1.6 引物设计 参考本课题组[9, 22]和GenBank中发表的IBV核苷酸序列的保守部位设计合成5对特异性引物(表 1)。引物由华大基因合成。
表 1. IBV的扩增引物序列 Table 1. Primers used for IBV genome sequence amplification
| Primer | Forward primer (5′→3′) | Reverse primer (5′→3′) | Size/bp |
| 3′UTR | GAGAGGAACAATGCACAGC | CATTTCCCTGGCGATAGAC | 346 |
| S1 | TTGAAAACTGAACAAAAGACCG | TACAAAACCTGCCATAACTAACAT | 1760 |
| E | AGAAGTATTTGACCCCTTTG | TATTATCGCTGCGACAAGA | 633 |
| M | CGAGTTTCCTAAGAACGGTTGGAA | CCCCTCTCTACACGCACACATTTAT | 750 |
| N | CCATGGCAAGCGGTAAAGCAR | CCACTCAAAGTTCATTCTCTCC | 1300 |
表选项
1.7 3′UTR、S1、E、M和N基因的扩增及测序 参照总RNA抽提试剂盒说明书抽提尿囊液中病毒RNA,进行RT-PCR扩增,并设鸡传染性喉气管炎病毒(ILTV)、鸡新城疫病毒(NDV)、鸭肝炎病毒(DHV)、禽流感病毒(AIV H9亚型)、禽呼肠孤病毒(ARV)、鸭坦布苏病毒(DTMUV)、鸭疫里默氏杆菌(RA)和阴性尿囊液对照。分离株S1、E、M和N基因的PCR扩增反应条件如下:94℃ 5 min;94℃ 45 s,56℃ (52℃, 52 ℃, 52 ℃) 45 s,72 ℃ 1 min,共35个循环;72℃延伸10 min。反应完毕后,通过琼脂糖凝胶电泳并按常规方法进行PCR产物的回收纯化。将纯化产物与pMD18-T载体连接,转化DH5α感受态细胞,扩大培养后提取质粒进行PCR初步鉴定,阳性重组质粒委托华大基因测序。
1.8 相似性、系统进化树、糖基化位点和重组分析 将分离株S1、E、M和N基因序列通过NCBI进行BLAST验证,分别应用生物软件MegAlign和MEGA6.0软件进行核苷酸和推导氨基酸序列相似性以及氨基酸序列系统进化树分析,参考株包括常用疫苗株、国际上主要血清型的毒株、国内代表分离株及广西主要基因型的代表分离株[S1 (52株)、E (51株)、M (52株)、N (52株)][9]。应用在线生物软件NetOGlyc 4.0 Server (http://www.cbs.dtu.dk/services/)进行N-糖基化位点和O-糖基化位点分析。应用软件RDP 4、SimPlot进行重组分析。
1.9 血清型鉴定 参照本实验室的方法进行鸡胚气管环的制备与培养[15]。参照Reed-Muench法[23]计算分离毒株的鸡胚气管环半数感染量(TOC-ID50);采用固定病毒稀释各单因子血清的方法,根据TOC-ID50的结果在24孔板上进行分离株的病毒中和试验[15]。
2 结果和分析 2.1 病毒的分离与鉴定 经过胰酶处理后的病毒第3代尿囊液血凝效价为24,传代至第5代时,病毒尿囊液血凝效价为210。对照组无血凝性。分离毒株鸡胚接种盲传5代后,胚体表现出侏儒胚(矮小)典型病变(图 1)。应用本课题组建立的IBV疫苗株与地方毒株鉴别诊断方法,排除了常用IBV疫苗株的感染;针对3′UTR基因的特异性引物对病料及盲传5代的鸡胚尿囊液的RNA进行RT-PCR鉴定,扩增产物均与目的片段大小相符,病料扩增产物测序结果与盲传5代的鸡胚尿囊液扩增产物测序结果完全一致,通过NCBI进行BLAST验证,表明均为IBV序列,病毒分离株命名为GX-QZ170728。
 |
| 图 1 分离毒株GX-QZ170728鸡胚致病试验 Figure 1 The pathogenicity of GX-QZ170728 isolate to the chicken embryos. A: dwarf embryo; B: normal embryo. |
| 图选项 |
2.2 分离毒株S1、E、M和N基因的扩增 应用设计的针对S1、N、M和E基因的特异性引物分别对分离株GX-QZ170728进行PCR扩增,扩增片段与预期结果大小相符(图 2),ILTV、NDV、DHV、AIV (H9)、ARV、DTMUV、RA和阴性尿囊液均不出现特异性扩增。测序结果显示,GX-QZ170728毒株S1、E、M和N基因ORF长度分别为1617、330、675、1230 bp,分别编码539、110、225、410个氨基酸。
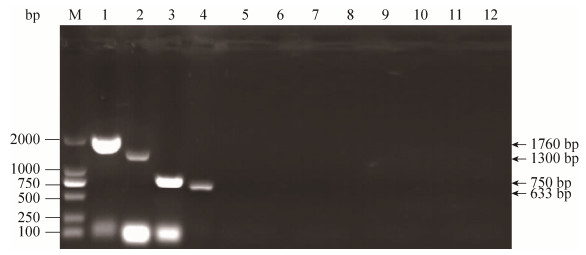 |
| 图 2 IBV分离株GX-QZ170728 RT-PCR扩增产物电泳图 Figure 2 Electrophoresis of RT-PCR amplified products from GX-QZ170728 isolate. M: 2000 bp Ladder DNA Marker; lane 1–4: Products of RT-PCR with primer for S1, N, M, E genes; lane 5: ILTV; lane 6: NDV; lane 7: DHV; lane 8: AIV (H9); lane 9: ARV; lane 10: DTMUV; lane 11: RA; lane 12: Negative control. |
| 图选项 |
2.3 S1、E、M和N基因的相似性、糖基化位点和重组分析 相似性分析结果表明,GX-QZ170728毒株S1、E、M和N基因的核苷酸序列与参考株相似性分别为60.1%–99.7% (除与火鸡冠状病毒毒株Turkey coronavirus为44.5%外)、81.7%–100.0%、86.5%–93.6%、86.0%–94.4%。S1基因与流行基因型毒株QX及CK/CH/LSC/99I相似性分别为79.1%、79.7%。S蛋白的裂解位点为RRSRR (-Arg- Arg-Ser-Arg-Arg-),与疫苗株4/91的裂解位点相同。S1、E、M和N基因与疫苗株H120、4/91、LDT3的核苷酸相似性分别为78.6%–99.7%、85.4%–100.0%、91.6%–93.2%、86.7%–91.7% (表 2);与上述疫苗株比较,除N基因仅存在点突变外,S1、E和M基因均存在氨基酸的突变、插入和(或)缺失情况(表 3)。糖基化位点分析结果显示:GX-QZ170728毒株S1、E、M和N基因分别有17个、3个、2个和1个N-糖基化位点;N基因有26个O-糖基化位点,S1、E和M基因均无O-糖基化位点。重组分析结果显示,4个结构基因没有重组区域。
表 2. IBV分离株GX-QZ170728结构基因与疫苗株H120、4/91、LDT3核苷酸相似性比较 Table 2. The comparison of nucleotide sequence similarities of the structural genes (%) of GX-QZ170728 isolate with IBV vaccine strains H120, 4/91 and LDT3
| Vaccine strains | S1/% | E/% | M/% | N/% |
| H120 | 78.6 (aa 75.2) | 87.3 (aa 80.9) | 91.6 (aa 94.7) | 86.7 (aa 90.5) |
| 4/91 | 99.7 (aa 99.1) | 85.4 (aa 87.9) | 91.7 (aa 93.7) | 86.9 (aa 91.2) |
| LDT3 | 79.3 (aa 75.9) | 100 (aa 100) | 93.2 (aa 96.4) | 91.7 (aa 93.7) |
表选项
表 3. IBV分离株GX-QZ170728与疫苗株H120、4/91、LDT3比对氨基酸情况 Table 3. Amino acid comparison of GX-QZ170728 with IBV vaccine strains H120, 4/91 and LDT3
| Vaccine strains | Amino acid insertion sites | Amino acid deletion sites | |||||||
| S1 | E | M | N | S1 | E | M | N | ||
| H120 | 117–118 (SQ) | - | - | - | - | - | 220 (G) | - | |
| 4/91 | - | 102–103 (QQD) | 2–3 (NKT) | - | - | - | 216 (V) | - | |
| LDT3 | - | - | - | - | 23 (S) | - | 221 (G) | - | |
表选项
2.4 S1、E、M和N基因的遗传进化树分析 基于IBV分离株GX-QZ170728和参考株S1、E、M和N基因的氨基酸系统进化树(图 3)显示,该毒株S1基因与本课题组分离鉴定的广西流行株GX-NN7同属于4/91型,且与4/91亲缘关系相近,而E、M和N基因均属于LDT3型。
 |
| 图 3 分离株GX-QZ170728与参考株S1、E、M和N基因的遗传进化树分析 Figure 3 Phylogenetic trees of gene S1 (A), E (B), M (C) and N (D) of GX-QZ170728 and IBV reference strains. |
| 图选项 |
2.5 分离毒株的血清型分析 依据Reed-Muench法计算分离株GX- QZ170728的TOC-ID50/mL为10–6.64,证明分离株在TOC上较好地增殖,随即进行中和试验,结果如表 4所示。根据中和试验计算相关系数(R < 0.25),中和滴度相同即属于同一血清型的判定标准,分离株GX-QZ170728为血清2型,与疫苗株H120(血清3型)及4/91型(血清5型)均不相同。
表 4. IBV分离株GX-QZ170728中和试验结果 Table 4. The results of neutralization test of GX-QZ170828 IBV isolate
| GX-YL5 (Serotype 1) | GX-C (Serotype 2) | H120 (Serotype 3) | GX-YL1 (Serotype 4) | GX-NN7 (Serotype 5) | GX-YL9 (Serotype 6) | GX-NN12 (Serotype 7) |
| 1:16 | 1:256 | 1:8 | 1:64 | 1:32 | 1:128 | 1:8 |
表选项
3 讨论 冠状病毒可广泛引起人与动物的发病如SARS、MERS等,因此冠状病毒的流行病学研究越来越引起人们的重视。近年相关文献报道从水禽、孔雀等鸡形目患呼吸道症状的患病动物体内甚至野鸟粪便中成功分离到IBV样病毒,表明IBV的感染宿主在不断扩大[3, 12-13, 16-21]。吴晓平等[19]从产蛋异常的番鸭体内分离到IBV,并证实其对番鸭具有致病性,但未对其基因和抗原变异情况进行分析。Chen等[17]通过下一代测序技术(NGS)对鸭源IBV的非编码基因1ab及N基因进行分型研究,证明该冠状病毒为鸭源IBV样病毒。Yao等[18]对鸭源IBV进行了基因变异研究,但只限于S1和M基因,未对E和N基因进行分析,基因分型难免有缺陷。本试验通过对呼吸道感染的樱桃谷肉鸭病变组织无菌处理后进行RT-PCR鉴定、鸡胚接种分离、传代及血凝试验、结构基因S1、E、M和N测序分析、血清定型等手段,鉴定了从鸭分离的毒株为IBV。本研究的分离毒株临床引起雏鸭明显的呼吸道症状,而吴晓平等[19]观察到蛋番鸭产蛋异常,未观察到明显的呼吸症状和肾脏病变,推测可能与日龄及毒株特性有关。
近年研究表明[9],S1和N基因变异与新出现的IBV毒株具有相关性,M和E基因对于机体的粘膜免疫、IBV的出芽及病毒样颗粒的形成至关重要。因此,进行多个结构基因分析从而避免单基因分析造成的假象是非常有必要的。有鉴于此,本研究首次对鸭源IBV结构基因S1、E、M和N进行基因分型。结果表明,分离株S1基因属于4/91型,E、M和N基因均为LDT3型,提示该毒株基因重组的可能性。相关研究报道表明[6, 24],由于病毒RNA依赖的RNA聚合酶缺乏校正功能,病毒在进化的过程中极易发生突变,而弱毒疫苗的频繁免疫可能引起地方分离毒与疫苗株的“共存在”发生基因重组形成“新”的病毒。因此,虽然本研究通过生物分析软件暂未发现该分离株S1基因的重组区域,但不排除该毒株在非编码区域(1ab等)或S2基因存在重组的可能性[6, 25]。分离株S1基因与疫苗株4/91核苷酸相似性极高(99.7%),而E、M和N基因与疫苗株LDT3同属一群,是否与该地区鸡群频繁免疫的4/91及其类似野毒株与LDT3弱毒疫苗导致疫苗毒扩散乃至发生基因重组,尚不明确,但已有证据表明广西存在疫苗株4/91参与的重组现象[9, 26]。下一步非常有必要进行该毒株全基因组测序。
为了进一步了解该鸭源IBV分离毒株的抗原变异情况,本研究对其进行了血清型鉴定。结果表明,该鸭源IBV毒株为血清型2型,与常用疫苗株H120 (血清型1型)及4/91 (血清型5型)血清型均不相同。该鸭场无IBV疫苗免疫史,但却从病鸭分离到IBV,且血清型不同于常用疫苗株,而近几年广西鸡群中IBV流行株的优势血清型也是血清型2型(本课题组未发表资料),说明引起该鸭场发病的IBV毒株可能来源于鸡场IBV,提示IBV防控的严峻性。下一步工作将进行鸡和鸭的致病性试验以及该毒株与鸡源IBV的交叉中和试验。此鸭源IBV对其他禽类是否具有感染性,同样值得关注。
综上所述,本研究结果说明鸭源IBV毒株GX-QZ170728并非疫苗毒,提示频繁的结构基因变异导致血清型的变化,并可能导致宿主范围的进一步扩展,但是否有必然联系需进一步验证。本课题组下一步将进行该毒株的全基因测序及相关致病性试验研究。
References
| [1] | Masters PS. The molecular biology of coronaviruses. Advances in Virus Research, 2006, 66: 193-292. DOI:10.1016/S0065-3527(06)66005-3 |
| [2] | Han ZX, Sun CY, Yan BL, Zhang XN, Wang Y, Li CR, Zhang QX, Ma YZ, Shao YH, Liu QR, Kong XG, Liu SW. A 15-year analysis of molecular epidemiology of avian infectious bronchitis coronavirus in China. Infection, Genetics and Evolution, 2011, 11(1): 190-200. DOI:10.1016/j.meegid.2010.09.002 |
| [3] | Cavanagh D. Coronavirus avian infectious bronchitis virus. Veterinary Research, 2007, 38(2): 281-297. DOI:10.1051/vetres:2006055 |
| [4] | Chen YQ, Jiang L, Zhao WJ, Liu LL, Zhao Y, Shao YH, Li HX, Han ZX, Liu SW. Identification and molecular characterization of a novel serotype infectious bronchitis virus (GI-28) in China. Veterinary Microbiology, 2017, 198: 108-115. DOI:10.1016/j.vetmic.2016.12.017 |
| [5] | Thor SW, Hilt DA, Kissinger JC, Paterson AH, Jackwood MW. Recombination in avian gamma-coronavirus infectious bronchitis virus. Viruses, 2011, 3(9): 1777-1799. DOI:10.3390/v3091777 |
| [6] | Jiang L, Han ZX, Chen YQ, Zhao WJ, Sun JF, Zhao Y, Liu SW. Characterization of the complete genome, antigenicity, pathogenicity, tissue tropism, and shedding of a recombinant avian infectious bronchitis virus with a ck/CH/LJL/140901-like backbone and an S2 fragment from a 4/91-like virus. Virus Research, 2018, 244: 99-109. DOI:10.1016/j.virusres.2017.11.007 |
| [7] | Cavanagh D, Davis PJ, Cook JKA, Li D, Kant A, Koch G. Location of the amino acid differences in the S1 spike glycoprotein subunit of closely related serotypes of infectious bronchitis virus. Avian Pathology, 1992, 21(1): 33-43. DOI:10.1080/03079459208418816 |
| [8] | Fan WS, Wang HY, Tang N, Dong ZH, Wei TC, Mo ML, Wei P. Establishment of identification method for infectious bronchitis virus vaccine strains and Guangxi field isolates. Progress in Veterinary Medicine, 2018, 39(5): 26-30. (in Chinese) 范文胜, 王海勇, 唐宁, 董志华, 韦天超, 磨美兰, 韦平. 鸡传染性支气管炎疫苗株与广西流行野毒株鉴别方法的建立. 动物医学进展, 2018, 39(5): 26-30. DOI:10.3969/j.issn.1007-5038.2018.05.005 |
| [9] | Mo ML, Li M, Huang BC, Fan WS, Wei P, Wei TC, Cheng QY, Wei ZJ, Lang YH. Molecular characterization of major structural protein genes of avian coronavirus infectious bronchitis virus isolates in southern China. Viruses, 2013, 5(12): 3007-3020. DOI:10.3390/v5123007 |
| [10] | Valastro V, Holmes EC, Britton P, Fusaro A, Jackwood MW, Cattoli G, Monne I. S1 gene-based phylogeny of infectious bronchitis virus:An attempt to harmonize virus classification. Infection, Genetics and Evolution, 2016, 39: 349-364. DOI:10.1016/j.meegid.2016.02.015 |
| [11] | Ignjatovic J, Galli U. Immune responses to structural proteins of avian infectious bronchitis virus. Avian Pathology, 1995, 24(2): 313-332. DOI:10.1080/03079459508419072 |
| [12] | Muradrasoli S, Bálint A, Wahlgren J, Waldenstr?m J, Belák S, Blomberg J, Olsen B. Prevalence and phylogeny of coronaviruses in wild birds from the Bering Strait area (Beringia). PLoS ONE, 2010, 5(10): e13640. DOI:10.1371/journal.pone.0013640 |
| [13] | Jackwood MW. Review of infectious bronchitis virus around the world. Avian Diseases, 2012, 56(4): 634-641. DOI:10.1637/10227-043012-Review.1 |
| [14] | de Wit JJS, Cook JKA, van der Heijden HMJF. Infectious bronchitis virus variants:a review of the history, current situation and control measures. Avian Pathology, 2011, 40(3): 223-235. DOI:10.1080/03079457.2011.566260 |
| [15] | Li M, Wang XY, Wei P, Chen QY, Wei ZJ, Mo ML. Serotype and genotype diversity of infectious bronchitis viruses isolated during 1985-2008 in Guangxi, China. Archives of Virology, 2012, 157(3): 467-474. DOI:10.1007/s00705-011-1206-6 |
| [16] | Muradrasoli S, Mohamed N, Hornyák A, Fohlman J, Olsen B, Belák S, Blomberg J. Broadly targeted multiprobe QPCR for detection of coronaviruses:Coronavirus is common among mallard ducks (Anas platyrhynchos). Journal of Virological Methods, 2009, 159(2): 277-287. DOI:10.1016/j.jviromet.2009.04.022 |
| [17] | Chen GQ, Zhuang QY, Wang KC, Liu S, Shao JZ, Jiang WM, Hou GY, Li JP, Yu JM, Li YP, Chen JM. Identification and survey of a novel avian coronavirus in ducks. PLoS ONE, 2013, 8(8): e72918. DOI:10.1371/journal.pone.0072918 |
| [18] | Yao SX, Ou CB, Liu XY, Wang XW, Yao ZH, Liu JJ. Isolation of a novel serotype strain of infectious bronchitis virus ZZ2004 from ducks in China. Virus Genes, 2016, 52(5): 660-670. DOI:10.1007/s11262-016-1352-8 |
| [19] | Wu XP, Pan SL, Zhou WD, Wu YJ, Huang YF, Wu BC. The isolation and identification of infectious bronchitis virus PTFY strain in muscovy ducks. Chinese Journal of Virology, 2016, 32(2): 203-209. (in Chinese) 吴晓平, 潘书磊, 周五朵, 吴异健, 黄一帆, 吴宝成. 番鸭源传染性支气管炎病毒PTFY株的分离鉴定. 病毒学报, 2016, 32(2): 203-209. |
| [20] | Cavanagh D. Coronaviruses in poultry and other birds. Avian Pathology, 2005, 34(6): 439-448. DOI:10.1080/03079450500367682 |
| [21] | Woo PCY, Lau SKP, Lam CSF, Tsang AKL, Hui SW, Fan RYY, Martelli P, Yuen KY. Discovery of a novel bottlenose dolphin coronavirus reveals a distinct species of marine mammal coronavirus in Gammacoronavirus. Journal of Virology, 2014, 88(2): 1318-1331. DOI:10.1128/JVI.02351-13 |
| [22] | Mo ML, Hong SM, Kwon HJ, Kim IH, Song CS, Kim JH. Genetic diversity of spike, 3a, 3b and e genes of infectious bronchitis viruses and emergence of new recombinants in Korea. Viruses, 2013, 5(2): 550-567. DOI:10.3390/v5020550 |
| [23] | Archetti I, Horsfall FL. Persistent antigenic variation of influenza A viruses after incomplete neutralization in ovo with heterologous immune serum. The Journal of Experimental Medicine, 1950, 92(5): 441-462. DOI:10.1084/jem.92.5.441 |
| [24] | Han ZX, Jiang L, Zhao WJ, Chen YQ, Xu LW, Sun JF, Zhao Y, Liu SW. Isolation and characteristics of the Arkansas-type infectious bronchitis virus in China. Avian Diseases, 2018, 62(1): 18-27. DOI:10.1637/11719-072517-Reg.1 |
| [25] | Jiang L, Zhao WJ, Han ZX, Chen YQ, Zhao Y, Sun JF, Li HX, Shao YH, Liu LL, Liu SW. Genome characterization, antigenicity and pathogenicity of a novel infectious bronchitis virus type isolated from south China. Infection, Genetics and Evolution, 2017, 54: 437-446. DOI:10.1016/j.meegid.2017.08.006 |
| [26] | Wu CL, He YN, Li HM, Sun XK, Tan YC, Wei TC, Mo ML, Wei P. Isolation and analysis of structural protein genes variation and serotype of a recombinant strain of chicken infectious bronchitis virus. Acta Veterinaria Et Zootechnica Sinica, 2015, 46(5): 815-823. (in Chinese) 吴翠兰, 何怡宁, 李和鸣, 孙新宽, 谭渝才, 韦天超, 磨美兰, 韦平. 一株重组鸡传染性支气管炎病毒的分离及结构蛋白基因变异和血清型分析. 畜牧兽医学报, 2015, 46(5): 815-823. |
