孙雨, 李玉英, 王司军, 于乾龙, 岳琦, 李朝飞


西北农林科技大学植物保护学院, 陕西 杨凌 712100
收稿日期:2018-03-15;修回日期:2018-04-11;网络出版日期:2018-04-20
基金项目:国家自然科学基金面上项目(31672082)
*通信作者:李朝飞, E-mail:zhaofeili@nwsuaf.edu.cn
摘要:[目的] 克隆草地贪夜蛾(Spodoptera frugiperda)Vta1基因,检测Vta1在苜蓿银纹夜蛾核多角体病毒(Autographa californica multiple nucleopolyhedrovirus,AcMNPV)复制中的作用。[方法] 利用反转录-PCR与PCR方法筛选草地贪夜蛾Vta1基因及缺失Vta1 N-端MIT结构域的突变体并构建其瞬时表达质粒,通过转染Sf9细胞检测表达;构建Vta1及其突变体的双分子荧光互补表达质粒,并通过瞬时转染检测其与Vps4及ESCRT-Ⅲ亚基Vps46与Vps60的相互作用;共转染gp64与Vta1及其突变体瞬时表达质粒,检测瞬时表达Vta1突变体对AcMNPV出芽型病毒产量及病毒基因启动子指导报告基因表达的影响。[结果] 获得了草地贪夜蛾Vta1基因。氨基酸序列相似性分析表明,昆虫、酵母与人类Vta1同源蛋白的相似性分别约为20%与50%。Western blotting分析表明GFP标签的Vta1及其突变体均能在瞬时转染的Sf9细胞中表达。双分子荧光互补分析发现,缺失第1个或第2个MIT结构域显著降低Vta1突变体与Vps4、Vps46或Vps60的相互作用。此外,瞬时表达Vta1突变体显著降低了AcMNPV感染性出芽型病毒的产量,但并未影响AcMNPV ie1基因早期启动子和p6.9基因晚期启动子指导的LacZ和GUS报告基因的表达。[结论] Vta1可能参与杆状病毒AcMNPV子代病毒粒子的组装和/或出芽释放过程。
关键词:草地贪夜蛾内吞分选转运复合体Vta1苜蓿银纹夜蛾核多角体病毒
Effects of deletion of MIT domains of host Vta1 on replication of Autographa californica multiple nucleopolyhedrovirus
Yu Sun, Yuying Li, Wang Sijun, Qianlong Yu, Qi Yue, Zhaofei Li


College of Plant Protection, Northwest A & F University, Yangling 712100, Shaanxi Province, China
Received 15 March 2018; Revised 11 April 2018; Published online 20 April 2018
*Corresponding author: Zhaofei Li, E-mail:zhaofeili@nwsuaf.edu.cn
Supported by the National Natural Science Foundation of China (31672082)
Abstract: [Objective] To isolate Vta1 of Spodoptera frugiperda and to detect the requirement of Vta1 in replication of Autographa californica multiple nucleopolyhedrovirus(AcMNPV). [Methods] Vta1 was isolated from Sf9 cells using reverse-transcription PCR.Two mutations of Vta1, which removed the first or second microtubule-interacting and transport domain (MIT) were transiently expressed.The interaction of Vta1 and its mutants with Vps4, Vps46 and Vps60 was detected with bimolecular fluorescence complementation (BiFC).Using a viral complementation assay, the effect of Vta1 mutants on replication of AcMNPV was determined. [Results] We obtained Vta1 of S.frugiperda.The amino acid identities between Vta1 of insect and yeast or between Vta1 of insect and human are about 20% or 50%.Western blotting analysis showed GFP-tagged Vta1 and its mutants were expressed in Sf9 cells.BiFC analysis revealed that deletion of MIT1 or MIT2 significantly reduced the interaction of Vta1 mutants with Vps4, Vps46 or Vps60.Overexpression of Vta1 mutants significantly decreased the infectious AcMNPV budded virions production but had no effect on the expression of the reporter genes LacZ and GUS, which separately controlled by AcMNPV ie1 and p6.9 early or late promoter. [Conclusion] Vta1 might be involved in assembly and/or budding of progeny virions of AcMNPV.
Keywords: Spodoptera frugiperdaESCRTVta1AcMNPV
在真核细胞中,内吞分选转运复合体(the endosomal sorting complex required for transport,ESCRT)由ESCRT-0、ESCRT-Ⅰ、ESCRT-Ⅱ、ESCRT-Ⅲ及Vps4 (vacuolar protein sorting protein 4)5个复合体与一些辅助蛋白组成。ESCRT复合体参与多泡体(multivesicular bodies, MVB)的形成、胞质分裂、质膜修复及核膜重构等生理过程,对维持细胞稳态具有重要作用[1-2]。此外,ESCRT复合体也参与包括人类免疫缺陷型病毒(human immunodeficiency virus type 1, HIV-1)与昆虫杆状病毒等多种囊膜病毒的入侵或出芽释放过程[3-5]。研究表明,在酵母细胞中ESCRT-Ⅲ复合体由Vps2、Vps20、Vps24、Vps32、Vps46、Vps60等多个亚基组成,具有脂质双层膜解离功能[6]。在ESCRT系统中,Vps4是ATP酶,具有水解ESCRT-Ⅲ复合体促进其组分循环利用的功能[6]。近年的研究发现,Vps4的激活依赖Vta1(Vps twenty associated 1)[7-10]。
研究表明,酵母Vta1包含N-端的2个MIT (microtubule-interacting and transport domain)结构域与C-端的VSL (Vta1/SBP-1/LIP5)结构域。其中,VSL结构域与Vps4 C-端的β折叠结合;而Vta1 N-端的MIT结构域与ESCRT-Ⅲ组分Vps46和Vps60结合[7, 10]。研究发现,在Vps46与Vps60不存在时,Vta1对Vps4的激活能力较弱;当Vps46或Vps60与Vta1的MIT结构域结合后,Vta1对Vps4的激活能力则显著增强[7]。
昆虫杆状病毒是一类DNA囊膜病毒,其双链环状分子大小约为80-180 kb。在杆状病毒复制过程中,通常产生两种形态和功能各异的病毒:包埋型病毒(occlusion-derived virus,ODV)和出芽型病毒(budded virus,BV)。昆虫口服被病毒污染的食物后,在昆虫中肠碱性环境条件下,多角体裂解并释放出ODV;ODV病毒粒子穿过中肠围食膜起始感染中肠上皮细胞。BV在不同组织或离体培养的细胞之间进行感染[11]。目前,较广泛深入研究的杆状病毒为苜蓿银纹夜蛾核多角体病毒(AcMNPV)[11]。研究发现,干扰宿主细胞ESCRT-Ⅰ、ESCRT-Ⅲ或Vps4的表达显著影响AcMNPV出芽型病毒的入侵和子代病毒的出芽释放[4-5]。
本文通过克隆草地贪夜蛾(Spodoptera frugiperda) Vta1基因,缺失了该基因N-端编码的2个MIT结构域,构建了Vta1及其突变体的表达质粒。初步检测了Vta1及其突变体与Vps4及ESCRT-Ⅲ亚基Vps46与Vps60的相互作用,以及瞬时表达Vta1及其突变体对AcMNPV出芽型病毒复制的影响,为揭示宿主ESCRT复合体调控杆状病毒侵染机理奠定基础。
1 材料和方法 1.1 材料
1.1.1 细胞与病毒: 草地贪夜蛾细胞Sf9购自美国模式培养物集存库(ATCC);Sf9OP1D细胞系(持续表达Orgyia pseudotsugata multiple nucleopolyhedrovirus GP64蛋白)[12]与缺失gp64基因的AcMNPV病毒LacZGUS-gp64ko (报告基因LacZ与GUS的表达分别由AcMNPV早期基因ie1和晚期基因p6.9的启动子控制)[5]由美国康奈尔大学Gary Blissard教授惠赠。两株细胞均在28 ℃培养,培养基为含有10% FBS (Gibco)的TNMFH (Sigma-Aldrich)。
1.1.2 菌株与质粒: 大肠杆菌(Escherichia coli) DH5α购自TaKaRa公司,pIEnGFP与基于mCherry的双分子荧光互补表达质粒本实验室构建[13]。AcMNPV gp64表达质粒pBieGP64[4]由Gary Blissard教授惠赠。
1.1.3 酶、抗体与试剂盒: T4 DNA连接酶和限制性内切酶BamH Ⅰ、EcoR Ⅰ购自Promega公司,ExTaq polymerase购自TaKaRa公司。GFP、c-Myc-tag、HA-tag、GP64单克隆抗体分别购自GenScript、Abbkine与Santa Cruz公司,碱性磷酸酶标记的羊抗鼠IgG与NBT/BCIP显色试剂盒购自Promega公司。
1.2 PCR引物设计 根据草地贪夜蛾EST数据库[14](http://bioweb.ensam.inra.fr/spodobase)中的部分Vta1序列设计PCR引物(表 1),引物由Invitrogen公司合成。
表 1. 草地贪夜蛾Vta1及缺失MIT结构域的PCR引物序列 Table 1. Primer sequences for PCR amplification of S. frugiperda Vta1 and the MIT domain-deleted constructs
| Primer | Sequence (5′-3′) | Construct |
| Vta1BF | AATGGATCCATGTCTGTGAATATACCTGAGT | Vta1 |
| Vta1ER | AATGAATTCTCAAGCAGGATCACGGCCTGTT | |
| dMIT1F | AATGGATCCAATGAAGCAATTACTAATGAAGT | dMIT1 |
| dMIT2F | TATCGAGAACCAGGACCAATGCAGTCAGAA | dMIT2 |
| dMIT2R | TGGTCCTGGTTCTCGATACGTTTTCTTAGCT |
表选项
1.3 Vta1基因克隆及突变体构建 收集适量的Sf9细胞采用RNAiso plus Trizol (TaKaRa)进行总RNA提取并按照RNA LA PCRTM (AMV)反转录试剂方法(TaKaRa)进行cDNA合成。采用PCR及重叠PCR方法分别克隆Vta1基因及构建缺失Vta1 N-端MIT1或MIT2的截短突变体。PCR反应体系(50μL)包括cDNA 5 μL、Ex Taq polymerase 0.25 μL、10× Ex Taq buffer 5 μL、dNTP (1×10-2 mol/L) 4 μL、上、下游引物(5×10-6 mol/L)各4 μL、ddH2O 27.75 μL。反应条件为:94 ℃ 3 min;94 ℃ 30 s,52 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃ 10 min。PCR产物经1%琼脂糖凝胶电泳纯化后,用BamH Ⅰ与EcoR Ⅰ酶切并连接到pIEnGFP载体,重组质粒命名为GFP-Vta1pBlue、GFP-dMIT1pBlue、GFP-dMIT2pBlue并送至生工生物工程(上海)股份有限公司测序。
1.4 Vta1及其突变体的表达 采用CaPO4沉淀法[4],将GFPpBlue[5]、GFP-Vta1pBlue、GFP-dMIT1pBlue、GFP-dMIT2pBlue质粒(各2 μg)分别转染Sf9细胞。在转染后36 h,收集细胞并用0.1% Triton X-100裂解液(0.1% Triton X-100、0.05 mol/L Tris·Cl、0.15 mol/L的NaCl、protease inhibitor cocktail (Roche),pH 8.0)裂解,进行SDS-PAGE。随后,将蛋白样品转印至PVDF膜(Millipore),用GFP抗体和碱性磷酸酶标记的羊抗鼠IgG检测。
1.5 双分子荧光互补分析 采用BamH Ⅰ与EcoR Ⅰ酶切GFP-Vta1pBlue、GFP-dMIT1pBlue、GFP-dMIT2pBlue质粒并回收Vta1、dMIT1及dMIT2片段,将其分别与基于mCherry的双分子荧光互补(bimolecular fluorescence complementation, BiFC)表达载体Nm-HApBlue或Cm-MycpBlue连接[13]。随后,将Nm-Vta1pBlue、Nm-dMIT1pBlue、Nm-dMIT2pBlue、Cm-Vta1pBlue、Cm-dMIT1pBlue、Cm-dMIT2pBlue分别与c-Myc-tag与HA-tag标签的Vps4-NmpBlue、Vps46-NmpBlue、Vps60-NmpBlue、Vps4-CmpBlue、Vps46-CmpBlue、Vps60-CmpBlue[5]组合转染Sf9细胞(12孔培养板,2×105细胞/孔,每个质粒2 μg,每个质粒组合转染4个培养孔)。在转染后36 h收集其中一组细胞,用c-Myc-tag与HA-tag抗体进行Western blotting检测各融合蛋白的表达。同时,在倒置荧光显微镜下观察其他转染细胞并拍照。
1.6 表达Vta1突变体对AcMNPV复制的影响 在12孔细胞培养板中(2×105细胞/孔),采用磷酸钙沉淀法将GP64表达质粒pBieGP64与GFPpBue、GFP-Vta1pBlue、GFP-dMIT1pBlue或GFP-dMIT2pBlue (各2 μg)共转染Sf9细胞。阳性对照组合为共转染pBieGP64与E231Q-GFPpBlue质粒[4] (每一个质粒组合重复转染3个细胞培养孔)。在转染后12 h,接种LacZGUS-gp64ko病毒感染细胞(MOI=5 TCID50)1 h。随后,用TNMFH培养基漂洗细胞一次并换入新鲜的TNMFH培养基。在病毒感染后24 h,收取培养上清液,3000 g、5 min离心去除细胞。采用TCID50方法,用Sf9OP1D细胞测定AcMNPV出芽型病毒的滴度。同时,Western blotting检测细胞中GP64与Vta1蛋白的表达。重复上述转染、病毒感染实验并在病毒感染后6 h和24 h,分别收集细胞并用含有2 mg/mL LacZ底物Chlorophenol red-β-D-galactopyranoside (CPRG, Roche Diagnostics GmbH)或GUS底物4-Nitrophenyl β-D-glucuronide (PNPG, Sigma- Aldrich)的0.5% NP-40 (PBS,pH 7.4)裂解细胞并在37 ℃反应30 min。随后,在酶标仪中读取570 nm (CPRG)或405 nm (PNPG)的吸光值。
2 结果和分析 2.1 Vta1基因的序列分析 通过提取草地贪夜蛾Sf9细胞的总RNA,结合反转录与PCR方法获得了Vta1基因(GenBank登录号:MH054904)。序列分析表明,该基因的开放阅读框(open reading frame,ORF)为969个核苷酸,预测编码322个氨基酸。氨基酸序列相似性分析表明,昆虫与酵母的Vta1蛋白序列相似性约为20%,而昆虫与人类的Vta1同源蛋白序列相似性约为50%;在不同昆虫中,Vta1同源蛋白的序列相似性差异较大,约为40%-78%。结构域分析发现,在酵母、昆虫与人类Vta1同源蛋白的氨基酸序列中均保守存在MIT1、MIT2与VSL结构域(图 1)。
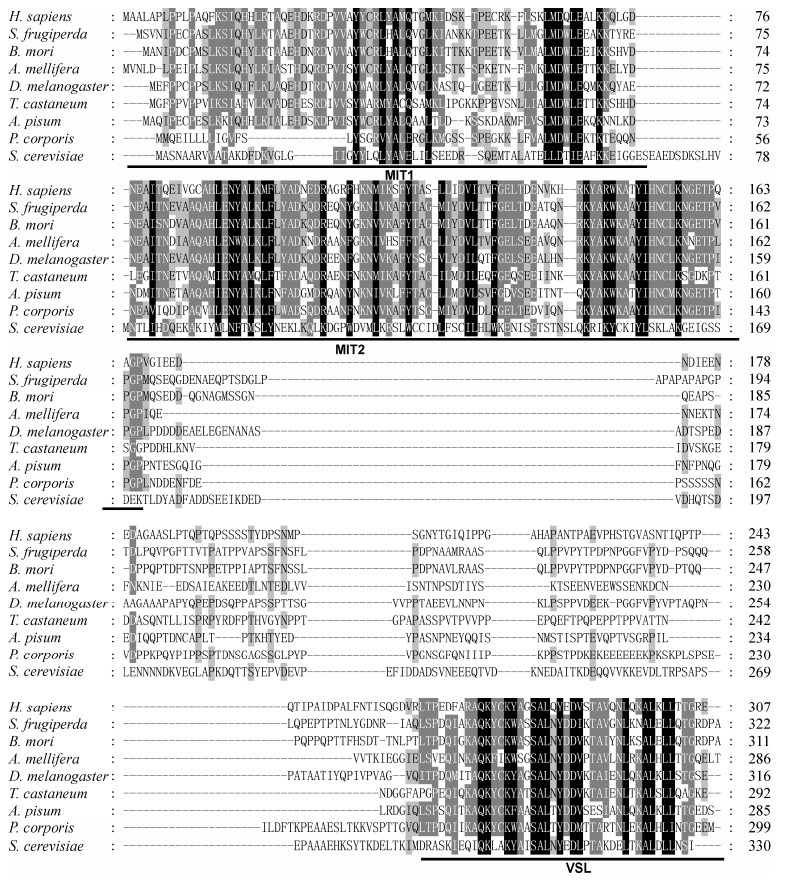 |
| 图 1 昆虫、酵母与人类Vta1同源蛋白的氨基酸序列比对分析 Figure 1 Amino acid sequence alignment of Vta1 homologs from insects, yeast and humans. The predicted MIT1, MIT2 and VSL domains are underlined. MIT, microtubule-interacting and transport domain; VSL, Vta1/SBP-1/LIP5. The amino acid sequences used were from Homo sapiens (GenBank accession No. NP057569), Spodoptera frugiperda (MH054904), Bombyx mori (NP001040410), Apis mellifera (XP001123063), Drosophila melanogaster (NP647640), Tribolium castaneum (XP970311), Acyrthosiphon pisum (NP001191949), Pediculus humanus corporis (XP002423438) and Saccharomyces cerevisiae (NP013282). |
| 图选项 |
2.2 Vta1与缺失MIT结构域突变体的表达 采用普通PCR和重叠PCR方法分别缺失了草地贪夜蛾Vta1基因N-端编码的MIT1和MIT2结构域,突变体命名为dMIT1、dMIT2 (图 2-A)。将N-端融合GFP的Vta1及其突变体瞬时表达质粒GFP-Vta1pBlue、GFP-dMIT1pBlue、GFP-dMIT2pBlue及对照质粒GFPpBlue转染Sf9细胞。Western blotting分析表明,各融合蛋白在Sf9细胞中均有表达(图 2-B)。有趣的是,过表达GFP标签的dMIT2突变体诱导约30% Sf9细胞的形状由通常的圆形改变为梭形(图 2-C),推测该突变体的表达可能影响了细胞分裂过程而引发部分Sf9细胞形态改变。
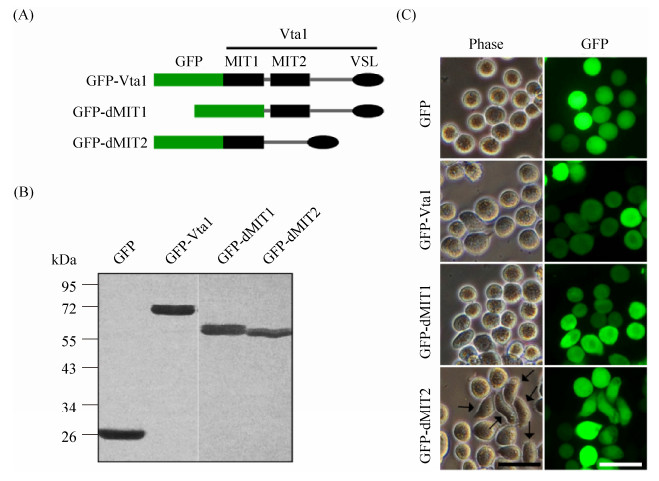 |
| 图 2 GFP标签的草地贪夜蛾Vta1及缺失其MIT结构域的突变体在Sf9细胞中的瞬时表达 Figure 2 Transient expression of GFP-tagged Vta1 and its MIT domains-deleted constructs in Sf9 cells. A: diagram representation of domain structure and GFP fusions of Vta1 and its N-terminal MIT domains-deleted constructs. MIT, microtubule-interacting and transport domain; VSL, Vta1/SBP-1/LIP5. B: Western blotting analysis of transiently expressed GFP-Vta1 fusion proteins in Sf9 cells by using an anti-GFP monoclonal antibody. C: morphology of Sf9 cells transfected with the plasmids expressing GPF-tagged Vta1 and its mutation constructs. The spindle cells in which expressing GFP-dMIT2 were indicated with black arrows. Bar, 50 μm. |
| 图选项 |
2.3 Vta1及缺失MIT结构域突变体与Vps4、Vps46及Vps60的相互作用 根据双分子荧光互补技术(BiFC)原理,将Vta1及缺失MIT结构域的突变体分别与红色荧光蛋白mCherry的N-端(Nm)或C-端(Cm)融合并将其分别与Vps4、Vps46或Vps60的BiFC表达质粒组合共转染Sf9细胞。如图 3所示,在转染后36 h,采用HA-tag与c-Myc-tag抗体检测发现各融合蛋白在Sf9细胞中均有表达(图 3-A,其中mCherry N-端融合Vta1及缺失MIT结构域的突变体与mCherry C-端融合Vps4、Vps46、或Vps60的表达结果未显示)。在共转染Cm-Vta1pBlue与Vps4-NmpBlue、VPS46-NmpBlue或Vps60-NmpBlue组合的Sf9细胞中观察到约12%-20%的红色荧光细胞(图 3-B,C)。相比较,在共转染Cm-dMIT1pBlue与Vps4-NmpBlue的Sf9细胞中仅存在约3%的红色荧光细胞,而在共转染Cm-dMIT1pBlue与Vps46-NmpBlue或Vps60-NmpBlue以及共转染Cm-dMIT2pBlue与Vps4-NmpBlue、Vps46-NmpBlue或Vps60-NmpBlue组合的Sf9细胞中未观察到mCherry红色荧光(图 3-B,C)。在共转染Nm-Vta1pBlue、Nm-dMIT1pBlue或Nm-dMIT2pBlue与Vps4-CmpBlue、Vps46-CmpBlue或Vps60-CmpBlue组合的Sf9细胞中,我们观察到类似的相互作用现象(结果未显示)。据此,我们推测缺失MIT1或MIT2结构域显著抑制了Vta1突变体与Vps4、Vps46及Vps60的相互作用。
 |
| 图 3 双分子荧光互补分析Vta1及其突变体与Vps4、Vps46及Vps60的相互作用 Figure 3 BiFC analysis of the interactions of Vta1 and its mutation constructs with Vps4, Vps46 and Vps60. A pair of BiFC plasmids: one expressing Cm-Myc fused Vta1 or its mutation constructs, and the other expressing HA-Nm-tagged Vps4, Vps46 or Vps60, were used to co-transfect Sf9 cells. At 36 h post-transfection, the expression of each construct in co-transfected Sf9 cells was analyzed by Western blotting with anti-HA (for Nm-tagged Vps4, Vps46 and Vps60) or anti-Myc (for Cm-tagged Vta1 and its mutation constructs) antibodies (A) and the cells were examined for red fluorescence complementation by epifluorescence microscopy (B). C: the percentage of mCherry red fluorescence-positive cells in five fields was estimated. Error bars represent the standard deviations from the mean of three replicates. |
| 图选项 |
2.4 瞬时表达缺失MIT结构域的Vta1突变体对AcMNPV复制的影响 为了初步探究Vta1是否与杆状病毒AcMNPV侵染有关,我们采用病毒缺失补偿策略[4-5]分析瞬时表达Vta1突变体对AcMNPV复制的影响。考虑到Sf9细胞的转染效率约为70%,共转染Vta1或其突变体瞬时表达质粒与GP64表达质粒(GP64为病毒出芽释放所必需[15],瞬时表达GP64可以补偿病毒出芽释放所需要的GP64)尽可能确保出芽释放的病毒来自共转染表达Vta1或其突变体与GP64的Sf9细胞。在共转染12 h后,用缺失gp64基因的AcMNPV病毒LacZGUS-gp64ko感染Sf9细胞。如图 4所示,在病毒感染后24 h,Western blotting分析表明感染细胞中GP64与Vta1或其突变体的表达水平类似(图 4-A)。瞬时表达GFP标签的Vps4突变体E231Q (E231Q-GFP)导致细胞培养上清中感染性病毒粒子的产量急剧下降。相比较,瞬时表达Vta1对感染性AcMNPV的产生没有显著影响,然而,瞬时表达缺失MIT结构域的Vta1突变体dMIT1或dMIT2均导致感染性AcMNPV出芽型病毒产量显著下降(图 4-B)。为了进一步分析Vta1突变体对AcMNPV复制的影响,我们重复上述共转染与感染实验并在LacZGUS-gp64ko感染后6 h与24 h分别检测Sf9细胞中的LacZ和GUS活性。如图 5所示,与我们之前的研究结果类似[5],瞬时表达Vps4突变体E231Q (E231Q-GFP)造成病毒感染早、晚期阶段报告基因LacZ和GUS的表达显著下降。比较而言,LacZ或GUS的活性在瞬时表达GFP标签的Vta1或缺失MIT结构域突变体的Sf9细胞中与对照(表达GFP)一致,揭示病毒复制进入晚期阶段。这一结果初步表明瞬时表达缺失MIT结构域的Vta1突变体可能对病毒入侵及复制过程没有显著影响,而瞬时表达这些突变体对感染性病毒产量的影响可能暗示Vta1突变体影响了病毒粒子的组装和/或出芽释放。
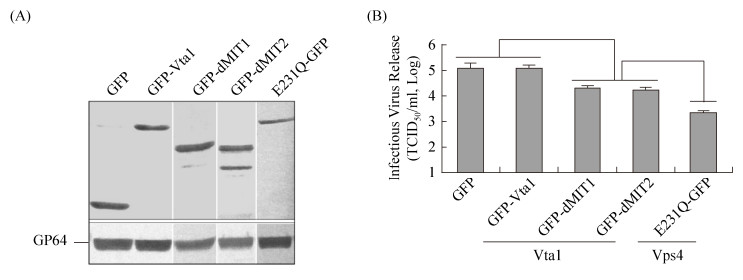 |
| 图 4 瞬时表达Vta1及缺失MIT结构域的突变体对AcMNPV出芽型病毒产生的影响 Figure 4 Effects of transient expression of Vta1 and its MIT domain-deleted constructs on the production of infectious budded virions of AcMNPV. Sf9 cells were co-transfected with two plasmids expressing GP64 and either GFP-tagged Vta1, dMIT1, dMIT2, or GFP. At 12 h post-transfection, Sf9 cells were infected with the gp64-knockout virus (LacZGUS-gp64ko, MOI=5). At 24 h post-infection, the expression of GP64 and GFP-tagged Vta1 and its mutation constructs was examined by Western blotting analysis using anti-GFP and anti-GP64 (AcV5) monoclonal antibodies (A). B: the effect of mutated Vta1 proteins on replication of AcMNPV was analyzed by determining the titers of infectious budded virions in the cultured supernatants. Error bars represent standard deviations from the mean of three replicates. *, P < 0.05 (by unpaired t test). |
| 图选项 |
 |
| 图 5 瞬时表达Vta1及缺失MIT结构域的突变体对AcMNPV启动子指导的LacZ与GUS报告基因表达的影响 Figure 5 Effects of transient expression of Vta1 and its MIT domain-deleted constructs on the expression of the reporter genes LacZ and GUS that directed by AcMNPV promoters. Sf9 cells were co-transfected with two plasmids expressing GP64 and either GFP-tagged Vta1, dMIT1, dMIT2, Vps4 mutation construct E231Q, or GFP. At 12 h post-transfection, Sf9 cells were infected with LacZGUS-gp64ko virus (MOI=5). A: at 6 h post-infection, the expression of LacZ that controlled by AcMNPV ie1 early promoter was determind using CPRG as the substrate. B: at 24 h post-infection, the expression of GUS that controlled by AcMNPV p6.9 late promoter was determined using PNPG as the substrate. Error bars represent standard deviations from the mean of three replicates. |
| 图选项 |
3 讨论 自从2001年发现ESCRT复合体以来,大量的研究表明ESCRT复合体参与真核细胞内几乎所有的脂质双层膜解离过程。其中,ESCRT-0、ESCRT-Ⅰ与ESCRT-Ⅱ参与底物募集以及脂质双层膜结合,而ESCRT-Ⅲ则直接介导膜结构的缢缩和解离。在膜结构剪切的最后阶段,Vta1与ESCRT-Ⅲ亚基Vps46与Vps60协助激活Vps4并利用Vps4水解ATP产生的能量解聚ESCRT-Ⅲ复合体[1-2]。研究表明,在酵母细胞中Vps46与Vps60均能与Vta1 N-端的MIT结构域结合并调控Vps4功能[8-10]。
近年来,较多的研究发现宿主ESCRT复合体调控多种RNA病毒、逆转录病毒以及一些大分子DNA囊膜病毒的侵染过程。RNA干扰或表达相应ESCRT组分的显性-负性(dominant-negative,DN)突变体普遍影响上述病毒的入侵和/或出芽释放[3, 16]。近期的研究发现,RNA干扰抑制宿主细胞Vta1同源基因的表达,显著降低人类免疫缺陷性病毒(HIV-1)感染性病毒的出芽释放[17]。最近的研究表明,在杆状病毒AcMNPV侵染昆虫细胞Sf9与Tn5B1-4的过程中,病毒的入侵及子代病毒核衣壳经核膜的释放过程依赖于宿主ESCRT-Ⅰ、ESCRT-Ⅲ及Vps4的功能[4-5]。然而,关于宿主ESCRT复合体中其他组分,特别是一些调控ESCRT复合体功能的辅助蛋白是否参与AcMNPV的侵染尚不清楚。
本文中,我们克隆了草地贪夜蛾Vta1基因并构建了缺失其N-端编码2个MIT结构域的区域。值得一提的是,在Sf9细胞中瞬时表达GFP标签的dMIT2突变体诱导部分Sf9细胞的形态由通常的圆形转变为梭形(图 2-C)。考虑到在酵母细胞中RNA干扰Vta1同源基因的表达显著抑制胞质分裂[8-9],我们推测dMIT2突变体的瞬时表达可能影响了部分Sf9细胞的正常分裂过程。类似于在酵母细胞中的发现[8, 10],缺失草地贪夜蛾Vta1 N-端的MIT1或MIT2结构域完全抑制了Vta1突变体dMIT1或dMIT2与Vps46或Vps60的互作(图 3)。同时,与酵母细胞中不同[7-10],我们发现缺失MIT结构域也显著影响或完全抑制Vta1与Vps4的互作,推测草地贪夜蛾Vta1的MIT结构域直接参与二者的互作或MIT结构域的缺失引发Vta1突变体构象的改变进而影响Vta1与Vps4的互作。关于上述蛋白之间互作的分子机制仍需要采用其他方法,如酵母双杂交、免疫共沉淀等进一步验证。
研究发现,在ESCRT-Ⅲ亚基的N-端或C-端融合一些大分子蛋白如GFP将形成相应ESCRT蛋白的显性-负性(DN)突变体进而造成过表达细胞中产生可见的囊泡现象并影响一些囊膜病毒的入侵和/或出芽释放[3, 5]。我们发现,在Sf9细胞中瞬时表达GFP融合的Vta1并没有诱导产生可见的异常表型(图 2-C)也不影响感染性AcMNPV出芽型病毒的产生(图 4)或病毒早、晚期基因启动子指导下的报告基因表达(图 5)。相比较而言,瞬时表达GFP标签的缺失MIT结构域的Vta1突变体却显著降低了感染性AcMNPV出芽型病毒的产量(图 4)。进一步分析发现,瞬时表达dMIT1或dMIT2突变体不影响AcMNPV早、晚期基因启动子指导下的报告基因LacZ和GUS的表达(图 5),推测Vta1突变体不影响出芽型病毒的入侵和病毒复制过程,但对病毒粒子的组装和/或出芽释放过程产生了影响。在酵母细胞中,Vta1通过其N-端的MIT结构域与Vps46或Vps60互作[8-10]。我们之前的研究发现,瞬时表达Vps4、Vps46或Vps60的DN突变体显著降低子代病毒粒子的出芽释放[5]。因此,Vta1突变体对AcMNPV侵染的影响也可能是由于该类突变体间接影响了Vps46与Vps60对Vps4功能调节的结果。关于Vta1在AcMNPV侵染中的作用仍需要进一步深入研究。
References
| [1] | Christ L, Raiborg C, Wenzel EM, Campsteijn C, Stenmark H. Cellular functions and molecular mechanisms of the ESCRT membrane-scission machinery. Trends in Biochemical Sciences, 2017, 42(1): 42-56. DOI:10.1016/j.tibs.2016.08.016 |
| [2] | Hurley JH. ESCRTs are everywhere. The EMBO Journal, 2015, 34(19): 2398-2407. DOI:10.15252/embj.201592484 |
| [3] | Scourfield EJ, Martin-Serrano J. Growing functions of the ESCRT machinery in cell biology and viral replication. Biochemical Society Transactions, 2017, 45(3): 613-634. DOI:10.1042/BST20160479 |
| [4] | Li Z, Blissard GW. Cellular Vps4 is required for efficient entry and egress of budded virions of Autographa californica multiple nucleopolyhedrovirus. Journal of Virology, 2012, 86(1): 459-472. DOI:10.1128/JVI.06049-11 |
| [5] | Yue Q, Yu Q, Yang Q, Xu Y, Guo Y, Blissard GW, Li Z. Distinct roles of cellular ESCRT-Ⅰ and ESCRT-Ⅲ proteins in efficient entry and egress of budded virions of Autographa californica multiple nucleopolyhedrovirus. Journal of Virology, 2018, 92(1): e01636-17. DOI:10.1128/JVI.01636-17 |
| [6] | Chiaruttini N, Roux A. Dynamic and elastic shape transitions in curved ESCRT-Ⅲ filaments. Current Opinion in Cell Biology, 2017, 47: 126-135. DOI:10.1016/j.ceb.2017.07.002 |
| [7] | Davies BA, Norgan AP, Payne JA, Schulz ME, Nichols MD, Tan JA, Xu ZH, Katzmann DJ. Vps4 stimulatory element of the cofactor Vta1 contacts the ATPase Vps4 α7 and α9 to stimulate ATP hydrolysis. Journal of Biological Chemistry, 2014, 289(41): 28707-28718. DOI:10.1074/jbc.M114.580696 |
| [8] | Lottridge JM, Flannery AR, Vincelli JL, Stevens TH. Vta1p and Vps46p regulate the membrane association and ATPase activity of Vps4p at the yeast multivesicular body. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(16): 6202-6207. DOI:10.1073/pnas.0601712103 |
| [9] | Shiflett SL, Ward DM, Huynh D, Vaughn MB, Simmons JC, Kaplan J. Characterization of Vta1p, a class E Vps protein in Saccharomyces cerevisiae. Journal of Biological Chemistry, 2004, 279(12): 10982-10990. DOI:10.1074/jbc.M312669200 |
| [10] | Yang D, Hurley JH. Structural role of the Vps4-Vta1 interface in ESCRT-Ⅲ recycling. Structure, 2010, 18(8): 976-984. DOI:10.1016/j.str.2010.04.014 |
| [11] | Rohrmann GF. Baculovirus molecular biology. 3rd ed. Bethesda, MD: National Center for Biotechnology Information (US), 2013. |
| [12] | Plonsky I, Cho MS, Oomens AGP, Blissard G, Zimmerberg J. An analysis of the role of the target membrane on the GP64-induced fusion pore. Virology, 1999, 253(1): 65-76. DOI:10.1006/viro.1998.9493 |
| [13] | Guo Y, Yue Q, Gao JL, Wang Z, Chen YR, Blissard GW, Liu TX, Li Z. Roles of cellular NSF protein in entry and nuclear egress of budded virions of Autographa californica multiple nucleopolyhedrovirus. Journal of Virology, 2017, 91(20): e01111-17. DOI:10.1128/JVI.01111-17 |
| [14] | Nègre V, H?telier T, Volkoff AN, Gimenez S, Cousserans F, Mita K, Sabau X, Rocher J, López-Ferber M, d'Alencon E, Audant P, Sabourault C, Bidegainberry V, Hilliou F, Fournier P. SPODOBASE: an EST database for the lepidopteran crop pest Spodoptera. BMC Bioinformatics, 2006, 7: 322. DOI:10.1186/1471-2105-7-322 |
| [15] | Oomens AGP, Blissard GW. Requirement for GP64 to drive efficient budding of Autographa californica multicapsid nucleopolyhedrovirus. Virology, 1999, 254(2): 297-314. DOI:10.1006/viro.1998.9523 |
| [16] | Votteler J, Sundquist WI. Virus budding and the ESCRT pathway. Cell Host & Microbe, 2013, 14(3): 232-241. |
| [17] | Ward DM, Vaughn MB, Shiflett SL, White PL, Pollock AL, Hill J, Schnegelberger R, Sundquist WI, Kaplan J. The role of LIP5 and CHMP5 in multivesicular body formation and HIV-1 budding in mammalian cells. Journal of Biological Chemistry, 2005, 280(11): 10548-10555. DOI:10.1074/jbc.M413734200 |
