赵东岳, 王德民, 林丹枫


福建师范大学生命科学学院, 福建省发育与神经生物学重点实验室, 福建 福州 350108
收稿日期:2018-04-23;修回日期:2018-07-10;网络出版日期:2018-12-03
基金项目:福建省教育厅项目(A类)(JAT170137,JT180080);福建师范大学生命科学学院项目(FZSKK2018003,FZSKK2018004)
*通信作者:林丹枫, Tel:+86-591-22860765;E-mail:mountain@fjnu.edu.cn
摘要:[目的] Rv3194c基因编码的是结核分枝杆菌的PDZ信号蛋白,本研究探讨该蛋白的亚细胞定位,为其细胞结合蛋白的筛选奠定基础。[方法] 从H37Rv基因组中扩增出编码只含有PDZ结构域的tRv3194c(Rv3194c 1-234 aa)的基因片段,在3'端加T2A和EGFP序列,一并插入真核表达载体构建出pcDNA3.1-tRv3194c-T2A-EGFP。将构建好的质粒瞬时转染L929细胞,并共感染重组痘苗病毒vTF7-3,用间接免疫荧光、流式细胞分选以及Western blotting检测融合蛋白的表达以及亚细胞定位。[结果] 成功构建出真核表达载体pcDNA3.1-tRv3194c-T2A-EGFP,瞬时转染L929细胞后融合蛋白tRv3194c定位于线粒体膜上,且重组痘苗病毒vTF7-3的感染有助于靶蛋白表达水平的提高。[结论] Rv3194蛋白的PDZ结构域与线粒体外膜相关蛋白结合,为了解该蛋白在细胞内的致病机制提供重要线索。
关键词:结核分枝杆菌Rv3194c蛋白线粒体重组痘苗病毒重组质粒
Subcellular localization of Rv3194c protein from Mycobacterium tuberculosis
Dongyue Zhao, Demin Wang, Danfeng Lin


Fujian Key Laboratory of Developmental and Neuro Biology, College of Life Sciences, Fujian Normal University, Fuzhou 350108, Fujian Province, China
Received 23 April 2018; Revised 10 July 2018; Published online 3 December 2018
*Corresponding author: Danfeng Lin, Tel: +86-591-22860765; E-mail: mountain@fjnu.edu.cn
Supported by the Educational Department Project (Category A) of Fujian Province (JAT170137, JT180080) and by the Colloge of Life Sciences of Fujian Normal University (FZSKK2018003, FZSKK2018004)
Abstract: [Objective] To investigate the expression and subcellular localization of post-synaptic density-95, Drosophilia tumor suppressor protein diskslarge-1, the tight junction protein zonula occludentes 1 signal protein encoded by Rv3194c gene from Mycobacterium tuberculosis, and to serve the identification of the cellular binding proteins of Rv3194c protein. [Methods] The gene encoding tRv3194c (Rv3194c 1-234 aa) with T2A and EGFP sequence was cloned by PCR from the genomic H37Rv, then inserted into the eukaryotic expression vector to construct pcDNA3.1-tRv3194c-T2A-EGFP. Indirect immune fluorescence assay, flow cytometry sorting and Western blotting assay were used to observe subcellular localization, when L929 cells were transfected with constructs before infection with the recombinant vaccinia virus vTF7-3 expressing T7 RNA polymerase. [Results] The eukaryotic expression vector pcDNA3.1-tRv3194c-T2A-EGFP was constructed correctly. After the transient transfection with the plasmid, localization of fusion protein tRv3194 in mitochondria was observed by immune fluorescence assay. The dramatically enhanced expression level by co-infection with vTF7-3 before transfection was detected by flow cytometry sorting and Western-blotting assay. [Conclusion] Post-synaptic density domain in Rv3194c protein can bind to its ligand protein which located in mitochondrial outer membrane, which provides a key clue to understand its pathogenic mechanism in intracellular.
Keywords: Mycobacterium tuberculosisRv3194c proteinmitochondriarecombinant vaccinia virusrecombinant plasmid
结核病是由结核分枝杆菌(Mycobacterium tuberculosis)和牛分枝杆菌引起的人畜共患的慢性消耗性传染病,该病极易传染,除人外还可感染牛、羊、鹿等动物,被世界动物卫生组织列为B类动物疫病[1]。主要的致病性菌株有人型[2]、牛型[3]和非洲型[4]结核分枝杆菌,其中以人型结核分枝杆菌感染最常见并且致病力最强。宿主在感染结核分枝杆菌后,被巨噬细胞吞噬进而定殖在肺泡巨噬细胞中,也可在胞外生长[5-6],因此,结核分枝杆菌的携带者没有典型的结核病症状,在短期内没有传染性,但是这些携带者一旦受到相应的刺激或者免疫力低下时,就有可能发展成为具有传染性的结核病。这种长期处于潜伏感染状态的结核分枝杆菌携带者已成为全世界致力于消灭结核病的又一大障碍。结核杆菌的致病机制复杂,一方面随着结核杆菌长期与宿主巨噬细胞的感染-免疫斗争,其自身也随之进化出免疫逃逸的策略来抵御宿主的免疫攻击,使结核杆菌的免疫反应变得越来越复杂[7];另一方面,感染结核杆菌的患者主要使用抗结核药物治疗,例如利福平、异烟肼、乙胺丁醇、吡嗪酰胺和链霉素等,但是由于长期用药引起的耐菌株的出现,使结核病的发病呈现回升现象,尤其是多重耐药分枝杆菌的出现以及病毒的混合感染,使得对结核病的治疗变得越来越困难[8]。因此研究结核病的致病机制,寻找新型、高效的药物靶点成为当务之急。结核分枝杆菌Rv3194c蛋白的功能,至今还不清楚,经生物信息学预测,该蛋白含有PDZ (PSD-95、DLG、ZO-1)结构域、Lon C结构域以及跨膜区,推测该蛋白可能为分泌蛋白。从蛋白质组学的角度讲,PDZ结构域分布广泛,结合机制多样,对蛋白与蛋白相互作用起着特殊的调节作用[9]。富含PDZ结构域的蛋白通常是蛋白相互作用的“节点”,使其成为下一代药物的理想靶标[10],因此设计针对PDZ结构域的药物可特异性阻断与其特定配体之间的相互作用,切断其信号传导,为相关疾病的治疗提供新途径[11]。本课题组前期发现Rv3194c的PDZ结构域可以结合细胞基质中的糖胺聚糖类分子具有黏附素特性[12]。Rv3194c的PDZ结构域在细胞内的配体还不清楚,因此,阐明Rv3194c蛋白在细胞内的定位,可为筛选该蛋白在细胞内的配体奠定基础,对于理解Rv3194c蛋白的致病机制以及新型药物靶点的开发,具有非常重要的指导意义。
1 材料和方法 1.1 材料
1.1.1 菌株、质粒、细胞与病毒: 菌株E. coli DH5α、结核分枝杆菌H37Rv基因组、表达T7 RNA多聚酶的重组痘苗病毒vTF7-3以及L929细胞系均由本实验室保存。真核表达质粒pcDNA3.1 (plasmid #52535)购自Addgene。
1.1.2 主要试剂: Primer star高保真酶、T4 DNA Ligases、各种限制性内切酶、Agarose Gel DNA Purification Kit均购自TaKaRa生物工程有限公司。质粒提取试剂盒、胶回收试剂盒以及PCR纯化试剂盒均购于Omega公司;转染试剂Lipofectamine 3000,Alexa Fluor-488/688/800标记的山羊抗鼠IgG的荧光二抗,均购自Thermo Fisher公司;小鼠抗Flag-tag单克隆抗体购自Novagen;Digitonin、Triton X-100、PIPES系Sigma公司产品。
1.1.3 引物: 用在线服务器pfam分析结核分枝杆菌Rv3194c (Accession: AFN51190)的氨基酸序列,发现该蛋白包含PDZ结构域(115–197 aa)和Lon C结构域(236–305 aa),为了研究该PDZ结构域在细胞内的功能,我们需要在细胞内表达截短的Rv3194c (Rv3194c 1–234 aa片段),其编码碱基为702 bp。我们设计如下引物从H37Rv基因组中扩增出编码Rv3194c (1–234aa)的基因片段,基因的3′端引入T2A序列,其引物序列:Rv3194c-F:5′-GCTAGCGTGAATAGGCGGATATTGACC-3′;Rv3194c-R:5′-TGGGCCAGGATTCTCCTCGACG TCACCGCATGTTAGACGACTTCCTCTGCCCTC TCCACTGCCCGACGTTGGCGAGGTGGA-3′,其中粗字体为限制性内切酶位点Nhe Ⅰ (GCTAGC)、下划线的序列为T2A序列。我们设计如下引物从质粒pEGFP-N1中扩增出EGFP基因,其基因的5′端引入T2A序列,其引物序列:EGFP-F:5′-GGCA GTGGAGAGGGCAGAGGAAGTCGTCTAACATG CGGTGACGTCGAGGAGAATCCTGGCCCAATG GTGAGCAAGGGCGA-3′,EGFP-R:5′-GAATTCT CACAAATTTTGTAATCCAGAGG-3′,其中粗字体为限制性内切酶位点EcoR Ⅰ (GAATTC),下划线的序列为T2A序列。我们还设计如下引物从H37Rv基因组中扩增出编码Rv3194c (1–234 aa)的基因片段,5′端引入限制性内切酶位点Nhe Ⅰ (GCTAGC),3′端引入限制性内切酶位点EcoR Ⅰ (GAATTC),其引物序列:Rv3194c-F1:5′-GCTAGCGTGAATA GGCGGATATTG ACC-3′,Rv3194c-R1:5′-GAATTCCGACGTTGGCGAGGT GGA-3′,其中粗字体为限制性内切酶位点。
1.2 pcDNA3.1-tRv3194c-T2A-EGFP以及pcDNA3.1-tRv3194c重组质粒的构建 利用设计的上游引物Rv3194c-F以及下游引物Rv3194c-R,以结核分枝杆菌H37Rv基因组为模板,PCR扩增出5′端引入酶切位点Nhe Ⅰ、3′端引入T2A序列的tRv3194c (Rv3194c 1–702 bp) -T2A片段。PCR扩增体系(50 μL):结核分枝杆菌H37Rv基因组DNA 1 μL (100 ng DNA),Primer star Max DNA polymerose 25 μL,10 μmol/L上下游引物各1 μL,ddH2O 22 μL。PCR扩增参数为:94 ℃ 5 min;94 ℃ 1 min 58 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。PCR扩增完成后,割胶回收并用PCR产物纯化试剂盒进行纯化。利用设计的上游引物EGFP-F以及下游引物EGFP-R,以质粒pEGFP-N1质粒为模板,PCR扩增出5′端引入T2A序列、3′端引入EcoR Ⅰ限制性酶切位点的T2A-EGFP序列,该PCR反应条件和反应体系同上。利用设计的上游引物Rv3194c-F以及下游引物EGFP-R,以扩增产物tRv3194c-T2A和T2A-EGFP为模板,PCR扩增出tRv3194c-T2A-EGFP片段,该PCR反应体系和反应条件同上。利用Nhe Ⅰ-EcoR Ⅰ分别酶切pcDNA3.1质粒和tRv3194c-T2A-EGFP产物,然后用PCR纯化试剂盒回收酶切产物,最后通过T4 DNA连接酶定向克隆入质粒的Nhe Ⅰ/EcoR Ⅰ位点,得到pcDNA3.1-tRv3194c-T2A-EGFP重组质粒(图 1)。利用设计的上游引物Rv3194c-F1以及下游引物Rv3194c-R1,以结核分枝杆菌H37Rv基因组为模板,PCR扩增出5′端引入酶切位点Nhe Ⅰ、3′端引入EcoR Ⅰ的tRv3194c (Rv3194c 1–702 bp)基因片段,该PCR反应条件和反应体系同上,然后利用Nhe Ⅰ-EcoR Ⅰ分别酶切pcDNA3.1质粒和tRv3194c,用PCR纯化试剂盒回收酶切产物,最后通过T4 DNA连接酶定向克隆入质粒的Nhe Ⅰ/EcoR Ⅰ位点,得到pcDNA3.1-tRv3194c重组质粒。
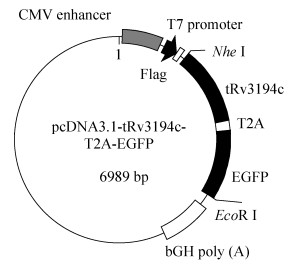 |
| 图 1 重组质粒pcDNA3.1-tRv3194c-T2A-EGFP示意图 Figure 1 Schematic structure of recombinant plasmid pcDNA3.1-tRv3194c-T2A-EGFP. |
| 图选项 |
1.3 细胞转染 使用质粒提取试剂盒提取重组质粒pcDNA3.1-tRv3194c-T2A-EGFP以及pcDNA3.1-tRv3194c。L929细胞培养至汇合度达到60%–80%时,用PBS漂洗3次,分别加入5 MOI的vTF7-3,37 ℃吸附1 h。根据Superfect Transfection Reagent转染试剂的说明书分别转染上述构建的重组质粒,转染后小心移除Superfect-DNA混合物,用2 mL无菌PBS洗涤细胞3–4次,加入含10%胎牛血清培养基,在32 ℃、5% CO2条件下继续培养24 h。
1.4 间接免疫荧光(IFA) 共聚焦小皿用多聚赖氨酸(50 μg/mL)包被过夜后,用无菌水漂洗3次晾干备用。将转染重组质粒pcDNA3.1-tRv3194c的L929细胞接种到多聚赖氨酸包被过的共聚焦小皿,在含有5%胎牛血清的细胞培养基中培养过夜,然后再用250 nmol/L的MitoTracker (green)在培养液中处理细胞30 min;用PBS溶液漂洗3次,冷丙酮(–20 ℃)固定10 min,再用含有100 mmol/L甘氨酸的PBS冲洗3次,最后再用PBS洗3次;滴加封闭液(含1%牛血清白蛋白的PBS)室温放置30 min;分别滴加抗小鼠的anti-flag的抗体(1:3000稀释),4 ℃孵育过夜后,用PBS漂洗3次;滴加封闭液稀释的山羊抗鼠的Alexa Fluor-688荧光二抗(1:5000稀释),37 ℃孵育2 h,用PBS漂洗3次;滴加荧光淬灭剂封片,在共聚焦显微镜下观察融合蛋白的共定位情况。
1.5 Western blotting分析 将细胞裂解液用10%的SDS-聚丙烯酰胺凝胶电泳分离,转移至硝酸纤维素膜上;用含5%脱脂奶以及0.02% NaN3的TBS封闭膜30 min;用PBST在摇床上漂洗PVDF膜3次,每次10 min;小鼠抗Flag标签蛋白的单克隆抗体用封闭液按照1:2000的比例稀释,在4 ℃下孵育过夜;用PBST在摇床上漂洗PVDF膜3次;滴加封闭液稀释的山羊抗鼠的Alexa Fluor-800荧光二抗(1:10000稀释),室温孵育2 h;用PBST在摇床上漂洗PVDF膜3次。用红、绿双色荧光成像系统检测。
1.6 活细胞的流式分析 L929细胞培养至汇合度达到60%–80%时,用PBS漂洗3次,加入5 MOI的重组痘苗病毒vTF7-3,37 ℃吸附1 h,对照组不加重组痘苗病毒。根据Superfect Transfection Reagent转染试剂的说明书分别转染重组质粒pcDNA3.1-tRv3194c-T2A-EGFP,转染后小心移除Superfect-DNA混合物,用2 mL无菌PBS洗涤细胞3–4次,加入含10%胎牛血清培养基,在32 ℃、5% CO2条件下继续培养24 h后,分别收集107个细胞,放入流式细胞仪进行流式分选,观察融合蛋白的表达效率。
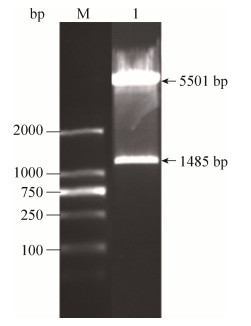
2 结果和分析 2.1 tRv3194c融合蛋白表达载体的构建 以结核杆菌标准株H37Rv基因组DNA为模板,用PCR扩增出Rv3194c (1–702 bp)片段,该截短型的基因片段表示为tRv3194c,其所编码的氨基酸序列中仅包含PDZ结构域。将PCR产物进行1%琼脂糖凝胶电泳,结果显示目的片段得到扩增,并与预期扩增值702 bp大小相一致(图 2)。Rv3194c (1–702 bp)测序证实正确后与空载的真核表达质粒pcDNA3.1(–)连接,构建出pcDNA3.1-tRv3194c重组质粒,用限制性内切酶Nhe Ⅰ和EcoR Ⅰ酶切后所得片段大小均与预测片段大小一致(图 3),测序结果也证明基因克隆正确。
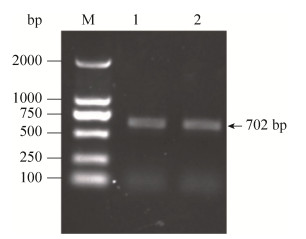 |
| 图 2 截短Rv3194c基因的PCR扩增 Figure 2 Gene fragment of truncated Rv3194c amplified by PCR. M: DNA marker 2000; 1, 2: Rv3194c (1–702 bp). |
| 图选项 |
 |
| 图 3 质粒pcDNA3.1-tRv3194c的酶切鉴定图谱 Figure 3 Restrictive enzymatic digestion patterns of recombinant plasmid pcDNA3.1-tRv3194c. M: DNA marker 2000; 1, 2: Nhe Ⅰ and EcoR Ⅰ. |
| 图选项 |
2.2 tRv3194c-T2A-EGFP融合蛋白表达载体的构建 分别以结核杆菌标准株H37Rv基因组DNA以及质粒pEGFP-N1为模板,通过设计引物用PCR分别扩增出tRv3194c-T2A以及T2A-EGFP片段。通过上述扩增产物为模板,通过重叠PCR扩增出融合片段tRv3194c-T2A-EGFP。将重叠PCR的产物进行1%琼脂糖凝胶电泳,结果显示目的片段得到扩增,并与预期扩增值1485 bp大小相一致(图 3)。测序证实正确后与空载的真核表达质粒pcDNA3.1(–)连接,构建出pcDNA3.1-tRv3194c-T2A-EGFP重组质粒,用限制性内切酶Nhe Ⅰ和EcoR Ⅰ酶切后所得片段大小均与预测片段大小一致(图 4),测序结果也证明基因克隆正确。
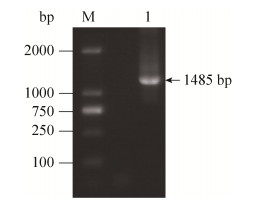 |
| 图 4 重叠PCR扩增tRv3194c-T2A-EGFP基因片段 Figure 4 Gene fragment of tRv3194c-T2A-EGFP amplified by overlap PCR. M: DNA marker 2000; 1: Rv3194c (1–702 bp). |
| 图选项 |
2.3 融合蛋白tRv3194c的亚细胞定位 Rv3194c蛋白的氨基酸序列中包含PDZ (115–197 aa)结构域和Lon C (236–305 aa)结构域,为了筛选Rv3194c蛋白的PDZ结构域在细胞内的配体蛋白,必须明确Rv3194c蛋白在细胞器的定位。我们构建重组质粒pcDNA3.1-tRv3194c仅在细胞中表达含有PDZ结构域的融合蛋白Flag-tRv3194c (Rv3194c 1–234 aa)。我们在转染pcDNA3.1-tRv3194c质粒的L929细胞,首先用荧光染料MitoTracker (green)标记细胞中的线粒体,再用anti-Flag抗体标记融合蛋白Flag-tRv3194c (红光)。荧光共聚焦实验发现,融合蛋白tRv3194c (红光)与线粒体发生共定位,并且感染重组痘苗病毒vTF7-3的细胞有助于融合蛋白tRv3194c的表达(图 5),说明Rv3194c蛋白的PDZ结构域的细胞内配体位于线粒体外膜上。
 |
| 图 5 质粒pcDNA3.1-tRv3194c-T2A-EGFP的酶切鉴定图谱 Figure 5 Restrictive enzymatic digestion patterns of recombinant plasmid pcDNA3.1-tRv3194c-T2A-EGFP. M: DNA marker 2000; Lane 1, 2: Nhe Ⅰ and EcoR Ⅰ. |
| 图选项 |
2.4 重组痘苗病毒vTF7-3可有效增强融合蛋白的表达 免疫荧光实验发现(图 6),重组病毒vTF7-3感染的细胞中有助于融合蛋白tRv3194c的表达。我们进一步通过流式细胞分选实验,发现与重组表达质粒pcDNA3.1-tRv3194c-T2A-EGFP转染未感染vTF7-3病毒的细胞相比,细胞发出绿色荧光的数目明显增多(从19%提高到35%),说明转染的细胞感染vTF7-3后,融合蛋白tRv3194c的表达量显著提高(图 7)。同时Western blotting发现,重组质粒pcDNA3.1-tRv3194c-T2A-EGF转染感染病毒的细胞中融合蛋白tRv3194c的表达量显著增加,与流式细胞实验结果一致(图 8)。
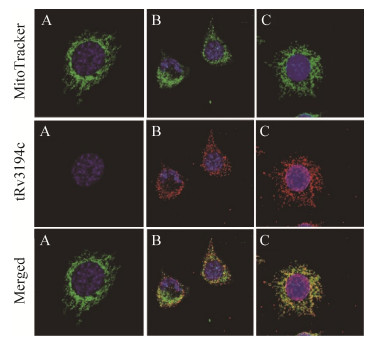 |
| 图 6 tRv3194c与线粒体的共定位 Figure 6 Co-localization of tRv3194c and mitochondria. A: L929 cells transfected with empty vector pcDNA3.1 were cultured in medium overnight, and followed treatment with MitoTracker (250 nmol/L) for 30 min; B: L929 cells transfected with pcDNA3.1-tRv3194c were cultured in medium overnight, and followed treatment with MitoTracker (250 nmol/L) for 30 min; C: L929 cells added to 5 MOI vaccinia virus vTF7-3 were incubated at 37 ℃ for 1 h, and followed transfection with pcDNA3.1-tRv3194c before treatment with MitoTracker (250 nmol/L) for 30 min. |
| 图选项 |
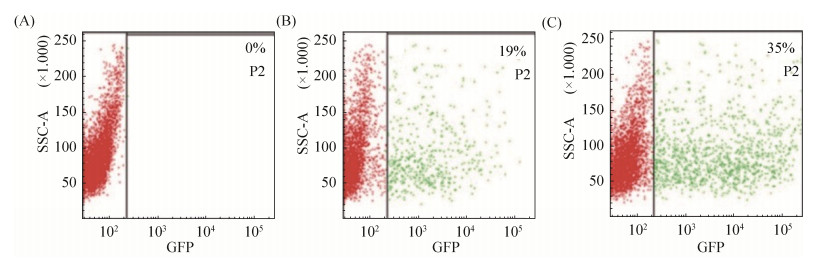 |
| 图 7 流式细胞分选 Figure 7 Flow cytometry sorting. A: L929 cells were transfected with empty vector pcDNA3.1; B: L929 cells were transfected with recombinant plasmid pcDNA3.1-tRv3194c-T2A-EGFP; C: L929 cells added to vTF7-3 were incubated at 37 ℃ for 1 h before transfection with recombinant plasmid pcDNA3.1-tRv3194c-T2A-EGFP. |
| 图选项 |
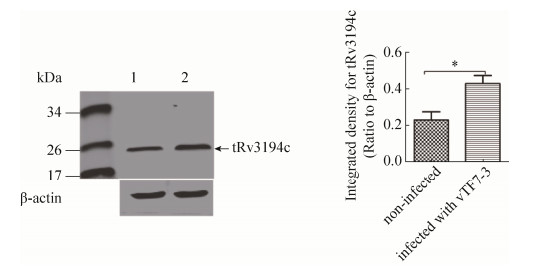 |
| 图 8 tRv3194c的Western-blot分析 Figure 8 Analysis of western-blot for tRv3194c. L929 cells were lysed, and then extracted the total protein to detect tRv3194c by western blot using anti-flag antibody. 1: L929 cells were transfected with recombinant plasmid pcDNA3.1-tRv3194c-T2A-EGFP; 2: L929 cells added to vTF7-3 were incubated at 37 ℃ for 1 h before transfection with recombinant plasmid pcDNA3.1-tRv3194c-T2A-EGFP. |
| 图选项 |
3 讨论 结核分枝杆菌Rv3194c蛋白的生物学功能至今还不完全清楚,我们课题组在前期实验中初步发现,该蛋白具有黏附素特性,能够结合细胞外基质中的糖胺聚糖类分子,其具体的黏附机制仍在探索中。由于Rv3194c蛋白的PDZ结构域具有结合配体多样性的特点[9],因此我们试图寻找Rv3194c蛋白在细胞内的结合蛋白。本研究摸索了提高截短Rv3194c (1–234 aa)蛋白的表达量的多种方法,可采取密码子优化,也可共感染表达T7 RNA多聚酶的重组痘苗病毒[13-14]。重组痘苗病毒vTF7-3感染细胞后可在胞浆中表达T7 RNA多聚酶,从而可利用载体上的T7启动子,高效率地转录,并利用自身的酶合成5′加帽和3′加尾的mRNA,被宿主细胞的翻译系统翻译该编码基因[15]。在本实验中,pcDNA3.1-tRv3194c-T2A-EGFP重组质粒转染入细胞后,进入细胞核的部分质粒在CMV启动子的作用下进行转录;细胞浆中的质粒在病毒的DNA多聚酶的作用下大量复制使其拷贝数显著增加,然后靶基因在T7启动子调控下由vTF7-3合成的T7 RNA多聚酶进行转录,并且在胞浆中完成mRNA的加工,显著提高靶蛋白的表达效率[16]。综上所述,我们通过感染表达T7 RNA多聚酶的重组痘苗病毒,可有效增强融合蛋白tRv3194c的表达,并且该蛋白的PDZ结构域与线粒体外膜蛋白相结合,这些结果的取得为进一步纯化Rv3194c蛋白的细胞结合蛋白、深入阐明结核杆菌的的感染机制提供重要的线索。
References
| [1] | O'Reilly LM, Daborn CJ. The epidemiology of Mycobacterium bovis infections in animals and man:a review. Tubercle and Lung Disease, 1995, 76 Suppl: 1-46. |
| [2] | Someya S, Hayashi O, Tajima Y, Endo M. Studies on the virulence of tubercle bacilli. Ⅲ. The fate of human type and bovine type tubercle bacille in various organs of intravenously infected mice. Kekkaku, 1951, 26(2): 74-78. |
| [3] | Ascoli A. Reaction of the cholemic calf to Mycobacterium tuberculosis, bovine type. Giornale Italiano Della Tubercolosi, 1950, 4(3): 129-130. |
| [4] | Castets M, Boisvert H, Grumbach F, Brunel M, Rist N. Tuberculosis bacilli of the African type:preliminary note. Revue de Tuberculose et de Pneumologie, 1968, 32(2): 179-184. |
| [5] | Flynn JL, Chan J. Immunology of tuberculosis. Annual Review of Immunology, 2001, 19(1): 93-129. DOI:10.1146/annurev.immunol.19.1.93 |
| [6] | van Crevel R, Ottenhoff THM, van der Meer JWM. Innate Immunity to Mycobacterium tuberculosis. Clinical Microbiology Reviews, 2002, 15(2): 294-309. DOI:10.1128/CMR.15.2.294-309.2002 |
| [7] | Puvaci? S, Dizdarevi? J, Santi? Z, Mulaomerovi? M. Protective effect of neonatal BCG vaccines against tuberculous meningitis. Bosnian Journal of Basic Medical Sciences, 2004, 4(1): 46-49. DOI:10.17305/bjbms.2004.3460 |
| [8] | Shenai S, Rodrigues C, Mehta A. Rapid speciation of 15 clinically relevant mycobacteria with simultaneous detection of resistance to rifampin, isoniazid, and streptomycin in Mycobacterium tuberculosis complex. International Journal of Infectious Diseases, 2009, 13(1): 46-58. DOI:10.1016/j.ijid.2008.03.025 |
| [9] | Javier RT, Rice AP. Emerging theme:cellular PDZ proteins as common targets of pathogenic viruses. Journal of Virology, 2011, 85(22): 11544-11556. DOI:10.1128/JVI.05410-11 |
| [10] | Hormozdiari F, Salari R, Bafna V, Sahinalp SC. Protein-protein interaction network evaluation for identifying potential drug targets. Journal of Computational Biology, 2010, 17(5): 669-684. DOI:10.1089/cmb.2009.0032 |
| [11] | Houslay MD. Disrupting specific PDZ domain-mediated interactions for therapeutic benefit. British Journal of Pharmacology, 2009, 158(2): 483-485. DOI:10.1111/j.1476-5381.2009.00359.x |
| [12] | Zhao DY, Lin LL, Wen FL. Expression, purification and characterization of Rv3194c protein from Mycobacterium tuberculosis. Acta Microbiologica Sinica, 2016, 56(12): 1847-1855. (in Chinese) 赵东岳, 林莉莉, 温福利. 结核分枝杆菌Rv3194c蛋白的表达、纯化及活性鉴定. 微生物学报, 2016, 56(12): 1847-1855. |
| [13] | Xiao XD, Chakraborti S, Dimitrov AS, Gramatikoff K, Dimitrov DS. The SARS-CoV S glycoprotein:expression and functional characterization. Biochemical and Biophysical Research Communications, 2003, 312(4): 1159-1164. DOI:10.1016/j.bbrc.2003.11.054 |
| [14] | Simmons G, Reeves JD, Rennekamp AJ, Amberg SM, Piefer AJ, Bates P. Characterization of severe acute respiratory syndrome-associated coronavirus (SARS-CoV) spike glycoprotein-mediated viral entry. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(12): 4240-4245. DOI:10.1073/pnas.0306446101 |
| [15] | Wu YS, Feng Y, Dong WQ, Zhang YM, Li M. A vaccinia replication system for producing recombinant hepatitis C virus. World Journal of Gastroenterology, 2004, 10(18): 2670-2674. DOI:10.3748/wjg.v10.i18.2670 |
