周利艳1,2, 付钰1,2


1.中国科学院微生物研究所, 微生物资源前期开发国家重点实验室, 北京 100101;
2.中国科学院大学, 存济医学院, 北京 100049
收稿日期:2018-04-04;修回日期:2018-05-08;网络出版日期:2018-07-19
基金项目:国家自然科学基金(31571288),中国科学院跨学科创新团队,英国皇家学会的牛顿先进奖学金(NA140085)
*通信作者:付钰, Tel:+86-10-64806126;E-mail:fuyu@im.ac.cn
摘要:[目的] 建立流式细胞仪分选新生隐球菌单细胞的方法,确定新生隐球菌单细胞恢复生长的条件和能力。[方法] 利用Moflo XDP流式细胞分析分选仪,体外测定不同条件下新生隐球菌恢复生长的比率。[结果] 建立了流式细胞仪新生隐球菌单细胞分选流程。确定流式细胞仪分选得到的新生隐球菌单细胞具有恢复生长的能力,恢复生长的能力受营养条件和菌株差异的影响。在营养丰富的条件下,新生隐球菌JEC21和H99单细胞恢复生长比率分别为74%和89%。在寡营养条件下,JEC21和H99单细胞恢复生长比率分别为37%和80%。JEC21生长比率随细胞数的增加而升高,细胞数为100个时,生长比率为55%;细胞数为1000个时,生长比率为97%。[结论] 流式细胞仪分选得到新生隐球菌单细胞具有恢复生长的能力,生长能力受营养条件、菌株差异的影响。
关键词:单细胞分选技术流式细胞仪新生隐球菌
Using cell sorting techniques to explore the recovery of individual Cryptococcus neoformans cells
Liyan Zhou1,2, Yu V. Fu1,2


1.State Key Laboratory of Microbial Resources, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China;
2.Savaid Medical School, University of Chinese Academy of Sciences, Beijing 100049, China
Received 4 April 2018; Revised 8 May 2018; Published online 19 July 2018
*Corresponding author: Yu V. Fu, Tel: +86-10-64806126; E-mail: fuyu@im.ac.cn
Supported by the National Natural Science Foundation of China (31571288), by the CAS Interdisciplinary Innovation Team and by the Newton Advanced Fellowship (NA140085) from the Royal Society
Abstract: [Objective] A method of sorting single cells of Cryptococcus neoformans by flow cytometry was established to determine factors influencing proliferation of single C. neoformans cells. [Methods] The Moflo XDP flow cytometric sorter was used. The clonal recovery rate of C. neoformans cell was determined under various conditions. [Results] Single C. neoformans cells sorting process by cytometry was established. Single C. neoformans cells could recover growth which was affected by nutritional conditions and strains. Under nutrient-rich conditions, the clonal recovery rates of C. neoformans stains JEC21 and H99 were 74% and 88%, respectively. Under oligotrophic conditions, the clonal recovery rate of JEC21 was 37%; while the clonal recovery rate of H99 was 80%. The clonal recovery rate of JEC21 increased with increasing initial number of cells. When the cell number of JEC21 strain was 100, the clonal recovery rate was 55%; when the cell number was 1000, the clonal recovery rate was 97%. [Conclusion] The single C. neofroman cells sorted by flow cytometry had the capacity of recovery to growth, and the capacity was affected by nutritional conditions and strains.
Keywords: single cell sorting technologyflow cytometryC. neoformans
新生隐球菌(Cryptococcus neoformans)是一种条件致病菌,在环境中广泛存在。近年来,伴随免疫功能缺陷人群的增多、人类与自然生态系统相互影响的增强以及医学干预等因素,它已经成为威胁人类健康的全球性问题之一[1-3]。
传统感染学认为侵入人体的真菌、细菌、病毒达到一定的数量才可以引起宿主感染[4]。有观点认为微生物群体间的信息交流和相互协作有助于微生物适应外界的各种胁迫与压力,保证微生物群体的生存[5]。Kwon-Chung等敲除新生隐球菌群感效应相关基因TUP1后新生隐球菌表现出浓度依赖性生长表型,接种细胞数量少于103时无法在平板上形成单菌落,只有当细胞数目达到一定浓度才能生长[6],说明新生隐球菌细胞间的协作对群体的生存极为重要,关于新生隐球菌协作的研究需要获取单个新生隐球菌细胞。在新生隐球菌感染与有性生殖过程中,细胞与细胞间表现出了极大的形态异质性,这些形态迥异的细胞间可能存在着复杂的交流、协作,保障其感染和有性生殖的发生,然而当前对其产生高度异质性的分子机制仍缺乏研究[7]。在单细胞水平观察隐球菌发育分化过程,有助于解析其中的调控机制。同时,单细胞是生命结构和功能的基本单元,每个单细胞都是一个独立的个体,个体之间存在着遗传学的差异,研究新生隐球菌单细胞的基因组对于了解新生隐球菌的进化关系具有重要的意义[8-9]。单细胞全基因组的研究首先要解决的问题是如何获取单个细胞的问题[10]。
传统方法是通过显微操作(Micromanipulation)的方式得到新生隐球菌单细胞,该方法耗时耗力且对新生隐球菌细胞损伤较大,因此如何高效低损伤地获得单个新生隐球菌细胞成为一个重要的研究课题[11]。
目前获得单细胞微生物较新的技术主要有荧光激活液滴分选技术(Fluorescence-activated droplet sorting,FADS)、拉曼激活细胞分选技术(Raman-activated cell sorting,RACS)和流式细胞术(Flow cytometry)等。FADS通过微流控生成微体积液滴,液滴内包含单个或者多个细胞,由泊松分布可知,单细胞数目约为总样品的30%。该方法可以实现超小反应体系,但操作复杂且通量较小[12]。RACS是一种利用拉曼光谱信息引导光镊夹取单个细胞将其收集起来的技术,该技术特异性强,但设备要求高,分选效率低下[13]。流式细胞术是利用荧光标记及生物的物理和化学特性对细胞进行高效分析分选的技术[14]。流式细胞术在哺乳动物单细胞分选方面更为成熟,但在微生物单细胞分选方面受到制约[15-16]。已有利用流式细胞分选技术能够成功分选单个哺乳动物细胞的报道,但尚未有报道证实流式细胞分选技术可以用于真菌及细菌等微生物的单细胞分选。
本研究建立了流式细胞术分选单个新生隐球菌细胞的流程和方法,并通过研究新生隐球菌恢复生长的能力与营养条件、菌株差异之间的相关性,确定该分选方法对新生隐球菌的影响。
1 材料和方法 1.1 菌株和试剂
1.1.1 用于单细胞确定的菌株: 酿酒酵母(Saccharomyces cerevisiae) BY4741 (met15Δ)、W303(tripΔ),大肠杆菌(Escherichia coli)来自本实验室。
1.1.2 用于测定细胞恢复生长比率的菌株: 新生隐球菌(C. neoformans) JEC21、新生隐球菌H99来自中国科学院微生物研究所王琳淇实验室。白色念珠菌(Candida albicans) SC5314来自中国科学院微生物研究所黄广华实验室。酿酒酵母BY4741来自本实验室。
1.1.3 主要试剂和仪器: PBS缓冲液(1000 mL,pH 7.4):NaCl 8.00 g,KCl 0.20 g,Na2HPO4 1.44 g,KH2PO4 0.24 g,超纯水补至1000 mL。PBS缓冲液涉及试剂均购于中国生物工程有限公司。矿物轻油、PI (Propidium iodide)购于美国西格玛奥德里奇公司。Moflo XDP流式细胞分析分选仪购于德国贝克曼库尔特商贸(中国)有限公司。
1.1.4 培养基: 酵母浸出粉胨葡萄糖培养基(YPD,g/L) 1000 mL:酵母提取物10,蛋白胨20,葡萄糖20。酵母培养基SD-Trp (g/L):无氨基酸酵母氮源6.7,葡萄糖20.0,亮氨酸0.1,甲硫氨酸0.1,尿嘧啶0.1,组氨酸单盐酸0.1,腺嘌呤硫酸盐0.1,赖氨酸单盐酸0.1,精氨酸单盐酸0.1。酵母培养基SD-Met (g/L):无氨基酸酵母氮源6.7,葡萄糖20.0,亮氨酸0.1,尿嘧啶0.1,色氨酸0.1,组氨酸单盐酸0.1,腺嘌呤硫酸盐0.1,赖氨酸单盐酸0.1,精氨酸单盐酸0.1。酵母氮源基础培养基(YNB,g/L):无氨基酸酵母氮源6.7,葡萄糖20.0。LB培养基(g/L):胰蛋白胨10,酵母提取物5,NaCl 10。其中酵母提取物、无氨基酸酵母氮源、蛋白胨、氨基酸均购于美国BD有限公司,以上培养基均1×105 Pa高压灭菌15 min。
1.2 样品预处理 将储存于–80 ℃冰箱中的新生隐球菌、白色念珠菌、酿酒酵母储藏液挑出少许,接入盛有4 mL YPD培养液的试管中,30 ℃、200 r/min振荡过夜活化。将大肠杆菌转接入4 mL LB液体培养液中,30 ℃、200 r/min振荡过夜培养。次日,取500 μL菌液加入4 mL相应培养基中,继续培养活化3 h,使所用菌处于对数期。分别取1 mL对数期的实验用菌3000 g/min离心2 min,弃上清。用1×PBS缓冲液清洗2次,后用PBS稀释至105个/mL。置于冰上。上样前,样品过300目尼龙膜。
1.3 流式细胞仪分选模式参数的建立 在流式细胞分选仪中选用70 μm喷嘴,建立FSC/SSC双参数散点图和FSC-Height/FSC-Area双参数散点图,去粘连获得分散单个细胞区域。选定分选区域,droplet mode设为single 0.5分选模式,使每个液滴默认只含有一个细胞。
1.4 单细胞确定 用每孔都含有50 μL矿物轻油的96孔板收集单细胞,96孔板200 g/min,离心2 min。随后在倒置显微镜顺着96孔板平底依次寻找液滴和液滴内的细胞情况。显微镜下观察并记录96孔板的每个孔内液滴和细胞数,确保流式细胞仪分选的为单个细胞。
1.5 上样细胞死活比例的测定 在进行真菌单细胞分选前,将上样管内细胞摇匀后取100 μL菌液与5 μg/mL PI避光染色10 min后上样,经过流式细胞仪测定PI阳性细胞数,确定上样细胞死活的比例。
1.6 细胞恢复生长比率的测定 用每孔含有200 μL培养液的96孔板收集单细胞后放置96孔板摇床上,180 r/min振荡培养3 d,观察并记录96孔板孔内浑浊及40倍、100倍显微镜镜检确认分选出的单细胞生长状况。计算单细胞恢复生长比率,细胞恢复生长比率(Clonal recovery rate)=(微生物生长的孔数目/获得单细胞的孔数目)/(1–死亡细胞百分数)×100%。
2 结果和分析 2.1 建立单细胞分选条件 将大肠杆菌和酿酒酵母BY4741及酿酒酵母W303三种菌混合上样分选,用于保证单细胞分选模式的准确性。流式细胞仪分选界面如图 1所示,R1为大肠杆菌所在区域,R2为酿酒酵母(BY4741和W303)所在区域,R3为酿酒酵母(BY4741和W303)分选区域。
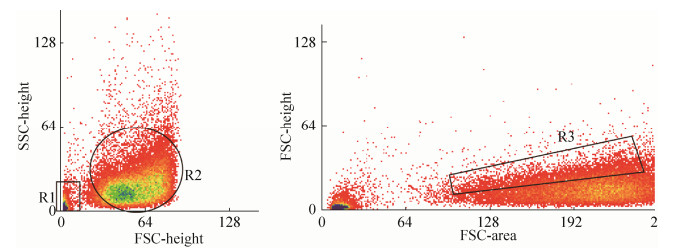 |
| 图 1 大肠杆菌、酿酒酵母BY4741、酿酒酵母W303混合样品分选界面 Figure 1 The flow cytometry sorting interface of the mixed sample of E. coli, BY4741 and W303. R1 indicated the area where E. coli cells were located, R2 indicated the interface of BY4741 and W303, R3 indicated the yeast sorting area. |
| 图选项 |
为了确定流式细胞仪分选出的目的细胞为单个细胞,按照单细胞分选模式将R3细胞区域内的液滴收集到含有50 μL矿物轻油的96孔板中,利用倒置显微镜顺着96孔板平底依次寻找液滴和液滴内的细胞情况。本研究发现96孔板中存在空液滴,液滴中含有单个细胞和无液滴3种情况(图 2-A),并对此3种情况统计,三者比例分别为6%、28%、66% (图 2-B)。在确定含有液滴的孔中,仅有含有单个细胞的液滴及空液滴两种情况,未见含有多个细胞的液滴,说明流式细胞仪在单细胞模式下,能够保证液滴内有且仅有1个细胞,不会出现多个细胞的情况。
 |
| 图 2 流式细胞仪分选单个液滴显微镜图 Figure 2 Microscopic observation of droplet after sorting. A: A single droplet including yeast-like cells and an empty droplet were observed under microscope; B: Empty droplets, droplets of singlecells and without visible droplets were detected in the 96-well plate. Experiments were repeated three times and the mean±SD values were obtained. |
| 图选项 |
2.2 单细胞确定 大肠杆菌、酿酒酵母细胞(BY4741、W303)可在富营养培养基YPD上生长。BY4741、W303均不能在SD-Trp-Met培养基上生长。其中,BY4741在SD-Trp培养基上生长,不能在SD-Met培养基上生长。反之,W303能在SD-Met培养基上生长,不能在SD-Trp培养基上生长。本研究利用流式细胞仪分选R3区域内的细胞,并用含有200 μL YPD培养液的96孔板收集,200 r/min模式30 ℃振荡培养3 d。理论上,R3区域为酿酒酵母(BY4741和W303)细胞区,该区域不含大肠杆菌。如果流式细胞仪未能正确区分大肠杆菌和酿酒酵母细胞,则96孔内存在大肠杆菌和酿酒酵母细胞的混合菌;如果流式细胞仪能够正确区分大肠杆菌和酿酒酵母细胞,则96孔内均为酿酒酵母细胞。实验随机选取96孔板中的9个孔内菌液在40倍及100倍光学显微镜下镜检。显微镜视野中见酵母细胞形态的细胞,未见大肠杆菌形态细胞(图 3-A),说明流式细胞仪能正确区分大肠杆菌和酿酒酵母两种不同的细胞。
 |
| 图 3 R3分选区域分选得到的单细胞扩大培养后鉴定 Figure 3 The yeast culture after sorting in R3. A: Microscopic observation of the yeast cultured after sorting in R3; B: Analysis of 10-μL samples cultured in SD-Trp-Met, SD-Trp, or SD-Met medium with shaking overnight. |
| 图选项 |
将分选模式参数设置为单细胞模式分选R3区域内的细胞,并用含有200 μL YPD培养基的96孔板收集,200 r/min模式30 ℃振荡培养3 d。随后,随机选取10孔吸取10 μL菌液分别转接至4 mL SD-Trp-Met、SD-Trp、SD-Met培养基中振荡过夜培养。如果流式细胞仪未能分选单个细胞,则96孔内会出现BY4741和W303混合菌,则该孔内菌将在SD-Trp和SD-Met培养液内生长,两试管呈浑浊;如果流式细胞仪能够分选单个细胞,则96孔内不会出现混合菌,孔内单一为BY4741或W303细胞,则该孔仅能在SD-Trp或者SD-Met培养基内生长,两试管只出现单只试管浑浊(图 3-B)。本研究随机选取的10个孔转接至SD-Trp-Met、SD-Trp、SD-Met培养基的试管中,SD-Trp-Met试管均澄清,说明孔内未被其他菌污染;SD-Trp、SD-Met培养基内均只出现单支试管浑浊,未发现两只试管均浑浊的情况,说明孔内为单一酿酒酵母细胞。
2.3 新生隐球菌单细胞恢复生长比率测定
2.3.1 样品中死细胞比例的测定: 为确定制备的样品中死细胞和活细胞的比例,在上样前每个样品均摇匀后取出100 μL与5 μg/mL PI避光染色10 min后上样。PI是一类核酸染料,PI不能通过活细胞,当细胞死亡后,细胞膜结构遭到破坏,PI穿过细胞膜与双链DNA结合能够被激发出红色荧光,因此可以利用PI阳性细胞数百分比确定样品中死细胞比例。其中新生隐球菌JEC21、H99、白色念珠菌SC5314和酿酒酵母BY4741的PI阳性细胞数百分比分别为0.95%、1.10%、1.92%和0.84%,说明样品中死细胞比例较低。
2.3.2 富营养条件下,新生隐球菌单细胞恢复生长比率测定: YPD为富集培养基,用含有200 μL YPD培养基的96孔板收集分选出的新生隐球菌JEC21和新生隐球菌H99单细胞,其中JEC 21为环境分离菌株,H99为临床分离菌株,两者均可在富集培养基(YPD)和寡营养培养基(YNB)上生长。酿酒酵母、白色念珠菌作为对照组。经振荡培养3 d后,不同种的真菌单细胞均可恢复生长(图 4-A),其中新生隐球菌JEC21单细胞恢复生长比率为74%,新生隐球菌H99单细胞恢复生长比率为89%,白色念珠菌SC5314和酿酒酵母BY4741分别为89%、65%。四种真菌单细胞恢复生长比率分别进行t检验,在统计学上无明显差异(P>0.05)。在富营养条件下,真菌单细胞均可恢复生长,不同菌株的新生隐球菌单细胞恢复生长比率无明显差异,新生隐球菌与其他真菌单细胞恢复生长比率无明显差异。
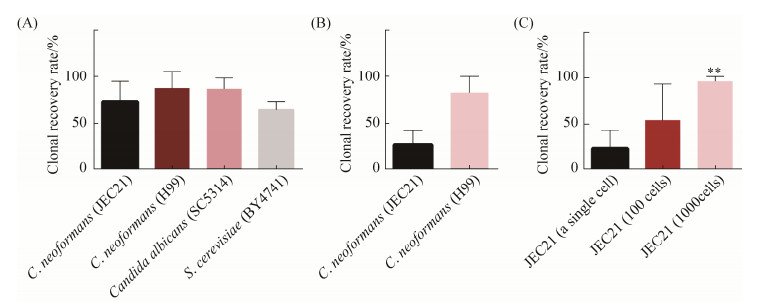 |
| 图 4 不同培养条件致病菌细胞恢复生长比率的比较 Figure 4 Comparison of the clonal recovery rate of pathogenic fungi in different culture conditions. A: The clonal recovery rate of pathogenic fungi cells in YPD medium; B: The clonal recovery rate of C. neoformans JEC21 and H99 isolates on auxotrophic medium; C: The clonal recovery rate of C. neoformans JEC21 single cells and multiple cells on auxotrophy media. Experiments were repeated three times and the mean±SD values were obtained. |
| 图选项 |
2.3.3 寡营养条件下,新生隐球菌单细胞恢复生长比率测定: 为阐释新生隐球菌单细胞在寡营养条件下的生长情况,利用寡营养培养基(YNB)研究新生隐球菌JEC21及H99的单细胞恢复生长比率。结果显示JEC21的单细胞恢复生长比率为37%,与JEC21相比,H99的单细胞恢复生长比率高达80%,明显高于JEC21菌株的单细胞恢复生长比率(图 4-B)。结果说明寡营养条件下,新生隐球菌单细胞均可恢复生长,但恢复生长的能力受到菌株差异的影响。
2.3.4 寡营养条件下,新生隐球菌多细胞恢复生长比率测定: 单个JEC21细胞的恢复生长比率受到培养条件的影响,为进一步阐明新生隐球菌细胞数目达到一定水平能否克服寡营养条件限制使细胞恢复生长比率得到提高,本研究利用含有YNB培养基的96孔收集不同数量的JEC21细胞,分别是1个细胞、100个细胞、1000个细胞。培养3 d后结果如图 4-C所示,单个细胞的恢复生长比率仅为30%。随着新生隐球菌细胞数量的增多,细胞恢复生长比率也相应的提高,细胞数目为100个时,细胞恢复生长比率为55%。细胞数目为1000个细胞时,JEC21在寡营养培养基YNB中的细胞恢复生长比率与在富营养培养基YDP中细胞恢复生长比率无明显差异。在寡营养培养条件下,JEC21达到一定数量时,细胞恢复生长比率与H99单细胞恢复生长比率无明显差异。这表明当细胞数目增多时,菌株差异对细胞恢复生长比率无明显影响。
3 讨论 本研究建立了流式细胞仪分选隐球菌单细胞的方法,利用流式细胞仪稳定、正确、低损地分选新生隐球菌单细胞。本研究发现流式细胞仪分选的新生隐球菌单细胞具有恢复生长的能力,但其能力受营养条件、菌株差异的影响。
通过传统显微操作获得隐球菌单细胞的方法效率低下,并在一定程度上会造成单细胞的损伤[17]。本研究首次利用流式细胞仪分选隐球菌单细胞,该方法不直接接触细胞,根据实验结果可知,分选出的单细胞具有生长能力,说明该方法对细胞的损伤较低。
前人报道有利用相似的方法分选微生物。Raphael等将细胞悬浮在可凝胶化的液体中,经过超声频率振动,从而将含有细胞的射流剪切成均匀的液滴,形成具有不同细胞数的10–40 μm琼脂糖珠[18]。该方法原理与流式细胞仪分选原理相似,不同在于该研究分选得到的琼脂糖珠内微生物数量随机,不能自定义分选数目。同时该方法将菌体包埋于琼脂糖珠中,未能与培养基充分混合,对试验造成一定程度影响。本研究利用流式细胞仪直接将含有单细胞的液滴打入培养基中,细胞与培养基能够充分接触,减少实验误差的生成。
流式细胞仪分选微生物具有简便、高效和高选择性等优点。根据本研究的结果可知,流式细胞仪能够正确地分选单个隐球菌细胞,为后续的单细胞测序提供了正确的模板。同时,流式细胞仪分选的真菌单细胞都具有恢复生长的能力,说明流式细胞仪分选对真菌的损伤较小,其分选得到的细胞具有较高的活力,保证该细胞能够完成后续的群感效应或者生殖异质性的研究,减少因操作造成的实验误差。
利用流式细胞仪分选的隐球菌单细胞恢复生长的能力与菌株种类和培养基相关。富营养培养基中,不同菌株恢复生长的能力无差异。寡营养培养基中,不同菌株恢复生长的能力有明显差异,说明菌株种类和不同培养条件有可能影响单细胞恢复生长的能力,将来可以根据实验的需要选取菌株种类和培养条件。
综上所述,本研究通过制备方式的优化和系统调整,使流式细胞仪能够高效、稳定、有目的地分选出单个细胞,通过该方法得到的隐球菌细胞能够进一步用于群感效应、生殖异质性或者单细胞测序的研究。同时该方法同样适用于环境微生物的分离或者临床微生物分离培养。流式细胞仪分选得到的新生隐球菌具有恢复生长能力,其能力受营养条件、菌株差异的影响,这些结果在一定范围内为将来利用流式细胞仪分选新生隐球菌单细胞所需要的培养条件提供了参考。
References
| [1] | Brown GD, Denning DW, Gow NA, Levitz SM, Netea MG, White TC. Hidden killers:human fungal infections. Science Translational Medicine, 2012, 4(165): 165rv113. |
| [2] | Fisher MC, Henk DA, Briggs CJ, Brownstein JS, Madoff LC, McCraw SL, Gurr SJ. Emerging fungal threats to animal, plant and ecosystem health. Nature, 2012, 484(7393): 186-194. DOI:10.1038/nature10947 |
| [3] | Rajasingham R, Smith RM, Park BJ, Jarvis JN, Govender NP, Chiller TM, Denning DW, Loyse A, Boulware DR. Global burden of disease of HIV-associated cryptococcal meningitis:an updated analysis. The Lancet Infectious Diseases, 2017, 17(8): 873-881. DOI:10.1016/S1473-3099(17)30243-8 |
| [4] | Jones KE, Patel NG, Levy MA, Storeygard A, Balk D, Gittleman JL, Daszak P. Global trends in emerging infectious diseases. Nature, 2008, 451(7181): 990-993. DOI:10.1038/nature06536 |
| [5] | Crespi BJ. The evolution of social behavior in microorganisms. Trends in Ecology & Evolution, 2001, 16(4): 178-183. |
| [6] | Lee H, Chang YC, Nardone G, Kwon-Chung KJ. TUP1 disruption in Cryptococcus neoformans uncovers a peptide-mediated density-dependent growth phenomenon that mimics quorum sensing. Molecular Microbiology, 2007, 64(3): 591-601. DOI:10.1111/mmi.2007.64.issue-3 |
| [7] | Wang LQ, Lin XR. The morphotype heterogeneity in Cryptococcus neoformans. Current Opinion in Microbiology, 2015, 26: 60-64. DOI:10.1016/j.mib.2015.06.003 |
| [8] | Dark MJ. Whole-genome sequencing in bacteriology:state of the art. Infection and Drug Resistance, 2013, 6: 115-123. |
| [9] | Zhang L, Cui X, Schmitt K, Hubert R, Navidi W, Arnheim N. Whole genome amplification from a single cell:implications for genetic analysis. Proceedings of the National Academy of Sciences of the United States of America, 1992, 89(13): 5847-5851. DOI:10.1073/pnas.89.13.5847 |
| [10] | Fu YS, Li CM, Lu SJ, Zhou WX, Tang FC, Xie XS, Huang YY. Uniform and accurate single-cell sequencing based on emulsion whole-genome amplification. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(38): 11923-11928. DOI:10.1073/pnas.1513988112 |
| [11] | Kwon-Chung K. A new genus, Filobasidiella, the perfect state of Cryptococcus neoformans. Mycologia, 1975, 67(6): 1197-1200. DOI:10.1080/00275514.1975.12019866 |
| [12] | Qiao YX, Zhao XY, Zhu J, Tu R, Dong LB, Wang L, Dong ZY, Wang QH, Du WB. Fluorescence-activated droplet sorting of lipolytic microorganisms using a compact optical system. Lab on a Chip, 2018, 18(1): 190-196. DOI:10.1039/C7LC00993C |
| [13] | Lau AY, Lee LP, Chan JW. An integrated optofluidic platform for Raman-activated cell sorting. Lab on a Chip, 2008, 8(7): 1116-1120. DOI:10.1039/b803598a |
| [14] | Spitzer MH, Nolan GP. Mass cytometry:single cells, many features. Cell, 2016, 165(4): 780-791. DOI:10.1016/j.cell.2016.04.019 |
| [15] | Shapiro HM. Practical Flow Cytometry. 4th ed. New York: John Wiley & Sons, 2005. |
| [16] | Vives-Rego J, Lebaron P, Nebe-von Caron G. Current and future applications of flow cytometry in aquatic microbiology. FEMS Microbiology Reviews, 2000, 24(4): 429-448. DOI:10.1111/j.1574-6976.2000.tb00549.x |
| [17] | Barer R, Saunders-Singer AE. A new single-control micromanipulator. Journal of Cell Science, 1948, 89(Pt 4): 439-447. |
| [18] | Nir R, Lamed R, Gueta L, Sahar E. Single-cell entrapment and microcolony development within uniform microspheres amenable to flow cytometry. Applied and Environmental Microbiology, 1990, 56(9): 2870-2875. |
