张勇1, 赵天宇1, 邓竣丹2, 吴珍珍3, 杨云秋1

 , 龙雁华3
, 龙雁华3

1. 安徽农业大学茶树生物学与资源利用国家重点实验室, 安徽 合肥 230036;
2. 安徽农业大学林学与园林学院, 安徽 合肥 230036;
3. 安徽农业大学生命科学学院, 安徽 合肥 230036
收稿日期:2018-07-31;修回日期:2018-10-16;网络出版日期:2019-03-27
基金项目:国家自然科学基金(31870635);安徽省重点研发计划(1804e03020320);国家重点实验室开放基金(SKLTOF20180109);安徽农业大学研究生创新基金(2018yjs-37)
*通信作者: Tel: +86-551-64786521; 杨云秋,E-mail:yyq_lyh@ahau.edu.cn;
龙雁华, E-mail:longyanhua@ahau.edu.cn.
摘要:[目的] 茶尺蠖是茶园中的重要害虫。研究茶尺蠖寄主食物-肠道菌群-茶尺蠖生长发育三者之间的关系对于茶尺蠖的防治具有重要的理论指导价值。[方法] 分析不添加茶叶因子的纯人工饲料和茶树鲜叶对茶尺蠖幼虫的存活影响;用高通量测序技术分析不同饲料饲喂的茶尺蠖幼虫的肠道菌群异同。[结果] 取食人工饲料的幼虫死亡率远远高于取食茶树鲜叶的幼虫;取食人工饲料的幼虫肠道细菌多样性和丰富度高于取食茶树鲜叶的幼虫;茶尺蠖幼虫肠道中存在很多促进宿主生长的细菌。[结论] 饲料类型影响茶尺蠖幼虫的存活;饲料类型影响茶尺蠖幼虫肠道菌群结构。
关键词:肠道菌群茶尺蠖幼虫多样性差异性
Effect of feed on gut bacterial diversity and larval survival of Ectropis obliqua (Lepidoptera: Geometridae)
Yong Zhang1, Tianyu Zhao1, Jundan Deng2, Zhenzhen Wu3, Yunqiu Yang1

 , Yanhua Long3
, Yanhua Long3

1. State Key Laboratory of Tea Plant Biology and Utilization, Anhui Agricultural University, Hefei 230036, Anhui Province, China;
2. School of Forestry and Landscape Architecture, Anhui Agricultural University, Hefei 230036, Anhui Province, China;
3. School of Life Sciences, Anhui Agricultural University, Hefei 230036, Anhui Province, China
*Corresponding author: Tel: +86-551-64786521; Yunqiu Yang, E-mail: yyq_lyh@ahau.edu.cn;
Yanhua Long, E-mail:longyanhua@ahau.edu.cn.
Foundation item: Supported by the National Natural Science Foundation of China (31870635), by the Anhui Provincial Key R & D Projects (1804e03020320), by the Open Fund of State Key Laboratory (SKLTOF20180109) and by the Anhui Agricultural University Graduate Innovation Fund (2018yjs-37)
Abstract: [Objective] Ectropis obliqua Prout (Lepidoptera:Geometridae) is the most devastating insect pest of tea plants in China. Studying on the relationship among feed, gut microbial flora and fitness of Ectropis obliqua is of relatively high theoretical value for the management of E. obliqua. [Methods] We analyzed the effect of artificial diet (without tea ingredients) and tea leaves on survival of Ectropis obliqua larvae. We also analyzed the similarities and differences of gut microbial flora in Ectropis obliqua larvae fed with different feeds based on high-throughput sequencing technology. [Results] The mortality of larvae were significantly different. Larvae fed with artificial diet had high mortality. Larvae fed with artificial diet had higher bacterial diversity and evenness than larvae fed with tea leaves. Many bacteria were found in the gut of Ectropis obliqua larvae. [Conclusion] Feed affects the survival and the gut microbial flora of Ectropis obliqua larvae.
Keywords: gut floraEctropis obliqua larvaerichnessdifference
肠道作为昆虫的消化场所,栖息着大量的细菌。这些细菌通常以内共生或外共生的方式在昆虫肠道中定殖[1-2]。对昆虫肠道细菌(外共生细菌)的菌群结构和菌群功能的研究发现,肠道细菌与宿主昆虫之间存在相互依赖、互利共生的关系。肠道细菌对昆虫健康和适应环境重要:(1)帮助宿主合成必需的营养物质;(2)产生消化酶促进宿主消化代谢;(3)参与宿主的生殖调节;(4)抵御(或解除)植物毒素(植物异种化感物质)和外源杀虫剂的毒害;(5)抵御外来病原物的入侵[3]。昆虫则可以为肠道细菌提供稳定的生活环境和生存必需的营养物质。目前国内外很多****将肠道细菌定义为宿主的一个“隐形器官”。因此,研究肠道细菌对于保护益虫和防治害虫具有重大的生态意义和科学价值。
影响昆虫肠道菌群结构的因素有很多,主要可分为三点:(1)昆虫的取食特性;(2)昆虫的肠道结构;(3)昆虫的肠道理化环境[4]。食物对昆虫肠道细菌的结构影响最大。例如,饲喂桑叶的家蚕肠道中的优势菌群为气单胞菌属(Aeromonas)、短杆菌属(Brevibacterium)和克雷伯氏菌(Klebsiella),柘叶饲喂的家蚕体内只有假单胞杆菌属(Pseudomonas)和土壤杆菌(Agrobacterium)[5]。而饲喂不含桑叶粉的幼虫肠道多出了葡萄球菌(Staphylococcus),因此认为该细菌的出现是家蚕生长被抑制的一个重要原因[6]。
植物产生了很多次级代谢物质(如植物酚类、生物碱和萜烯类)帮助抵御植食性昆虫的入侵[7]。那么昆虫是如何取食含有大量次级代谢物质的食物?昆虫肠道菌群能够帮助宿主抵御或分解植物毒素[8]。例如,咖啡浆果螟(Hypothenemus hampei)的肠道优势细菌假单胞菌(Pseudomonada)具有脱甲基能力,能够帮助宿主昆虫将咖啡碱降解,降低或解除咖啡碱的毒害作用[9]。对小菜蛾(Plutella xylostella)的肠道的宏基因组功能预测分析,发现其肠道菌群中的坏疽肠杆菌(Enterobacter asburiae)和阴沟肠杆菌(Enterobacter cloacae)具有降解酚类物质的基因[10]。
茶尺蠖(Ectropis obliqua Prout)属于鳞翅目(Lepidoptera)尺蛾科(Geometridae),是中国江南和江北茶区的主要食叶性害虫之一。以幼虫取食茶树的叶片方式危害茶园。虫害发生严重时,可以将茶园中的茶树叶片和嫩芽全部吃光,严重制约了茶叶生产的优质高效[11]。茶尺蠖属于寡食性昆虫,其幼虫在生长过程中大量取食茶树叶片,当食物缺乏时也会少量取食其他植物叶片,如向日葵、芝麻和辣蓼等[12]。茶尺蠖肠道细菌对宿主生长发育及寄主适应性是否起着重要的作用,目前未见报道过。另一方面,茶树叶片中含有丰富的次级代谢物质,如儿茶素、咖啡碱和茶皂苷等[13]。这些物质不利于昆虫生长。茶尺蠖是如何适应富含次级代谢物质的食物,与其肠道细菌是否相关等这些问题尚不知。为了了解寄主食物对茶尺蠖幼虫肠道细菌的影响,本实验通过改变茶尺蠖幼虫的寄主食物,来分析食物类型对肠道细菌的影响,并预测肠道微生物在茶尺蠖适应寄主植物过程中的作用。
1 材料和方法 1.1 供试昆虫 本实验中供试昆虫为茶园中主要食叶害虫茶尺蠖幼虫。幼虫从安徽农业大学茶树生物学与资源利用国家重点实验室获得。
1.2 昆虫饲养 昆虫饲养在人工气候室中,饲养条件为:温度(22±1) ℃;湿度(75±10)%;光照时间/黑暗时间 = 16 h/8 h。纯人工饲料配方如下:麦胚粉12.00 g、蔗糖2.00 g、大豆粉4.50 g、琼脂粉2.00 g、韦氏盐0.50 g、山梨酸0.15 g、尼泊金甲酯0.25 g、酵母粉0.20 g、维生素C 0.20 g、氯化胆碱0.05 g、胆固醇0.10 g、肌醇0.05 g和78 mL无菌水。人工饲料的制备:将各组分原料称好加入去离子水用玻璃棒搅拌混匀(除氯化胆碱、维生素C和酵母粉)。将混匀后的饲料置于250 mL的玻璃烧杯中,放入高温高压蒸汽灭菌锅105 ℃处理40 min再取出冷却;当体系温度冷却至60 ℃以下,加入膜过滤后的维生素C、氯化胆碱和酵母粉的混合溶液并用灭菌后的玻璃棒搅拌混匀。将配好的人工饲料用无菌保鲜膜包好,于4 ℃冰箱保存备用。
茶尺蠖初孵幼虫用茶树鲜叶饲喂12 d至三龄阶段;将这些三龄幼虫随机分成两组。一组继续用茶树鲜叶饲喂,另一组饲喂纯人工饲料。从每组中各选取健康的70头幼虫,分别用茶树鲜叶和饲料饲喂。昆虫饲喂在90 mm的培养皿中;每个培养皿中有10头健康幼虫。每天记录死亡的幼虫个数直至幼虫全部化蛹(意外死亡的不计入死亡数),将记录的生存结果绘制成生存曲线。
1.3 昆虫肠道解剖 选取50头持续用茶树鲜叶饲喂的健康五龄茶尺蠖幼虫,在超净工作台中解剖。首先将幼虫置于含有70%乙醇的烧杯中浸泡15 s进行体表杀菌,再用无菌水漂洗2次。然后将幼虫置于经紫外照射半小时后的蜡盘上(蜡盘置于冰块上),用无菌解剖工具取出整个肠道放入2 mL离心管(经过高温高压灭菌)中。取食人工饲料的茶尺蠖幼虫处理方式与之相同。每种处理均具有3个生物学重复。
1.4 DNA提取、PCR扩增和高通量测序 采用QIAamp DNA Stool Mini Kit (Qiagen, USA)粪便试剂盒提取茶尺蠖幼虫肠道中所有细菌的DNA。用Nanodrop超微量紫外分光光度计(Thermo,USA)检测DNA浓度,继而对所提DNA用1%的琼脂糖凝胶电泳检测。
以提取的总DNA为模板,使用带Barcode (515F-806R)的特异引物扩增茶尺蠖肠道细菌的16S rRNA的V4可变区。使用的酶和缓冲液来自Phusion? High-Fidelity PCR Master Mix (New England Biolabs)。PCR产物经2%琼脂糖凝胶电泳后,送交北京诺禾致源生物信息有限科技公司使用IlluminaHiSeq 2500平台进行DNA测序(PE250)。
1.5 数据分析 对获得的原始数据进行质控(截取、过滤和去嵌合体等处理,严格按照Qiime (V1.9.1,http://qiime.org/scripts/split_libraries_fastq.html)的操作流程),最终获得高质量的有效数据(effective tags)。
使用UPARSE软件(Uparse v7.0.1001 http://drive5.com/uparse/)对获得的Effective Tags进行聚类分析,默认以97%的相似度将序列聚类成OTUs (operational taxonomic units),依据其算法原则,将出现频率最高的序列作为OTUs的代表序列。用Mothur方法与SILVA (http://www.arb-silva.de/)的SSUrRNA数据库进行物种注释分析(设定阈值为0.8-1.0),获得分类学信息并分别在各个分类水平:界(kingdom),门(phylum),纲(class),目(order),科(family),属(genus),种(species)统计各样本的群落组成。使用MUSCLE (Version 3.8.31,http://www.drive5.com/muscle/)软件进行快速多序列比对,得到所有OTUs代表序列的系统发生关系。最后对各样品的数据进行均一化处理,以样品中数据量最少的为标准进行均一化处理,后续的Alpha多样性分析和Beta多样性分析都是基于均一化处理后的数据。
使用Qiime软件(Version 1.9.1)计算Observed- species、Chao1、Shannon、Simpson、ACE、Goods- coverage指数,使用R软件(Version 2.15.3)绘制稀释曲线并使用R软件进行Alpha多样性指数组间差异分析。用Qiime软件(Version 1.9.1)计算Unifrac距离、构建UPGMA样品聚类树。使用R软件(Version 2.15.3)绘制NMDS图。Alpha多样性指数和Beta多样性指数的组间差异分析均选用T-test和wilcox检验。
2 结果和分析 2.1 饲喂人工饲料和茶树鲜叶对茶尺蠖幼虫的生长影响。 取食不同食物的茶尺蠖幼虫的存活率方面有显著性差异(Student’s t test;P < 0.0001)。如图 1所示,饲料组幼虫从第3天就开始死亡,而茶树鲜叶组幼虫并无死亡现象。第10天时所有幼虫都进入蛹期。最终,茶树鲜叶组的幼虫全部存活(存活率为100%),而饲料组仅存活了44头(存活率为62.86%)。结果表明食物类型对茶尺蠖幼虫的生长有很大的影响。
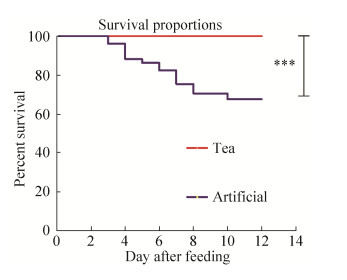 |
| 图 1 人工饲料和茶树鲜叶对茶尺蠖幼虫的存活率的影响 Figure 1 Effects of artificial diets and tea leaves on the survival proportions of E. obliqua larvae. Tea: the larvae reared with tea plant [Camellia sinensis (L.) O. Kuntze] leaves; Artificial: the larvae reared with normal artificial diets. Values are based on unpaired T test of two groups larvae on survival proportions; An unpaired two-tailed t-test was performed to assess the significance of differences between groups unless otherwise stated. *, P < 0.05; **, P < 0.001; ***, P < 0.0001 |
| 图选项 |
2.2 饲喂人工饲料和茶树鲜叶对茶尺蠖幼虫肠道细菌的影响
2.2.1 原始数据进行质控: 最终获得436002个Effective Tags。按照16S rRNA基因序列相似度97%为同一个OTU原则,共获得4351个OTU。从OTUs的角度分析食物处理对茶尺蠖幼虫肠道细菌的影响。基于OTU分类地位鉴定,共鉴定了44个门、108个纲、169个目、324个科、674个属和324个种。很多OTU无法被鉴定到种,可能属于新的细菌种。因而后续分析主要基于属的水平。
2.2.2 饲喂人工饲料和茶树鲜叶对茶尺蠖肠道细菌种群组成和丰度的影响: 如图 2所示,在门的水平,茶树鲜叶组幼虫肠道细菌丰度最高的分别是厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)。饲喂人工饲料和茶树鲜叶的茶尺蠖幼虫肠道细菌在门级别的组成上没有差异。两种食物饲喂的幼虫肠道优势细菌门都是厚壁菌门及变形菌门。茶树鲜叶组和饲料组的幼虫中厚壁菌门占的比例分别为79.98%和78.59%。在属的水平上,取食茶树鲜叶的茶尺蠖肠道细菌丰度前五的细菌分别是肠球菌(Enterococcus)、红球菌属(Rhodococcus)、紫单胞菌属(Parabacteroides)、脱硫弧菌(Desulfovibrio)和沙雷氏菌属(Serratia)等。饲料组幼虫肠道细菌丰度前五的细菌分别是肠球菌(Enterococcus)、魏斯式菌属(Weissella)、链球菌属(Streptococcus)、鞘氨醇单胞菌(Sphingomonas)以及乳球菌属(Lactococcus)。可以看出,两种食物处理的幼虫肠道优势菌都是肠球菌属,茶树鲜叶组和饲料组幼虫肠道中肠球菌属所占比值分别是75.50%和70.61%,差异并不是很大,除了优势细菌肠球菌外,两组幼虫的次优势菌种类和丰度都有很大的差异。如茶树鲜叶组中红球菌属丰度仅次于肠球菌,且该菌在饲料组中并未检测到,而饲料组中丰度第二的魏斯式菌属在茶树鲜叶组中也没有检测到。从肠道细菌的组成和丰度来看,两组幼虫肠道细菌结构还是有部分差异的。
 |
| 图 2 饲喂人工饲料和茶树鲜叶对茶尺蠖幼虫肠道细菌组成(A)和丰度的影响(B) Figure 2 Effects of artificial diets and tea leaves on the composition and abundance of bacteria in E. obliqua larvae gut. A: phylum level; B: genus level |
| 图选项 |
2.2.3 饲喂人工饲料和茶树鲜叶对茶尺蠖幼虫肠道细菌组成的影响: 对获得的OTUs进行均一化处理后,将两组幼虫肠道共有和不同的OTU绘制成韦恩图(图 3)。韦恩图显示在茶树鲜叶组幼虫肠道检测出3028个OTU,而饲料组幼虫肠道中检测出3461个OTU;饲料组OTU高于茶树鲜叶组。在这些OTU当中,有2138个OTU是共有的。这些共有的OTUs比率分别占吃茶树鲜叶的幼虫和吃人工饲料的幼虫肠道细菌中的70.6%和61.8%。从这数据可以看出两组肠道细菌组成有很大的差异。在我们的实验中,两组幼虫前处理是相同的(茶树鲜叶饲喂到三龄阶段),短期内改变幼虫食物对肠道细菌的组成有很大的影响。
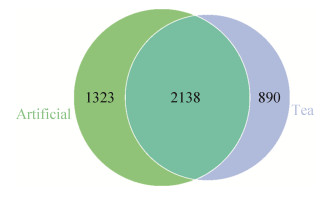 |
| 图 3 韦恩图显示饲喂人工饲料和茶树鲜叶的茶尺蠖幼虫肠道细菌群落结构 Figure 3 Venn analysis of OTUs of the gut bacterial of E. obliqua larval fed on artificial diets and tea leaves. Artificial: larvae feed on artificial diets; Tea: larvae feed on tea leaves |
| 图选项 |
2.2.4 不同食物处理茶尺蠖肠道细菌多样性: 如表 1所示,Chao1指数和ACE指数都是反映样品中细菌的丰富度,数值越大,则说明群落丰富度越大。茶树鲜叶组幼虫肠道细菌的Chao1指数和ACE指数都小于饲料组幼虫(Student’s t test,P < 0.05)。Shannon指数和Simpson指数反映群落的多样性。如表 1所示,茶树鲜叶组幼虫肠道细菌的Shannon指数低于人工饲料组幼虫,且Simpson指数高于人工饲料组的幼虫(Student’s t test, Simpson’s diversity: P < 0.05;Shannon diversity:P = 0.0748)。说明人工饲料组幼虫肠道细菌的多样性高于茶树鲜叶组。综上所述,饲料组幼虫肠道细菌多样性和丰富度高于茶树鲜叶组,暗示着食物对幼虫肠道细菌菌群结构有很大影响。
表 1. 茶尺蠖肠道细菌的Alpha多样性指数 Table 1. Alpha indices of the bacteria in the gut of larval Ectropis obliqua
| Index | Tea | Artificial | P valuea |
| Observed species | 664.33±115.28 | 1113.33±162.60 | 0.1830 |
| ACE diversity | 794.89±276.69 | 2279.31±459.85 | 0.0174* |
| Chao 1 diversity | 756.09±125.37 | 2223.76±462.05 | 0.0201* |
| Shannon diversity | 1.15±0.59 | 2.91±0.91 | 0.0748 |
| Simpson’s diversity | 0.60±0.02 | 0.17±0.08 | 0.0464* |
| Artificial: larvae feed on artificial diets; Tea: larvae feed on tea leaves,aAn unpaired two-tailed t-test was performed to assess the significance of differences between groups unless otherwise stated. *, P < 0.05. | |||
表选项
无度量多维标定法(NMDS,non-metric multi-dimensional scaling,stress < 0.2)统计能够有效地反映不同样本间细菌种类差异性。如图 4所示,两组幼虫肠道细菌在种类组成上具有显著性的差异。
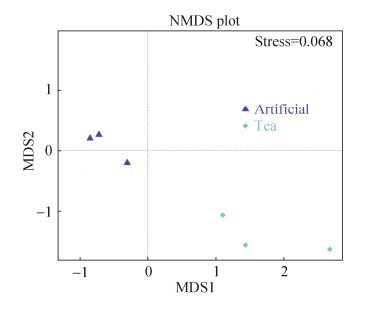 |
| 图 4 NMDS分析饲喂人工饲料和茶树鲜叶的茶尺蠖幼虫肠道细菌结构的差异 Figure 4 Nonmetric multidimensional scaling (NMDS) analysis of the gut bacterial structure of E. obliqua larval fed on artificial diets and tea leaves. Nonmetric multidimensional scaling (NMDS) diagrams of 6 samples, based on a Bray-Curtis distance matrix for bacterial communities that consisted of OTUs (97% similarity level). Bacterial communities of the two groups were significantly separated from each other (ANOSIM, P = 0.001). Artificial: larvae feed on artificial diets; Tea: larvae feed on tea leaves |
| 图选项 |
3 结论和讨论 本实验中,我们分别用茶树鲜叶和人工饲料饲喂三龄茶尺蠖幼虫直至化蛹。结果如图 1所示:茶树鲜叶组幼虫存活率100%,饲料组幼虫存活率为62.86%。与茶树鲜叶相比,人工饲料具有以下优点:(1)人工饲料为全营养饲料,营养成分比茶树鲜叶更全面;(2)人工饲料的主要成分均研磨成粉末状,更容易被昆虫消化吸收;(3)人工饲料中的次生性代谢物质含量远远低于茶树鲜叶[14]。但是从我们的饲养结果来看,饲料组的幼虫生长状况比茶树鲜叶组昆虫差很多。这暗示着茶树鲜叶中存在某些成分是茶尺蠖幼虫生长必不可少的。那么,茶尺蠖幼虫是如何适应具有潜在“毒素”的食物?近年来的研究认为昆虫肠道细菌对宿主具有补充必需营养物质、降解植物组织和解除植物毒素等功能。基于此,我们用二代测序技术首次对不同食物处理的五龄茶尺蠖幼虫肠道细菌菌落多样性和差异性进行分析,基于OTU注释结果,总共注释到44个门、108个纲、169个目、324个科、674个属和324个种。
从肠道细菌组成和丰度的角度进行比较。在门的水平差异不大,取食不同食物的茶尺蠖幼虫优势菌都属于厚壁菌门和变形菌门。在属的水平,两组幼虫肠道优势细菌都是肠球菌属,该细菌属于厚壁菌门,是一种革兰氏阴性细菌,在自然界中广泛存在,也是昆虫肠道中常见的细菌[15]。很多鳞翅目昆虫肠道中的优势细菌都是肠球菌属,如棉叶虫(Spodoptera littoralis)肠道的优势细菌是蒙氏肠球菌[16](Enterococcus mundtii),舞毒蛾(Gypsy moth)幼虫肠道优势细菌是粪肠球菌(Enterococcus faecalis)[17]。可能是因为鳞翅目昆虫肠道多为碱性环境,肠球菌属的细菌可以产生乙酸盐,能通过降低肠液的pH值来保护宿主[18]。除了这些功能外,肠球菌属还具有解毒功能(外源杀虫剂和植物次生性代谢物质)。如舞毒蛾肠道的粪肠球菌能够帮助宿主降低苏云金芽孢杆菌杀虫剂活性[19];烟草天蛾(Manduca sexta)和小菜蛾(Plutella xylostella)肠道内的肠球菌能够降低Cry1Ac的活性[20];宏基因组分析大戟天蛾(Hyles euphorbiae)和毛建夜蛾(Brithys crini)肠道细菌功能发现,这两种幼虫肠道的铅黄肠球菌(Enterococcus casseliflavus )能够降解植物中的萜烯类物质[21]。从我们得到的结果,我们认为茶尺蠖幼虫肠道中的肠球菌属可以帮助宿主降低肠液中的pH从而达到保护宿主的目的;另外,茶尺蠖幼虫能够适应茶树鲜叶中的次生性代谢物质可能与肠球菌相关。
除了肠球菌外,两组幼虫肠道内其他细菌丰度差异较大。茶树鲜叶组幼虫肠道内的红平红球菌(Rhodococcus erythropolis)含量仅次于肠球菌属的细菌,而饲料组肠道内红球菌含量极低。该细菌具有降解咖啡碱的能力,能将咖啡碱降解成可可碱。除了红平红球菌能降解咖啡碱外,粘质沙雷氏菌(Serratia marcescens)也具有一定的降解咖啡碱能力[22]。粘质沙雷氏菌在茶树鲜叶组幼虫肠道中的丰度也远远高于饲料组。咖啡碱在茶鲜叶中的含量很高(约占茶树鲜叶干重的1%–4%),对于昆虫来说咖啡碱不仅吃起来苦而且具有致死作用[23]。茶尺蠖幼虫能够够适应茶树鲜叶中的咖啡碱,可能与这些细菌相关。饲料中并无咖啡碱,所以与降解咖啡碱相关的细菌丰度菌都减少了。值得注意的是,饲料组的幼虫肠道中出现了新的细菌魏斯氏菌属,该细菌和肠球菌属同属于肠乳杆菌科。该细菌具有很好的降解纤维素能力[24]。人工饲料的主成分是麦胚粉和大豆粉。麦胚和大豆中的纤维素相对来说比较高,远远高于茶树鲜叶中的含量[25]。这可以解释为什么饲料组幼虫肠道中出现大量魏斯式菌属。
从肠道细菌的多样性和丰富度的角度比较,如韦恩图所示茶树鲜叶组幼虫肠道细菌OTU数量低于饲料组(茶树鲜叶组与饲料组分别有3028和3461个OTU)这些OTU中有2138个是相同的(分别占茶树鲜叶组和饲料组幼虫肠道细菌总OTU的70.6%和61.8%)。因为我们是先用茶树鲜叶饲喂初孵幼虫饲喂12 d至幼虫三龄阶段再改用饲料饲喂至五龄阶段,所以食物对幼虫肠道细菌的影响还是很大的。将这些OTU均一化处理后进行多样性分析。如表 1所示,饲料组幼虫肠道细菌的多样性和丰富度是高于茶树鲜叶组的,可能是因为食物的营养成分不同,茶树鲜叶中含有很多次生性代谢物质能够抑制很多细菌定殖。如茶树鲜叶中的多酚类物质表没食子儿茶素(EGCG)含量很高(约占茶树鲜叶干重的36%–56%),在人体及其他哺乳动物的试验中发现,EGCG具有显著的抑菌作用[26]。而饲料中的成分可能更适合很多细菌在肠道中定殖。比较两组幼虫肠道细菌的种类发现,两组幼虫肠道细菌种类差异很大(图 5)。人工饲料组中存在很多不利于昆虫生长的细菌,如金黄色葡萄球菌(Staphylococcus aureus),该菌是自然界中常见的病原菌[27]。除此之外,人工饲料组幼虫肠道中存在假单胞菌属(Pseudomonas)和假黄色单胞菌属(Pseudoxanthomonas),这些细菌曾被报道过不利于昆虫生长[28]。这表示改变寄主食物类型对幼虫肠道细菌结构影响很大。
在本试验中,人为改变茶尺蠖幼虫的寄主食物不仅影响到幼虫的正常生长,还影响到幼虫肠道细菌的结构。从我们的试验中可以得出结论:(1)寄主食物种类影响茶尺蠖幼虫的存活情况;(2)寄主食物种类影响茶尺蠖幼虫肠道菌群结构。
References
| [1] | Crotti E, Balloi A, Hamdi C, Sansonno L, Marzorati M, Gonella E, Favia G, Cherif A, Bandi C, Alma A, Daffonchio D. Microbial symbionts: a resource for the management of insect-related problems. Microbial Biotechnology, 2012, 5(3): 307-317. DOI:10.1111/mbt.2012.5.issue-3 |
| [2] | Chapman RF. The insects: structure and functionnn. London: Cambridge University Press, 1998: 132-141. |
| [3] | Engel P, Moran NA. The gut microbiota of insects - diversity in structure and function. FEMS Microbiology Reviews, 2013, 37(5): 699-735. |
| [4] | Brune A, Egert M, Lemke T, Friedrich MW, Wagner B. Microbial community structure in midgut and hindgut of the humus-feeding larva of Pachnoda ephippiata (Coleoptera: Scarabaeidae). Applied and Environmental Microbiology, 2003, 69(11): 6659-6668. DOI:10.1128/AEM.69.11.6659-6668.2003 |
| [5] | Xiang YQ, Wang XQ, Feng W, Zhou W, Xie HX, Wan YJ. Comparative analysis of the composition of dominant intestinal microflora in silkworm reared with different forages. Acta Ecologica Sinica, 2010, 30(14): 3875-3882. (in Chinese) 向芸庆, 王晓强, 冯伟, 周围, 谢洪霞, 万永继. 不同饲料饲养家蚕其肠道微生态优势菌群类型的组成及差异性. 生态学报, 2010, 30(14): 3875-3882. |
| [6] | Xiang H, Li MW, Zhao Y, Zhao LP, Zhang YH, Huang YP. Bacterial community in midguts of the silkworm larvae estimated by PCR/DGGE and 16S rDNA gene library analysis. Acta Entomologica Sinica, 2007, 50(3): 222-233. (in Chinese) 相辉, 李木旺, 赵勇, 赵立平, 张月华, 黄勇平. 家蚕幼虫中肠细菌群落多样性的PCR-DGGE和16S rDNA文库序列分析. 昆虫学报, 2007, 50(3): 222-233. DOI:10.3321/j.issn:0454-6296.2007.03.003 |
| [7] | Rosenthal GA, Berenbaum MR. Herbivores: their interactions with secondary plant metabolites Vol Ⅱ: ecological and evolutionary processes. 2nd ed. New York: Academic Press, 1992. |
| [8] | Itoh H, Tago K, Hayatsu M, Kikuchi Y. Detoxifying symbiosis: microbe-mediated detoxification of phytotoxins and pesticides in insects. Natural Product Reports, 2018, 35(5): 434-454. DOI:10.1039/C7NP00051K |
| [9] | Ceja-Navarro JA, Vega FE, Karaoz U, Hao Z, Jenkins S, Lim HC, Kosina P, Infant F, Northen TR, Brodie EL. Gut microbiota mediate caffeine detoxification in the primary insect pest of coffee. Nature Communications, 2015, 6: 7618. DOI:10.1038/ncomms8618 |
| [10] | de Fine Licht HH, Schi?tt M, Rogowska-Wrzesinska A, Nygaard S, Roepstorff P, Boomsma JJ. Laccase detoxification mediates the nutritional alliance between leaf-cutting ants and fungus-garden symbionts. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(2): 583-587. DOI:10.1073/pnas.1212709110 |
| [11] | Chen YG, Huang MD. Biological control progress of Ectropis obliqua Prout. Natural Enemies of Insects, 2001, 23(4): 181-184. (in Chinese) 陈亦根, 黄明度. 茶尺蠖生物防治进展. 环境昆虫学报, 2001, 23(4): 181-184. DOI:10.3969/j.issn.1674-0858.2001.04.007 |
| [12] | Gao XH, Wan XC, Yang YQ, Zheng GY, Shen Q. Studies on the biological habits of Ectropis obliqua prout. Plant Protection, 2007, 33(3): 110-113. (in Chinese) 高旭晖, 宛晓春, 杨云秋, 郑高云, 沈强. 茶尺蠖生物学习性研究. 植物保护, 2007, 33(3): 110-113. DOI:10.3969/j.issn.0529-1542.2007.03.031 |
| [13] | Wan XC, Li DX, Zhang ZZ, Xia T, Ling TJ, Chen Q. Research advance on tea biochemistry. Journal of Tea Science, 2015, 35(1): 1-10. (in Chinese) 宛晓春, 李大祥, 张正竹, 夏涛, 凌铁军, 陈琪. 茶叶生物化学研究进展. 茶叶科学, 2015, 35(1): 1-10. |
| [14] | Zeng FR. Research of insect artificial diet. Chinese Journal of Biological Control, 2018, 34(2): 184-197. (in Chinese) 曾凡荣. 昆虫人工饲料研究. 中国生物防治学报, 2018, 34(2): 184-197. |
| [15] | Yang YQ, Zhang Y, Chen YR, Zhang C, Zhao TY, Long YH. Function and research methods of insect intestinal bacteria. Journal of Anhui Agricultural University, 2018, 45(3): 512-518. (in Chinese) 杨云秋, 张勇, 陈亦然, 张灿, 赵天宇, 龙雁华. 昆虫肠道细菌的功能和研究方法. 安徽农业大学学报, 2018, 45(3): 512-518. |
| [16] | Chen BS, Teh BS, Sun C, Hu SR, Lu XM, Boland W, Shao YQ. Biodiversity and activity of the gut microbiota across the life history of the insect herbivore Spodoptera littoralis. Scientific Reports, 2016, 6: 29505. DOI:10.1038/srep29505 |
| [17] | Guan CH, Ju JH, Borlee BR, Williamson LL, Shen B, Raffa KF, Handelsman J. Signal mimics derived from a metagenomic analysis of the gypsy moth gut microbiota. Applied and Environmental Microbiology, 2007, 73(11): 3669-3676. DOI:10.1128/AEM.02617-06 |
| [18] | Mead LJ, Khachatourians GG, Jones GA. Microbial ecology of the gut in laboratory stocks of the migratory grasshopper, Melanoplus sanguinipes (Fab.) (Orthoptera: Acrididae). Applied and Environmental Microbiology, 1988, 54(5): 1174-1181. |
| [19] | Broderick NA, Raffa KF, Goodman RM, Handelsman J. Census of the bacterial community of the gypsy moth larval midgut by using culturing and culture-independent methods. Applied and Environmental Microbiology, 2004, 70(1): 293-300. DOI:10.1128/AEM.70.1.293-300.2004 |
| [20] | Johnston PR, Crickmore N. Gut bacteria are not required for the insecticidal activity of Bacillus thuringiensis toward the tobacco hornworm, Manduca sexta. Applied and Environmental Microbiology, 2009, 75(15): 5094-5099. DOI:10.1128/AEM.00966-09 |
| [21] | Vilanova C, Baixeras J, Latorre A, Porcar M. The generalist inside the specialist: gut bacterial communities of two insect species feeding on toxic plants are dominated by Enterococcus sp.. Frontiers in Microbiology, 2016, 7: 1005. |
| [22] | Mazzafera P. Degradation of caffeine by microorganisms and potential use of decaffeinated coffee husk and pulp in animal feeding. Scientia Agricola, 2002, 59(4): 815-821. DOI:10.1590/S0103-90162002000400030 |
| [23] | Nathanson JA. Caffeine and related methylxanthines: possible naturally occurring pesticides. Science, 1984, 226(4671): 184-187. |
| [24] | Wang HJ, Dai YK, Pan Q. Research status of Weissella. Journal of Chengdu Medical College, 2014, 9(6): 747-750. (in Chinese) 王海娟, 戴雨珂, 潘渠. 魏斯氏菌的研究现状. 成都医学院学报, 2014, 9(6): 747-750. DOI:10.3969/j.issn.1674-2257.2014.06.027 |
| [25] | Sun YQ, Guo YH. Determination of different types of Legumes cellulase content. Journal of Liaoning University of Traditional Chinese Medicine, 2014, 16(10): 63-65. (in Chinese) 孙艺琦, 郭晏华. 不同种类豆科植物中纤维素酶含量测定. 辽宁中医药大学学报, 2014, 16(10): 63-65. |
| [26] | Singh BN, Shankar S, Srivastava RK. Green tea catechin, epigallocatechin-3-gallate (EGCG): mechanisms, perspectives and clinical applications. Biochemical Pharmacology, 2011, 82(12): 1807-1821. DOI:10.1016/j.bcp.2011.07.093 |
| [27] | Bhakdi S, Tranum-Jensen J. Alpha-toxin of Staphylococcus aureus. Microbiological Reviews, 1991, 55(4): 733-751. |
| [28] | Yang HJ, Tan ZJ, Xiao QM, He KJ. Biocontrol functions of Pseudomonas. Chinese Journal of Eco-Agriculture, 2004, 12(3): 158-161. (in Chinese) 杨海君, 谭周进, 肖启明, 何可佳. 假单胞菌的生物防治作用研究. 中国生态农业学报, 2004, 12(3): 158-161. |
