韦苏慧1,2, 黄雪年2, 张伟2

 , 路尧1, 韩力挥1
, 路尧1, 韩力挥1
 , 吕雪峰2
, 吕雪峰2 1.中国海洋大学化学化工学院, 山东 青岛 266100;
2.中国科学院青岛生物能源与过程研究所, 中国科学院生物燃料重点实验室, 山东省合成生物学重点实验室, 山东 青岛 266101
收稿日期:2017-05-18;修回日期:2017-08-01;网络出版日期:2017-09-13
基金项目:国家自然科学基金(31400080)
*通信作者:张伟, Tel:+86-532-66786371, E-mail:lhhan@ouc.edu.cn
韩力挥, Tel:+86-532-80662715, E-mail:zhang_wei3@qibebt.ac.cn
摘要:[目的]分析洛伐他汀工业生产菌株土曲霉HZ01的次级代谢产物合成能力,为后期的遗传改造、次级代谢产物及其基因簇挖掘提供指导。[方法]对洛伐他汀发酵条件下的样品进行了转录组分析,同时运用色谱分离技术及波谱学方法对主要次级代谢产物进行了分离和结构鉴定。[结果]洛伐他汀合成相关基因转录水平非常高,还有4个聚酮合酶(PKS)、6个非核糖体多肽合成酶(NRPS)和1个PKS-NRPS杂合酶基因进行了转录,其他PKS和NRPS基因都处于沉默状态。此外,从该菌的发酵产物中分离鉴定了10个主要副产物并确定了其结构。[结论]土曲霉HZ01是一株优良的洛伐他汀生产菌株,在构建次级代谢产物异源合成细胞工厂和鉴定次级代谢产物生物合成途径方面具有很好的应用潜力。
关键词: 土曲霉 次级代谢产物 洛伐他汀 工业菌株 转录组
Synthesis of secondary metabolites by lovastatin-producing strain Aspergillus terreus HZ01
Wei Suhui1,2, Huang Xuenian2, Zhang Wei2

 , Lu Yao1, Han Lihui1
, Lu Yao1, Han Lihui1
 , Lü Xuefeng2
, Lü Xuefeng2 1.College of Chemistry and Chemical Engineering, Ocean University of China, Qingdao 266100, Shandong Province, China;
2.Key Laboratory of Biofuels, Shandong Provincial Key Laboratory of Synthetic Biology, Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences, Qingdao 266101, Shandong Province, China
Received 18 May 2017; Revised 1 August 2017; Published online 13 September 2017
*Corresponding author: Wei Zhang, Tel: +86-532-80662715, E-mail: zhang_wei3@qibebt.ac.cn
Lihui Han, Tel: +86-532-66786371, E-mail: lhhan@ouc.edu.cn
Supported by the National Natural Science Foundation of China (31400080)
Abstract: [Objective]The biosynthesis ability of secondary metabolites in the lovastatin-producing strain Aspergillus terreus HZ01 was analyzed, for strain improvement and genome mining of secondary metabolites through genetic engineering.[Methods]The transcriptome of Aspergillus terreus HZ01 under the condition of lovastatin fermentation was analyzed. Meanwhile, the main by-products were separated and identified by chromatographic separation and spectroscopy.[Results]The biosynthesis of lovastatin was very active, and most of other PKS and NRPS genes are silent besides of 4 PKS, 6 NRPS and 1 PKS-NRPS. In addition, 10 major by-products were isolated and identified from the cultures.[Conclusion]Aspergillus terreus HZ01 is an excellent lovastatin producing strain, which will also be a valuable chassis cell for the microbial cell factory construction and biosynthesis pathway identification.
Key words: Aspergillus terreus secondary metabolites lovastatin industrial strain transcriptome
丝状真菌是提供具有生物活性天然产物的重要资源库,合成了许多与人类生活密切相关的次级代谢产物,有对人类健康有益的抗生素(青霉素)、降血脂药物(洛伐他汀)、免疫抑制剂(环孢霉素)以及食品色素等;也有对人畜有害的真菌毒素(黄曲霉毒素)和对农作物有害的植物性毒素等[1],这使得真菌次级代谢产物的研究受到广泛关注[2-4]。聚酮类和非核糖体多肽类化合物是最主要的两种真菌次级代谢产物,碳骨架分别由核心酶聚酮合酶(polyketide synthase,PKS)和非核糖体多肽合成酶(non-ribosomal peptide synthetase,NRPS)负责合成,然后在各种修饰酶的辅助作用下形成最终产物,这些相关基因通常会在基因组上相互毗邻形成一个生物合成基因簇[5]。近年来,随着基因组测序工作的不断推进,对这些基因簇的研究也受到广泛关注[6]。
土曲霉是一种具有重要经济价值的丝状真菌,作为发酵菌株已经用于衣康酸和洛伐他汀的大规模工业生产。其中,衣康酸是一种重要的化工原料,被美国能源部列为十二种最具应用前景的生物基平台化合物之一[7];洛伐他汀及其衍生物是重要的降血脂药物之一,曾长期位列全球畅销药前列,2015年全球销售额仍高达30亿美元。基因组序列公布后,生物信息学研究显示,测序菌株土曲霉NIH2624基因组中含有大量的次级代谢产物合成基因簇,这说明土曲霉具有很强的次级代谢产物合成能力,近年来也吸引了较多的关注,但受菌株所限,只有少部分基因簇及其产物被鉴定[8]。
土曲霉HZ01是一株产洛伐他汀的工业生产菌株,具有很好的洛伐他汀合成能力,但是其发酵副产物一直没有被分析,因此有必要对其进行研究,有望发现更多有用的新化合物。同时,在明确主要副产物之后,将可以通过代谢工程技术来阻断竞争途径[9],减少副产物的生成,既可以进一步提高洛伐他汀的产量,还可以降低后续产物分离纯化的难度,从而降低企业的生产成本[10]。为了更全面地了解土曲霉HZ01的次级代谢合成特征,本研究对该菌株在洛伐他汀发酵条件下的转录组和主要发酵副产物进行了分析,为土曲霉的次级代谢产物及其基因簇挖掘提供指导,也为该工业菌株的进一步改良和应用打下基础。
1 材料和方法 1.1 仪器与试剂 AVANCE III 600 MHz超导核磁共振波谱仪(瑞士Bruker公司),Agilent 7890-5975C型质谱仪(Agilent Technologies),Agilent1260型高效液相色谱仪(Agilent Technologies),JASCO P-2000旋光仪(日本电子),Waters XBridge OBD C18 (150 mm×10 mm,5 μm) preparative HPLC column (Waters公司),ZORBAX Eclipse XDB-C18 (150 mm×4.6 mm,5 μm) analytical HPLC column (Agilent Technologies),HP-05型耐瓷封闭式恒温电炉(上海学森仪器有限公司)。HPLC用色谱甲醇、乙腈(ACS国药集团化学试剂有限公司),其他试剂(石油醚、乙酸乙酯、二氯甲烷、甲醇等)均为国药集团分析纯。
1.2 菌株及培养条件 菌株来源于浙江海正药业股份有限公司;PDA培养基购自BD公司;在PDA平板上30 ℃培养7 d获得成熟孢子。洛伐他汀发酵培养基(g/L):葡萄糖70,蔗糖20,酵母抽提物1.5,蛋白胨20,乙酸钠7,KH2PO4 0.5,MgSO4 0.5,豆粕5,碳酸钙5,pH 6.5,按35 mL/三角瓶(250 mL)进行分装,1×105 Pa灭菌30 min。
1.3 洛伐他汀发酵条件下的转录组分析 将成熟孢子制备孢子悬液,接种至三角摇瓶发酵培养基中(3瓶),接种量5×107个/mL孢子,在28 ℃、220 r/min条件下摇床振荡培养60 h。滤布过滤收集菌丝,无菌水洗涤,3个平行样品分别称取1.5 g进行混合,混合样品液氮研磨后用Plant RNA Purification Reagent试剂盒(Invitrogen)提取RNA,采用Illumina TruseqTM RNA sample prep Kit方法构建文库,用Illumina Hiseq测序平台进行2×150 bp测序。
1.4 次级代谢产物的提取与分离 发酵第7天结束后,菌体与菌液分离,分别用乙酸乙酯萃取3次,粗提物减压浓缩获得粗浸膏,通过减压硅胶柱层析,以石油醚-乙酸乙酯(体积比分别为10%、30%、50%、70%、90%和100%的乙酸乙酯)为流动相进行梯度洗脱,获得6个组分(Fr.A–F)。
Fr.D组分经过反相硅胶柱层析得到3个组分(Fr.D-1–Fr.D-3),Fr.D-2组分经半制备液相分离HPLC (MeOH:H2O=70:30)得到化合物1、2和3。Fr.C组分经过反相硅胶柱层析得到2个组分(Fr.C-1–Fr.C-2),Fr.C-1组分经半制备液相分离(MeOH:H2O=60:40)得到化合物8和9,Fr.C-2组分经半制备液相分离(MeOH:H2O=65:35)得到化合物10。Fr.B组分经过反相硅胶柱层析得到5个组分(Fr.B-1-Fr.B-5),Fr.B-2组分经半制备液相分离(MeOH:H2O=30:70)得到化合物4和5,Fr.B-3经半制备液相分离(MeOH:H2O=25:65)得到化合物6,Fr.B-1经半制备液相分离(MeOH:H2O=10:90)得到化合物7。
HPLC分析方法:流动相A:5% MeCN/H2O (0.05% FA);流动相B:MeCN (0.05% FA);0–5 min 100%–80% A,5–35 min 80%–40% A,35–50 min 40% A,50–55 min 40%–0% A,55–60 min 0%–100% A,60–65 min 100% A,1 mL/min;检测波长250 nm;上样量10 μL。
2 结果和分析 2.1 主要副产物的分离鉴定 对土曲霉HZ01在洛伐他汀发酵条件下产生的次级代谢产物进行了HPLC分析(图 1),结果显示,除了他汀类化合物(*标注)之外还有一些副产物,其中量较大的是化合物6和7。选择含量相对较大的10个副产物进行了分离鉴定(图 2)。
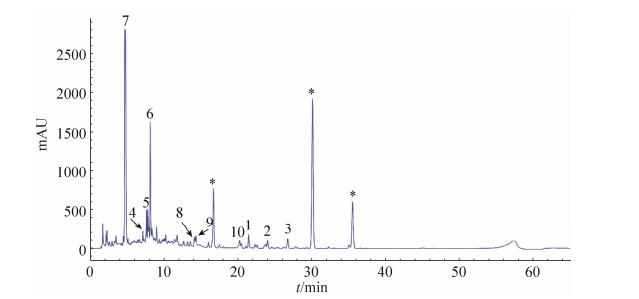 |
| 图 1 土曲霉HZ01次级代谢产物色谱分析图 Figure 1 The chromatogram of secondary metabolites from Aspergillus terreus HZ01. *: Statins. |
| 图选项 |
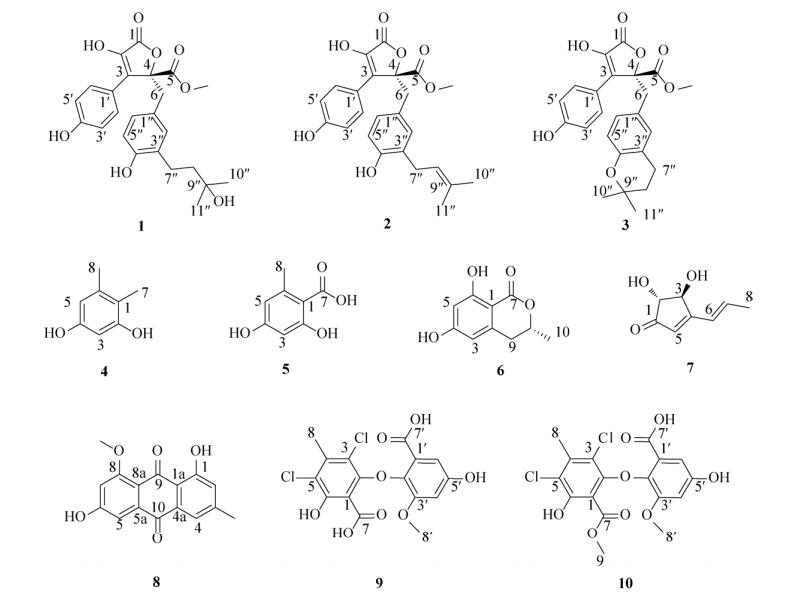 |
| 图 2 土曲霉HZ01主要副产物的化学结构 Figure 2 The chemical structure of the main by-products of Aspergillus terreus HZ01. |
| 图选项 |
化合物1:浅黄色油状固体。ESI-MS显示分子离子峰m/z 441 [M-H]–,分子量为442,提示分子式为C24H26O8,不饱和度为12。在1H-NMR谱中,低场处一共存在7个烯氢信号,其中δH 7.64 (2H,d,J=6.0 Hz)和6.99 (2H,d,J=6.0 Hz)的信号表明结构中含有一个对位取代的苯环结构,而δH 6.53 (1H,m)、6.56 (1H,m)和6.57 (1H,m)的信号表明结构中存在1个三取代的苯环结构,δH 3.80 (3H,s)为甲氧基氢信号,δH 2.50 (2H,m)、1.56 (2H,m)和1.19 (6H,s)为脂肪链上氢的信号,还剩4个不饱和度,可能存在全取代的内酯环结构和羰基结构,1H-NMR谱符合丁内酯类化合物的特征,结合与文献[11]的数据比对,确定该化合物为terrelactone。
化合物2:黄色油状固体。ESI-MS显示分子离子峰m/z 423 [M-H]–,分子量为424,提示分子式为C24H24O7,不饱和度为13。1H-NMR谱与化合物1的1H-NMR谱相似,提示为同类型的丁内酯类化合物,不同在于相较化合物1在低场处多出1个烯氢信号:δH 5.12 (1H,t,J=6.0 Hz),在高场处的脂肪氢信号消失:δH 2.50 (2H,m)、1.56 (2H,m),结合较化合物1多出1个不饱和度,提示可能是在与苯环相连的侧链上多出一个双键,根据与文献[12]数据的比对,确定该化合物为butyrolactone I。
化合物3:白色油状固体。ESI-MS显示分子离子峰m/z 423 [M-H]–,分子量为424,提示分子式为C24H24O7,不饱和度为13。1H-NMR谱与化合物1的1H-NMR谱非常相似,提示为同类型的丁内酯类化合物,它们之间的不同主要表现在化合物1在高场处的氢信号δH 2.50 (2H,m)、1.56 (2H,m)和1.19 (6H,s)在化合物3中向低场移动δH 2.57 (2H,m)、1.72 (2H,t,J=6.0 Hz)和1.23 (6H,d,J=6.0 Hz),结合化合物3较1多出1个不饱和度,表明连在苯环上的侧链可能与羟基成环,最后根据与文献[13]数据的比对,确定该化合物为aspernolide A。
化合物4:白色油状固体。GC-MS显示分子离子峰m/z 138 [M]+,分子量为138,提示分子式为C8H10O2,不饱和度为4。在1H-NMR谱中存在间位取代的苯环上氢的信号δH 6.20 (1H,d,J=2.4 Hz)、6.26 (1H,d,J=2.4 Hz),高场处为2个与苯环相连的甲基氢信号δH 2.16 (3H,s)、2.02 (3H,s),在13C-NMR谱中与之对应的存在6个苯环上碳(δC 156.9,156.2,139.3,115.0,109.2和101.0)以及与苯环相连碳的信号(δC 20.4和11.0)。表明该化合物为苯的衍生物,根据与文献[14]数据比对,确定该化合物为4, 5-dimethylresorcinol。
化合物5:无色结晶粉末。ESI-MS显示分子离子峰m/z 167 [M-H]–,分子量为168,提示分子式为C8H8O4,不饱和度为5。NMR谱与化合物4相似,提示为同类型化合物,1H-NMR谱中与化合物4的主要区别在于高场处一个连在苯环的甲基氢信号δH 2.02 (3H,s)消失,在13C-NMR谱中化合物4高场处的连苯环的碳信号δC 20.5消失,低场处多出一个酯羰基碳信号δC 175.1。结合分子量及不饱和度推测可能是苯甲酸衍生物,通过与文献[15]数据比对,确定该化合物为orsellinic acid。
化合物6:无色结晶粉末。ESI-MS显示分子离子峰m/z 193 [M-H]–,分子量为194,提示分子式为C10H10O4,不饱和度为6。在1H-NMR谱中低场处与化合物4相似,出现间位取代的苯环氢信号δH 6.31 (H,d,J=2.4 Hz)、6.27 (H,d,J=2.4 Hz)。δH 4.70 (1H,m)为连氧氢信号,低场处存在1个次甲基氢信号δH 2.95 (1H,dd,J=16.2,3.0 Hz)、2.86 (1H,dd,J=16.2,3.0 Hz)和1个甲基氢信号δH 1.46 (3H,d,J=6.0 Hz),结合分子量与不饱和度推测可能与蜂蜜曲菌素相似,通过查阅文献[16],确定化合物6为6-hydroxymellein,化合物6的旋光为[α]D25=?65.1 (c 2.3%,MeOH),与文献[α]D25=?49.3±1 (c 1.15%,MeOH)对比确定8位为R构型。
化合物7:无色油状固体。ESI-MS显示分子离子峰m/z 153 [M-H]–,分子量为154,提示分子式为C8H10O3,不饱和度为4。1H-NMR谱在低场处可以观察到3个烯键氢信号δH 6.81(1H,dq,J=15.8,6.9 Hz)、6.43 (1H,br d,J=15.8 Hz)和5.95(1H,s),由此推断:其中1个双键被甲基取代,另外1个为三取代双键,且带有双键氢的碳连在季碳上,1H-NMR谱还给出了2个连氧的次甲基信号δH 4.71 (1H,d,J=2.4 Hz)、4.07 (1H,d,J=2.4 Hz)和1个甲基信号δH 1.90 (3H,d,J=6 Hz)。结合以上数据,调研文献[17]发现,该化合物为在土曲霉中大量存在的terrein。
化合物8:黄色结晶粉末。ESI-MS显示分子离子峰m/z 283 [M-H]–,分子量为284,提示分子式为C16H12O5,不饱和度为11。13C-NMR谱的低场处存在2个酮羰基碳信号(δC 188.7和184.1)和12个烯碳信号(δC 166.3,165.2,163.7,148.3,138.9,134.0,125.4,120.6,116.0,114.6,108.4和105.7),表明该化合物具有蒽醌类骨架结构,在1H-NMR谱中低场处可以观察到2个活泼氢信号δH 13.24 (1H,s)、11.24 (1H,s)和4个间位取代的苯环氢信号δH 7.45 (1H,d,J=2.4 Hz)、7.23 (1H,d,J=2.4 Hz),7.15 (1H,d,J=2.4 Hz)、6.87 (1H,d,J= 2.4 Hz),高场处给出1个连氧的甲基氢信号δH 3.91 (3H,s)和连在苯环上的甲基氢信号δH 2.40 (3H,s),表明该化合物为多羟基取代的蒽醌甲醚类化合物,通过与文献[18]比对,确定该化合物为questin。
化合物9:无色结晶粉末。ESI-MS显示存在同位素分子离子峰m/z 401,403,405 [M-H]–,且它们的丰度比为9:6:1,提示分子中含有2个氯原子,分子量为403,提示分子式为C16H12Cl2O8,不饱和度为10。在1H-NMR谱中低场处给出2个间位取代的苯环氢信号δH 6.82 (1H,d,J=2.4 Hz),6.68 (1H,d,J=2.4 Hz),高场处给出1个连氧的甲基氢信号δH 3.55 (3H,s)和连在苯环上的甲基氢信号δH 2.50 (3H,s),在13C-NMR谱中低场处的2个酯羰基碳(δC 171.2和167.1)和12个烯碳(δC 157.1,154.1,153.5,151.8,141.0,138.7,125.4,118.1,117.6,109.2,108.6和105.8)为曲地酸类化合物的特征信号,通过与文献[19]数据比对,确定化合物9为3, 5-dichloro-6, 5′-dihydroxy-3′-methoxy-4-methyl-2, 2′-oxy-di-benzoic acid。
化合物10:无色结晶粉末。ESI-MS显示存在同位素分子离子峰m/z 415,417,419 [M-H]–,且它们的丰度比为9:6:1,提示分子中含有2个氯原子,分子量为417,提示分子式为C17H14Cl2O8,不饱和度为10。化合物10的1H-NMR谱与化合9相似,说明它们均为曲地酸类化合物,1H-NMR谱与9的区别主要在δH 3.74 (3H,s)处多出1个连氧的甲基氢信号。通过与文献[19]数据比对,确定该化合物为neogeodin hydrate。
2.2 波谱数据 Terrelactone:Light yellow oil solid。ESI-MS m/z 441.1 [M-H]–。1H-NMR (600 MHz,CD3COCD3):δH 3.80 (3H,s,MeO-5);3.45 (2H,s,H-6),7.64 (2H,d,J=6.0 Hz,H-2′ and H-6′),6.99 (2H,d,J=6.0 Hz,H-3′ and H-5′),6.53 (1H,m,H-2″),6.56 (1H,m,H-5″),6.57 (1H,m,H-6″),2.50 (2H,m,H-7″),1.56 (2H,m,H-8″),1.19 (6H,s,H-10″ and H-11")。
Butyrolactone I:Yellow oil solid。ESI-MS m/z 423.1 [M-H]–。1H-NMR (600 MHz,CDCl3):δH 3.79 (3H,s,MeO-5),3.53 (2H,m,H-6),7.62 (2H,d,J=6.0 Hz,H-2′ and H-6′),6.93 (2H,d,J=6.0 Hz,H-3′ and H-5′),6.53 (1H,m,H-2″),6.60 (1H,m,H-5″),6.56 (1H,m,H-6″),3.16 (2H,d,J=6.0 Hz,H-7″),5.12 (1H,t,J=6.0 Hz,H-8″),1.68 (3H,s,H-10″),1.72 (3H,s,H-11″)。
Aspernolide A:Colorless oil solid。ESI-MS m/z 423.1 [M-H]–。1H-NMR (600 MHz,CD3COCD3):δH 3.80 (3H,s,MeO-5);3.46 (2H,d,J=6.0 Hz,H-6),7.62 (2H,d,J=12.0 Hz,H-2′ and H-6′),6.99 (2H,d,J=6.0 Hz,H-3′ and H-5′),6.46 (1H,d,J=6.0 Hz,H-2″),6.54 (1H,t,J=12.0 Hz,H-5″),6.56 (1H,t,J=12.0 Hz,H-6″),2.57 (2H,d,J= 6.0 Hz,H-7′),1.72 (2H,t,J=6.0 Hz,H-8″),1.23 (6H,d,J=6.0 Hz,H-10″ and H-11″)。
4, 5-dimethylresorcinol:Colorless oil solid。GC-MS m/z 138.1 [M]+。1H-NMR (600 MHz,CD3COCD3):δH 6.20 (1H,d,J=2.4 Hz,H-3),6.26 (1H,d,J=2.4 Hz,H-5),2.16 (3H,s,H-7),2.02 (3H,s,H-8)。13C-NMR (600 MHz,CD3OD):δC 115.0 (C,C-1),156.9 (C,C-2),101.0 (CH,C-3),156.2 (C,C-4),109.2 (CH,C-5),139.3 (C,C-6),11.0 (CH3,C-7),20.4 (CH3,C-8)。
Orsellinic acid:Colorless crystal power。ESI-MS m/z 167.0 [M-H]–。1H-NMR (600 MHz,CD3OD):δH 6.14 (1H,s,H-3),6.19 (1H,s,H-5),2.48 (3H,s,H-8)。13C-NMR (600 MHz,CD3OD):δC 108.6 (C,C-1),163.7 (C,C-2),101.6 (CH,C-3),167.0 (C,C-4),112.3 (CH,C-5),145.3 (C,C-6),175.1 (C,C-7),24.3 (CH3,C-8)。
6-hydroxymellein:Colorless crystal power。ESI-MS m/z 193.0 [M-H]–。1H-NMR (600 MHz CD3COCD3):δH 6.31 (H,d,J=2.4 Hz,H-3),6.27 (H,d,J=2.4 Hz,H-5),4.70 (1H,m,H-8),2.95 (1H,dd,J=16.2,3.0 Hz,H-9a),2.86 (1H,dd,J=16.2,3.0 Hz,H-9b),1.46 (3H,d,J=6.0 Hz,H-10)。Optical rotation [α]D25 =?65.1 (c 2.3%,MeOH)。
Terrein:Colorless oil solid。ESI-MS m/z 153.0 [M-H]–。1H-NMR (600 MHz,CD3OD):δH 4.07 (1H,d,J=2.4 Hz,H-2),4.71 (1H,d,J=2.4 Hz,H-3),5.95 (1H,s,H-5),6.43 (1H,br d,J=15.8 Hz,H-6),6.81 (1H,dq,J=15.8,6.9 Hz,H-7),1.90 (3H,d,J=6.0 Hz,H-8)。
Questin:Yellow crystal power。ESI-MS m/z 283.0 [M-H]–。1H-NMR (600 MHz,DMSO):δH 13.24 (1H,s,1-OH),11.24 (1H,s,6-OH),7.45 (1H,d,J=2.4 Hz,H-2),7.23 (1H,d,J=2.4 Hz,H-4),7.15 (1H,d,J=2.4 Hz,H-5),6.87 (1H,d,J=2.4 Hz,H-7),3.91 (3H,s,8-OCH3),2.40 (3H,s,3-CH3),13C-NMR (600 MHz,CD3OD):δC 188.7 (C,C-9),184.1 (C,C-10),166.3 (C,C-6),165.2 (C,C-8),163.7 (C,C-1),148.3 (C,C-3),138.9 (C,C-5a),134.0 (C,C-4a),125.4 (CH,C-2),120.6 (CH,C-4),116.0 (C,C-1a),114.6 (C,C-8a),108.4 (CH,C-7),105.7 (CH,C-5),56.9 (CH3,8-OCH3),21.9 (CH3,3-CH3)。
3, 5-dichloro-6, 5′-dihydroxy-3′-methoxy-4-methyl-2, 2′-oxy-di-benzoic acid:Colorless crystal power。ESI-MS m/z 401.0,403.0,405.0 [M-H]–。1H-NMR (600 MHz,CD3COCD3):δH 2.50 (3H,s,4-Me),6.68 (1H,d,J=2.4 Hz,H-4′),6.82 (1H,d,J= 2.4 Hz,H-6′),3.55 (3H,s,3′-OMe)。13C-NMR (600 MHz,CD3COCD3):δC 109.2 (C,C-1),151.8 (C,C-2),117.6 (C,C-3),141.0 (C,C-4),118.1 (C,C-5),153.5 (C,C-6),171.2 (C,1-COOH),18.6 (CH3,4-Me),125.4 (C,C-1′),138.7 (C,C-2′),154.1 (CH,C-3′),105.8 (CH,C-4′),157.1 (CH,C-5′),108.6 (C,CH-6′),167.1 (C,1′-COOH),57.0 (CH3,3′-OMe)。
Neogeodin hydrate:Colorless crystal power。ESI-MS m/z 415.0,417.0,419.0 [M-H]–。1H-NMR (600 MHz,CD3COCD3):δH 3.56 (3H,s,1-COOMe),2.47 (3H,s,4-Me),3.74 (3H,s,3′-OMe),6.68 (1H,s,H-4′),6.82 (1H,s,H-6′)。
2.3 转录组检测结果概述 提取了发酵第60 h的菌丝样品的总RNA,OD260/280为1.921,OD260/230为2.042,总量为61 μg (50 μL),质量良好(图 3)。用Illumina Hiseq测序平台进行2×150 bp测序,Mapped rate为82.32%,共得到9295个转录本,长度分布于351 bp到21114 bp之间,平均长度为1958.83 bp,N50为2146 bp。
 |
| 图 3 总RNA样品的琼脂糖凝胶电泳检测结果 Figure 3 Agarose gel electrophoresis results of the total RNA sample. M: DNA Marker; 1: RNA sample. |
| 图选项 |
2.4 次级代谢产物合成关键基因的转录水平分析 生物信息学分析显示,土曲霉NIH2624基因组中有30个PKS和1个PKS-NRPS杂合酶[8, 20]。土曲霉HZ01的转录组分析结果显示只有15个PKS基因的FPKM值大于1,FPKM值大于5的有5个(表 1)。其中转录水平最高的是与洛伐他汀合成相关的2个PKS基因ATEG_09961 (lovB)和ATEG_09968(lovF),分别为894.49和361.14,显著高于其他PKS,这说明经过驯化后PKS途径的代谢流主要流向洛伐他汀合成途径,充分显示了土曲霉HZ01高产洛伐他汀的优良性状。但是也有部分PKS处于活跃状态,转录水平都不高,例如ATEG_08451、ATEG_00145、ATEG_04718以及PKS-NRPS杂合酶ATEG_00325,其中ATEG_08451、ATEG_00145的产物在发酵物中都有被发现。ATEG_08451在硫酯酶ATEG_08450的帮助下合成蒽醌类化合物8,在多种修饰酶的作用下最终生成化合物9和10,该合成途径非常复杂,很多修饰酶基因都有待鉴定[21-23]。ATEG_00145的产物链长特异性较差,会以丙二酰-CoA为延伸单元反应2–4次,分别生成不同链长的化合物5–7,其中化合物7土曲霉酮是主要产物,目前土曲霉酮合成基因簇已被报道,但是各基因在生物合成过程中的功能都尚未明确[24]。关于ATEG_04718基因的功能目前尚未见报道。
表 1. 活跃型PKS和NRPS基因的转录水平 Table 1. The transcriptional level of the PKS and NRPS genes
| Gene ID | Type | Domain composition | FPKM* |
| ATEG_09961 | HR-PKS | KS-AT-DH-MT-(ER)-KR-ACP | 894.49 |
| ATEG_09968 | HR-PKS | KS-AT-DH-MT-ER-KR-ACP | 361.14 |
| ATEG_08451 | NR-PKS | SAT-KS-AT-PT-ACP | 24.96 |
| ATEG_04718 | HR-PKS | KS-AT-DH-KR-ER-KR-ACP | 17.79 |
| ATEG_00145 | NR-PKS | SAT-KS-AT-PT-ACP-ACP-TE | 8.62 |
| ATEG_01052 | NRPS-like | A-T-R | 472.92 |
| ATEG_09142 | NRPS | A-T-R | 41.10 |
| ATEG_02403 | NRPS-like | A-T-R-KR | 26.76 |
| ATEG_02815 | NRPS-like | A-T-TE | 26.41 |
| ATEG_09064 | NRPS | A-T-C-T-C | 6.60 |
| ATEG_00228 | NRPS | C-A-A-T-C-T | 5.05 |
| ATEG_00325 | PKS-NRPS | KS-AT-(DH)-(MT)-(KR)-ACP-C-A-T-R/C | 6.87 |
| *FPKM: Fragments per kilobase of exon model per million mapped reads. | |||
表选项
在38个NRPS及类NRPS基因中,FPKM值大于1的有14个,大于5的只有6个(表 1)。其中ATEG_01052的转录水平高达472.92,显著高于其他NRPS基因,甚至高于洛伐他汀合成基因ATEG_09968。这6个NRPS基因中只有ATEG_02815的功能已被鉴定,化合物1–3就是其产物[25],而其他5个基因的功能都有待研究。主要副产物中只有一类非核糖体多肽化合物,可能是这5个转录活跃的基因并未行使功能或者合成的化合物未能解离释放。次级代谢产物合成除了核心的PKS或NRPS之外通常都是需要其他辅助酶进行修饰或者将产物从酶上释放下来,在某些修饰酶缺失的情况下也会无法获得最终产物,也可能是因产物含量较少而未被分离[21, 26],接下来可以通过在体内敲除这些基因来进一步在含量较少的副产物中来寻找其产物。
3 讨论 土曲霉NIH2624是基因组测序菌株,生物信息学分析显示,土曲霉NIH2624基因组中有30个PKS、22个NRPS、15个类NRPS以及1个PKS-NRPS杂合酶[8, 20],初步进行产物鉴定的只有14个,其中开展了基因簇功能鉴定的只有6个。土曲霉HZ01的洛伐他汀合成途径非常活跃,除此之外只有少数几个活跃基因,土曲霉HZ01经过驯化后与洛伐他汀合成有竞争关系的次级代谢产物合成途径都被阻断或弱化了。在活跃的PKS中,ATEG_00145和ATEG_08451的产物也是主要副产物,这说明这两条合成途径确实是活跃的,尤其是ATEG_00145的合成产物化合物6和7的含量较高(图 1),可能会与洛伐他汀合成途径竞争聚酮合成所需的底物,因此敲除ATEG_00145这一竞争途径有望进一步强化洛伐他汀的合成。
通过反向遗传学方法进行基因功能鉴定是常用的策略之一,对合成途径中未知功能基因进行功能鉴定。转录组信息显示PKS ATEG_04718和其他5个NRPS基因都处于活跃状态,而它们的功能都尚不清楚,因此,接下来可以通过体内敲除的方法来寻找其产物。PKS ATEG_08451的功能已经被鉴定,但是其所参与的生物合成途径非常复杂而且很多关键酶都尚不清楚。因此,接下来可以用土曲霉HZ01作为出发菌株,对其生物合成途径进行系统的分析鉴定。
大部分微生物的次级代谢产物合成基因簇都是沉默的,在异源宿主中重构合成途径是鉴定沉默基因簇的一种重要策略[27]。土曲霉HZ01中洛伐他汀之外的其他次级代谢产物合成途径并不活跃,因此内源修饰酶对异源合成途径的干扰小,对于解析沉默的异源次级代谢产物合成基因簇非常重要[28]。因此,敲除了洛伐他汀合成途径的土曲霉HZ01工程菌株将是一个非常好的底盘细胞,通过代谢途径异源重构的方式对沉默型次级代谢产物合成基因簇进行功能鉴定,从而挖掘更多新化合物以及催化特殊反应的酶。而且,土曲霉作为真菌,可以更有效地表达真核来源的基因,相对于大肠杆菌和链霉菌等底盘细胞,对于挖掘真核生物的次级代谢产物更具适用性[27]。除此之外,该底盘细胞在工业应用方面也具有潜在价值。很多具有应用价值的次级代谢产物由于天然宿主调控机制复杂、培养难度大或者周期较长等因素,生产效率非常低,严重阻碍了其经济开发前景,例如植物和一些极端微生物。随着合成生物学近年来的快速发展,构建异源高效微生物细胞工厂成为研究热点[27]。将完整的合成途径在底盘细胞进行异源重构,以避免天然宿主的特异性调控,从而实现高产,而在此过程中底盘细胞的选择非常重要[29]。土曲霉HZ01具有卓越的洛伐他汀生产能力,这说明其聚酮类合成的上游途径非常发达,作为底盘细胞用于生产其他异源次级代谢产物,尤其是聚酮类化合物时可以保证充足的底物供应,是目标化合物高产的重要保障。而且,土曲霉HZ01作为工业生产菌株,具有优良的工业生产性能和成熟的发酵工艺,相较于普通的底盘细胞在发酵规模放大方面难度相对较小,更具竞争力。
本研究对洛伐他汀工业生产菌株土曲霉HZ01在洛伐他汀发酵条件下的转录组和主要副产物进行了分析,发现该菌株中洛伐他汀合成途径之外的大部分次级代谢合成途径都处于沉默状态,合成的副产物的种类和含量都非常少,最主要的副产物是由PKS ATEG_00145合成的,因此敲除该基因有望进一步提高洛伐他汀生产能力。此外,研究结果也显示,阻断洛伐他汀合成途径之后,该菌株可以作为一个优秀的底盘细胞,用于解析沉默的次级代谢产物合成基因簇以及构建高效细胞工厂。
References
| [1] | Wang HM, Liao BS, Lei Y, Huang JQ, Yan LY. Progresses on research of secondary metabolite and regulation of primary mycotoxins in Aspergillus flavus. Microbiology China, 2014, 41(7): 1425-1438. (in Chinese) 王后苗, 廖伯寿, 雷永, 黄家权, 晏立英. 黄曲霉菌主要真菌毒素次级代谢与调控的研究进展. 微生物学通报, 2014, 41(7): 1425-1438. |
| [2] | Misiek M, Hoffmeister D. Fungal genetics, genomics, and secondary metabolites in pharmaceutical sciences. Planta Medica, 2007, 73(2): 103-115. DOI:10.1055/s-2007-967104 |
| [3] | Feng L, Jiang Q, Sun W, Li YX, Zhang FL, Li ZY. Diversity and antimicrobial activity of fungi isolated from deep-sea sediments in South China Sea. Acta Microbiologica Sinica, 2017, 57(9): 1332-1341. (in Chinese) 冯丽, 蒋群, 孙伟, 李英新, 张风丽, 李志勇. 中国南海部分深海沉积物真菌多样性及其抗菌活性. 微生物学报, 2017, 57(9): 1332-1341. |
| [4] | Dong JJ, Zhang XY, Bao J, Xu XY, Nong XH, Qi SH. Secondary metabolites of the co-culture of Aspergillus sp. MNMCCE 001. Acta Microbiologica Sinica, 2014, 54(11): 1289-1295. (in Chinese) 董杰杰, 张晓勇, 鲍洁, 徐新亚, 农旭华, 漆淑华. 海洋真菌Aspergillus sp. SCSGAF 0076与细菌Bacillus sp. MNMCCE001共培养次生代谢产物. 微生物学报, 2014, 54(11): 1289-1295. |
| [5] | Walton JD. Horizontal gene transfer and the evolution of secondary metabolite gene clusters in fungi: an hypothesis. Fungal Genetics and Biology, 2000, 30(3): 167-171. DOI:10.1006/fgbi.2000.1224 |
| [6] | Li W, Wu GW, Yang YP, Yin WB. Discovery of fungal natural product in the post-genomicera. Mycosystema, 2015, 34(5): 914-926. (in Chinese) 李伟, 吴广畏, 杨玉萍, 尹文兵. 后基因组时代的真菌天然产物发现. 菌物学报, 2015, 34(5): 914-926. |
| [7] | Werpy T, Petersen G. Top value added chemicals from biomass Volume I-Results of screening for potential candidates from sugars and synthesis gas. Oak Ridge, TN: U.S. Department of Energy (DOE), 2004. |
| [8] | Guo CJ, Wang CC. Recent advances in genome mining of secondary metabolites in Aspergillus terreus. Frontiers in Microbiology, 2014, 5: 717. |
| [9] | Pickens LB, Tang Y, Chooi YH. Metabolic engineering for the production of natural products. Annual Review of Chemical and Biomolecular Engineering, 2011, 2: 211-236. DOI:10.1146/annurev-chembioeng-061010-114209 |
| [10] | Jaivel N, Marimuthu P. Strain improvement of Aspergillus terreus for increased lovastatin production. International Journal of Engineering Science and Technology, 2010, 2(7): 2612-2615. |
| [11] | Wang Y, Zheng JK, Liu PP, Wang W, Zhu WM. Three new compounds from Aspergillus terreus PT06-2 grown in a high salt medium. Marine Drugs, 2011, 9(8): 1368-1378. DOI:10.3390/md9081368 |
| [12] | Niu XM, Dahse HM, Menzel KD, Lozach O, Walther G, Meijer L, Grabley S, Sattler I. Butyrolactone I derivatives from Aspergillus terreus carrying an unusual sulfate moiety. Journal of Natural Products, 2008, 71(4): 689-692. DOI:10.1021/np070341r |
| [13] | Parvatkar RR, D'Souza C, Tripathi A, Naik CG. Aspernolides A and B, butenolides from a marine-derived fungus Aspergillus terreus. Phytochemistry, 2009, 70(1): 128-132. DOI:10.1016/j.phytochem.2008.10.017 |
| [14] | Nelson PH, Nelson JT. Synthesis of tetra-and pentasubstituted benzenes from dimedone and derivatives. Synthesis, 1992, 1992(12): 1287-1291. DOI:10.1055/s-1992-26360 |
| [15] | Lopes TIB, Coelho RG, Yoshida NC, Honda NK. Radical-scavenging activity of orsellinates. Chemical & Pharmaceutical Bulletin, 2008, 56(11): 1551-1554. |
| [16] | Schlingmann G, Milne L, Carter GT. Isolation and identification of antifungal polyesters from the marine fungus Hypoxylon oceanicum LL-15G256. Tetrahedron, 2002, 58(34): 6825-6835. DOI:10.1016/S0040-4020(02)00746-9 |
| [17] | Al Trabolsy ZBK, Anouar EH, Zakaria NSS, Zulkeflee M, Hasan MH, Zin MM, Ahmad R, Sultan S, Weber JFF. Antioxidant activity, NMR, X-ray, ECD and UV/vis spectra of (+)-terrein: experimental and theoretical approaches. Journal of Molecular Structure, 2014, 1060: 102-110. DOI:10.1016/j.molstruc.2013.12.034 |
| [18] | Liu DS, Yan L, Ma LY, Huang YL, Pan XH, Liu WZ, Lv ZH. Diphenyl derivatives from coastal saline soil fungus Aspergillus iizukae. Archives of Pharmacal Research, 2015, 38(6): 1038-1043. DOI:10.1007/s12272-014-0371-z |
| [19] | Jongrungruangchok S, Aree T, Sureram S, Kittakoop P. Crystal structure of 2-(2-carboxy-4-hydroxy-6-methoxyphenoxy)-3, 5-dichloro-6-hydroxy-4-methylbenzoic acid 1-methyl ester. Chinese Journal of Structural Chemistry, 2013, 32(11): 1742-1748. |
| [20] | Sanchez JF, Somoza AD, Keller NP, Wang CCC. Advances in Aspergillus secondary metabolite research in the post-genomic era. Natural Product Reports, 2012, 29(3): 351-371. DOI:10.1039/c2np00084a |
| [21] | Awakawa T, Yokota K, Funa N, Doi F, Mori N, Watanabe H, Horinouchi S. Physically discrete β-lactamase-type thioesterase catalyzes product release in atrochrysone synthesis by iterative type I polyketide synthase. Chemistry and Biology, 2009, 16(6): 613-623. DOI:10.1016/j.chembiol.2009.04.004 |
| [22] | Couch RD, Gaucher GM. Rational elimination of Aspergillus terreus sulochrin production. Journal of Biotechnology, 2004, 108(2): 171-177. DOI:10.1016/j.jbiotec.2003.10.021 |
| [23] | Nielsen MT, Nielsen JB, Anyaogu DC, Holm DK, Nielsen KF, Larsen TO, Mortensen UH. Heterologous reconstitution of the intact geodin gene cluster in Aspergillus nidulans through a simple and versatile PCR based approach. PLoS One, 2013, 8(8): e72871. DOI:10.1371/journal.pone.0072871 |
| [24] | Zaehle C, Gressler M, Shelest E, Geib E, Hertweck C, Brock M. Terrein biosynthesis in Aspergillus terreus and its impact on phytotoxicity. Chemistry and Biology, 2014, 21(6): 719-731. DOI:10.1016/j.chembiol.2014.03.010 |
| [25] | Guo CJ, Knox BP, Sanchez JF, Chiang YM, Bruno KS, Wang CCC. Application of an efficient gene targeting system linking secondary metabolites to their biosynthetic genes in Aspergillus terreus. Organic Letters, 2013, 15(14): 3562-3565. DOI:10.1021/ol401384v |
| [26] | Horsman ME, Hari TPA, Boddy CN. Polyketide synthase and non-ribosomal peptide synthetase thioesterase selectivity: logic gate or a victim of fate?. Natural Product Reports, 20169, 33(2): 183-202. |
| [27] | Ma ZH, Li W, Yin WB. Progress in heterologous expression of fungal natural products-a review. Acta Microbiologica Sinica, 2016, 56(3): 429-440. (in Chinese) 马紫卉, 李伟, 尹文兵. 真菌天然产物异源生产研究进展. 微生物学报, 2016, 56(3): 429-440. |
| [28] | Chiang YM, Oakley CE, Ahuja M, Entwistle R, Schultz A, Chang SL, Sung CT, Wang CCC, Oakely BR. An efficient system for heterologous expression of secondary metabolite genes in Aspergillus nidulans. Journal of the American Chemical Society, 2013, 135(20): 7720-7731. DOI:10.1021/ja401945a |
| [29] | McLean KJ, Hans M, Meijrink B, van Scheppingen WB, Vollebregt A, Tee KL, van der Laan JM, Leys D, Munro AW, van den Berg MA. Single-step fermentative production of the cholesterol-lowering drug pravastatin via reprogramming of Penicillium chrysogenum. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(9): 2847-2852. DOI:10.1073/pnas.1419028112 |
