李晴1, 张红娜1, 刘玉庆2, 翟静3

 , 常维山1
, 常维山1

1.山东农业大学动物科技学院, 山东 泰安 271000;
2.山东省农业科学院, 山东 济南 250000;
3.泰山医学院基础医学部 山东 泰安 271000
收稿日期:2016-08-31;修回日期:2016-12-01;网络出版日期:2017-12-21
基金项目:山东省农业产业技术创新体系家禽创新团队(SDA/T-11-09)
*通信作者:翟静.Fax:+86-538-6222053, E-mail:jzhai@tsmc.edu.cn
常维山.Fax:+86-538-8248213, E-mail:wschang@sdau.edu.cn
摘要: [目的]研究废水中产超广谱β-内酰胺酶大肠杆菌中可移动质粒在耐药基因水平传播机制中的作用。[方法]对污水厂分离所得的50株产ESBLs大肠杆菌进行接合试验,并对所得的接合子采用纸片扩散法测定其对15种常见药物的耐药表型,针对质粒介导的产ESBLs菌株的耐药基因设计7对特异性引物对接合子进行PCR扩增。[结果]研究结果显示,80份水样分离得50株产ESBLs大肠杆菌,共接合成功35株细菌,接合成功率高达70%。接合子与供体菌相比,均发生耐药谱型的改变,且存在丢失一种或几种药物耐药性且产生另一种或几种药物耐药性的现象。PCR扩增结果显示,接合子与供体菌相比,耐药基因型有所减少或不变,blaTEM、blaCTX-M基因全部接合成功,blaSHV基因仅1株未接合成功,耐氟喹诺酮类基因未发生转移。[结论]本研究表明,不同的耐药基因可能位于不同的可移动质粒上,可移动质粒在大肠杆菌耐药性水平传播的过程中起到了十分重要的作用。
关键词: 超广谱β-内酰胺酶 大肠杆菌 耐药基因 质粒 接合 水平传播
Transfer of antimicrobial resistant genes of ESBL-producing Escherichia coli recovered from a wastewater treatment plant
Qing Li1, Hongna Zhang1, Yuqing Liu2, Jing Zhai3

 , Weishan Chang1
, Weishan Chang1

1.College of Animal Sciences, Shandong Agricultural University, Tai'an 271000, Shandong Province, China;
2.Shandong Academy of Agricultural Sciences, Jinan 250000, Shandong Province, China;
3.School of Basic Medical Sciences, Taishan Medical University, Tai'an 271000, Shandong Province, China
Received 31 August 2016; Revised 01 December 2016; Published online 21 December 2017
*Corresponding author: Zhai Jing.Fax:+86-538-6222053, E-mail:jzhai@tsmc.edu.cn
Chang Weishan.Fax:+86-538-8248213, E-mail:wschang@sdau.edu.cn
Supported by the Shandong Province Agricultural Industry Technology Innovation System of Poultry Innovation Team (SDA/T-11-09)
Abstract: [Objective]We explored the role of mobile plasmids in transferring antimicrobial resistant genes in extended-spectrum beta-lactamases (ESBLs)-producing Escherichia coli from a wastewater treatment plant.[Methods]Based on the conjugation experiments of ESBL-producing E. coli collected from wastewater, the disk diffusion assay and polymerase chain reaction (PCR) were used to determine the transfer of antimicrobial resistance.[Results]A total of 50 ESBL-producing E. coli were collected from 80 water samples (50/80, 62.5%), and successful conjugations were detected among 35 isolates (35/70, 70.0%). The results of PCR further showed that blaCTX-M and blaTEM genes were all capable of conjugation transfer, but the horizontal transfer of blaSHV gene was only detected in one isolate and resistance gene encoding fluoroquinolone was not capable of conjugation transfer in this study.[Conclusions]Plasmids carrying different antimicrobial resistant genes may exhibit different capacity of horizontal transfer. Importantly, the mobile plasmids played a very important role in the horizontal transfer of antimicrobial resistance genes of ESBL-producing E. coli.
Key words: extended-spectrum beta-lactamases Escherichia coli antimicrobial resistance genes plasmid conjugation horizontal transfers
大肠杆菌 (Escherichia coli) 广泛存在于自然界中,一直以来被认为是人类及大多数温血动物肠道内的正常菌群,没有致病性。直到20世纪中叶,人们渐渐发现有些E. coli不仅可以引起正常机体的腹泻,严重还能引起败血症。
β-内酰胺类抗生素在治疗肠杆菌引起的感染时是主要药物,由于使用甚至滥用形成的选择压导致耐药菌的出现。其中最重要的机制之一就是质粒介导的产超广谱β内酰胺酶 (extended-spectrum β-lactamases,ESBLs),能够水解β内酰胺环。超广谱β内酰胺酶是一类能够水解青霉素,第1代、第2代、第3代头孢菌素及氨曲南等抗生素的一种酶,能够被酶抑制剂所抑制,对头霉素和碳青霉烯类抗生素敏感。携带这种酶的细菌可以水解相应的抗生素从而导致治疗失败。在过去的几十年中,产ESBLs大肠杆菌的散播在不同的环境中均被报道过,包括食物、食品性动物、不同的水环境尤其是污水[1-2]。
城市污水处理厂是人和动物微生物的重要储存器,耐药菌可通过污水厂出水口进入到周围环境中,如水和食物,很可能反过来再次感染人和动物。污水中含有大量的细菌及抗生素,有利于细菌之间的接合,促进可移动元件携带的耐药基因的水平转移。而R质粒的发现,证实了在遗传物质含有天然耐药基因的同时,细菌迫于生存压力,也可产生获得性耐药性,这就造成了耐药性不仅可以垂直传播,也存在细菌种内甚至种间的耐药性传递,即水平传播。而耐药性扩散的主要因素被认为是细菌通过可移动元件,如接合质粒和转座子,获得和传播外来基因[3]。
本研究对泰安市某污水处理厂中分离到的产ESBL大肠杆菌进行接合试验,比较大肠杆菌接合前后耐药表型及耐药基因的变化,探讨可移动质粒在耐药性传播过程中所发挥的作用[4]。
1 材料和方法 1.1 样品采集 取样地点为泰安市最大污水处理厂,周边人口密集。于进水口、曝气池、出水口分别采样25、30、25份水样。进水口、出水口因具有流动性,利用连续自动定时采样器采集1个生产周期内的水样;曝气池水样由深层采样器于水下0.5 m采集。每份各20 mL,置于灭菌的20 mL样品管中,密封保存于4 ℃冰箱中,并于24 h内进行后续实验。
1.2 分离鉴定 将采集的水样分别经0.45 μm孔径的膜过滤器过滤,将滤膜置于5 mL MEE肉汤 (MEE broth) 中,进行选择性增菌培养。将增菌培养后的菌液接种于伊红美兰琼脂培养基上,37 ℃培养12 h后,挑取有金属光泽的菌落移至麦康凯琼脂培养基,同样37 ℃培养12 h后,挑取紫红色中间有黑点的菌落置于5 mL LB液体培养基中进行增菌培养8-12 h,将菌液与甘油7:3保存于-20 ℃冰箱中,用于进行后续试验。将所分离细菌用16S rRNA PCR进行菌种鉴定。所用培养基均购自青岛高科园海博生物技术有限公司。
1.3 ESBLs确证实验 使用双纸片协同测试法[5]:将受试菌均匀涂布于MH琼脂平板,贴头孢他啶 (CTX)、头孢他啶/棒酸 (CTX/Clav) 和头孢噻肟 (CAZ)、头孢噻肟/棒酸 (CAZ/Clav) 2组纸片,37 ℃培养6 h,如2组中任一组加克拉维酸比不加克拉维酸抑菌圈直径≥5 mm,可确认为产ESBLs菌株。
1.4 接合试验 供体菌为污水厂分离50株产ESBLs大肠杆菌,耐头孢噻肟,对叠氮钠敏感;受体菌大肠杆菌J53由浙江大学医学院俞云松教授惠赠,耐叠氮钠,对大多数药物敏感。参考膜过滤接合法 (filter mating method) 进行接合试验[6],分别将5 μL供体菌和受体菌加入到5 mL分别含有头孢噻肟 (64 μg/mL,前期证明J53对其敏感) 和叠氮钠 (100 μg/mL,前期证明全部受体菌对其敏感) 的LB液体培养基中,37 ℃摇床培养4-5 h,当其OD600达到0.6时,分别取0.5 mL供体菌和受体菌菌液置于4 mL LB液体培养基中,再将两者的混合物用Ф0.45 μm的无菌滤膜过滤,将带菌滤膜置于LB平板表面,37 ℃培养4-5 h后,用1 mL LB液体培养基重悬菌体。将重悬菌液适当稀释后,取50 μl稀释液涂布于同时含有头孢噻肟 (64 μg/mL) 和叠氮钠 (100 μg/mL) 的LB培养板上,同时分别取等量的供体菌和受体菌同法处理,作为对照,37 ℃培养12-16 h。挑取培养板上的单菌落以划线方式转移至药物选择性培养基上,连续传代3次后用甘油保存并用于后续试验[7]。接合子筛选试验标准判定[8]如表 1。
表 1. 接合子筛选判定标准 Table 1. the screening criteria of transconjugants
| Strains | Sodium azide | Cefotaxime | Sodium azide and cefotaxime |
| Donor strain | S | R | - |
| Recipient strain | R | S | - |
| Transconjugant | - | - | + |
| R: resistant; S: susceptible; -: no bacteria growing; +: colony growth. | |||
表选项
1.5 疑似接合子的鉴定试验 将保存的疑似接合子的菌液接种于含有头孢噻肟 (64 μg/mL) 和叠氮钠 (100 μg/mL) 的LB液体培养基中培养,进行ERIC-PCR鉴定,ERIC-PCR引物设计参考文献[9],ERIC-F:5'-ATGTAAGCTCCT GGGGATTCAC-3';ERIC-R:5'-AAGTAAGTGAC TGGGGTGAGCG-3',经ERIC-PCR扩增后,比较扩增条带与J53是否一致,若疑似接合子可在药物选择型平板和LB肉汤中生长,且ERIC-PCR扩增条带与J53相同,则可确定为接合子。
1.6 接合子耐药表型和耐药基因型的检测 耐药表型检测采用美国临床实验室标准化委员会 (CLSI) 所推荐的纸片扩散法,操作规范参照CLSI (M100-S22,2012) 标准。按照世界卫生组织 (WHO) 推荐的Kirby-Bauer法测定氟苯尼考 (FFC)、复方新诺明 (SXT)、氨苄西林 (AMP)、氨曲南 (AZT)、卡那霉素 (KAN)、头孢噻吩 (KF)、头孢吡肟 (FEP)、诺氟沙星 (NOR)、链霉素 (STR)、环丙沙星 (CIP)、亚胺培南 (IPM)、氯霉素 (C)、红霉素 (E)、庆大霉 (CN) 和四环素 (TE) 15种抗菌药物的敏感性 (所用药敏纸片均购自杭州天和微生物试剂有限公司),每次试验前用标准株进行质控,大肠杆菌质控株为实验室保存大肠杆菌ATCC 25922,每次实验做平行对照。药敏试验结果参照CL-SI2012判定标准对抑菌环直径作出解释,并与供体菌和受体菌进行比较。根据GenBank已知序列和参考文献[10-12]设计7对特异性引物,由生工生物工程 (上海) 有限公司合成,PCR所用引物及各扩增长度见表 2。取已经确证的接合子DNA进行PCR扩增,选取部分阳性扩增产物送生工生物工程 (上海) 有限公司进行测序,利用NCBI blast,测序结果在GenBank中进行同源检索分析,确定是否发生了耐药基因的水平转移。
表 2. PCR引物序列 Table 2. Squences of primers used for PCR
| Genes | Primer sequences (5'→3') | Product length/bp |
| blaSHV | F:GGGTTATTCTTATTTGTCGCT R:GGGTTAGCGTTGCCAGTG | 913 |
| blaTEM | F:GAGACAATAACCCTGGTAAATG R:AATGATTAATCAGTGAGGC | 886 |
| blaCTX-M | F:AAGAAAAGTGAAAGCGAA R:GTGAAGTAAGTGACCAGAATC | 548 |
| qnrA | F:TCAGCAAGAGGATTTCTCA R:GGCAGCACTATTACTCCCA | 627 |
| qnrB | F:ATGACGCCATTACTGTATAA R:GATCGCAATGTGTGAAGTTT | 562 |
| qnrS | F:ACCTTCACCGCTTGCACATT R:CCAGTGCTTCGAGAATCAGT | 576 |
| OXA | F:CTGTTGTTTGGGTTTCGCAAG R:CTTGGCTTTTATGCTTGATC | 591 |
表选项
2 结果和分析 2.1 分离鉴定 通过膜过滤器过滤以及选择性培养基分离,并经16S rRNA PCR检测、测序、Blast对比,大肠杆菌分离结果如表 3。
表 3. 大肠杆菌分离率 Table 3. Isolation rate of Escherichia coli
| Sampling position | Samples | Isolate strain | Separation rate/% |
| Water inlet | 25 | 25 | 100 |
| Aeration tank | 30 | 30 | 100 |
| Outlet | 25 | 15 | 60 |
表选项
2.2 产ESBLs大肠杆菌的确证 根据CLSI2009标准,对产ESBLs菌株表型确证判定,80份水样共获得50株产ESBLs大肠杆菌,分离率高达62.5%。进水口,曝气池,出水口分离率如表 4。
表 4. 产ESBLs大肠杆菌分离率 Table 4. Isolation rate of ESBLs producing Escherichia coli
| Sampling position | Samples | ESBLs producing strains | Separation rate/% |
| Water inlet | 25 | 22 | 88.0 |
| Aeration tank | 30 | 20 | 66.7 |
| Outlet | 25 | 8 | 32.0 |
表选项
2.3 接合试验 经ERIC-PCR及药物选择性平板验证,50株产ESBLs且耐头孢噻肟的供体菌共接合成功35株接合子,接合成功率高达70%,ERIC-PCR电泳结果如图 1。
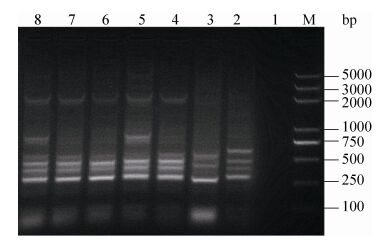 |
| 图 1. ERIC-PCR电泳结果 Figure 1. The results of ERIC-PCR. M: DL2000 plus DNA marker; lane 1: negative control; lane 2: J53; lane 3-8: product of gene fragment. |
| 图选项 |
2.4 耐药表型检测 对35株接合成功的大肠杆菌进行15种抗菌药物的耐药表型检测,结果如表 5和图 2,通过对药敏试验结果分析可以看出接合子与供体菌相比,对复方新诺明、氯霉素、氨苄西林、卡那霉素、头孢噻吩、链霉素、环丙沙星、红霉素、头孢吡肟、四环素和氨曲南的耐药性均发生了转移。其中,5.7%的接合子耐药谱变宽,94.3%的接合子耐药谱变窄,48.6%的接合子发生了丢失1种或几种药物耐药性并获得1种或几种药物耐药性的现象,表现出供体菌没有的耐药性,接合子有明显增加对链霉素耐药的趋势。与受体菌J53相比,(J53对上述15种药物均敏感) 接合子均表现出一定的耐药表型。
表 5. 35株供体菌与其接合子耐药表型 Table 5. Drug resistance phenotypes of donor strains and transconjugants
| No. | Transconjugant | Donor strain |
| A1 | AMP-KF-STR | AMP-KF-STR-C-FFC-CN-TE-KAN |
| A2 | AMP-AZT-KF-FEP-STR-E-TE | SXT-AMP-AZT-KF-FEP-STR-C-AZT-CIP-CN-TE-NOR |
| A4 | SXT-AMP-KF-FEP-STR-C-TE | AMP-KF-STR-C-CN-TE-KAN-FFC-IPM |
| A8 | SXT-AMP-AZT-KF-STR | AMP-AZT-KF-NOR-FEP-E-CIP-IPM |
| A10 | SXT-AMP-AZT-KAN-KF-STR-CIP-C | SXT-AMP-AZT-KAN-KF-CN-TE-FEP-E-IPM |
| A11 | SXT-AMP-AZT-KAN-KF-STR-E | SXT-AMP-AZT-KF-E-TE |
| A12 | SXT-AMP-AZT-KF-STR-C-TE | AMP-AZT-KF-TE-CN-NOR |
| A13 | SXT-AMP-AZT-KF-STR | SXT-AMP-AZT-KF-CN-TE-NOR-KAN-C-FFC |
| A14 | SXT-AMP-AZT-KF-STR | SXT-AMP-AZT-KF-STR-CN-TE-KAN-C-E-CIP-FFC |
| A15 | AMP-AZT-KF-STR | SXT-AMP-AZT-KAN-KF-STR-CN-TE-NOR-C-E-CIP-FFC |
| A17 | SXT-AMP-AZT-KF-STR | SXT-AMP-AZT-KF-CN-TE-FEP-C-AZT-E-IPM |
| A20 | SXT-AMP-AZT-KAN-KF-STR | SXT-AMP-AZT-KF-STR-TE-FEP |
| A21 | AMP-AZT-KF-STR-E | SXT-AMP-AZT-KF-STR-E-TE |
| B1 | SXT-AMP-AZT-KF-STR | SXT-AMP-AZT-KF-CN-TE-IPM |
| B3 | AMP-AZT-KAN-KF-STR | SXT-AMP-AZT-KAN-KF-STR-CN-TE |
| B4 | AMP-AZT-KF-FEP-STR | AMP-AZT-KF-STR-NOR-IPM-KAN |
| B5 | AMP-AZT-KF-STR | SXT-AMP-AZT-KF-STR-CN-NOR-CIP-IPM |
| B6 | SXT-AMP-AZT-KF-STR | SXT-AMP-AZT-KF-STR-CN-FEP |
| B7 | AMP-AZT--KF-STR | SXT-AMP-AZT-KF-STR-TE |
| B8 | AMP-AZT-KF-STR | SXT-AMP-AZT-KF-STR-CN-TE-NOR-C-CIP-FFC |
| B9 | AMP-KF-FEP--STR | SXT-AMP-AZT-KF-FEP-TE |
| B10 | AMP-AZT-KF-STR | SXT-AMP-AZT-KF-CN-TE |
| B11 | AMP-AZT-KF-FEP--STR | SXT-AMP-AZT-KF-FEP-STR-TE-E |
| B12 | AMP-AZT--KF-FEP-STR | SXT-AMP-AZT-KF-FEP-STR-IPM-TE |
| B14 | AMP-KF-FEP-STR | AMP-KF-STR-AZT-IPM |
| B15 | AMP-AZT-KF-STR | SXT-AMP-AZT-KF-FEP-E-IPM |
| B17 | AMP-AZT-KF-STR | SXT-AMP-AZT-KF-STR-TE-E-IPM |
| B18 | AMP-AZT-KF-FEP-STR | SXT-AMP-AZT-KF-FEP-STR-CN-TE-E-IPM |
| C1 | AMP--KF-STR | SXT-AMP-KF-AZT-STR-CN-TE-NOR-KAN-C-AZT-CIP-FFC-IPM |
| C3 | SXT-AMP-AZT-KF-FEP-STR | SXT-AMP-AZT-KF-STR-TE-IPM |
| C4 | SXT-AMP-AZT-KF-FEP | SXT-AMP-AZT-KF-FEP-IPM-TE |
| C5 | AMP-AZT-KF | SXT-AMP-AZT-KF-CIP-IPM-TE |
| C6 | AMP-AZT-KF | SXT-AMP-AZT-KF-E-IPM-TE-STR |
| C7 | AMP-AZT-KF | SXT-AMP-AZT-KF-FEP-TE-IPM |
| C8 | AMP-AZT-KF | SXT-AMP-AZT-KF-TE-STR-IPM |
表选项
 |
| 图 2. 35株供体菌与其接合子对15种抗菌药物多重耐药情况 Figure 2. Multiple drug resistance of 35 strains of donors and transconjugants to 15 kinds of antimicrobial agents. |
| 图选项 |
2.5 接合子耐药基因检测结果 通过对接合子携带的耐药基因进行PCR检测,得出各耐药基因的携带情况及耐药基因亚型见表 6和表 7,从中可以看出blaTEM和blaCTX-M基因全部接合成功,blaSHV仅有1株未接合成功,供体菌与其接合子均不携带OXA和qnrA基因,23株携带qnrS基因和2株携带qnrB基因的供体菌未发生耐药基因的转移。经测序和Blast对比,得出所携带主要耐药基因亚型为blaTEM-1、blaSHV-11和blaCTX-M-15。
表 6. 35株供体菌与其接合子耐药基因型 Table 6. The resistant genotype of 35 strains of donors and transconjugants
| number | Transconjugant | Donor strain |
| A1 | blaTEM-135--blaSHV-11--blaCTX-M-15 | blaTEM-135--blaSHV-11--blaCTX-M-15--qnrS |
| A2 | blaTEM-1--blaCTX-M-15 | blaTEM-1--blaSHV-11--blaCTX-M-15--qnrS |
| A4 | blaTEM-135--blaSHV-11--blaCTX-M-15 | blaTEM-135--blaSHV-11--blaCTX-M-15--qnrS |
| A8 | blaTEM-116--blaSHV-11--blaCTX-M-15 | blaTEM-116--blaSHV-11--blaCTX-M-15 |
| A10 | blaTEM-1--blaSHV-11--blaCTX-M-15 | blaTEM-1--blaSHV-11--blaCTX-M-15 |
| A11 | blaTEM-1--blaSHV-11--blaCTX-M-15 | blaTEM-1--blaSHV-11--blaCTX-M-15--qnrS |
| A12 | blaTEM-1--blaSHV-11--blaCTX-M-15 | blaTEM-1--blaSHV-11--blaCTX-M-15--qnrS |
| A13 | blaTEM-1--blaSHV-11--blaCTX-M-15 | blaTEM-1--blaSHV-11--blaCTX-M-15--qnrS |
| A14 | blaTEM-1--blaSHV-40--blaCTX-M-15 | blaTEM-1--blaSHV-40--blaCTX-M-15--qnrS |
| A15 | blaTEM-181--blaSHV-11--blaCTX-M-15 | blaTEM-181--blaSHV-11--blaCTX-M-15 |
| A17 | blaTEM-181--blaSHV-11--blaCTX-M-55 | blaTEM-181--blaSHV-11--blaCTX-M-55 |
| A20 | blaTEM-1--blaSHV-11--blaCTX-M-15 | blaTEM-1--blaSHV-11--blaCTX-M-15--qnrS |
| A21 | blaTEM-1--blaSHV-11--blaCTX-M-15 | blaTEM-1--blaSHV-11--blaCTX-M-15--qnrS |
| B1 | blaTEM-1--blaSHV-11--blaCTX-M-15 | blaTEM-1--blaSHV-11--blaCTX-M-15--qnrS |
| B3 | blaTEM-1--blaSHV-56--blaCTX-M-15 | blaTEM-1--blaSHV-6--blaCTX-M-15--qnrS |
| B4 | blaTEM-1--blaSHV-11--blaCTX-M-15 | blaTEM-1--blaSHV-11--blaCTX-M-15--qnrB |
| B5 | blaTEM-1--blaSHV-11--blaCTX-M-15 | blaTEM-1--blaSHV-11--blaCTX-M-15 |
| B6 | blaTEM-181--blaSHV-40--blaCTX-M-55 | blaTEM-181--blaSHV-40--blaCTX-M-55--qnrS |
| B7 | blaTEM-1--blaSHV-11--blaCTX-M-15 | blaTEM-1--blaSHV-11--blaCTX-M-15--qnrS |
| B8 | blaTEM-1--blaSHV-11--blaCTX-M-15 | blaTEM-1--blaSHV-11--blaCTX-M-15--qnrS |
| B9 | blaTEM-1--blaSHV-11--blaCTX-M-15 | blaTEM-1--blaSHV-11--blaCTX-M-15--qnrS |
| B10 | blaTEM-1--blaSHV-11--blaCTX-M-15 | blaTEM-1--blaSHV-11--blaCTX-M-15--qnrS |
| B11 | blaTEM-1--blaSHV-56--blaCTX-M-15 | blaTEM-1--blaSHV-56--blaCTX-M-15--qnrS |
| B12 | blaTEM-1--blaSHV-11--blaCTX-M-15 | blaTEM-1--blaSHV-11--blaCTX-M-15--qnrS |
| B14 | blaTEM-1--blaSHV-11--blaCTX-M-15 | blaTEM-1--blaSHV-11--blaCTX-M-15 |
| B15 | blaTEM-1--blaSHV-11--blaCTX-M-55 | blaTEM-1--blaSHV-11--blaCTX-M-55 |
| B17 | blaTEM-1--blaSHV-11--blaCTX-M-15 | blaTEM-1--blaSHV-11--blaCTX-M-15--qnrS |
| B18 | blaTEM-1--blaSHV-11--blaCTX-M-15 | blaTEM-1--blaSHV-11--blaCTX-M-15--qnrS |
| C1 | blaTEM-1--blaSHV-11--blaCTX-M-55 | blaTEM-1--blaSHV-11--blaCTX-M-55 |
| C3 | blaTEM-116--blaSHV-11--blaCTX-M-15 | blaTEM-116--blaSHV-11--blaCTX-M-15--qnrS |
| C4 | blaTEM-1--blaSHV-79--blaCTX-M-15 | blaTEM-1--blaSHV-79--blaCTX-M-15--qnrS |
| C5 | blaTEM-1--blaSHV-11--blaCTX-M-55 | blaTEM-1--blaSHV-11--blaCTX-M-55--qnrB |
| C6 | blaTEM-1--blaSHV-11--blaCTX-M-15 | blaTEM-1--blaSHV-11--blaCTX-M-15 |
| C7 | blaTEM-1--blaSHV-11--blaCTX-M-15 | blaTEM-1--blaSHV-11--blaCTX-M-15--qnrS |
| C8 | blaTEM-1--blaSHV-11--blaCTX-M-15 | blaTEM-1--blaSHV-11--blaCTX-M-15 |
表选项
表 7. 35株供体菌与其接合子各耐药基因检出率 Table 7. The detection rate of resistance genes of 35 strains of donors and transconjugants
| Gene type | Donor strain | Transconjugant |
| blaTEM | 35 | 35 |
| blaSHV | 35 | 34 |
| blaCTX-M | 35 | 35 |
| OXA | 0 | 0 |
| qnrA | 0 | 0 |
| qnrB | 2 | 0 |
| qnrS | 23 | 0 |
表选项
3 讨论 肠杆菌科细菌,特别是大肠杆菌,是重要的条件致病菌,可引起动物及人类的尿路感染、败血症等疾病[13]。最近的几十年来,世界各地多重耐药的肠杆菌科细菌患病率一直在增加。β-内酰胺类和氟喹诺酮类药物作为重要的治疗药物一直在被选择使用,这些药物的滥用产生的选择性压力导致了多重耐药菌的产生。多重耐药菌产生的机制之一就是质粒介导的能水解β-内酰胺环的ESBLs的产生[14]。ESBLs能水解β-内酰胺环,并通过质粒介导的形式在细菌间传播,这是目前革兰氏阴性杆菌耐药的主要原因之一。编码ESBLs的基因位于质粒上,其基因型有多种,目前发现的有blaCTX-M、blaSHV、blaTEM和OXA等类型。由于细菌编码ESBLs的基因常与其他耐药基因位于同一质粒上,导致细菌的多重耐药性,给临床感染性疾病治疗带来了很大的困难[15]。动物源产ESBLs大肠杆菌已有报道[16],但对水源产ESBLs大肠杆菌的报道较少。本文通过从污水厂分离产ESBLs大肠杆菌,并进行质粒接合试验,接合药敏试验及耐药基因检测实验,检测可移动元件质粒在细菌耐药性传播中的作用。本实验中,80份污水样品共分离出50株产ESBLs大肠杆菌,分离率非常高,由此可见,产ESBLs大肠杆菌在环境中已普遍存在。其中,出水口产ESBLs大肠杆菌分离率为32%,进水口分离率为88%,虽然,废水经污水处理厂处理后可显著减少水内微生物含量,但并不能完全消除耐药菌,相反在这些选择性压力下还会使某些细菌耐药性增加。出水口水中的产ESBLs大肠杆菌不能完全消除,则会进入到当地环境,造成耐药菌的传播;另一方面,暴雨期间未经处理的污水溢入地表可能是地表水产ESBLs大肠杆菌的来源之一[17]。
细菌产生耐药性的机制较为复杂,到目前为止人们已经在分子水平的研究上取得了很大的进展,尤其是R质粒的发现,则证实了在遗传物质含有天然耐药基因的同时,细菌迫于选择性压力,也可产生获得性耐药性,接合是基因水平传递最常见的方式,在耐药基因的传播中起到非常重要的作用。本实验中肠杆菌J53具有叠氮钠抗性并且对大多数抗菌药物敏感,J53作为受体菌与50株确证为产ESBLs的大肠杆菌菌株共培养,通过ERIC-PCR以及药物选择性培养板共同验证筛选,最终得到了35株接合子,接合成功率高达70%,即有35株大肠杆菌的接合性质粒成功转移到受体菌上。结果说明,在一定的选择性压力下,质粒非常容易在不同大肠杆菌之间转移,使耐药性更加便捷地传播,为临床上的治疗用药带来了极其严重的危害[18]。
由药敏实验结果可知,全部的接合子与供体菌相比发生了耐药谱型的变化,其中,94.3%的接合子耐药谱变窄,解释了耐药基因可能位于可移动元件质粒以外的遗传片段上,或者不同菌株携带的质粒不同,而有些质粒是不兼容的[19]。5.7%的接合子耐药谱变宽,48.6%的接合子发生了丢失1种或几种药物耐药性并获得1种或几种药物耐药性的现象,表现出供体菌没有的耐药性,例如,接合性流行病中,要谨慎应用抗生素,避免造成耐药性的增强。同时有明显增加对链霉素耐药的趋势,可能是位于接合性质粒上aadA1、aadA2基因盒在接合菌中表达活性增强引起的,表现出供体菌所没有的对氨基糖苷类抗生素的耐药性[20]。因此在病原菌引起的爆发时,药敏试验的耐药谱分析可以看出,产ESBLs大肠杆菌通过接合试验对氨苄西林,头孢噻吩药物的传递达100%,再次证明了可移动质粒在介导大肠杆菌耐药性传播中的作用。
编码ESBLs的基因位于质粒上,其基因型有多种,目前发现的有blaCTX-M、blaSHV、blaTEM、OXA和其他型等5种。由于地域和用药习惯的不同,各个国家地区、不同环境的流行基因型各不相同。本实验共从泰安市某城市污水处理厂分离了50株产ESBLs大肠杆菌,与J53共培养,接合成功35株。对产ESBLs菌耐药基因检测结果显示,共检测出blaCTX-M、blaSHV和blaTEM3种ESBLs基因型,这与之前的研究一致,未检测出OXA基因型。检测出少量氟喹诺酮类耐药基因。接合子耐药基因检测结果显示,blaTEM和blaCTX-M基因全部接合成功,blaSHV仅有1株未接合成功。随着β-内酰胺类抗生素特别是第3代头孢菌素使用量的不断增加,监测blaCTX-M、blaSHV和blaTEM3种类型菌株的产生有重要意义,尤其要进一步监测blaCTX-M、blaSHV和blaTEM基因型的传递,为临床合理使用抗生素提供可靠的依据。
参考文献
| [1] | Diwan V, Chandran SP, Tamhankar AJ, St?lsby Lundborg C, Macaden R. Identification of extended-spectrum β-lactamase and quinolone resistance genes in Escherichia coli isolated from hospital wastewater from central India.Journal of Antimicrobial Chemotherapy, 2012, 67(4): 857–859DOI:10.1093/jac/dkr564. |
| [2] | Jouini A, Vinue L, Slama KB, Sáenz Y, Klibi N, Hammami S, Boudabous A, Torres C. Characterization of CTX-M and SHV extended-spectrum β-lactamases and associated resistance genes in Escherichia coli strains of food samples in Tunisia.Journal of Antimicrobial Chemotherapy, 2007, 60(5): 1137–1141DOI:10.1093/jac/dkm316. |
| [3] | Mokracka J, Koczura R, Kaznowski A. Multiresistant enterobacteriaceae with class 1 and class 2 integrons in a municipal wastewater treatment plant.Water Research, 2012, 46(10): 3353–3363DOI:10.1016/j.watres.2012.03.037. |
| [4] | Wang HD, Xu GF, Jiao WW, Zhang XY. Investigation of antimicrobial agents resistance transferred horizontally in fluoroquinolone resistant Escherichia coli from swine.Acta Veterinaria et Zootechnica Sinica, 2016, 47(4): 805–811(in Chinese). 王宏栋, 徐国锋, 矫薇薇, 张秀英. 猪源氟喹诺酮耐药大肠杆菌通过接合水平传递耐药性的研究.畜牧兽医学报, 2016, 47(4): 805–811. |
| [5] | Chen MJ. Bacterial resistance and detection method of beta-amide.Chinese Journal of Laboratory Medicine, 2001, 24(7): 197–200(in Chinese). 陈民钧. 细菌对β-内酰胺药的耐药性及检测方法.中华检验医学杂志, 2001, 24(7): 197–200. |
| [6] | Clewell DB, An FY, White BA, Gawron-Burke C. Sex pheromones and plasmid transfer in Streptococcus faecalis:a pheromone, cAM373, which is also excreted by Staphylococcus aureus//Helinski D, Cohen SN, Clewell DB, Jackson DA, Hollaender A. Plasmids in Bacteria.New York: Plenum Press, 1985: 489-503. |
| [7] | An W, Zhang XY, Xu GF, Zhang L, Zhang YH, Li CY, Wu JD, Long ZC. Study of antibiotic resistance transferred horizontally in multidrug-resistant Escherichia coli from swine.Chinese Journal of Veterinary Medicine, 2014, 50(5): 76–78(in Chinese). 安微, 张秀英, 徐国锋, 张陆, 张燕华, 李春艳, 吴金迪, 龙忠臣. 猪源多重耐药大肠杆菌通过接合水平传播传递耐药性研究.中国兽医杂志, 2014, 50(5): 76–78. |
| [8] | 张弘. 健康人肠道大肠埃希菌耐药性及其耐药基因播散机制的研究. 四川大学硕士学位论文, 2006. |
| [9] | Zhang H, Yang ZQ, Zhao J, Wei RC, Wang R. Generating of ERIC-PCR molecular typing method and its application in Escherichia coli.Jiangsu Journal of Agricultural Science, 2010, 26(5): 1098–1103(in Chinese). 张辉, 杨振泉, 赵隽, 魏瑞成, 王冉. 大肠杆菌ERIC-PCR分子分型方法的建立及其初步应用.江苏农业学报, 2010, 26(5): 1098–1103. |
| [10] | Song XH, Yin YF, Huang YF, Liu XK. Detection of TEM, SHV and CTX-M genotype of ESBLs-producing gram-negative bacteria.Sichuan Journal of Physiological Sciences, 2011, 33(4): 154–156(in Chinese). 宋晓红, 尹亚非, 黄源芳, 刘小康. 产ESBLs革兰阴性菌的TEM、SHV、CTX-M基因分型研究.四川生理科学杂志, 2011, 33(4): 154–156. |
| [11] | Hu HY, Wang DG, Wei ZY, Zheng YW, Chen LM, Fang XF, Qi YX. Detection of multi-drug resistant Escherichia coli OXA gene and cluster analysis.Journal of Medical Research, 2012, 41(9): 129–133(in Chinese). 胡海莹, 王冬国, 魏志英, 郑雨薇, 陈玲敏, 方小芳, 戚永孝. 多药耐药大肠杆菌OXA基因检测及聚类分析.医学研究杂志, 2012, 41(9): 129–133. |
| [12] | Jiang Y, Zhou ZH, Qian Y, Wei Z, Yu Y, Hu S, Li L. Plasmid-mediated quinolone resistance determinants qnr and aac (6')-Ib-cr in extended-spectrum β-lactamase-producing Escherichia coli and Klebsiella pneumoniae in China.Journal of Antimicrobial Chemotherapy, 2008, 61(5): 1003–1006DOI:10.1093/jac/dkn063. |
| [13] | Lewis Ⅱ JS, Herrera M, Wickes B, Patterson JE, Jorgensen JH. First report of the emergence of CTX-M-type extended-spectrum β-lactamases (ESBLs) as the pre-dominant ESBL isolated in a U.S. health care system.Antimicrobial Agents and Chemotherapy, 2007, 51(11): 4015–4021DOI:10.1128/AAC.00576-07. |
| [14] | Cantón R, Novais A, Valverde A, Machado E, Peixe L, Baquero F, Coque TM. Prevalence and spread of extended-spectrum β-lactamase-producing Enterobacteriaceae in Europe.Clinical Microbiology and Infection, 2008, 14(S1): 144–153. |
| [15] | Koczura R, Mokracka J, Jab?ońska L, Gozdecka E, Kubek M, Kaznowski A. Antimicrobial resistance of integron-harboring Escherichia coli isolates from clinical samples, wastewater treatment plant and river water.Science of the Total Environment, 2012, 414: 680–685DOI:10.1016/j.scitotenv.2011.10.036. |
| [16] | Alexy R, Sommer A, Lange FT, Kümmerer K. Local use of antibiotics and their input and fate in a small sewage treatment plant-significance of balancing and analysis on a local scale vs. nationwide scale.Acta Hydrochimica et Hydrobiologica, 2006, 34(6): 587–592DOI:10.1002/(ISSN)1521-401X. |
| [17] | Diallo AA, Brugère H, Kérourédan M, Dupouy V, Toutain PL, Bousquet-Mélou A, Oswald E, Bibbal D. Persistence and prevalence of pathogenic and extended-spectrum beta-lactamase-producing Escherichia coli in municipal wastewater treatment plant receiving slaughterhouse wastewater.Water Research, 2013, 47(13): 4719–4729DOI:10.1016/j.watres.2013.04.047. |
| [18] | Cavaco LM, Hansen DS, Friis-M?ller A, Aarestrup FM, Hasman H, Frimodt-M?ller N. First detection of plasmid-mediated quinolone resistance (qnrA and qnrS) in Escherichia coli strains isolated from humans in Scandinavia.Journal of Antimicrobial Chemotherapy, 2007, 59(4): 804–805DOI:10.1093/jac/dkl554. |
| [19] | Zhang H, Liu HC, He X, Chen LJ, Zhang TG. Gene location of integrons in Escherichia coli strain isolates from healthy human.Chinese Journal of Health Laboratory Technology, 2008, 18(6): 1004–1006(in Chinese). 张弘, 刘衡川, 贺雄, 陈丽娟, 张铁钢. 健康人大肠埃希菌中Ⅰ类整合酶基因IntI1定位分析.中国卫生检验杂志, 2008, 18(6): 1004–1006. |
| [20] | Zhao HX, Shen JZ, An XP, Fan HL, Cao JS, Li PF. Characterization of integrons in multiple antimicrobial resistant Escherichia coli isolates from bovine endometritis.Research in Veterinary Science, 2011, 91(3): 412–414DOI:10.1016/j.rvsc.2010.09.004. |
