梅枫, 孔雯, 李阳, 马婷婷, 皮婷, 何冬兰, 程国军, 刘涛, 李晓华


中南民族大学生命科学学院, 生物技术国家民委重点实验室, 湖北 武汉 430074
收稿日期:2016-10-04;修回日期:2016-11-16;网络出版日期:2016-12-28
基金项目:国家自然科学基金(31070087,30570046);湖北省自然科学基金重点项目(2011CDA079,2008CDB076);中央科研基本业务费(CZW16005,YCZW15104)
*通信作者:Tel:+86-27-67843541;Fax:+86-27-67842689;E-mail:lixiaohua@mail.scuec.edu.cn
摘要: [目的]分离并鉴定1株具有尼古丁降解能力的细菌,研究其尼古丁降解特性并对其降解基因进行分析,为尼古丁微生物降解提供基础。[方法]从烟草种植地土壤中分离1株具有尼古丁降解能力的细菌,通过16S rRNA基因和生理生化特性对该菌株进行鉴定,检测该菌株尼古丁降解率与生长量的关系,并进一步对该菌株进行尼古丁浓度耐受性测定,采用高通量测序技术对菌株进行全基因组测序,BLAST比对分析尼古丁降解相关基因。[结果]筛选到1株具有尼古丁降解能力的细菌,经鉴定命名为根癌土壤杆菌(Agrobacterium tumerficience)SCUEC1菌株,根癌土壤杆菌SCUEC1菌株尼古丁降解率可达到94.81%,该菌株在尼古丁浓度为0.50-5.00 g/L范围内生长良好且有较高的尼古丁降解能力。对根癌土壤杆菌SCUEC1菌株全基因组序列进行BLAST比对分析,推测该菌株的尼古丁降解代谢途径与中间苍白杆菌SYJ1菌株的尼古丁降解途径相似。[结论]本研究揭示了Agrobacterium tumerficience SCUEC1菌株具备尼古丁降解特性,初步推测出尼古丁降解相关基因和降解代谢途径,为尼古丁微生物降解提供基础。
关键词: 尼古丁 根癌土壤杆菌SCUEC1菌株 降解特性 代谢途径
Isolation and gene characterization of a nicotine-degradation strain Agrobacterium tumefacience SCUEC1
Feng Mei, Wen Kong, Yang Li, Tingting Ma, Ting Pi, Donglan He, Guojun Cheng, Tao Liu, Xiaohua Li


Key Laboratory for Biotechnology of the State Ethnic Affairs Commission, College of Life Sciences, South-Central University for Nationalities, Wuhan 430074, Hubei Province, Chinas
Received 04 October 2016; Revised 16 November 2016; Published online 28 December 2016
*Corresponding author: Tel: +86-27-67843541; Fax: +86-27-67842689; E-mail: lixiaohua@mail.scuec.edu.cn
Supported by the National Natural Science Foundation of China (31070087, 30570046), by the Natural Science Foundation of Hubei Province (2011CDA079, 2008CDB076) and by the Central Science Research Study Basic Expenses (CZW16005, YCZW15104)
Abstract: [Objective]The aim of this study was to identify bacterial species capable of degrading nicotine, and to characterize related genes.[Methods]One bacterial strain with the ability to degrade nicotine was screened from tobacco field soil by using nicotine as the sole carbon source. Using phylogenetic analysis of its 16S rRNA gene, together with physiological and biochemical characteristics, we identified this strain as Agrobacterium tumefacience SCUEC1. We determined its association of degradation rate with its growth rate, and its tolerance to nicotine. Also, the genome was sequenced using high throughput sequencing technology, and the nicotine metabolic pathway of SCUEC1 strain was analyzed by bioinformatics tools.[Results]Nicotine degradation rate of SCUEC1 reached 94.81%. The strain tolerated nicotine with the concentration from 0.50 g/L to 5.00 g/L. Its metabolic pathway of nicotine degradation appeared similar to that of Ochrobactrum sp. strain SJY1.[Conclusion]Agrobacterium tumerficience SCUEC1 degraded nicotine. These findings provide a theoretical basis for biodegradation of nicotine.
Key words: nicotine Agrobacterium tumefacience SCUEC1 degradation characteristic metabolic pathways
尼古丁 (nicotine) 是一个杂环复合物,由一个吡啶和吡咯环组成,结构稳定,不易降解,是烟草中的主要生物碱[1-2]。尼古丁对人体有害,很容易被人体吸收,也是吸烟上瘾的主要物质,而且能引起严重的心血管疾病、癌症、基因突变和畸形等[3]。尼古丁作为神经毒素能够影响细胞的生命进程,例如细胞凋亡、细胞的畸形生长、提高基因表达率、分泌激素和调节酶的活性[4-5]。当人体吸入香烟时,肺部会快速吸收90%的尼古丁[6]。人体中的尼古丁能快速通过生物膜和血脑屏障,并加快心率和升高动脉压,引起静脉功能障碍[7-9]。此外,尼古丁易溶于水,在烟草种植和香烟生产上很容易造成固体和液体的高浓度污染,严重影响环境平衡和人类健康[10]。欧洲联盟已将每千克尼古丁质量浓度超过500 mg的烟草废弃物规定为“有毒有害物”,因此,尼古丁降解成为迫切需要解决的问题,而利用微生物降解尼古丁是低成本高效率且对环境影响小的尼古丁降解方法[11-12]。
利用微生物降解环境污染物是最有发展前景的方法[13-16]。降解尼古丁的微生物主要有嗜烟碱节杆菌 (Arthrobacter nicotianaes)[17-19]、假单胞菌属 (Pseudomonas sp.)[20-24]、中间苍白杆菌 (Ochrobactrumintermedium)[25]、土壤杆菌属 (Agrobacterium sp.)[26-27]、红球菌属 (Rhodococcus sp.)[28]和米曲菌 (Aspergillus oryzae)[29]等,这些微生物利用尼古丁作为生长的唯一的碳源、氮源和能源[30]。微生物降解尼古丁的途径因微生物菌种的不同而有所差异,节杆菌 (Arthrobacter sp.) 首先从吡啶环开始降解尼古丁 (吡啶途径),假单胞菌属 (Pseudomonas sp.) 首先从吡咯环开始降解尼古丁 (吡咯途径),真菌是去掉尼古丁吡咯环的甲基基团 (去甲基化途径)。本研究从湖北省襄阳市烟草种植地土壤分离出1株具有较高的尼古丁降解能力的微生物,通过对其降解特性和尼古丁降解途径进行研究,为利用微生物降解尼古丁的应用提供基础。
1 材料和方法 1.1 土壤样品 土壤样品采自湖北省襄樊市烟草种植基地。
1.2 培养基 尼古丁培养基 (g/L):K2HPO4 13.30,KH2PO4 4.00,(NH4)2SO4 0.01,酵母粉1.00,10.00 mL微量元素 (MgSO4·7H2O 1.00 g,MnSO4·H2O 0.40 g,CaCl2·2H2O 0.20 g,CuCl2·2H2O 0.20 g,FeSO4·7H2O 0.02 g,用0.10 mol/L HCI溶解至100 mL),加蒸馏水定容至1000 mL,自然pH。加入0.5 g尼古丁。
尼古丁固体培养基:在尼古丁培养基中添加1.8%的琼脂粉。
1.3 尼古丁降解菌的分离 称取2.00 g土壤样品于20.00 mL尼古丁培养基,30 ℃、180 r/min摇床培养。用0.90%生理盐水梯度稀释,涂布于尼古丁分离培养基,于30 ℃培养,挑取菌株划线分离纯化。分别将纯化的菌株接入尼古丁培养基中,于30 ℃、180 r/min摇床培养,测定发酵液中尼古丁浓度。
1.4 尼古丁培养基中尼古丁浓度的测定 根据尼古丁在波长为259 nm处有吸收峰,采用紫外分光光度法测定尼古丁的含量。将菌株接入尼古丁培养基中,于30 ℃、180 r/min摇床培养,用不接菌的尼古丁培养基作空白对照 (CK),发酵液在12000 r/min条件下离心5 min,测定发酵液在紫外光波长为259 nm处的吸光值。
尼古丁降解率的计算公式为:尼古丁降解率= (原培养液中尼古丁浓度-发酵液中尼古丁浓度)/原培养液中尼古丁浓度×100%。
1.5 菌体生长量的测定 将菌株接种至尼古丁培养基中,在30 ℃、180 r/min条件下摇床培养,定时取样,采用分光光度法测定菌体的生长量,菌体生长量用OD600表示。
1.6 菌种鉴定 参照文献[31]进行形态结构观察和生理生化特性鉴定。参照文献[32]提取细菌总DNA,测定16S rRNA基因序列。用于16S rRNA基因的PCR反应的引物为1对通用引物,正向引物F1:5′-AGAGTTTGATCCTGGCTCAG-3′和反向引物F2:5′-AAGGAGGTGATCCAGCC-3′。PCR反应体系 (20.00 μL):10×PCR缓冲液2.00 μL,dNTPs 1 μL,正向引物F1和反向引物F2各1.00 μL,模板DNA 1.00 μL,Taq酶0.25 μL,超纯水13.75 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 1 min,55 ℃ 1 min,72 ℃ 1.5 min,循环30次;72 ℃ 10 min。测序结果利用BLAST在GenBank基因库中进行同源性比较并进行鉴定。利用MEGA 6进行16S rRNA基因序列的比对与系统发育树的构建 (采取Neighbor-Joining法,bootstrap value为1000)。
1.7 发酵液的HPLC检测 用0.22 μm的水相膜过滤发酵液,HPLC检测,检测条件为:波长为259 nm,色谱柱为C18柱 (4.60 mm×250.00 mm,5.00 μm)。流动相为甲醇 (色谱纯):1.00 mmol/L H2SO4=25:75,流速为0.50 mL/min,柱温为30 ℃,进样量为20.00 μL。
1.8 基因组DNA的提取、测序及分析 基因组DNA的提取采用TaKaRa基因组DNA提取试剂盒。基因组测序由上海人类基因组研究中心基因组测序部完成。采用velvet V1.2.03对数据进行拼装,通过结合软件glimmer 3.02进行基因预测。搜寻NCBI的nr库,KEGG蛋白数据库以及SEED蛋白数据库进行基因功能注释,利用CDD数据库进行COG分类,通过KEGG数据库构建代谢通路[33]。将全基因组测序结果与已知降解基因的尼古丁降解菌的序列在NCBI中进行比对,预测尼古丁降解相关基因,推测可能的尼古丁降解途径。
2 结果和分析 2.1 尼古丁降解菌的分离 从湖北省襄阳市烟草种植地土壤样品中分离得到1株尼古丁降解菌株,命名为SCUEC1菌株。将尼古丁降解菌SCUEC1菌株以5%的接种量接种到尼古丁浓度为1.00 g/L的培养基中,30 ℃、180 r/min摇床发酵48 h,用紫外分光光度计法测定发酵液中尼古丁含量,结果如图 1所示:尼古丁培养基 (CK) 在259 nm处有吸收峰,而尼古丁降解菌SCUEC1菌株发酵48 h后259 nm处吸收峰消失,表明尼古丁降解菌SCUEC1菌株具有尼古丁降解能力。
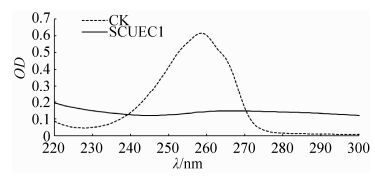 |
| 图 1. 尼古丁降解菌SCUEC1菌株发酵液和尼古丁培养基紫外吸收图谱 Figure 1. UV absorptions spectrum of fermentation liquid by SCUEC1 strain and nicotine medium. |
| 图选项 |
2.2 尼古丁降解菌SCUEC1菌株的鉴定 尼古丁降解菌SCUEC1菌株显微观察和生理生化实验结果为:在尼古丁固体培养基菌落呈淡黄色,光滑凸起,边缘整齐,平板不变色,液体发酵培养产生色素使原始澄清透明淡黄色培养液变成墨绿色;革兰氏染色、伏-普试验、甲基红试验、吲哚试验、硫化氢试验和柠檬酸试验均呈阴性。
尼古丁降解菌SCUEC1菌株的16S rRNA基因序列长度1473 bp,构建尼古丁降解菌SCUEC1菌株系统发育树,从图 2可以看出:该菌株与根癌土壤杆菌属 (Agrobacterium tumerficience) 分支较近。结合生理生化特性,初步确定尼古丁降解菌SCUEC1菌株为根癌土壤杆菌属 (Agrobacterium tumerficience)。该菌株已保藏于中国典型培养物保藏中心,其保藏编号:CCTCC M 2014133。
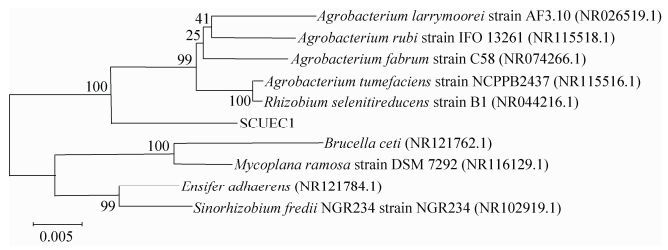 |
| 图 2. 尼古丁降解菌SCUEC1菌株系统发育树 Figure 2. Phylogenetic tree of nicotine degradation SCUEC1 strain. The GenBank accession numbers are given in parentheses. The number at each branch points is the percentage supported by bootstrap. Bar 0.005 at the bottom is the sequence divergence. |
| 图选项 |
2.3 根癌土壤杆菌SCUEC1菌株的降解特性 2.3.1?尼古丁降解率与生长量的关系:将根癌土壤杆菌SCUEC1菌株以5%的接种量接种至尼古丁培养基中,尼古丁质量浓度为1.00g/L,30 ℃、180 r/min摇床培养,取样测定并计算发酵液的尼古丁质量浓度和菌体浓度。结果如图 3所示,根癌土壤杆菌SCUEC1菌株0-12 h处于延滞期,12 h后菌体的生长速度加快进入对数生长期,36 h后处于平稳期,随着根癌土壤杆菌SCUEC1菌株的生长,尼古丁不断被降解,36 h菌株生长量和尼古丁降解率都达到最大,此时发酵液中的尼古丁浓度由0 h的3.16 g/L降到了0.53 g/L,菌体的OD600值也由0 h的0.04增加到了1.81。表明尼古丁降解率和菌体生长量呈正相关。
 |
| 图 3. 根癌土壤杆菌SCUEC1菌株的生长与尼古丁降解 Figure 3. The growth and degradation curve of Agrobacterium tumefacience SCUEC1 strain. |
| 图选项 |
2.3.2?根癌土壤杆菌SCUEC1菌株对尼古丁的耐受性:将根癌土壤杆菌SCUEC1菌株分别接种到尼古丁浓度分别为0.50、1.00、2.00、3.00、4.00、5.00、6.00、7.00g/L的尼古丁培养基中,30 ℃、180 r/min摇床培养,取样测定并计算发酵液的尼古丁浓度和菌体浓度。结果如表 1所示,根癌土壤杆菌SCUEC1菌株在尼古丁浓度为0.50-4.00 g/L时,尼古丁降解率都在85.66%以上,菌体的OD600值也都在1.10以上;当尼古丁浓度为5.00 g/L时,根癌土壤杆菌SCUEC1菌株尼古丁降解率下降到41.26%,菌体的OD600值也下降到0.88;当尼古丁浓度为6.00 g/L或高于6.00 g/L时,根癌土壤杆菌SCUEC1菌株生长量和降解率都较低,菌体的OD600值低于0.13,降解率低于8.57%,表明根癌土壤杆菌SCUEC1菌株对尼古丁的耐受性浓度为5.00 g/L。
表 1. 不同尼古丁浓度对根癌土壤杆菌SCUEC1菌株尼古丁降解率和生长量的影响 Table 1. Effect of nicotine concentration on growth and degradation of SCUEC1 strain
| Nicotine concentration/(g/L) | Growth amount/OD600 | Degradation rate/% |
| 0.50 | 1.06 | 93.22 |
| 1.00 | 1.18 | 94.81 |
| 2.00 | 1.26 | 89.26 |
| 3.00 | 1.28 | 87.27 |
| 4.00 | 1.10 | 85.66 |
| 5.00 | 0.88 | 41.26 |
| 6.00 | 0.13 | 8.57 |
| 7.00 | 0.06 | 6.53 |
表选项
2.4 根癌土壤杆菌SCUEC1菌株中间代谢产物HPLC分析 将根癌土壤杆菌SCUEC1菌株的静止细胞 (OD600为0.60左右) 以10%的接种量接种至pH 7.0、尼古丁浓度为1.00 g/L的0.05 mol/L K2HPO4/KH2PO4缓冲液中,30 ℃、180 r/min摇床培养48 h,分别定时取样,发酵液12000 r/min离心5 min,用0.22 μm的水相膜过滤。进行HPLC检测。结果如图 4显示,液体培养基中尼古丁的保留时间在6.50 min左右。当培养到11 h时,6.50 min左右的尼古丁峰面积明显减少,出现一个保留时间在13.50 min左右和17.11 min左右的新色谱峰,表明培养基中的尼古丁被降解,同时产生中间代谢产物。当培养到24 h时,6.50 min左右的尼古丁峰面积趋近于0,17.11 min左右的新色谱峰面积增大,表明根癌土壤杆菌SCUEC1菌株将尼古丁降解并产生中间代谢产物。
 |
| 图 4. 不同培养时间尼古丁降解菌SCUEC1菌株发酵液HPLC分析 Figure 4. HPLC analysis of nicotine degradation SCUEC1 strain. A: 0 h; B: 11 h; C: 24 h. |
| 图选项 |
2.5 根癌土壤杆菌SCUEC1菌株中尼古丁降解相关基因的分析 根癌土壤杆菌SCUEC1菌株进行全基因组测序,基因组组装获得30个contigs,整个基因组大小约5.32 Mb,编码区GC含量为60.30%。CDS数为5039,平均CDS长度为907 bp,tRNA数量为43。
与已知的尼古丁降解菌的序列比对分析发现,根癌土壤杆菌SCUEC1菌株的尼古丁降解相关基因主要位于contig18和contig25上,与中间苍白杆菌SYJ1菌株的尼古丁降解相关基因同源性较高 (表 2),中间苍白杆菌SYJ1菌株的尼古丁降解途径是吡咯途径与吡啶途径的变形途径[34]。根据已报道的尼古丁降解基因簇推测根癌土壤杆菌SCUEC1菌株的尼古丁降解基因簇 (图 5),并预测该菌株的尼古丁代谢途径 (图 6)。
表 2. 根癌土壤杆菌SCUEC1菌株中尼古丁降解相关基因预测 Table 2. Gene involved in degradation of nicotine in Agrobacterium tumerficience SCUEC1 strain
| Genes | Contig No. | Position/nt | Protein homologue | Identity/% | Proposed function |
| agnA | Contig 18 | 29414-32127 | VppA | 100 | nicotine hydroxylase |
| agnB | Contig 18 | 32746-34059 | VppB | 99 | 6-hydroxy-nicotine oxidase gene |
| agnD | Contig 25 | 6912-8087 | VppD | 99 | 6-hydroxy-3-succinoyl-pyridine 3-monooxygenase |
| agnE | Contig 18 | 38286-39314 | VppE | 99 | 2, 5-dihydroxy-pyridine dioxygenase |
| agnF | Contig 18 | 37478-38260 | VppF | 99 | N-formylmaleamic acid deformylase |
| agnG | Contig 18 | 39376-40008 | VppG | 99 | maleamate amidase |
| agnH | Contig 18 | 36881-37465 | VppH | 99 | maleate isomerase |
表选项
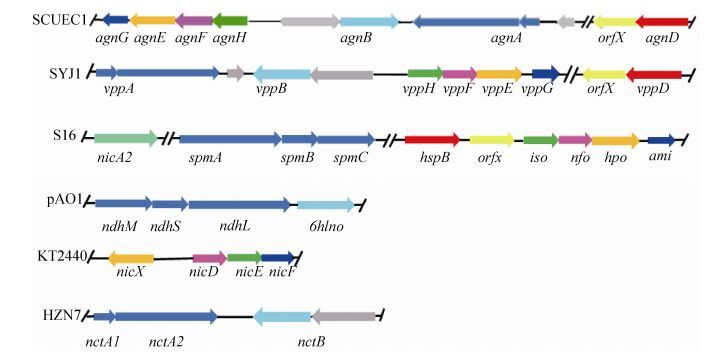 |
| 图 5. 根癌土壤杆菌SCUEC1菌株中尼古丁降解基因簇的预测和已报道的尼古丁降解基因簇的比较 Figure 5. Gene cluster of nicotine degradation have been reported and proposed gene cluster of nicotine degradation in Agrobacterium tumerficience SCUEC1 strain. SYJ1: Ochrobactrum sp. SJY1; S16: Pseudomonas putida S16; pAO1: Arthrobacter nicotinovorans pAO1; KT2440: Pseudomonas putida KT2440; HZN7: Shinella sp. HZN7. |
| 图选项 |
 |
| 图 6. 根癌土壤杆菌SCUEC1菌株尼古丁降解代谢途径的推测 Figure 6. Proposed pathway of nicotine catabolism in Agrobacterium tumerficience SCUEC1 strain. |
| 图选项 |
3 讨论 本研究从湖北省襄阳市烟草种植地土壤中分离得到1株尼古丁降解菌,鉴定为根癌土壤农杆菌 (Agrobacterium tumerficience)。SCUEC1菌株具有较高尼古丁耐受力和尼古丁降解率,发现该菌株在尼古丁浓度0.50-5.00 g/L内生长良好且有较高的尼古丁降解能力。根据文献报道,Ochrobactrumsp. 4-40尼古丁降解率为51.50%[35],Sinorhizobiumsp. 5-28尼古丁降解率为72.50%[36],Pseudomonas plecoglossicida尼古丁降解率为88.00%[37],根癌土壤农杆菌SCUEC1菌株尼古丁降解率为94.81%,具有较高的尼古丁降解率。全基因测序与比对分析表明,该菌株具有尼古丁降解途径中重要酶类的编码基因,如尼古丁羟化酶、6-羟基-尼古丁氧化酶、6-羟基-3-琥珀酰吡啶还原酶、2, 5-二羟基吡啶双加氧酶、顺丁烯酰胺酸去酰胺酶、顺丁烯异构酶。
尼古丁降解微生物能将尼古丁转化为多种中间代谢产物,其中的一些中间代谢产物能被用于制药工业。例如吡啶衍生物,能被广泛用于抗癌治疗、镇痛药的发展、帕金森的治疗、缓解高血压以及中央神经系统的紊乱。二羟基吡啶可用于合成植物生长调节剂、除草剂、治疗癌症的药物和类似于亚铁血红素和叶绿素的卟啉类化合物。6-羟基-3-琥珀酰吡啶是合成地棘蛙素类似物药物的前体物,地棘蛙素是一种极其有效的止痛剂分子。全基因测序及分析为揭示新型尼古丁降解途径和调控机制提供可能,本研究表明了Agrobacteriumtumerficience SCUEC1菌株具有尼古丁降解性能,其降解代谢途径已经被推测,并从基因层面证实了该菌株具有尼古丁降解能力,为尼古丁微生物降解的研究提供依据。
参考文献
| [1] | Hawkins BT, Abbruscato TJ, Egleton RD, Brown RC, Huber JD, Campos CR, Davis TP. Nicotine increases in vivo blood-brain barrier permeability and alters cerebral microvascular tight junction protein distribution.Brain Research, 2004, 1027(1/2): 48–58. |
| [2] | Cogo K, Montan MF, de Cássia Bergamaschi C, Andrade ED, Rosalen PL, Groppo FC. In vitro evaluation of the effect of nicotine, cotinine, and caffeine on oral microorganisms.Canadian Journal of Microbiology, 2008, 54(6): 501–508DOI:10.1139/W08-032. |
| [3] | Yildiz D. Nicotine, its metabolism and an overview of its biological effects.Toxicon, 2004, 43(6): 619–632DOI:10.1016/j.toxicon.2004.01.017. |
| [4] | Yildiz D, Ercal N, Armstrong DW. Nicotine enantiomers and oxidative stress.Toxicology, 1998, 130(2/3): 155–165. |
| [5] | Qiao D, Seidler FJ, Slotkin TA. Oxidative mechanisms contributing to the developmental neurotoxicity of nicotine and chlorpyrifos.Toxicology and Applied Pharmacology, 2005, 206(1): 17–26DOI:10.1016/j.taap.2004.11.003. |
| [6] | Zhang YD, Luo CR, Wang HL, Lu GF. Advances in microbial degradation of nicotine and its application.Tobacco Science & Technology, 2003(12): 3–7(in Chinese). 张彦东, 罗昌荣, 王辉龙, 卢国藩. 微生物降解烟碱研究应用进展.烟草科技/烟草工艺, 2003(12): 3–7. |
| [7] | Campain JA. Nicotine:potentially a multifunctional carcinogen.Toxicological Sciences, 2004, 79(1): 1–3DOI:10.1093/toxsci/kfh106. |
| [8] | Schievelbein H. Nicotine, resorption and fate.Pharmacology & Therapeutics, 1982, 18(2): 233–247. |
| [9] | Sabha M, Tanus-Santos JE, Toledo JCY, Cittadino M, Rocha JC, Moreno H Jr. Transdermal nicotine mimics the smoking-induced endothelial dysfunction.Clinical Pharmacology & Therapeutics, 2000, 68(2): 167–174. |
| [10] | Zhong WH, Zhu CJ, Shu M, Sun KD, Zhao L, Wang C, Ye ZJ, Chen JM. Degradation of nicotine in tobacco waste extract by newly isolated Pseudomonas sp. ZUTSKD.Bioresource Technology, 2010, 101(18): 6935–6941DOI:10.1016/j.biortech.2010.03.142. |
| [11] | Civilini M, Domenis C, Sebastianutto N, de Bertoldi M. Nicotine decontamination of tobacco agro-industrial waste and its degradation by micro-organisms.Waste Management & Research, 1997, 15(4): 349–358. |
| [12] | Brandsch R, Decker K. Isolation and partial characterization of plasmid DNA from Arthrobacter oxidans.Archives of Microbiology, 1984, 138(1): 15–17DOI:10.1007/BF00425400. |
| [13] | Be?koski VP, Gojgi?-Cvijovi? G, Mili? J, Ili?a M, Mileti?a S, ?olevi?a T, Vrvi?a MM. Ex-situ bioremediation of a soil contaminated by mazut (heavy residual fuel oil)-a field experiment.Chemosphere, 2011, 83(1): 34–40DOI:10.1016/j.chemosphere.2011.01.020. |
| [14] | Langer U, B?hme L, B?hme F. Classification of soil microorganisms based on growth properties:a critical view of some commonly used terms.Journal of Plant Nutrition and Soil Science, 2004, 167(3): 267–269DOI:10.1002/(ISSN)1522-2624. |
| [15] | Brenner K, You LC, Arnold FH. Engineering microbial consortia:a new frontier in synthetic biology.Trends in Biotechnology, 2008, 26(9): 483–489DOI:10.1016/j.tibtech.2008.05.004. |
| [16] | Eberhardt HJ. The biological degradation of nicotine by nicotinophilic microorganisms.Beitr?ge zur Tabakforschung International, 1995, 16(3): 119–129. |
| [17] | Baitsch D, Sandu C, Brandsch R, Igloi GL. Gene cluster on pAO1 of Arthrobacter nicotinovorans involved in degradation of the plant alkaloid nicotine:cloning, purification, and characterization of 2, 6-dihydroxypyridine 3-hydroxylase.Journal of Bacteriology, 2001, 183(18): 5262–5267DOI:10.1128/JB.183.18.5262-5267.2001. |
| [18] | Igloi GL, Brandsch R. Sequence of the 165-kilobase catabolic plasmid pAO1 from Arthrobacter nicotinovorans and identification of a pAO1-dependent nicotine uptake system.Journal of Bacteriology, 2003, 185(6): 1976–1986DOI:10.1128/JB.185.6.1976-1986.2003. |
| [19] | Kong W, Xian F, Li CY, Wang JX, Li XH. Isolation and characterization of a high nicotine-degradation bacterium.Journal of Huazhong Agricultural University, 2011, 30(1): 30–33(in Chinese). 孔雯, 先锋, 李长影, 王家昕, 李晓华. 1株烟碱降解菌的筛选、鉴定及其降解性能的初步研究.华中农业大学学报, 2011, 30(1): 30–33. |
| [20] | Ruan AD, Min H, Peng XH, Huang Z. Isolation and characterization of Pseudomonas sp. strain HF-1, capable of degrading nicotine.Research in Microbiology, 2005, 156(5/6): 700–706. |
| [21] | Tang HZ, Wang LJ, Meng XZ, Ma LY, Wang SN, He XF, Wu G, Xu P. Novel nicotine oxidoreductase-encoding gene involved in nicotine degradation by Pseudomonas putida strain S16.Applied and Environmental Microbiology, 2009, 75(3): 772–778DOI:10.1128/AEM.02300-08. |
| [22] | Tang HZ, Wang SN, Ma LY, Meng XZ, Deng ZX, Zhang DK, Ma CQ, Xu P. A novel gene, encoding 6-hydroxy-3-succinoylpyridine hydroxylase, involved in nicotine degradation by Pseudomonas putida strain S16.Applied and Environmental Microbiology, 2008, 74(5): 1567–1574DOI:10.1128/AEM.02529-07. |
| [23] | Wang LJ, Tang HZ, Yu H, Yao YX, Xu P. An unusual repressor controls the expression of a crucial nicotine-degrading gene cluster in Pseudomonas putida S16.Molecular Microbiology, 2014, 91(6): 1252–1269DOI:10.1111/mmi.2014.91.issue-6. |
| [24] | Wang SN, Liu Z, Tang HZ, Meng J, Xu P. Characterization of environmentally friendly nicotine degradation by Pseudomonas putida biotype A strain S16.Microbiology, 2007, 153(5): 1556–1565DOI:10.1099/mic.0.2006/005223-0. |
| [25] | Yuan YJ, Lu ZX, Huang LJ, Bie XM, Lü FX, Li Y. Optimization of a medium for enhancing nicotine biodegradation by Ochrobactrum intermedium DN2.Journal of Applied Microbiology, 2006, 101(3): 691–697DOI:10.1111/jam.2006.101.issue-3. |
| [26] | Wang SN, Huang HY, Xie KB, Xu P. Identification of nicotine biotransformation intermediates by Agrobacterium tumefaciens strain S33 suggests a novel nicotine degradation pathway.Applied Microbiology and Biotechnology, 2012, 95(6): 1567–1578DOI:10.1007/s00253-012-4007-2. |
| [27] | Wang SN, Liu Z, Xu P. Biodegradation of nicotine by a newly isolated Agrobacterium sp. strain S33.Journal of Applied Microbiology, 2009, 107(3): 838–847DOI:10.1111/jam.2009.107.issue-3. |
| [28] | Gong XW, Yang JK, Duan YQ, Dong JY, Zhe W, Wang L, Li QH, Zhang KQ. Isolation and characterization of Rhodococcus sp. Y22 and its potential application to tobacco processing.Research in Microbiology, 2009, 160(3): 200–204DOI:10.1016/j.resmic.2009.02.004. |
| [29] | Meng XJ, Lu LL, Gu GF, Xiao M. A novel pathway for nicotine degradation by Aspergillus oryzae 112822 isolated from tobacco leaves.Research in Microbiology, 2010, 161(7): 626–633DOI:10.1016/j.resmic.2010.05.017. |
| [30] | Li HJ, Li XM, Duan YQ, Zhang KQ, Yang JK. Biotransformation of nicotine by microorganism:the case of Pseudomonas spp..Applied Microbiology and Biotechnology, 2010, 86(1): 11–17DOI:10.1007/s00253-009-2427-4. |
| [31] | 沈萍, 陈向东. 微生物学实验.第4版.北京: 高等教育出版社, 2007. |
| [32] | Kieser T, Bibb M J, Chater KF, Butter MJ, Hopwood DA, Bittner MJ, Bibb MJ, Buttner MJ, Chater KF, Hopwood DA. Practical Streptomyces genetics:a laboratory manual. Norwich:John Innes Foundation, 2000. |
| [33] | Yang HL, Zhang ZB, Yan RM, Wang Y, Zhu D. Whole-genome sequencing and analysis of an endophytic actinomycete Streptomyces sp. PRh5 from Dongxiang wild rice.Microbiology China, 2015, 42(4): 801–809(in Chinese). 杨慧林, 张志斌, 颜日明, 汪涯, 朱笃. 东乡野生稻内生放线菌Streptomyces sp. PRh5的全基因组测序及序列分析.微生物学通报, 2015, 42(4): 801–809. |
| [34] | Yu H, Tang HZ, Zhu XY, Li YY, Xu P. Molecular mechanism of nicotine degradation by a newly isolated strain, Ochrobactrum sp. strain SJY1.Applied and Environmental Microbiology, 2015, 81(1): 272–281DOI:10.1128/AEM.02265-14. |
| [35] | Ma GH, Lei LP, Xia ZY, Gong XW, Zhou W, Yang JK. Diversity and phylogenetic analyses of nicotine degrading bacteria isolated from tobacco plantation soils.African Journal of Microbiology Research, 2012, 6: 6392–6398. |
| [36] | Chen C, Ma GH, Lei LP, Zhou W, Shen XJ, Yang JK. Isolation, Identification and Characteristics of Nicotine-degrading Bacterium Strain 5-28.Tobacco Science & Technology, 2012, 5(298): 74–78(in Chinese). 陈晨, 麻广慧, 雷丽萍, 周薇, 沈兴家, 杨金奎. 尼古丁降解细菌5-28菌株的分离鉴定和降解特性.烟草科技, 2012, 5(298): 74–78. |
| [37] | Raman G, Mohan KN, Manohar V, Natarajan S. Biodegradation of nicotine by a novel nicotine-degrading bacterium, Pseudomonas plecoglossicida TND35 and its new biotransformation intermediates.Biodegradation, 2014, 25: 95–107DOI:10.1007/s10532-013-9643-4. |
