杨兴龙, 穆晓清

 , 聂尧, 徐岩
, 聂尧, 徐岩 江南大学酿酒科学与酶技术中心, 工业生物技术教育部重点实验室, 江苏 无锡 214122
收稿日期:2016-01-21;修回日期:2016-04-05;网络出版日期:2016-04-19
基金项目:国家“863计划”(2015AA021004);国家自然科学基金(21336009,21176103);高等学校学科创新引智计划(111-2-06)
*通信作者:穆晓清, Tel/Fax:+86-510-85918201;E-mail:xqmuf@163.com
摘要: [目的]通过不同双基因共表达策略对亮氨酸脱氢酶和葡萄糖脱氢酶基因在大肠杆菌中表达影响的研究,获得具有高辅酶再生效率的双酶共表达重组生物催化剂,实现L-叔亮氨酸“一锅法”高效不对称合成。[方法]以来自于蜡状芽孢杆菌(Bacillus cereus)的亮氨酸脱氢酶(LDH)和来自芽孢菌属(Bacillussp.)的葡萄糖脱氢酶(GDH)为模板,考察单质粒共表达,双质粒共表达和融合表达等3种共表达策略对重组细胞中亮氨酸脱氢酶和葡萄糖脱氢酶活的影响,比较不同酶活比例和不同催化剂形式对三甲基丙酮酸不对称还原制备L-叔亮氨酸效率的影响。[结果]研究发现不同共表达策略对亮氨酸脱氢酶和葡萄糖脱氢酶的影响存在明显差异。亮氨酸脱氢酶在不同策略下均能够正常表达,而葡萄糖脱氢酶在融合表达时没有活力,当C端含有组氨酸标签时,表达蛋白活性低。通过表达优化,获得3株亮氨酸脱氢酶和葡萄糖脱氢酶高效表达且具有不同酶活比例的重组菌。比较粗酶液和全细胞形式下的催化效率,发现酶活比例及催化剂形式对不对称还原反应效率具有重要影响。确定单质粒串联表达C端不含His标签重组菌E.coli BL21/pET28a-L-SD-AS-G为最佳催化剂,以粗酶液进行转化时,完全转化0.5 mol/L底物所需菌体量为15 g/L,辅酶量为0.1 mmol/L。[结论]采用单质粒共表达策略,成功构建出1株具有较高亮氨酸脱氢酶和葡萄糖脱氢酶活性的重组菌,实现高效催化TMP合成L-Tle。
关键词: L-叔亮氨酸 亮氨酸脱氢酶 葡萄糖脱氢酶 共表达策略 C端 His标签
High efficient co-expression of leucine dehydrogenase and glucose dehydrogenase in Escherichia coli
Yang Xinglong, Mu Xiaoqing

 , Nie Yao, Xu Yan
, Nie Yao, Xu Yan Key Laboratory of Industrial Biotechnology, Ministry of Education, Center for Brewing Science and Enzyme Technology, School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu Province, China
Received 21 January 2016; Revised 05 April 2016; Published online 19 April 2016
*Corresponding author: Xiaoqing Mu Tel/Fax: +86-510-85918201; E-mail: xqmuf@163.com
Supported by the National High Technology Research and Development Program of China (2015AA021004), by the National Natural Science Foundation of China (21336009, 21176103) and by the Program of Introducing Talents of Discipline to Universities (111-2-06)
Abstract: [Objective]Different co-expression strategies to express leucine dehydrogenase and glucose dehydrogenase in E. coli were done to observe the effect of expression of different enzyme. A recombinant strain with two high enzyme activities was built for efficiently asymmetric synthesis of L-tert-leucine.[Methods]The leucine dehydrogenase (ldh) from Bacillus cereus and glucose dehydrogenase (gdh) from Bacillus sp. were co-expressed by three different strategies, including co-expressing two genes in single vector, co-expressing two genes in two vectors and expressing fusion protein. The catalytic efficiencies of recombinant strains with different enzyme activity ratio in different modes of biocatalyst were compared to produce L-tert-leucine from its corresponding α-keto acids.[Results]Different co-expression strategies displayed a slight impact on leucine dehydrogenase expression, whereas, a greater impact on glucose dehydrogenase. All the activity of leucine dehydrogenase was normally expressed, but the fusion proteins lost the activity of glucose dehydrogenase. Besides, the activity of glucose dehydrogenase was also totally inhibited when the 6-histidine tag was fused at C termini, which indicated the additional 6-histidine tag considerately depressed the glucose dehydrogenase activity. After optimization of expression, three recombinant strains exhibiting high enzyme activity and different enzyme activity ratio were used to synthesis L-tert-leucine in the mode of cell-free extracts and whole-cell. Result displayed a great influence on the catalytic efficiencies resulted from the mode of catalyst and enzyme activity. When the cell-free crude culture broth of E. coli BL21/pET28a-L-SD-AS-G coexpressing two genes in single vector was used as biocatalyst, 15 g/L cell loading and 0.1 mmol/L NAD+ were enough to completely transform 0.5 mol/L trimethylpyruvate into L-tert-leucine.[Conclusion]The recombinant strain with high activities of leucine dehydrogenase and glucose dehydrogenase was achieved by co-expressing two genes in single vector without histidine tag in E. coli and L-tert-leucine was efficiently produced with this recombinant strain.
Key words: L-tert-leucine leucine dehydrogenase glucose dehydrogenase co-expression C terminus His-tag
手性氨基酸是重要的手性化合物,在多肽和单对映体等活性药物中间体中具有广泛应用[1-2]。生物法合成手性氨基酸具有操作简单、反应条件温和、产品收率高以及光学活性值高等优势,是目前手性氨基酸不对称合成的研究热点。目前已开发出多种生物法合成手性氨基酸的方法[3-6],其中利用氨基酸脱氢酶催化前手性酮的不对称氨化还原反应最具有工业应用前景[7]。但不对称还原反应需要等当量的辅酶参与,由于辅酶价格昂贵,限制了其在工业水平的应用。采用酶偶联辅酶再生循环系统可以有效的解决辅酶限制,其中甲酸脱氢酶(FDH)[8]和葡萄糖脱氢酶(GDH)[9]研究最为广泛。陈星星等[10]利用羰基还原酶(CR2)和GDH在纯酶水平上实现了(S)-4-氯-3-羟基丁酸乙酯的高效生物合成。黎舒婷等[11]利用亮氨酸脱氢酶(LDH)和FDH在细胞水平通过2种细胞共同作用实现L-叔亮氨酸的生物合成。但这些方法通常需要构建2个单基因表达的重组生物催化剂,操作繁琐,成本较高。利用多酶共表达技术,实现多个酶在同一宿主细胞中的表达,能够实现“一锅法”不对称合成反应,操作简便,降低成本。
影响多酶共表达“一锅法”转化效率的主要因素包括关键酶的表达量和表达比例,而利用不同表达策略是同时实现目的酶高效表达和调节表达比例的最简单和有效方式[12]。目前实现双酶共表达的主要共表达策略有3种:单质粒共表达,双质粒共表达和融合表达。单质粒共表达策略利用单一质粒中的相同启动子实现2个酶基因的串联表达,酶基因的表达先后顺序影响其表达量,可以用来调节2个基因的表达比例,如Li等[13]构建单质粒共表达LDH和GDH用于合成L-叔亮氨酸。双质粒共表达策略则通过2个单基因表达质粒共同转入同一宿主细胞中,目的基因表达水平和比例受到质粒和表达条件的影响,其表达量较单质粒共表达的基因表达量高,但在双质粒不同抗生素标签的影响下,细胞生长速率明显减少,如Liu等[14]构建双质粒共表达LDH和FDH用于合成L-叔亮氨酸。融合表达策略利用柔性标签链接形成双功能蛋白,不仅可以使目的蛋白按照固定比例进行表达,而且可使2个目的蛋白的活性位点接近,从而提高双酶催化效率,如Pazmi?o等[15]构建Baeyer-Villiger单加氧酶和亚磷酸脱氢酶融合蛋白,成功实现在1个融合酶内催化以及NADPH再生的双重功能,但酶蛋白结构的变化也会影响其催化特性。
L-叔亮氨酸(L-Tle),由于结构上侧链叔丁基的特殊性,使其具有空间结构的调节性和疏水性,广泛应用于药物生产中[16-17],是重要非天然手性氨基酸。本研究在获得高效转化制备L-叔亮氨酸LDH的基础上,比较了LDH和GDH在3种不同策略下的蛋白共表达差异,并从粗酶液和全细胞2个水平,比较了其催化特性,获得1株具有较高亮氨酸脱氢酶和葡萄糖脱氢酶活性的重组菌,建立了高效不对称合成L-叔亮氨酸途径。
1 材料和方法 1.1 材料
1.1.1 菌种和质粒 实验所用的菌株E. coli JM109和E. coli BL21以及质粒pET28a和pET21为实验室所有,质粒pMD19-T购于TaKaRa公司,重组质粒pET28a-L和pET28a-G为实验室构建并保藏。引物均由上海生工合成,如表 1所示。 表 1. 本实验中用到的引物 Table 1. Primers used in this experiment
| Primers | Sequences (5′→3′) |
| G-SD-AS-l-F1 | CAGCTAGCATGTATCCGGATTTA (NheⅠ) |
| G-SD-AS-l-R1 | GACTCGAGGCGACGGCTAATAATGT (XhoⅠ) |
| G-SD-AS-l-R2 | GGTATATCTCCTTCTTAACCGCGGCCTGCCTGGAATGACG |
| G-SD-AS-l-F2 | GGTTAAGAAGGAGATATACCATGGCATTAGAAATCTTC |
| L-SD-AS-g-F1 | GGCAGCTAGCATGGCATTAGAAATCTTCGAATACTTAGAA (NheⅠ) |
| L-SD-AS-g-R1 | GACTCGAGACCGCGGCCTGCCTGG (XhoⅠ) |
| L-SD-AS-g-R2 | ATGCCATGGTATATCTCCTTCTTACCTACGGCTAATAATGT |
| L-SD-AS-g-F2 | CGTCGCTAAGAAGGAGATATACCATGTACCCGGATTTAAAAGG |
| L-Linker-G-F1 | GGCAGCTAGCATGGCATTAGAAATCTTCGAATACTTAGAA (NheⅠ) |
| L-Linker-G-R1 | GACTCGAGTTAACCGCGGCCTGCCTGGAAT (XhoⅠ) |
| L-Linker-G-R2 | GCCAGAGCCACCACCGCCAGAGCCACCACCGCCGCGACGGCTAATAATGTCG |
| L-Linker-G-F2 | CGGTGGTGGCTCTGGCGGTGGTGGCTCTATGTATCCGGATTTA |
| G-Linker-L-F1 | CAGCTAGCATGTATCCGGATTTA (NheⅠ) |
| G-Linker-L-R1 | GACTCGAGTTACCTACGGCTAATAATGT (XhoⅠ) |
| G-Linker-L-F2 | CGGTGGTGGCTCTGGCGGTGGTGGCTCTATGGCATTAGAAATCTTC |
| G-Linker-L-R2 | GCCAGAGCCACCACCGCCAGAGCCACCACCGCCACCGCGGCCTGCCTG |
| The sequences of SD-AS and Linker are bold; the restriction endonuclease sites are underlined. | |
表选项
1.1.2 主要试剂和仪器 Taq DNA polymerase、T4 DNA Ligase、限制性内切酶Xho I和Nhe I、IPTG、DNA Marker、Protein Marker购于TaKaRa公司;DNA回收试剂盒购于北京天根生化科技有限公司;Plasmid mini kit购于OMEGA BIO-TEK。三甲基丙酮酸和L-叔亮氨酸分别购于西亚试剂公司和Sigma公司;NAD+和NADH购于上海索莱宝公司;其余试剂均为国产分析纯。 高速冷冻离心机(Beckman公司),Agilent ZORBAX SB-Aq (4.6 mm×250 mm)柱以及HPLC系统(Agilent公司),酶标仪(Thermo公司),超声破碎仪VCX750 (美国Sonic公司)。
1.1.3 培养基 LB培养基成分为蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L,pH 7.2。LB液体与固体培养基使用前,根据需要添加卡那霉素或氨苄青霉素至终浓度分别为50 mg/L和100 mg/L。 1.2 构建重组质粒pET21-l和pET21-g 以质粒pET28a-L为模板,以L-SD-AS-G-F1和G-SD-AS-L-R1为引物,PCR扩增出ldh;以pET28a-G作为模板,以G-SD-AS-L-F1和L-SD-AS-G-R1为引物,PCR扩增出gdh。对扩增获得的基因通过加A,柱纯化后连接T-载体,转化大肠杆菌JM109,涂布到氨苄抗性平板,挑取阳性转化子,测序验证。将带有目的基因的T-载体与表达载体pET-21同时利用限制性内切酶XhoⅠ和NheⅠ双酶切,T4连接酶连接过夜后转化大肠杆菌BL21,利用氨苄抗性平板筛选获得重组菌E. coli BL21/pET21-l和E. coli BL21/pET21-g。
1.3 LDH和GDH的3种共表达策略
1.3.1 单质粒共表达 通过在2个基因之间加上与pET28a载体相同的SD-AS序列,实现单质粒共表达2种基因。采用重叠延伸PCR的方法,以质粒pET28a-L和pET28a-G作为模板,先利用上述共表达引物分别扩增出表达基因的前、后半段序列,两片段经退火重叠连接后于72 °C在DNA聚合酶的作用下延伸至完整的双链,再以上一轮获得的完整双链DNA为模板,利用上下游引物扩增出全长基因,然后将扩增产物按1.2中的方法连接到载体pET28a上,最后转化获得重组菌E. coli BL21/pET28a-L-SD-AS-g和E. coli BL21/pET28a-G-SD-AS-l。
1.3.2 融合表达 通过在2个基因之间加上1个Linker(柔性的寡肽接头),实现单质粒融合表达。同样采用重叠延伸PCR的方法,利用上述融合表达引物进行PCR扩增,操作步骤与构建单质粒共表达相同,最终获得融合表达重组菌E. coli BL21/pET28a-L-Linker-G和E. coli BL21/pET28a-G-Linker-L。
1.3.3 双质粒共表达 在同一株菌中同时导入2个质粒,2个质粒上分别带有不同的基因,从而实现单菌双质粒共表达。将1.2构建的重组质粒,分2组pET21-l pET28-G和pET28-L pET21-g,转入大肠杆菌BL21,利用含氨苄抗性和卡那抗性的平板进行筛选,获得双质粒共表达菌株E. coli BL21/pET21-l pET28a-G和E. coli BL21/pET28a-L pET21-g。 1.4 构建C端不带His标签的重组质粒pET21-L,pET21-G,pET28a-L-SD-AS-G和pET28a-G-SD-AS-L
1.4.1 构建pET21-L和pET21-G 由于表 1中共表达的下游引物中不含有终止子,融合表达的下游引物含有终止子,所以采用融合表达的全基因上下游引物构建C端不带His标签的重组质粒。以质粒pET28a-L为模板,以G-Linker-L-F1和L-Linker-G-R1为引物,PCR扩增出ldh;以pET28a-G作为模板,以L-Linker-G-F1和G-Linker-L-R2为引物,PCR扩增出gdh。扩增产物按1.2中的方法连接到质粒pET21上,最终获得重组菌E. coli BL21/pET21-L和E. coli BL21/pET21-G。
1.4.2 构建pET28a-L-SD-AS-G和pET28a-G-SD-AS-L 重组质粒pET28a-L-SD-AS-G和pET28a-G-SD-AS-L的构建方法同1.3单质粒共表达构建方法,其中全基因上下游引物替换为融合表达的全基因上下游引物,从而获得C端不带His标签单质粒共表达菌E. coli BL21/pET28a-L-SD-AS-G和E. coli BL21/pET28a-G-SD-AS-L。 1.5 基因工程菌的蛋白表达 将成功构建好的重组菌株接种于含所需抗性的LB培养基中,于37 °C、200 r/min培养到OD600为0.6-0.8时,添加0.1 mmol/L的IPTG进行17 °C诱导14 h,离心收集菌体。将所获得的菌体少量进行SDS-PAGE蛋白电泳验证,另外部分进行超声破碎,测量酶活。
1.6 酶活测定 LDH和GDH都是辅酶NAD(H)依赖型酶,酶活的测定都是通过测定340 nm处吸光值改变确定辅酶NADH的改变来反映酶活。LDH酶活测定条件为总反应体积0.2 mL,分别加入0.1 mol/L Tris-HC1 (pH 8.5),5 mmol/L TMP,0.2 mmol/L NADH,1 mol/L NH4Cl-NH3·H2O缓冲液,30 °C保温2 min,加入适量酶液后开始扫描340 nm处吸光值的变化。GDH酶活测定的条件为:总反应体积0.2 mL,分别加入0.1 mol/L Tris-HC1 (pH 8.5),2 mmol/L NAD+,0.1 mol/L D-葡萄糖,30 °C保温2 min,加入适量酶液后开始扫描340 nm处吸光值的变化。蛋白质含量测定采用Bradford法,以牛血清白蛋白BSA为标准品。酶活力定义为:在上述条件下,每分钟催化生成1 μmol产物为1个酶活单位U。酶活的计算公式为:酶活(U)=EW × V × 103/(6220 × 0.3),其中,EW为1 min内340 nm处吸光度的变化;V为反应液的体积(mL);6220为摩尔消光系数(L·mol-1·cm-1);0.3为光程距离(cm)。比活的计算公式:比活(U/mg)=酶活(U)/蛋白量(mg)。
1.7 重组菌催化反应 采用全细胞和粗酶液2种形式进行催化底物TMP生成L-Tle反应。总反应体积为50 mL,体系中含有0.5 mol/L TMP,0.6 mol/L葡萄糖,0.1 mmol/L NAD+,1 mol/L NH4Cl,适量重组菌体或者是菌体破碎的粗酶液作为催化剂。反应条件为30 °C、200 r/min,反应12 h后进行取样,检测底物和产物。
1.8 HPLC分析方法
1.8.1 底物TMP检测 流速1 mL/min,紫外检测器210 nm,流动相为20 mmol/L磷酸钾/乙腈溶液[99.5:0.5 (V/V),pH 2.0],进样量5 μL。
1.8.2 产物L-Tle检测 先利用OPA进行柱前衍生化,色谱条件为:流速1 mL/min,紫外检测器338 nm,流动相A为pH 7.2的50 mmol/L醋酸钠,流动相B为50 mmol/L醋酸钠/甲醇/乙腈溶液[2:4:4,(V/V/V),pH 7.2],泵程序为27 min内B组分由7%升至50%,4 min内再升至80%,保持3 min,然后在1 min内降至7%,最后保持3 min (总时间38 min)。 2 结果和分析 2.1 不同质粒对LDH和GDH蛋白表达的影响 基因在不同质粒中的表达存在差异,选择适宜的表达质粒对目的基因的正确高效表达极为重要,也是双酶共表达的基础。本研究比较了LDH和GDH在常见质粒pET21和pET28a上的表达差异。对成功构建的单独表达LDH和GDH重组菌进行酶活测定,发现重组菌E. coli BL21/pET28a-L和E. coli BL21/pET21-l的LDH比活力相近,分别为5.89 U/mg和5.60 U/mg;而重组菌E. coli BL21/pET28a-G和E. coli BL21/pET21-g的GDH比活力相差很大,分别为195 U/mg和2.43 U/mg,携带质粒pET21-g大肠杆菌的比活力明显低于pET28a-G。表明不同质粒对不同基因的表达具有不同影响,且质粒pET28a单独表达两种目的蛋白均优于pET21,所以选择pET28a作为单质粒共表达和融合表达的载体。
2.2 不同共表达策略对LDH和GDH表达的影响 不同的共表达策略对目的酶表达量以及不同酶之间表达比例都存在差异,从而导致双酶协同反应效率的差异。为获得高效不对称还原制备L-叔亮氨酸的重组催化剂,分别采用3种不同的共表达策略构建获得6株重组菌,分别为顺序不同的单质粒共表达、融合表达以及2种酶分别在不同质粒上的双质粒共表达。
蛋白电泳图表明(图 1),6株重组菌均表达出所需目的蛋白,但他们的表达量以及两酶之间的比例存在差别。基因顺序不同的融合表达均获得目标大小约74 kDa的蛋白条带,由于融合表达是通过Linker连接,所以2种酶量比例为1:1。单质粒不同串联顺序共表达的2种蛋白,在启动子后上游基因的表达量明显高于下游基因,据报道,上游基因的终止子与下游基因的启动子之间的距离可能会对下游基因的表达产生影响[18]。两种双质粒共表达菌株表达的GDH表达量均高于LDH表达量,与表达质粒的组合无关。
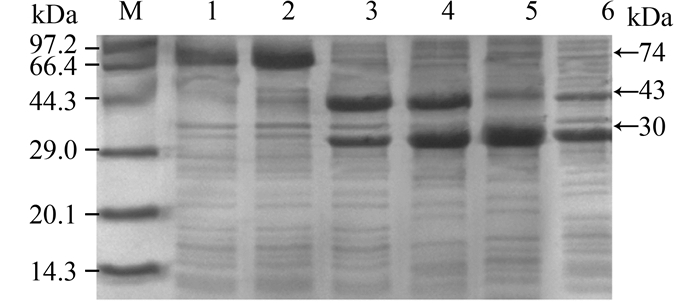 |
| 图 1. 3种共表达方式的重组菌株表达产物SDS-PAGE电泳分析 Figure 1. SDS-PAGE analysis of expression of recombinant strains from three different co-expression strategies. M: protein marker; lane 1: E. coli BL21/pET28a-L-Linker-G; lane 2: E. coli BL21/pET28a-G-Linker-L; lane 3: E. coli BL21/pET28a-L-AS-SD-g; lane 4: E. coli BL21/pET28a-G-AS-SD-l; lane 5: E. coli BL21/pET21-l pET28a-G; lane 6: E. coli BL21/pET28a-L pET21-g. |
| 图选项 |
酶活研究表明(表 2),LDH在3种不同共表达策略中的差异性不大,均能正常表达;而GDH的表达差异较大,甚至没有GDH活性。融合表达质粒pET28a-L-Linker-G和pET28a-G-Linker-L表达融合蛋白的LDH酶活正常,但确丧失了GDH活性,据报道,来源于Bacillus sp.的GDH为四聚体[19],在融合LDH的过程中,可能由于空间位阻的影响,使得GDH很难折叠为正确的构象。携带单质粒共表达质粒pET28a-L-AS-SD-g和pET28a-G-SD-AS-l的大肠杆菌具有相对其它表达方式更高的LDH比活力,分别为3.32 U/mg和1.87 U/mg,但两者GDH活性却分别为0和146 U/mg,可能是下游基因C端融合的His标签对LDH和GDH产生不同的影响,造成GDH错误折叠丧失酶活,却不影响LDH活性。双质粒共表达菌株E. coli BL21/pET28a-L pET21-g和E. coli/pET21-l pET28a-G的LDH活性较单质粒共表达低,与其较低的LDH表达量相符;两者GDH活性分别为1.62 U/mg和127 U/mg,其中pET21-g表达的GDH与pET28a-L-AS-SD-g一样,C端含His标签,表明C端融合的His标签极有可能影响GDH活性。
表 2. 3种共表达策略重组菌酶活对比 Table 2. Enzyme activity of recombinant strains from three different co-expression strategies
| Strains | Activity of LDH /(U/mg) | Activity of GDH /(U/mg) |
| E. coliBL21/pET28a-L-Linker-G | 1.67 | 0 |
| E. coliBL21/pET28a-G-Linker-L | 1.03 | 0 |
| E. coliBL21/pET28a-L-AS-SD-g | 3.32 | 0 |
| E. coliBL21/pET28a-G-AS-SD-l | 1.87 | 146 |
| E. coliBL21/pET21-l pET28a-G | 0.70 | 127 |
| E. coliBL21/pET28a-L pET21-g | 1.47 | 1.62 |
| In this paper, L and G represent the gene of ldh and gdh, respectively; l and g represent the gene of ldh and gdh with additional His-tag at C termini, respectively. | ||
表选项
综合对比以上3种共表达策略:融合表达过程中GDH失活,LDH表达活力也低于单质粒共表达策略;双质粒共表达策略能够成功表达GDH和LDH,但LDH表达活力低于单质粒共表达策略,GDH表达活力略低于单质粒共表达策略;单质粒共表达策略能够通过调整表达顺序调控2种酶的表达量,具有较高的GDH和LDH表达活力。
2.3 C端His标签对LDH和GDH表达的影响 pET21和pET28a质粒具有相同的T7lac启动子,其差异主要是抗性基因和His标签,pET28a在N和C端均含有His标签,而pET21质粒仅在C端含有His标签。Ledent等[20]研究发现His标签虽然能够利于蛋白纯化,但是可能影响蛋白折叠,从而抑制酶活性。为确定C端His标签是否为造成GDH酶活下降的原因,利用质粒pET21构建了2株C端不含有His标签的重组菌株E. coli BL21/pET21-L和E. coli BL21/pET21-G。蛋白电泳图表明(图 2)重组菌正常表达蛋白。C端不含His标签的重组菌LDH酶活达到6.24 U/mg,与含有His标签的重组菌接近,表明C端His标签并不会明显影响LDH的酶活性;而C端不含His标签的重组菌GDH酶活达到158 U/mg,较含His标签重组菌提高65倍,表明C端His标签极大地抑制GDH酶活力。
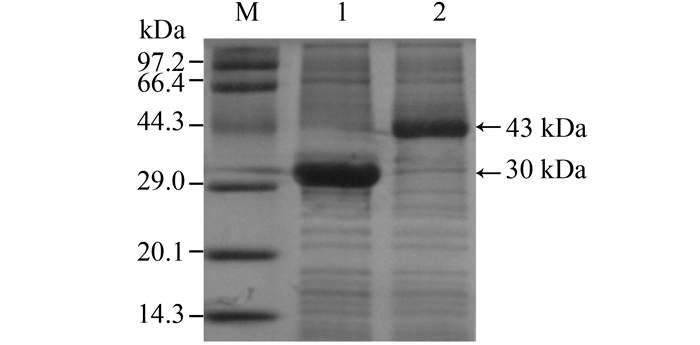 |
| 图 2. 重组菌E. coli/pET21-L和E. coli/pET21-G的SDS-PAGE电泳分析 Figure 2. SDS-PAGE analysis of E. coli/pET21-L and E. coli/pET21-G. M: protein marker; lane 1: pET21-G; lane 2: pET21-L. |
| 图选项 |
2.4 C端His标签对单质粒共表达策略LDH和GDH表达的影响 重组酶的C端His标签影响酶活性,可以通过进一步构建C端不带His标签的单质粒共表达菌株,获得具有较高LDH和GDH酶活,但具有不同表达量的重组菌。蛋白电泳(图 3)表明成功表达重组酶。酶活测定(表 3)表明,不含C端His标签的质粒pET28a-L-AS-SD-G和pET28a-G-AS-SD-L表达的LDH活力分别为3.98 U/mg和3.33 U/mg,较质粒pET28a-G-AS-SD-l表达的LDH酶活分别提高到1.8和2.1倍;GDH活力分别为104 U/mg和120 U/mg,为pET28a-G-AS-SD-l的GDH的0.82和0.71倍。
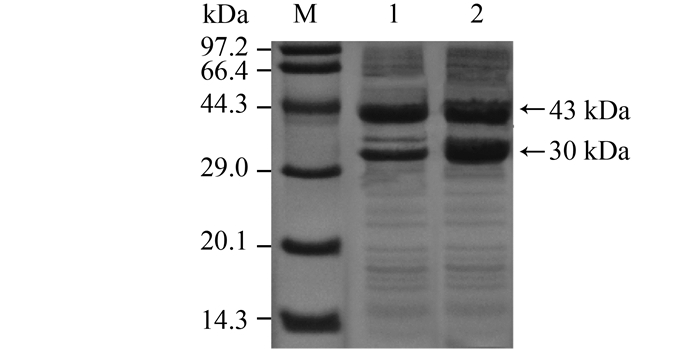 |
| 图 3. 重组菌E. coli BL21/pET28a-L-AS-SD-G和E. coli BL21/pET28a-G-AS-SD-L的SDS-PAGE分析 Figure 3. SDS-PAGE analysis of E. coli BL21/pET28a-L-AS-SD-G and E. coli BL21/pET28a-G-AS-SD-L. M: protein marker; lane 1: pET28a-L-AS-SD-G; lane 2: pET28a-G-AS-SD-L. |
| 图选项 |
2.5 酶活比例对重组菌株不对称还原TMP制备L-Tle效率的影响 利用重组菌催化TMP合成L-Tle过程中需用到2种酶作为催化剂,两酶的酶活大小和比例,以及酶催化剂存在形式,将会影响反应效率。因此本研究对具有相对较高的LDH和GDH活性,但酶活配比不同的的3株单质粒共表达菌株,在粗酶液和全细胞水平进行“一锅法”转化反应。实验结果表明(表 3),重组菌的酶活比例和催化剂形式都会对不对称还原反应效率产生影响。在相同细胞量下,LDH的酶活水平决定了转化效率的高低。在相同LDH酶活水平时,过高的GDH酶活对反应效率没有影响。粗酶液催化剂优于全细胞,因为粗酶液相比全细胞少了细胞膜的阻碍,传质效率更高,提高了反应效率。重组菌E. coli BL21/pET28a-L-AS-SD-G具有最高的LDH酶活,且GDH酶活水平能够满足辅酶再生的要求,其完全转化0.5 mol/L底物所需的菌体量最少,为15 g/L,辅酶量为0.1 mmol/L。
表 3. 重组菌转化反应 Table 3. Asymmetric conversion by recombinant strains
| Strains | Activity of LDH/(U/mg) | Activity of GDH/(U/mg) | Activity ratio of LDH to GDH | Biocatalyst | Cell amount/(g/L) | Conversion/% |
| E. coliBL21/pET28a- G-AS-SD-l | 1.87 | 146 | 1:78 | Whole-cell | 10 | 65.3 |
| Cell-free crudes a | 10 | 75.8 | ||||
| Cell-free crudes b | 32 | 99.9 | ||||
| E. coliBL21/pET28a- G-AS-SD-L | 3.33 | 120 | 1:36 | Whole-cell | 10 | 76.9 |
| Cell-free crudes a | 10 | 82.6 | ||||
| Cell-free crudes b | 18 | 99.9 | ||||
| E. coliBL21/pET28a- L-AS-SD-G | 3.98 | 104 | 1:26 | Whole-cell | 10 | 86.4 |
| Cell-free crudes a | 10 | 93.4 | ||||
| Cell-free crudes b | 15 | 99.9 | ||||
| In this table, cell-free crudes a represents the reaction in the same the cell amount; cell-free crudes b represents the reaction in the same LDH activity. | ||||||
表选项
3 讨论 利用多酶共表达实现一锅法不对称还原制备手性氨基酸的核心是获得具有高效辅酶再生能力的双功能催化剂。本研究选择在大肠杆菌表达系统中具有更高活力的葡萄糖脱氢酶与L-叔亮氨酸不对称合成关键酶亮氨酸脱氢酶进行共表达,克服了利用甲酸脱氢酶进行辅酶再生带来高细胞量的要求(表 4)。
表 4. 生物合成L-叔亮氨酸同类工作对比 Table 4. Comparison between this work and other reported biosynthesis of L-tert-leucine
| Biocatalyst | c(TMP)/ (mol/L) | Cell loading/ (g/L) | c(NAD+)/ (mmol/L) | Conversion/% | Ref. |
| Cell extract of E. coliBL21 (pET28a-Bcldh-Bsgdh) | 0.5 | 15 | 0.10 | 99.9 | This work |
| Cell extract of E. coliBL21(pRSFDuet-1-Lsldh/ pET21a-Cbfdh) | 0.5 | 40 | 0.23 | 99.9 | [14] |
| E. coliBL21 (pET28a-Esldh-Bmgdh) | 0.5 | 5a | 0.50 | 99.9 | [21] |
表选项
同时本研究比较了单质粒共表达、双质粒共表达和融合表达等3种共表达策略对亮氨酸脱氢酶和葡萄糖脱氢酶表达量和表达比例的影响。研究发现,亮氨酸脱氢酶具有较好的表达适应性,其表达水平接近;而来源于芽孢菌属的葡萄糖脱氢酶的表达不仅受到载体种类、表达顺序的影响,也受到C端His标签的抑制。通过表达策略优化获得高产亮氨酸脱氢酶和葡萄糖脱氢酶的共表达重组菌。
通过细胞和酶水平催化效率的比较研究发现,单质粒串联表达不含有C端His标签的重组菌E. coli BL21/pET28a-L-AS-SD-G为催化剂,在酶水平构建不对称反应体系转化效率最高。通过粗酶反应系统的建立,有效利用细胞内辅酶,降低了反应外加辅酶量(表 4),完全转化0.5 mol/L底物催化剂用量和辅酶用量明显下降,表明该重组菌表达的亮氨酸脱氢酶和葡萄糖脱氢酶显示出优良的双酶协同作用,具有良好的工业催化合成L-叔亮氨酸的应用价值。
参考文献
| [1] | Ager DJ, Fotheringham IG. Methods for the synthesis of unnatural amino acids.Current Opinion in Drug Discovery & Development, 2001, 4(6): 800–807. |
| [2] | Taylor PP, Pantaleone DP, Senkpeil RF, Fotheringham IG. Novel biosynthetic approaches to the production of unnatural amino acids using transaminases.Trends in Biotechnology, 1998, 16(10): 412–418DOI:10.1016/S0167-7799(98)01240-2. |
| [3] | Nugent TC, El-Shazly M. Chiral amine synthesis-recent developments and trends for enamide reduction, reductive amination, and imine reduction.Advanced Synthesis&Catalysis, 2010, 352(5): 753–819. |
| [4] | Hhne M, Bornscheuer UT. Biocatalytic routes to optically active amines.ChemCatChem, 2009, 1(1): 42–51DOI:10.1002/cctc.v1:1. |
| [5] | Woodley JM. New opportunities for biocatalysis:making pharmaceutical processes greener.Trends in Biotechnology, 2008, 26(6): 321–327DOI:10.1016/j.tibtech.2008.03.004. |
| [6] | Breuer M, Ditrich K, Habicher T, Hauer B, Ke?eler M, Stürmer R, Zelinski T. Industrielle Verfahren zur Herstellung von optisch aktiven Zwischenprodukten.Angewandte Chemie, 2004, 116(7): 806–843DOI:10.1002/(ISSN)1521-3757. |
| [7] | Constable DJC, Dunn PJ, Hayler JD, Humphrey GR, Leazer Jr JL, Linderman RJ, Lorenz K, Manley J, Pearlman BA, Wells A, Zaks A, Zhang TY. Key green chemistry research areas-a perspective from pharmaceutical manufacturers.Green Chemistry, 2007, 9(5): 411–420DOI:10.1039/B703488C. |
| [8] | Liese A, Villela Filho M. Production of fine chemicals using biocatalysis.Current Opinion in Biotechnology, 1999, 10(6): 595–603DOI:10.1016/S0958-1669(99)00040-3. |
| [9] | Yamamoto H, Mitsuhashi K, Kimoto N, Matsuyama A, Esaki N, Kobayashi Y. A novel NADH-dependent carbonyl reductase from Kluyveromyces aestuarii and comparison of NADH-regeneration system for the synthesis of ethyl (S)-4-chloro-3-hydroxybutanoate.Bioscience, Biotechnology, and Biochemistry, 2004, 68(3): 638–649DOI:10.1271/bbb.68.638. |
| [10] | Chen XX.Asymmetric enzymatic reduction of prochiral β-ketoesters by enzyme-coupled system.Master's Thesis of Jiangnan Univercity, 2012.(in Chinese) 陈星星.酶偶联法不对称还原潜手性β-酮酯类化合物的研究.江南大学硕士学位论文, 2012. http://cdmd.cnki.com.cn/article/cdmd-10295-1013129552.htm |
| [11] | Li ST, Wang M. Research on conditions of L-Tert-leucine biosynthesis by genetically engineered Escherichia coli.Pharmaceutical Biotechnology, 2009, 16(3): 202–206(in Chinese).黎舒婷, 王旻. 基因工程菌生物合成叔亮氨酸的条件研究.药物生物技术, 2009, 16(3): 202–206. |
| [12] | Geng FT, Zhao XY, Gao S. The strategy of coexpression in Escherichia coli.Letters in Biotechnology, 2007, 18(2): 339–341(in Chinese).耿风廷, 赵晓瑜, 高珊. 多基因在大肠杆菌中的共表达策略.生物技术通讯, 2007, 18(2): 339–341. |
| [13] | Li J, Pan J, Zhang J, Xu JH. Stereoselective synthesis of L-tert-leucine by a newly cloned leucine dehydrogenase from Exiguobacterium sibiricum.Journal of Molecular Catalysis B:Enzymatic, 2014, 105: 11–17DOI:10.1016/j.molcatb.2014.03.010. |
| [14] | Liu WM, Ma HM, Luo JX, Shen WH, Xu X, Li S, Hu Y, Huang H. Efficient synthesis of L-tert-leucine through reductive amination using leucine dehydrogenase and formate dehydrogenase coexpressed in recombinant E.coli.Biochemical Engineering Journal, 2014, 91: 204–209DOI:10.1016/j.bej.2014.08.003. |
| [15] | Pazmi?o DET, Snajdrova R, Baas BJ, Ghobrial M, Mihovilovic MD, Fraaije MW. Self-sufficient Baeyer-Villiger monooxygenases:effective coenzyme regeneration for biooxygenation by fusion engineering.Angewandte Chemie-International Edition, 2008, 47(12): 2275–2278DOI:10.1002/(ISSN)1521-3773. |
| [16] | Bommarius AS, Schwarm M, Stingl K, Kottenhahn M, Huthmacher K, Drauz K. Synthesis and use of enantiomerically pure tert-leucine.Tetrahedron:Asymmetry, 1995, 6(12): 2851–2888DOI:10.1016/0957-4166(95)00377-0. |
| [17] | Ashorn P, McQuade TJ, Thaisrivongs S, Tomasselli AG, Tarpley WG, Moss B. An inhibitor of the protease blocks maturation of human and simian immunodeficiency viruses and spread of infection.Proceedings of the National Academy of Sciences of the United States of America, 1990, 87(19): 7472–7476DOI:10.1073/pnas.87.19.7472. |
| [18] | Tan S, Kern RC, Selleck W. The pST44 polycistronic expression system for producing protein complexes in Escherichia coli.Protein Expression and Purification, 2005, 40(2): 385–395DOI:10.1016/j.pep.2004.12.002. |
| [19] | Chen XJ, Ding HT, Du YQ, Lin H, Li ZL, Zhao YH. Cloning, expression and characterization of a glucose dehydrogenase from Bacillus sp.G3 in Escherichia coli.African Journal of Microbiology Research, 2011, 5(32): 5882–5888. |
| [20] | Ledent P, Duez C, Vanhove M, Lejeune A, Fonzé E, Charlier P, Rhazi-Filali F, Thamm I, Guillaume G, Samyn B, Devreese B, Van Beeumen J, Lamotte-Brasseur J, Frère JM. Unexpected influence of a C-terminal-fused His-tag on the processing of an enzyme and on the kinetic and folding parameters.FEBS Letters, 1997, 413(2): 194–196DOI:10.1016/S0014-5793(97)00908-3. |
| [21] | Li J.Genome data mining of leucone dehydrogenase and its catalytic performance in reductive amination of trimethylpyruvic acid to L-tert-leucine.Master's Thesis of East China University of Science and Technology, 2014.(in Chinese) 李静.亮氨酸脱氢酶的基因发掘、催化性能及其应用研究.华东理工大学硕士学位论文, 2014. http://xuewen.cnki.net/CMFD-1014256126.nh.html |
