高清清, 夏乐, 刘娟华, 高崧

 , 刘秀梵
, 刘秀梵 扬州大学兽医学院, 江苏省动物重要疫病与人兽共患病防控协同创新中心, 农业部禽用生物制剂创制重点实验室, 江苏 扬州 225009
收稿日期:2015-12-24;修回日期:2016-03-05;网络出版日期:2016-03-28
基金项目:国家自然科学基金(31272559,30972196,30771604,30471281);农业部公益性行业专项(201303044);中国博士后科学基金项目(2015M580477);江苏省博士后基金项目(1501076C);江苏省自然科学基金(BK20140485,BK20151308);江苏省高校自然科学基金(14KJB230001);江苏高校优势学科建设工程资助项目(PAPD);扬州大学科技创新培育基金项目(2014CXJ051,2015CXJ057)
*通信作者:高崧,Tel:+86-514-87972117;Fax:+86-514-87972218;E-mail:gsong@yzu.edu.cn
摘要: [目的]探究荚膜对肠道外致病性大肠杆菌致病作用的影响。[方法]选取负责荚膜多糖转运的基因kpsE和kpsD,利用λ Red重组系统构建APEC E058和UPEC U17荚膜缺失株E058ΔkpsED和U17ΔkpsED,并通过一系列的体内及体外试验对其生物学特性及致病性进行研究。[结果]双基因缺失株的生长速度较野生株没有明显差异,但缺失株抗血清补体杀菌能力和抗鸡巨噬细胞HD-11细胞吞噬能力显著下降。1日龄雏鸡LD50致病性试验结果显示,缺失株E058ΔkpsED和U17ΔkpsED对鸡失去致病力,而回复株毒力恢复至野生株水平;35日龄SPF鸡体内动态分布和竞争试验显示ΔkpsED缺失株在鸡体内定殖能力和竞争性生长能力显著下降,表明kpsED双基因的缺失能显著降低APEC E058和UPEC U17的致病力。[结论]荚膜与肠道外致病性大肠杆菌的致病性相关,是其重要的毒力因子。
关键词: 肠道外致病性大肠杆菌 荚膜 缺失株 致病力
Dual deletion of the kpsE and kpsD genes reduced the bacterial virulence of extraintestinal pathogenic Escherichia coli
Gao Qingqing, Xia Le, Liu Juanhua, Gao Song

 , Liu Xiufan
, Liu Xiufan Key Laboratory of Avian Bioproducts Development, Ministry of Agriculture, Jiangsu Co-Innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, College of Veterinary Medicine, Yangzhou University, Yangzhou 225009, Jiangsu Province, China
Received 24 December 2015; Revised 05 March 2016; Published online 28 March 2016
*Corresponding author: Tel:+86-514-87972117;Fax:+86-514-87972218;E-mail:gsong@yzu.edu.cn
Supported by National Natural Science Foundation of China (31272559, 30972196, 30771604, 30471281), by the Special Fund forAgroscientific Research in the Public Interest (201303044), by the General Financial Grant from the China Postdoctoral ScienceFoundation (2015M580477), by the Natural Science Foundation of the Higher Education Institutions of Jiangsu Province(14KJB230001), by the Natural Science Foundation of Jiangsu Province (BK20140485, BK20151308), by the JiangsuPostdoctoral Science Foundation (1501076C), by the Science and Technology Innovation Fund of Yangzhou University(2014CXJ051, 2015CXJ057) and by the Project Funded by the Priority Academic Program Development of Jiangsu HigherEducation Institutions (PAPD)
Abstract: [Objective] To study the role of capsule polysaccharide in pathogenesis of extraintesinal pathogenic Escherichia coli (ExPEC). [Methods] By using λ Red recombination system, we generated the capsular polysaccharide transport associated genes kpsE and kpsD double knockout mutants E058ΔkpsED and U17ΔkpsED. We then compared and analyzed the characteristics of the mutant strains and wild-type strains. [Results] The growth curves in Luria Bertani showed that the deletion of kpsED did not affect growth kinetics of the mutants. The abilities of resistance to serum and killing by chicken macrophages were significantly impaired. LD50 results showed that the double mutants completely abolished the virulence, whereas the complementation strains restored the virulence to resemble that of wild-type strains, and the colonization and coinfection model demonstrated that the deletion of kpsED led to attenuation of virulence, because the double mutant showed significantly decreased colonization compared with the wild-type strains in all organs tested in chickens. [Conclusion] These results indicated that the virulence factors encoded by capsule genes were important for the pathogenesis of ExPEC.
Key words: extraintestinal pathogenic Escherichia coli capsule mutant pathogenicity
肠道外致病性大肠杆菌(Extraintestinal patho- genic Escherichia coli,ExPEC)是一类引起人和动物肠道外感染的病原菌,主要包括:禽致病性大肠杆菌(Avian pathogenic E. coli,APEC),尿道致病性大肠杆菌(Uropathogenic E. coli,UPEC)和新生儿脑膜炎大肠杆菌(Neonatal meningitis-associated E. coli,NMEC)[1]。研究证实APEC和UPEC在血清型,种系发生型和毒力基因型等方面具有很大的相似性[2-4]。鉴于两者之间的相似性以及APEC可能由污染的禽肉传播给人[5-6],有观点指出APEC 可能是UPEC的菌株来源或者毒力基因的贮库。
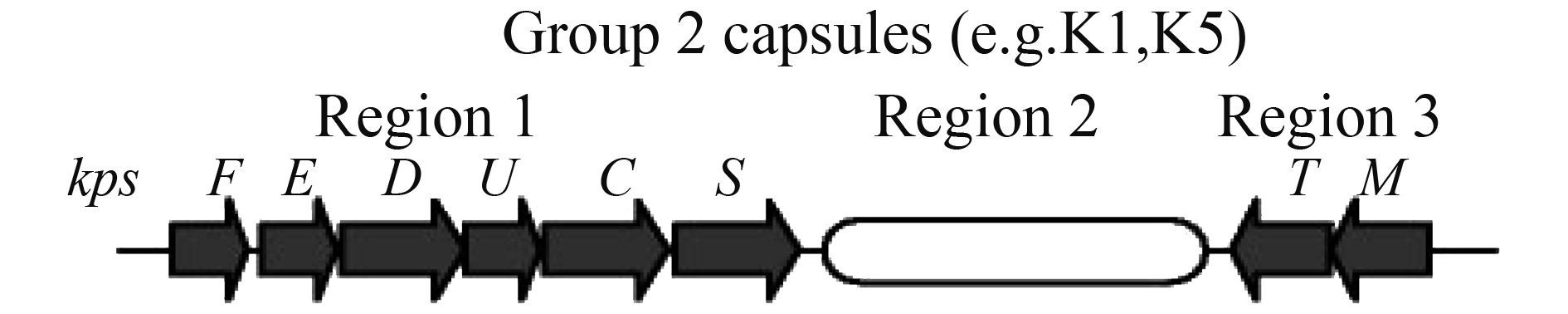
存在于细菌外层的荚膜多糖(Capsular polysa- ccharide),能直接与其他细菌或环境相互作用,保护菌体免受宿主免疫系统的侵害[7-8]。大肠杆菌可表达超过80多种的荚膜抗原(K抗原),依据其表面的荚膜多糖的血清学和化学特性的差异,可分成4个群(group)[9]。其中,2群型荚膜主要表达于肠道外致病性大肠杆菌,脑膜炎奈瑟菌和流感嗜血杆菌等病原菌中,与3群型荚膜具有相似的操纵子结构,包括编码运输和组装荚膜成分的中度至高度保守区域(如kpsDMTE)[10]。根据基因功能的不同,荚膜基因簇可分为3个区域(图 1)。区域1的基因跟荚膜多糖聚合物转运至外膜有关[11-13],区域2的基因跟荚膜N-已酰神经氨酸酶的合成、激活、聚合相关联,并且是唯一一个跟多糖抗原有关系的区域[11, 14-15],而区域3的基因负责转运唾液酸(PSA)通过胞质膜[16-17]。区域1或者区域3中基因的突变可能会使胞内的多糖分子聚合物积聚,而区域2基因的突变会影响到多糖分子聚合物的合成[11]。
 |
| 图 1. 本研究中使用菌株和质粒 Figure 1. Bacterial strains and plasmids used in this study |
| 图选项 |
2群型荚膜的组装转运途径是ATP结合盒(ATP- binding cassette,ABC)转运蛋白依赖型。细菌在细胞内膜的胞质面上,在新生肽链的非还原性末端添加葡萄糖残基聚合形成多糖。多糖聚合物转运穿过内膜导入周质,主要依赖KpsM和KpsT蛋白,这2种蛋白是典型的ABC-2型转运蛋白,其中KpsM是一种内膜蛋白,KpsT是ATP酶[18-20]。ABC转运蛋白在输出荚膜多糖过程中,还需要2种辅助蛋白,一种是细胞质膜-周质辅助蛋白KpsE,还有一种是外膜辅助蛋白KpsD[18]。依靠这2种辅助蛋白,细菌可将荚膜多糖跨周质转运至外膜。kpsE基因在K1和K5型大肠杆菌中已测序,其编码的氨基酸序列与CtrB和BexC蛋白同源,这2种蛋白分别是由流感嗜血杆菌和脑膜炎奈瑟菌中荚膜相关基因编码的[21-23]。通过对KpsE蛋白拓扑结构研究发现,其C端结构能够与细胞质膜周间质面相互作用,经化学交联法证实KpsE主要以二聚体的形式发挥作用,其二聚体化不依赖于其它Kps蛋白或荚膜的合成[24]。KpsD为一种外膜辅助蛋白,作为跨周质和外膜之间转运的桥梁,促进荚膜多糖的转运[24]。有研究报道,在空肠弯曲杆菌中,通过对kpsE基因的缺失,证实荚膜在其黏附和入侵人胚上皮细胞过程中发挥着重要作用[25]。
本研究为了探讨荚膜与ExPEC (APEC和UPEC)致病性的关系,利用λ Red同源重组系统,分别构建了荚膜转运基因kpsED双基因缺失株APEC E058ΔkpsED和UPEC U17ΔkpsED,旨在进一步了解荚膜在ExPEC致病过程中的作用及深入研究ExPEC的致病机理。
1 材料和方法 1.1 菌株和质粒 APEC E058菌株为本实验室由临床发病鸡中分离的鸡源强毒株[26],血清型为O2;UPEC U17菌株为本实验室由临床尿道感染病例中分离的人源强毒株[2],血清型未定。本研究所用的质粒和菌株见表 1。
表 1. 本研究中使用菌株和质粒 Table 1. Bacterial strains and plasmids used in this study
| Strains or plasmids | Characteristics | Source or reference |
| Strains | ||
| E058 | Wild-type avian E. coli serotype O2 | Avian |
| U17 | Wild-type strain of UPEC serotype nontypable | Human |
| E058ΔkpsED | E058ΔkpsED | This study |
| U17ΔkpsED | U17ΔkpsED | This study |
| DH5α | endA1 hsdR17(rk–mk+)supE44 thi-1 recA1 gyrA (NalR) RelA1Δ(lacIZYA-argF) U169deoR (ф80d lac Δ(lacZ) M15) | Invitrogen |
| Plasmids | ||
| pMD18-T Vector | TA Cloning Vector,Amp | TaKaRa |
| pHSG396 | Complementary vector,Cam | TaKaRa |
| pKD46 | Amp,expresses λ Red recombinase | [27] |
| pKD3 | cat gene,template plasmid | [27] |
| pCP20 | Cm,Amp,yeast Flp recombinase gene,FLP | [27] |
表选项
1.2 引物设计 根据质粒pKD3序列设计引物KCF/KCR,扩增氯霉素基因,并在引物的5′端加50 bp的kpsED上下游序列,作为同源重组的同源臂。引物KF和KR为kpsED开放阅读框上下游序列,结合CF和CR进行kpsED缺失株的鉴定。引物HF和HR扩增kpsED全长序列,用以构建回复株。引物序列见表 2。
表 2. 本试验中使用引物 Table 2. Primers used in this study
| Primers | Sequences(5′→3′) | Target genes |
| KCF | ATGTTGATAAAAGTGAAGTCTGCCGTATCCTGGATGCGTGCTCGTCTGTCTTGTGTAGGCTGGAGCTGCT | pKD3 |
| KCR | ATTGATGACGTCGCCATCTTCAAGCAGAACAGAATCAATATTGGATTCGTATGGGAATTAGCCATGGTCC | pKD3 |
| KF | AGTGAAGTCTGCCGTATCC | Upstream region of kpsED |
| KR | GTCGCCATCTTCAAGCAGA | Downstream region of kpsED |
| CF | TTGTGTAGGCTGGAGCTGCT | pKD3 |
| CR | ATGGGAATTAGCCATGGTCC | pKD3 |
| HF | CTCAAGCTTATGTTGATAAAAGTGAAGTC | kpsED |
| HR | GCTCTCGAGTTACAAAGACAGAATCACT | kpsED |
| 50 bp up- and down-stream region of kpsED are underlined. | ||
表选项
1.3 缺失株的构建 1.3.1?线性打靶DNA的制备: 以pKD3为模板,使用引物KCF/KCR扩增并回收两端带有50 bp kpsED同源臂的氯霉素基因的PCR产物,即为用于λ Red 同源重组反应的线性打靶DNA。
1.3.2?电转化及缺失株的鉴定: 将线性打靶DNA 片段电转化到含有pKD46的感受态细胞E058和U17中[28]。电转化后,菌液涂布于含氯霉素的LB 琼脂平板培养,挑取单菌落使用引物KF/KR结合CF/CR进行PCR扩增鉴定。鉴定正确的缺失株在42 ℃培养后去除pKD46质粒,并进行PCR鉴定。
1.3.3?氯霉素抗性基因的去除: 将表达FLP重组酶的辅助质粒pCP20电转化入含有氯霉素抗性基因的缺失株中,于含氨苄青霉素的LB平板上筛选阳性株,然后在普通LB平板上筛选不含氯霉素抗性基因的缺失株。
1.4 回复株的构建 用引物HF/HR从野生株基因组DNA中扩增全长kpsED片段,纯化回收并连接到pMD18-T载体上。用Hind Ⅲ和Xho I 双酶切质粒pMD18-T-kpsED获得目的片段kpsED,克隆入回复质粒pHSG396的Hind Ⅲ、Xho I酶切位点,构建重组质粒pHSG396-kpsED。按照上述电转方法将重组质粒电转入缺失株中,构建突变回复株。
1.5 菌落形态观察及遗传稳定性分析 1.5.1?菌落形态观察: 将荚膜缺失株和野生株经三区划线接种于LB琼脂平板,于37 ℃培养,观察两者的菌落形态有无明显差异。
1.5.2?遗传稳定性分析: 将获得的缺失株E058 ΔkpsED和U17ΔkpsED进行连续传代,然后通过PCR鉴定及测序验证,以分析其遗传稳定性。
1.5.3?生长曲线测定: 在相同培养条件下,分别接种等量的野生株、缺失株(调节OD600=0.05)于10 mL LB培养基中,在37 ℃恒温摇床中,以220 r/min摇振培养;连续4 h,每隔0.5 h测定培养物的OD600值。以培养时间为横坐标,OD600为纵坐标,绘制细菌的生长曲线,观察野生株与缺失株在LB培养基中的生长速度。
1.6 血清杀菌试验 分别测定野生株E058和U17,缺失株E058 ΔkpsED和U17ΔkpsED抗血清补体杀菌的能力。用1 mL含15% 甘油的PBS将LB平板上培养的细菌洗下,稀释浓度调至106 CFU/mL。取100 μL菌液混合等体积的90% SPF鸡血清,置37 ℃培养。分别取培养1、2、3和4 h时间段的菌液稀释涂平板计数,18 h后观察结果。
1.7 1日龄鸡的半数致死量(LD50)的测定 分别对野生株E058和U17,缺失株E058ΔkpsED和U17ΔkpsED,回复株ReE058ΔkpsED和ReU17 ΔkpsED对鸡的LD50进行测定。基本步骤如下:细菌分别接种于LB液体培养基中,37 ℃培养至对数生长期,4 ℃离心,沉淀的细菌用15%甘油-PBS溶液洗涤悬浮并稀释至108、107、106、105和104 CFU/mL;每个稀释度取0.1 mL菌液气囊接种1日龄SPF鸡6只,并以平板计数确定实际攻毒量,攻毒后观察7 d,并记录雏鸡存活情况。通过Reed 和 Muench的方法计算LD50结果。
1.8 鸡巨噬细胞感染试验 1.8.1?HD-11细胞的吞噬试验: 将2×105个/孔的细胞接种到24孔细胞培养板,用含10% FCS和100 U/mL氨苄青霉素、100 μg/mL链霉素的DMEM培养基在37 ℃、含5% CO2的湿润气体条件下培养获得单层细胞。在细菌接种前1.5 h,将细胞培养基更换为含10% FCS、不含抗生素的DMEM培养基。取处于对数生长期野生株和突变株,4000 r/min离心5 min,用PBS洗涤细菌,以100∶1的m.o.i比值将细菌加入细胞中。室温1000 r/min离心5 min,离使细胞的吞噬作用同步。37 ℃孵育1 h,用PBS洗涤细胞3次,加入含10% FCS和100 μg/mL离庆大霉素的DMEM培养基,37 ℃孵育1.5 h,杀灭胞外的细菌。用PBS洗涤细胞3次,加入1 mL 0.1% TritonX-100溶液裂解细胞。每孔内的1 mL细胞裂解液,取100 μL加入到900 μL的PBS,依次稀释。每个稀释度的稀释液取100 μL,涂布LB平板进行离细菌计数。每次重复3个孔。细胞对细菌的内离吞率=(吞入细胞的细菌数÷每孔接种的细菌离数)×100%。
1.8.2?胞内存活试验: 细菌感染细胞至庆大霉素杀灭胞外菌过程同1.8.1。用PBS洗涤细胞3次,加入含10% FCS和10 μg/mL庆大霉素的DMEM培养基,用于抑制胞外细菌的生长增殖。从加入低抗生素浓度的培养基时开始计时,分别在细菌增殖6、12和24 h时,加入1 mL 0.1% TritonX-100溶液裂解细胞进行胞内细菌涂板计数。细菌在胞内的存活率= (在一定时间内胞内计数的细菌数÷每孔接种的细菌数)×100%。
1.9 35日龄SPF鸡感染试验 1.9.1?体内动态分布试验: 将细菌浓度调至4×108 CFU/mL。60只35日龄的SPF鸡,随机分为4组,每组15只。每组35日龄SPF鸡分别左胸气囊接种0.25 mL的E058、U17野生株、E058ΔkpsED和U17ΔkpsED缺失株。接种24 h后,扑杀各组鸡,取心血及内脏器官中的肝脏、脾脏、肺脏、肾脏,称重后研磨,经过连续稀释后,用无抗性的LB固体培养基和氯霉素抗性培养基进行细菌计数,18 h后观察结果。动态分布试验结果用Mann Whitney test方法进行统计分析。
1.9.2?体内竞争试验: 体内竞争试验时,每组15只35日龄SPF鸡分别在左胸气囊接种0.5 mL的E058野生株与E058ΔkpsED缺失株混合菌液,U17野生株与U17ΔkpsED缺失株的混合菌液(每只鸡最终接种野生株、缺失株各108 CFU)。接种24 h后,全部扑杀,取心、肝、脾、肺、肾,称重后研磨,经过稀释后用有氯霉素抗性的和无抗性的LB固体培养基进行细菌计数,18 h后观察结果。
2 结果和分析 2.1 ΔkpsED缺失株的构建及鉴定 以pKD3为模板,引物KCF/KCR扩增出大小为1100 bp两侧带kpsED同源臂的氯霉素抗性基因片段,经胶回收纯化后得到线性打靶DNA (图 2)。
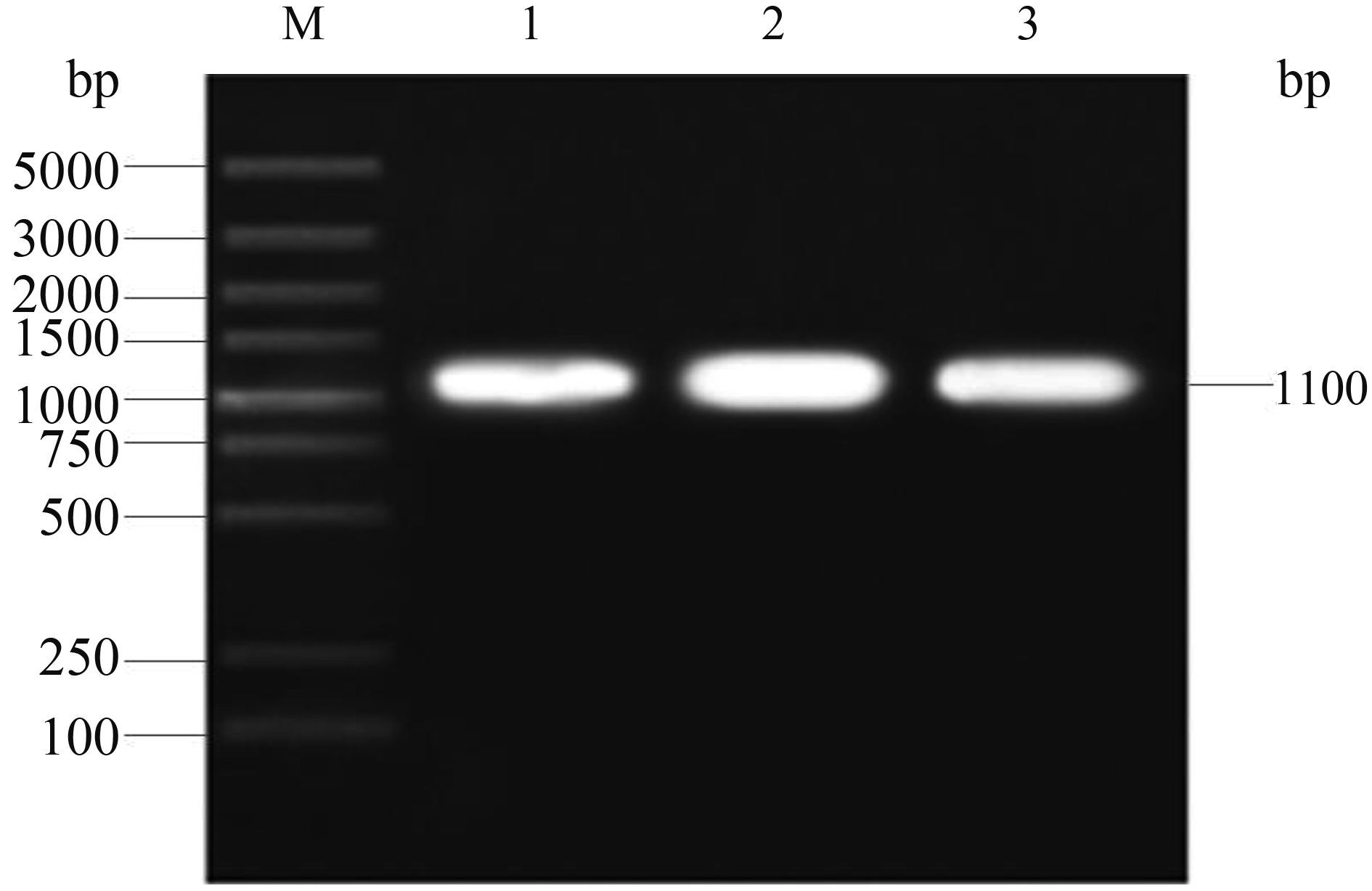 |
| 图 2. 线性打靶DNA PCR结果 Figure 2. PCR product of linear targeting DNA. M: DL5000 DNA marker (TaKaRa); lane 1, 2, 3: PCR product of linear targeting DNA. |
| 图选项 |
将线性打靶DNA分别电转化入含有pKD46的野生株E058和U17菌株中,诱导同源重组,挑取在氯霉素抗性平板上生长的阳性克隆株进行PCR 鉴定,以KF/KR引物扩增出带氯霉素抗性基因片段,对照野生株扩增片段为2500 bp,ΔkpsED::cat重组菌条带大小为1100 bp (图 3)。
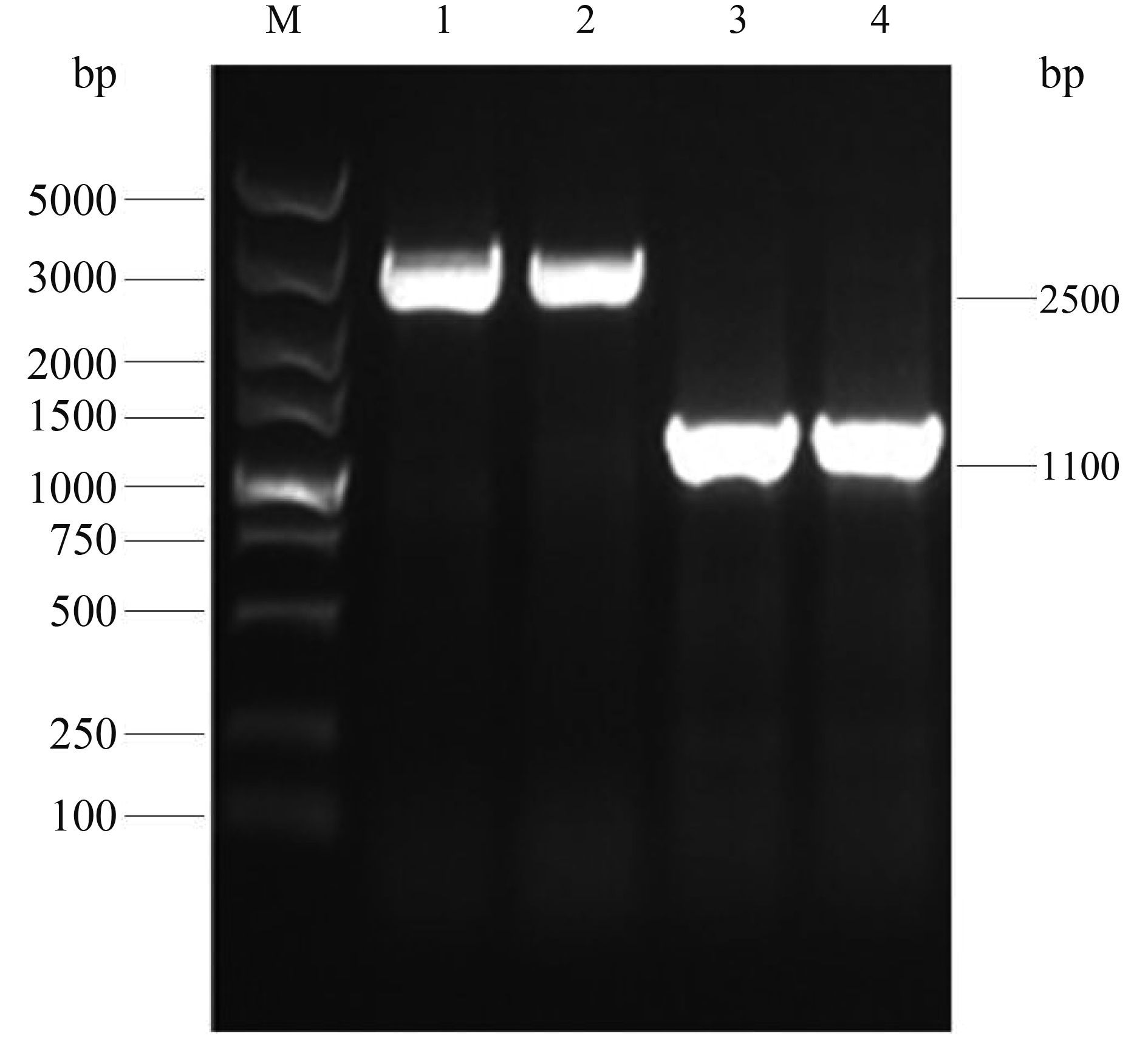 |
| 图 3. E058ΔkpsED::cat 和U17ΔkpsED::cat 重组菌PCR鉴定 Figure 3. dentification of E058ΔkpsED::cat and U17ΔkpsED::cat by PCR. M: DL5000 DNA marker (TaKaRa); lane 1, 2: the amplified kpsED fragment of E058 and U17 by primer KF/KR; lane 3, 4: the amplified kpsED-cat fragment of E058ΔkpsED::cat and U17ΔkpsED::cat by primer KF/KR. |
| 图选项 |
通过转入能够表达FLP重组酶的pCP20辅助质粒用于消除FRT位点之间的氯霉素抗性基因,以已经丢失氯霉素抗性的阳性克隆菌株为模板,以KF/KR引物进行PCR扩增鉴定,野生株扩增片段为2500 bp,重组菌大小为120 bp (图 4),表明缺失株E058ΔkpsED和U17ΔkpsED构建成功。
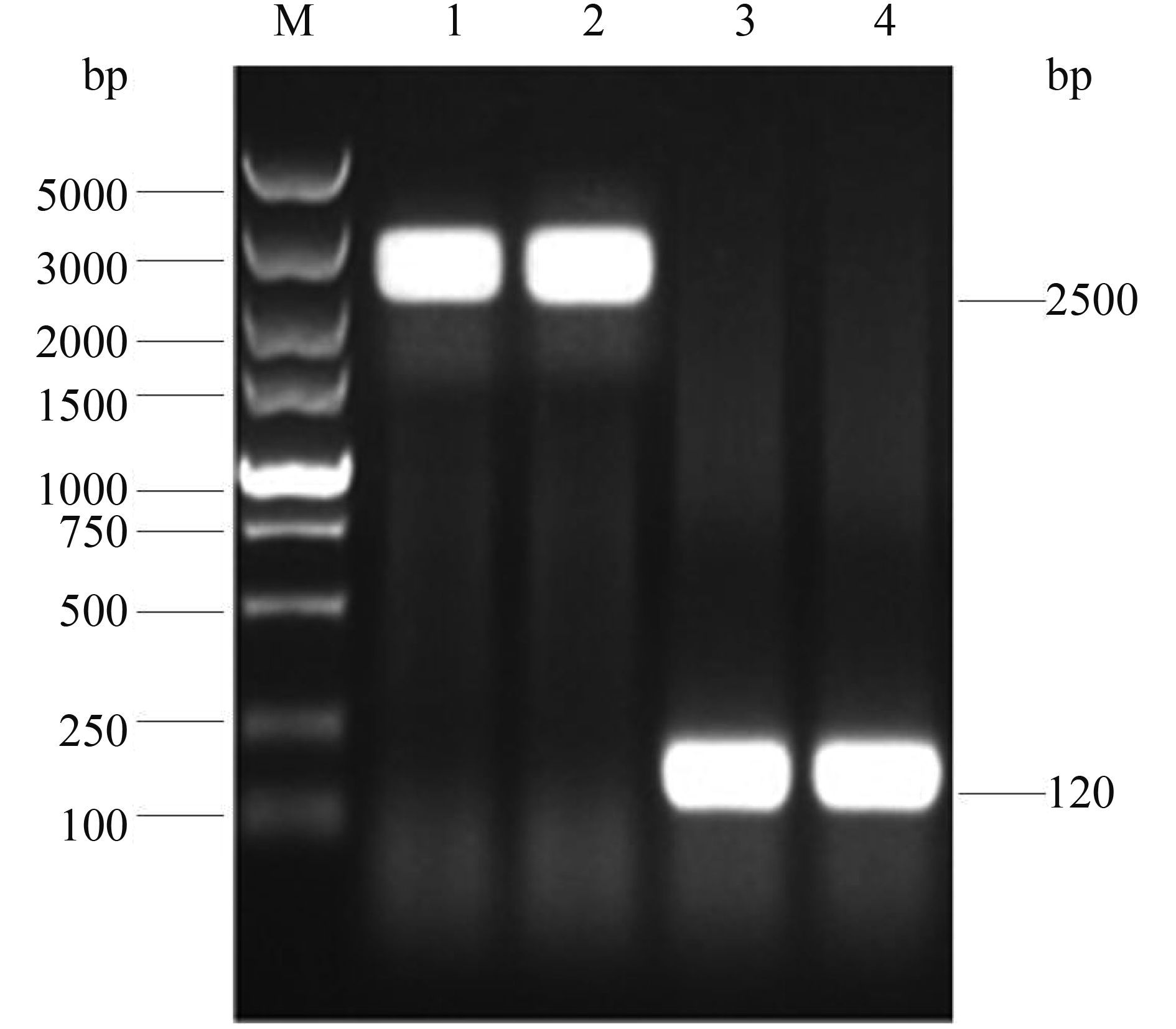 |
| 图 4. 缺失株E058ΔkpsED和U17ΔkpsED PCR鉴定 Figure 4. Identification of E058ΔkpsED and U17ΔkpsED by PCR. M: DL5000 DNA marker (TaKaRa); lane 1, 2: the amplified kpsED fragment of E058 and U17 by primer KF/KR; lane 3, 4: the amplified kpsED fragment of E058ΔkpsED and U17ΔkpsED by primer KF/KR. |
| 图选项 |
2.2 回复株的构建及鉴定 利用引物HF/HR扩增kpsED全长序列,大小为2826 bp,将该片段克隆入质粒pHSG396,通过PCR及酶切鉴定,构建了重组质粒pHSG396-kpsED。将回复质粒pHSG396-kpsED电转化入缺失株E058ΔkpsED和U17ΔkpsED中,挑取在氯霉素抗性平板上生长的阳性克隆株,用引物KF/KR进行PCR鉴定(图 5),结果表明回复株构建成功,分别命名为ReE058ΔkpsED和ReU17ΔkpsED。
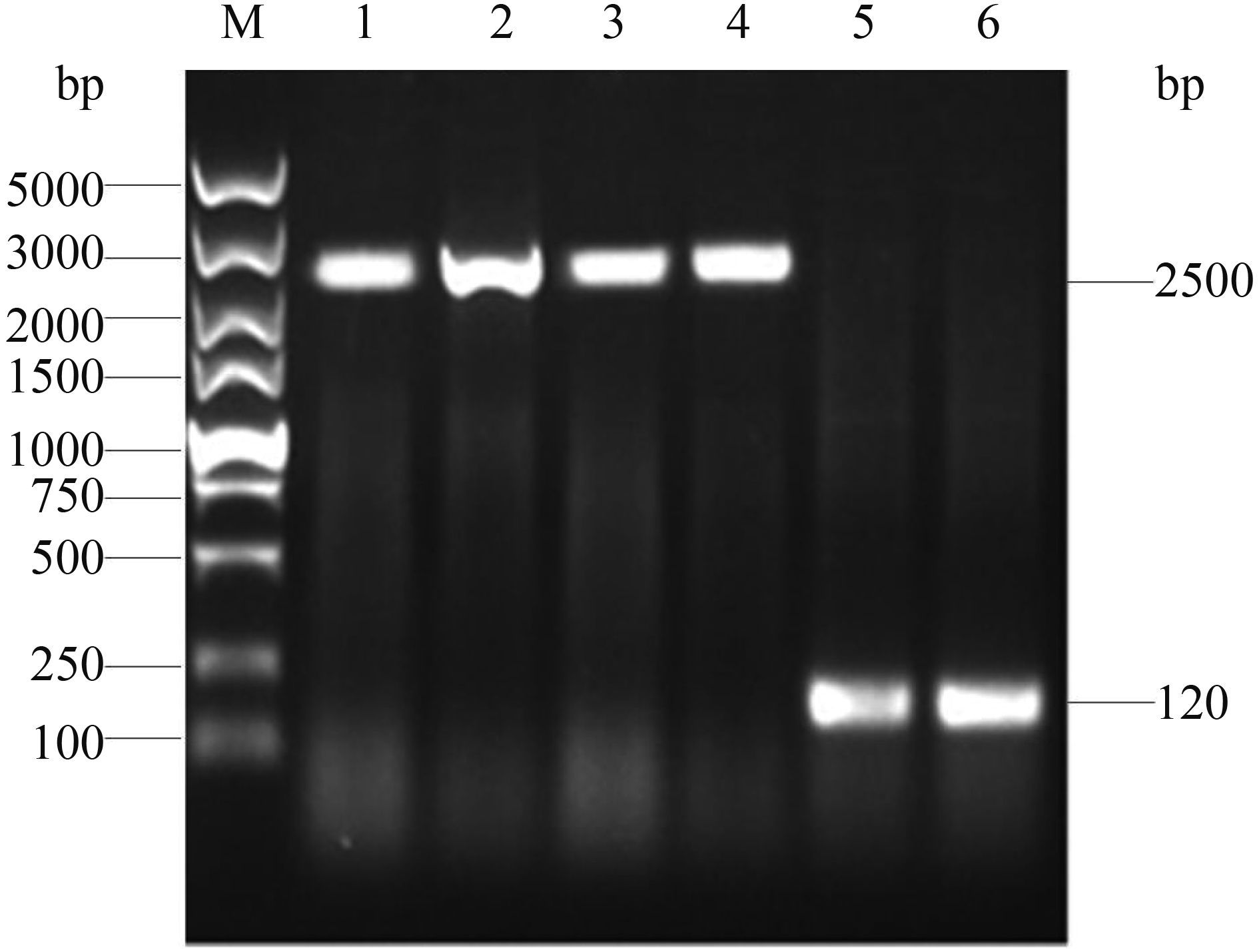 |
| 图 5. 回复株ReE058ΔkpsED和ReU17ΔkpsED PCR鉴定 Figure 5. Identification of complementation strain ReE058ΔkpsED and ReU17ΔkpsED by PCR. M: DL5000 DNA marker (TaKaRa); lane 1, 2: the amplified kpsED fragment of E058 and U17 by primer KF/KR; lane 3, 4: the amplified kpsED fragment of ReE058ΔkpsED and ReU17ΔkpsED by primer KF/KR; lane 5, 6: the amplified kpsED fragment of E058ΔkpsED and U17ΔkpsED by primer KF/KR. |
| 图选项 |
2.3 缺失株的主要生物学特性 2.3.1?菌落形态的比较: 将缺失株和野生株经三区划线接种于LB固体培养基,于37 ℃培养18 h后,均长出圆形,微凸,光滑,湿润的细小菌落(直径1-2 mm)。表明,与野生株相比,缺失株的菌落形态并没有发生明显的变化。
2.3.2?遗传稳定性分析: 将突变株连续传10代后,PCR鉴定未发生回复突变,序列测序结果正确,表明其具有良好的遗传稳定性。
2.3.3?生长曲线测定: 根据野生株E058和U17,及缺失株E058ΔkpsED和U17ΔkpsED在LB中分别培养0.5、1、1.5、2、2.5、3、3.5和4 h的OD600测定的结果,可以看出缺失株的生长速度与野生株基本一致(图 6)。
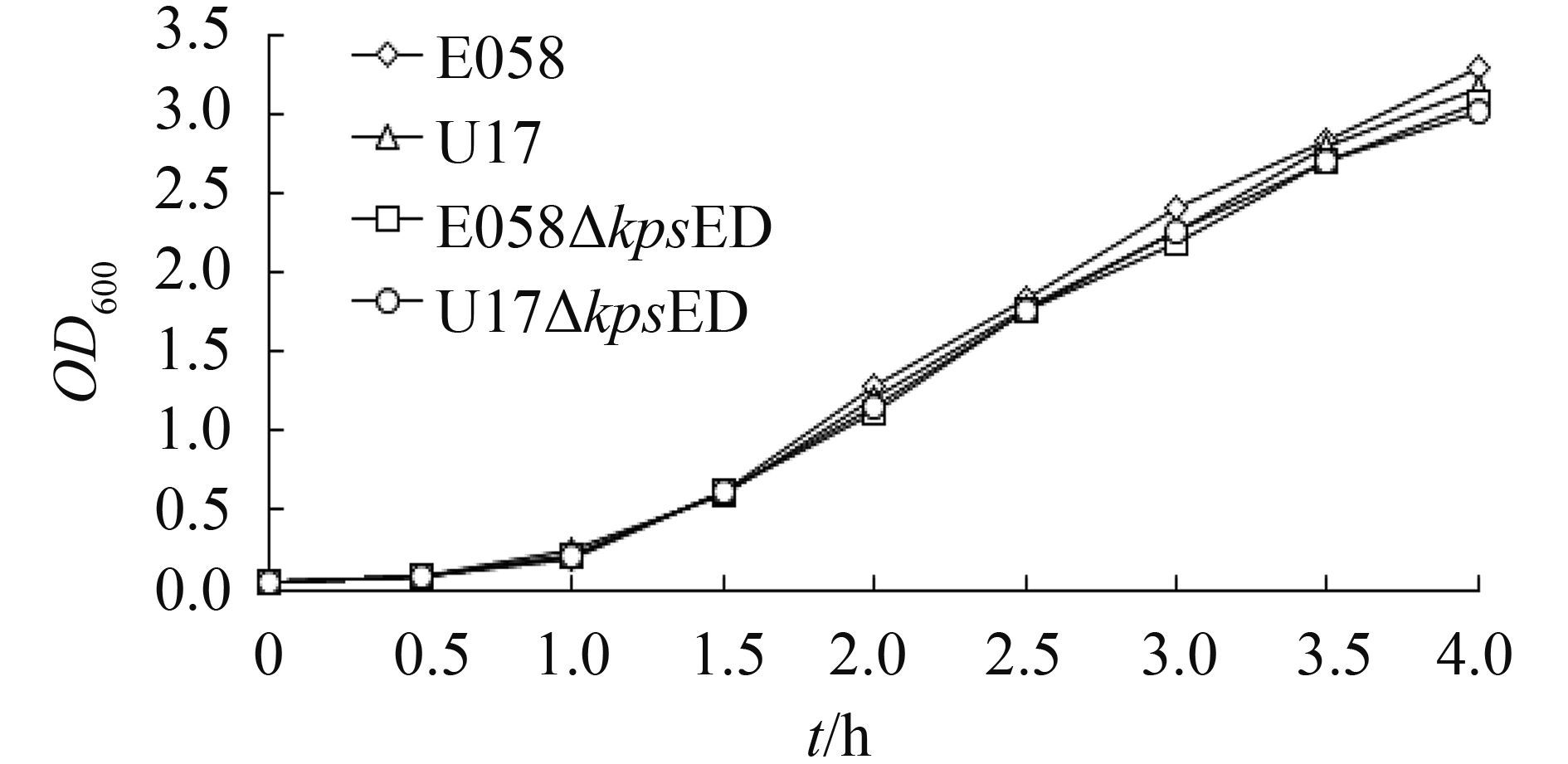 |
| 图 6. ExPEC野生株、荚膜缺失株在LB中的生长曲线 Figure 6. Growth curves of wild-type strains and isogenic mutants in LB at 37 ℃, and their optical density checked at different times. |
| 图选项 |
2.4 SPF鸡血清杀菌试验结果 血清杀菌试验结果显示缺失株E058ΔkpsED和U17ΔkpsED抵抗血清补体杀菌的能力显著下降,表明荚膜在抗血清补体杀菌方面发挥着重要的作用(图 7)。
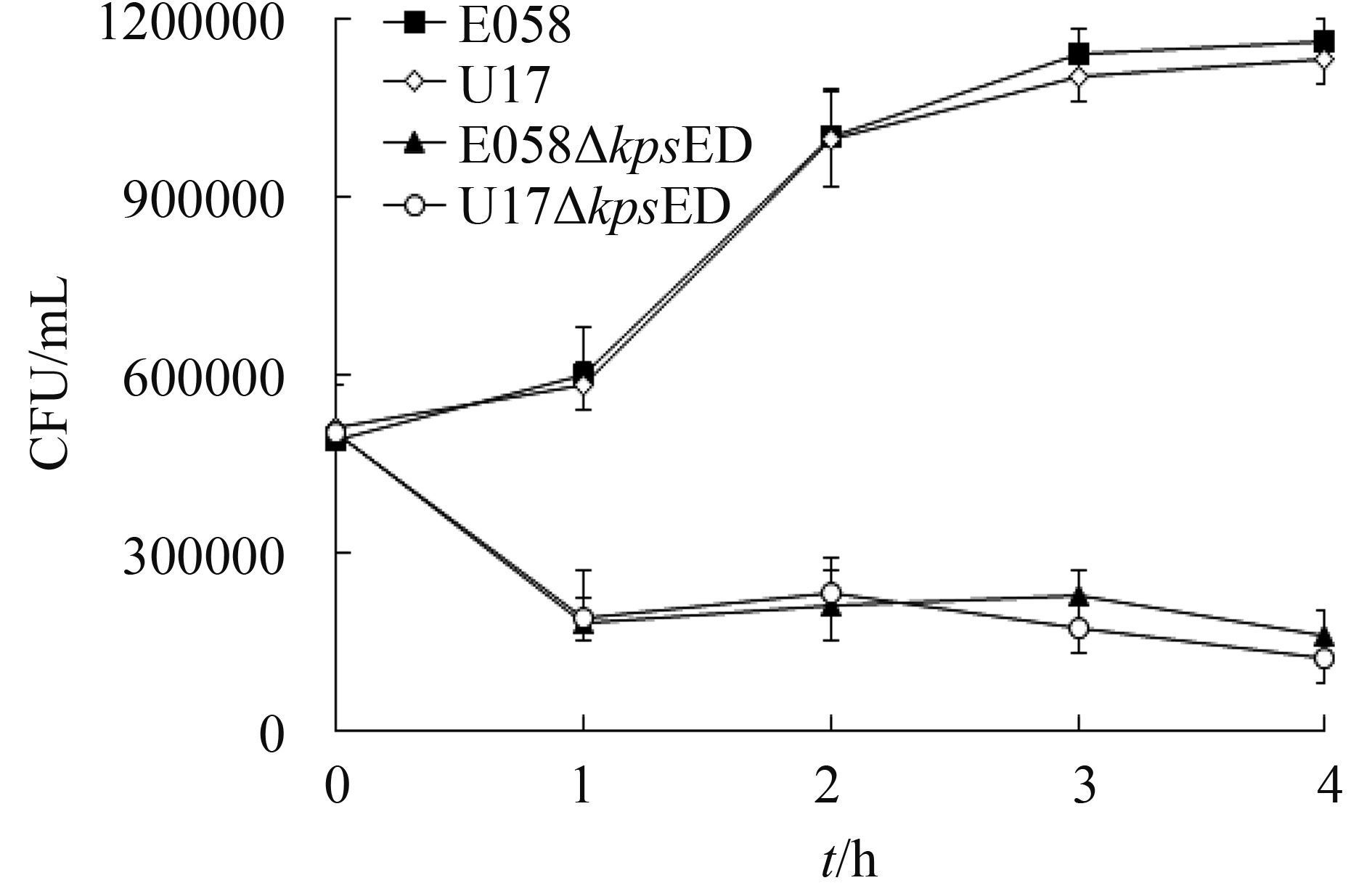 |
| 图 7. ExPEC野生株和荚膜缺失株血清杀菌试验 Figure 7. Influence of the capsule on serum resistance of wild-type strains E058, U17 and isogenic mutants. Bacteria were incubated in 90% serum obtained from SPF chicks. The graph shows means standard errors of values originated from three independent assays. |
| 图选项 |
2.5 半数致死量(LD50)的测定 利用1日龄雏鸡感染模型测定野生株、缺失株和回复株的毒力,结果表明缺失株毒力基本丧失,而回复株毒力恢复至野生株水平,见表 3。
表 3. ExPEC野生株、荚膜缺失株和回复株LD50的测定 Table 3. LD50 of wild-type strains, mutants and complementation strains
| Strains | Challenge dose (CFU) | LD50 | ||||
| 107 | 106 | 105 | 104 | 103 | ||
| APEC E058 | 6/6* | 6/6 | 5/6 | 5/6 | 4/6 | 103.5 |
| UPEC U17 | 6/6 | 5/6 | 5/6 | 5/6 | 3/6 | 103.8 |
| E058ΔkpsED | 0/6 | 0/6 | 0/6 | 0/6 | 0/6 | \ |
| U17ΔkpsED | 0/6 | 0/6 | 0/6 | 0/6 | 0/6 | \ |
| ReE058ΔkpsED | 6/6 | 5/6 | 4/6 | 4/6 | 3/6 | 103.9 |
| ReU17ΔkpsED | 5/6 | 4/6 | 5/6 | 4/6 | 3/6 | 104.2 |
| *Number of dead chicks/Number of inoculated chicks. | ||||||
表选项
2.6 细胞感染试验 2.6.1? HD-11细胞吞噬试验: HD-11细胞吞噬试验结果显示,HD-11细胞对野生株E058和U17的内吞率分别为0.24% 和0.25%,而对缺失株E058 ΔkpsED和U17ΔkpsED的内吞率显著高于野生株,分别为1.44% 和1.26% (表 4)。
表 4. 鸡巨噬细胞HD-11细胞吞噬试验 Table 4. Ingestion assays of bacteria by HD-11
| Strains | Percent of intracellular bacteria/% |
| E058 | 0.24±0.019 |
| U17 | 0.25±0.002 |
| E058ΔkpsED | 1.44±0.02** |
| U17ΔkpsED | 1.26±0.016** |
| **, Significant differences between mutants and their wild-type strains (P<0.01). | |
表选项
2.6.2?细菌胞内存活试验: 细菌胞内存活试验结果显示,与接种细胞的细菌量相比,在感染6 h、12 h 和 24 h后,野生株E058胞内存活率分别为1.51%、1.65%和1.92%,U17分别为1.26%、1.47%和1.84%。相比而言,kpsED缺失株在胞内存活能力显著下降,E058ΔkpsED在感染6 h后,存活率为1.15%,而在感染12 h 和 24 h后分别下降至0.46% 和0.12%;U17ΔkpsED感染6 h后,存活率为1.22%,而在12 h和24 h后分别下降至0.48% 和0.09% (图 8)。
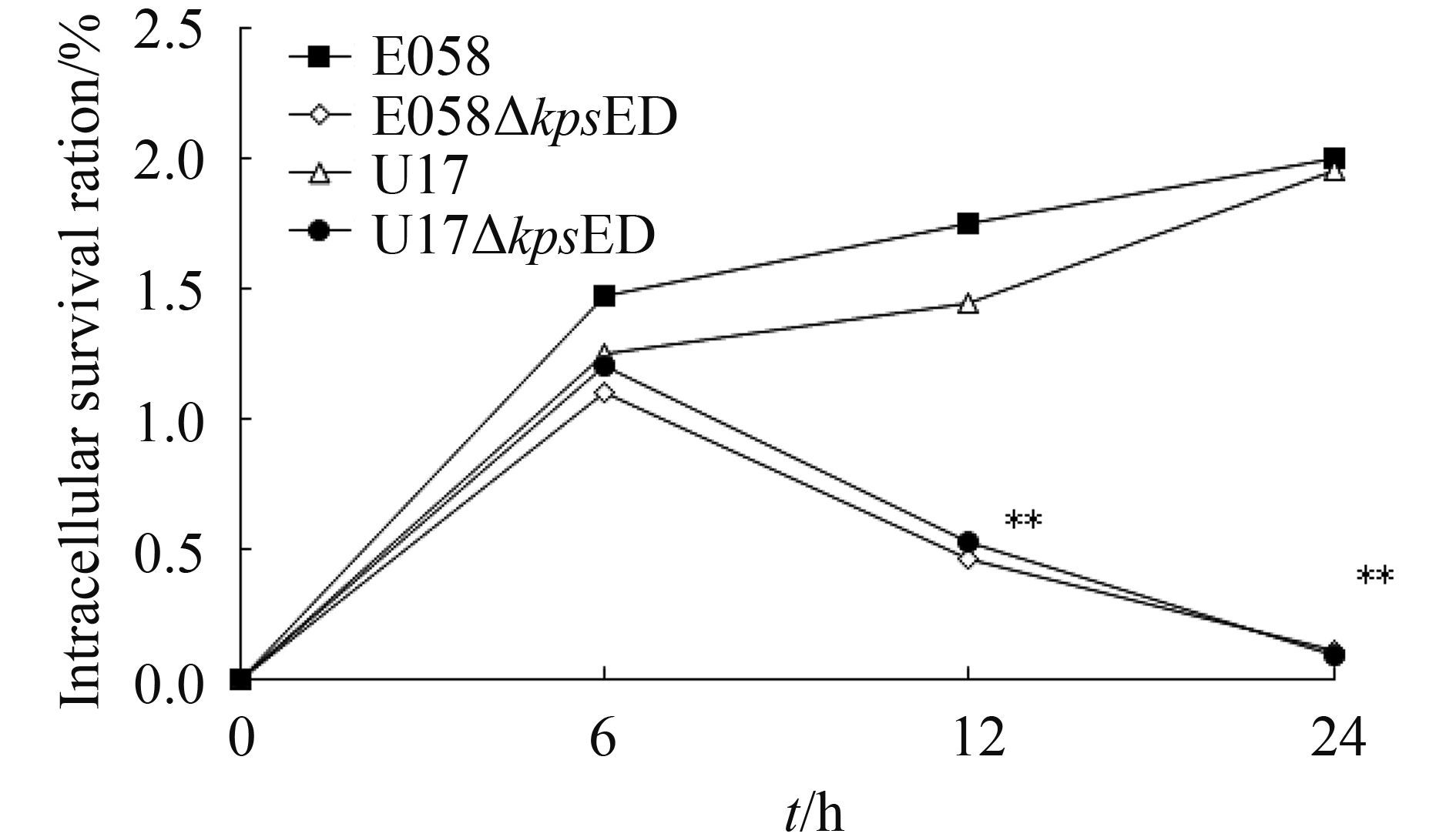 |
| 图 8. ExPEC野生株和荚膜缺失株胞内存活试验 Figure 8. Intracellular survival of bacteria in chicken macrophage HD-11 cells. Intracellular growth of wild-type strain E058 and U17, isogenic mutants E058ΔkpsED and E058ΔkpsED were compared over a 24 h period. The values represented the average data of three independent experiments. Asterisks indicate statistically significant differences (**P<0.01). |
| 图选项 |
2.7 SPF鸡体内动态分布试验结果 24 h的体内动态分布试验结果表明,与野生株相比,缺失株E058ΔkpsED和U17ΔkpsED在脏器中的带菌量显著下降,毒力被高度致弱(P<0.01) (图 9)。
 |
| 图 9. ExPEC野生株和荚膜缺失株体内动态分布试验 Figure 9. Colonization and persistence of the wild-type strain E058 (●), E058ΔkpsED (▲), U17 (▼), U17ΔkpsED (○) during systemic infection. A: blood; B: liver; C: spleen; D: lung; E: kidney. Data were presented as log10 (CFU/mL) of heart blood or log10 (CFU/g) of tissues. Horizontal bars indicated the mean values. Each data point represented a sample from an individual chicken. Statistically significances as determined by the Mann-Whitney test were indicated by asterisks (**P<0.01). |
| 图选项 |
2.8 体内竞争结果 体内竞争结果显示,kpsED缺失株与野生株竞争生长能力显著下降,其毒力明显减弱(图 10)。
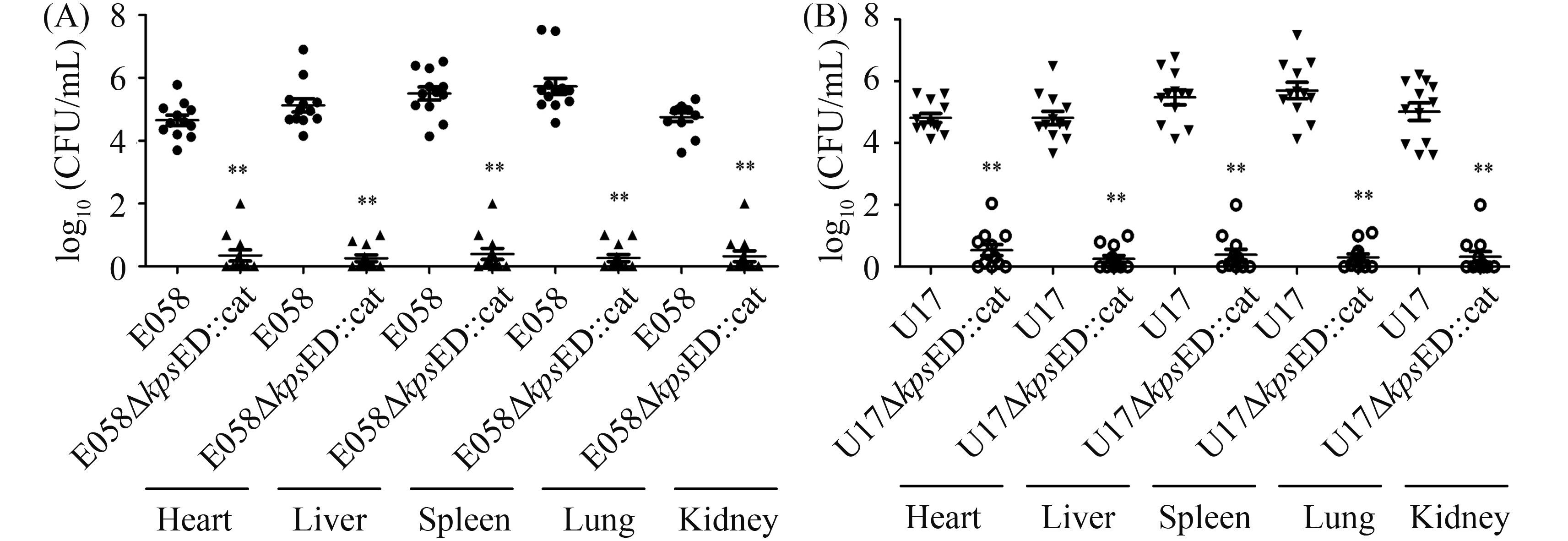 |
| 图 10. ExPEC野生株和荚膜缺失株体内竞争试验 Figure 10. In vivo competition assays: (A) E058 (●) and mutant E058ΔkpsED::cat (▲) were inoculated simultaneously; (B) U17 (▼) and mutant U17ΔkpsED::cat (○) were inoculated simultaneously. Data are presented as log10 (CFU/mL) of tissues. Horizontal bars indicated the mean log10 (CFU/mL) values. Each data point represented a sample from an individual chicken. Statistically significant differences in values between wild-type strains and their mutants were indicated with asterisks (**P<0. 01). |
| 图选项 |
3 讨论 ExPEC的致病机理比较复杂,涉及多因子的相互作用,尤其是毒力相关因子,在其致病过程中发挥着重大作用。目前,围绕着ExPEC毒力因子的研究一直是一个热点,除了已知的一些毒力因子,对潜在的毒力基因的挖掘工作也一直在延续。研究通常采用基因突变的方法,对假定毒力基因进行缺失突变,通过比较野生株和缺失株的生物学特性及致病性,了解和推测相关基因的生物学意义和功能,尤其对致病性方面的影响,进而明确其是否为真正的毒力基因。
位于细菌表面的荚膜多糖,能直接与环境或其他细菌相互作用,对细菌的生存具有重要意义。细菌不仅可利用荚膜抵御不良环境,抵抗宿主的非特异性免疫[29],而且能增强与细胞表面或细菌之间的黏附,表现出对靶细胞的专一攻击能力,还能促进生物被膜的形成和在不同环境中的定殖。有研究表明,UPEC的荚膜多糖形成的生物被膜使得其更易感染并附着于尿道[30]。尽管荚膜多糖是细菌的一种重要的毒力因子,但是对于它在ExPEC感染过程中到底扮演什么样的角色,目前仍然不清楚。因此,本研究选取了负责转运荚膜多糖至外膜的基因kpsE和kpsD,利用λ Red重组系统构建了APEC E058和UPEC U17荚膜缺失株E058ΔkpsED和U17ΔkpsED,研究其生物学特性及致病性,试图深入了解荚膜在ExPEC致病过程中发挥的作用。
宿主在抗病原菌感染中的第一道防线就是血清补体系统的杀菌作用。与共生性革兰氏阴性菌不同,ExPEC往往能够抵抗血清的杀伤作用,表明ExPEC的致病作用与其抗血清补体的杀菌作用有很大的关联[31]。因此,首先评价了荚膜基因缺失对于ExPEC菌株抗血清补体杀菌能力方面的影响,结果显示,荚膜缺失株对于鸡血清表现出高度敏感性,说明荚膜在抗血清补体杀菌方面发挥着重要作用。
ExPEC在建立感染的初期,往往还需要抵御巨噬细胞对其吞噬作用,而且在巨噬细胞内的定殖也能够帮助ExPEC逃避宿主免疫反应的清除作用,为其生存提供有利条件。研究证实,与低致病性菌株相比,高致病性肠道外病原菌更能抵抗鸡巨噬细胞的杀伤作用[32]。因此,利用鸡巨噬细胞HD-11,评价了荚膜基因kpsED的缺失对于细菌在巨噬细胞内存活作用的影响。结果显示,kpsED缺失株能够被巨噬细胞更多地吞入,而野生株能够抵抗吞噬细胞的吞入作用。同时,kpsED的缺失导致病原菌在巨噬细胞内的存活率显著下降。由于在巨噬细胞内存活,对于ExPEC来说是一种生存优势,缺失株的这种表型缺陷可能是导致了其毒力下降的原因之一。
动物感染模型可对病原菌中参与致病作用的因子进行直观的评价。通过雏鸡LD50的毒力试验证实了荚膜缺失株已经完全丧失了毒力。鸡体内动态分布试验结果显示,与野生株相比,荚膜缺失株E058ΔkpsED和U17ΔkpsED在受检脏器中定殖能力均显著下降。鸡体内竞争模型在评价突变株相比野生株毒力变化方面更为敏感,结果同样证明荚膜缺失株毒力被高度致弱,这就进一步证实荚膜多糖作为ExPEC中的一种重要的毒力因子,在细菌的致病过程中发挥了不可或缺的作用。
参考文献
| [1] | Russo TA, Johnson JR. Proposal for a new inclusive designation for extraintestinal pathogenic isolates of Escherichia coli: ExPEC.The Journal of Infectious Diseases, 2000, 181(5): 1753–1754DOI:10.1086/jid.2000.181.issue-5. |
| [2] | Zhao LX, Gao S, Huan HX, Xu XJ, Zhu XP, Yang WX, Gao QQ, Liu XF. Comparison of virulence factors and expression of specific genes between uropathogenic Escherichia coli and avian pathogenic E. coli in a murine urinary tract infection model and a chicken challenge model.Microbiology, 2009, 155(5): 1634–1644DOI:10.1099/mic.0.024869-0. |
| [3] | Mora A, López C, Dabhi G, Blanco M, Blanco JE, Alonso MP, Herrera A, Mamani R, Bonacorsi S, Moulin-Schouleur M, Blanco J. Extraintestinal pathogenic Escherichia coli O1: K1: H7/NM from human and avian origin: detection of clonal groups B2 ST95 and D ST59 with different host distribution.BMC Microbiology, 2009, 9(1): 132DOI:10.1186/1471-2180-9-132. |
| [4] | Moulin-Schouleur M, Schouler C, Tailliez P, Kao MR, Brée A, Germon P, Oswald E, Mainil J, Blanco M, Blanco J. Common virulence factors and genetic relationships between O18: K1: H7 Escherichia coli isolates of human and avian origin.Journal of Clinical Microbiology, 2006, 44(10): 3484–3492DOI:10.1128/JCM.00548-06. |
| [5] | Ojeniyi AA. Direct transmission of Escherichia coli from poultry to humans.Epidemiology and Infection, 1989, 103(3): 513–522DOI:10.1017/S0950268800030910. |
| [6] | Linton AH, Howe K, Bennett PM, Richmond MH, Whiteside EJ. The colonization of the human gut by antibiotic resistant Escherichia coli from chickens.Journal of Applied Microbiology, 1977, 43(3): 465–469. |
| [7] | 陆承平. 兽医微生物学.北京: 中国农业出版社, 2013: 15-16. |
| [8] | Zapata G, Crowley JM, Vann WF. Sequence and expression of the Escherichia coli K1 neuC gene product.Journal of Bacteriology, 1992, 174(1): 315–319. |
| [9] | Whitfield C, Roberts IS. Structure, assembly and regulation of expression of capsules in Escherichia coli.Molecular Microbiology, 1999, 31(5): 1307–1319DOI:10.1046/j.1365-2958.1999.01276.x. |
| [10] | Robbins JB, McCracken GH Jr, Gotschlich EC, ?rskov F, ?rskov I, Hanson LA. Escherichia coli K1 capsular polysaccharide associated with neonatal meningitis.The New England Journal of Medicine, 1974, 290(22): 1216–1220DOI:10.1056/NEJM197405302902202. |
| [11] | Boulnois GJ, Roberts IS. Genetics of capsular polysaccharide production in bacteria.Current Topics in Microbiology and Immunology, 1990, 150: 1–18. |
| [12] | Pazzani C, Rosenow C, Boulnois GJ, Bronner D, Jann K, Roberts IS. Molecular analysis of region 1 of the Escherichia coli K5 antigen gene cluster: a region encoding proteins involved in cell surface expression of capsular polysaccharide.Journal of Bacteriology, 1993, 175(18): 5978–5983. |
| [13] | Wunder DE, Aaronson W, Hayes SF, Bliss JM, Silver RP. Nucleotide sequence and mutational analysis of the gene encoding KpsD, a periplasmic protein involved in transport of polysialic acid in Escherichia coli K1.Journal of Bacteriology, 1994, 176(13): 4025–4033. |
| [14] | Boulnoisl GJ, Jann K. Bacterial polysaccharide capsule synthesis, export and evolution of structural diversity.Molecular Microbiology, 1989, 3(12): 1819–1823DOI:10.1111/mmi.1989.3.issue-12. |
| [15] | Roberts IS, Mountford R, Hodge R, Jann KB, Boulnois GJ. Common organization of gene clusters for production of different capsular polysaccharides (K antigens) in Escherichia coli.Journal of Bacteriology, 1988, 170(3): 1305–1310. |
| [16] | Pavelka MS Jr, Wright LF, Silver RP. Identification of two genes, kpsM and kpsT, in region 3 of the polysialic acid gene cluster of Escherichia coli K1.Journal of Bacteriology, 1991, 173(15): 4603–4610. |
| [17] | Smith AN, Boulnois GJ, Roberts IS. Molecular analysis of the Escherichia coli K5 kps locus: identification and characterization of an inner-membrane capsular polysaccharide transport system.Molecular Microbiology, 1990, 4(11): 1863–1869DOI:10.1111/mmi.1990.4.issue-11. |
| [18] | Paulsen IT, Beness AM, Saier MH Jr. Computer-based analyses of the protein constituents of transport systems catalysing export of complex carbohydrates in bacteria.Microbiology, 1997, 143(8): 2685–2699DOI:10.1099/00221287-143-8-2685. |
| [19] | Pigeon RP, Silver RP. Topological and mutational analysis of KpsM, the hydrophobic component of the ABC-transporter involved in the export of polysialic acid in Escherichia coli K1.Molecular Microbiology, 1994, 14(5): 871–881DOI:10.1111/mmi.1994.14.issue-5. |
| [20] | Pavelka MS Jr, Hayes SF, Silver RP. Characterization of KpsT, the ATP-binding component of the ABC-transporter involved with the export of capsular polysialic acid in Escherichia coli K1.The Journal of Biological Chemistry, 1994, 269(31): 20149–20158. |
| [21] | Frosch M, Edwards U, Bousset K, Krau?e B, Weisgerber C. Evidence for a common molecular origin of the capsule gene loci in gram-negative bacteria expressing group Ⅱ capsular polysaccharides.Molecular Microbiology, 1991, 5(5): 1251–1263DOI:10.1111/mmi.1991.5.issue-5. |
| [22] | Frosch M, Müller D, Bousset K, Müller A. Conserved outer membrane protein of Neisseria meningitidis involved in capsule expression.Infection and Immunity, 1992, 60(3): 798–803. |
| [23] | Kroll JS, Loynds B, Brophy LN, Moxon ER. The bex locus in encapsulated Haemophilus influenzae: a chromosomal region involved in capsule polysaccharide export.Molecular Microbiology, 1990, 4(11): 1853–1862DOI:10.1111/mmi.1990.4.issue-11. |
| [24] | Arrecubieta C, Hammarton TC, Barrett B, Chareonsudjai S, Hodson N, Rainey D, Roberts IS. The transport of group 2 capsular polysaccharides across the periplasmic space in Escherichia coli: roles for the kpsE and kpsD proteins.The Journal of Biological Chemistry, 2001, 276(6): 4245–4250DOI:10.1074/jbc.M008183200. |
| [25] | Bachtiar BM, Coloe PJ, Fry BN. Knockout mutagenesis of the kpsE gene of Campylobacter jejuni 81116 and its involvement in bacterium-host interactions.FEMS Immunology and Medical Microbiology, 2007, 49(1): 149–154DOI:10.1111/j.1574-695X.2006.00182.x. |
| [26] | Gao S, Liu XF, Zhang RK, Jiao XA, Wen QY, Wu CX, Tang YM, Zhu XB, Li C, Chen J, Cui LB, Cui HP. The isolation and identification of pathogenic Escherichia coli isolates of chicken origin from some regions in China.Acta Veterinaria et Zootechnica Sinica, 1999, 30(2): 164–171(in Chinese).高崧, 刘秀梵, 张如宽, 焦新安, 文其乙, 吴长新, 唐一鸣, 朱晓波, 李琮, 陈娟, 崔力兵, 崔洪平. 我国部分地区禽病原性大肠杆菌的分离与鉴定.畜牧兽医学报, 1999, 30(2): 164–171. |
| [27] | Datsenko KA, Wanner BL. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products.Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(12): 6640–6645DOI:10.1073/pnas.120163297. |
| [28] | Gao QQ, Wang XB, Xu HQ, Xu YY, Ling JL, Zhang DB, Gao S, Liu XF. Roles of iron acquisition systems in virulence of extraintestinal pathogenic Escherichia coli: salmochelin and aerobactin contribute more to virulence than heme in a chicken infection model.BMC Microbiology, 2012, 12(1): 143DOI:10.1186/1471-2180-12-143. |
| [29] | Howard CJ, Glynn AA. The virulence for mice of strains of Escherichia coli related to the effects of K antigens on their resistance to phagocytosis and killing by complement.Immunology, 1971, 20(5): 767–777. |
| [30] | Goller CC, Seed PC. Revisiting the Escherichia coli polysaccharide capsule as a virulence factor during urinary tract infection: contribution to intracellular biofilm development.Virulence, 2010, 1(4): 333–337DOI:10.4161/viru.1.4.12388. |
| [31] | Mellata M, Dho-Moulin M, Dozois CM, Curtiss R Ⅲ, Brown PK, Arné P, Brée A, Desautels C, Fairbrother JM. Role of virulence factors in resistance of avian pathogenic Escherichia coli to serum and in pathogenicity.Infection and Immunity, 2003, 71(1): 536–540DOI:10.1128/IAI.71.1.536-540.2003. |
| [32] | Pourbakhsh SA, Boulianne M, Martineau-Doizé B, Fairbrother JM. Virulence mechanisms of avian fimbriated Escherichia coli in experimentally inoculated chickens.Veterinary Microbiology, 1997, 58(2/4): 195–213. |
