陈婷婷1, 董战旗1, 胡楠1, 胡志刚1, 鲁成1,2, 潘敏慧1,2


1.西南大学家蚕基因组生物学国家重点实验室, 重庆 400716;
2.西南大学农业部家蚕功能基因组和生物学重点实验室, 重庆 400716
收稿日期:2015-12-22;修回日期:2016-03-31;网络出版日期:2016-05-09
基金项目:国家自然科学基金(31472152);国家蚕桑产业技术体系(CARS-22)
*通信作者:潘敏慧,Tel/Fax:+86-230-6825097;E-mail:pmh0476@hotmail.com
摘要: [目的]家蚕核型多角体病毒(Bombyx mori nucleopolyhedrovirus,BmNPV)lef-11基因作为杆状病毒高度保守的晚期表达因子之一,对病毒晚期基因的表达极其重要。因此对lef-11基因进行有效RNA干扰将提高宿主细胞对BmNPV的抗性。[方法]本文基于经典的sh-RNA-loop骨架及家蚕内源性的miRNA骨架,构建以BmNPV lef-11基因为靶标的干扰载体pIZ-shRNA1、pIZ-shRNA2和pIZ-DsRed-amiR279;分别构建基于A4、IE1、IE1-295、IE2、IE2-339、hr3A4和hsp70启动子驱动的干扰载体,用以评价不同启动子驱动的干扰载体的抗病毒效果,并对干扰载体进行优化。[结果]首先,本文通过比较miRNA-based和shRNA-based RNAi载体对同一靶基因同一位点的干扰效率,发现pIZ-DsRed-amiR279对BmNPV lef11基因的干扰效率超过90%,远优于shRNA-based RNAi载体的干扰效果;其次,通过对干扰载体进行优化,发现IE1启动子的效果最优,由其驱动的pIZ-DsRed-milef11干扰载体也是本研究中的最优干扰载体,对病毒的增殖抑制效果最为明显。[结论]对目的基因的干扰效果并非启动子的活性越高、miRNA积累得越多就越好,只有综合考虑干扰片段的选择、启动子的活性以及靶基因自身的功能等多方面的因素,才能提高干扰效率,达到干扰目的。
关键词: 家蚕 家蚕核型多角体病毒 RNA干扰 lef-11 载体优化 启动子
Optimization of RNA interference strategy for lef-11 gene of Bombyx mori nucleopolyhedrovirus
Chen Tingting1, Dong Zhanqi1, Hu Nan1, Hu Zhigang1, Lu Cheng1,2, Pan Minhui1,2


1.State Key Laboratory of Silkworm Genome Biology, Southwest University, Chongqing 400716, China;
2.Key Laboratory for Sericulture Functional Genomics and Biotechnology of Agricultural Ministry, Southwest University, Chongqing 400716, China
Received 22 December 2015; Revised 31 March 2016; Published online 09 May 2016
*Corresponding author: Tel/Fax:+86-230-6825097;E-mail:pmh0476@hotmail.com
Supported by the Project of National Natural Science Foundation of China (31472152) and by the State of Sericulture IndustryTechnology System (CARS-22)
Abstract: [Objective] Gene lef-11 is one of the high conservative late expression factors in Bombyx mori nucleopolyhedrovirus (BmNPV), and contributes to virus replication and proliferation. The effective RNA interference will increase the resistance of host cells to BmNPV. [Methods] Choosing two classical skeleton sh-RNA-loop and miRNA skeleton based on silkworm endogenous, we constructed targeted-lef-11 interference vectors: pIZ-shRNA1, pIZ-shRNA2 and pIZ-DsRed-amiR279 and optimized these vectors via different promoters. [Results] First, comparing the interference efficiency of shRNA-based and miRNA-based RNAi vectors on the same site, we found the interference efficiency of pIZ-DsRed-amiR279 on target gene was more than 90%, better than that of RNAi shRNA-based and could be applied for follow-up experiments. Second, we evaluated the antiviral effect of different interference vectors driven by A4, IE1, IE1-295, IE2, IE2-339, hr3A4 and hsp70 promoters and found that the most active promoter had less interference effect on the target gene and IE1 was the optimal screening seven promoters, which demonstrated that the accumulation of pre-miRNA was not contribute to interference. [Conclusion] The results showed that the interference effect on the target gene depended on kinds of factors, such as the interference skeleton, the activity of promoter and the function of target gene.
Key words: Bombyx mori BmNPV RNAi lef-11 vector optimization promoter
蚕丝业作为我国传统的优势产业,在国际市场上具有主导地位。然而,蚕病的发生每年都会给蚕丝业造成巨大的经济损失。其中,家蚕核型多角体病毒(Bombyx mori nucleopolyhedrovirus,BmNPV)是蚕业生产上危害最严重的病原微生物之一,其引起的家蚕核型多角体病占蚕病损失70%左右。因此,如何提高家蚕对BmNPV的抗性备受科研工作者关注。目前RNA干扰(RNA interference,RNAi)技术作为一种有效的基因操纵手段已被广泛应用于动物抗病毒治疗和品种遗传改良等多个方面,为解决这一难题带来了希望[1-3]。
将转基因技术与RNAi技术有效结合,以BmNPV病毒复制增殖必需基因为靶标,构建稳定表达的RNAi转基因系统,抑制病毒复制增殖必需基因的表达,是防控家蚕核型多角体病的一种有效策略,具有重要的应用价值。2004年Isobe等第1次报道了以BmNPV晚期表达因子lef-1为靶基因,利用RNAi技术提高了家蚕对病毒的抗性[4]。此后,RNAi被快速应用于家蚕抗病毒研究中。Kanginakudru等以ie-1基因为靶基因,构建表达ie-1双链RNA的载体,在转基因家蚕中进行RNAi,同样表现出了较强的病毒抵抗力[5]。Javaregowda等以病毒的ie-1,lef-1,lef-3和p74为靶基因,构建了针对多个病毒基因的RNAi抗病毒系统,并成功的导入家蚕实用品种中,该转基因家蚕对BmNPV的抗性提高了75%[6]。张军等利用成熟的人工miRNA 在细胞水平上靶向沉默BmNPV中的lef-11基因,发现病毒的扩散受到抑制[7]。Zhou等以ie-1,lef-1,lef-2和lef-3为靶基因对RNAi系统进行了优化,有效提高了家蚕抗BmNPV的能力[8]。
虽然RNAi技术已广泛应用于家蚕抗病毒策略,但是如何提高RNAi效果与干扰稳定性仍然是亟待解决的问题。为此,本文以BmNPV晚期表达因子11 (late expression factor 11,lef-11)为靶基因比较了不同干扰载体骨架和不同启动子驱动的干扰载体的干扰效果,进而优化lef-11基因RNAi策略,为广泛高效应用RNAi提供了一定的理论依据。
1 材料和方法 1.1 材料 1.1.1?细胞和病毒: 家蚕卵巢细胞系BmN-SWU1和BmNPV (T3株)改造病毒(带绿色荧光)由本实验室保存。
1.1.2?试剂和仪器: TC-100昆虫细胞培养基(US Biological);澳洲胎牛血清(Gibco);限制性内切酶(Kpn I、Hind Ⅲ、BspH I、Sal I和Xho I等)、连接酶、DNA Marker、Protein Marker等分子生物学操作试剂购自TaKaRa公司;胶回 收试剂盒购于Omega公司;质粒提取试剂盒(全式金公司);16 ℃连接仪(Eppendorf);荧光共聚焦显微镜(Olympus);倒置显微镜(NiKON);多功能荧光酶标仪(Promega)。
1.2 载体构建 首先本文根据文献报道选择了2个经典的shRNA loop骨架合成以lef-11为靶标的shRNA-based RNAi载体,pIZ-shRNA1和pIZ-shRNA2[7-10]。同时,构建了双荧光素酶miRNA靶标报告系统,将包含有lef-11基因完整序列的DNA片段插入到本实验室已经构建成功的pDual-Mir-Luc-Reporter报告质粒的多克隆位点。pIZ-shRNA1,pIZ-shRNA2和pIZ-DsRed-amiR279载体的构建参照张军等方法[7]。
再者,根据已有文献报道,筛选克隆了7个启动子,A4、IE1、IE1-295、IE2、IE2-339、hr3A4和hsp70,参照张军等的方法分别构建相应载体[7, 11-17]。其中,A4启动子的扩增以家蚕基因组为模板,IE1和IE1-295启动子的扩增以pDual-IE1prm-Fluc质粒为模板,IE2和IE2-339启动子以Piz-V5/His质粒为模板,hr3A4启动子以pSL1180-hr3A4质粒为模板,hsp70启动子以pSL1180-hsp70质粒为模板。各启动子引物序列见表 1,载体构建如图 1和图 2所示。
表 1. 不同启动子的PCR引物 Table 1. The different primers of promoters
| Name | Sequence (5′→3′) | Tm/℃ | Length/bp |
| A4 | F: TCATCTTGTCACACCTACATCTTAC | 60 | 749 |
| R: AACCAATCCTCTAACAACCG | |||
| IE1 | F: ATCAATGTCTTTGTGATGC | 64 | 598 |
| R: GTCGTTTGGTTGTTCACG | |||
| IE1-295 | F: GCTCCTCGTGTCCCGTT | 62 | 295 |
| R: AGTCGTTTGGTTGTTCACGA | |||
| IE2 | F: TGATAAACAATGTATGGTGC | 63 | 551 |
| R: TAAATTCGAACAGATGCTG | |||
| IE2-339 | F: ACGCTCCAAATACACTACC | 64 | 339 |
| R: TAAATTCGAACAGATGCTG | |||
| hr3A4 | F: GGCGCGCCTAGGCC | 63 | 1747 |
| R: AACCAATCCTCTAACAACCG | |||
| hsp70 | F: CTAGAATCCCAAAACAAACTG | 60 | 453 |
| R: TATTCAGAGTTCTCTTCTTGTATTC |
表选项
 |
| 图 1. 不同启动子驱动的pGL3-Basic载体的构建(改自Promega公司产品说明) Figure 1. Schematic of construction of the pGL3-Basic plasmids derived by different promoters (changed from Promega company product description). |
| 图选项 |
 |
| 图 2. 不同启动子驱动的干扰载体的构建(改自Life Technologies公司产品说明) Figure 2. Schematic of construction of the miRNA plasmids derived by different promoters (changed from Life Technologies company product description). |
| 图选项 |
1.3 细胞培养及转染 家蚕BmN-SWU1使用已添加10% FBS的TC-100培养基,在27 ℃恒温培养箱中培养,具体培养方法参照潘敏慧等方法[18-19]。细胞转染试剂为X-tremeGENE 9 DNA Transfection Reagent (Roche公司),细胞转染参考Roche操作手册进行。
1.4 双荧光素酶活测定 将构建好的由不同启动子驱动的荧光素酶基因载体质粒和内参载体质粒pIZ-Rluc分别共转染BmN-SWU1细胞,用pGL3-Basic空载与pIZ-Rluc共转染的质粒作为阴性对照。转染后48 h收集细胞,并按Dual-Glo luciferase assay kit (Promega)的标准步骤测定2种荧光素酶的活性。
1.5 病毒增殖检测 将由不同启动子驱动的干扰质粒和内参质粒pIZ-Rluc分别与荧光素酶载体质粒pFastBac-Dual-IE1prm-Fluc-lef11共转染BmN-SWU1细胞,转染24 h后加入病毒,感染病毒96 h后(hour post infection,hpi),利用荧光显微镜观察统计荧光,分析病毒感染率和细胞中多角体的产量,具体方法参照董战旗等[20]。
1.6 病毒DNA拷贝数分析 将不同启动子驱动的干扰质粒和内参质粒pIZ-Rluc分别与荧光素酶载体质粒pFastBac-Dual-IE1prm-Fluc-lef11共转染BmN-SWU1细胞,转染24 h后加入病毒,96 hpi,利用Wizard? Genomic DNA Purification Kit试剂盒提取细胞总DNA,具体方法参照试剂盒说明书。以病毒基因GP41 (GP41-F:5′-AGCGGTTTGAATCGGAGGAGAC-3′;GP41-R:5′-TTGAACGGTAACGGAATG GGAA-3′)作为定量引物,参照先前研究进行绝对定量PCR,检测病毒DNA复制水平[20]。
2 结果和分析 2.1 miRNA-based与shRNA-based RNAi载体干扰效果比较 将pIZ-shRNA1、pIZ-shRNA2和pIZ-DsRed-amiR279分别与pDual-Mir-Luc-Reporter-lef11共转染BmN-SWU1细胞后,检测Fluc/Rluc相对酶活性。结果如图 3-B所示,同一类shRNA的2个不同干扰片段对同一靶基因的干扰效果存在明显差异,pIZ-shRNA2的干扰效果高于pIZ-shRNA1。而且pIZ-DsRed-amiR279对靶基因的干扰效率超过90%,显著优于shRNA-based RNAi载体的干扰效果。这些结果表明miRNA-based RNAi较其它2个载体的干扰效果更佳。因此,miRNA-based RNAi可应用于后续实验。
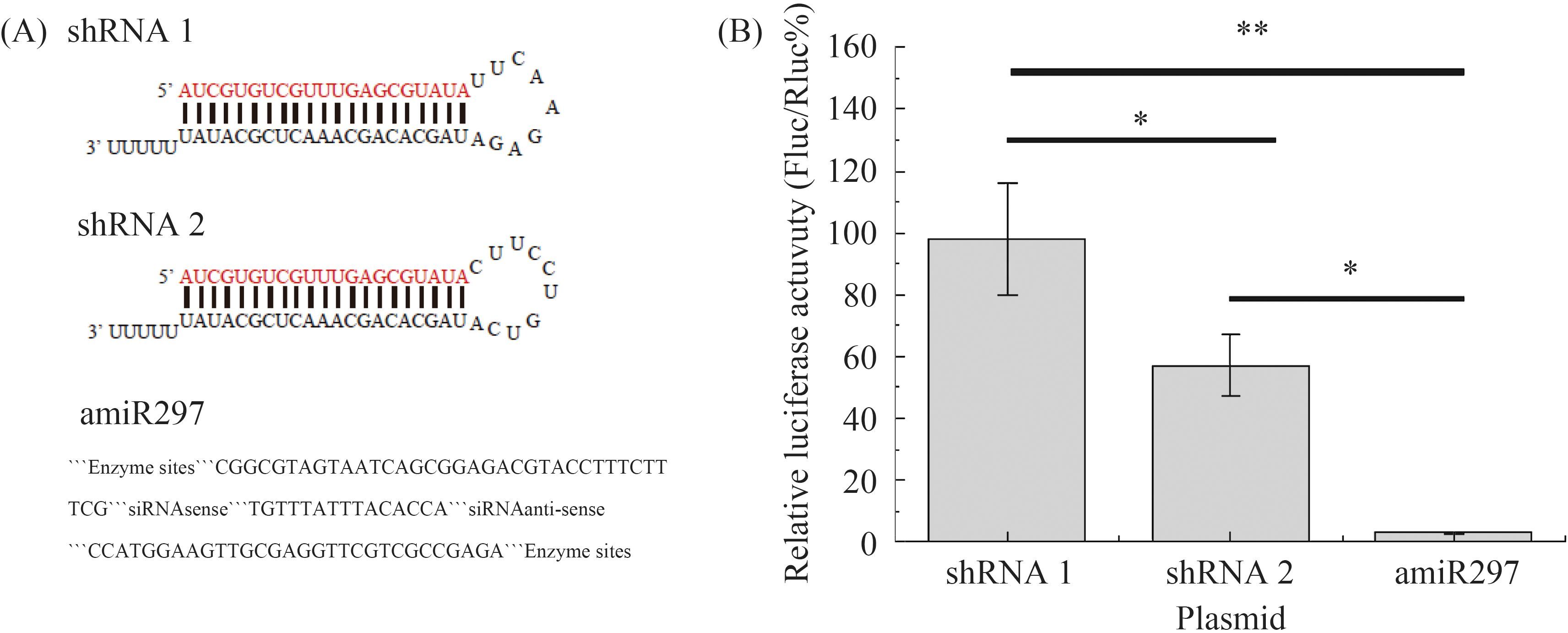 |
| 图 3. miRNA-based与shRNA-based RNAi载体对靶基因干扰效果比较 Figure 3. Effects of miRNA-based and shRNA-based RNAi vectors on target gene. Statistically significant. A: the skeleton of miRNA-based and shRNA-based RNAi interference vectors. B: the relatve interference effect of miRNA-based and shRNA-based vectors. Differences: *P<0.05, **P<0.01. |
| 图选项 |
2.2 不同启动子驱动的干扰载体对同一基因的干扰效果 2.2.1?不同启动子的活性检测: 将不同启动子驱动的荧光素酶基因载体质粒和内参载体质粒pIZ-Rluc分别共转染BmN-SWU1细胞48 h后,通过酶活性的测定来检测各个启动子的活性。结果显示,IE2启动子活性最高,达到60.2;其次是IE2-339启动子,活性是57.1;IE1启动子和IE1-295启动子活性分别是23.1和20.9;A4、hr3A4和hsp70启动子活性较低,分别是1.25、1.71和3.19 (图 4)。与pGL3相比,IE2和IE2-339具有极显著性差异,IE1和IE1-295具有显著性差异,说明本实验具有统计学意义。
 |
| 图 4. 不同启动子的活性检测 Figure 4. Detection of different promoter’s activity. Statistically significant differences. a: P<0.01, b: P<0.05, c: not significant. |
| 图选项 |
2.2.2?不同启动子驱动的干扰载体对同一基因的干扰效果比较: 为了进一步研究启动子活性不同是否对干扰载体的干扰效果产生影响,本文以BmNPV lef-11基因为靶基因构建了不同启动子驱动的干扰载体。将干扰载体转染BmN-SWU1细胞48 h后,通过酶活性测定检测其对目的基因的干扰效果。结果显示,以DsRed为对照组,由A4、IE1、IE1-295、IE2、IE2-339、hr3A4和hsp70等启动子驱动的干扰载体对lef-11基因的抑制效果分别是92.6%、97.9%、96.9%、94.8%、95.3%、96.8%和97.9% (图 5)。IE2启动子活性虽然最高,但其对lef-11基因的抑制效果并非是最好的,而启动活性较低的IE1和hsp70启动子却对lef-11基因的抑制效果最好。实验结果表明并非启动子效率越高、干扰片段的量越多对靶基因的干扰效果就越好。
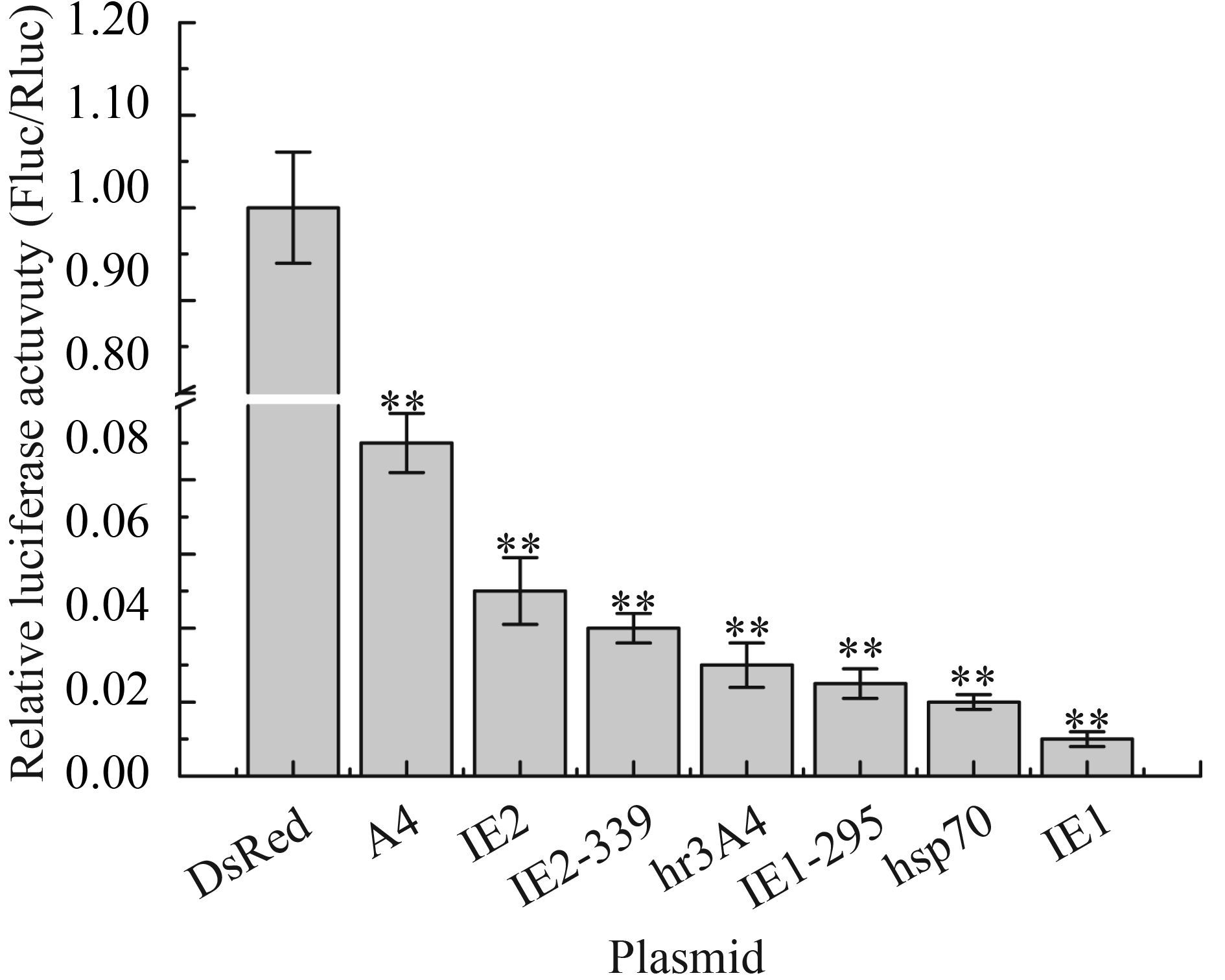 |
| 图 5. 不同启动子驱动的干扰载体对同一基因的干扰效果 Figure 5. Detection of RNAi activity of miRNA plasmids derived by different promoters. Statistically significant differences: **P<0.01. |
| 图选项 |
2.3 不同启动子驱动的干扰载体对病毒增殖复制的影响 为了选择最优干扰载体对病毒基因进行沉默,将构建的由不同启动子驱动的干扰质粒、内参质粒pIZ-Rluc、荧光素酶载体质粒pFastBac-Dual-IE1prm-Fluc-lef11共转染BmN-SWU1细胞,转染24 h后加入病毒,96 hpi,观察荧光和细胞内多角体的产量。发现病毒的增殖明显受到抑制,但是各个启动子驱动的干扰载体之间对病毒增殖复制的影响没有显著差异(图 6-A)阴性对照中用pIZ-DsRed-TAA空载体代替干扰载体。
 |
| 图 6. 不同启动子驱动的干扰载体对病毒增殖复制的影响 Figure 6. The influence of the virus replication by miRNA plasmids derived by different promoters in miRNA expression BmN-SWU1 cells. Statistically significant differences: **P<0.01. A: The results of fluorescence, green represents virus replication, red represents the expression of interference vector. B: Relative infection rate of virus, cells transfected PIZ-DsRed-TAA are took as a negative control. That is red fluorescence but not green fluorescent are regarded as positive cells that uninfected cells. C: Relative polyhedrin yield, cells transfected PIZ-DsRed-TAA are took as a negative control. That is red fluorescence but not green fluorescent are regarded as positive cells that uninfected cells. |
| 图选项 |
此外,经过生物学统计分析也得到一致的结果。首先本文统计了有红光无绿光的细胞数,发现A4、IE1、IE1-295、IE2、IE2-339、hr3A4和hsp70启动子驱动的干扰载体转染的细胞中,病毒的感染率分别是18.1%、8.34%、8.41%、11.1%、11.9%、12.1%和11.8%,病毒的感染率没有显著的差别,设定转染pIZ-DsRed阴性对照为100% (图 6-B)。其次,统计了有红色荧光细胞中的多角体数目,发现干扰后细胞中病毒的包涵体产量明显减少,但是各干扰载体之间没有显著性差异,分别为32%、26%、26%、25%、24%、19%和20% (图 6-C)。最后,为了更加精确的检测各干扰载体干扰lef-11后对病毒复制增殖的影响,进一步通过绝对定量PCR测定了干扰后病毒基因组的拷贝数,发现各启动子启动的干扰载体对病毒DNA复制的影响无显著差异,与上述结果一致(图 7)。综合图 6和图 7可发现A4、IE1、IE1-295、IE2、IE2-339、hr3A4和hsp70启动子驱动的干扰载体中IE1启动的干扰载体干扰效果更为明显。
 |
| 图 7. 不同启动子驱动的干扰载体对病毒DNA复制的影响 Figure 7. The influence on the virus in miRNA expreesion in BmN-SWU1 cells. Statistically significant differences. **: P<0.01. |
| 图选项 |
3 讨论 BmNPV是家蚕的主要病原微生物之一,每年BmNPV引起的病毒病给蚕业造成直接经济损失占整个蚕病损失的70%左右,因此迫切需要提高家蚕的抗BmNPV病毒能力。RNAi作为一种基因沉默工具,能够靶向沉默BmNPV复制增殖关键基因,将RNAi干扰载体与转基因技术结合可有效提高家蚕对BmNPV的抗性。先前的研究者主要选择了BmNPV关键基因ie-1、lef-1、lef-3、gp64、helicase、lef-11和p47等为靶标基因,发现这些基因的沉默使BmNPV增殖受到明显的抑制[4-8]。这不仅为家蚕抗病基因功能研究提供了一种快捷的研究方法,也为家蚕转基因抗性品系的培育奠定基础。
但是,目前很难在个体水平达到稳定高效的干扰效果,干扰系统的影响因素和优化条件都还有待研究。本文的研究结果为干扰载体干扰效果影响因素的研究与干扰载体的优化提供了一定依据。首先,根据张军等的报道比较了miRNA-based和shRNA-based RNAi载体对同一靶基因的同一位点的干扰效率,发现pIZ-DsRed-amiR279对靶基因的干扰效率远远超过shRNA-based RNAi载体。amiR279能够在家蚕BmN-SWU1细胞中高量表达成熟的外源miRNA,得到了与张军等相似的结果(图 3)[7]。miRNA作为内源性RNA,避免了在宿主细胞中产生免疫反应,用于干扰更有优势,而且高水平表达的shRNA可能具有细胞毒性[10, 21-23]。因此,在后续实验中采用了基于家蚕内源性miRNA骨架的干扰载体(miRNA-based RNAi载体)构建策略。
机体内miRNA的过量聚集,会造成miRNA不能正常行使功能,在应用miRNA进行干扰时,miRNA的量并非积累的越多越好。因此,可通过不同活性的启动子对miRNA的表达量进行有效的调控,从而获得高效稳定的干扰载体。本研究通过检测A4、IE1、IE1-295、IE2、IE2-339、hr3A4和hsp70等7个启动子的活性以及它们驱动的干扰载体对lef-11基因的干扰效果,发现这些启动子的活性具有显著性差异(图 4),但是活性不同的启动子驱动的干扰载体之间对lef-11基因的干扰效果没有显著性差异。这一实验结果表明干扰片段表达量的高低与干扰效果并非呈正相关,当干扰片段的表达量达到一定程度时干扰效果就已经最佳,过高的表达量并不会提高干扰效果,反而会降低干扰效果。正如结果2.3所示(图 6和图 7):高活性的IE2、IE2-339启动子驱动的干扰载体对lef-11基因的干扰效果却明显低于低活性的IE1和hsp70启动子。Lebbink等也曾报道miRNA干扰时并非启动子的活性越高,miRNA前体的量积累得越多,对目的基因的干扰效果就越好[9]。最后,本文进一步比较了不同干扰效果的干扰载体对病毒增殖复制的影响,发现不同干扰效果的干扰载体对病毒增殖复制的影响并不存在显著性差异(图 6和图 7),这可能与干扰的靶基因的功能有关。lef-11基因被敲除后病毒晚期基因表达明显受到抑制,但是却不会影响病毒早期基因的表达[7, 24-25]。所以虽然不同启动子驱动的干扰载体对lef-11基因的干扰效果有差异,但是病毒早期基因并没有受到影响,这可能是为什么lef-11干扰效率有显著差异而病毒增殖复制的能力并没有显著差异的原因之一。当然,其具体原理还有待进一步研究。
本文通过比较分析以家蚕核型多角体病毒lef-11为靶基因的miRNA的干扰载体,发现IE1启动子是筛选的7个启动子中最优化的启动子,其驱动的pIZ-DsRed-milef11干扰载体也是本研究中最优化的干扰载体,对病毒的增殖抑制效果最为明显。利用转基因技术将干扰载体注射进蚕卵中用以筛选培育稳定高效的抗病毒家蚕品系,这虽然是目前最有效的手段,但是这一技术并不成熟,还需要进行各方面的优化。本研究结果表明,在应用miRNA技术时应该综合考虑各类因素,选择最合适的干扰片段和启动子,构建最优的干扰载体,才能真正的利用好RNAi技术,为今后家蚕抗性素材的培育提供依据。
参考文献
| [1] | Boden D, Pusch O, Lee F, Tucker L, Ramratnam B. Human immunodeficiency virus type 1 escape from RNA interference.Journal of Virology, 2003, 77(21): 11531–11535DOI:10.1128/JVI.77.21.11531-11535.2003. |
| [2] | Brummelkamp TR, Bernards R, Agami R. A system for stable expression of short interfering RNAs in mammalian cells.Science, 2002, 296(5567): 550–553DOI:10.1126/science.1068999. |
| [3] | Jiang L, Xia QY. The progress and future of enhancing antiviral capacity by transgenic technology in the silkworm Bombyx mori.Insect Biochemistry and Molecular Biology, 2014, 48: 1–7DOI:10.1016/j.ibmb.2014.02.003. |
| [4] | Isobe R, Kojima K, Matsuyama T, Quan GX, Kanda T, Tamura T, Sahara K, Asano SI, Bando H. Use of RNAi technology to confer enhanced resistance to BmNPV on transgenic silkworms.Archives of Virology, 2004, 149(10): 1931–1940. |
| [5] | Kanginakudru S, Royer C, Edupalli SV, Jalabert A, Mauchamp B, Chandrashekaraiah, Prasad SV, Chavancy G, Couble P, Nagaraju J. Targeting ie-1 gene by RNAi induces baculoviral resistance in lepidopteran cell lines and in transgenic silkworms.Insect Molecular Biology, 2007, 16(5): 635–644DOI:10.1111/imb.2007.16.issue-5. |
| [6] | Subbaiah EV, Royer C, Kanginakudru S, Satyavathi VV, Babu AS, Sivaprasad V, Chavancy G, DaRocha M, Jalabert A, Mauchamp B, Basha I, Couble P, Nagaraju J. Engineering silkworms for resistance to baculovirus through multigene RNA interference.Genetics, 2013, 193(1): 63–75DOI:10.1534/genetics.112.144402. |
| [7] | Zhang J, He Q, Zhang CD, Chen XY, Chen XM, Dong ZQ, Li N, Kuang XX, Cao MY, Lu C, Pan MH. Inhibition of BmNPV replication in silkworm cells using inducible and regulated artificial microRNA precursors targeting the essential viral gene lef-11.Antiviral Research, 2014, 104: 143–152DOI:10.1016/j.antiviral.2014.01.017. |
| [8] | Zhou F, Chen RT, Lu Y, Liang S, Wang MX, Miao YG. piggyBac transposon-derived targeting shRNA interference against the Bombyx mori nucleopolyhedrovirus (BmNPV).Molecular Biology Reports, 2014, 41(12): 8247–8254DOI:10.1007/s11033-014-3726-0. |
| [9] | Lebbink RJ, Lowe M, Chan T, Khine H, Wang XY, McManus MT. Polymerase Ⅱ promoter strength determines efficacy of microRNA adapted shRNAs.PLoS One, 2011, 6(10): e26213DOI:10.1371/journal.pone.0026213. |
| [10] | McBride JL, Boudreau RL, Harper SQ, Staber PD, Monteys AM, Martins I, Gilmore BL, Burstein H, Peluso RW, Polisky B, Carter BJ, Davidson BL. Artificial miRNAs mitigate shRNA-mediated toxicity in the brain: implications for the therapeutic development of RNAi.Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(15): 5868–5873DOI:10.1073/pnas.0801775105. |
| [11] | Mangé A, Couble P, Prudhomme JC. Two alternative promoters drive the expression of the cytoplasmic actin A4 gene of Bombyx mori.Gene, 1996, 183(1/2): 191–199. |
| [12] | Masumoto M, Ohde T, Shiomi K, Yaginuma T, Niimi T. A Baculovirus immediate-early gene, ie1, promoter drives efficient expression of a transgene in both Drosophila melanogaster and Bombyx mori.PLoS One, 2012, 7(11): e49323DOI:10.1371/journal.pone.0049323. |
| [13] | Ma ZM, Gong CL. Clone and analysis of bombyx mori nuclear polyhedrosis virus suzhou strain IE-1 promoter sequence.Jiangsu Sericulture, 2001(3): 1–6(in Chinese).马志明, 贡成良. 家蚕核型多角体病毒IE-1基因启动子的克隆和序列分析.江苏蚕业, 2001(3): 1–6. |
| [14] | Wang Y, Ye XQ, Wu YL, Gui MY, Zuo ZH. Comparison of four promoters for transient expression of RFP reporter gene in cultured Bombyx mori cells (Bm-e-HNU5).Acta Entomologica Sinca, 2006, 49(2): 167–171(in Chinese).王云, 叶向群, 吴亦亮, 桂慕燕, 左正宏. 四种启动子调控RFP报告基因在家蚕细(Bm-e-HNU5)内的瞬时表达.昆虫学报, 2006, 49(2): 167–171. |
| [15] | Zhuang LF, Wei H, Lin JR, Zhong BX. Identification of Bombyx mori hsp70 promoter and its function.Chinese Journal of Cell Biology, 2011, 33(5): 503–509(in Chinese).庄兰芳, 危浩, 林健荣, 钟伯雄. 家蚕hsp70启动子的克隆及功能研究.中国细胞生物学学报, 2011, 33(5): 503–509. |
| [16] | Wang ZX, Zhao L, Li WB. Progress of plant inducible promoter.Soybean Science & Technology, 2011(3): 5–9(in Chinese).王志新, 赵琳, 李文滨. 植物诱导型启动子的研究进展.大豆科技, 2011(3): 5–9. |
| [17] | Li HP, Yao XW, Guo N, Yang XM. Experience on analyzing the promoter activity with luciferase and green florence protein.Chinese Journal of Laboratory Diagnosis, 2010, 14(7): 1017–1019(in Chinese).李慧萍, 姚兴伟, 郭楠, 杨曦明. 影响启动子活性测定的关键影响因素.中国实验诊断学, 2010, 14(7): 1017–1019. |
| [18] | Pan MH, Cai XJ, Liu M, Lv J, Tang H, Tan J, Lu C. Establishment and characterization of an ovarian cell line of the silkworm, Bombyx mori.Tissue and Cell, 2010, 42(1): 42–46DOI:10.1016/j.tice.2009.07.002. |
| [19] | Pan MH, Xiao SQ, Chen M, Hong XJ, Lu C. Establishment and characterization of two embryonic cell lines of Bombyx mori.In Vitro Cellular & Developmental Biology-Animal, 2007, 43(2): 101–104. |
| [20] | Dong ZQ, Zhang J, Chen XM, He Q, Cao MY, Wang L, Li HQ, Xiao WF, Pan CX, Lu C, Pan MH. Bombyx mori nucleopolyhedrovirus ORF79 is a per os infectivity factor associated with the PIF complex.Virus Research, 2014, 184: 62–70DOI:10.1016/j.virusres.2014.02.009. |
| [21] | Qu J, Ye J, Fang RX. Artificial microRNA-mediated virus resistance in plants.Journal of Virology, 2007, 81(12): 6690–6699DOI:10.1128/JVI.02457-06. |
| [22] | Schwarz DS, Hutvágner G, Du TT, Xu ZS, Aronin N, Zamore PD. Asymmetry in the assembly of the RNAi enzyme complex.Cell, 2003, 115(2): 199–208DOI:10.1016/S0092-8674(03)00759-1. |
| [23] | Song GQ, Sink KC, Walworth AE, Cook MA, Allison RF, Lang GA. Engineering cherry rootstocks with resistance to Prunus necrotic ring spot virus through RNAi-mediated silencing.Plant Biotechnology Journal, 2013, 11(6): 702–708DOI:10.1111/pbi.12060. |
| [24] | Todd JW, Passarelli AL, Miller LK. Eighteen baculovirus genes, including lef-11, p35, 39K, and p47, support late gene expression.Journal of Virology, 1995, 69(2): 968–974. |
| [25] | Lin GY, Blissard GW. Analysis of an autographa californica nucleopolyhedrovirus lef-11 knockout: LEF-11 is essential for viral DNA replication.Journal of Virology, 2002, 76(6): 2770–2779DOI:10.1128/JVI.76.6.2770-2779.2002. |
