刘玉川, 李宇兴, 赖永勤, 李学如

 , 黄新河, 郭泰林, 姚宁
, 黄新河, 郭泰林, 姚宁 西南交通大学生命科学与工程学院, 四川 成都 610031
收稿日期:2016-02-29;修回日期:2016-04-08;网络出版日期:2016-04-19
基金项目:国家自然科学基金(31070117);四川省科技支撑项目(2012FZ0048)
*通信作者:李学如, Tel:+86-28-87600990;E-mail:xueruli@sina.com
摘要: [目的]马链球菌兽疫亚种是工业上生产透明质酸的主要菌种,该菌能产生引起宿主细胞溶血的链球菌溶血素S(streptolysin S,SLS)毒素,因而其产品的安全性一直是人们所担心的问题。本实验的目的就是通过基因敲除的方法构建不产SLS的透明质酸生产工程菌,同时探讨溶血素sagA基因缺失对菌株透明质酸合成和其他毒力因子的影响。[方法]利用温度敏感/自杀性质粒pJR700载体系统,构建马链球菌兽疫亚种sagA基因缺失突变株;通过PCR扩增,溶血平板和SLS含量测定等方法确定sagA基因缺失;采用分光光度、SDS-PAGE和细胞毒性试验等分析方法,对野生菌株和sagA基因缺失突变菌株透明质酸含量、透明质酸分子量、溶血素Hylc、透明质酸分解酶、甘油醛-3-磷酸脱氢酶和菌体表面蛋白等相关毒力因子进行对比研究。[结果]获得了透明质酸产量提高30%而溶血活性极低的马链球菌兽疫亚种sagA基因缺失突变株。该突变株与野生菌株相比较,透明质酸分解酶活性增加而透明质酸相对分子量降低,此外,与毒力相关的表面蛋白含量、溶血素Hylc和甘油醛-3-磷酸脱氢酶活性也显著降低。细胞毒性实验结果表明,野生菌株与sagA基因缺失突变菌株的培养物上清液,对细胞活性的影响存在显著差异。[结论]在马链球菌兽疫亚种中sagA不仅是表达溶血素SLS的基因,同时sagA基因对菌株透明质酸合成、透明质酸分解酶、菌体表面蛋白、溶血素Hylc和甘油醛-3-磷酸脱氢酶等都具有调节作用。
关键词: 马链球菌兽疫亚种 基因缺失突变株 透明质酸 链球菌溶血素S 毒力因子
Construction and characterization of hemolysin S gene mutant strain producing hyaluronic acid
Liu Yuchuan, Li Yuxing, Lai Yongqin, Li Xueru

 , Huang Xinhe, Guo Tailin, Yao Ning
, Huang Xinhe, Guo Tailin, Yao Ning School of Life Science and Engineering, Southwest Jiaotong University, Chengdu 610031, Sichuan Province, China
Received 29 February 2016; Revised 08 April 2016; Published online 19 April 2016
*Corresponding author: Xueru Li, Tel:+86-28-87600990;E-mail:xueruli@sina.com
Supported by the National Natural Science Foundation of China (31070117) and by the Key Technology R & D Program of Sichuan Province (2012FZ0048)
Abstract: [Objective]Streptococcus equi subsp. zooepidemicus (GCS) is mainly used to produce hyaluronic acid (HA) in the industry. GCS secretes the hemolysis toxin (streptolysin S, SLS) that causes hemolysis in the host cells. Therefore, the safety of HA produced by GCS is concerned. We constructed an engineering strain, to produce commercial HA without SLS by knocking out sagA.[Method]The sagA of GCS was knocked out by the thermosensitive delivery vector system pJR700. The sagA mutant was identified through PCR with primers homologous to the flanking regions and SLS analysis. The yield of HA, HA molecular weight and virulence factors such as streptolysin Hylc, hyaluronate lyase, glyceraldehyde-3-phosphate dehydrogenase and cell surface proteins were determined by spectrophotometer and SDS-PAGE.[Result]We constructed successfully the in-frame deletion sagA mutant strain of GCS. In the sagA mutant, HA titer increased more than 30% than that of the wild type strain and no SLS hemolytic activity was detected. Compared to the wild type strain the sagA mutant decreased the quality of surface proteins, hemolytic Hylc activity and glyceraldehyde-3-phosphate dehydrogenase activity. The activities of hyaluronidase and cell were increased in the sagA mutant.[Conclusion]The sagA not only expressed hemolysis S but also regulated production of HA, the quality of surface proteins and activities of hyaluronidase, hemolysis Hylc and glyceraldehydes-3-phosphate dehydrogenase in Streptococcus equi subsp. zooepidemicus.
Key words: Streptococcus equi subsp.zooepidemicus gene deletion mutants hyaluronic acid streptolysin S virulence factors
透明质酸(hyaluronic acid,HA)是一种由N-乙酰氨基葡萄糖与葡萄糖醛酸为双糖单位聚合而成的酸性黏多糖,广泛的应用于临床治疗、医学研究、日化和食品添加剂等领域[1-2]。工业上主要通过动物组织提取和微生物发酵2种方法获得HA产品,目前发酵法为工业化生产HA的主要方式[1]。马链球菌兽疫亚种(Streptococcus equi subsp. zooepidemicus, GCS)是发酵法生产透明质酸的主要菌种,由于该菌有一定的致病性,因此,利用该菌发酵法生产透明质酸的安全性是人们一直担心的问题[2-4]。特别是链球菌所产生的SLS能损坏细胞膜,引起典型的细胞溶血现象[5-6],因此,通过发酵法生产的透明质酸产品,不能含链球菌SLS毒素。目前通过物理、化学诱变的方法获得不产SLS的透明质酸生产菌种[7-9],由于传统诱变方法得到的可能只是一个或者多个碱基发生变异得到的变异株,这种变异株具有遗传的不稳定性,通过基因敲除的方法可以获得遗传性能稳定的基因缺失突变株[10]。
前期我们通过温度敏感自杀性载体系统pJR700成功的构建了不含抗生素基因的马链球菌兽疫亚种血红素受体基因shr缺失突变株[10]和透明质酸产率显著提高的透明质酸合成酶双拷贝基因工程菌[11]。这里我们报道通过基因敲除方法成功构建遗传性能稳定、产SLS基因完全缺失突变菌株,该菌株的其他毒力因子如表面蛋白、溶血素Hylc、甘油醛-3-磷酸脱氢酶等显著降低,但透明质酸生产却显著提高。研究的结果为今后进一步通过基因工程方法改造透明质酸生产菌提供了一种选择。
1 材料和方法 1.1 材料
1.1.1 质粒和菌株及细胞 质粒pJR700(美国Georgia州立大学Dr. Eichenbaum实验室惠赠),卡拉霉素抗性,温度敏感;马链球菌兽疫亚种和大肠杆菌(E. coli) DH5α为本实验室保存[9]。HepG2细胞为本学院茆灿泉教授实验室惠赠。
1.1.2 培养基和菌株培养 (1)?链球菌THY液体培养基[10]:3% Todd-Hewitt,0.2% Yeast extract;(2)?THY固体培养基:THY液体培养基加2%琼脂粉;(3)?大肠杆菌(E. coli) DH5α培养基:LB (Luria-Bertani)培养基。培养方法及培养条件[10]:马链球菌兽疫亚种及其构建菌种和大肠杆菌(E. coli) DH5α均37 ℃、200 r/min摇瓶培养;根据细菌培养的需要,固体或液体培养基中加入终浓度70 μg/mL的卡拉霉素。
1.1.3 主要试剂 Todd-Hewitt (Bacto公司);限制性内切酶NheⅠ、ClaⅠ,T4连接酶,PCR试剂(宝生物工程公司);透明质酸酶、G-3-P、D-葡萄糖醛酸、小牛血清(Sigma公司),质粒提取试剂盒、PCR纯化试剂盒,胶回收试剂盒、革兰氏阳性菌DNA提取试剂盒(Omega公司)。 1.2 马链球菌兽疫亚种sagA缺失基因工程菌的构建
1.2.1 引物设计 根据GenBank数据库中报道的Streptococcus equi subsp. zooepidemicus MGCS10565全基因组序列,使用Vector NTI Advance?11软件(Invitrogen公司),在溶血素S基因(sagA)上游1039 bp和下游881 bp位点(图 1-A)设计扩增包括sagA基因在内的2080 bp DNA片段的一对引物(5′端含有内切酶ClaⅠ,下横线):YLS1(5′-AAAAAATCGAT GAAGCATAAGGCTAAGCAG-3′)和YLR1(5′-AAAAAATCGATCTAAGATGATGACACCTC AG-3′)。
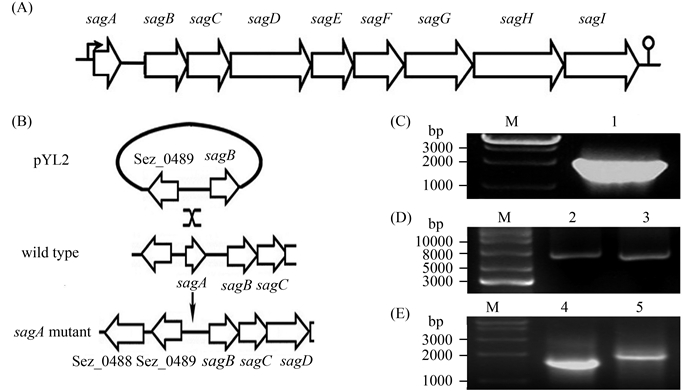 |
| 图 1. 构建马链球菌兽疫亚种sagA缺失突变菌的原理及结果 Figure 1. The strategy and result of constructing sagA mutant. A: map of the sag genetic locus in sag operon of GCS strains; B: the strategy of constructing sagA mutant; C: analysis of sagA PCR product by agarose gel electrophoresis; D: agarose gel electrophoresis analyzed the recombinant plasmid pYL1 carrying sagA fragment and plasmid pYL2 with the deleted-sagA DNA fragment; E: the PCR analysis of sagA fragment on chromosome DNA in GCS strains. M: DNA maker; lane 1: sagA; lane 2: pYL1.pJR700 with sagA; lane 3: pYL2.pJR700 carrying the inframe deletion sagA; lane 4: wild-type strain; lane 5: the deleted-sagA mutant strain. |
| 图选项 |
1.2.2 马链球菌兽疫亚种基因组DNA的提取 马链球菌兽疫亚种基因组DNA的提取方法按Omega生物技术公司革兰氏阳性DNA提取试剂盒指导进行。
1.2.3 sagA基因缺失质粒载体pYL2的构建 参考文献[10-11],以基因组DNA为模板,PCR扩增sagA,ClaⅠ酶切PCR产物和pJR700,T4连接酶连接,获得pYL1(pJR-sagA)质粒载体。由于在距sagA基因上游121 bp和下游54 bp处有NheⅠ酶切位点,用NheⅠ酶切pYL1质粒后,连接质粒片段,获得携带sagA基因缺失的温度敏感性质粒载体pYL2 (图 1-A和图 1-B)。
1.2.4 sagA基因缺失质粒载体pYL2的电转化和sagA缺失突变株的筛选 参考文献[10-11],电转化缺失质粒到马链球菌兽疫亚种感受态细胞中,在37 ℃卡拉霉素THY平板筛选重组子;在含卡拉霉素的培养基中37 ℃传代3次,再转接到不含卡拉霉素的培养基中,30 ℃传代5次,涂添加5%-7%的无菌绵羊血血平板,挑取抗生素敏感并且不产生溶血透明圈的单菌落进行下一步确定菌株的sagA基因的缺失。
1.2.5 sagA基因缺失突变菌的确定 以马链球菌兽疫亚种野生菌株和上述初步确定的不产溶血透明圈的溶血缺失突变菌基因组DNA为模板,以YLS1和YLR1为引物,进行PCR扩增,比较PCR扩增片段,确定不产溶血透明圈的单菌落染色体DNA上sagA基因的缺失。 1.3 sagA缺失突变菌与野生菌SLS含量的测定 参照文献[12]介绍的方法,过夜培养液体菌种按10%接种量转接到THY培养基(含有10%的小牛血清),37 ℃摇瓶培养8 h取菌液5 mL,7500 r/min离心10 min,上清液用0.25 μm滤膜过滤除菌,备用。将兔血血细胞200 r/min离心2 min,用生理盐水洗血细胞沉淀物3次,再用生理盐水稀释成0.8%血细胞溶液,取制备好的细菌过滤液500 μL加500 μL生理盐水稀释,加入终浓度为5 mg/mL的HYLC活性抑制剂(胆固醇),再加入500 μL 0.8%的红细胞,37 ℃孵育1 h,1000 r/min离心5 min去除未破碎的红细胞,取上清液,在分光光度计540 nm处,测光吸收值(OD540)。
1.4 sagA基因缺失突变菌遗传稳定性及缺失突变回复菌株的构建 将sagA基因缺失突变菌株在斜面传代10次以后,检测突变株溶血透明圈和按1.3介绍的方法测定溶血素SLS活性。
sagA基因缺失突变株回复菌株构建参考文献[13]进行,将pYL1质粒电转到sagA基因缺失突变株,在37 ℃含5%-7%的绵羊血的卡拉霉素THY平板筛选回复菌株,将产生溶血透明圈的单菌落进行SLS溶血素活性测定和PCR检测菌株含有野生和缺失sagA基因的DNA条带。
1.5 马链球菌兽疫亚种sagA缺失突变菌与野生菌毒力因子的测定
1.5.1 透明质酸产量和分子量的测定 将过夜培养液体菌种按10%接种量转接到THY培养基中,37 ℃摇瓶培养8 h,取培养菌液20 mL野生菌液和sagA基因缺失突变株菌液,5000 r/min离心10 min,取上清液10 mL加入2.3倍无水乙醇(23 mL)混匀,5000 r/min离心10 min,沉淀用1 mL ddH2O溶解,采用Bitter-Muir法[14]测定菌株透明质酸产量; 参照文献[15-16]介绍的方法测定HA的平均分子量,用内径为0.5 mm的乌氏粘度计,在25 ℃下测定重复3次,并根据公式(1)计算的平均分子量。
 | (1) |
1.5.2 菌体表面蛋白的测定 利用热酸法[17-18]提取马链球菌兽疫亚种的表面蛋白即:将过夜培养液体菌种按10%接种量转接到THY培养基中,37 ℃摇瓶培养18 h,取培养菌液10 mL,4000 r/min离心10 min收集菌体,用pH 7.2浓度为10 mmol/L的PBS缓冲液洗涤菌体2次,用PBS缓冲液10 mL重新悬浮菌体,用盐酸调悬浮液pH至2.5。95 ℃水浴15 min,冷却至室温后将pH调至中性,12000 r/min离心5 min收集上清。用取20 μL上清液与上样缓冲液混合液用SDS-PAGE电泳检测。
1.5.3 菌体溶血素Hylc的测定 Hylc测定方法与SLS类似,由于Hylc对氧敏感,Hylc测定需在半胱氨酸终浓度20 mmol/L还原条件进行,同时加入终浓度0.05 mg/mL台盼蓝抑制SLS活性。在制备好的细菌过滤液500 μL中加500 μL生理盐水稀释,按浓度要求加入半胱氨酸和台盼蓝后,室温放置10 min,再加入0.8%红细胞悬浮液,后续方法同SLS。
1.5.4 菌体透明质酸分解酶(Hyl)的测定 采用对二甲基氨基苯甲醛测定透明质酸分解酶酶活的方法[19]。将过夜培养液体菌种按10%接种量转接到THY培养基中,37 ℃摇瓶培养8 h,取培养菌液7500 r/min离心5 min收集菌体,超声破碎细胞,0.1 mol/L的乙酸缓冲液(pH 4)重悬,7500 r/min离心5 min去除菌体,取上清100 μL与100 μL浓度为0.04%底物HA混合,加200 μL乙酸缓冲液混匀,37 ℃孵育1 h。加入100 μL 0.4 mol/L的NaOH溶液终止反应,冰浴至冷却,加入100 μL硼酸缓冲液(pH 9.1)混匀,100 ℃沸水浴3 min后,冰浴冷却。再加入0.9 mL的对二甲基氨基苯甲醛溶液,混匀,37 ℃孵育20 min,放入水中冷却。分光光度计测定585 nm处OD值。
1.5.5 菌体甘油醛-3-磷酸脱氢酶(GAPDH)的测定 参照文献[20]介绍的方法,将过夜培养液体菌种按10%接种量转接到THY培养基中,37 ℃摇瓶培养6 h达到对数末期,将菌液7500 r/min离心5 min,收集菌体沉淀,然后用PBS洗2次菌体沉淀,再用PBS调整菌体悬浮液OD600为1。取1 mL菌体悬浮液加入600 μL酶反应液(由pH 7.4的50 mmol/L Tris-HCl,4 mmol/L NaH2PO4,4 mmol/L NAD,4 mmol/L G-3-P组成),混匀室温5 min,离心取上清在OD340测定。
1.5.6 HepG2细胞毒性实验 参考文献[21-22]稍作修改,HepG2细胞用新鲜培养基(RPMI1640,10% FBS,1%青霉素,1%链霉素,3%谷氨酰胺)复苏及传代培养。接种浓度为1×105/mL HepG2细胞于24孔板中,每孔1 mL,37 ℃、5% CO2过夜孵育。将过夜培养的马链球菌兽疫亚种野生菌株和突变菌株培养液按10%接种量转接到THY培养基中,37 ℃摇瓶培养8 h,用培养基调整菌液到相同细胞单位,然后取相同体积的培养菌液,4 ℃、7500 r/min离心10 min,0.22 μm滤器过滤取上清备用。生长为单层的细胞板用无血清PRMI1640洗2次,每孔加900 μL新鲜细胞培养基,然后分别加入细菌培养基(作对照)、野生菌株和sagA突变菌株培养上清液100 μL,37 ℃、5% CO2孵箱中培养,于24、48、72 h终止培养,弃孔内培养液加入100 μL 0.2%结晶紫染2 min,弃孔内液体,用PBS液洗3遍,加入100 μL 1%的SDS液,37 ℃裂解30 min,酶标仪630 nm处测定OD值。 1.6 数据处理及分析方法 所有数据重复3次,实验数据的处理与作图使用IBM SPSS Statistics 20软件完成,采用t检验得到显著性。
2 结果和分析 2.1 马链球菌兽疫亚种sagA缺失基因工程菌的构建 生物信息分析GenBank数据库中Streptococcus equi subsp. zooepidemicus菌株基因组序列中表达链球菌溶血素S的基因(sagA)定位与结构显示,马链球菌兽疫亚种与目前研究的比较清楚的化脓性链球菌溶血素sagA基因相似,溶血素S基因与其后边的sagB、sagC、sagD、sagE、sagF、sagG、sagH和sagI共同组成sag操纵子(图 1-A)。不同实验室所研究的结果证实,在化脓性链球菌中,溶血素sagA基因缺失导致菌株失去溶血活性[5-6, 23]。为了构建无溶血活性的马链球菌兽疫亚种透明质酸生产菌,我们以马链球菌兽疫亚种基因组DNA为模板,通过PCR扩增获得了包括sagA基因在内的2080 bp DNA片段(图 1-C),将该片段连接到温度敏感自杀性载体系统pJR700,获得携带sagA基因的质粒pYL1(图 1-D),由于2080 bp DNA片段sagA基因上游121 bp和下游54 bp处含有NheⅠ内切酶酶切位点,用NheⅠ内切酶酶切pYL1质粒,连接含质粒的酶切片段,获得敲除sagA基因,但仍含有sagA基因上游918 bp和下游827 bp的能进行同源重组的染色体DNA片段的质粒pYL2 (图 1-D),将sagA基因缺失质粒pYL2电转化到马链球菌兽疫亚种感受态细胞中,通过含卡拉霉素的培养基中37 ℃和不含卡拉霉素的培养基中30 ℃传代,使菌株自杀性温度敏感质粒载体上携带的sagA基因缺失染色体DNA片段与菌株染色体正常的sagA基因DNA进行同源重组交换,温度敏感质粒从染色体上切离(原理图 1-B所示),在5%-7%的无菌绵羊血血平板上,挑取抗生素敏感并且不产生溶血透明圈的单菌落进行进一步对其染色体上的sagA基因进行PCR鉴定,结果如图 1-E表明,sagA缺失突变株与野生株相比缺失了一段约300 bp DNA片段。将PCR产物送测序公司测序结果证实,突变株sagA基因缺失。
2.2 sagA基因缺失对菌株SLS的影响 将野生型菌株和sagA缺失突变菌株接种到含5%-7%的无菌绵羊血血平板培养24 h,结果图 2-A所示,sagA缺失突变菌没有产生溶血透明圈,表明sagA基因缺失确实影响链球菌兽疫亚种SLS的产生。进一步检测细菌培养物上清液溶血活性结果如图 2-B所示,相对于野生菌株的SLS溶血活性,sagA缺失菌株溶血活性降低将近90%。为了进一步证实所构建的sagA基因缺失突变株遗传稳定性,将突变株转接10代,进行溶血素S活性检测,结果图 2-A-4和2-B-4显示,本实验所构建的sagA缺失菌株转接10代仍然维持极低的溶血活性。图 2-A-3和2-B-3为sagA缺失回复菌株溶血素S活性检测实验结果,sagA缺失回复菌株SLS溶血活性完全恢复,进一步证实,本实验所构建的马链球菌兽疫亚种突变株溶血活性降低的确是由sagA基因缺失所致。因此,上述几方面的实验结果可以得到的结论是,通过基因敲除的方法,所构建马链球菌兽疫亚种溶血素S活性缺失突变菌株,遗传性能十分稳定,由该菌株发酵所生产透明质酸产品极大地降低了含溶血素S的可能性,因而减轻了人们对马链球菌兽疫亚种发酵法生产透明质酸产品可能含溶血素S的担心。
 |
| 图 2. GCS野生菌株与sagA缺失突变菌株的SLS溶血 Figure 2. SLS hemolytic activities in GCS strains of wild type and sagA mutant. A: zones of hemolysis for the GCS strains on 5% sheep blood agar plates after growth at 37 ℃; B: assay of SLS hemolytic activities of culture supermentant from GCS strains in the early stationary phase. 1: wild-type; 2: sagA mutant; 3: sagA -complemented strain; 4: 10th passage of sagA mutant. ***: P < 0.001. |
| 图选项 |
2.3 sagA基因缺失对菌株HA的影响 Salim等[24]研究化脓链球菌时发现,sagA基因作为一调控元件,除能够影响化脓链球菌的毒力因子表达外,对细菌密度也会产生影响。而我们比较马链球菌兽疫亚种野生菌株和sagA基因缺失菌株生长动力学发现,两者之间不存在显著差异(图 3),sagA基因缺失对马链球菌兽疫亚种的生长没有明显影响。进一步分析野生菌和sagA缺失突变菌HA含量结果如图 4所示,sagA缺失突变菌HA产量比野生菌HA产量提高30%左右,两者之间存在显著差异(P < 0.001)。而sagA缺失突变菌产生的HA的平均分子量(0.475×105)比野生菌(0.475×105)要小将近一个数量级(表 1)。虽然马链球菌兽疫亚种sagA基因缺失不像化脓链球菌那样,影响细菌的生长繁殖,但马链球菌兽疫亚种sagA基因缺失会导致透明质酸含量提高,所产生的HA分子量降低,我们推测,马链球菌兽疫亚种的sagA基因可能与化脓链球菌sagA基因一样,对某些毒力因子具有调控作用。
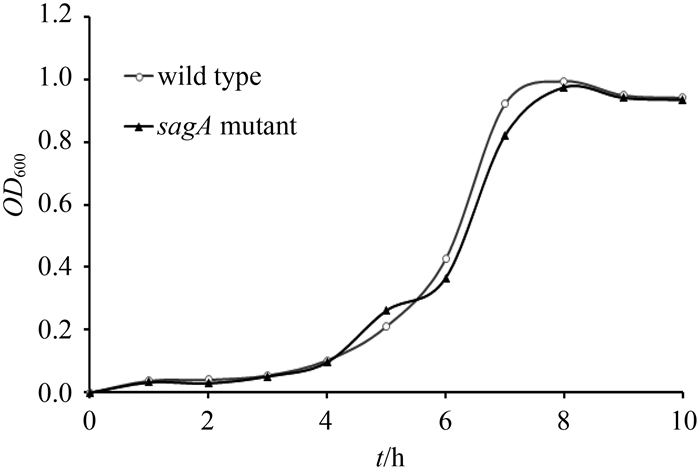 |
| 图 3. GCS野生菌和sagA缺失突变菌生长曲线 Figure 3. Growth curve of GCS strains of wild type and sagA mutant. |
| 图选项 |
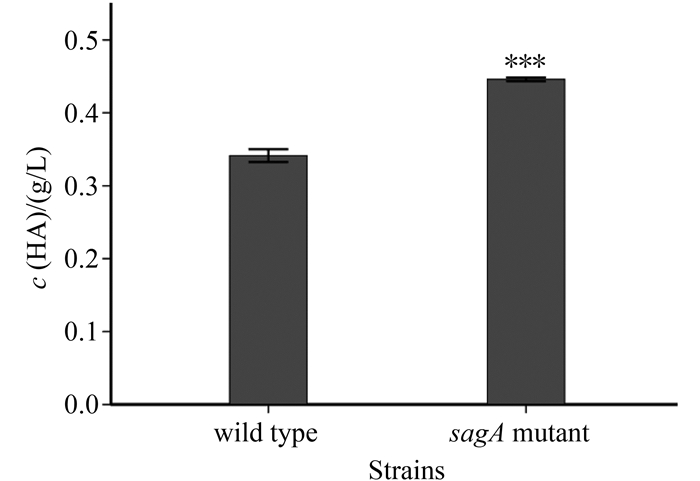 |
| 图 4. GCS野生菌株和sagA缺失突变菌株HA含量 Figure 4. The concentration of HA in GCS strains of wild type and sagA mutant. ***: P < 0.001. |
| 图选项 |
表 1. GCS野生菌和sagA缺失突变菌HA平均分子量比较 Table 1. Comparation average molecular weight of HA produced by wild type with that of sagA mutant
| Strains | Intrinsic viscosity/(η) | Average molecular weight |
| sagA mutant | 1.601 | 0.4753×105** |
| **: P<0.01. | ||
表选项
2.4 sagA基因缺失对菌株其它毒力因子的影响 为了证实马链球菌兽疫亚种的sagA基因可能与化脓链球菌sagA基因一样,对某些毒力因子具有调控作用,为此,进一步比较了野生菌株与sagA基因缺失菌株其他一些重要相关毒力因子活性。
2.4.1 sagA基因缺失对菌体Hylc活性的影响 链球菌除分泌SLS溶血素(Streptolysin S)外,还分泌另一种溶血素含-SH基、对氧敏感溶血素,到目前为止,该类链球菌溶血素的研究,主要集中在一些致病性很强的如化脓性链球菌、猪链球菌等。由于Hylc对氧不稳定,很难在血平板上观察到溶血现象,为此,本研究在培养物上清液中添加还原剂半胱氨酸和溶血素SLS抑制剂台盼蓝,通过检测培养物上清液溶血活性来评价马链球菌兽疫亚种溶血素Hylc在裂解血红细胞过程中的作用,实验所测得的Hylc溶血活性结果如图 5所示,与野生菌相比较,sagA缺失突变菌株显著降低了Hylc溶血活性,sagA缺失突变菌的Hylc相对活性比野生菌株降低了20%以上(图 5),具有显著差异P < 0.05。将测得溶血素SLS和Hylc数据进行比较,结果表 2所示,在马链球菌兽疫亚种血红细胞溶血活性中,主要表现的是溶血素SLS溶血,而Hylc溶血活性只有SLS的10%左右,因此推测马链球菌兽疫亚种裂解血红细胞的主要毒力因子是溶血素SLS,而Hylc则相对较弱。
 |
| 图 5. 野生菌和sagA缺失突变菌Hylc溶血活性分析结果 Figure 5. Hylc hemolytic activity assay in GCS strains of wild type and sagA mutant. *: P < 0.05. |
| 图选项 |
表 2. GCS野生菌株和sagA缺失突变菌株溶血素SLS和Hylc溶血活性比较 Table 2. Comparation the hemolytic activity of SLS and Hylc in culture supermentant of wild type with that of sagA mutant
| Strains | Relative activity of SLS/% | Relative activity of Hylc/% |
| Wild type | 100 | 9.8** |
| sagA mutant | 12.2** | 7.5* |
| **: P<0.01,*: P<0.05. | ||
表选项
2.4.2 sagA基因缺失对菌体透明质酸分解酶(Hyl)活性的影响 在马链球菌兽疫亚种中既存在透明质酸,也有透明质酸分解酶。而透明质酸分解酶的主要作用是能够在透明质酸内部随机切割透明质酸分子,产生透明质酸小片段,造成透明质酸酶的存在会造成透明质酸的产率降低,而且分子量下降[19]。由于sagA基因缺失导致马链球菌兽疫亚种透明质酸产量提高而分子量却下降,因此,推测分子量下降可能是透明质酸分解酶造成的,同时sagA基因缺失有可能影响透明质酸分解酶的活性。为了印证推测对野生菌和sagA缺失突变菌透明质酸分解酶酶活进行测定,结果如图 6可见sagA基因缺失的确导致突变菌透明质酸分解酶酶活增加,进而造成突变菌透明质酸分子量下降。实验结果证实,透明质酸分解酶的活性与透明质酸分子量大小具有相关性,sagA基因缺失会提高透明质酸分解酶的活性。
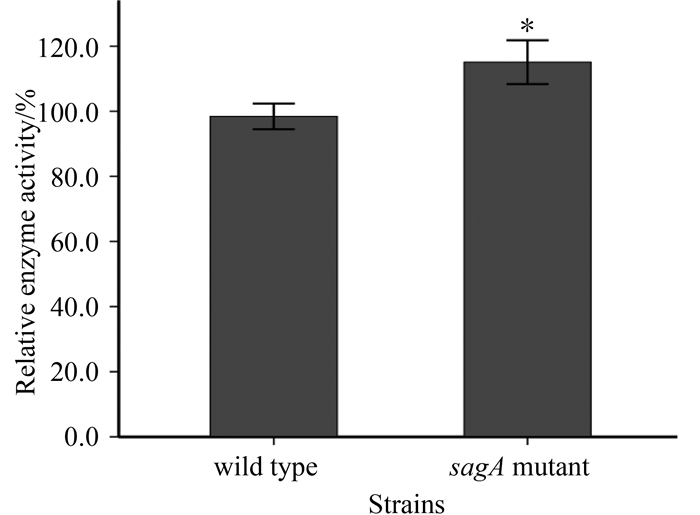 |
| 图 6. 野生菌和sagA缺失突变菌Hyl酶活活性分析结果 Figure 6. Hyl activity assay in GCS strains of wild type and sagA mutant. *: P < 0.05. |
| 图选项 |
2.4.3 sagA基因缺失对菌体甘油醛-3-磷酸脱氢酶(GAPDH)活性的影响 甘油醛-3-磷酸脱氢酶存在于链球菌表面,具有粘附活性,能够吸附到宿主的纤维蛋白酶、纤连蛋白和肌动蛋白等细胞表面与体液蛋白上,在细菌的感染和侵入过程中起重要作用[25]。分析马链球菌兽疫亚种野生菌和sagA缺失突变菌GAPDH酶酶活结果图 7表明,sagA缺失突变菌GAPDH酶活比野生菌显著降低(P < 0.05)。因此,有理由推测sagA基因缺失会导致GAPDH酶活活性降低,进而导致细菌粘附下降,毒力下降。
 |
| 图 7. 野生菌和sagA缺失突变菌GAPDH酶活活性分析结果 Figure 7. GAPDH activity assay in GCS strains of wild type and sagA mutant. *: P < 0.05. |
| 图选项 |
2.4.4 sagA基因缺失对菌体表面蛋白的影响 范红结等[4]认为,马链球菌兽疫亚种表面蛋白能够介导细菌与宿主细胞的相互粘附作用,其表面所带的负电荷可排斥吞噬细胞的吞噬作用,此外表面蛋白与诸如败血症、关节炎、肾小球肾炎等人的多种疫病可能有关。由于sagA基因缺失会导致表面蛋白GAPDH活性降低(图 7),因此,有必要进一步研究sagA基因缺失菌株表面蛋白的变化。热酸法提取的马链球菌兽疫亚种表面蛋白SDS-PAGE电泳结果如图 8所示,图中野生菌7条蛋白条带明显可见,相对分子量分别为80、62、55、50、48、46、40 kDa,而sagA缺失突变菌明显可见的只有6条蛋白带,且sagA缺失突变菌和野生菌相比,表面蛋白量下降,特别是在62 kDa处的蛋白含量下降最明显。sagA缺失突变菌表面蛋白表达下降,进一步证实,sagA基因缺失影响菌株的毒力。先前王国勤等[18]在马链球菌马亚种中提取的表面蛋白只有5条,其分子量大小也与本实验中所提取的马链球菌兽疫亚种表面蛋白有所不同,因此我们推测表面蛋白表达受多种因素影响,当然也包括种属特异性。
 |
| 图 8. SDS-PAGE电泳分析野生菌和sagA缺失突变菌表面蛋白 Figure 8. Surface protein assay of wild type and sagA mutant by SDS-PAGE electrophoresis. M: protein marker. |
| 图选项 |
2.4.5 野生菌株与sagA基因缺失菌株对细胞毒性比较 在细胞培养过程中添加野生菌株和sagA基因缺失菌株培养上清液,对细胞生长影响研究结果表 3表明,无论是野生菌株还是sagA基因缺失菌株在细胞培养的早期对细胞的生长抑制都较轻,当细胞培养到72 h,上清液表现出明显抑制作用,相对于野生菌株,sagA基因缺失能显著降低细胞的抑制作用,两者的差异有统计学意义(P < 0.05)。细胞培养的结果进一步证实,马链球菌兽疫亚种sagA基因缺失的确能减轻菌株的毒力。 表 3. GCS野生菌株和sagA缺失突变菌株和挥发突变株上清液对细胞生长抑制比较 Table 3. The inhibitory rate of cell growth in culture supermentants from wild type, sagA mutant and sagA complemented strain
| Strains | t/h | |||
| 0 | 24 | 48 | 72 | |
| Wild type | 0 | 1.62 | 5.45 | 21.04** |
| sagA Mutant | 0 | 1.53 | 4.38 | 8.25 |
| sagA complemented strain | 0 | 1.61 | 5.27 | 20.86** |
| Inhibitory rate of cell(%)=(1-ODexample/ODcontrol) × 100%; **: P<0.01. | ||||
表选项
3 讨论 透明质酸在医疗、化妆品、食品等领域有着越来越大的需求,目前工业上大规模生产主要是通过马链球菌兽疫亚种发酵生产获得,过去相当一段时间,研究的重点主要集中在马链球菌兽疫亚种发酵生产透明质酸高产菌种选育、发酵工艺条件优化以及其合成途径等方面[2]。近年来,随着透明质酸应用领域的不断扩大,人们开始关注透明质酸生产菌本身及其产品的安全性问题。在化脓性链球菌中,sagA基因表达产物SLS目前研究得比较清楚,SLS毒素对氧稳定、无免疫原性,除能引起红细胞的典型溶血外,还能损坏包括淋巴细胞,中性粒细胞和血小板,某些肿瘤细胞以及亚细胞器如溶酶体和线粒体等的细胞膜结构[6]。但目前人们对SLS在马链球菌兽疫亚种中的作用还不十分清楚。我们的研究结果表明,在马链球菌兽疫亚种细胞溶血活性中,溶血素SLS溶血占主导地位,而Hylc相对较弱。sagA基因对透明质酸合成起着调控作用,sagA基因缺失能提高透明质酸产量,先前有研究结果显示,在化脓性链球菌中,ABC转运操纵子基因的缺失,会使菌株通透性增强,导致透明质酸产量的提高[26],sag操纵子sagA基因缺失导致突变株透明质酸含量的提高,是否与菌株通透性相关,还有待今后研究所证实。与马链球菌兽疫亚种野生型菌株相比较,sagA基因缺失突变株中,病原菌毒力相关因子如菌体表面蛋白含量,溶血素Hylc和甘油醛-3-磷酸脱氢酶活性都显著降低,而透明质酸分解酶活性提高,因此,本实验结果表明,在马链球菌兽疫亚种中sagA基因,也像在化脓性链球菌中一样,对毒力因子具有调控作用。
综上所述,本实验所构建的马链球菌兽疫亚种sagA基因缺失突变株,不仅极大的降低了HA生产菌株溶血素活性,提高了透明质酸的产率,而且突变株其他相关毒力因子活性也显著下降,将该菌株用于工业化生产透明质酸,对减轻人们对发酵法生产的透明质酸产品的安全性的担心必将起到积极的作用,同时实验结果也为今后进一步通过基因工程方法获得安全高产的透明质酸基因工程菌提供了更多的选择。
参考文献
| [1] | Jiang YC, Jiang SY, Fu FM, Huang K, Kang XX, Xu D. Advance in research on HA biosynthesis and gene engineering.China Biotechnology, 2015, 35(1): 104–110(in Chinese).蒋延超, 蒋世云, 傅凤鸣, 黄凯, 康星欣, 徐丹. 透明质酸生物合成途径及基因工程研究进展.中国生物工程杂志, 2015, 35(1): 104–110. |
| [2] | Bi YL, Wang Z, Wang L, Liu H. High throughput screening and cloning of new genes related to synthesis of hyaluronic acid in Streptococcus zooepidemicus.Microbiology China, 2015, 42(12): 2291–2299(in Chinese).毕亚丽, 王震, 王璐, 刘浩. 兽疫链球菌中与透明质酸合成相关新基因的高通量筛选及克隆.微生物学通报, 2015, 42(12): 2291–2299. |
| [3] | Chong BF, Blank LM, Mclaughlin R, Nielsen LK. Microbial hyaluronic acid production.Applied Microbiology and Biotechnology, 2005, 66(4): 341–351DOI:10.1007/s00253-004-1774-4. |
| [4] | Fan HJ, Lu CP. Virulent factors of Streptococcus equi subsp.zooepidemicus.Chinese Journal of Zoonoses, 2006, 22(3): 279–281(in Chinese).范红结, 陆承平. 马链球菌兽疫亚种毒力因子.中国人兽共患病学报, 2006, 22(3): 279–281. |
| [5] | Nizet V, Beall B, Bast DJ, Datta V, Kilburn L, Low DE, De Azavedo JCS. Genetic locus for streptolysin S production by group A streptococcus.Infection and Immunity, 2000, 68(7): 4245–4254DOI:10.1128/IAI.68.7.4245-4254.2000. |
| [6] | Molloy EM, Cotter PD, Hill C, Mitchell DA, Ross RP. Streptolysin S-like virulence factors:the continuing sagA.Nature Reviews Microbiology, 2011, 9(9): 670–681DOI:10.1038/nrmicro2624. |
| [7] | Yang XH, Ye Y, Lin K, Wang HS.The process of sodium hyaluronate production by bacterial fermentation.China, 201110436265.2013-06-26.(in Chinese) 杨晓辉, 叶昀, 林克, 王洪森.一种利用细菌发酵生产透明质酸钠的生产工艺.中国, 201110436265.2013-06-26. |
| [8] | Liu L, Wang Q, Chen YH. Progress on optimization of fermentation conditions of hyaluronic acid.Food and Fermentation Industries, 2009, 35(2): 125–129(in Chinese).刘丽, 王强, 陈永浩. 微生物发酵生产透明质酸研究进展.食品与发酵工业, 2009, 35(2): 125–129. |
| [9] | Kim JH, Yoo SJ, Oh DK, Kweon YG, Park DW, Lee CH, Gil GH. Selection of a Streptococcus equi mutant and optimization of culture conditions for the production of high molecular weight hyaluronic acid.Enzyme and Microbial Technology, 1996, 19(6): 440–445DOI:10.1016/S0141-0229(96)00019-1. |
| [10] | Li Y, Lan XL, Li XR, Guo TL, Yao N, Jiang NP, Ren YY. Construction of in-frame deletion streptococcal hemoprotein receptor gene mutant in streptococcus equi subsp.zooepidemicus.Acta Microbiologica Sinica, 2010, 50(6): 822–827(in Chinese).李尧, 蓝小玲, 李学如, 郭泰林, 姚宁, 江南屏, 任瑶瑶. 一种构建马链球菌兽疫亚种血红素受体基因缺失突变株的方法.微生物学报, 2010, 50(6): 822–827. |
| [11] | Lan XL, Zhang B, Li XR, Li Y, Guo TL, Meng T, Ren YY, Jiang NP. Constructing duplication hasABC of chromosome recombinant in streptococcus equi subsp.zooepidemicu.Acta Microbiologica Sinica, 2012, 52(3): 396–401(in Chinese).蓝小玲, 张波, 李学如, 李尧, 郭泰林, 孟涛, 任瑶瑶, 江南屏. 构建无抗性标记双拷贝透明质酸合成酶基因工程菌.微生物学报, 2012, 52(3): 396–401. |
| [12] | Flanagan J, Collin N, Timoney J, Mitchell T, Mumford JA, Chanter N. Characterization of the haemolytic activity of Streptococcus equi.Microbial Pathogenesis, 1998, 24(2): 211–221. |
| [13] | Hu S.Study on the role of Streptococcus pyogenes htrA in protein secrection.Chengdu:Master's Thesis of Southwest Jiaotong University, 2013.(in Chinese) 胡珊.化脓性链球菌htrA与蛋白分泌相关性初步研究.西南交通大学硕士学位论文, 2013. http://cdmd.cnki.com.cn/article/cdmd-10613-1013250536.htm |
| [14] | Bitter T, Muri HM. A modified uronic acid carbazole reaction.Analytical Biochemistry, 1962, 4(4): 330–334DOI:10.1016/0003-2697(62)90095-7. |
| [15] | Laurent TC, Ryan M, Pietruszkiewicz A. Fractionation of hyaluronic acid the polydispersity of hyaluronic acid from the bovine vitreous body.Biochimica et Biophysica Acta, 1960, 42: 476–485DOI:10.1016/0006-3002(60)90826-X. |
| [16] | Hong SS, Chen J, Teng LR, Meng QF, Zhang JG, Liu LY. Purification and structure characterization of the hyaluronic acid produced by a Streptococcus zooepidemicus mutation strain.Chemical Journal of Chinese Universities, 2004, 25(5): 853–857(in Chinese).洪水声, 陈佳, 滕利荣, 孟庆繁, 张建国, 刘兰英. 兽疫链球菌变异株产生的透明质酸的纯化及表征.高等学校化学学报, 2004, 25(5): 853–857. |
| [17] | Timoney JF, Mukhtar MM. The protective M proteins of the equine group C streptococci.Veterinary Microbiology, 1993, 37(3/4): 389–395. |
| [18] | Wang GQ, Jiang HJ, Jiang H, Su Y. Analysis on extraction and immunogenicity of the outer-protein of Streptococcus equi subsp.equi isolated in Xinjiang.Journal of Xinjiang Agricultural University, 2014, 37(3): 181–184(in Chinese).王国勤, 姜慧娇, 江航, 苏艳. 马链球菌马亚种新疆株ZX表面蛋白的提取及免疫原性分析.新疆农业大学学报, 2014, 37(3): 181–184. |
| [19] | Cui YN, Su XD, Wang Y, Ma XY, Wang XJ, Lin Y, Zhang W. Gene knocking out of hyaluronidase in Streptococcus zoopidemics.China Biotechnology, 2009, 29(12): 94–99(in Chinese).崔亚娜, 苏旭东, 王羽, 马晓燕, 王雪静, 林杨, 张伟. 兽疫链球菌透明质酸分解酶基因的敲除.中国生物工程杂志, 2009, 29(12): 94–99. |
| [20] | Bo?l G, Jin H, Pancholi V. Inhibition of cell surface export of group A streptococcal anchorless surface dehydrogenase affects bacterial adherence and antiphagocytic properties.Infection and Immunity, 2005, 73(10): 6237–6248DOI:10.1128/IAI.73.10.6237-6248.2005. |
| [21] | He X, Yuan J, Wang H, Li CW, Jiang H, Dong J, Cui J, Dong SS, Zhou AE, Zhang XM, Xu WC, Yin YB, He YJ. In vitro expression of pneumolysin and identification of its biological activity.Acta Academiae Medicinae Militaris Tertiae, 2011, 33(3): 237–240(in Chinese).贺潇, 袁军, 王虹, 李忱炜, 姜慧, 董杰, 崔瑾, 董姗姗, 周爱娥, 张雪梅, 胥文春, 尹一兵, 何於娟. 肺炎链球菌溶血素的体外表达及活性鉴定.第三军医大学学报, 2011, 33(3): 237–240. |
| [22] | Yu YP, Peng YB, Zhi LM, Ji YH, Wu ZL. Vero cell assay for detection of E.coli O157:H7 toxin.Journal of Microbiology, 1999, 19(3): 17–18(in Chinese).郁燕萍, 彭奕冰, 支立民, 季育华, 吴仲梁. Vero细胞毒性试验法检测大肠杆菌O157:H7毒素.微生物学杂志, 1999, 19(3): 17–18. |
| [23] | Betschel SD, Borgia SM, Barg NL, Low DE, De Azavedo JCS. Reduced virulence of group A streptococcal Tn 916 mutants that do not produce streptolysin S.Infection and Immunity, 1998, 66(4): 1671–1679. |
| [24] | Salim KY, de Azavedo JC, Bast DJ, Cvitkovitch DG. Role for sagA and siaA in quorum sensing and iron regulation in Streptococcus pyogenes.Infection and Immunity, 2007, 75(10): 5011–5017DOI:10.1128/IAI.01824-06. |
| [25] | Seidler KA, Seidler NW. Role of extracellular GAPDH in Streptococcus pyogenes virulence.Missouri Medicine, 2013, 110(3): 236–240. |
| [26] | Ouskova G, Spellerberg B, Prehm P. Hyaluronan release from Streptococcus pyogenes:export by an ABC transporter.Glycobiology, 2004, 14(10): 931–938DOI:10.1093/glycob/cwh115. |
