 , 安晓强2, 崔雨琦2, 兰华春2
, 安晓强2, 崔雨琦2, 兰华春2
 , 李艳红1
, 李艳红11. 桂林理工大学环境科学与工程学院, 桂林 541004;
2. 清华大学水质与水生态研究中心, 北京 100084
收稿日期: 2021-03-07; 修回日期: 2021-03-18; 录用日期: 2021-03-18
基金项目: 国家自然科学基金面上项目(No.51978373)
作者简介: 张杰阳(1995—), 男, E-mail: jieyangzhang@163.com
通讯作者(责任作者): 兰华春, E-mail: hclan@tsinghua.edu.cn
摘要:吸附材料在水中的分散性对于增加其与吸附质间相互作用,实现污染物的高效去除尤为重要.本文基于分子形态易于调控的石墨相氮化碳二维材料,通过简单的化学处理方法制备成高度分散于水中的溶胶吸附剂(M-C3N4-sol、U-C3N4-sol),通过透射电镜(TEM)、X射线衍射(XRD)、傅里叶变换红外光谱(FTIR)、X射线光电子能谱仪(XPS)、Zeta电位仪(Zeta Potential Analyzer)、比表面积及孔径分布仪(BET)等对其形貌、组成、结构进行了表征.结果表明,氮化碳溶胶呈现纳米级纤维状结构,在水中有着极佳的分散性.相较于原始氮化碳(g-C3N4),溶胶吸附剂对多种重金属离子的吸附去除能力得到大幅度提升,尤其是对Pb2+具有较高的吸附选择性.在298 K时,对Pb2+的吸附在1 min内即可达到平衡,快速吸附过程符合准二级动力学模型和Freundlich等温模型.吸附机理的研究表明,M-C3N4-sol对Pb2+的吸附是在静电引力、离子交换、氨基的表面络合和阳离子-π键的协同作用下完成的.吸附金属离子后,M-C3N4-sol发生脱稳形成易于实现固液分离的沉淀产物,对其进行稀硝酸脱附再生,吸附容量没有明显降低,表明其良好的循环使用性能.
关键词:氮化碳溶胶吸附重金属吸附机理
Application of highly dispersed carbon nitride sol solution for the adsorption removal of heavy metal ions
ZHANG Jieyang1,2
 , AN Xiaoqiang2, CUI Yuqi2, LAN Huachun2
, AN Xiaoqiang2, CUI Yuqi2, LAN Huachun2
 , LI Yanhong1
, LI Yanhong11. School of Environmental Science and Engineering, Guilin University of Technology, Guilin 541004;
2. Center for Water and Ecology, School of Environment, Tsinghua University, Beijing 100084
Received 7 March 2021; received in revised from 18 March 2021; accepted 18 March 2021
Abstract: The dispersion of adsorbents in water is particularly important for the efficient removal of pollutants by increasing the interactions between adsorbents and adsorbates. Herein, a simple chemical treatment method was used to prepare sol adsorbents (M-C3N4-sol, U-C3N4-sol) with high dispersivity in water. The morphology, composition and structure of the absorbents was characterized by TEM, XRD, FT-IR, XPS, Zeta Potential Analyzer and BET. The results showed that the dispersed carbon nitride exhibited a fibrous structure with nanoscale sizes. Compared to the pristine bulk carbon nitride, the adsorption capacity of sol adsorbents for various heavy metal ions was significantly improved, especially for Pb2+ in water. At 298 K, the adsorption equilibrium of Pb2+ was achieved within 1min. The rapid adsorption process accorded with the quasi-second-order kinetic model and the Freundlich isothermal model. Mechanism study revealed that the adsorption of Pb2+ by M-C3N4-sol was ascribed to the synergistic effect of electrostatic attraction, ion exchange, surface complexation of amino groups and cationic-π bond. After the adsorption of metal ions, M-C3N4-sol was destabilized to form precipitate products, which could be easily separated from water. The recycled adsorbents could be regenerated by dilute nitric acid, with ignorable decrease of adsorption capacity, suggesting its good recycling performance.
Keywords: carbon nitride soladsorptionheavy metal ionsthe adsorption mechanism
1 引言(Introduction)随着社会经济的快速发展, 人为向自然水体中排放的工业废水数量激增, 其中包含了大量有毒重金属离子.由于其不可降解、高毒性且广泛分散在水溶液中, 从而对人体健康和环境生态系统产生严重危害.现有的重金属有效分离工艺有吸附、沉淀、离子交换、电化学处理、膜技术、蒸发凝固等, 其中, 吸附法因具有高效、节能、可循环利用、环保等特点而被广泛使用(张帆等, 2013).
常用于水中重金属吸附的材料有活性炭、沸石、粘土矿物、工业固体废弃物和生物材料等(Burakov et al., 2018).然而, 由于传统材料的表面官能团有限, 与目标污染物的相互作用较弱, 限制了其在复杂系统中有效和选择性去除污染物的应用(Chen et al., 2020).石墨相氮化碳(g-C3N4)具有类似石墨烯的层状结构, 可以通过表面氨基官能团及π-π共轭作用对各种污染物进行吸附(Fronczak, 2020).其不含金属组分, 生物相容性好, 无毒副作用, 是一种环境友好的吸附材料(韩丽珍等, 2020).例如, Zhu等(2017)采用低成本三聚氰胺直接煅烧法制备了g-C3N4, 对Pb2+具有良好的吸附性能, 最大吸附容量为7.4 mg·g-1.然而, 吸附通常是发生在吸附剂表面的反应过程, 吸附剂的分散性对其与吸附质之间的界面接触, 特别是对于低浓度污染物的捕获具有重要作用(Lata et al., 2016).石墨相氮化碳比表面积小且在水中分散性差, 一定程度上阻碍了其在吸附应用中优势的发挥, 获得的吸附效果不甚理想(Zhu et al., 2017).
为了弄清氮化碳水中分散性与其去除重金属离子性能间的内在关系, 本研究制备出高度分散于水的氮化碳溶胶材料M-C3N4-sol和U-C3N4-sol.通过对比常规氮化碳和溶胶氮化碳对水中不同重金属离子的吸附性能, 以证明溶胶吸附剂分散性对污染物去除效率的重要贡献.研究进一步考察pH、时间、温度等条件对吸附的影响, 进而推断M-C3N4-sol吸附去除水中Pb2+的可能机理, 以期为设计开发高效吸附材料处理重金属废水提供新思路.
2 材料与方法(Materials and methods)2.1 主要试剂及实验仪器主要试剂: 三聚氰胺、尿素购于北京百灵威科技有限公司, 氢氧化钠购于上海泰坦科技股份有限公司, 硝酸铅、硝酸铜、硝酸镉、硝酸镍、硝酸锌、硝酸钴购于阿拉丁试剂(上海)有限公司, 以上试剂均为分析纯.
实验仪器: 超纯水机(Milli-Q Integral 3, Merck Millipore)、PH计(PHS-3C, 雷磁)、恒温摇床(HZY-E, 金坛吉特实验仪器厂)、高速冷冻离心机(3-18KS, Sigma)、水浴锅(ZNCL-GS)、马弗炉(KSL-1200X, 合肥科晶材料公司)、真空冷冻干燥机(北京博医康仪器公司).
2.2 材料制备体相氮化碳(M-g-C3N4、U-g-C3N4)的制备: 称取10 g的三聚氰胺加入到有盖的坩埚中, 放入马弗炉中以5 ℃·min-1的速率从室温升至550 ℃并保持4 h, 再冷却至室温后取出, 充分研磨后得到M-g-C3N4粉末.用尿素替换三聚氰胺, 重复上述操作, 得到U-g-C3N4粉末.
氮化碳溶胶(M-C3N4-sol、U-C3N4-sol)的制备: 称取2 g的M-g-C3N4倒入装有3 mol·L-1氢氧化钠溶液的烧杯中, 保持搅拌在60 ℃的油浴锅中加热12 h;待冷却后, 在3000 r·min-1离心作用下去除未完全剥离的大颗粒;随后装入7000 Da的透析袋中, 透析数天至透析液达到中性, 得到M-C3N4-sol.用U-g-C3N4替换M-g-C3N4, 重复上述操作, 得到U-C3N4-sol.
2.3 材料表征通过加速电压为120~200 kV的高分辨透射电镜(HRTEM, JEM- 2010)观察样品材料的形貌;通过ZETA电位仪(Zeta Potential Analyzer, Nano Brook)测定样品材料的Zeta电位;通过X射线衍射仪(XRD, D8 ADVANCE, 布鲁克)测定样品材料的物相组成;通过傅里叶变换红外光谱仪(FT-IR, Nicolet iS50)测定样品材料及吸附前后的结构组成;通过X射线光电子能谱(XPS, ESCALAB 250Xi)测定样品材料及吸附前后的表层元素组成和结合状态;通过比表面积及孔径分布仪(BET, ASAP 2020 Plus HD88)来测定样品材料的比表面积和孔径分布.
2.4 吸附实验多元重金属离子吸附实验配制了一系列初始浓度为5 mg·L-1的Pb2+、Cu2+、Cd2+、Zn2+、Ni2+、Co2+的单独存在溶液及六元共存溶液, 并分别投加0.1 g·L-1的g-C3N4、M-C3N4-sol、U-C3N4-sol(溶胶质量以固体计), 调整溶液pH为5.0±0.1, 置于25 ℃恒温摇床中振荡2 h.
探究pH影响的实验配制了一系列初始浓度为2 mg·L-1的Pb2+溶液, 均投加0.02 g·L-1的M-C3N4-sol, 分别调节pH为2.0~9.0, 置于25 ℃恒温摇床中振荡2 h.
探究动力学的实验配制了初始浓度为2 mg·L-1和1 mg·L-1的Pb2+溶液, 分别投加0.1 g·L-1的M-C3N4-sol, 调整溶液pH为5.0±0.1, 置于25 ℃恒温摇床中振荡, 在不同时间点进行取样.
探究等温线和热力学的实验配制了3组初始浓度分别为0.5、1、2、3、4、5 mg·L-1的Pb2+溶液, 均投加0.02 g·L-1的M-C3N4-sol, 调整溶液pH为5.0±0.1, 将每组溶液分别置于15、25、35 ℃恒温摇床中振荡2 h.
探究再生性能的实验是将吸附完成的M-C3N4-sol取出, 加入至少量0.2 mol·L-1的硝酸溶液中充分振荡, 再用超纯水洗涤一次后继续用于吸附.
所有实验均在锥形瓶中进行, 恒温摇床在200 r·min-1下避光运行.吸附完成后静置1 h待絮体自然沉降分离, 取上清液用0.45 μm水系滤膜过滤.重金属浓度用电感耦合等离子体发射光谱仪(ICP-OES, Agilent 5110VDV)测定, 根据式(1)计算吸附量.
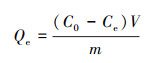 | (1) |
3 结果与讨论(Results and discussion)3.1 材料形貌与结构表征实验通过透射电镜对制备出的氮化碳溶胶(M-C3N4-sol、U-C3N4-sol)形貌进行观察.由图 1可见, 在碱溶液的水解作用下, 原始石墨相氮化碳(g-C3N4)由微米级尺寸的厚片层结构转化为直径仅为几纳米的纳米纤维状, 并且形成了相互交联的网状结构.从图 1d中可以观察到剥离后的M-C3N4-sol与U-C3N4-sol形成了可以高度稳定分散在水中的分散液, 放置数10 d时间也不会发生聚沉.
图 1(Fig. 1)
 |
| 图 1 g-C3N4(a)、M-C3N4-sol(b)、U-C3N4-sol(c)的TEM图和三者形貌对比图(d) Fig. 1TEM image of g-C3N4(a), M-C3N4-sol(b), U-C3N4-sol(c) and morphological comparison of the three(d) |
原始石墨相氮化碳(g-C3N4)与氮化碳溶胶(M-C3N4-sol、U-C3N4-sol)的XRD图谱如图 2所示.结果表明, 在碱处理后, 氮化碳谱图中27.5°处的衍射峰强度大幅降低, 并且移向更大的角度, 此处对应于g-C3N4的类石墨层(002)间距, 表明g-C3N4有序的层间堆叠变弱, 层状结构被有效剥离(Tian et al., 2013).谱图中13.0°处对应于三均三嗪环的(100)晶面的衍射峰几乎消失, 表明部分片层结构遭到了破坏(Zhang et al., 2016), 这与纳米纤维形成的形貌变化相一致.
图 2(Fig. 2)
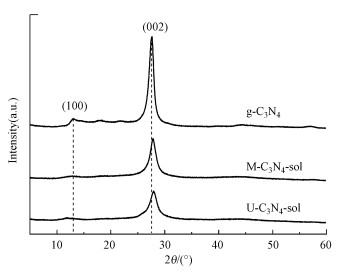 |
| 图 2 M-C3N4-sol、U-C3N4-sol与g-C3N4的XRD图谱 Fig. 2XRD pattern of g-C3N4, M-C3N4-sol and U-C3N4-sol |
氮化碳溶胶(M-C3N4-sol、U-C3N4-sol)与原始石墨相氮化碳(g-C3N4)的FT-IR图谱如图 3所示.其中, 800 cm-1处的吸收峰为三均三嗪环在平面弯曲振动, 1200~1650 cm-1处的吸收峰为CN杂环的拉伸振动, 结果表明, 在碱处理后, g-C3N4的主要骨架结构得到了很好的保留(Cheng et al., 2016), 在3000~3500 cm-1处出现了连续变宽的吸收峰, 这是末端得到保留的—NHx振动峰与碱处理形成的—OH拉伸振动峰相叠加导致的(Zhang et al., 2016).
图 3(Fig. 3)
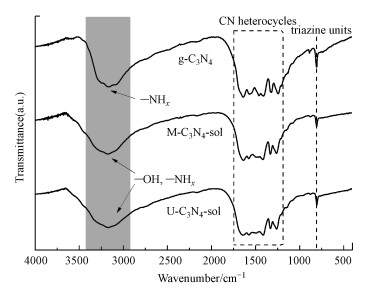 |
| 图 3 M-C3N4-sol、U-C3N4-sol与g-C3N4的FT-IR图谱 Fig. 3FT-IR spectra of g-C3N4, M-C3N4-sol and U-C3N4-sol |
氮化碳溶胶(M-C3N4-sol、U-C3N4-sol)与原始石墨相氮化碳(g-C3N4)测得的比表面积和孔径分布见表 1.用于检测的溶胶样品经过冷冻干燥处理, 测得的比表面积分别为9.24 m2·g-1和10.11 m2·g-1, 比g-C3N4略有增大, 但溶胶在水中分散后的真实比表面积要远远大于测得值(Burakov et al., 2018).总孔体积大幅降低, 说明制得的溶胶所含孔的数量大幅减少, 并且孔径多为5 nm左右, 推测为纳米纤维相互交联而导致形成更多的网络空间.
表 1(Table 1)
| 表 1 不同样品的比表面积、总孔体积及平均孔径 Table 1 Surface area, pore volume and pore diameter distribution of different samples | ||||||||||||||||
表 1 不同样品的比表面积、总孔体积及平均孔径 Table 1 Surface area, pore volume and pore diameter distribution of different samples
| ||||||||||||||||
3.2 多元重金属离子的竞争吸附研究对比了氮化碳溶胶(M-C3N4-sol、U-C3N4-sol)与原始石墨相氮化碳(g-C3N4)对于重金属阳离子Pb2+、Cu2+、Cd2+、Zn2+、Ni2+、Co2+单独存在及多元离子共存时的吸附性能.如图 4所示, 无论重金属离子是单独存在还是多元共存, M-C3N4-sol和U-C3N4-sol对各种重金属离子的吸附量均较g-C3N4大幅提高.例如, Pb2+的吸附量从3.3 mg·g-1提高至47.7 mg·g-1(M-C3N4-sol)和43.4 mg·g-1(U-C3N4-sol), Cu2+的吸附量从0.2 mg·g-1提高至17.7 mg·g-1和15.6 mg·g-1, Cd2+的吸附量从1.7 mg·g-1提高至22.7 mg·g-1和20.1 mg·g-1.可能由于结构与亲水性的细微差别, 导致M-C3N4-sol的吸附性能更优于U-C3N4-sol.因此, 后续实验进一步探究了M-C3N4-sol的吸附性能.
图 4(Fig. 4)
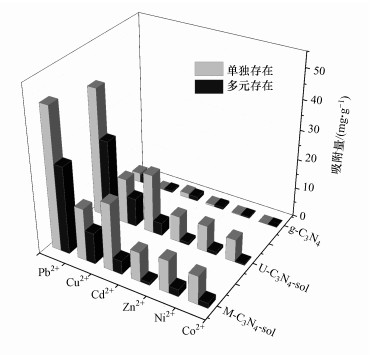 |
| 图 4 氮化碳材料对不同重金属离子的吸附性能对比 Fig. 4Comparison of adsorption properties of carbon nitride materials for different heavy metal ions |
通过吸附平衡时各种离子的吸附量和平衡浓度的比值, 可以计算出分配系数Kd, 其代表吸附剂对于不同离子的选择性, 大于104即代表良好的吸附选择性(Wang et al., 2020).如图 5所示, M-C3N4-sol对不同重金属离子的吸附选择性顺序遵循Pb2+ >> Cd2+>Cu2+>Ni2+≈Zn2+≈Co2+, 其中对于Pb2+的吸附选择性极佳.通常重金属离子的电负性越高, 其在带负电的M-C3N4-sol表面上的吸引力就会越强(Seyed et al., 2002).此外, 其形成的金属氢氧化物Pb(OH)+、Cu(OH)+、Cd(OH)+、Zn(OH)+的第一级稳定性常数lgK1分别为7.82、7.0、4.17、4.4, lgK1越大, 代表亲和力越强, 这也与上述顺序基本一致.这两点说明M-C3N4-sol对相关重金属离子的吸附选择性同时与离子的电负性和lgK1有着密切的关联.此外, M-C3N4-sol表面官能团与不同重金属离子络合能力的不同也是导致选择性差异的一种可能原因(Peng et al., 2017).
图 5(Fig. 5)
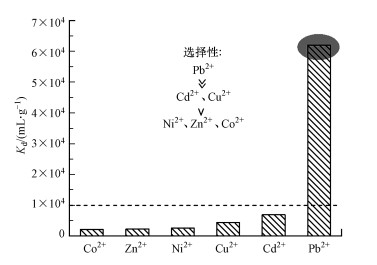 |
| 图 5 M-C3N4-sol吸附不同重金属离子的分配系数 Fig. 5Distribution coefficient of M-C3N4-sol for different heavy metal ions |
3.3 pH的影响溶液pH值不仅影响吸附剂表面电荷及官能团的解离程度, 还会影响到溶液中离子的存在形式, 因此是影响吸附过程的一个重要因素(Crini et al., 2007).图 6展示了不同pH时, M-C3N4-sol的Zeta电位及其溶胶稳定性对比.M-C3N4-sol表面存在大量官能团, 导致其Zeta电位随pH变化而改变(Chowdhury et al., 2013).等电点出现在pH为2~3, 此时M-C3N4-sol分子间作用力大于静电斥力, 纳米纤维容易通过自组装发生团聚, 导致其脱稳(Zhang et al., 2017).如图 7所示, 由于吸附剂暴露出的吸附位点急剧减少, 此时吸附效果并不佳.当pH>3时, Zeta电位均小于-60 mV, 且负电荷不断增多, 这是溶胶一直保持稳定的原因(Trefalt et al., 2016).随着pH不断增加, H+对Pb2+的竞争不断减少, 吸附剂表面暴露出的吸附位点快速增多, 通过静电引力对Pb2+产生吸附, 从而吸附量大幅增加.实验过程结合Visual MINTEQ软件模拟可知, Pb2+在pH大于5时会产生Pb(OH)2沉淀, 所以pH>5时吸附量快速增加是吸附和沉淀的共同作用.吸附量与溶液pH的密切关联表明吸附主要是表面络合作用.
图 7(Fig. 7)
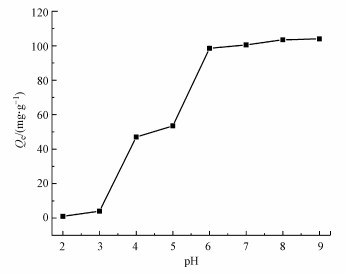 |
| 图 7 M-C3N4-sol对Pb2+在不同pH时的吸附量 Fig. 7Adsorption capacity of M-C3N4-sol for Pb2+ at different pH values |
图 6(Fig. 6)
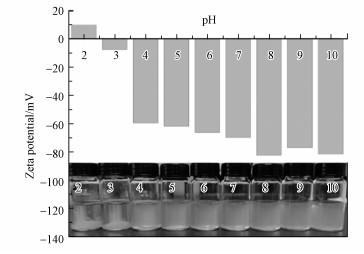 |
| 图 6 M-C3N4-sol在不同pH时的Zeta电位和稳定性 Fig. 6Zeta potential and stability of M-C3N4-Sol at different pH values |
3.4 吸附动力学吸附剂对污染物的吸附需要一定的时间, 在吸附材料与污染物的有效接触时间内, 污染物需和吸附剂进行充分的接触, 从而提高两者之间的相互作用.因此, 吸附动力学研究对于实际污染物处理过程中的性能优化、设备选择、节能减排均有重要的意义.
M-C3N4-sol对Pb2+的吸附量随时间的变化如图 8所示.可见, 氮化碳能够非常迅速地吸附金属离子, 在1 min之内即可达到平衡, 且在1 h内达到完全平衡状态.快速的吸附可能是由于M-sol在水中极佳的分散性, 使其暴露出纳米结构上大量的吸附位点, 与Pb2+迅速发生接触, 完成吸附.随后, 对吸附过程进行了准一级动力学模型(式(2))、准二级动力学模型(式(3))和内扩散模型(式(4))拟合.
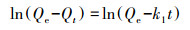 | (2) |
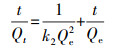 | (3) |
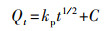 | (4) |
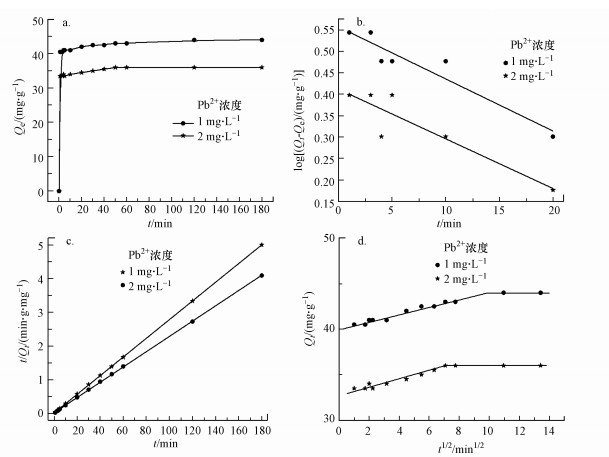 |
| 图 8 吸附量随时间的变化(a)及准一级动力学(b)、准二级动力学(c)、内扩散模型拟合(d) Fig. 8The change of adsorption capacity with time(a) and the quasi first order kinetics(b), quasi second order kinetics(c), internal diffusion model fitting(d) |
式中, Qe和Qt分别为吸附平衡和t时的吸附量(mg·g-1);k1为准一级吸附速率常数(min-1);k2为准二级吸附速率常数(g·mg-1·min-1);kp为颗粒内扩散速率常数(g·mg-1·min-1);C为吸附常数.
动力学参数拟合结果如图 8和表 2所示, 准二级动力学模型可以更好地描述M-C3N4-sol对Pb2+的吸附过程, 表明其速度限制步骤可能主要是化学吸附, 而不是单一的分子传质(Ho, 2006).准二级动力学参数k2随Pb2+浓度增加而降低, 表明M-C3N4-sol更适用于对低浓度Pb2+的吸附.内扩散模型中, 实验数据点主要分布在两段直线上, 第一段表示Pb2+从溶液中扩散至M-C3N4-sol表面的过程, 第二段表示吸附和解吸达到平衡的过程(汪赛奇等, 2014).拟合曲线未过原点, 说明粒子内扩散并不是唯一控制吸附速率的步骤(Javanbakht et al., 2016).
表 2(Table 2)
| 表 2 动力学模型拟合参数 Table 2 The kinetics model fitting parameters | ||||||||||||||||||||||||||||||||
表 2 动力学模型拟合参数 Table 2 The kinetics model fitting parameters
| ||||||||||||||||||||||||||||||||
3.5 吸附等温线与热力学为了描述吸附剂和重金属离子之间的吸附特性, 利用Langmuir等温模型(式(5))和Freundlich等温模型(式(6))对288、298、308 K时M-C3N4-sol对Pb2+的吸附数据进行拟合分析.
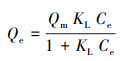 | (5) |
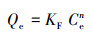 | (6) |
由图 9和表 3可知, Freundlich等温模型比Langmuir等温模型更适合描述吸附过程, 说明Pb2+在M-C3N4-sol表面为非均匀的多层吸附过程(Xu et al., 2016).
图 9(Fig. 9)
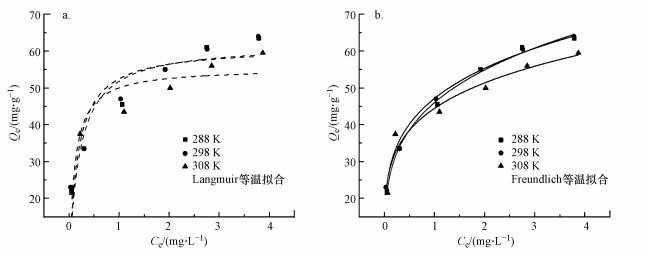 |
| 图 9 Langmuir(a)和Freundlich(b)等温模型拟合结果 Fig. 9Langmuir(a) and Freundlich isothermal model fitting results |
表 3(Table 3)
| 表 3 等温模型拟合参数 Table 3 Isotherm model fitting parameters | ||||||||||||||||||||||||||||||||||||
表 3 等温模型拟合参数 Table 3 Isotherm model fitting parameters
| ||||||||||||||||||||||||||||||||||||
为探究吸附过程中能量的变化, 依据热力学方程(式(7)~(9))对吸附过程进行进一步研究, 分析计算吉布斯自由能变ΔG0(kJ·mol-1)、焓变ΔH0(kJ·mol-1)、熵变ΔS0(kJ·mol-1·K-1).
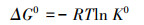 | (7) |
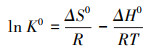 | (8) |
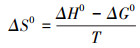 | (9) |
由表 4可知, ΔG0皆为负值, 表明吸附过程是一个自发的过程.ΔH0<0, 表明吸附过程为放热过程, 升高温度有利于吸附的进行.ΔS0>0, 表明M-C3N4-sol与Pb2+之间的高亲和力及吸附过程中固液界面的无序性增加.当温度从288 K升高至308 K时, 吸附量逐渐降低, 说明高温不利于M-C3N4-sol对Pb2+的吸附.
表 4(Table 4)
| 表 4 热力学参数结果 Table 4 Thermodynamic fitting parameters | ||||||||||||||||
表 4 热力学参数结果 Table 4 Thermodynamic fitting parameters
| ||||||||||||||||
3.6 与其他常规吸附剂的对比将M-C3N4-sol与已报道的其他几种吸附剂对Pb2+的吸附性能进行对比, 结果如表 5所示.对比发现, 所制得溶胶吸附剂M-C3N4-sol在吸附容量、应用条件等方面均具有一定优势, 且在较短的时间内即可达到较高的吸附量, 是非常有潜力的吸附材料.
表 5(Table 5)
| 表 5 M-C3N4-sol与其他几种吸附剂对Pb2+的吸附性能对比 Table 5 Performance of Pb2+ adsorption by M-C3N4-sol compared with several other adsorbents | ||||||||||||||||||||||||||||||||
表 5 M-C3N4-sol与其他几种吸附剂对Pb2+的吸附性能对比 Table 5 Performance of Pb2+ adsorption by M-C3N4-sol compared with several other adsorbents
| ||||||||||||||||||||||||||||||||
3.7 循环使用性能吸附后的M-C3N4-sol经过低浓度硝酸溶液的洗涤完成脱附再生, 可继续用于吸附.如图 10所示, 经过3次循环后, M-C3N4-sol对Pb2+的吸附容量仍有第一次的85%, 说明M-C3N4-sol吸附剂拥有不错的循环使用性能.对再生后的M-C3N4-sol再次进行TEM和FI-TR分析, 结果如图 11所示, 再生后的形貌、结构组成及化学基团与吸附前保持一致, 并未在再生时遭到破坏.
图 10(Fig. 10)
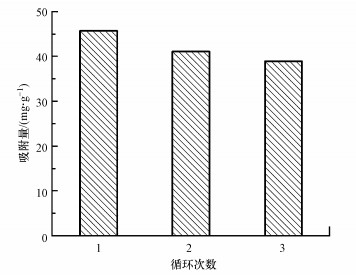 |
| 图 10 M-C3N4-sol的再生性能 Fig. 10Regeneration performance of M-C3N4-sol |
图 11(Fig. 11)
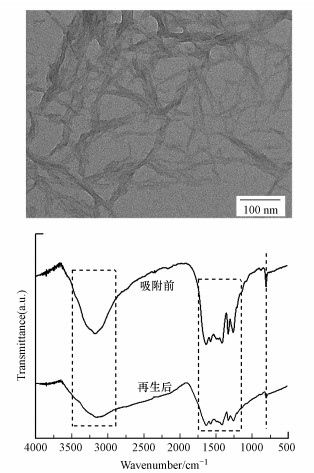 |
| 图 11 M-C3N4-sol再生后的TEM及FTIR图 Fig. 11TEM and FTIR images of regenerated M-C3N4-sol |
3.8 吸附机理分析为更深入探讨M-C3N4-sol吸附Pb2+的机理, 对吸附Pb2+前后的样品进行了FT-IR分析.如图 12所示, 吸附后, 3000~3750 cm-1处代表氨基和羟基的峰明显变宽, 表明氨基和羟基可能参与了吸附(Xiao et al., 2019).1332、1265 cm-1两处分别对应仲氨基、叔氨基的峰强度减小, 说明未完全缩合的氨基参与了吸附(Shen et al., 2015).
图 12(Fig. 12)
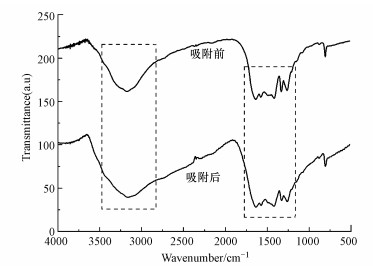 |
| 图 12 M-C3N4-sol吸附Pb2+前后的FT-IR图谱 Fig. 12FT-IR spectra of before and after adsorption Pb2+ by M-C3N4-sol |
通过XPS对吸附Pb2+前后的样品进行进一步分析.如图 13及图 14所示, XPS全谱及Pb4f谱中Pb4f轨道峰的出现说明Pb2+被成功吸附在吸附剂表面.吸附后Na元素几乎消失, 表明吸附剂表面的Na+与Pb2+发生了离子交换.N1s谱中, 对应—NHx与C—N=C的峰的结合能在吸附后都发生了偏移.说明三-s-三嗪环末端的氨基与Pb2+发生络合, 改变了元素轨道周围的电子密度(Fang et al., 2020).同时, 结构中芳香环通过阳离子-π作用与Pb2+发生结合, 完成吸附(Ghadim et al., 2013).O1s谱中, 连接羟基的O—C—N未发生偏移, 说明羟基并未参与到Pb2+的吸附中.
图 13(Fig. 13)
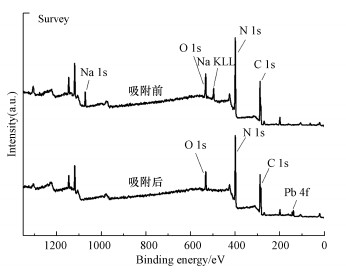 |
| 图 13 M-C3N4-sol吸附Pb2+前后的XPS全谱 Fig. 13XPS full spectrum of before and after adsorption Pb2+ by M-C3N4-sol |
图 14(Fig. 14)
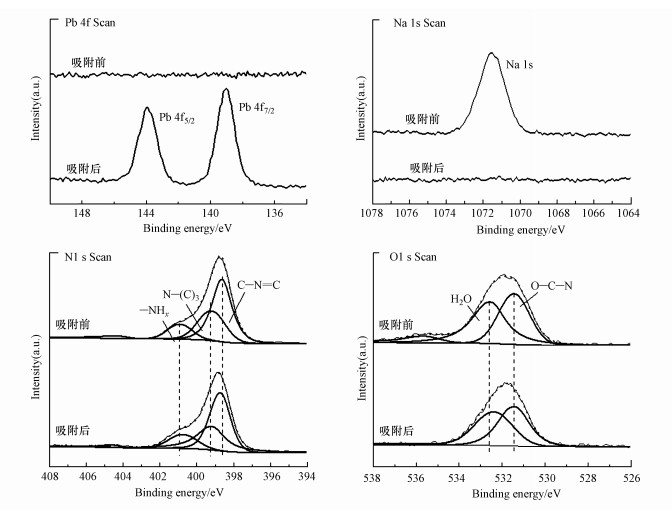 |
| 图 14 M-C3N4-sol吸附Pb2+前后的XPS高分辨图 Fig. 14XPS high-resolution spectrum of before and after adsorption Pb2+ by M-C3N4-sol |
基于上述分析, M-C3N4-sol对Pb2+的吸附过程主要基于分散在水中的纳米溶胶吸附剂通过暴露出的大量氨基官能团及π-π共轭结构形成了大量的吸附位点, 在静电引力、离子交换、氨基的表面络合和阳离子-π键的协同作用下, 对水中的Pb2+发生快速的吸附.吸附后, 引入的阳离子改变了纳米纤维之间的氢键, 进而促进了纳米网状纤维向片层结构的重新堆叠.如图 15所示, 吸附后高度分散的氮化碳胶体发生脱稳, 相互堆叠形成大颗粒, 在重力作用下自然沉降, 随后通过简单的过滤提取出来, 从而完成固液分离.
图 15(Fig. 15)
 |
| 图 15 M-C3N4-sol吸附后固液分离 Fig. 15Solid-liquid separation occurred after adsorption |
4 结论(Conclusions)1) 制得的C3N4-sol呈纳米级的纤维结构, 有着极佳的水分散性, 并保留了原本g-C3N4的骨架结构及大量氨基官能团, 因此, 提供了更多的吸附位点与重金属离子结合, 从而大大提高了吸附效率及性能.
2) M-C3N4-sol、U-C3N4-sol对各种重金属离子的吸附量均较g-C3N4大幅提高, 且对于Pb2+具有极佳的选择性, M-C3N4-sol的吸附性能优于U-C3N4-sol.
3) M-C3N4-sol对Pb2+的吸附量随pH上升而增加, 吸附过程符合准二级动力学模型和Freundlich等温模型, 为化学吸附为主的非均匀的多层吸附过程.热力学分析表明, 吸附过程是自发的放热过程.
4) 机理分析表明吸附过程主要是在静电引力、离子交换、氨基的表面络合和阳离子-π键的协同作用下进行.
5) 吸附后, M-C3N4-sol发生脱稳即可实现固液分离, 经稀硝酸脱附再生后, 吸附容量没有明显降低.
参考文献
| Burakov A E, Galunin E V, Burakova I V, et al. 2018. Adsorption of heavy metals on conventional and nanostructured materials for wastewater treatment purposes: A review[J]. Ecotoxicology and Environmental Safety, 148: 702-712. DOI:10.1016/j.ecoenv.2017.11.034 |
| Chen Z, Zhang S, Liu Y, et al. 2020. Synthesis and fabrication of g-C3N4-based materials and their application in elimination of pollutants[J]. Science of the Total Environment, 731: 139054. DOI:10.1016/j.scitotenv.2020.139054 |
| Cheng F, Yan J, Zhou C, et al. 2016. An alkali treating strategy for the colloidization of graphitic carbon nitride and its excellent photocatalytic performance[J]. Journal of Colloid and Interface Science, 468: 103-109. DOI:10.1016/j.jcis.2016.01.044 |
| Chowdhury I, Duch M C, Mansukhani N D, et al. 2013. Colloidal properties and stability of graphene oxide nanomaterials in the aquatic environment[J]. Environmental Science & Technology, 47: 6288-6296. |
| Crini G, Peindy H N, Gimbert F, et al. 2007. Removal of C.I. Basic Green 4 (Malachite Green) from aqueous solutions by adsorption using cyclodextrin-based adsorbent: Kinetic and equilibrium studies[J]. Separation and Purification Technology, 53: 97-110 |
| Fang Y, Lv X, Xu X, et al. 2020. Three-dimensional nanoporous starch-based material for fast and highly efficient removal of heavy metal ions from wastewater[J]. International Journal of Biological Macromolecules, 164: 415-426. DOI:10.1016/j.ijbiomac.2020.07.017 |
| Fronczak M. 2020. Adsorption performance of graphitic carbon nitride-based materials: Current state of the art[J]. Journal of Environmental Chemical Engineering, 8: 104411. DOI:10.1016/j.jece.2020.104411 |
| Ghadim E E, Manouchehri F, Soleimani G, et al. 2013. Adsorption properties of tetracycline onto graphene oxide: Equilibrium, kinetic and thermodynamic studies[J]. PLoS One, 8: e79254. DOI:10.1371/journal.pone.0079254 |
| 韩丽珍, 杨艺欣, 张婧, 等. 2020. 石墨相氮化碳材料在样品前处理中的研究进展[J]. 色谱, 38: 28-35. |
| Ho Y S. 2006. Review of second-order models for adsorption systems[J]. Journal of Hazardous Materials, 136: 681-689. DOI:10.1016/j.jhazmat.2005.12.043 |
| Javanbakht V, Ghoreishi S M, Habibi N, et al. 2016. A novel magnetic chitosan/clinoptilolite/magnetite nanocomposite for highly efficient removal of Pb(Ⅱ) ions from aqueous solution[J]. Powder Technology, 302: 372-383. DOI:10.1016/j.powtec.2016.08.069 |
| Kul A R, Koyuncu H. 2010. Adsorption of Pb(Ⅱ) ions from aqueous solution by native and activated bentonite: Kinetic, equilibrium and thermodynamic study[J]. Journal of Hazardous Materials, 179: 332-339. DOI:10.1016/j.jhazmat.2010.03.009 |
| Lata S, Samadder S R. 2016. Removal of arsenic from water using nano adsorbents and challenges: A review[J]. Journal of Environmental Management, 166: 387-406. DOI:10.1016/j.jenvman.2015.10.039 |
| Mohan D, Pittman C U, Bricka M, et al. 2007. Sorption of arsenic, cadmium, and lead by chars produced from fast pyrolysis of wood and bark during bio-oil production[J]. Journal of Colloid and Interface Science, 310: 57-73. DOI:10.1016/j.jcis.2007.01.020 |
| Nadeem R, Nasir M H, Hanif M S. 2009. Pb(Ⅱ) sorption by acidically modified Cicer arientinum biomass[J]. Chemical Engineering Journal, 150: 40-48. DOI:10.1016/j.cej.2008.12.001 |
| Peng W, Li H, Liu Y, et al. 2017. A review on heavy metal ions adsorption from water by graphene oxide and its composites[J]. Journal of Molecular Liquids, 230: 496-504. DOI:10.1016/j.molliq.2017.01.064 |
| Seyed A, Dastgheib David A. 2002. A model for the adsorption of single metal ion solutes in aqueous solution onto activated carbon produced from pecan shells[J]. Carbon, 40: 1843-1851. DOI:10.1016/S0008-6223(02)00037-4 |
| Shen C, Chen C, Wen T, et al. 2015. Superior adsorption capacity of g-C3N4 for heavy metal ions from aqueous solutions[J]. Journal of Colloid and Interface Science, 456: 7-14. DOI:10.1016/j.jcis.2015.06.004 |
| Stafiej A, Pyrzynska K. 2008. Solid phase extraction of metal ions using carbon nanotubes[J]. Microchemical Journal, 89: 29-33. DOI:10.1016/j.microc.2007.11.001 |
| Tian J, Liu Q, Ge C, et al. 2013. Ultrathin graphitic carbon nitride nanosheets: a low-cost, green, and highly efficient electrocatalyst toward the reduction of hydrogen peroxide and its glucose biosensing application[J]. Nanoscale, 5: 8921-8924. DOI:10.1039/c3nr02031b |
| Trefalt G, Behrens S H, Borkovec M. 2016. Charge regulation in the electrical double layer: Ion adsorption and surface interactions[J]. Langmuir, 32: 380-400. DOI:10.1021/acs.langmuir.5b03611 |
| 汪赛奇, 唐玉朝, 黄显怀, 等. 2014. 还原共沉淀法制备Fe-Ti复合氧化物及其吸附水中As(Ⅴ)的研究[J]. 环境科学学报, 34(8): 2014-2021. |
| Wang Z, Tu Q, Sim A, et al. 2020. Superselective removal of lead from water by two-dimensional MoS2 nanosheets and layer-stacked membranes[J]. Environmental Science & Technology, 54: 12602-12611. |
| Xiao G, Wang Y, Xu S, et al. 2019. Superior adsorption performance of graphitic carbon nitride nanosheets for both cationic and anionic heavy metals from wastewater[J]. Chinese Journal of Chemical Engineering, 27: 305-313. DOI:10.1016/j.cjche.2018.09.028 |
| Xu H, Zhu B S, Ren X M, et al. 2016. Controlled synthesized natroalunite microtubes applied for cadmium(Ⅱ) and phosphate co-removal[J]. Journal of Hazardous Materials, 314: 249-259. DOI:10.1016/j.jhazmat.2016.04.044 |
| Zhang C F J, Pinilla S, Mceyoy N, et al. 2017. Oxidation stability of colloidal two-dimensional Titanium Carbides (MXenes)[J]. Chemistry of Materials, 29: 4848-4856. DOI:10.1021/acs.chemmater.7b00745 |
| Zhang Y, Zhou Z, Shen Y, et al. 2016. Reversible assembly of graphitic carbon nitride 3D network for highly selective dyes absorption and regeneration[J]. ACS Nano, 10: 9036-9043. DOI:10.1021/acsnano.6b05488 |
| Zhu L, You L, Wang Y, et al. 2017. The application of graphitic carbon nitride for the adsorption of Pb2+ ion from aqueous solution[J]. Materials Research Express, 4: 075606. DOI:10.1088/2053-1591/aa7903 |
| 张帆, 李菁, 谭建华, 等. 2013. 吸附法处理重金属废水的研究进展[J]. 化工进展, 32: 2749-2756. |
