 , 吴川1
, 吴川1
 , 薛生国1, 刘敏2, 刘梓毓1, 何璇1
, 薛生国1, 刘敏2, 刘梓毓1, 何璇11. 中南大学冶金与环境学院, 长沙 410083;
2. 南华大学核科学与技术学院, 衡阳 421001
收稿日期: 2020-12-08; 修回日期: 2021-01-26; 录用日期: 2021-01-26
基金项目: 国家自然科学基金(No.42177392);国家自然科学基金(No.41771512)
作者简介: 安文慧(1994-), 女, E-mail: wenhuian@csu.edu.cn
通讯作者(责任作者): 吴川, E-mail: wuchuan@csu.edu.cn
摘要:生物炭的施用对土壤铁(氢)氧化物还原、砷(As)的形态转化有重要作用,极大地影响了As的环境行为.本文研究了生物炭/AQDS(蒽醌-2,6-二磺酸盐)对含As(Ⅲ)水铁矿化学还原和异化还原的影响,探索了由此产生的非生物和生物过程中Fe和As的形态转化及次生矿物的形成.结果表明,生物炭和AQDS的添加可以促进水铁矿的化学还原和As(Ⅲ)的化学氧化,AQDS促进水铁矿化学还原和As释放的能力强,生物炭促进As形态转化的能力强;生物组在添加Shewanella oneidensis MR-1后发现,生物炭和AQDS的添加可以促进Fe(Ⅱ)的生成,AQDS的添加促进Fe(Ⅱ)的生成、As形态转化和释放的能力要高于生物炭.EEM结果表明,生物炭产生的DOM可以与溶液中的物质发生氧化还原作用从而被消耗.循环伏安曲线在0.25 V处观察到一个小而宽的阳极峰(B),可能对应了As(Ⅲ)氧化为As(Ⅴ).XRD结果显示AQDS处理的非生物组和生物组出现了蓝铁矿,表明AQDS可以促进次生矿物的生成.EDX-SEM结果表明,新矿物的生成有利于As的固定(BCF:0.73%<BF:1.69%<BAF:1.82%).通过穆斯堡尔谱拟合,得到AQDS处理非生物组和生物组蓝铁矿的相对含量分别为13.1%和26.3%.本研究有助于理解生物炭和铁还原菌对As和Fe地球化学循环的影响,为降低土壤As有效性和毒性、降低As污染环境风险提供了理论依据.
关键词:异化铁还原As(Ⅲ)水铁矿生物炭蓝铁矿
Effects of biochar on the arsenic and mineral transformation in the reduction process of As(Ⅲ)-adsorbed ferrihydrite
AN Wenhui1
 , WU Chuan1
, WU Chuan1
 , XUE Shengguo1, LIU Min2, LIU Ziyu1, HE Xuan1
, XUE Shengguo1, LIU Min2, LIU Ziyu1, HE Xuan11. School of Metallurgy and Environment, Central South University, Changsha 410083;
2. College of Nuclear science and Technology, University of South China, Hengyang 421001
Received 8 December 2020; received in revised from 26 January 2021; accepted 26 January 2021
Abstract: Biochar plays an important role in the reduction of iron (hydr)oxide and the transformation of arsenic (As) in soils, greatly affects the environmental behavior of As. The effects of biochar and anthraquinone-2, 6- disulphonate (AQDS) on the process of As(Ⅲ)-adsorbed ferrihydrite chemical and microbial reduction were studied. The behavior of Fe and As and the production of secondary minerals in the abiotic and biological processes were explored. Results showed that the addition of biochar and AQDS can promote the chemical reduction of ferrihydrite and the chemical oxidation of As(Ⅲ). AQDS has a strong ability to facilitate the chemical reduction of ferrihydrite as well as the release of As, and biochar has a strong ability to promote the speciation transformation of As. During the microbial reduction, biochar and AQDS can promote the reduction of iron mineral, while AQDS has the stronger ability to promote Fe(Ⅱ) generaion, As speciation transformation and As release than biochar. EEM results showed that DOM produced by biochar could be consumed by redox reaction with substances in solutions. Cyclic voltammetry (CV) result showed that a small and wide anodic peak (B) was observed at 0.25 V, possibly corresponding to the oxidation of As(Ⅲ) to As(Ⅴ). XRD results showed that vivianite was produced only in AQDS treatment under abiotic and biological conditions, indicating that AQDS can promote the generation of secondary minerals. The mapping of As indicated that As could be adsorbed on the vivianite or incorporated into the vivianite structure to reduce its amount released (BCF: 0.73%<BF: 1.69%<BAF: 1.82%). The M?ssbauer results showed that the relative contents of vivianite in AQDS treatment under abiotic and biological conditions were 13.1% and 26.3%, respectively. The study is important for a better understanding of the effects of biochar and iron-reducing bacteria on the geochemical cycles of As and Fe, providing a theoretical basis for reducing the availability and toxicity of As in soils and the environmental risk of As pollution.
Keywords: bio-induced iron reductionAs(Ⅲ)ferrihydritebiocharvivianite
1 引言(Introduction)地下水和土壤砷(As)污染已成为严重的环境问题, 威胁着全球人类健康(Wu et al., 2020).在全球70多个国家, 地下水As浓度为0.5~5000 μg·L-1, 在波兰西南部的下西里西亚, 土壤中As浓度可高达1.81×104 mg·kg-1(Ravenscroft et al., 2009; Singh et al., 2015).As中毒会造成黑变病、角化病、坏疽和皮肤癌等, 长期接触无机As还会导致消化系统、呼吸系统、心血管系统、造血系统、内分泌系统、肾脏系统、神经系统和生殖系统等多种紊乱, 最终导致癌症(Mandal et al., 1996; Maharjan et al., 2005; Singh et al., 2015).As在环境中通常以亚砷酸盐(As(Ⅲ))和砷酸盐(As(Ⅴ))等含氧阴离子的形式存在, 铁氢氧化物广泛分布于土壤、沉积物和地表水中, 因其具有大的比表面积, 众多的吸附位点和正的表面电荷, 对As有较强的吸附能力.铁还原对As的迁移和形态转化有重要的影响, 一方面铁的还原溶解使以吸附或共沉淀与铁矿物结合的As释放出来, 增加了As的移动性;另一方面铁还原使环境中二价铁浓度增加, 为次生矿物的生成提供条件, 可以产生如针铁矿、磁铁矿、绿锈、蓝铁矿、菱铁矿、赤铁矿、含砷硫化矿等多种次生矿物, 其中可能伴随着As的再吸附和共沉淀, 抑制了As的移动性, 甚至还可能发生As的形态转化(Saalfield et al., 2009; Kocar et al., 2010; Li et al., 2012; Guo et al., 2013; Muehe et al., 2016; 韩蕊, 2016; 吴松等, 2018).韩蕊等(2016)发现MR-1野生型和突变体还原水铁矿, 在培养期的前两天, 次生矿物均以针铁矿和赤铁矿为主.Li等(2012)分别以磷酸盐(PBS)和piperazine-1, 4-bis(2-ethanesulfonic acid) (PIPES)为缓冲液时, Shewanella decolorationis S12还原水铁矿产生的次生矿物分别为蓝铁矿和磁铁矿.Saalfield等(2009)研究脱硫弧菌处理含As(Ⅲ/Ⅴ)-水铁矿、乳酸盐、硫酸盐的碳酸盐缓冲液, 水铁矿的硫化作用导致了磁铁矿、单质硫和微量铁硫化物的形成, As(Ⅴ)-水铁矿体系中As浓度逐渐降低, As(Ⅲ)-水铁矿体系中随着铁矿物被还原As浓度经短暂上升后最终降低.Kocar等(2010)发现生物硫酸盐还原过程, 诱导了As(Ⅴ)-水铁矿固相相变和As形态变化, 生成了绿锈、磁铁矿、含砷硫化矿(As2S3)等次生矿物.
在铁还原诱导产生次生矿物生成的过程中, 微生物异化铁还原是重要驱动力(O′Loughlin et al., 2010; 司友斌等, 2015).腐殖质能够作为电子受体加速电子传递, 微生物还原腐殖质, 随后电子从还原性的腐殖质转移到难溶的铁(氢)氧化物, 显著提高微生物的铁矿物还原速率(Piepenbrock et al., 2014).生物炭可以提高土壤持水能力、增加养分、修复环境污染, 影响微生物群落, 常作为土壤改良剂被广泛应用(Beesley et al., 2011);铁生物炭(Fe-BC)复合材料可以结合BC与Fe的吸附、还原性和络合能力的复合材料, 被广泛应用于废水或土壤修复中去除潜在的有毒元素(如As)(Sun et al., 2019).研究表明, 生物炭可以作为电子穿梭体加速微生物和铁矿物之间的电子转移, Kappler等(2014)研究表明生物炭浓度为5 g·L-1和10 g·L-1可以促进Shewanella oneidensis MR-1微生物还原水铁矿, 并且生物炭的添加使水铁矿还原产物由磁铁矿(Fe3O4)转变为菱铁矿(FeCO3).吴松等(2018)研究表明, 在培养初期, 活性炭和生物炭通过抑制菌的生长, 抑制了异化铁还原过程;随后Shewanella oneidensis MR-1逐渐适应反应环境, 在反应结束时, 活性炭和生物炭显著提高了反应体系中Fe(Ⅱ)/Fe(T), 促进了次生矿物蓝铁矿和菱铁矿的产生, 在这个过程中As(Ⅴ)可以被次生矿物蓝铁矿所固定, 从而减少了As(Ⅴ)释放量.
铁(氢)氧化物的还原溶解会导致吸附的As释放, 然而在还原溶解过程中可能发生矿物转化, 形成次生矿物, 这些次生矿物可能会发生As的再吸附, 减少As的释放量.然而, 生物炭促进铁(氢)氧化物的生物还原是否会导致As(Ⅲ)释放或固定以及其相关机制尚不清楚, 需要进一步研究.大量的研究表明, 微生物还原含As(Ⅲ)铁氧化物过程中可能会出现As(Ⅲ)形态的转变(氧化, 甲基化)(Muehe et al., 2013; 汪明霞等, 2014; 王娟等, 2015).As在环境中的氧化还原作用对As的毒性与活性有很大的影响, 越来越多的证据表明有机质参与了环境中As和Fe的形态转化, 所以在评估污染物的命运时必须考虑有机物本身的化学作用.为了充分了解异化铁还原对As(Ⅲ)的影响, 本文研究了生物炭/AQDS对含As(Ⅲ)水铁矿还原的影响, 探索了由此产生的非生物和生物过程中Fe和As的形态及矿物相的转化, 探究了胞外电子传递介导的微生物异化还原水铁矿耦合As的反应机制, 借助电化学和光谱学等手段方法探究含As水铁矿在微生物还原作用下的溶液中Fe和As的氧化还原特性, 为降低土壤As的有效性和毒性、降低As污染环境风险提供理论依据.
2 材料与方法(Materials and methods)2.1 微生物活化及材料制备取保存于-80 ℃条件下的Shewanella oneidensis MR-1(中国科学院生态环境研究中心), 接种至LB培养基中, 在30 ℃条件下培养至后对数期, 7500 ×g离心5 min, 用在121 ℃高压蒸汽灭菌20 min后的PBS缓冲液(磷酸盐缓冲液, 20 mmol·L-1, pH=7)洗涤后, 制成菌悬液(OD600=2.0)(Jiang et al., 2013; Kappler et al., 2014).
水铁矿制备具体方法如下: 将1 mol·L-1氢氧化钠(NaOH)逐滴加入到1 L 0.4 mol·L-1三氯化铁(FeCl3)溶液中, 直至pH到7.0, 离心(8000 ×g, 5 min)得到沉淀后, 用去离子水洗涤去除盐离子, 得到水铁矿(Jiang et al., 2013).将制得的水铁矿真空冷冻干燥, 研磨后过300目筛备用.
根据Zou等(2018)制备生物炭, 在氮气保护下, 将水稻秸秆在马弗炉(中国长沙远东热电有限公司SX2-5-12)中600 ℃下热解6 h制备而成.生物炭用去离子水清洗, 在80 ℃条件下烘干, 研磨过筛(<48 μm).将生物炭置于充满100%N2真空箱中过夜, 然后在真空箱中用PBS缓冲液配置50 g·L-1的悬浮液, 再以超声波探头对悬浮液处理10 min以使生物炭分布均匀(Kappler et al., 2014).
2.2 实验方法实验在真空厌氧箱中进行, 样品瓶为150 mL血清瓶.除菌悬液外, 所有溶液均用N2处理去除溶解氧, 并用厚的丁基橡胶塞子和铝箔密封盖住(Jiang et al., 2013).将上述配制好的缓冲液、溶液、培养基、悬浮液, 以及其他实验所需要的器具用报纸包裹, 进行高压蒸汽灭菌, 温度为121 ℃, 冷却至室温后使用.
实验处理如下(所有样品均含1 mmol·L-1 NaAsO2和30 mmol·L-1乳酸钠): 对照, 150 mL PBS (CK);处理A, 水铁矿粉末悬浮液150 mL (最终浓度30 mmol·L-1)(F);处理B, 水铁矿和生物炭悬浮液150 mL(浓度30 mmol·L-1, 5 g·L-1)(CF);处理C, 含AQDS(最终浓度为0.1 mmol·L-1)和水铁矿粉末(浓度为30 mmol·L-1)悬浮液150 mL(AF).将密封好的样品瓶置于振荡箱中, 以180 r·min-1的培养24 h后, 用无菌注射器取样, 过滤后进行总As(As(T))含量测定.
接种体积分数为5% Shewanella oneidensis MR-1细胞悬液于血清瓶(BF, BAF, BCF), 对照组接种同样体积无菌水(F, AF, CF).将所有处理置于振荡箱中, 180 r·min-1, 30 ℃培养.所有样品被分成两部分, 一部分是用于12 d的Fe和As的浓度测定, 每隔24 h进行取样, 取100 μL样液, 用900 μL 1 mol·L-1的HCl溶液浸提1 h后过0.22 μm滤膜, 用于测定Fe(Ⅱ)和Fe(T)(Kappler et al., 2014);取样液直接过滤,用于As(T)和As(Ⅲ)含量测定.另一部分是破坏性取样, 培养0、7、14、21、120 d的固体样品用于X射线衍射(XRD)和穆斯堡尔谱测定, 培养120 d后的上清液经过滤后用于循环伏安曲线(CV)和三维荧光光谱测定.每个处理中不同样品设置3个平行样.
2.3 数据处理本实验采用无菌注射器进行采样, 通过邻菲罗啉比色法对Fe含量进行测定(Kappler et al., 2014).采用高效液相色谱-氢化物(HPLC-HG-AFS)原子荧光光谱法(Shimadzu LC-15C Suzhou Instruments Co., China and HG-AFS, AFS-8230, Beijing Jitian Instruments Co., China)测定As(T)和As(Ⅲ)的浓度;三维荧光光谱的测定通过荧光分光光度计测定(F-4600, Hitachi, Japan) (激发采样间隔: 2.0 nm, 发射采样间隔: 5.0 nm;扫描速度: 12000 nm·min-1;激发狭缝宽度: 10.0 nm, 激发狭缝宽度: 10.0 nm, PMT电压: 400 V).循环伏安曲线通过电化学工作站测定(Chi660E, Shanghai Chenhua Instrument Co., China)(玻碳电极为工作电极, 铂片电极为对电极, Ag/AgCl电极为参比电极, 电势范围为-1.5~1.5 V, Init E=-1.5 V, High E= 1.5 V, Low E=-1.5 V, Scan Rate (V·s-1)=0.05和0.005, Sample Interval=0.001 V, Quiet Time=2 s, Sensitivity (A/V)=0.001).最终产物经冷冻干燥, 300目过筛后用于XRD (TTR Ⅲ, Rigaku Corporation, Japan), SEM-EDX分析(日立S-4800)和穆斯堡尔谱分析(Wang et al., 2018).数据分析使用Microsoft Excel 2010和SPSS 19.0, 通过MDI Jade 5.0对XRD数据进行分析, 使用MossWinn 4.0对矿物进行铁谱分析, 图采用Origin 9.5绘制.
3 结果(Results)3.1 不同处理溶液中砷的初始浓度水铁矿(F)、AQDS+水铁矿(AF)、生物炭+水铁矿(CF)反应24 h后, 溶液中的As(T)含量如图 1所示.结果表明, F、AF、CF组上清液中As(T)浓度分别为22.0、23.1、28.3 mg·L-1, 对照组为78.2 mg·L-1, 吸附率分别为71.9%、70.4%、63.8%.相对于水铁矿(F)处理组, 不同缓冲液中AQDS +水铁矿(AF)对As(Ⅲ) 的吸附效果均不显著, 生物炭+水铁矿(CF)处理抑制了对As(Ⅲ) 吸附.
图 1(Fig. 1)
 |
| 图 1 不同处理(对照CK、水铁矿F、AQDS+水铁矿AF、生物炭+水铁矿CF)溶液中As(T)浓度 (不同字母表示存在显著性差异,p < 0.05) Fig. 1The concentrations of total As in CK and after adding ferrihydrite (F), AQDS + ferrihydrite (AF) and biochar + ferrihydrite (CF) (Different letters denote significant difference at p<0.05) |
PO43-可以与As竞争铁(氢)氧化物表面的吸附位点, 由于竞争吸附作用, 使As(Ⅲ) 的吸附量减少(Stachowicz et al., 2008).研究表明, As(Ⅲ) 的初始浓度大于100 mg·L-1时, 水铁矿的吸附率可达到90%, 与土壤及其胶体对As(Ⅴ)具有更强的吸附能力不同, As(Ⅲ) 更容易被水铁矿和水铁矿胶体吸附, 这可能是由于As(Ⅲ) 优先结合双配位羟基, 而As(Ⅴ)则优先结合三配位羟基所造成(马玉玲等, 2018);此外, As(Ⅴ)在无定形水铁矿上可以形成内层表面配位体, 主要是通过形成内圈型表面络合物被吸附和固定, 属于专性吸附;而As(Ⅲ) 在水铁矿上不仅存在内层配位, 还有外层配位, 既可形成内圈型表面络合物又可形成外圈型表面络合物, 吸附类型包括专性吸附和静电吸附(Goldberg et al., 2001; 孙林等, 2016).马玉玲等(2018)研究表明, 水铁矿及其胶体对As(Ⅲ) 的吸附速度和吸附量均高于As(Ⅴ), 吸附易于进行且为多层吸附.结合Wu等(2020)可知, 在PBS缓冲液中不同处理对As(Ⅲ) 吸附效果高于对As(Ⅴ)的吸附效果, 与马玉玲等(2018)结果一致.
生物炭表面具有大量带负电的有机官能团, 对带正电荷的金属阳离子有良好的吸附作用, 而对以含氧阴离子形式存在的As(Ⅲ)和As(Ⅴ)无明显吸附效果.此外, 生物炭会产生溶解性的有机质, 可以与As(Ⅲ) 竞争水铁矿表面的吸附位点, 减少As(Ⅲ) 的吸附量.Xue等(2019)研究表明, 在较宽的pH范围(4~11)内, 与纯水铁矿相比, 通过共沉淀法制备的腐植酸(HA)与水铁矿可以显著降低As(Ⅲ)和As(Ⅴ)的吸附量, 并且随着HA比例的增加, As(Ⅲ)和As(Ⅴ)的吸附量均降低;纯水铁矿在pH > 6.5时, As(Ⅲ)的吸附量大于As(Ⅴ), 在加入有机质之后, As(Ⅲ)仍比As(Ⅴ)更容易被吸附.
3.2 非生物条件下不同处理溶液中Fe、As变化非生物条件下, 水铁矿(F)、AQDS+水铁矿(AF)、生物炭+水铁矿(CF)溶液中的Fe(Ⅱ)和Fe(Ⅱ)/Fe(T)浓度变化曲线如图 2a, 2b所示.Fe(Ⅱ)含量和Fe(Ⅱ)/Fe(T)不同处理组均先呈现CF>AF>F, 后呈现AF>CF>F的趋势, 表明AQDS和生物炭的添加均可以促进水铁矿的化学还原.反应初期, 生物炭的添加对铁还原的影响大于AQDS, 随后生物炭处理组产生的Fe(Ⅱ)趋于稳定.6 d后AQDS处理组Fe(Ⅱ)的产生量显著高于生物炭处理组, 并在培养结束时达到最大值256 mg·L-1.随着培养时间的延长, AQDS促进铁化学还原的能力更强(Fe(Ⅱ)max, AQDS: 256 mg·L-1, 生物炭: 97.6 mg·L-1).AQDS和生物炭处理组Fe(Ⅱ)/Fe(T)在培养9 d后均出现含量先降低后增加, 并基本维持稳定, AQDS和生物炭处理的Fe(Ⅱ)/Fe(T)最高分别达60.3%、49.0%.
图 2(Fig. 2)
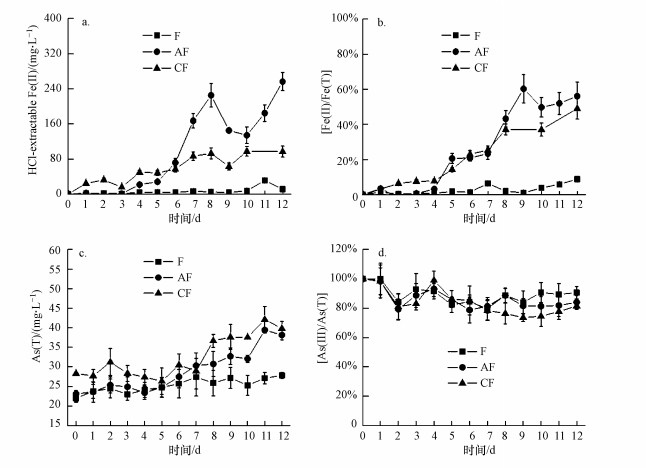 |
| 图 2 非生物条件下,不同处理(水铁矿F、AQDS+水铁矿AF、生物炭+水铁矿CF)溶液中的Fe(Ⅱ) (a),Fe(Ⅱ)/Fe(T) (b),As(T) (c)和As(Ⅲ)/As(T) (d)变化曲线 Fig. 2The changes of Fe(Ⅱ) (a), Fe(Ⅱ)/Fe(T) (b), As(T) (c) and As(Ⅲ)/As(T) (d) during the abiotic redox processes in ferrihydrite (F), AQDS + ferrihydrite (AF) and biochar + ferrihydrite (CF) |
非生物条件下, 水铁矿(F)、AQDS+水铁矿(AF)、生物炭+水铁矿(CF)溶液中的As(T)和As(Ⅲ) /As(T)变化曲线如图 2c, d所示.不同处理上清液As(T)的含量均呈先上升后稳定的变化趋势, CF组As(T)浓度始终均高于AF和F组, CF组和AF组As(T)浓度在第11 d达到最大, F组As(T)浓度在第12 d达到最大, 浓度分别为CF: 42.1 mg·L-1, AF: 39.4 mg·L-1, F: 27.8 mg·L-1.相对于初始浓度, 第12 d不同处理释放到溶液中的As浓度分别为CF: 11.5 mg·L-1, AF: 15.0 mg·L-1, F: 5.86 mg·L-1, 表明非生物条件下, AQDS促进As释放的能力要高于生物炭.由As(Ⅲ) /As(T)变化曲线可知, 生物炭和AQDS的添加促进了As(Ⅲ) 形态的转化, 第7 d后As(Ⅲ) /As(T)呈现为CF<AF<F, 在第10 d溶液中As(Ⅲ) /As(T)为CF 74.5%<AF 81.3%<F 90.7%, 表明生物炭处理组溶液中As(Ⅲ) 形态的转化更为明显.第10 d后, As(Ⅲ) /As(T)比例升高可能与次生矿物的生成有关, As(Ⅲ) 形态转化生成的As(Ⅴ)以吸附/共沉淀的形式固定在固相, 导致上清液As(Ⅲ) /As(T)升高.
3.3 微生物还原含As(Ⅲ) 水铁矿过程中Fe、As变化为了描述微生物还原含As(Ⅲ)水铁矿的过程, Fe(Ⅱ)及Fe(Ⅱ)/Fe(T)12 d的变化曲线如图 3a, 3b所示.通过图 3a可知, 相对于非生物组, 添加了Shewanella oneidensis MR-1之后, 生物炭和AQDS的添加可以促进Fe(Ⅱ)的生成, AQDS的促进效果更加显著.在Shewanella oneidensis MR-1作用下, 不同处理Fe(Ⅱ)的浓度为BAF>BCF>BF, BF、BAF和BCF组均呈先增加后稳定的变化趋势.BAF组Fe(Ⅱ)含量在第8 d达到最大, 为245 mg·L-1, BF组和BCF组Fe(Ⅱ)含量在第11 d达到最大, 分别为41.2 mg·L-1和113 mg·L-1.通过图 3b可知, Fe(Ⅱ)/Fe(T)始终呈BAF>BCF>BF的趋势(第12 d的Fe(Ⅱ)/Fe(T)含量, BAF: 62.8%, BCF: 34.0%, BF: 18.8%).
图 3(Fig. 3)
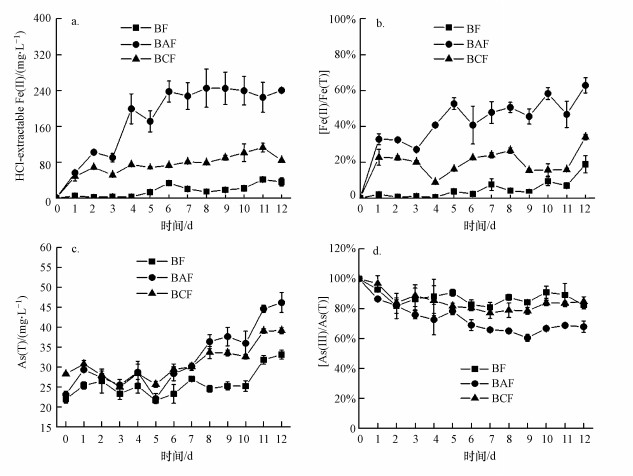 |
| 图 3 生物条件下,不同处理(水铁矿BF、AQDS+水铁矿BAF、生物炭+水铁矿BCF)溶液中的Fe(Ⅱ) (a),Fe(Ⅱ)/Fe(T) (b),As(T) (c)和As(Ⅲ)/As(T) (d)变化曲线 Fig. 3The changes of Fe(Ⅱ) (a), Fe(Ⅱ)/Fe(T) (b), As(T) (c) and As(Ⅲ)/As(T) (d) during the biological redox processes in ferrihydrite (BF), AQDS + ferrihydrite (BAF) and biochar + ferrihydrite (BCF) |
生物条件下, 水铁矿(BF)、AQDS+水铁矿(BAF)、生物炭+水铁矿(BCF)溶液中的As(T)和As(Ⅲ) /As(T)变化曲线如图 3c, 3d所示.在前7 d, 上清液As(T)的含量呈BCF>BAF>BF, 7 d后呈BAF>BCF>BF, 在第7 d, 不同处理上清液As(T)浓度为BCF: 30.1 mg·L-1, BAF: 30.2 mg·L-1, BF: 27.0 mg·L-1), 在第12 d, 呈BAF>BCF>BF(As(T), BCF: 39.1 mg·L-1, BAF: 46.2 mg·L-1, BF: 33.1 mg·L-1). As(Ⅲ) /As(T)在12 d内始终呈现BAF<BCF<BF的趋势, 相对于初始浓度, 第12 d不同处理释放到溶液中的As浓度分别为BCF: 10.8 mg·L-1, BAF: 23.1 mg·L-1, BF: 11.1 mg·L-1, 表明在微生物铁还原过程中, AQDS的添加促进As形态转化和释放的能力要高于生物炭.根据Fe(Ⅱ)浓度及Fe(Ⅱ)/Fe(T)变化可知, 添加了Shewanella oneidensis MR-1之后生物炭和AQDS可以促进Fe(Ⅱ)的生成, AQDS促进异化铁还原的能力更加显著, 溶液中Fe(Ⅱ)的含量BAF组显著高于BF, BCF组, 从而使溶液中释放了更多的As.
非生物条件和生物条件下, 水铁矿(F, BF)、AQDS+水铁矿(AF, BAF)、生物炭+水铁矿(CF, BCF)溶液中的As(T)和As(Ⅲ) /As(T)变化曲线如图 4所示.对比F和AF可知, 在未添加电子穿梭体的条件下, Shewanella oneidensis MR-1的添加略微增加了砷的释放和形态转化(第12 d, As(T): BF 33.1 mg·L-1>F 27.8 mg·L-1, As(Ⅲ) /As(T): BF 82.3%<F 90.6%);AQDS的添加不仅可以促进微生物介导Fe(Ⅱ)的生成, 也可以促进As(Ⅲ) 的释放并耦合As(Ⅲ) 的形态转化(第12 d, As(T): BAF 46.2 mg·L-1>AF 38.1 mg·L-1, As(Ⅲ) /As(T): BAF 67.9%<AF 84.0%);相对于非生物组, 微生物的添加使生物炭处理组溶液中的As(T)含量略微降低, As(Ⅲ) /As(T)略微升高, 这可能是因为生物炭产生的溶解性有机质一部分被微生物代谢消耗, 并未完全用于化学氧化还原反应.
图 4(Fig. 4)
 |
| 图 4 非生物条件和生物条件下,水铁矿(F, BF) (a)、AQDS+水铁矿(AF, BAF) (b)、生物炭+水铁矿(CF, BCF) (c)不同处理溶液中的As(T)和As(Ⅲ)/As(T)变化曲线 Fig. 4The abiotic and biological redox processes that the dynamic changes of As(T) and As(Ⅲ)/As(T) in ferrihydrite (F, BF) (a), AQDS + ferrihydrite (AF, BAF) (b) and biochar + ferrihydrite (CF, BCF) (c) |
3.4 溶液中DOM的动态变化对照组(F)、生物炭处理组(CF)、AQDS处理组(AF), 生物处理组BF、BCF、BAF反应120 d后, 溶液的三维荧光光谱图如图 5所示.由Wu等(2020)可知, 生物炭的添加会使溶液中产生类富里酸和类腐殖酸峰, 然而在反应后的CF组未检测到类似的峰出现, 表明生物炭产生的DOM可能与溶液中的物质发生氧化还原作用从而被消耗殆尽.生物反应后, BF、BAF、BCF组的类蛋白和可溶性微生物代谢产物代表区域观察到了明显的荧光峰, 是由于微生物的活动代谢而造成, 表明溶液中发生了铁的生物还原作用.但由于AQDS具有荧光猝灭作用以及微生物可能附着于溶液中的生物炭中生长, 导致了BAF和BCF组液相中类蛋白和可溶性微生物代谢产物区域的峰强较弱(Wu et al., 2020).
图 5(Fig. 5)
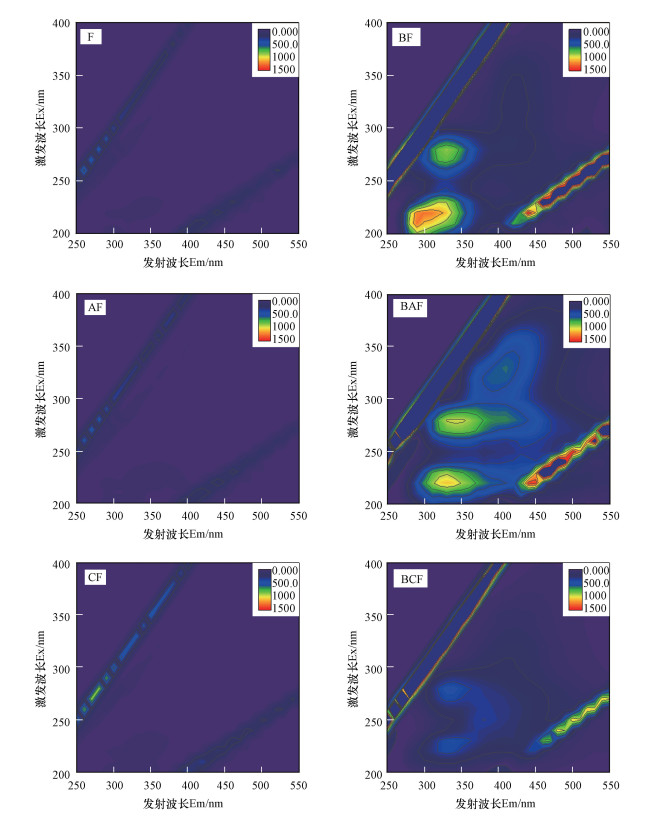 |
| 图 5 非生物条件和生物条件下,反应120 d后不同处理(水铁矿(F, BF)、AQDS+水铁矿(AF, BAF)、生物炭+水铁矿(CF, BCF))的三维荧光光谱图 Fig. 5EEM fluorescence spectra of DOM in ferrihydrite (F, BF), AQDS + ferrihydrite (AF, BAF) and biochar + ferrihydrite (CF, BCF) after the 120 d abiotic and biological reactions |
3.5 不同处理溶液电化学分析在0.005 V·s-1和0.05 V·s-1扫描速度下生物组和非生物组溶液的循环伏安曲线如图 6所示.电位为1.5 V和-1.5 V时存在较大的阳极电流和阴极电流, 可能分别对应氧气和氢气的析出.相对于非生物组, 生物组具有更大的阳极电流, 表明微生物加入后, 溶液中电子转移性能变强.在-0.4 V处观察到一个小而宽的阴极峰(A), 可能对应了O2+ H++ e-= HO2 (Wu et al., 2020).在0.25 V处观察到一个小而宽的阳极峰(B), 可能对应了As(Ⅲ)氧化为As(Ⅴ)(Ottakam Thotiyl et al., 2012), 但可能由于溶液中As含量过低, 峰强相对较弱.F/BF、AF/BAF、CF/BCF组在1.31 V时均检测到一个显著的阳极峰(C), 生物组的峰强高于非生物组, 阳极峰(C)可以表示Fe2+氧化为Fe3+的复杂反应(Wu et al., 2020), 表明生物组和非生物组溶液中均出现了铁的还原, 与铁溶液数据结果一致.AQDS溶液体系中原应有两个阳极峰(D1, D2)和两个阴极峰(E1, E2), 这两对峰代表了一个中间半醌基的连续单电子顺序转移(Q+e-?Q-, Q-+ e-?Q2-) (Wu et al., 2020).图中仅出现了微弱的阴极峰(E1, E2), 对应了醌-半醌-氢醌的还原反应, 表明溶液中的AQDS由于发生化学氧化还原作用被消耗.
图 6(Fig. 6)
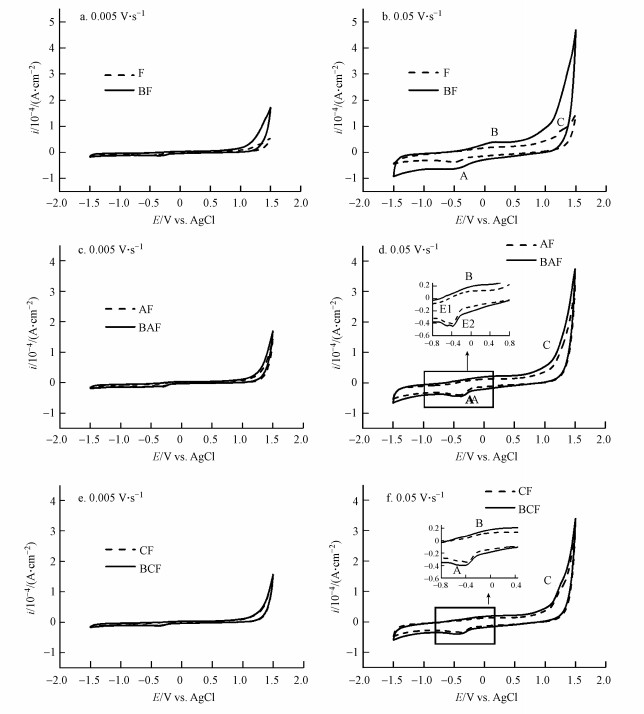 |
| 图 6 非生物条件和生物条件下,反应120 d后水铁矿(F, BF) (a~b)、AQDS+水铁矿(AF, BAF) (c~d)、生物炭+水铁矿(CF, BCF) (e~f)上清液的循环伏安曲线(电势范围:-1.5~1.5 V vs. Ag/AgCl) Fig. 6Cyclic voltammograms of supernatants in ferrihydrite (F, BF) (a~b), AQDS + ferrihydrite (AF, BAF) (c~d) and biochar + ferrihydrite (CF, BCF) (e~f) after the 120 d abiotic and biological reactions (potential range: -1.5-1.5 V vs. Ag/AgCl) |
3.6 铁还原最终产物的矿物学表征反应120 d后, 非生物组中, F组和CF组均未出现次生矿物, 仅在AQDS处理组出现了次生矿物蓝铁矿.次生矿物的生成与其溶解性有关, 25 ℃时蓝铁矿的lgKsp为-36(Postma, 1981; Muehe et al., 2013).实验所用PBS缓冲液中含有20 mmol·L-1的磷酸根, 根据2.2节可知, PBS缓冲液中AF组还原产生Fe(Ⅱ)的含量远远高于其他组(第12 d, F: 11.5 mg·L-1, AF: 256 mg·L-1, CF: 97 mg·L-1), 可能导致了仅在AF组中出现了次生矿物蓝铁矿的生成.除此之外, 生物炭表面具有大量带负电的有机官能团, 对金属阳离子具有很强的吸附能力, 因此可能吸附了溶液中还原产生的Fe(Ⅱ), 抑制了新矿物的形成.
Shewanella oneidensis MR-1还原水铁矿过程中0、7、14、21、120 d生物对照组BF, AQDS处理组BAF, 生物炭处理组BCF中铁矿物矿物相XRD结果如图 7a~7c所示.在PBS缓冲液中, BF、BCF组的XRD谱图均未出现新特征峰, BAF组在第14 d已经出现了次生矿物, 表明AQDS的添加促进了水铁矿矿物相的转化.为了验证XRD的结果, 本课题组对第120 d的矿物进行了SEM形貌分析, 如图 7d~7f所示, BAF组观察到了大量片状矿物的生成, 而BF组仍均为无定形的水铁矿, BCF组也未出现次生矿物.实验结果均与XRD结果相同, 因此可以得知, 新生成的片状矿物为蓝铁矿, 与Muehe等(2016)、吴松等(2018)、Wu等(2018)形貌分析结果一致.生物炭的添加抑制了次生矿物的生成, 可能是由于生物炭对Fe(Ⅱ)的吸附降低了Fe(Ⅱ)的迁移性(Kappler et al., 2014).此外, 新矿物的形成可能是导致液相中As(T)和Fe(Ⅱ)浓度下降的原因之一.
图 7(Fig. 7)
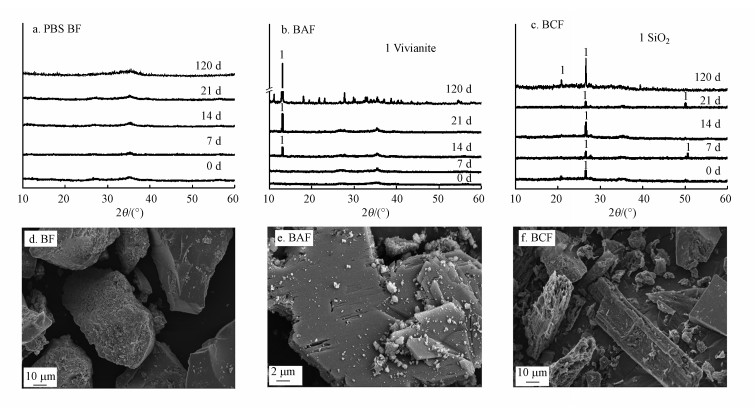 |
| 图 7 Shewanella oneidensis MR-1还原水铁矿0、7、14、21、120 d后不同处理组:水铁矿BF (a)、AQDS +水铁矿BAF (b)、生物炭+水铁矿BCF (c)的铁矿物矿物相变化及处理120 d后BF (d)、BAF (e)、BCF (f)SEM表征 Fig. 7XRD graphs for minerals produced by Shewanella oneidensis MR-1 reduction after 0, 7, 14, 21, 120 d with ferrihydrite (BF) (a), AQDS + ferrihydrite (BAF) (b) and biochar + ferrihydrite (BCF) (c) and SEM images with BF(d), BAF(e) and BCF (f) after 120 d |
为了进一步确定次生矿物对As的固定效果, 通过SEM-EDX方法观察了不同元素在矿物中的分布(图 8).选取C、Fe、P、As 4种元素进行面扫, 结果表明, 磷酸根离子可以与As竞争吸附位点, 吸附在矿物表面, 但相对于其他处理, BAF处理矿物具有更高的P含量(BAF 20.03%>BF 5.62%>BCF 4.75%), 这与次生矿物蓝铁矿的生成有关;根据As元素面扫可知, 生物炭表面As含量远低于水铁矿对砷的吸附量, BAF组As的吸附量高于BF组(BCF: 0.73%<BF: 1.69%<BAF: 1.82%), 表明生物反应后As可以被新生成的次生矿物蓝铁矿所固定.Wu等(2018)通过SEM-EDX结果表明, As(Ⅲ)与蓝铁矿结合较差, 而As(Ⅴ)与蓝铁矿结合较强.因此, 可以推测与蓝铁矿结合的大部分为氧化后的As(Ⅴ).
图 8(Fig. 8)
 |
| 图 8 Shewanella oneidensis MR-1还原水铁矿(BF)、AQDS+水铁矿(BAF)、生物炭+水铁矿(BCF)120 d后最终矿物相产物EDX-SEM表征 Fig. 8EDX-SEM images for iron minerals with ferrihydrite (BF), AQDS + ferrihydrite (BAF) and biochar + ferrihydrite (BCF) after the 120 d reduction by Shewanella oneidensis MR-1 |
为了确定次生矿物的形成及其相对含量, 对非生物和生物条件下反应120 d后不同处理最终矿物相产物进行了穆斯堡尔谱表征(图 9), 主要参数见表 1.水铁矿的拟合通常以一个双峰或两个双峰的形式进行拟合(Murad et al., 1980; Wade et al., 1999; Stevens et al., 2005).非生物条件下F、CF组, 生物条件下BF、BCF组呈顺磁性双峰, 均未有二价铁矿物出现, 与XRD结果一致;AF组和BAF组水铁矿按两个双峰进行拟合.一个和两个双峰拟合所得参数化学位移(IS)和四级矩分裂(QS)均与前人发表水铁矿的穆斯堡尔谱数据相近(Murad et al., 1980; Wade et al., 1999; Stevens et al., 2005).铁原子在蓝铁矿晶体结构中占据两个不同的八面体位置, 通常FeB2+/FeA2+≈2(Mccammon et al., 1980).蓝铁矿在空气中容易被氧化或发生光氧化, 导致微量Fe(Ⅱ)转化为Fe(Ⅲ)(Mccammon et al., 1980; Prot et al., 2020).在AF组和BAF组次生矿物蓝铁矿穆斯堡尔谱的分析中, 按照Prot等(2020)所用方法进行拟合, 拟合为Fe(Ⅲ) (Vivi. A+B), FeA2+和FeB2+, 参数与报道的相似(Mccammon et al., 1980; Prot et al., 2020).因此, AF和BAF的蓝铁矿的相对含量分别为13.1%、26.3%.
图 9(Fig. 9)
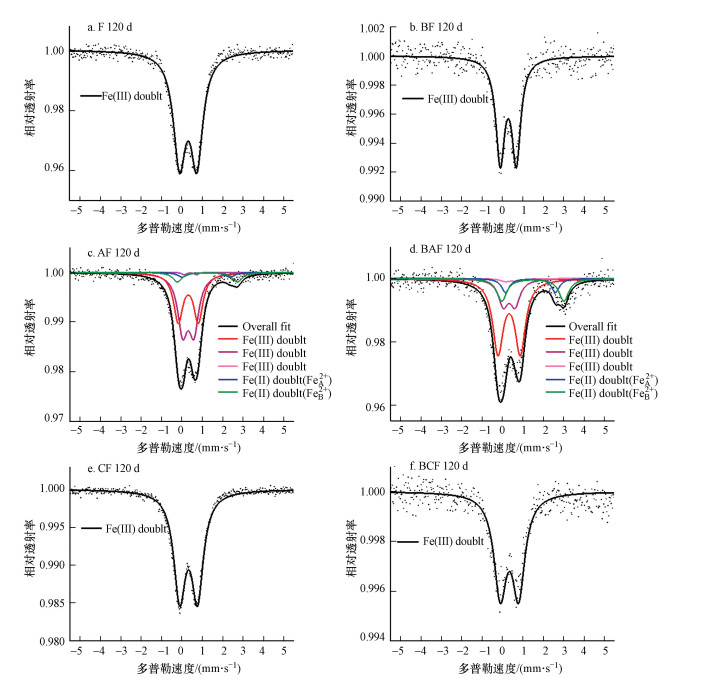 |
| 图 9 非生物和生物条件下,水铁矿(F, BF) (a, b)、AQDS+水铁矿(AF, BAF) (c, d)、生物炭+水铁矿(CF, BCF) (e, f)反应120 d最终矿物相产物穆斯堡尔谱表征 Fig. 9M?ssbauer spectra of minerals after the 120 d abiotic and biological reduction with ferrihydrite (F, BF) (a, b), AQDS + ferrihydrite (AF, BAF) (c, d) and biochar + ferrihydrite (CF, BCF) (e, f) |
表 1(Table 1)
| 表 1 穆斯堡尔谱数据 Table 1 M?ssbauer spectral data | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 穆斯堡尔谱数据 Table 1 M?ssbauer spectral data
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
4 讨论(Discussion)4.1 非生物条件下不同处理对Fe、As变化的影响在本研究中, 生物炭的添加可以促进水铁矿的化学还原, 且促进作用水铁矿化学还原主要发生在前6 d, 6 d后Fe(Ⅱ)含量趋于稳定.生物炭是由生物质在低温和缺氧条件下加热产生, 是一种低密度的富碳材料, 广泛用于土壤改良剂和肥料(Dong et al., 2014).在非生物条件下, 生物炭的添加可以造成水铁矿的还原, 生物炭溶解可以产生活性的DOM, 既可以作为电子供体又可以作为电子受体参与化学反应.Kapple等(2014)研究了非生物条件下, 生物炭(0.5、1、5、10 g·L-1)的添加对水铁矿还原的影响, 结果表明, 生物炭可以化学还原水铁矿, 电子从生物炭转移至水铁矿, 促使了Fe(Ⅱ)的生成, 随着生物炭添加量的增加, Fe(Ⅱ)含量显著增加, 生物炭为5 g·L-1时, Fe(Ⅱ)的产生量约为1.00~1.25 mmol·L-1(55.8~69.8 mg·L-1).吴松等(2018)研究表明, 未施加微生物的条件下, 生物炭和活性炭的添加, 可以提高溶液中的Fe(Ⅱ)/Fe(T).造成上清液As(T)的含量增加的原因主要有两个, 一个是因为水铁矿的还原导致吸附在水铁矿上的As(Ⅲ) 释放到溶液中;由于水铁矿对As(Ⅲ) 的吸附效果要优于As(Ⅴ), 另一个原因可能是溶液中可能出现了As(Ⅲ) 形态的转化, 水铁矿对溶液中As的吸附能力减弱, 导致溶液中As(T)含量的增加.陈雯等(2009)研究初始pH值为7, 水铁矿对浓度为1200 μg·L-1的As(Ⅲ)溶液及总浓度为1200 μg·L-1的As混合液(As(Ⅲ)/As(Ⅴ)=1∶1)的吸附效果, 达到吸附平衡后, 纯As(Ⅲ)溶液中As(T)的含量降至10 μg·L-1以下, 而混合液中As(T)浓度仍有600 μg·L-1以上.无论铁氧化物的矿物化学计量学和晶体结构如何, Fe(Ⅱ)吸附在铁氧化物上可以形成≡ Fe(Ⅲ) —O—Fe(Ⅱ)—OH典型表面络合物(Charlet et al., 1998; Elsner et al., 2004).铁氢氧化物和Fe(Ⅱ)同时存在的情况下, 类似于在铁还原微生物存在的环境中, 可能会出现的As(Ⅲ)氧化(Amstaetter et al., 2010).Amstaetter等(2010)研究表明, 针铁矿与溶解的Fe(Ⅱ)相互作用表现出较高的氧化还原活性, 在Fe(Ⅱ)-针铁矿体系中As(Ⅲ)快速氧化为As(Ⅴ).此外, DOM作为环境中生物地球化学的重要组成部分, 在氧化还原反应中既是电子供体又是电子受体, 是影响As的重要因素.Redman等(2002)研究表明, 在90 h内, DOM (C含量为10 mg·L-1, pH 6.0)能够将25~40 μg·L-1 As(Ⅲ)氧化为As(Ⅴ).Dong等(2014)通过电子自旋共振研究表明, 生物炭溶解产生的DOM中的半醌自由基参与了As(Ⅲ)氧化, 可通过式(1)(Dong et al., 2014)描述.
 | (1) |
4.2 Shewanella oneidensis MR-1存在条件下不同处理对Fe、As变化的影响对比As(Ⅲ)-水铁矿非生物处理组, 发现BF组还原产生的Fe(Ⅱ)含量不高, 可能与As(Ⅲ)对菌生长的抑制作用有关.对比BF组及非生物条件下AF和CF组, 生物炭和AQDS可以作为电子穿梭体促进水铁矿的异化铁还原过程.与Wu等(2020)As(Ⅴ)-水铁矿反应体系生物炭促进更多Fe(Ⅱ)含量不同, As(Ⅲ)-水铁矿反应体系AQDS处理组产生的Fe(Ⅱ)含量更高, 一方面这可能是因为As(Ⅲ) 对Shewanella oneidensis MR-1生长抑制作用较As(Ⅴ)更为严重, 在微生物还原As(Ⅲ) -水铁矿反应体系中, 铁的化学还原占主导优势.在非生物条件下, 生物炭产生的溶解性有机质可以将水铁矿还原为Fe(Ⅱ), AQDS可以通过氧化As(Ⅲ) 产生半醌和氢醌等活性反应基团还原铁矿物生成Fe(Ⅱ), 且总体来看, 0.1 mmol·L-1的AQDS促进As(Ⅲ)-水铁矿铁化学还原的效果优于5 g·L-1的生物炭.另一方面可能是因为生物炭产生的溶解性有机质与As(Ⅲ)发生了氧化还原作用, 未能用于促进微生物的生长代谢.因此, 在异化铁还原As(Ⅲ)-水铁矿过程中AQDS处理组溶液中Fe(Ⅱ)的含量更高.在反应后期, Fe(Ⅱ)和Fe(Ⅱ)/Fe(T)浓度降低, 可能与次生矿物的生成和Fe(Ⅱ)的再吸附有关.
As(Ⅲ)对Shewanella oneidensis MR-1的生长有一定程度的抑制作用, 可能是通过抑制了糖代谢, 使其得不到足够的电子供体, 从而抑制菌的生长与活性减少了Fe(Ⅲ)的还原(汪明霞等, 2014).Wang等(2016)研究了不同种类的无机砷对Shewanella oneidensis MR-1生长的抑制作用, 发现1.0 mg·L-1的As(Ⅲ)和As(Ⅴ)分别使后对数期分别延长到了4 d和3 d, 表明As(Ⅲ)对Shewanella oneidensis MR-1的毒害作用更大.汪明霞等(2014)报道, As(Ⅲ)可以通过制约菌体的生长与活性来抑制Fe(Ⅲ)异化还原.然而, 有研究表明As(Ⅲ)的存在使微生物Shewanella oneidensis MR-1还原针铁矿的程度更高, 对水铁矿的微生物还原无抑制作用, 较高的As/Fe比甚至可以提高针铁矿的还原速率(Muehe et al., 2013).Muehe等(2013)合成的含As铁矿物的方法是在制备铁矿物过程中添加As溶液, 对此的解释为As(Ⅲ)离子的存在会降低合成的矿物的粒度和结晶度, 可能会增加铁还原菌对铁氧化物的生物利用度, 但不足以解释为什么As(Ⅲ)的存在微生物Shewanella oneidensis MR-1对水铁矿还原无抑制作用以及高的As/Fe比提高了Fe(Ⅲ)矿物的溶解.因此, 我们推测在异化铁还原过程中, As(Ⅲ)氧化为As(Ⅴ)或As(Ⅲ)的甲基化在一定程度上促进了Fe(Ⅲ)的还原.
Shewanella oneidensis MR-1属于典型的铁还原菌, 在没有铁氧化物存在的条件下, Shewanella oneidensis MR-1对As没有直接的氧化还原作用, 但在还原Fe(Ⅲ)的同时, 可使As(Ⅲ) 氧化成As(Ⅴ), 从而起到解毒作用, 即As(Ⅲ)发生氧化转化是由于Fe(Ⅲ)异化还原而间接导致的(汪明霞等, 2014; 王娟等, 2015).汪明霞等(2014)研究表明, Fe(OH)3被Shewanella oneidensis MR-1还原的过程中, As(Ⅲ)被氧化为As(Ⅴ), 适量浓度的Fe(Ⅲ)会促进As(Ⅲ)氧化转化, 而过高浓度的Fe(Ⅲ)浓度使得溶液中产生过多的Fe(Ⅱ)一定程度上抑制了As(Ⅲ)氧化转化.王娟等(2015)研究表明, 在添加As(Ⅲ)时, 由于Shewanella oneidensis MR-1细胞自身的解毒作用会氧化生成少量的As(Ⅴ), 同时在酶的作用下, As(Ⅲ)甚至可以与培养体系中甲基供体结合生成MMA和DMA.Wang等(2016)研究表明, Shewanella oneidensis MR-1可以将无机砷甲基化转化为毒性较小的有机砷化合物, 甲基供体、培养基的组成和Fe(Ⅲ)的存在可以影响Shewanella oneidensis MR-1对无机砷的生物转化, 以s-腺苷蛋氨酸为供体的培养基中甲基化砷的含量大于以甲基钴胺为供体的培养基中甲基化砷的含量.Muehe等(2013)在铁还原中同样观察到了As(Ⅲ)的氧化, 微生物还原含As(Ⅲ)人工合成的含As针铁矿、水铁矿和生物合成的铁(氢)氧化物的过程中, 分别有21%~25%, 20%~43%和32%~34%的As(Ⅲ)被氧化为As(Ⅴ), 可能是由于AQDS还原过程中生成了具有氧化能力的活性半醌自由基, 也可能是由于Fe(Ⅱ)-Fe(Ⅲ)矿物形成的表面复合物可以将As(Ⅲ)氧化为As(Ⅴ).
综上所述, 生物炭和AQDS的添加可直接引起水铁矿的化学还原, 加速Shewanella oneidensis MR-1存在下水铁矿发生的生物还原, 促进了溶液中二价铁离子的生成, 导致吸附在水铁矿上的As(Ⅲ) 的释放到溶液中.水铁矿还原是导致As释放的主要原因, AQDS的化学作用和作为电子穿梭体引起的异化作用都要高于生物炭, 所以AQDS处理组释放的As(T)要高于生物炭处理组.在这个过程中出现了As(Ⅲ) 的氧化, As(Ⅲ) 形态的转化对溶液中As(T)含量的增加也有一定的影响, 可能的途径有①生物炭产生的溶解性有机质和AQDS直接氧化As(Ⅲ), ②生物炭和AQDS作为电子穿梭体异化还原水铁矿, 耦合了As(Ⅲ) 的氧化, ③Fe(Ⅱ)催化作用.Zhang等(2019)发现, 在厌氧条件下, Fe(Ⅱ)催化As(Ⅲ)吸附的水铁矿转化过程中, 70%~80%的As(Ⅲ)被氧化为As(Ⅴ).此外, 次生矿物的形成对As的释放也有一定的抑制作用.
4.3 矿物相变化对As的影响在AQDS处理组中, Shewanella oneidensis MR-1还原含As(Ⅲ) 水铁矿生成了蓝铁矿, 可用式(2)来表示(Zhou et al., 2016).而生物炭表面具有大量带负电的有机官能团, 对带正电荷的金属阳离子有良好的吸附作用, 可以降低Fe(Ⅱ)的迁移性, 抑制二价铁矿物的生成.由于与介质中磷酸盐的相似性, As(Ⅴ)在整个反应过程中可能受吸附竞争过程及Fe(Ⅲ)还原后矿物转化的控制(Jiang et al., 2013).大量的研究表明, 微生物还原含As(Ⅲ)的铁氧化物导致了溶液中As(Ⅲ)浓度的显著增加, 但在新矿物形成后并未或很少被出现再吸附、与次生矿物吸附/共沉淀(Muehe et al., 2013; Wu et al., 2018; 吴松等, 2018).先前的研究表明, 可能由于蓝铁矿的PZC点较低(point of zero charge, PZC=5.3), 使蓝铁矿在中性pH值下具有负的表面电荷, As(Ⅲ)与天然的蓝铁矿结合极少(Thinnappan et al., 2008; Muehe et al., 2013).尽管蓝铁矿的PZC值为5.3是在水中测定得出的, 溶液体系的不同会对PZC值有一定的影响, 但假设在培养过程中生成的蓝铁矿具有相似的PZC点, 那么不带电的As(Ⅲ)和带负电的As(Ⅴ)很大程度不会吸附在蓝铁矿上(Thinnappan et al., 2008; Muehe et al., 2013).然而, 与As(Ⅲ)的设置相比, 微生物对含As(Ⅴ)水铁矿的还原并没有导致更多的As(Ⅴ)释放.As(Ⅴ)在铁还原过程中被固定可能有以下3种机制: ①在中性pH条件下, As(Ⅴ)可以通过吸附作用吸附到次生矿物蓝铁矿中;②通过竞争作用, 替代了磷酸根阴离子, 生成Fe3(AsO4)2·8H2O;③由于磷酸盐与As(Ⅴ)在结构上具有同源性, As(Ⅴ)可能与蓝铁矿中的磷酸盐发生交换(Muehe et al., 2013).除此之外, 砷铁矿和蓝铁矿在25 ℃的溶解度很相似, 分别为10-33.25 mol2·L-2和10-33.06 mol2·L-2, 砷铁矿-蓝铁矿复合矿物可能也具有相似的溶解度(Muehe et al., 2016).综上所述, 微生物还原含As(Ⅲ)的水铁矿过程中可能生成了蓝铁矿-复合矿物(Fe3(PO4/AsO4)2·8H2O), 导致As(Ⅴ)被固定(Muehe et al., 2013; Jiang et al., 2013; Muehe et al., 2016; 吴松等, 2018; Wu et al., 2018).
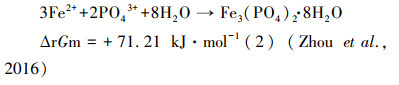 |
2) 与非生物组相比, Shewanella oneidensis MR-1的添加使溶液中Fe(Ⅱ)含量显著增加, 生物炭和AQDS的添加可以促进Fe(Ⅱ)的生成, AQDS的促进效果更加显著, 不同处理Fe(Ⅱ)的浓度为BAF>BCF>BF, BAF组Fe(Ⅱ)含量在第8 d达到最大245 mg·L-1, BF组和BCF组Fe(Ⅱ)含量在第11 d达到最大, 分别为41.2 mg·L-1和113 mg·L-1.在前7 d, 上清液As(T)的含量呈BCF>BAF>BF, 7 d后呈BAF>BCF>BF, 在第12 d, As(T)分别为BCF: 39.1 mg·L-1, BAF: 46.2 mg·L-1, BF: 33.1 mg·L-1).相对于初始浓度, 第12 d不同处理释放到溶液中的As浓度分别为BCF: 10.8 mg·L-1, BAF: 23.1 mg·L-1, BF: 11.1 mg·L-1. As(Ⅲ) /As(T)在12 d内始终呈现BAF<BCF<BF的趋势, 表明在微生物铁还原过程中, AQDS的添加促进As形态转化和释放的能力要高于生物炭.
3) EEM结果表明, 生物炭产生的DOM可以与溶液中的物质发生氧化还原作用从而被消耗殆尽.循环伏安曲线在0.25 V处观察到一个小而宽的阳极峰(B), 可能对应了As(Ⅲ)氧化为As(Ⅴ).
4) 矿物相结果显示仅在AF和BAF组出现了蓝铁矿, 表明AQDS可以促进次生矿物的生成.EDX-SEM结果表明, 新矿物的生成有利于As的固定(BCF: 0.73%<BF: 1.69%<BAF: 1.82%).穆斯堡尔谱结果表明, AF和BAF组蓝铁矿的相对含量分别为13.1%、26.3%.
参考文献
| Amstaetter K, Borch T, Larese-Casanova P, et al. 2010. Redox transformation of arsenic by Fe(Ⅱ)-activated goethite (α-FeOOH)[J]. Environmental Science & Technology, 44(1): 102-108. |
| Baxendale J H, Hardy H R, Sutcliffe L H. 1951. Kinetics and equilibria in the system ferrous ion + ferric ion + hydro-quinone+quinone[J]. Transactions of the Faraday Society, 47: 963-973. DOI:10.1039/tf9514700963 |
| Beesley L, Moreno-Jiménez E, Gomez-Eyles J L, et al. 2011. A review of biochars' potential role in the remediation, revegetation and restoration of contaminated soils[J]. Environmental Pollution, 159(12): 3269-3282. DOI:10.1016/j.envpol.2011.07.023 |
| Borch T, Inskeep W P, Harwood J A, et al. 2005. Impact of ferrihydrite and anthraquinone-2, 6-disulfonate on the reductive transformation of 2, 4, 6-trinitrotoluene by a gram-positive fermenting bacterium[J]. Environmental Science & Technology, 39(18): 7126-7133. |
| Charlet L, Silveste E, Liger E. 1998. N-compound reduction and actinide immobilisation in surficial fluids by Fe(Ⅱ): The surface ≡FeⅢOFeⅡOH0 species, as major reductant[J]. Chemical Geology, 151: 85-93. DOI:10.1016/S0009-2541(98)00072-2 |
| Chen J, Gu B, Royer R A, et al. 2003. The roles of natural organic matter in chemical and microbial reduction of ferric iron[J]. Science of the Total Environment, 307(1-3): 167-178. DOI:10.1016/S0048-9697(02)00538-7 |
| 陈雯, 刘玲, 周建伟. 2009. 三种氧化铁吸附水环境中砷的试验研究[J]. 环境科学与技术, 32(1): 63-67. DOI:10.3969/j.issn.1003-6504.2009.01.016 |
| Dong X L, Ma L Q, Gress J, et al. 2014. Enhanced Cr(Ⅵ) reduction and As(Ⅲ) oxidation in ice phase: Important role of dissolved organic matter from biochar[J]. Journal of Hazardous Materials, 267: 62-70. DOI:10.1016/j.jhazmat.2013.12.027 |
| Duesterberg C K, Waite T D. 2007. Kinetic modeling of the oxidation of p-hydroxybenzoic acid by fenton's reagent: implications of the role of quinones in the redox cycling of iron[J]. Environmental Science & Technology, 41(11): 4103-4110. |
| Elsner M, Schwarzenbach R P, Haderlein S B. 2004. Reactivity of Fe(Ⅱ)-bearing minerals toward reductive transformation of organic contaminants[J]. Environmental Science & Technology, 38(3): 799-807. |
| Goldberg S, Johnston C T. 2001. Mechanisms of arsenic adsorption on amorphous oxides evaluated using macroscopic measurements, vibrational spectroscopy, and surface complexation modeling[J]. Journal of Colloid and Interface Science, 234(1): 204-216. DOI:10.1006/jcis.2000.7295 |
| Guo H M, Ren Y, Liu Q, et al. 2013. Enhancement of arsenic adsorption during mineral transformation from siderite to goethite: mechanism and application[J]. Environmental Science & Technology, 47: 1009-1016. |
| 韩蕊. 2016. Shewanella oneidensis MR-1外膜细胞色素c介导的胞外电子传递过程研究[D]. 广州: 华南理工大学 |
| Jiang J, Bauer I, Paul A, et al. 2009. Arsenic redox changes by microbially and chemically formed semiquinone radicals and hydroquinones in a humic substance model quinone[J]. Environmental Science & Technology, 43(10): 3639-3645. |
| Jiang S H, Lee J H, Kim D H, et al. 2013. Differential arsenic mobilization from As-bearing ferrihydrite by iron-respiring Shewanella strains with different arsenic-reducing activities[J]. Environmental Science & Technology, 47: 8616-8623. |
| Kappler A, Wuestner M L, Ruecker A, et al. 2014. Biochar as an electron shuttle between bacteria and Fe(Ⅲ) minerals[J]. Environmental Science & Technology Letters, 1(8): 339-344. |
| Kocar B D, Borch T, Fendorf S. 2010. Arsenic repartitioning during biogenic sulfidization and transformation of ferrihydrite[J]. Geochimica et Cosmochimica Acta, 74(3): 980-994. DOI:10.1016/j.gca.2009.10.023 |
| Li X M, Liu T X, Li F B, et al. 2012. Reduction of structural Fe(Ⅲ) in oxyhydroxides by Shewanella decolorationis S12 and characterization of the surface properties of iron minerals[J]. Journal of Soils and Sediments, 12(2): 217-227. DOI:10.1007/s11368-011-0433-5 |
| 马玉玲, 马杰, 陈雅丽, 等. 2018. 水铁矿及其胶体对砷的吸附与吸附形态[J]. 环境科学, 39(1): 179-186. DOI:10.3969/j.issn.1000-6923.2018.01.021 |
| Maharjan M, Watanabe C, Ahmad S A, et al. 2005. Arsenic contamination in drinking water and skin manifestations in lowland Nepal: the first community-based survey[J]. The American Journal of Tropical Medicine and Hygiene, 73(2): 477-479. DOI:10.4269/ajtmh.2005.73.477 |
| Mandal B K, Chowdhury T R, Samanta G, et al. 1996. Arsenic in groundwater in seven districts of West Bengal, India-The biggest arsenic calamity in the world[J]. Current Science (Bangalore), 70(11): 976-986. |
| Mccammon C A, Burns R G. 1980. The oxidation mechanism of vivianite as studies by M essbauer spectroscopy[J]. American Mineralogist, 65: 361-366. |
| Muehe E M, Morin G, Scheer L, et al. 2016. Arsenic(Ⅴ) incorporation in vivianite during microbial reduction of arsenic(Ⅴ)-bearing biogenic Fe(Ⅲ) (oxyhydr)oxides[J]. Environmental Science & Technology, 50(5): 2281-2291. |
| Muehe E M, Scheer L, Daus B, et al. 2013. Fate of arsenic during microbial reduction of biogenic versus abiogenic As-Fe(Ⅲ)-mineral coprecipitates[J]. Environmental Science & Technology, 47(15): 8297-8307. |
| Murad E, Udo S. 1980. The M ssbauer spectrum of ferrihydrite and its relations to those of other iron oxides[J]. American Mineralogist, 65: 1044-1049. |
| O'Loughlin E J, Gorski C A, Scherer M M, et al. 2010. Effects of oxyanions, natural organic matter, and bacterial cell numbers on the bioreduction of lepidocrocite (γ-FeOOH) and the formation of secondary mineralization products[J]. Environmental Science & Technology, 44(12): 4570-4576. |
| Ottakam Thotiyl M M, Basit H, Sánchez J A, et al. 2012. Multilayer assemblies of polyelectrolyte-gold nanoparticles for the electrocatalytic oxidation and detection of arsenic(Ⅲ)[J]. Journal of Colloid and Interface Science, 383(1): 130-139. DOI:10.1016/j.jcis.2012.06.033 |
| Piepenbrock A, Schr der C, Kappler A. 2014. Electron transfer from humic substances to biogenic and abiogenic Fe(Ⅲ) oxyhydroxide minerals[J]. Environmental Science & Technology, 48(3): 1656-1664. |
| Postma D. 1981. Formation of siderite and vivianite and the pore-water composition of a Recent bog sediment in Denmark[J]. Chemical Geology, 31: 225-244. |
| Prot T, Wijdeveld W, Eshun L E, et al. 2020. Full-scale increased iron dosage to stimulate the formation of vivianite and its recovery from digested sewage sludge[J]. Water Research, 182: 115911. DOI:10.1016/j.watres.2020.115911 |
| Ravenscroft P, Brammer H, Richards K. 2009. Arsenic pollution: a global synthesis[M]. UK: Wiley-Blackwell, 318-485. |
| Redman A D, Macalady D L, Ahmann D. 2002. Natural organic matter affects arsenic speciation and sorption onto hematite[J]. Environmental Science & Technology, 36(13): 2889-2896. |
| 司友斌, 王娟. 2015. 异化铁还原对土壤中重金属形态转化及其有效性影响[J]. 环境科学, 39(9): 3533-3542. |
| Saalfield S L, Bostick B C. 2009. Changes in iron, sulfur, and arsenic speciation associated with bacterial sulfate reduction in ferrihydrite-rich systems[J]. Environmental Science & Technology, 43(23): 8787-8793. |
| Singh R, Singh S, Parihar P, et al. 2015. Arsenic contamination, consequences and remediation techniques: A review[J]. Ecotoxicology and Environmental Safety, 112: 247-270. |
| Stachowicz M, Hiemstra T, van Riemsdijk W H. 2008. Multi-competitive interaction of As(Ⅲ) and As(Ⅴ) oxyanions with Ca2+, Mg2+, PO43-, and CO32- ions on goethite[J]. Journal of Colloid and Interface Science, 320(2): 400-414. DOI:10.1016/j.jcis.2008.01.007 |
| Stevens J G, Khasanov A M, Mabe D R. 2005. M ssbauer and X-Ray diffraction investigations of a series of B-doped ferrihydrites[J]. Hyperfine Interactions, 161: 83-92. DOI:10.1007/s10751-005-9170-8 |
| 孙林, 王寅, 司友斌. 2016. 三种铁氧化物对As(Ⅲ)和As(Ⅴ)的吸附研究[J]. 土壤通报, 47(1): 198-206. |
| Sun Y Q, Yu I K M, Tsang D C W, et al. 2019. Multifunctional iron-biochar composites for the removal of potentially toxic elements, inherent cations, and hetero-chloride from hydraulic fracturing wastewater[J]. Environment International, 124: 521-532. DOI:10.1016/j.envint.2019.01.047 |
| Thinnappan V, Merrifield C M, Islam F S, et al. 2008. A combined experimental study of vivianite and As (Ⅴ) reactivity in the pH range 2-11[J]. Applied Geochemistry, 23(11): 3187-3204. DOI:10.1016/j.apgeochem.2008.07.001 |
| Van der Zee F P, Cervantes F J. 2009. Impact and application of electron shuttles on the redox (bio)transformation of contaminants: A review[J]. Biotechnology Advances, 27(3): 256-277. DOI:10.1016/j.biotechadv.2009.01.004 |
| Wade M L, Agresti D G, Wdowiak T J, et al. 1999. A M ssbauer investigation of iron-rich terrestrial hydrothermal vent systems: Lessons for Mars exploration[J]. Journal of Geophysical Research: Planets, 104(E4): 8489-8507. DOI:10.1029/1998JE900049 |
| 王娟, 韩涛, 司友斌. 2015. Shewanella oneidensis MR-1对不同价态砷的生物转化与甲基化[J]. 中国环境科学, 35(11): 3396-3402. DOI:10.3969/j.issn.1000-6923.2015.11.026 |
| Wang J, Wu M Y, Lu G, et al. 2016. Biotransformation and biomethylation of arsenic by Shewanella oneidensis MR-1[J]. Chemosphere, 145: 329-335. DOI:10.1016/j.chemosphere.2015.11.107 |
| 汪明霞, 王娟, 司友斌. 2014. Shewanella oneidensis MR-1异化还原Fe(Ⅲ)介导的As(Ⅲ)氧化转化[J]. 中国环境科学, 34(9): 2368-2373. |
| Wang Z Z, Li R, Cui L L, et al. 2018. Characterization and acid-mobilization study for typical iron-bearing clay mineral[J]. Journal of Environmental Sciences, 71: 222-232. DOI:10.1016/j.jes.2018.04.012 |
| Wu C, An W H, Liu Z Y, et al. 2020. The effects of biochar as the electron shuttle on the ferrihydrite reduction and related arsenic (As) fate[J]. Journal of Hazardous Materials, 390: 121391. DOI:10.1016/j.jhazmat.2019.121391 |
| Wu S, Fang G D, Wang D J, et al. 2018. Fate of As(Ⅲ) and As(Ⅴ) during microbial reduction of arsenic-bearing ferrihydrite facilitated by activated carbon[J]. ACS Earth and Space Chemistry, 2(9): 878-887. DOI:10.1021/acsearthspacechem.8b00058 |
| 吴松, 袁贝嘉, 闫慧珺, 等. 2018. 两种典型炭材料对微生物还原含砷水铁矿的影响及其机制研究[J]. 农业环境科学学报, 37(7): 1370-1376. |
| Xue Q, Ran Y, Tan Y, et al. 2019. Arsenite and arsenate binding to ferrihydrite organo-mineral coprecipitate: Implications for arsenic mobility and fate in natural environments[J]. Chemosphere, 224: 103-110. DOI:10.1016/j.chemosphere.2019.02.118 |
| Zhang G, Yuan Z, Lei L, et al. 2019. Arsenic redistribution and transformation during Fe(Ⅱ)-catalyzed recrystallization of As-adsorbed ferrihydrite under anaerobic conditions[J]. Chemical Geology, 525: 380-389. DOI:10.1016/j.chemgeo.2019.08.002 |
| Zhou G W, Yang X R, Li H, et al. 2016. Electron shuttles enhance anaerobic ammonium oxidation coupled to iron(Ⅲ) reduction[J]. Environmental Science & Technology, 50(17): 9298-9307. |
| Zou Q, An W H, Wu C, et al. 2018. Red mud-modified biochar reduces soil arsenic availability and changes bacterial composition[J]. Environmental Chemistry Letters, 16: 615-622. DOI:10.1007/s10311-017-0688-1 |
