 , 张瑞雪1,2
, 张瑞雪1,2
 , 吴攀1,2, 张世鸿1, 安丽1, 张予豪1, 傅渝然1
, 吴攀1,2, 张世鸿1, 安丽1, 张予豪1, 傅渝然11. 贵州大学资源与环境工程学院, 贵阳 550025;
2. 喀斯特地质资源与环境教育部重点实验室, 贵阳 550025
收稿日期: 2021-04-10; 修回日期: 2021-05-30; 录用日期: 2021-05-30
基金项目: 国家重点研发计划(No.2019YFC1805300);国家自然科学基金委员会-贵州省人民政府喀斯特科学研究中心项目(No.U1612442);贵州省学科建设项目(No.黔学位合字ZDXK[2016]11)
作者简介: 王能(1994-), 男, E-mail: 2529438194@qq.com
通讯作者(责任作者): 张瑞雪, E-mail: zhangxuer7908@126.com
摘要:利用从高硫煤矸石堆场浸出液中培养驯化获得的氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans,A.f),通过静态实验,探讨添加不同量的碳酸盐岩对酸性硫酸盐体系中Fe2+生物氧化速率及次生铁矿物合成的影响.结果表明:添加10 g和30 g碳酸盐岩不会对体系中pH、氧化还原电位(ORP)和Fe2+生物氧化速率产生明显影响,但总铁(TFe)的去除率可从37%分别提高到55%和62%,矿物生成量也从8.17 g·L-1分别增加到12.03 g·L-1和13.69 g·L-1;同时,体系中合成的次生铁矿物相与不加碳酸盐岩时无明显变化,主要为黄铁矾和施氏矿物的混合物.随着碳酸盐岩添加量增至50、70和90 g时,体系pH快速上升,Fe2+生物氧化速率受到抑制,并产生大量结晶程度较好的硫酸钙,形成的铁矿物主要为纤铁矿或针铁矿.而适量的碳酸盐岩添加可使体系中产生Ca2+和Mg2+,从而影响次生铁矿物的合成.因此,在以碳酸盐岩为反应介质的酸性矿山废水处理工艺设计中,可通过添加A.f菌并控制碳酸盐岩投加量,强化系统中Fe2+生物氧化及次生矿物的合成,从而进一步提高反应系统对TFe的去除效果.
关键词:碳酸盐岩氧化亚铁硫杆菌氧化速率次生铁矿物矿物相
The influence of carbonate rock on Fe2+ biological oxidation and iron mineral synthesis
WANG Neng1
 , ZHANG Ruixue1,2
, ZHANG Ruixue1,2
 , WU Pan1,2, ZHANG Shihong1, AN Li1, ZHANG Yuhao1, FU Yuran1
, WU Pan1,2, ZHANG Shihong1, AN Li1, ZHANG Yuhao1, FU Yuran11. College of Resources and Environmental Engineering, Guizhou University, Guiyang 550025;
2. Key Laboratory of Karst Geological Resource and Environment, Ministry of Education, Guiyang 550025
Received 10 April 2021; received in revised from 30 May 2021; accepted 30 May 2021
Abstract: In this study, Acidithiobacillus ferrooxidans (A.f) was incubated and domesticated from the leaching solution of high-sulfur coal gangue yard. Through static experiments, the effects of adding different amounts of carbonate rocks on the biological oxidation rate of Fe2+ and the synthesis of secondary iron minerals in sulfate-rich acidic environment were discussed. The results showed that the addition of 10 g and 30 g carbonate rocks did not have a significant effect on pH, ORP and Fe2+ biological oxidation rate, but the removal rate of TFe increased from 37% to 55% and 62% respectively, and the mineral production also increased from 8.17 g·L-1 to 12.03 g·L-1 and 13.69 g·L-1, respectively. Meanwhile, the secondary iron mineral phase synthesized in the system had no obvious change compared with that without carbonate rocks, and it was mainly a mixture of schwertmannite and jarosite minerals. With the addition of carbonate rocks to 50 g, 70 g and 90 g, the pH in the system increased rapidly, the biological oxidation rate of Fe2+ was inhibited, and a large amount of calcium sulfate with good crystallinity was produced. The iron minerals are mainly lepidocrocite and goethite. The addition of an appropriate amount of carbonate rocks could produce Ca2+ and Mg2+ in the system, thus affecting the synthesis of secondary iron minerals. Therefore, when using carbonate rocks as a reaction medium to treat acid coal mine wastewater, adding A.f. bacteria and controlling the dosage of carbonate rock could strengthen the biological oxidation of Fe2+ and the synthesis of secondary minerals in the system, further improve the removal effect of TFe in the reaction system.
Keywords: carbonate rocksAcidithiobacillus ferrooxidansoxidation ratesecondary iron mineralsmineral phase
1 引言(Introduction)煤矿或各种有色金属矿开采产生的大量贫矿石、围岩等暴露于空气与水中, 经过复杂的物理化学和生物作用, 会形成低pH、高Fe和高硫酸盐浓度的酸性矿山废水(Acid Mine Drainage, AMD)(Evangelou et al., 1995;Rambabu et al., 2020).AMD的任意排放对矿区周围土壤和水体造成严重污染, 其含有的重金属等污染物极易在环境中富集, 进而通过食物链威胁人体健康(唐常源等, 2009;张莎莎等, 2016).而碳酸盐岩作为一种廉价易得的AMD中和反应材料, 能有效提升废水pH并同步去除Fe、Mn等重金属污染物, 且该技术在国内外已工程应用(龙中等, 2019).但由于矿硐排放的AMD中Fe主要以Fe2+形式存在(韦冠俊, 2001), 且Fe2+在自然环境中氧化缓慢, 常规的碳酸盐岩中和法仅能将AMD的pH提升至7.0左右(熊玲等, 2010)(Fe2+和Fe3+沉淀的pH要求分别为8.5和3.5以上).因此, 由于Fe2+氧化缓慢且不完全而导致处理系统占地面积大或出水中Fe2+浓度高而影响水质(周立祥, 2017).然而在富铁酸性硫酸盐的AMD环境中, 氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans, A.f)可介导施氏矿物或黄铁矾等次生铁矿物的合成, 从而去除AMD中的Fe和SO42-(Sabrina et al., 2011).同时还可以通过吸附共沉淀等作用去除体系中Cr、Cd和As等重金属离子(宋永伟等, 2020;Jin et al., 2020).
虽然A.f细菌能有效氧化Fe2+, 但生物矿化率相对较低(30%左右), 大部分Fe2+被生物氧化后以Fe3+形式存在(周立祥, 2017).AMD环境中生物氧化与次生铁矿物形成受环境因子影响, 如pH、阳离子(K+、Ca2+、Na+、Mg2+和NH4+等(刘奋武等, 2014;2016;Song et al., 2018))和阴离子(PO43-、NO3-和Cl-(宋永伟等, 2018))等可通过影响体系中细菌活性或次生铁矿物的形成及Fe2+生物氧化, 进而影响体系中Fe的去除.如Ca2+与SO42-结合生成CaSO4·2H2O结晶能够作为生物成因次生铁矿物合成过程的“晶种”有效促进次生铁矿物的合成(刘奋武等, 2016);Mg2+浓度不同可导致生物合成次生铁矿物存在形态不同而直接影响次生铁矿物的合成量(刘奋武等, 2014), 同时添加固态物质(石英砂、硅藻土、施氏矿物和黄铁矾等(王敏等, 2011;宋永伟等, 2020))作为“晶种”可促进酸性硫酸盐体系次生铁矿物的合成.
基于此, 本文利用A.f细菌(Fe2+强化生物氧化)和碳酸盐岩(调节pH并提供Ca2+、Mg2+等)联合作用过程研究碳酸盐岩对酸性富硫酸盐体系中Fe2+生物氧化速率及次生铁矿物合成的影响, 旨在探究通过添加适量的碳酸盐岩, 在不影响Fe2+生物氧化速率的情况下促进体系中总Fe的去除.该研究结果可为碳酸盐岩与氧化亚铁硫杆菌联合治理AMD的作用过程和方法构建, 提供科学基础和数据参考, 具有一定的实际应用价值.
2 材料与方法(Materials and methods)2.1 氧化亚铁硫杆菌液(A.f)的制备高硫煤矸石堆场浸出液(pH=2.42、SO42- 3451 mg·L-1、TFe 552 mg·L-1)按20%接种于改良9K液态培养基(刘奋武等, 2014)(FeSO4·7H2O 44.24 g·L-1、(NH4)2SO4 3 g·L-1、KCI 0.1 g·L-1、K2HPO4 0.5 g·L-1、Ca(NO3)2·4H2O 0.01 g·L-1、MgSO4·7H2O 0.5 g·L-1, 用9 mol·L-1 H2SO4溶液调节pH至约2.5), 然后将混合液置于160 r·min-1往复式振荡器(ZD-85A恒温振荡器)中30 ℃培养3~4 d至反应体系中混合液颜色从绿色变成红棕色.经多次富集培养后获得细菌液, 利用宏基因组微生物分类测序鉴定为较纯的A.f细菌液, 将获得的A.f细菌液于4 ℃保藏备用.
2.2 试验方法本实验选用的碳酸盐岩为较纯的方解石, 主要含有CaCO3、MgCO3和SiO2等.将碳酸盐岩(Φ=1.2~1.7 cm)用去离子水冲洗数遍后置于50 ℃烘箱中12 h烘干, 然后称取0 g(J0)、10 g(J10)、30 g(J30)、50 g(J50)、70 g(J70)和90 g(J90)分别置于250 mL锥形瓶.将15 mL A.f保藏菌液接种于135 mL新鲜9K培养液中(调节pH为2.5), 然后置于160 r·min-1振荡器(ZD-85A恒温振荡器)中30 ℃培养至Fe2+完全氧化后完成细菌活化.取活化后的A.f细菌液15 mL接种于添加不同量碳酸盐岩和含有135 mL新鲜9 K培养基的锥形瓶中, 将各体系的初始pH值调节为2.5后置于160 r·min-1振荡器中30 ℃培养.本实验共设6组处理(J0、J10、J30、J50、J70和J90), 每组处理3个重复(①、②和③), 其中: ①用于定时监测反应体系中pH值及ORP, 并从各反应体系中取1 mL反应液经0.22 μm滤膜过滤后, 测定Fe2+及TFe浓度, 测定Fe2+样品立即用盐酸酸化至pH<1, 测定TFe样品立即用硝酸酸化至pH<2.反应82 h后, 将②和③反应液进行真空抽滤, 过滤获得的沉积物置于50 ℃烘箱中烘干, 分别用于测试沉淀物的生成量和矿物相及矿物形貌观察.
2.3 测定方法与数据处理各反应体系的pH和ORP使用PHS-3C型酸度计测定, Fe2+采用邻菲罗啉分光光度法测定.TFe、Mg2+和Ca2+采用原子吸收法测定(TAS-990, 北京), 实验过程中采用空白样、10%的平行样和内标等进行质量控制, 平行样相对误差小于10%, 每10个测定样品间用标样回测, 误差在5%以内视为可接受.矿物相利用X射线衍射仪(XRD, 理学, UI tima Ⅳ)测定, 测试工作条件为: 管电压40 kV, 管电流40 mA, 扫描区间为10°~70°(2θ), 步长为0.02°, Cu靶(弯晶单色器), 扫描矿物特征衍射峰, 出峰位置和强度与粉末衍射标准联合委员会提供的JCPDS标准卡相匹配.沉淀物表面形貌利用热场发射扫描电子显微镜(SEM, JSM-7001F)进行直接观察.本实验获得的所有数据使用Microsoft Excel(2010)软件进行分析统计, XRD使用Jade6.5软件分析, 所有实验数据均用平均值与标准偏差表示, 使用Origin 8.0软件制图.
文中Fe2+氧化率(OR)和TFe去除率(RR)计算方法分别见式(1)~(2), 其中, C(Fe2+)0、C(Fe2+)t分别为初始和t时刻Fe2+浓度, C(TFe)0、C(TFe)t分别为初始和t时刻TFe浓度.
 | (1) |
 | (2) |
图 1(Fig. 1)
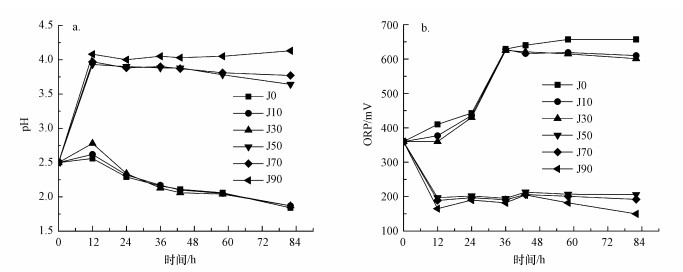 |
| 图 1 不同碳酸盐岩体系中pH(a)与ORP(b)的变化 Fig. 1The changes of pH(a) and ORP(b) in the different carbonate systems |
从图 1a可知, 系统培养至0~12 h时, J0、J10和J30体系的pH变化与J50、J70和J90体系的pH变化差异明显, 体系pH从初始的2.5分别提升至2.56、2.62、2.78、3.93、3.97和4.08.12 ~82 h时J0、J10和J30体系的pH分别下降至1.84、1.87和1.87, 而J50和J70体系的pH缓慢下降, J90体系的pH缓慢上升, 82 h后这3个体系的pH分别为3.64、3.77和4.13.反应初期A.f催化Fe2+生物氧化使体系pH升高, 随后Fe3+水解生成铁氧羟基硫酸盐矿物, 产生H+, 体系pH降低(Liu et al., 2015).pH变化可间接指示A.f细菌的活性(王敏等, 2011;张莎莎等, 2016), 碳酸盐岩添加量为10 g和30 g时对体系中生物催化次生铁矿物合成体系的pH影响较小, 因此, 对体系中A.f菌活性影响不明显.低pH会使底物和菌体酶蛋白的带电状态改变, 从而使细菌对营养物质的吸收及代谢过程中酶的活性降低, 导致Fe2+氧化速率下降(许保玖, 1983);高pH会使Fe3+减少, H+增多, 铁氧化物对细菌吸附包裹, 从而阻碍H+的扩散, 不利于Fe2+向Fe3+转化, 而pH过高或过低均会导致细菌死亡(朱琳, 2011).因此, 可利用碳酸盐岩较慢的侵蚀速率(相比石灰、氢氧化钠等)调节体系pH.随碳酸盐岩添加50、70和90 g时培养初期体系pH迅速上升, 可能会抑制A.f细菌的活性, 使体系中生物氧化速率降低或者仅依赖化学氧化.
各处理体系的ORP变化如图 1b所示, J0、J10和J30反应体系的ORP逐渐上升, 且在0~24 h内ORP值为J0>J10>J30, pH值为J30 >J10>J0, ORP与pH变化相反.培养至24~36 h时J0、J10和J30反应体系的ORP值变化几乎一致.在0~12 h时J50、J70和J90体系的ORP值随pH值的升高而降低, pH升高有利于Fe3+水解, 同时在各体系中Fe2+氧化与Fe3+水解同时进行, 12~82 h时J50、J70和J90体系的ORP先缓慢上升后下降.
3.2 碳酸盐岩对各体系中Fe2+氧化及TFe去除的影响在富铁酸性硫酸盐环境中, Fe2+的氧化速率可表示A.f菌在体系中的代谢活性(Jensen et al., 1995;董燕等, 2018), TFe的去除率可以表征体系中次生铁矿物的合成量(刘奋武等, 2016).本试验中, 不同含量碳酸盐岩对体系中Fe2+氧化速率及TFe去除率的影响如图 2所示.
图 2(Fig. 2)
 |
| 图 2 碳酸盐岩对体系中Fe2+氧化率(a)及TFe去除率(b)的影响 Fig. 2The influence of carbonate rock on the Fe2+ oxidation rate(a) and TFe removal rate(b) in the systems |
从图 2a可见, J0、J10和J30反应体系中Fe2+氧化速率变化几乎一致, 0~12 h培养时间段Fe2+氧化率不足10%, 然而在12~36 h时间段Fe2+氧化率可达97.94%~98.57%, 82 h后Fe2+几乎氧化完全.J50、J70和J90反应体系中Fe2+氧化率逐渐上升, 82 h后Fe2+氧化率分别为39.15%、41.09%和63.77%.A.f菌通常适宜生长的pH为1.5~6.0, 最佳pH为2.0~2.5(Nemati et al., 1998), 0~36 h时J0、J10和J30体系的pH为2.13~2.78, 而J50、J70和J90体系的pH上升速率快(pH>3.60), Fe2+生物氧化速率降低.在J50、J70和J90体系中Fe2+氧化速率随碳酸盐岩添加量的增加而升高, 由于在pH<4的酸性硫酸体系中Fe2+难以被化学氧化(Kirby et al., 1999;刘奋武等, 2016), 而J90体系在12~82 h时间段pH为4.00~4.13, 且Fe2+氧化速率明显高于J50和J70体系, 表明此时间段J90体系中Fe2+化学氧化速率高于J50和J70体系.
在A.f菌促进下Fe3+与硫酸根在酸性条件下形成施氏矿物或黄铁矾等次生铁矿物(周立祥, 2017;Jin et al., 2020), 添加碳酸盐岩可提升反应体系pH, 使Fe3+水解形成铁氧化物沉淀(龙中等, 2019).如图 2b所示, J0体系在0~12 h时间段的TFe去除率仅为2%, 而J10、J30、J50、J70和J90体系在0~12 h时间段的TFe去除率分别为6.14%、12.32%、13.12%、14.00%和14.00%, 明显高于J0体系, 说明碳酸盐岩的添加促进了TFe的去除.在12~58 h内J10和J30体系中TFe去除率高于J0、J50、J70和J90体系, 培养至58 h时J0、J10、J30、J50、J70和J90体系的TFe去除率分别为36.02%、53.50%、60.65%、33.41%、35.16%和50.90%.由此表明, 在此时间段内J10和J30体系中大量的Fe2+被生物氧化为Fe3+后发生水解沉淀.而J50、J70和J90体系中Fe2+氧化速率较低, 限制了TFe的去除, J0体系中Fe2+氧化速率快, 但次生铁矿物形成率低.在J50、J70和J90体系中随碳酸盐岩投加量增加, pH和Fe2+氧化速率增加, 在43~82 h时间段内J90反应体系中TFe去除率升至最高.最终经培养82 h后, J0、J10、J30、J50、J70和J90体系的TFe去除率分别37.00%、55.00%、62.00%、41.00%、44.00%和66.56%.
3.3 各反应体系中Ca2+和Mg2+浓度变化在酸性硫酸盐体系中硫酸与碳酸盐岩反应过程中会产成大量Ca2+和Mg2+(式(3))(刘丛强等, 2008), Ca2+和Mg2+会影响生物催化次生铁矿物的合成, 进而影响体系中pH、ORP、Fe2+氧化速率及TFe去除(刘奋武等, 2014;2016).本实验中各反应体系的Ca2+和Mg2+浓度变化见图 3.
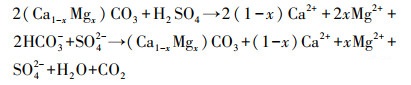 | (3) |
 |
| 图 3 不同碳酸盐岩体系中Ca2+(a)与Mg2+(b)浓度变化 Fig. 3The changes of Ca2+(a) and Mg2+(b) concentration in the different carbonate systems |
添加碳酸盐岩组培养至0~12 h时, 各反应体系中Ca2+和Mg2+浓度迅速升高, 在12~82 h时间段内各反应体系中Ca2+浓度呈不同程度上下波动.培养初期, 反应体系呈低pH与碳酸盐反应速率快特征, 产生大量的Ca2+和Mg2+, 培养至12 h后, 碳酸盐岩继续反应产生Ca2+和Mg2+, 但在碳酸盐岩表面产生的硫酸钙和Fe3+水解形成的铁氧化物会包裹在碳酸盐岩表面, 减缓了碳酸盐岩反应速率(夏雨等, 2018).同时, Ca2+和SO42-在反应体系中形成硫酸钙结晶, 使反应体系中Ca2+和SO42-浓度减小, 从而造成Ca2+浓度上下波动的现象.Mg2+浓度随碳酸盐岩添加量增加和培养时间延长而不断增加, 由于碳酸盐岩表面被包裹, 培养至58 h时Mg2+浓度增加缓慢.Mg2+浓度可间接指示碳酸盐岩在酸性硫酸体系中的反应进程, 同时Mg2+也是影响硫酸钙结晶速率的重要因素, Mg2+浓度越大使硫酸钙结晶越大, 结晶程度越好(夏雨等, 2018).
3.4 不同含量碳酸盐岩体系中沉淀物量及次生铁矿物相表征在常温常压下, Fe3+水解成施氏矿物是不能自发进行的, 但由于A.f菌氧化Fe2+会释放能量, 克服了后续Fe3+水解成矿的能垒, 生物氧化与Fe3+水解成矿偶联使总反应自由能为负值, 从而导致系统中施氏矿物或黄铁矾等次生矿物的合成(周立祥, 2017).通过添加不同量的碳酸盐岩改变体系的pH, 使其铁矿物发生转化(范聪, 2019).本试验各体系中沉淀物生成量如图 4所示.由图可知, 未添加碳酸盐岩的J0体系中产生沉淀物量为8.17 g·L-1, J10、J30、J50、J70和J90体系中沉淀物生成量分别为12.03、13.69、13.47、14.00和18.02 g·L-1.结果表明, 添加碳酸盐岩体系中生成的沉淀物量明显高于未添加对照实验J0.
图 4(Fig. 4)
 |
| 图 4 不同碳酸盐岩体系中沉淀物的产生量 Fig. 4The amount of precipitate produced in the different carbonate systems |
X射线衍射图谱(XRD)是鉴别矿物种类最有效的手段之一(王敏等, 2011;Zhu et al., 2013).本次实验各体系中沉淀物的X衍射图谱如图 5所示, 经Jade6.5软件寻峰分析, 参考JCPDS晶型黄铁矾类物质(黄钾铁矾: No.22-0827;黄铵铁矾: No.26-1014)、非晶型施氏矿物(No.47-1775)、硫酸钙(No.33-0311)、针铁矿(No.81-0462)和纤铁矿(No.76-2301)的标准衍射图谱, 根据衍射峰位置及相对强度发现(JCPDS, 2002), J0、J10和J30次生铁矿物合成体系所得矿物衍射图谱中均含有黄铁矾的特征尖锐的衍射强峰(2θ=17.41°、29.55°、39.37°、45.86°及49.93°等)及相对较弱的施氏矿物特征衍射峰(2θ=35.16°), 而J30沉淀物中还含有CaSO4·2H2O结晶衍射峰(2θ=11.59°和20.72°)(Wang et al., 2006;刘奋武等, 2016;Eskandarpour et al., 2008;Pan et al., 2013;Jensen et al., 1995).随碳酸盐岩量增加为50、70和90 g时, 各反应体系中均含有硫酸钙结晶的特征尖锐强峰(2θ=11.59°、20.72°、23.40°和29.11°等), 同时还含有相对较弱的针铁矿或纤铁矿的特征衍射峰(2θ=36.62°或36.50°或36.65°).
图 5(Fig. 5)
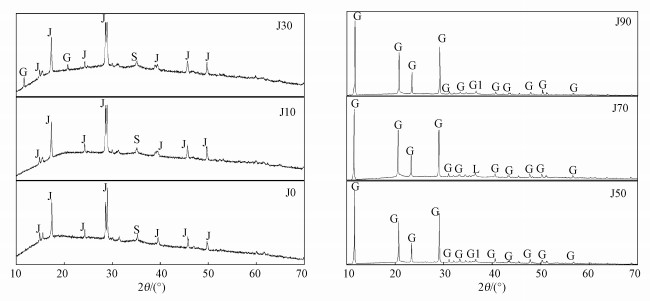 |
| 图 5 不同反应体系中次生铁矿物的X射线衍射图谱(J为黄铁矾, S为施氏矿物, G为硫酸钙, L为纤铁矿, G1为针铁矿) Fig. 5X-ray diffraction patterns of secondary iron minerals in the different carbonate systems |
由图 6可知, J0、J10和J30体系中矿物形貌差别较小, 黄铁矾类物质为结晶度较好的假立方体“枕状”结构, 嵌套于黄铁矾晶体之间的絮状无定型的矿物为施氏矿物(Zhu et al., 2013;宋永伟等, 2020).但在J30体系还含有较少晶粒细小及分散的硫酸钙结晶, 结晶度好的硫酸钙结晶晶粒较大, 内部质点的排列较规则, 结晶度差的硫酸钙晶体一般晶粒较小, 晶体中有错位等缺陷(陈曲仙等, 2014).J50、J70和J90体系均存在大量晶粒较大的硫酸钙结晶, 较少的纤铁矿或针铁矿混肴于硫酸钙晶体间.由此可见, 添加碳酸盐岩10 g和30 g与未添加碳酸盐岩时, A.f菌催化次生铁矿物合成体系中矿物相差别不大, 主要为黄铁矾与施氏矿物的混合物.
图 6(Fig. 6)
 |
| 图 6 不同反应体系中次生铁矿物的扫描电镜照片(J为黄铁矾, S为施氏矿物, G为硫酸钙) Fig. 6Scanning electron micrographs of secondary iron minerals in the different carbonate systems |
在酸性硫酸盐体系中不同pH条件下可形成不同的铁矿物, 通常pH<3时, 存在高浓度的硫酸根与一价阳离子时可形成黄铁矾(K, Na, NH4, HO3[Fe3(OH)6(SO4)2]), 当pH为3~4.5时, 硫酸根浓度为1000~3000 mg·L-1时常形成为施氏矿物(Fe8O8(OH)6SO4), pH继续提升可形成铁羟基化合物针铁矿(α-FeOOH)、水铁矿(5Fe2O3·9H2O)和纤铁矿(γ-FeOOH)等(范聪, 2019).因此, 随碳酸盐岩添加至50、70和90 g时, 反应体系中产生大量结晶程度较好的硫酸钙晶体和晶格较完整的针铁矿和纤铁矿.通常石灰石中和处理AMD过程产生的沉淀物主要成分为铁氧化物与硫酸钙(Herrera et al., 2007), 但在J50、J70和J90沉淀物XRD分析中主要尖锐特征峰为硫酸钙, 可能由于铁氧化物的宽峰被硫酸钙的尖锐峰所覆盖(Xiong et al., 2009;Liu et al., 2015).
4 结论(Conclusions)1) 碳酸盐岩添加量为10 g和30 g时, 不会对酸性硫酸盐体系的pH、ORP、Fe2+生物氧化速率和次生铁矿物的矿物相产生明显影响, 但TFe去除率可从37%分别提高到55%和62%, 沉淀物产生量从8.17 g·L-1分别增加到12.03 g·L-1和13.69 g·L-1;生成的次生铁矿物类型主要为黄铁矾和施氏矿物的混合物.
2) 随碳酸盐岩添加量增至50、70和90 g时, 各反应体系的pH快速上升, ORP下降, Fe2+生物氧化速率受到明显抑制, 反应体系中产生大量结晶程度较好的硫酸钙结晶, 形成的铁矿物为纤铁矿或针铁矿.
3) 添加适量碳酸盐岩可有效调控酸性硫酸盐环境, 实现Fe2+生物氧化与碳酸盐岩中和协同去除酸性硫酸盐体系中TFe的目的.
参考文献
| 陈曲仙, 杨柳春, 陈敏, 等. 2014. 二水硫酸钙结晶的影响因素研究[J]. 湘潭大学自科学报, 36(3): 60-66. |
| 董燕, 曹志云, 毕文龙, 等. 2018. 富铁酸性硫酸盐体系施氏矿物附着包裹硫杆菌的Fe2+氧化能力研究[J]. 环境科学学报, 38(6): 2327-2333. |
| Evangelou V P B, Zhang Y L. 1995. A review: Pyrite oxidation mechanisms and acid mine drainage prevention[J]. Critical Reviews in Environmental Science & Technology, 25(2): 141-199. |
| Eskandarpour A, Onyango M S, Ochieng A, et al. 2008. Removal of fluoride ions from aqueous solution at low pH using schwertmannite[J]. Journal of Hazardous Materials, 152(2): 571-579. DOI:10.1016/j.jhazmat.2007.07.020 |
| 范聪. 2019. 施氏矿物还原-重结晶过程中重金属的再分配机制研究[D]. 广州: 华南理工大学 |
| JCPDS(Joint Committee on Powder Diffraction Standards). 2002. Mineral powder diffraction files[Z]. International Center for Diffraction Data, Swarthmore: Pennsyvania |
| Jensen A B, Webb C. 1995. Ferrous sulphate oxidation using thiobacillus ferrooxidans: a review[J]. Process Biochemistry, 30(3): 225-236. DOI:10.1016/0032-9592(95)85003-1 |
| Jin D C, Wang X M, Liu L L, et al. 2020. A novel approach for treating acid mine drainage through forming schwertmannite driven by a mixed culture of Acidiphilium multivorum and Acidithiobacillus ferrooxidans prior to lime neutralization[J]. Journal of Hazardous Materials, 400. |
| Herrera P, Uchiyama H, Igarashi T, et al. 2007. Treatment of acid mine drainage through a ferrite formation process in central Hokkaido, Japan: Evaluation of dissolved silica and aluminium interference in ferrite formation[J]. Minerals Engineering, 20(13): 1255-1260. DOI:10.1016/j.mineng.2007.06.007 |
| Kirby C S, Thomas H M, Southam G, et al. 1999. Relative contributions of abiotic and biological factors in Fe(Ⅱ) oxidation in mine drainage[J]. Applied Geochemistry, 14(4): 511-530. DOI:10.1016/S0883-2927(98)00071-7 |
| 赖锦豪, 包艳萍, 王奕舜, 等. 2020. 色氨酸对生物成因铁硫酸盐次生矿物形成的影响[J]. 环境科学学报, 40(5): 1703-1709. |
| Liu F, Zhou L, Zhou J, et al. 2012. Improvement of sludge dewaterability and removal of sludge-borne metals by bioleaching at optimum pH[J]. Journal of Hazardous Materials, 221-222(30): 170-177. |
| Liu F, Zhou J, Zhou L, et al. 2015. Effect of neutralized solid waste generated in lime neutralization on the ferrous ion bio-oxidation process during acid mine drainage treatment[J]. Journal of Hazardous Materials, 299(15): 404-411. |
| 刘奋武, 高诗颖, 王敏, 等. 2014. 镁离子对氧化亚铁硫杆菌生物合成次生铁矿物的影响[J]. 中国环境科学, 34(3): 713-719. |
| 刘奋武, 高诗颖, 崔春红, 等. 2016. Ca2+对酸性硫酸盐环境中次生铁矿物合成的影响[J]. 中国环境科学, 35(4): 1142-1148. |
| 龙中, 吴攀, 张瑞雪, 等. 2019. 多级复氧反应-垂直流人工湿地深度处理煤矿酸性废水[J]. 环境工程学报, 13(6): 1391-1399. |
| 刘丛强, 蒋颖魁, 陶发祥, 等. 2008. 西南喀斯特流域碳酸盐岩的硫酸侵蚀与碳循环[J]. 地球化学, 37(4): 404-414. DOI:10.3321/j.issn:0379-1726.2008.04.014 |
| Nemati M, Harrison S T L, Hansford G S, et al. 1998. Biological oxidation of ferrous sulphate by Thiobacillus ferrooxidans: a review on the kinetic aspects[J]. Biochemical Engineering Journal, 1(3): 171-190. DOI:10.1016/S1369-703X(98)00006-0 |
| Pan Z, Lou Y, Yang G, et al. 2013. Preparation of calcium sulfate dihydrate and calcium sulfate hemihydrate with controllable crystal morphology by using ethanol additive[J]. Ceramics International, 39(5): 5495-5502. DOI:10.1016/j.ceramint.2012.12.061 |
| Rambabu K, Banat F, Pham Q M, et al. 2020. Biological remediation of acid mine drainage: Review of past trends and current outlook[J]. Environmental Science and Ecotechnology, 2020: 100024. |
| Sabrina H, Heinrich L, Reinhard K, et al. 2011. Schwertmannite formation adjacent to bacterial cells in a mine water treatment plant and in pure cultures of Ferrovum myxofaciens[J]. Environmental Science & Technology, 45: 7685-7692. |
| 宋永伟, 陈婷, 王鹤茹, 等. 2018. 阴离子对Acidithiobacillus ferrooxidans氧化活性及次生铁矿物形成影响[J]. 中国环境科学, 38(2): 574-580. DOI:10.3969/j.issn.1000-6923.2018.02.020 |
| 宋永伟, 王蕊, 杨琳琳, 等. 2020. 三种次生矿物固定A.ferrooxidans的Fe2+氧化及成矿性能比较[J]. 中国环境科学, 40(5): 2073-2080. DOI:10.3969/j.issn.1000-6923.2020.05.025 |
| Song Y W, Wang H R, Yang J, et al. 2018. Influence of monovalent cations on the efficiency of ferrous ion oxidation, total iron precipitation, and adsorptive removal of Cr(Ⅵ) and As(Ⅲ) in simulated acid mine drainage with inoculation of acidithiobacillus ferrooxidans[J]. Metals, 8(8): 596. DOI:10.3390/met8080596 |
| 唐常源, 吴攀, 韩志伟, 等. 2009. 酸性矿坑废水对流域酸化的影响-以贵州兴仁县典型废弃煤矿区小流域为例[J]. 中国岩溶, 28(2): 135-143. DOI:10.3969/j.issn.1001-4810.2009.02.007 |
| Wang H, Bigham J M, Tuovinen O H. 2006. Formation of schwertmannite and its transformation to jarosite in the presence of acidophilic iron-oxidizing microorganisms[J]. Materials Science and Engineering C, 26(4): 588-592. DOI:10.1016/j.msec.2005.04.009 |
| 王敏, 周立祥. 2011. 硅藻土、石英砂和钾离子促进微生物转化酸性矿山废水中亚铁成次生矿物的研究[J]. 岩石矿物学杂志, 30(6): 1031-1038. DOI:10.3969/j.issn.1000-6524.2011.06.009 |
| 韦冠俊. 2001. 矿山环境工程[M]. 北京: 冶金工业出版社. |
| 夏雨, 吴攀, 张瑞雪, 等. 2018. 酸性矿山废水对碳酸盐岩侵蚀的影响[J]. 生态学杂志, 37(6): 1702-1707. |
| 熊玲, 张瑞雪, 吴攀, 等. 2010. 碳酸盐岩处理煤矿酸性废水的试验研究[J]. 水处理技术, 36(8): 45-48. |
| Xiong H X, Liang J R, Xu Y Q, et al. 2009. Spectral analysis of FeOOH prepared through hydrolysis and neutralization of ferric solutions under different conditions[J]. Spectroscopy & Spectral Analysis, 29(7): 2005-2009. |
| 许保玖. 1983. 当代给水与废水处理原理[M]. 北京: 清华大学出版社. |
| 张莎莎, 沈晨, 刘兰兰, 等. 2016. 附着微生物黄铁矾回流对不同温度酸性硫酸盐体系亚铁氧化及总铁沉淀的强化效果[J]. 环境科学学报, 36(2): 513-520. |
| 周立祥. 2017. 生物矿化: 构建酸性矿山废水新型被动处理系统的新方法[J]. 化学学报, 75(6): 552-559. |
| Zhu J, Gan M, Zhang D, et al. 2013. The nature of Schwertmannite and Jarosite mediated by two strains of Acidithiobacillus ferrooxidans with different ferrous oxidation ability[J]. Materials Science & Engineering C, 33(5): 2679-2685. |
| 朱琳. 2011. Fe2+生物氧化和矿山酸性废水资源化利用研究[D]. 南京: 南京大学 |
