 , 梁瑜海1,2
, 梁瑜海1,2
 , 陈漫霞1, 陈莉丹1, 何坤桓1, 余光伟1,2
, 陈漫霞1, 陈莉丹1, 何坤桓1, 余光伟1,21. 华南农业大学, 资源环境学院, 广州 510642;
2. 华南农业大学, 广东省农业农村污染治理与环境安全重点实验室, 广州 510642
收稿日期: 2021-03-29; 修回日期: 2021-04-29
基金项目: 国家自然科学基金项目(No.51708229);广东省珠江人才计划"青年拔尖人才"项目(No.2017GC010157)
作者简介: 姚丽婷(1997-), 女, E-mail: 18819231429@163.com
通讯作者(责任作者): 梁瑜海, E-mail: liangyuhai@scau.edu.cn
摘要:短程硝化过程是短程生物脱氮工艺中的限速步骤,在保证稳定亚硝化率的前提下,提高曝气量能够提高好氧氨氧化菌的活性,进而提高氨氧化速率.本文在序批式反应器中,通过改变曝气量,在高溶解氧条件下,考察不同曝气量对短程硝化的性能及微生物的影响.结果表明,随着曝气量的增大,氨氧化速率不断升高.单位体积曝气量为0.8、1.7、3.3、5.0 L·min-1·L-1时,氨氧化率维持在50%左右,亚硝酸盐氮积累率稳定在99%以上,平均氨氧化速率分别为0.88、0.96、1.29和1.32 mg·L-1·min-1.高通量测序分析表明,不同曝气量条件下,反应器中好氧氨氧化菌的优势菌属均为Nitrosomonas,而亚硝酸盐氧化菌都被有效抑制,Nitrospira丰度很低.此外,检出Acidovorax、Denitratisoma、Hyphomicrobium、Ignavibacterium等多种反硝化细菌,这些反硝化菌能够与好氧氨氧化菌共同作用,使系统发生少量内源同步硝化反硝化.综合考虑曝气能耗和反应速率,曝气量为3.3 L·min-1·L-1时,可实现控制短程硝化工艺的低耗高效运行.
关键词:短程硝化曝气量氨氧化细菌氨氧化速率微生物群落
Effects of aeration rates on the performance and microbial characteristics of partial nitrification under high dissolved oxygen condition
YAO Liting1
 , LIANG Yuhai1,2
, LIANG Yuhai1,2
 , CHEN Manxia1, CHEN Lidan1, HE Kunhuan1, YU Guangwei1,2
, CHEN Manxia1, CHEN Lidan1, HE Kunhuan1, YU Guangwei1,21. College of Natural Resources and Environment, South China Agricultural University, Guangzhou 510642;
2. Guangdong Provincial Key Laboratory of Agricultural & Rural Pollution Control and Environmental Safety, South China Agricultural University, Guangzhou 510642
Received 29 March 2021; received in revised from 29 April 2021;
Abstract: Partial nitrification is the rate-limiting step in the short-cut biological nitrogen removal process. On the premise of stable nitrite accumulation, increasing aeration rate can improve the activity of aerobic ammonia-oxidizing bacteria (AOB), and then accelerate the ammonia oxidation. In this study, the effects of aeration rates on the performance and microbial characteristics of partial nitrification in SBR under high dissolved oxygen conditions were investigated. The results showed that the ammonia oxidation rate increased with the elevation of the aeration rate. When the aeration rate per unit volume was 0.8, 1.7, 3.3 and 5.0 L·min-1·L-1, the ammonia oxidation rate stayed at about 50%, the nitrite accumulation rate was stable above 99%, and the average ammonia oxidation rates were 0.88, 0.96, 1.29 and 1.32 mg·L-1·min-1, respectively. The high-throughput sequencing results that Nitrosomonas was the dominant AOB under different aeration rates, while nitrite-oxidizing bacteria were effectively inhibited, with a very low abundance of Nitrospira. Additionally, a variety of denitrifying bacteria were detected, including Acidovorax, Denitisoma, Hypomicrobium and Ignavibacterium. These denitrifying bacteria can interact with AOB to make a small amount of endogenous simultaneous nitrification and denitrification in the system. Considering the aeration energy consumption and the reaction rate, when the aeration rate is 3.3 L·min-1·L-1, the partial nitrification process can achieve prominent ammonia oxidation with low consumption.
Keywords: partial nitrificationaeration rateaerobic ammonia oxidizing bacteriaammonia oxidation speed ratemicrobial community
1 引言(Introduction)随着工农业的快速发展, 大量的含氮废水排放进入水体, 造成严重的水体富营养化现象.为了有效地控制氮素污染, 高效低耗的新型脱氮工艺如短程硝化反硝化、短程硝化厌氧氨氧化等工艺引起了广泛的关注(Lackner et al., 2014; Chen et al., 2016), 实现这些工艺的前提是长期稳定的短程硝化.短程硝化是在好氧情况下, 好氧氨氧化菌(Ammonia-oxidizing bacteria, AOB)将NH4+-N氧化成NO2--N, 硝化反应停留在NO3--N这一步的过程(Rodriguez-Sanchez et al., 2014).
实现短程硝化的关键是富集AOB以及抑制和淘汰亚硝酸盐氧化菌(Nitrite-oxidizing bacteria, NOB).目前, 已有一些实现短程硝化的控制策略, 包括低溶解氧(Dissolved oxygen, DO) 浓度(Le et al., 2020)、间歇曝气(Zhou et al., 2020)、实时控制曝气时间(Cui et al., 2020)、高游离氨(FA)(Park et al., 2015)、高游离亚硝酸(FNA)(Tang et al., 2020)、短污泥停留时间(SRT)和高温(Ge et al., 2015)等.在很多研究中, 都是采用多个参数共同控制的策略, Jiang等(2019)利用FNA和DO抑制(< 0.5 mg·L-1)维持膜生物反应器(MBR)中的短程硝化的稳定, 亚硝酸盐氮积累率大于96%.Zhang等(2019)通过对间歇曝气、pH、DO浓度、FA浓度进行联合控制, 快速实现短程硝化的启动, 并且在稳定状态下, 亚硝酸盐氮积累率和氨氧化率都达到97%左右.
但是在实际应用中, 很难控制进水的FA、FNA、温度等参数, 较易控制的是曝气模式和DO浓度.因此, 低DO浓度控制一直被广泛应用于短程硝化工艺中.低DO浓度的控制机理是利用AOB的氧半饱和常数比NOB低(杨庆等, 2018), 低DO条件下NOB的活性被抑制, 来实现短程硝化.但是近年来, 一些研究发现(Liu et al., 2013;Liu et al., 2019), 长期在低DO条件下, NOB会适应DO环境, 短程硝化难以维持稳定.而且当DO浓度较低时, 好氧氨氧化速率比较慢, 丁文川等(2012)研究得出, 在DO浓度为0.8 mg·L-1的条件下, NH4+-N转化速率比较低, 为5.14 mg·L-1·h-1.氨氧化速率低会使得短程硝化成为短程硝化反硝化和短程硝化厌氧氨氧化工艺的限速步骤, 限制了脱氮效率的提高.在一些存在其他控制条件的短程硝化工艺中, 为了使短程硝化不成为限速步骤, 可通过提高DO浓度来提高好氧氨氧化速率.但是当DO到达某一浓度, 氨氧化速率会达到极限, 继续增加DO也无法继续提高氨氧化速率, 造成浪费曝气能耗.而DO浓度多通过曝气量调控来实现, 目前针对高DO条件下短程硝化的曝气控制研究的报道还较少.因此, 本文在序批式反应器(Sequencing Batch Reactor, SBR)中, 通过改变曝气量, 在DO条件下, 考察不同曝气量对短程硝化的性能及微生物的影响, 确定最优曝气控制参数, 以期实现短程硝化工艺高效低耗的稳定运行.
2 材料与方法(Materials and methods)2.1 实验装置实验采用有效容积为20 L的SBR反应器, 实验装置由圆柱形的塑料桶、曝气装置、搅拌器和抽水泵组成.SBR反应器在常温(25~30 ℃)下进行培养.
图 1(Fig. 1)
 |
| 图 1 SBR反应器装置示意图 Fig. 1Schematic diagram of a SBR reactor |
2.2 长期实验长期实验总共运行60 d, SBR的运行分为表 1所示的4个阶段.每天运行一个周期, SBR的一个周期包括进水、反应、沉淀、排水、闲置5个阶段.实验用水为人工配置, 加入18.68 g硫酸铵和48 g碳酸氢钠到20 L水中, 控制进水的NH4+-N浓度为200 mg·L-1左右.反应时间是曝气时间, 并且一直进行搅拌, 每个阶段的曝气量和曝气时间由表 1所示, 曝气时间是根据曝气量的改变而改变, 使氨氧化率(Ammonia oxidation rate, AOR)维持在50%左右.在曝气开始后几分钟和结束后几分钟取水样来测定进出水的NH4+-N、NO2--N、NO3--N浓度, 并测定温度、pH、DO.在曝气结束后, 静置15 min, 利用抽水泵排水, 排水体积约为75%, 然后进行洗泥.洗泥完成后进入闲置阶段至下一次曝气开始.
表 1(Table 1)
| 表 1 短程硝化SBR运行阶段 Table 1 Operation stage of partial nitrification SBR | |||||||||||||||
表 1 短程硝化SBR运行阶段 Table 1 Operation stage of partial nitrification SBR
| |||||||||||||||
2.3 周期实验在每个阶段结束后进行一次周期实验, 在曝气过程中每隔一段时间取样来测NH4+-N、NO2--N、NO3--N浓度, 并测pH和DO, 时间间隔则按照前期短、中期长、后期短的规律进行, 直到NH4+-N完全被氧化就停止曝气, 其他操作与长期实验相同.
2.4 污泥的微生物特征分析在每个阶段的最后一天(即第14、29、44、60 d)从反应器中获取污泥样品进行DNA提取.将污泥样品置于50 mL无菌塑料试管中, 在-20 ℃的条件保存.将污泥样品送至生工生物工程(上海)股份有限公司进行DNA提取和高通量测序.扩增细菌16S rRNA基因的V3~V4区域, 引物采用341F/805R(341F:CCTACGGNGGCWGCAG;805R:GACTA CHVGGTATCTAATCC).将所得序列用uclust(uclustv1.1.579)进行聚类分析, 相似度97%定义为操作分类单元(Operational Taxonomic Unit, OTU).用Mothur(http://www.mothur.org/)计算香农多样性指数, 用Silva(http://www.arb-silva.de)比较.
2.5 分析方法和计算方法NO2--N浓度的测定采用N-(1-萘基)-乙二胺光度法, NO3--N浓度的测定采用紫外分光光度法, NH4+-N浓度的测定采用纳氏试剂分光光度法, 温度、DO浓度及pH值的测定则采用了水质分析仪.AOR、亚硝酸盐氮积累率(nitrite accumulation rate, NAR)和氨氧化速率分别按照式(1)~(3)计算.
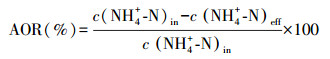 | (1) |
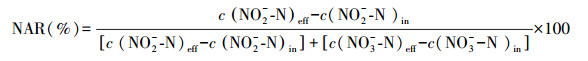 | (2) |
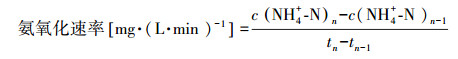 | (3) |
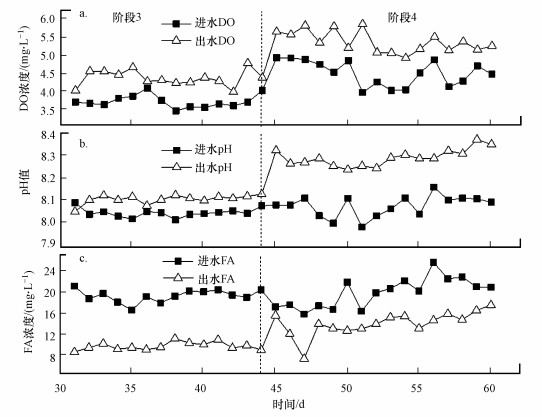
3 结果与讨论(Results and discussion)3.1 不同气水比条件下短程硝化性能变化如图 2所示, 进水NH4+-N浓度控制在200 mg·L-1左右, 系统分4个阶段运行, 曝气量逐渐增加, 曝气时间随之减少, 氨氧化率基本在50%左右, 亚硝酸盐氮积累率稳定在99%以上, 系统的亚硝化反应比较稳定.阶段1的曝气量为0.8 L·min-1·L-1, 运行了14 d, 曝气时间控制在150 min, 出水NH4+-N浓度在97.49 mg·L-1, 平均AOR达到52.91%, NAR稳定在99%以上.到了第2阶段, 曝气量增加到1.7 L·min-1·L-1, 氨氧化速率提高, 曝气时间减少到120 min, 平均AOR为52.75%, NAR稳定在99%以上.在第3阶段, 曝气量增加到3.3 L·min-1·L-1, 反应器中的平均进水DO浓度为3.75 mg·L-1(图 3), 提高AOB的活性, 曝气时间减少80 min, 平均AOR为53.45%, NAR稳定在99%以上, 出水DO浓度增加到4.39 mg·L-1, pH稳定在8.0~8.1.在第4阶段, 曝气量增加到5.0 L·min-1·L-1, 进水DO浓度增加到4.53 mg·L-1, 短程硝化没有被破坏, AOR为50.96%, NAR稳定在99%以上, 但是曝气时间减少的程度不大, 减少到70 min, pH稳定在8.1~8.3.
图 2(Fig. 2)
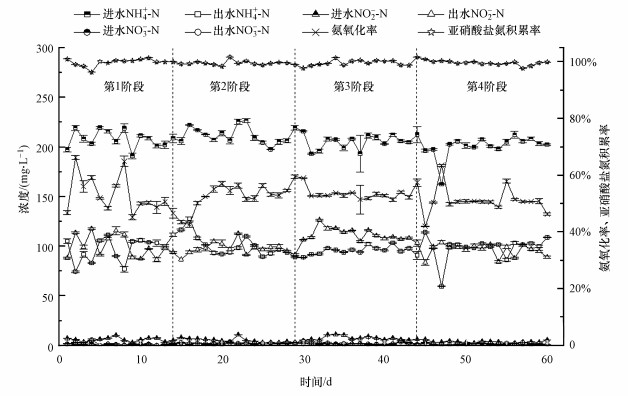 |
| 图 2 运行期间NH4+-N浓度、NO2--N浓度、NO3--N浓度、氨氧化率及亚硝酸盐氮积累率的变化 Fig. 2Changes of ammonia, nitrite and nitrate concentrations, AOR and NAR during operation |
图 3(Fig. 3)
 |
| 图 3 阶段3、阶段4的DO、pH、FA变化 Fig. 3Changes of DO, pH and FA in stage 3 and 4 |
由图 2中3种氮素的进出水数据可以算出, 整个实验过程中都有总氮损失, 说明反应器中可能有同步硝化反硝化(Simultaneous nitrification and denitrification, SND)发生.这可能是由于活性污泥絮凝体中的DO梯度的结果, 即硝化细菌存在于DO浓度高的区域, 而反硝化菌则在DO浓度极低的区域发挥活性(Münch et al., 1996).在曝气量较小的时候, 总氮损失较高, 随着曝气量的增加, 反应器中的DO增加, 第3、4阶段的总氮损失量减少.反应器内或污泥絮凝体内部极有可能存在缺氧微环境, 为反硝化细菌提供生存环境(郭海燕等, 2012).而曝气量相对较高时, 氧的穿透能力较强, 使污泥絮凝体内部的DO也增大, 从而缩小内部的缺氧区, 减弱了反硝化能力, 所以减少了总氮损失.最近研究发现, 存在好氧反硝化菌, 在有氧条件下进行反硝化作用(孙家君等, 2014), 这也是发生SND的另外一个原因.而同一阶段的总氮损失波动, 可能是因为曝气量相同时, 氨氧化率会受进水氨氮浓度波动的影响, 且进出水pH都在8.0以上, 反应器内可能存在氨氮的吹脱作用.
如图 3b所示, 除了第31 d, 出水的pH都稍微比进水的高, 理论上, 亚硝化反应会消耗碱度并产生H+, 会导致pH值下降, 可能是因为本试验的曝气量太大, CO2被快速、大量吹脱, 导致CO2的吹脱速率大于亚硝化反应的产酸速率, 导致pH值上升, 从而出水pH大于进水pH.
由图 3c可知, 第3阶段和第4阶段的FA浓度都比较高, 进水平均FA浓度在19.7 mg·L-1, 出水平均FA浓度为12.3 mg·L-1.Anthonisen等(1976)指出对NOB的抑制浓度为0.1~1.0 mg·L-1, 而有研究表明(Chen et al., 2010), 为了有效维持AOB的活性和抑制NOB以实现高效的亚硝酸盐氮积累, 需要较高的FA浓度, 为10~15 mg·L-1.本研究的FA浓度为12.3~19.7 mg·L-1, 当增加曝气量, 使系统内的进水DO浓度增加到4.53 mg·L-1, 也能有效维持短程硝化的稳定.Sui等(2016)认为, 在高DO条件下((3.75±0.49) mg·L-1), FA高达(10.61±2.89) mg·L-1, 可维持84%的亚硝酸盐氮积累率的稳定, 这与本研究结果类似.
3.2 不同曝气量条件下短程硝化周期试验分析如图 4所示, 图 4a~4d的曲线变化相对一致, 随着反应的进行, NH4+-N浓度持续下降, NO2--N浓度逐渐增加, NO3--N浓度一直稳定在5 mg·L-1以下, 亚硝化率都稳定在99%以上.由图 4a~4d, 逐渐提高曝气量, 都有大量NO2--N积累, 亚硝化反应没有被破坏, 说明亚硝化反应在高DO浓度下也能稳定进行.而且当NH4+-N氧化完全之后, 继续曝气, NO3--N并没有增加, 这说明了反应器内NOB数量较少, 被成功抑制.在4种曝气量情况下总氮都逐渐减少, 表明在反应过程中还发生了微弱的SND或吹脱作用.
图 4(Fig. 4)
 |
| 图 4 不同曝气量下周期实验中三氮浓度变化 (a. 0.8 L·min-1·L-1, b. 1.7 L·min-1·L-1, c. 3.3 L·min-1·L-1, d.5.0 L·min-1·L-1) Fig. 4Changes of three types of nitrogen concentrations in periodic experiments under different aeration rates (a. 0.8 L·min-1·L-1, b. 1.7 L·min-1·L-1, c. 3.3 L·min-1·L-1, d.5.0 L·min-1·L-1) |
曝气量分别为0.8、1.7、3.3、5.0 L·min-1·L-1时, NH4+-N几乎被氧化完全时所用的时间分别为390、305、235、220 min, 而氨氧化率为50%左右所用的时间则为150、120、80、70 min, 可以看出在其他条件不变的情况下, 增大曝气量到3.3 L·min-1·L-1, 氨氧化速率随之增加, 大大缩短了曝气时间.而增加曝气量到5.0 L·min-1·L-1时, 曝气时间减少的程度变小了, 与曝气量为3.3 L·min-1·L-1相比, 曝气时间相差不大.为了不造成曝气能耗的浪费, 3.3 L·min-1·L-1是较为合适的曝气量.
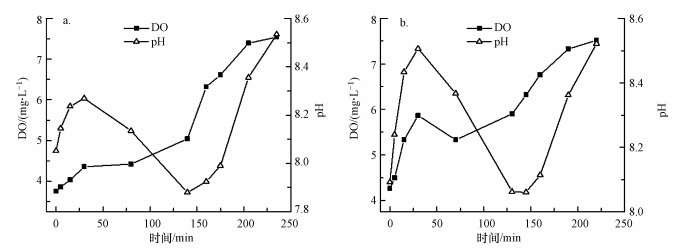
图 5是曝气量为3.3、5.0 L·min-1·L-1的条件下周期实验的pH、DO变化, 从图 5可以看出, pH都保持在7.8~8.6, 适宜于AOB生长.pH值在运行初始时迅速增加, 主要是由于系统中二氧化碳(CO2)的析出造成的(Peng et al., 2004).pH随着NH4+-N不断被氧化而降低, pH值的降低是由于氨转化为亚硝酸盐的过程中消耗了碱度并产生了H+(Guo et al., 2009).图 5a的第140 min和图 5b的第130 min时, 短程硝化即将完成时, 由于CO2溶出, pH值开始上升.pH曲线出现了一个迅速回升的拐点, 称之为“氨谷”(Guo et al., 2009), 当氨氧化率为50%左右的时候, pH值比初始pH高, 这一现象与长期实验的pH变化符合.
图 5(Fig. 5)
 |
| 图 5 周期实验中的pH、DO变化 (a. 3.3 L·min-1·L-1, b. 5.0 L·min-1·L-1) Fig. 5Changes of pH and DO in batch experiments (a. 3.3 L·min-1·L-1, b. 5.0 L·min-1·L-1) |
在DO随时间变化曲线中, 亚硝化过程中DO缓慢增加.在亚硝化过程即将结束时, DO急剧增加.由于AOB的氨氧化速率会随着反应器内NH4+-N含量的减少而不断降低, 所以耗氧速率小于供氧速率时, 会造成DO的上升.当接近反应终点时, 由于NH4+-N接近消耗完毕, AOB的耗氧速率几乎接近于零, 从而造成反应器中DO快速积累, 此时造成DO浓度迅速升高(吴朕君等, 2019).另外随着曝气量的增加, DO曲线出现拐点所需的时间缩短.pH和DO曲线上分别出现了氨谷和DO转折点, 与三氮浓度变化曲线上的相应点对比可知, DO浓度与pH值的转折预示着短程硝化的终点即将到来.
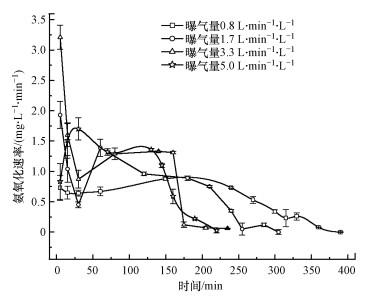
3.3 动力学分析如图 6所示, 不同曝气量, 亚硝化过程的氨氧化速率变化趋势都不太一样.在曝气量为0.8 L·min-1·L-1和5.0 L·min-1·L-1的条件下, 初始的氨氧化速率都比较低, 分别为0.55 mg·L-1·min-1和0.42 mg·L-1·min-1, 随着反应的进行, 氨氧化速率逐渐提高.0.8 L·min-1·L-1的曝气量, 会产生较低的DO浓度, 抑制AOB的活性(Liu et al., 2013), 从而导致AOB氧化NH4+-N的速率不高.而曝气量为5.0 L·min-1·L-1的条件下, AOB未能很快适应过高的DO条件, 所以活性较低, 需要一段时间来适应环境才能恢复活性, 逐渐提高氨氧化速率.所以很低和很高的曝气量不是最佳的选择.
图 6(Fig. 6)
 |
| 图 6 不同曝气量下周期实验中氨氧化速率变化 Fig. 6Changes of ammonia oxidation rates in batch experiments with different aeration rates |
在曝气量为1.7 L·min-1·L-1和3.3 L·min-1·L-1的条件下, 初始的氨氧化速率比较高, 分别为1.80 mg·L-1·min-1和3.21 mg·L-1·min-1.由于在较高曝气强度环境下, AOB的活性较高, 相应地对于NH4+-N的利用能力也得到了提升, 故氨氧化速率相对较高.
但是1.7 L·min-1·L-1的曝气量下, 随着反应的进行, 氨氧化速率的变化比较大, 不稳定, 先急剧下降到0.34 mg·L-1·min-1, 然后又迅速回升到较高的氨氧化速率, 为1.39 mg·L-1·min-1, 之后随着亚硝化反应的进行, 氨氧化速率逐渐减少.而在曝气量为3.3 L·min-1·L-1的条件下, 氨氧化速率从3.21 mg·L-1·min-1减少到1.11 mg·L-1·min-1, 之后的氨氧化速率比较稳定, 直到第175 min, NH4+-N几乎被氧化完全, 氨氧化速率迅速下降到0.12 mg·L-1·min-1.在整个反应过程中, 曝气量为3.3 L·min-1·L-1条件下的氨氧化速率比较高, 而且波动不大.说明3.3 L·min-1·L-1的曝气量条件下的反应器更能长时间维持稳定、高速运行.
短程硝化作为厌氧氨氧化的一个重要的初步过程, 需要向厌氧氨氧化反应器提供合适的进水(50%NH4+-N转化为NO2--N)方面起着重要作用(Dong et al., 2017).当曝气量分别为0.8、1.7、3.3、5.0 L·min-1·L-1时, NH4+-N被氧化50%左右, 所达到的平均氨氧化速率分别为0.88、0.96、1.29、1.32 mg·L-1·min-1.这表明随着曝气量的增加, 氨氧化速率也随之增加, 但是增加的幅度减少.
3.4 反应器中功能微生物特征3.4.1 生物多样性高通量测序技术可用于获知反应器中的微生物特征.本实验分析所采用的污泥样品取自第一阶段、第二阶段、第三阶段、第四阶段, 分别命名为P1、P2、P3、P4.如图OTU分析结果为根据的相似水平对有效的聚类分析, 样品P1的OTU数为678, 样品P2的OTU数为678, 样品P3的OTU数为673, 样品P4的OTU数为664(图 7).
图 7(Fig. 7)
 |
| 图 7 污泥样品的OTU分布Venn图 Fig. 7Venn diagram of OTU distribution of sludge samples |
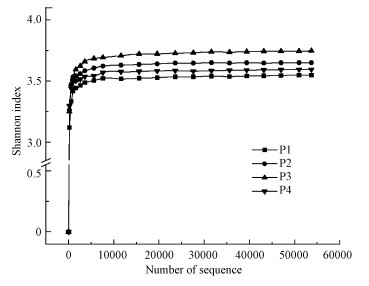
除了用OTU种类对微生物种群多样性进行分析, 还应进一步分析每个OTU中序列的数量占比.本研究采用Shannon指数对样品生物数量和均匀度进行评估.Shannon指数越高, 表明污泥样品中的生物多样性越高, 并且表明系统中微生物分布比较均匀.图 8是4个阶段污泥样品的Shannon指数.由图可知, P1、P2、P3、P4的Shannon指数分别为3.55、3.65、3.75、3.59.与OTU种类数量进行对比, Shannon指数的大小顺序与OTU种类数量的大小顺序存在明显差异.OTU种类:P1=P2>P3>P4, Shannon指数:P3>P2>P4>P1.这种差异是由于样品中微生物的均匀程度不同造成的.由此看出曝气量为3.3 L·min-1·L-1时, 废水能够与絮状污泥快速混合均匀, 使得各个部分环境状态相近, 所以系统中微生物种群分布较均匀, 多样性最大.
图 8(Fig. 8)
 |
| 图 8 污泥样品的Shannon指数 Fig. 8Shannon index of sludge sample |
3.4.2 门水平的对比图 9a为4个阶段污泥样品在门水平上的微生物特征.4个阶段中相对丰度较高的菌门为Bacteroidetes(拟杆菌门)、Proteobacteria(变形菌门)、Chloroflexi(绿弯菌门).其中, 拟杆菌门是污水处理厂中大量存在的细菌, 常在硝化反应器细菌群落中占主导地位(Sun et al., 2017), 其属于化能有机营养菌, 可以降解多种复杂有机物, 代谢碳水化合物, 广泛存在于活性污泥系统中(韩亚琳等, 2020).变形菌门是污水处理系统中活性污泥的重要组成部分, 与生物硝化作用和有机物降解有关(Yao et al., 2016).大多数与脱氮相关的功能菌, 如AOB、NOB和反硝化菌都属于变形菌门.绿弯菌门主要降解多糖和蛋白质等复杂化合物(Kindaichi et al., 2012).
图 9(Fig. 9)
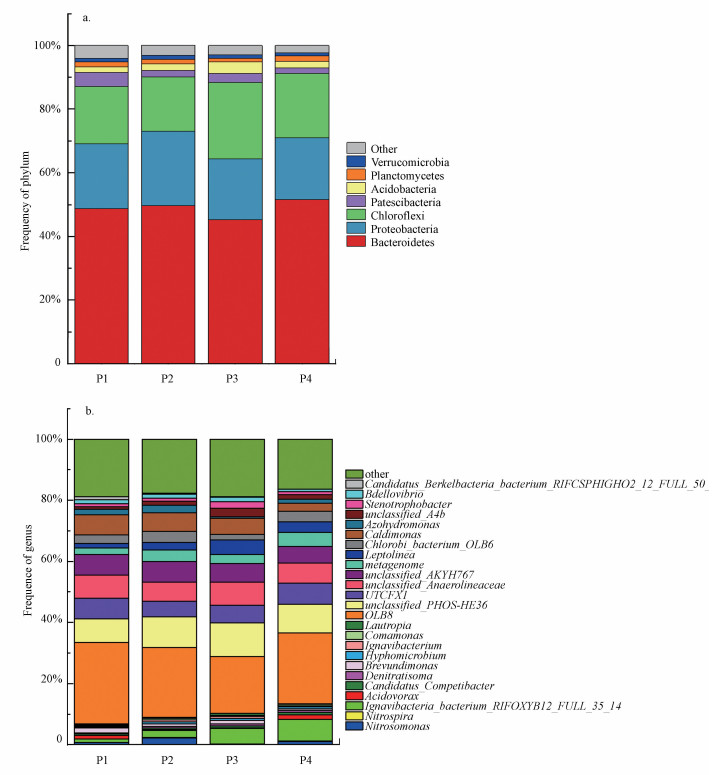 |
| 图 9 不同曝气量下微生物门水平(a)与属水平(b)相对丰度 Fig. 9Relative abundance of microorganisms at Phylum level(a) and Genus level(b) with different aeration rates |
3.4.3 属水平的对比不同曝气条件下, 污泥中微生物群落在属水平上的相对丰度如图 9b所示.本研究唯一检测出属于NOB的菌属是Nitrospira.Nitrospira的相对丰度的比例在4个阶段都很低, 分别是0.04%、0.06%、0.07%、0.06%, 说明NOB有效地被抑制.Nitrospira是k-对策者微生物, 对底物的亲和力比较高, 适合在低DO和NO2-浓度较低的条件下生长(Val Del Rio et al., 2019).本实验的高FA浓度可以有效地抑制NOB的活性, 但很难彻底把NOB完全淘汰.4个阶段中AOB的优势菌属均为Nitrosomonas.Nitrosomonas在P1、P2、P3、P4中的占比分别为0.72%、2.23%、0.18%、1.09%.其中, AOB在P3中的占比远小于其他3个反应器.但是根据上面所述, 第3阶段的氨氧化速率比较高, 对应的AOB的含量却不高, 可能是因为AOB的活性在曝气量为3.3 L·min-1·L-1时的活性达到最高.本研究中检测出的Ignavibacteria_bacterium_ RIFOXYB12_FULL_35_14、Candidatus_Competibacter、Acidovorax、Denitratisoma、Brevundimonas、Hyphomicrobium、Ignavibacterium、Comamonas、Lautropia都属于反硝化菌(Song et al., 2019; Xin et al., 2019; 刘玉佳等, 2019).其中, Hyphomicrobium、Denitratisoma、Comamonas都是好氧反硝化菌, 它们是利用好氧反硝化酶的作用, 在有氧的条件下进行反硝化的一类反硝化细菌(王永刚等, 2017).有研究表明, 好氧反硝化菌同时具有异养硝化的能力(王欢等, 2008).并且最近有研究发现, Hyphomicrobium与硝化性能密切相关, 并呈正相关趋势(Fukushima et al., 2013), 其丰度增加, 短程硝化的效果增加(王嗣禹等, 2019).在本研究中也出现这种现象, 在第3阶段的时候, 短程硝化的效果最好, 而Hyphomicrobium在P3的丰度是最大的, 占比为0.8344%, 可能是因为异养硝化-好氧反硝化菌的存在, 促进了短程硝化, 并提高氨氧化速率.好氧反硝化菌的存在表明了反应器中的SND不仅通过传统的自养硝化-异养反硝化进行, 也可能通过异养硝化-好氧反硝化进行.
4 结论(Conclusions)1) 在高DO条件下, 高FA浓度可有效抑制NOB活性, 从而实现短程硝化的高效稳定运行, 使氨氧化率维持在50%左右, 亚硝化率稳定在99%以上.
2) 曝气量为3.3 L·min-1·L-1时, 平均氨氧化速率为1.29 mg·L-1·min-1, 且反应周期内波动不大, 说明此条件下的反应器能长时间维持稳定、高速运行.相比于5.0 L·min-1·L-1可节省更多曝气能耗, 兼顾低耗和高效.
3) 4个曝气量条件下, AOB的优势菌属均为Nitrosomonas, 而NOB都被有效抑制, 丰度很小.曝气量为3.3 L·min-1·L-1时, 氨氧化速率较高, 可能与AOB活性较大及异养硝化菌比例增加有关.
4) 本研究中检测出多种反硝化细菌, 如Acidovorax、Denitratisoma、Hyphomicrobium、Ignavibacterium等, 这些反硝化菌与AOB共同作用, 使系统在曝气条件下有微弱的同步硝化反硝化.
参考文献
| Anthonisen A C, Loehr R C, Prakasam T B, et al. 1976. Inhibition of nitrification by ammonia and nitrous acid[J]. Journal-Water Pollution Control Federation, 48(5): 835-852. |
| Blackburne R, Yuan Z, Keller J. 2008. Partial nitrification to nitrite using low dissolved oxygen concentration as the main selection factor[J]. Biodegradation, 19(2): 303-312. DOI:10.1007/s10532-007-9136-4 |
| Chen J, Zheng P, Yu Y, et al. 2010. Enrichment of high activity nitrifers to enhance partial nitrification process[J]. Bioresource Technology, 101(19): 7293-7298. DOI:10.1016/j.biortech.2010.04.080 |
| Chen Z, Wang X, Yang Y, et al. 2016. Partial nitrification and denitrification of mature landfill leachate using a pilot-scale continuous activated sludge process at low dissolved oxygen[J]. Bioresource Technology, 218: 580-588. DOI:10.1016/j.biortech.2016.07.008 |
| Cui B, Yang Q, Liu X, et al. 2020. The effect of dissolved oxygen concentration on long-term stability of partial nitrification process[J]. Journal of Environmental Sciences, 90: 343-351. DOI:10.1016/j.jes.2019.12.012 |
| 丁文川, 吴丹, 曾晓岚, 等. 2012. 不同曝气量对SBBR短程硝化微生物特性及氮转化的影响[J]. 环境科学学报, 32(9): 2112-2118. |
| Dong H, Zhang K, Han X, et al. 2017. Achievement, performance and characteristics of microbial products in a partial nitrification sequencing batch reactor as a pretreatment for anaerobic ammonium oxidation[J]. Chemosphere, 183: 212-218. DOI:10.1016/j.chemosphere.2017.05.119 |
| Fukushima T, Whang L, Chen P, et al. 2013. Linking TFT-LCD wastewater treatment performance to microbial population abundance of Hyphomicrobium and Thiobacillus spp[J]. Bioresource Technology, 141: 131-137. DOI:10.1016/j.biortech.2013.03.122 |
| Ge S, Wang S, Yang X, et al. 2015. Detection of nitrifiers and evaluation of partial nitrification for wastewater treatment: A review[J]. Chemosphere, 140: 85-98. DOI:10.1016/j.chemosphere.2015.02.004 |
| Gu S, Wang S, Yang Q, et al. 2012. Start up partial nitrification at low temperature with a real-time control strategy based on blower frequency and pH[J]. Bioresource Technology, 112: 34-41. DOI:10.1016/j.biortech.2011.12.028 |
| Guisasola A, Jubany I, Baeza J A, et al. 2005. Respirometric estimation of the oxygen affinity constants for biological ammonium and nitrite oxidation[J]. Journal of Chemical Technology & Biotechnology, 80(4): 388-396. |
| 郭海燕, 郭祯, 柳志刚, 等. 2012. 不同曝气强度下SBMBBR和SBR脱氮除磷性能对比研究[J]. 环境科学学报, 32(3): 568-576. |
| Guo J H, Peng Y Z, Wang S Y, et al. 2009. Effective and robust partial nitrification to nitrite by real-time aeration duration control in an SBR treating domestic wastewater[J]. Process Biochemistry, 44(9): 979-985. DOI:10.1016/j.procbio.2009.04.022 |
| Guo J, Peng Y, Wang S, et al. 2009. Long-term effect of dissolved oxygen on partial nitrification performance and microbial community structure[J]. Bioresource Technology, 100(11): 2796-2802. DOI:10.1016/j.biortech.2008.12.036 |
| Hellinga C, Schellen A A J C, Mulder J W, et al. 1998. The sharon process: An innovative method for nitrogen removal from ammonium-rich waste water[J]. Water Science and Technology, 37(9): 135-142. DOI:10.2166/wst.1998.0350 |
| 韩亚琳, 王福浩, 王群, 等. 2020. HSBBR运行模式对同步短程硝化反硝化脱氮及微生物群落特征的影响[J]. 环境工程, 39(1): 51-57+17. |
| Jiang Y, Poh L S, Lim C, et al. 2019. Impact of free nitrous acid shock and dissolved oxygen limitation on nitritation maintenance and nitrous oxide emission in a membrane bioreactor[J]. Science of the Total Environment, 660: 11-17. DOI:10.1016/j.scitotenv.2019.01.024 |
| Kindaichi T, Yuri S, Ozaki N, et al. 2012. Ecophysiological role and function of uncultured Chloroflexi in an anammox reactor[J]. Water Science and Technology, 66(12): 2556-2561. DOI:10.2166/wst.2012.479 |
| Lackner S, Gilbert E M, Vlaeminck S E, et al. 2014. Full-scale partial nitritation/anammox experiences——an application survey[J]. Water Res, 55: 292-303. DOI:10.1016/j.watres.2014.02.032 |
| Le L, Lee S, Bui X, et al. 2020. Suppression of nitrite-oxidizing bacteria under the combined conditions of high free ammonia and low dissolved oxygen concentrations for mainstream partial nitritation[J]. Environmental Technology & Innovation, 20: 101135. |
| Liu G, Wang J. 2013. Long-term low DO enriches and shifts nitrifier community in activated sludge[J]. Environmental Science & Technology, 47(10): 5109-5117. |
| Liu W, Chen W, Yang D, et al. 2019. Functional and compositional characteristics of nitrifiers reveal the failure of achieving mainstream nitritation under limited oxygen or ammonia conditions[J]. Bioresource Technology, 275: 272-279. DOI:10.1016/j.biortech.2018.12.065 |
| 刘玉佳, 李茹莹. 2019. 河道底泥中异养硝化-好氧反硝化菌群富集培养及其脱氮性能[J]. 环境科学学报, 39(9): 2911-2918. |
| Ma Y, Peng Y, Wang S, et al. 2009. Achieving nitrogen removal via nitrite in a pilot-scale continuous pre-denitrification plant[J]. Water Research, 43(3): 563-572. DOI:10.1016/j.watres.2008.08.025 |
| Münch E V, Lant P, Keller J. 1996. Simultaneous nitrification and denitrification in bench-scale sequencing batch reactors[J]. Water Research, 30(2): 277-284. DOI:10.1016/0043-1354(95)00174-3 |
| Park S, Chung J, Rittmann B E, et al. 2015. Nitrite accumulation from simultaneous free-ammonia and free-nitrous-acid inhibition and oxygen limitation in a continuous-flow biofilm reactor[J]. Biotechnology and Bioengineering, 112(1): 43-52. DOI:10.1002/bit.25326 |
| Peng Y Z, Chen Y, Peng C Y, et al. 2004. Nitrite accumulation by aeration controlled in sequencing batch reactors treating domestic wastewater[J]. Water Science Technology, 50(10): 35-43. DOI:10.2166/wst.2004.0603 |
| Perez J, Costa E, Kreft J U. 2009. Conditions for partial nitrification in biofilm reactors and a kinetic explanation[J]. Biotechnol Bioeng, 103(2): 282-295. DOI:10.1002/bit.22249 |
| Rodriguez-Sanchez A, Gonzalez-Martinez A, Martinez-Toledo M, et al. 2014. The effect of influent characteristics and operational conditions over the performance and microbial community structure of partial nitritation reactors[J]. Water, 6(7): 1905-1924. DOI:10.3390/w6071905 |
| Song H, Liu J. 2021. Forward osmosis membrane bioreactor using Bacillus and membrane distillation hybrid system for treating dairy wastewater[J]. Environmental Technology, 42(12): 1943-1954. DOI:10.1080/09593330.2019.1684568 |
| Sui Q, Liu C, Zhang J, et al. 2016. Response of nitrite accumulation and microbial community to free ammonia and dissolved oxygen treatment of high ammonium wastewater[J]. Applied Microbiology and Biotechnology, 100(9): 4177-4187. DOI:10.1007/s00253-015-7183-z |
| 孙家君, 刘芳, 胡筱敏. 2014. 溶解氧和曝气时间对好氧反硝化菌脱氮效果的影响[J]. 环境工程, 32(12): 62-64. |
| Sun N, Ge C, Ahmad H A, et al. 2017. Realization of microbial community stratification for single-stage nitrogen removal in a sequencing batch biofilter granular reactor[J]. Bioresource Technology, 241: 681-691. DOI:10.1016/j.biortech.2017.05.203 |
| Tang L, Deshusses M A. 2020. Novel integrated biotrickling filter-anammox bioreactor system for the complete treatment of ammonia in air with nitrification and denitrification[J]. Environmental Science & Technology, 54(19): 12654-12661. |
| Val Del Rio A, Campos J L, Da Silva C, et al. 2019. Determination of the intrinsic kinetic parameters of ammonia-oxidizing and nitrite-oxidizing bacteria in granular and flocculent sludge[J]. Separation and Purification Technology, 213: 571-577. DOI:10.1016/j.seppur.2018.12.048 |
| 王欢, 汪苹, 刘晶晶. 2008. 好氧反硝化菌的异养硝化性能研究[J]. 环境科学与技术, 31(11): 45-47, 119. DOI:10.3969/j.issn.1003-6504.2008.11.013 |
| 王嗣禹, 刘灵婕, 王芬, 等. 2019. 溶解氧对悬浮与附着生长系统短程硝化反应的影响机制[J]. 环境科学, 40(12): 5430-5437. |
| 王永刚, 王旭, 张俊娥, 等. 2017. 好氧反硝化细菌研究及应用进展[J]. 工业水处理, 37(2): 12-17. |
| 吴朕君, 穆剑楠, 刘铭雪, 等. 2019. 基于DO和ORP一阶导数的短程硝化SBR实时控制研究[J]. 环境科学学报, 39(5): 1544-1553. |
| Xin X, Qin J. 2019. Rapid start-up of partial nitritation in aerobic granular sludge bioreactor and the analysis of bacterial community dynamics[J]. Bioprocess and Biosystems Engineering, 42(12): 1973-1981. DOI:10.1007/s00449-019-02190-x |
| 杨庆, 杨玉兵, 杨忠启, 等. 2018. 溶解氧对短程硝化稳定性及功能菌群的影响[J]. 中国环境科学, 38(9): 3328-3334. DOI:10.3969/j.issn.1000-6923.2018.09.016 |
| Yao R, Yang H, Yu M, et al. 2016. Enrichment of nitrifying bacteria and microbial diversity analysis by high-throughput sequencing[J]. RSC Advances, 6(115): 113959-113966. DOI:10.1039/C6RA24213H |
| Zhang D, Su H, Antwi P, et al. 2019. High-rate partial-nitritation and efficient nitrifying bacteria enrichment/out-selection via pH-DO controls: Efficiency, kinetics, and microbial community dynamics[J]. Science of the Total Environment, 692: 741-755. DOI:10.1016/j.scitotenv.2019.07.308 |
| Zhou Y, Oehmen A, Lim M, et al. 2011. The role of nitrite and free nitrous acid (FNA) in wastewater treatment plants[J]. Water Research, 45(15): 4672-4682. DOI:10.1016/j.watres.2011.06.025 |
| Zhou Z, Qi M, Wang H. 2020. Achieving partial nitrification via intermittent aeration in SBR and short-term effects of different C/N ratios on reactor performance and microbial community structure[J]. Water, 12(12): 3485. DOI:10.3390/w12123485 |
