 , 孙水裕1,2, 廖小健1, 方小弟1, 关智杰1, 叶茂友3, 李寿朋1
, 孙水裕1,2, 廖小健1, 方小弟1, 关智杰1, 叶茂友3, 李寿朋1

1. 广东工业大学环境科学与工程学院, 广州 510006;
2. 广东环境保护工程职业学院, 佛山 528216;
3. 仲恺农业工程学院, 环境科学与工程学院, 广州 510006
收稿日期: 2021-01-06; 修回日期: 2021-02-04; 录用日期: 2021-02-04
基金项目: 国家重点研发计划(No.2018YFD0800700);广东省科技计划项目(No.2016A040403068);广东省自然科学基金资助项目(No.2015A030308008)
作者简介: 周思宇(1995—), 男, E-mail: 775015562@qq.com
通讯作者(责任作者): 李寿朋, E-mail: lsp@gdut.edu.cn
摘要:针对铅锌硫化矿尾矿生物浸出周期长和效率低的问题,本研究采用Leptospirillum ferriphilum(L. ferriphilum)和Acidithiobacillus caldus(A. caldus)等比例混合构建了中度嗜热菌群,浸出铅锌硫化矿尾矿.引入一株兼性自养铁/硫氧化微生物Sulfobacillus benefaciens(S. benefaciens),考察其对中度嗜热菌群浸出尾矿过程的影响.结果表明,中度嗜热菌群(L. ferriphilum+A. caldus)8 d Zn浸出率达到93.94%.随着S. benefaciens引入,浸出环境保持更高的氧化还原电位和微生物活性,浸出过程中Fe3+浓度以及总铁浓度增加,4 d内Zn浸出速率提升了13.63%,8 d内Zn浸出率达到96.08%,S. benefaciens的加入强化了中等嗜热菌群的浸出效率.相关性分析表明多糖、蛋白质以及溶解性有机碳(DOC)与浸出过程中的溶液介质参数变化具有统计学意义上显著性和强相关性.表面官能团以及胞外聚合物(EPS)结果证实,引入S. benefaciens在浸出过程中促进菌群产生更多的蛋白质和碳水化合物,有助于提高中度嗜热菌群的浸出效率,加快浸出铅锌硫化矿尾矿中有价金属,降低其环境毒性.
关键词:生物浸出中度嗜热菌群Sulfobacillus benefaciens铅锌硫化矿尾矿
Mechanism of Sulfobacillus benefaciens enhancing the lead-zinc sulfide tailings bioleaching performance by moderate thermophilic consortia
ZHOU Siyu1
 , SUN Shuiyu1,2, LIAO Xiaojian1, FANG Xiaodi1, GUAN Zhijie1, YE Maoyou3, LI Shoupeng1
, SUN Shuiyu1,2, LIAO Xiaojian1, FANG Xiaodi1, GUAN Zhijie1, YE Maoyou3, LI Shoupeng1

1. School of Environmental Science and Engineering, Guangdong University of Technology, Guangzhou 510006;
2. Guangdong Polytechnic of Environmental Protection Engineering, Foshan 528216;
3. College of Environmental Science and Engineering, Zhongkai University of Agriculture and Engineering, Guangzhou 510006
Received 6 January 2021; received in revised from 4 February 2021; accepted 4 February 2021
Abstract: To overcome the problems of long cycle and low efficiency of bioleaching the lead-zinc sulfide tailings,this study applied Leptospirillum ferriphilum and Acidithiobacillus caldus in equal proportion to constructed a moderate thermophilic consortia to leach lead-zinc sulfide. The influence of introducing a facultative autotrophic iron/sulfur-oxidizer Sulfobacillus benefaciens on the process of bioleaching tailings was investigated. The results showed that Zn leaching rate of by L.ferriphilum and A.caldus consortia reached 93.94% only in 8 days. With the introduction of S.benefaciens,the leaching system maintained a higher redox potential and microbial activity,and the ferric iron and total iron concentration increased during the leaching process. The relative leaching rate of Zn increased by 13.63% within 4 days,and the Zn leaching rate reached 96.08% within 8 days. Therefore,the addition of S.benefaciens enhanced the leaching efficiency of the moderate thermophilic consortia. Correlation analysis indicated that polysaccharides,protein,and dissolved organic carbon (DOC) showed a significant correlation with the changes in solution media parameters during the leaching process. Moreover,the result of surface functional groups and extracellular polymeric substances (EPS) confirmed that the introduction of S.benefaciens in the leaching process promoted the consortia to produce more proteins and carbohydrates,which could improve the leaching efficiency of moderate thermophilic bacteria,accelerated the leaching of valuable metals in lead-zinc sulfide tailings,and reduced its environmental toxicity.
Keywords: bioleachingmoderately thermophilic consortiaSulfobacillus benefacienslead-zinc sulfide tailing
1 引言(Introduction)随着有色金属硫化矿矿冶业的迅猛发展, 选矿过程中产生的硫化矿尾矿越来越多.铅锌硫化矿尾矿属于一种危险废物, 含有包括铅、锌和镉等多种重金属元素, 在湿润和有氧的环境中, 重金属离子易溶出, 随水体迁移, 形成酸性矿山废水(AMD), 严重污染周边的生态环境.因此, 发展环保、经济、高效的尾矿综合利用新技术回收尾矿中有价金属, 降低尾矿环境毒性, 具有重大的学术意义和经济价值.
生物浸出基于嗜酸性微生物可利用矿石中低价态硫以及二价铁为能源物质, 将矿石中的不溶性的金属转变为可溶性的金属, 继而回收利用.该技术因其具有环境友好、操作简单、反应温和、成本低廉等优点, 近年来被广泛应用于多种硫化矿的处理(Gu et al., 2018; Srichandan et al., 2019), 但单一菌种浸出尾矿存在浸出周期长和浸出效率低的瓶颈, 限制了该方法的推广应用.据文献报道, 生物浸出系统中常见的浸矿微生物超过40种(Panda et al., 2015).根据代谢类型的不同, 用于浸矿的嗜酸微生物可分为铁氧化菌、硫氧化菌和铁/硫氧化菌(Mendez-Garcia et al., 2015).根据浸矿微生物的适宜生长温度, 可分为常温菌(20~40 ℃)、中等嗜热菌(40~60 ℃)以及极端嗜热菌(60 ℃以上)(Mahmoud et al., 2017).已有研究表明, 不同代谢类型微生物的协同作用, 有助于铁和硫的代谢, 提高重金属的浸出能力(Behera et al., 2011).在浸出过程中, 复配的混合菌比单一菌的浸出效果更好(Li et al., 2014).Liao等(2019) 利用Leptospirillum ferriphilum(L.ferriphilum)和Acidithiobacillus thiooxidans(A.thiooxidans)等比例混合构建共培养体系在30 ℃对铅锌尾矿进行浸出, 达到87.97% Zn浸出率只需要12 d, 浸出周期比Acidithiobacillus ferrooxidans(A. ferrooxidans)单菌浸出缩短了20 d (叶茂友等, 2016), 但达到94.5% Zn浸出率, 仍需20 d.因此, 微生物浸出铅锌硫化矿尾矿的周期和效率仍有上升的空间.
在硫化矿堆浸的过程中, 矿物氧化的过程是放热反应, 产生大量的热量, 导致浸出体系的温度升高, 整个浸出体系的温度可升至50 ℃, 甚至更高(曾伟民等, 2010;周洪波等, 2010).与常温菌相比, 中度嗜热菌具有以下优势: ①较强的氧化能力;②在不利条件下的抵抗和生存能力(刘丽君等, 2016;Castro et al., 2019).因此, 中度嗜热菌的应用有望进一步缩短浸出周期, 提高浸出效率.实验室浸出实验和工业运行的生物冶金厂都证明, 中等嗜热菌L.ferriphilum和Acidithiobacillus caldus(A.caldus)是菌群中的优势菌, Mahmoud等(2017)研究进一步表明, 浸出实验初期菌群中通常以铁氧化菌L.ferriphilum为主, 而A.caldus和Sulfobacillus. Spp在浸出后期才逐渐占据优势.此外, 引入Sulfobacillus. Spp可改变浸出过程中的群落结构, 有利于生物浸出的进行(Nancucheo et al., 2010; Bryan et al., 2011; Spolaore et al., 2011).为进一步促进尾矿浸出, 本研究选择铁氧化菌L.ferriphilum和硫氧化菌A.caldus等比混合, 形成人工微生物群落, 并在其浸出体系初期引入Sulfobacillus. Spp.Sulfobacillus benefaciens(S.benefaciens)作为一种兼性自养铁/硫氧化微生物(Johnson et al., 2008), 属厚壁门, 它可以利用元素硫、四硫酸盐、亚铁和硫化物矿物等作为能源物质生长.相较于常见的Sb. thermosulfidooxidans和Sb.acidophilus, S.benefaciens氧化亚铁离子的能力更强, 且显示出更大的自养生长倾向, 目前关于该微生物的研究尚少.
胞外聚合物(EPS) 是微生物与矿物之间互相作用的重要媒介, 促进细胞与矿物表面生物膜的形成, 为矿物溶解和细胞能量代谢之间提供了反应场所, 在生物浸出过程中起着非常关键的作用(He et al., 2014; Priya et al., 2018).同时发现EPS的组成和结构特征对生物浸出过程有显著影响(Cai et al., 2018; Wang et al., 2018).而根据浸出体系中微生物介导产生的EPS与矿物和生物的相对关系, 可将EPS分为可溶性EPS(Soluble EPS, 简称S-EPS)和黏附层EPS(Bound EPS, 简称B-EPS).其中B-EPS又可进一步分为松散层EPS(Loosely bound EPS, 简称LB-EPS)和紧密层EPS(Tightly bound EPS, 简称TB-EPS)(Zhang et al., 2019).Liao等(2019)首次采用三维荧光光谱结合平行因子分析法和物理化学方法分析尾矿浸出过程中不同层EPS的特征变化.但目前将三维荧光光谱技术应用于浸出微生物EPS的特征变化分析较少, 特别是对EPS的定性和定量分析.因此, 分析EPS的特征变化, 有助于揭示中等嗜热菌群浸出的机制.
本研究引入一种兼性自养铁/硫氧化菌S.benefaciens到铅锌硫化矿尾矿的研究.考察S.benefaciens对铁氧化菌L.ferriphilum和硫氧化菌A.caldus的共培养体系浸出铅锌硫化矿尾矿过程的影响.采用傅里叶变换红外光谱仪(FTIR)、荧光激发发射矩阵(EEM)测量和荧光区域综合指数法(FRI)分析矿物表面和EPS组分的改变, 揭示引入S.benefaciens前后对L.ferriphilum和A.caldus混合菌体系浸出过程的影响机制, 为生物浸出尾矿重金属技术提供一定的理论依据.
2 材料和方法(Materials and methods)2.1 矿物的前处理本文所用铅锌硫化矿尾矿样品来自广东省韶关市仁化县凡口铅锌矿尾矿库, 85%的矿物粒度小于75 μm.XRD结果表明, 尾矿样品主要由闪锌矿、黄铁矿、二氧化硅、方解石等组成(Liao et al., 2019).样品在厌氧环境中保存.样品经微波消解(MARS6, CEM, USA)后, 采用电感耦合等离子体光学发射光谱仪(ICP-OES, 7500, Agilent, USA)测定液体中的金属离子的浓度.结果表明: 该尾矿中主要金属元素及其含量为铁13.03%、锌0.67%和铅1.17%.
2.2 微生物的培养与驯化2.2.1 微生物的培养实验所使用的L. ferriphilum由中南大学生物冶金教育部重点实验室提供.A. caldus和S. benefaciens分别购自相应的菌种保藏中心.3株微生物的培养条件如表 1所示.其中微生物的培养使用9 K培养基培养, 配方如下: 0.50 g·L-1 MgSO4·7H2O、0.10 g·L-1 KCl、3.00 g·L-1 (NH4)2SO4、0.01 g·L-1 Ca(NO3)2和0.50 g·L-1 K2HPO4.驯化后的微生物使用表 1中的培养条件培养至对数期后离心收集接种到实验摇瓶中.
表 1(Table 1)
| 表 1 微生物的培养条件 Table 1 The culture conditions of microorganisms used in this study | |||||||||||||||||||||||
表 1 微生物的培养条件 Table 1 The culture conditions of microorganisms used in this study
| |||||||||||||||||||||||
2.2.2 微生物的驯化利用矿物取代硫源和亚铁作为能源物质来驯化细菌, 可缩短微生物对矿物的适应阶段(石丽娟, 2014).驯化条件如下: 溶液体系100 mL, 矿浆浓度5%(M/V).灭菌后分别于40 ℃和170 r·min-1的条件下培养微生物.将微生物培养至对数期后, 分别收集游离微生物以及附着微生物进行下一次的驯化, 该过程重复3次以上.收集游离微生物以及附着微生物的收集方法为: 低速离心(3000 r·min-1)7 min, 去除沉淀, 上清液高速离心(10000 r·min-1)20 min, 收集游离微生物.此外, 加入无菌的的9 K培养基重新悬浮沉淀, 然后加入0.2 mm玻璃微珠1 g, 涡流振荡至少5 min, 离心收集附着微生物(Feng et al., 2016).
2.3 生物浸出实验250 mL锥形瓶中装入100 mL的9 K培养基(不含单质硫以及硫酸亚铁), 矿浆浓度5%(M/V), 调节初始pH为1.8后, 于转速170 r·min-1、浸出温度40 ℃的摇床中进行.实验器皿均经过灭菌处理.采用2种不同接种方式进行生物浸出实验, 分别为L.ferriphilum+A.caldus以及L.ferriphilum+A.caldus+S.benefaciens, 其中各微生物等比例混合, 初始的微生物总数目为1×107个·mL-1.同时设置硫酸浸出的空白对照, 为抑制微生物的生长在酸浸对照组中加入5 mL 2%百里酚甲醇溶液(龙腾发等, 2019), 每组实验均设置至少两个平行样, 定期补加蒸馏水补充损耗的水分.实验序号为: (Ⅰ)非生物的酸浸对照组;(Ⅱ)L.ferriphilum+A.caldus;(Ⅲ)L.ferriphilum+A.caldus+S.benefaciens.
2.4 分析方法2.4.1 主要化学参数分析生物浸出实验周期为12 d, 每2 d对金属离子浓度、pH值、ORP值和微生物总量进行测定.ORP和pH分别用以Ag/AgCl为参比电极的氧化还原电位计(STORP1, OHAUS, USA)和数字pH计(STARTER 2100, OHAUS, USA)测量.样品经0.45 μm醋酸纤维素膜过滤除杂后, 采用5-磺基水杨酸分光光度法测定浸出液中铁离子和总铁浓度(Liu et al., 2018; Xia et al., 2018).采用电感耦合等离子体光谱法(720ES, Agilent, USA)测定浸出液中Zn离子的浓度.微生物总量使用血球计数板, 在奥林巴斯光学显微镜(B203LED, OPTEC, China)下获得.
2.4.2 EPS的提取与分析方法① EPS的提取.生物浸出过程中, 参考从尾矿浆中提取EPS的方法(Liao et al., 2019), 每4 d从混合培养实验组(Ⅱ)和混合培养实验组(Ⅲ)的浸出体系中提取EPS分析其组成和结构.各EPS层分析前通过0.45 μm醋酸纤维素膜过滤.
② EPS中多糖浓度和DOC测定.以葡萄糖为标准, 采用苯酚-硫酸法测定各层EPS样品中多糖的浓度(Li et al., 2017), 用TOC分析仪(Multi N/C 3100, Analytik Jena, Germany)测定各EPS层中的可溶性有机碳(DOC)的含量.
③ EPS分析与数据处理.利用三维激发发射矩阵荧光分光光度计(F-4600, Hitachi, Japan)对每一层EPS进行分析, 扫描速度为2400 nm·min-1, 发射光谱(Em)扫描范围为250~500 nm, 激发光谱(Ex)扫描范围为200~500 nm.在相同的狭缝带宽下(5 nm), 以5 nm的采样间隔记录光谱.在同等条件下, 使用水作为空白扫描, 样品的荧光强度减去空白扫描, 消除了水的拉曼散射峰(Xu et al., 2013).为了获取EPS组分的变化, 利用Origin 96软件(Math Works, Natick, Massachusetts, United States)对EEM数据进行FRI解析.FRI通过对每个EEM区域下的体积进行积分, 可对溶解性有机物(DOM)进行定量分析, 是最早用于分析DOM的方法之一.将荧光光谱分解为独立的荧光组分, 得到最大荧光强度分数峰位等参数(Xu et al., 2013; Zhu et al., 2015; Han et al., 2018).
④ 统计分析方法.利用IBM软件SPSS v22.0进行统计分析.通过皮尔森相关性系数分析评估浸出过程中各EPS物质含量变化与生物浸出参数变化之间的关系.
⑤ 矿物表面变化分析.浸出过程中尾矿样品用蒸馏水洗涤, 真空冷冻干燥后进行红外光谱分析.利用傅里叶红外光谱(Nicolet 6700, Thermo-Fisher, USA)观察了生物浸出过程中矿物表面官能团的变化.
3 结果与讨论(Results and discussion)3.1 浸出过程溶液介质参数的变化规律由图 1a~1f可观察, 铅锌硫化矿尾矿在生物浸出过程中溶液介质参数的变化.结果表明, 生物组和非生物组之间的参数变化存在显著差异.酸浸对照组pH、ORP值和Fe离子浓度基本保持不变, 大部分重金属仍停留在尾矿中.而对于生物组, 不同能源类型混合的菌群都对尾矿浸出有不同程度的促进作用.生物组在12 d的浸出过程中, Zn的浸出率从43.28%上升到99.55%, 同时pH由1.80下降至1.05, ORP值由380 mV上升至最高的808 mV.与此同时, Fe3+离子[Fe3+]和总铁浓度[TFe]分别从0.05 g·L-1和0.51 g·L-1上升至最高的4.24 g·L-1和6.67 g·L-1.微生物总量从初始的1.0×107个·mL-1上升至最高值2.2×108个·mL-1后开始下降.据微生物数量的变化, 可以将浸出过程分为3阶段, 0~4 d内为微生物的适应阶段, 4~10 d为微生物浸出的主要阶段, 10~12 d为浸出后期.
图 1(Fig. 1)
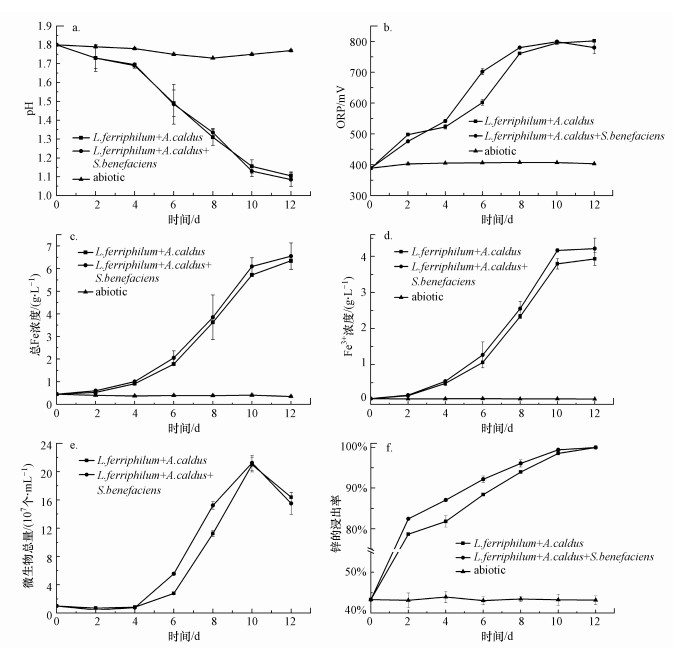 |
| 图 1 生物浸出溶液介质参数变化(a.pH, b. ORP, c.总Fe浓度, d.Fe3+浓度, e.微生物总量, f. Zn的浸出率) Fig. 1The variation in media parameters during bioleaching (a. pH, b. ORP, c. total iron concentration, d. ferric concentration, e. cells density, f. zinc leaching rate) |
图 1a显示了不同实验组下浸出过程中溶液pH的变化.非生物组的pH在浸出过程中几乎保持不变, 表明化学氧化对pH下降的贡献有限.生物浸出组(Ⅱ)~(Ⅲ)的浸出体系中pH表现出相同的持续下降趋势, 而在浸出过程中未出现明显的区别.在适应阶段0~4 d, 实验组(Ⅱ)~(Ⅲ)的pH下降速率较慢, 同期微生物量也下降, 这是由于微生物需要适应浸矿环境, 微生物氧化产酸与脉石耗酸之间在角力.在浸出的4~12 d, 各实验组的pH迅速下降, 微生物的量逐渐升高, 微生物氧化产酸过程超过耗酸过程, 初始pH从1.80开始下降至约1.05.这种显著的下降归因于微生物作用下金属硫化物的溶解.首先微生物通过直接氧化作用, 促进矿物溶解, 获取生长所需的S0和Fe2+ (式(1)、(2))(M代表金属元素, S代表硫元素, MS代表闪锌矿、方铅矿和黄铁矿等)(Liao et al., 2019).接着, 微生物通过氧化S0和Fe2+, 产生质子和Fe3+并作用在矿物表面(式(3)、(4))(Mahmoud et al., 2017).
 | (1) |
 | (2) |
 | (3) |
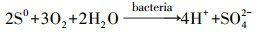 | (4) |
 | (5) |
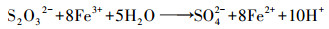 | (6) |
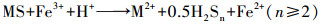 | (7) |
 | (8) |
 | (9) |
中度嗜热菌群的微生物总量是浸出过程中的重要指标, 微生物总量与浸出率之间存在关联性.微生物数量提高, 有助于硫化矿的氧化(叶茂友, 2017).中度嗜热菌群生物浸出过程中微生物总量呈现出相同的生长趋势变化, 如图 1e所示.微生物总量的变化反映了不同组别之间的差别.在0~4 d的适应阶段, 微生物总量先下降, 从1.0×107个·mL-1下降至0.7×107个·mL-1.4 d后进入主要浸出阶段, 组(Ⅲ)微生物总量迅速增加, 8 d内达到15.2×107个·mL-1, 高于组(Ⅱ)11.2×107个·mL-1.在10 d达到峰值21.0×107个·mL-1, 此时微生物对尾矿的浸出能力更强, 与ORP值和[TFe]的变化趋势相一致.在10~12 d的浸出后期, 大部分矿物被氧化后, 促使矿物中的金属离子浸出, 微生物无法获取生长所需的能源物质, 微生物的数量开始下降.上述结果表明, 随着浸出体系微生物种类的改变, 微生物数量在浸出过程中表现出不同的增长速度.在引入了S.benefaciens的实验组中微生物的量在浸出过程中升高, 并保持着最高的增长速度.
Zn的浸出率是衡量生物浸出效果的重要指标.图 1f表明, 生物组和非生物组之间锌浸出率存在明显差异.实验组(Ⅱ)~(Ⅲ)在浸出的12 d后, Zn浸出率均达到了99.55%, 而非生物组(Ⅰ)只有43.28%的Zn浸出率.实验组(Ⅱ)和(Ⅲ)对比可观察到, 不同类型的微生物的浸出速率存在差异, 随着浸出体系中微生物种类的增加, 浸出率在前10 d升高.引入S.benefaciens的实验组(Ⅲ)在4 d内的相对浸出速率最高提升了13.63%, 8 d内的Zn浸出率为96.08%, 高于实验组(Ⅱ)的93.94%.对比其他实验组, 引入S.benefaciens的实验组(Ⅲ)在浸出的0~8过程中保持着更高的ORP提升速率、Fe3+浓度以及更高微生物的量.高氧化还原电位和Fe3+对Zn浸出有促进作用, 闪锌矿通过微生物的直接氧化和Fe3+攻击, 溶解并释放锌离子, Zn浸出率提升.相比此前的研究(Liao et al., 2019), 本研究浸出体系中Zn浸出率达到93.94%以上只需要8 d, 浸出周期缩短了8 d.因此, 微生物种类较多的实验组表现出更好的锌浸出率, 这与群落演替密切相关.因为, 不同类型的微生物之间的协同作用有利于铁和硫代谢的更好平衡(Ma et al., 2017), 且群落中增加厚壁门菌(Firmicutes)可促使更高的金属浸出率(Wang et al., 2020).
3.2 生物浸出过程中EPS的三维结构与组成变化规律3.2.1 不同实验组浸出过程中EPS的变化规律本文利用荧光激发发射矩阵(EEM)测量和荧光区域综合指数法(FRI)(Guo et al., 2014)定性和定量分析EPS结构和物质组成, 进一步了解不同能源类型的中度嗜热菌群在浸出过程中的差异, 探究引入S.benefaciens前后的浸出过程的EPS特性变化.
图 2和3显示了实验组(Ⅱ)、(Ⅲ)的EPS三维荧光光谱的变化.图中标识的荧光光谱区域所代表的物质分别如下所示: A区域(Ex/Em=275/310 nm)色氨酸/酪氨酸类蛋白、B区域(Ex/Em=220/310 nm)色氨酸/酪氨酸类氨基酸、C区域(Ex/Em=290/380 nm)类芳香腐殖酸物质、D区域(Ex/Em=225/400 nm)富里酸(Wang et al., 2010;Guo et al., 2014; Wei et al., 2017).同时对EPS中上述的有机物含量使用荧光区域综合指数法进行量化分析(Chen et al., 2003), 如图 4c~4f所示.
图 2(Fig. 2)
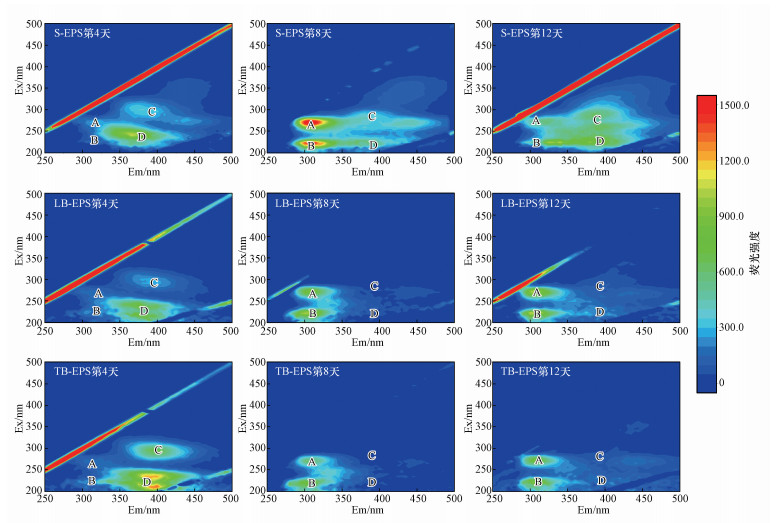 |
| 图 2 L.ferriphilum+A.caldus不同浸出时间各层EPS的三维荧光光谱(A、B、C、D代表不同荧光物质) Fig. 2The 3D fluorescence of each EPS layer at different leaching period with L.ferriphilum+A.caldus. (A, B, C, D represent different fluorescent substance) |
图 3(Fig. 3)
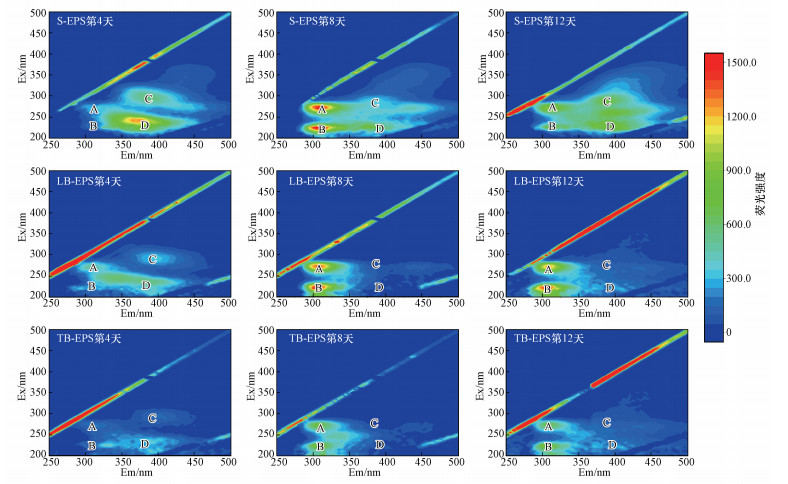 |
| 图 3 L.ferriphilum+A.caldus+S.benefaciens不同浸出时间各层EPS的三维荧光光谱(A、B、C、D代表不同的荧光物质) Fig. 3The 3D fluorescence of each EPS layer during different leaching period with L.ferriphilum+A.caldus+S.benefaciens. (A, B, C, D represent different fluorescent substance) |
图 4(Fig. 4)
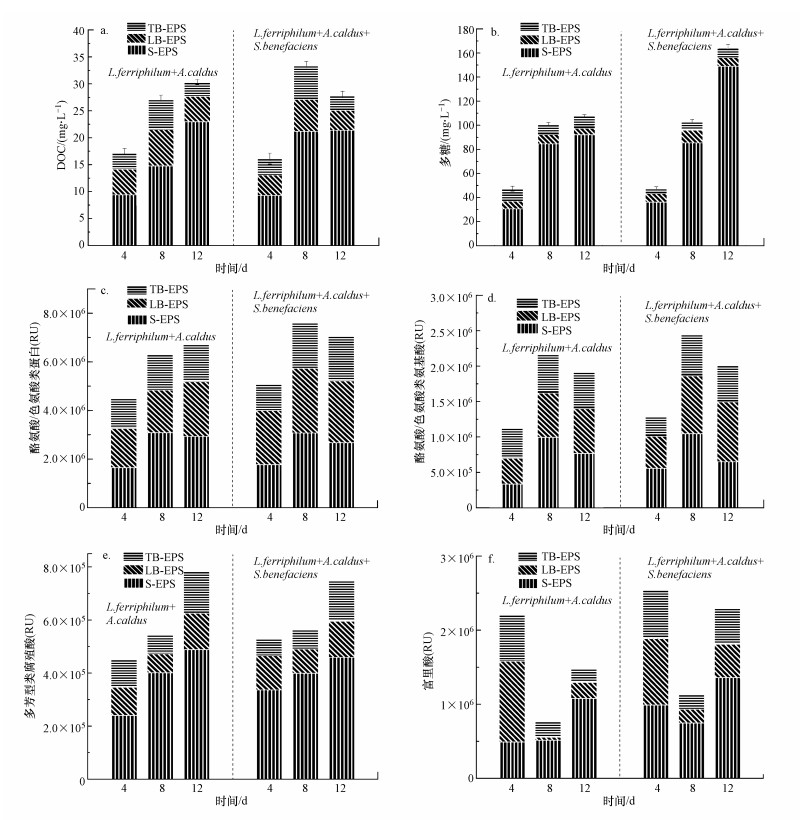 |
| 图 4 EPS中有机物含量的变化(a.DOC, b.多糖, c.酪氨酸/色氨酸类蛋白, d.类酪氨酸/色氨酸, e.多芳型类腐殖酸, f.富里酸) Fig. 4The variation in the organic matter content in EPS (a. DOC, b. Polysaccharides, c. Tyrosine/Tryptophan protein, d. Tyrosine/Tryptophan, e. Polyaromatic-type Humic acid, f. Fulvic acid) |
实验组(Ⅱ)、(Ⅲ)的EPS组分在浸出的12 d内变化趋势一致.在生物浸出的过程中, 均有蛋白质的产生, 随着S.benefaciens的引入, 实验组(Ⅱ)到(Ⅲ)的蛋白质相关区域的荧光强度逐渐增大.在浸出的第8 d, 各组蛋白质的荧光强度分别达到了峰值, 并在S层的EPS中发现了腐殖质物质(腐殖酸和富里酸), 而在LB和TB层则较少.在浸出的12 d, S-EPS中腐殖质类物质的荧光强度进一步增加, 而B-EPS蛋白质的荧光强度下降.由各实验组三维荧光下的对比可观察到, 在引入了S.benefaciens后, 各类物质的荧光强度在浸出过程中存在差别, 蛋白质和氨基酸的荧光强度不断增强, 同时富里酸的荧光强度也增强, 但腐殖酸的荧光强度并没发生较大变化.
EPS中DOC的变化, 在一定程度上可反映出EPS总量的变化(Zhao et al., 2019).如图 4a所示, 浸出过程中S-EPS中DOC的含量较多, 表明游离微生物通过分泌更多的EPS抵抗低pH和高浓度重金属的恶劣环境(Yu et al., 2017).在浸出的0~12 d, 实验组(Ⅱ)DOC总量呈现了上升趋势, 由4 d内的17.18 mg·L-1上升至12 d的30.31 mg·L-1.这是由于EPS的变化引起, EPS主要来源于代谢产物及代谢产物的降解.在此过程中细胞的死亡、裂解会释放胞内物质, 如脂类蛋白质、多糖、DNA和RNA等, 这可导致DOC浓度的上升.根据Rawlings等研究发现, 浸出过程中DOC主要来源于原生铁或硫氧化自养微生物, 如L.ferriphilum和A.caldus, 并可支持少量异养和混合养等嗜酸菌的生长(Rawlings et al., 2007).但在L.ferriphilum+A.caldus混合菌中引入S.benefaciens后, 实验组(Ⅲ)在浸出的12 d DOC有下降的趋势, 从33.46 mg·L-1下降至27.82 mg·L-1, 这可能是由于S. benefaciens在浸出过程中可降解DOM相关(Nancucheo et al., 2010), 减轻积累的有机物对微生物的影响, 微生物总量(图 1e) 的数据也证实了这一点.
EPS中多糖的浓度变化如图 4b所示, 引入S.benefaciens前, 组(Ⅱ)在浸出过程中(0~12 d), 随着浸出的进行, 多糖浓度不断提升由47.26 mg·L-1上升至107.93 mg·L-1.且在S-EPS中检测到大量的多糖物质, 这是由于游离微生物主要通过分泌多糖去抵抗不利的溶液环境(Yu et al., 2017);引入了S.benefaciens的实验组(Ⅲ), 浸出后期(12 d)的多糖含量显著增加.在浸出的12 d, 多糖含量达到了最高值164.28 mg·L-1.因为多糖物质可以络合Fe3+使细胞携带净正电荷, 并使它附着在带负电荷的的黄铁矿表面(Li et al., 2017), 有利于在EPS与矿物表面之间积累大量的Fe3+, 从而有效地促进Fe3+对矿物的侵蚀, 提高了Zn浸出率.
图 4c、4d是蛋白质以及氨基酸的荧光强度的变化趋势, 在浸出过程中呈现了上升趋势.在浸出的4~8 d, 蛋白质和氨基酸的荧光强度不断增强, 且荧光区域的主要出现在B-EPS中, 这与微生物通过分泌蛋白质以及糖类物质来粘附在矿物表面直接相关.细胞粘附在细胞基质之间, 确保了生物膜的稳定性(Flemming et al., 2010).胞外蛋白能在EPS的生物膜氧化还原过程中起着重要的作用, 但胞外蛋白的分泌一定程度上受pH的影响(Yu et al., 2017), 在浸出的8~12 d, 其荧光强度随着pH的下降而呈现下降趋势.与实验组(Ⅱ)相比, 引入S.benefaciens的实验组(Ⅲ)中, 类蛋白质和类氨基酸的荧光强度在浸出过程有所增强, 有利于促进Zn浸出率的提升.
EPS中腐殖酸类物质变化规律如图 4e所示.腐殖酸通过络合作用影响金属的转移和转化, 可以避免微生物遭受高浓度的离子威胁, 保护微生物(Koukal et al., 2003);也可以和胞外酶形成稳定的复合物, 对蛋白的热变、脱水和水解有极强抵抗力;腐殖酸还可以显著影响微生物与细胞外电子受体之间的电子传递, 成为微生物与矿物之间的通讯媒介(Koukal et al., 2003; Xiao et al., 2019).在浸出过程中(0~12 d), 多环芳烃类腐殖酸类物呈现上升趋势, 且主要分布在S-EPS层中, 其次是B-EPS层, 组(Ⅱ)和组(Ⅲ)间无明显差别.但引入S.benefaciens前后, 富里酸类物质与腐殖酸类物质变化趋势不同, 呈现先降后升的趋势(图 4f).引入S.benefaciens后, 在浸出前期(0~4 d), EPS中富里酸类物质的荧光强度最大, 在S-EPS层中尤其明显.但在浸出的中后期(4~12 d), 呈现了先降后升的变化趋势.而在浸出的4~8 d, 富里酸类物质的荧光区域出现了红移和蓝移现象, 红移与羰基、羟基、烷氧基、氨基和羧基等官能团的存在有关, 而蓝移则与大分子分解成更小的碎片有关(Zhu et al., 2015).浸出过程中, 组(Ⅲ)的荧光强度高于组(Ⅱ), 这可能与形成了富里酸-铁的复合物或者富里酸通过还原作用将铁从矿物表面分离到水相相关(Xie et al., 2017), 这与引入S.benefaciens后浸出液中更高的三价铁离子和总铁浓度相吻合(图 1c、1d).
3.2.2 EPS与浸出性能的相关性分析为进一步确定EPS物质与生物浸出过程之间的关系, 建立了皮尔森相关系数, 如表 2所示.由表可得, EPS物质与生物浸出行为的趋势高度相关.
表 2(Table 2)
| 表 2 EPS中各物质与浸出介质参数的皮尔森相关性分析 Table 2 Correlation analysis between each components in EPS and leaching medium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2 EPS中各物质与浸出介质参数的皮尔森相关性分析 Table 2 Correlation analysis between each components in EPS and leaching medium
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
多糖与pH和[Fe3+]浓度的R值分别为-0.922和0.932, (p < 0.01), 与Zn浸出率、ORP值、[TFe]、生物总量的R值分别为0.889、0.843、0.917和0.864(p < 0.05), 各项相关性系数R的绝对值均高于0.84, 这些结果表明多糖与生物浸出的各项理化参数都具有极强的相关性.蛋白质、DOC与各项理化参数之间也具有显著的相关性.蛋白质、DOC与ORP、生物总量的相关性系数R值分别为0.932、0.945、0.955、0.961, (p < 0.01), 与Zn浸出率、pH以及[Fe3+]的相关性系数R的绝对值均高于0.81(p < 0.05).此外, 与TFe浓度的相关性系数R值分别为0.802和0.791(p < 0.07), 同样具有较强相关性.
氨基酸类物质和腐殖酸类物质与浸出过程中溶液介质的部分参数具有统计学意义上的强相关性.氨基酸类物质与ORP、生物总量的相关性系数R值分别为0.914和0.883(p < 0.05).腐殖酸类物质与[TFe] 相关性系数R值为0.932(p < 0.01), 且与Zn浸出率以及Fe3+浓度成正相关, R值均大于0.89, (p < 0.05).而与pH呈负相关, R=-0.880(p < 0.05).但根据表 2中的结果, 富里酸类物质在浸出过程中的变化与溶液介质参数的变化不具有统计学意义上的显著相关性.
通过EPS物质与生物浸出溶液介质参数的皮尔森相关性分析, 进一步证实了在浸出过程中, 多糖、蛋白质、DOC、氨基酸和腐殖酸类物质的变化在生物浸出的过程发挥着不同的作用.其中, 多糖、蛋白质以及DOC与生物浸出溶液介质参数的相关性最强, 表明EPS中这3种物质可能是影响生物浸出进程的主要因素.
3.2.3 尾矿表面特征变化上述相关性分析的结果表明多糖、蛋白质以及DOC与生物浸出效率具有较强的相关性.为深入探究S.benefaciens引入对L.ferriphilum+A.caldus菌群浸出尾矿的影响机制, 利用FTIR分析尾矿表面官能团在浸出过程的变化, 如图 5所示.FTIR分析表明, 尾矿样品中的420~510 cm-1的吸收峰为黄铁矿, 吸光度频率的变动表示S—S的振动拉伸, 可归根于黄铁矿不断地被氧化(Ye et al., 2017a).670 cm-1处为SO42-的红外吸收峰, 表明S被氧化为硫酸根, 400~600 cm-1处的吸收峰与M—O键相关(M为金属离子)(Liu et al., 2020).1000~1200 cm-1的频率范围代表C—O—C和C—O的振动拉伸, 是碳水化合物(如多糖)的特征峰(Jiang et al., 2012).1620~1680 cm-1为蛋白质的吸收峰(Huang et al., 2019).生物浸出8 d后, 引入了S.benefaciens的实验组(Ⅲ)矿样表面碳水化合物和蛋白质的吸收峰强度高于实验组(Ⅱ), 这与三维荧光的结果一致.此外, 在吸附水的特征吸收峰3000~3400 cm-1上也发现了一些差异, 这可能是由于样品中游离水或结合水的数量不同所致(Chen et al., 2017).上述研究结果表明, S.benefaciens引入前后, 矿物表面的物质组成未发生显著的变化, 但S.benefaciens加入后促使群落分泌更多的蛋白质和多糖, 促进尾矿的浸出进程, 这与三维荧光的结果相符.
图 5(Fig. 5)
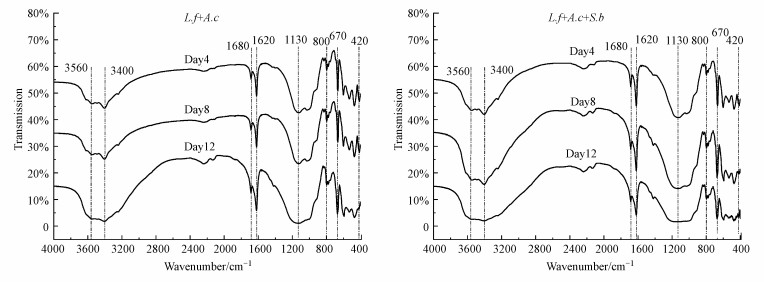 |
| 图 5 不同浸出时间尾矿表面官能团的FTIR谱图 Fig. 5FTIR spectra of tailing surface functional groups at different leaching times |
4 结论(Conclusions)1) 中度嗜热菌群(L.ferriphilum+ A.caldus)浸出铅锌硫化矿尾矿, 浸出7 d内Zn浸出率达到90%.将S.benefaciens加入中度嗜热菌群浸出体系中, 浸出前期和中期(0~8 d)浸出速率一直增高, 4 d内最多可提升13.63%, 浸出5 d后浸出率即到达90%, 12 d内可到达99.55%.
2) S.benefaciens加入L.ferriphilum+A.caldus的浸出体系中, 浸出环境保持更高的氧化还原电位和微生物活性, 促使浸出过程中[Fe3+]、[TFe]、ORP值以及微生物总量提高, 从而有利于浸出效率的提升.
3) 从矿物表面官能团变化、EPS变化可得, 在浸出过程中引入S.benefaciens, EPS组成的物质种类数量没发生改变, 但促使微生物菌群介导产生了更多的蛋白质和多糖, 有助于促进尾矿浸出.相关性分析进一步证实, 多糖、蛋白质以及DOC与浸出过程溶液介质参数的变化具有统计学意义上的强相关性, 是影响生物浸出进程的主要因素.
参考文献
| Behera S K, Panda P P, Singh S, et al. 2011. Study on reaction mechanism of bioleaching of nickel and cobalt from lateritic chromite overburdens[J]. International Biodeterioration & Biodegradation, 65(7): 1035-1042. |
| Bryan C G, Joulian C, Spolaore P, et al. 2011. The efficiency of indigenous and designed consortia in bioleaching stirred tank reactors[J]. Minerals Engineering, 24(11): 1149-1156. DOI:10.1016/j.mineng.2011.03.014 |
| Cai P, Lin D, Peacock C L, et al. 2018. EPS adsorption to goethite: Molecular level adsorption mechanisms using 2D correlation spectroscopy[J]. Chemical Geology, 494: 127-135. DOI:10.1016/j.chemgeo.2018.07.028 |
| Castro C, Urbieta M S, Plaza Cazon J, et al. 2019. Metal biorecovery and bioremediation: Whether or not thermophilic are better than mesophilic microorganisms[J]. Bioresource Technology, 279: 317-326. DOI:10.1016/j.biortech.2019.02.028 |
| Chen W, Westerhoff P, Leenheer J A, et al. 2003. Fluorescence excitation-Emission matrix regional integration to quantify spectra for dissolved organic matter[J]. Environmental Science & Technology, 37(24): 5701-5710. |
| Chen X, Ma H, Luo C. 2017. Recovery of valuable metals from waste cathode materials of spent lithium-ion batteries using mild phosphoric acid[J]. Journal of Hazardous Materials, 326: 77-86. DOI:10.1016/j.jhazmat.2016.12.021 |
| Feng S, Yang H, Wang W. 2016. Insights to the effects of free cells on community structure of attached cells and chalcopyrite bioleaching during different stages[J]. Bioresource Technology, 200: 186-193. DOI:10.1016/j.biortech.2015.09.054 |
| Flemming H C, Wingender J. 2010. The biofilm matrix[J]. Nature Reviews Microbiology, 8(9): 623-633. DOI:10.1038/nrmicro2415 |
| Gan M, Zhou S, Li M, et al. 2015. Bioleaching of multiple heavy metals from contaminated sediment by mesophile consortium[J]. Environment Science Pollution Research, 22(8): 5807-5816. DOI:10.1007/s11356-014-3759-x |
| Gu T, Rastegar S O, Mousavi S M, et al. 2018. Advances in bioleaching for recovery of metals and bioremediation of fuel ash and sewage sludge[J]. Bioresource Technology, 261: 428-440. DOI:10.1016/j.biortech.2018.04.033 |
| Guo L, Lu M, Li Q, et al. 2014. Three-dimensional fluorescence excitation-emission matrix (EEM) spectroscopy with regional integration analysis for assessing waste sludge hydrolysis treated with multi-enzyme and thermophilic bacteria[J]. Bioresource Technology, 171: 22-28. DOI:10.1016/j.biortech.2014.08.025 |
| Han F, Wei D, Ngo H H, et al. 2018. Performance, microbial community and fluorescent characteristic of microbial products in a solid-phase denitrification biofilm reactor for WWTP effluent treatment[J]. Journal of Environmental Management, 227: 375-385. |
| He Z, Yang Y, Zhou S, et al. 2014. Effect of pyrite, elemental sulfur and ferrous ions on EPS production by metal sulfide bioleaching microbes[J]. Transactions of Nonferrous Metals Society of China, 24(4): 1171-1178. DOI:10.1016/S1003-6326(14)63176-9 |
| Huang Z, Feng S, Tong Y, et al. 2019. Enhanced "contact mechanism" for interaction of extracellular polymeric substances with low-grade copper-bearing sulfide ore in bioleaching by moderately thermophilic Acidithiobacillus caldus[J]. Journal Environment Management, 242: 11-21. |
| Jiang K, Guo Z, Xiao X, et al. 2012. Effect of moderately thermophilic bacteria on metal extraction and electrochemical characteristics for zinc smelting slag in bioleaching system[J]. Transactions of Nonferrous Metals Society of China, 22(12): 3120-3125. DOI:10.1016/S1003-6326(11)61580-X |
| Johnson D B, Joulian C, d'Hugues P, et al. 2008. Sulfobacillus benefaciens sp. nov., an acidophilic facultative anaerobic Firmicute isolated from mineral bioleaching operations[J]. Extremophiles, 12(6): 789-798. DOI:10.1007/s00792-008-0184-4 |
| Koukal B, Guéguen C, Pardos M, et al. 2003. Influence of humic substances on the toxic effects of cadmium and zinc to the green alga Pseudokirchneriella subcapitata[J]. Chemosphere, 53(8): 953-961. DOI:10.1016/S0045-6535(03)00720-3 |
| Li Q, Sand W. 2017. Mechanical and chemical studies on EPS from Sulfobacillus thermosulfidooxidans: From planktonic to biofilm cells[J]. Colloids Surf B Biointerfaces, 153: 34-40. DOI:10.1016/j.colsurfb.2017.02.009 |
| Li S, Zhong H, Hu Y, et al. 2014. Bioleaching of a low-grade nickel-copper sulfide by mixture of four thermophiles[J]. Bioresource Technology, 153: 300-306. DOI:10.1016/j.biortech.2013.12.018 |
| Liao X, Sun S, Zhou S, et al. 2019. A new strategy on biomining of low grade base-metal sulfide tailings[J]. Bioresource Technology, 294: 122187. DOI:10.1016/j.biortech.2019.122187 |
| 刘丽君, 刘双江, 姜成英. 2016. 嗜热微生物及在高温生物冶金过程中的应用[J]. 微生物学通报, 43(5): 1101-1112. |
| Liu L, Nie Z, Yang Y, et al. 2018. In situ characterization of change in superficial organic components of thermoacidophilic archaeon Acidianus manzaensis YN-25[J]. Research in Microbiology, 169(10): 590-597. DOI:10.1016/j.resmic.2018.08.003 |
| Liu R, Mao Z, Liu W, et al. 2020. Selective removal of cobalt and copper from Fe (Ⅲ)-enriched high-pressure acid leach residue using the hybrid bioleaching technique[J]. Journal of Hazardous Materials, 384: 121462. DOI:10.1016/j.jhazmat.2019.121462 |
| 龙腾发, 张志勇, 余丽娟. 2009. 泥型废弃铜矿的细菌浸出试验研究[J]. 矿冶工程, 29(2): 63-65+69. DOI:10.3969/j.issn.0253-6099.2009.02.018 |
| Ma L, Wang X, Feng X, et al. 2017. Co-culture microorganisms with different initial proportions reveal the mechanism of chalcopyrite bioleaching coupling with microbial community succession[J]. Bioresource Technology, 223: 121-130. DOI:10.1016/j.biortech.2016.10.056 |
| Mahmoud A, Cézac P, Hoadley A F A, et al. 2017. A review of sulfide minerals microbially assisted leaching in stirred tank reactors[J]. International Biodeterioration & Biodegradation, 119: 118-146. |
| Mendez Garcia C, Pelaez A I, Mesa V, et al. 2015. Microbial diversity and metabolic networks in acid mine drainage habitats[J]. Front Microbiology, 6: 475. |
| Nancucheo I, Johnson D B. 2010. Production of glycolic acid by chemolithotrophic iron- and sulfur-oxidizing bacteria and its role in delineating and sustaining acidophilic sulfide mineral-oxidizing consortia[J]. Applied Environmental Microbiology, 76(2): 461-467. DOI:10.1128/AEM.01832-09 |
| Panda S, Akcil A, Pradhan N, et al. 2015. Current scenario of chalcopyrite bioleaching: a review on the recent advances to its heap-leach technology[J]. Bioresource Technology, 196: 694-706. DOI:10.1016/j.biortech.2015.08.064 |
| Priya A, Hait S. 2018. Extraction of metals from high grade waste printed circuit board by conventional and hybrid bioleaching using Acidithiobacillus ferrooxidans[J]. Hydrometallurgy, 177: 132-139. DOI:10.1016/j.hydromet.2018.03.005 |
| Rawlings D E, Johnson D B. 2007. The microbiology of biomining: development and optimization of mineral-oxidizing microbial consortia[J]. Microbiology (Reading), 153(Pt 2): 315-324. |
| Sajjad W, Zheng G, Din G, et al. 2019. Metals extraction from sulfide ores with microorganisms: The bioleaching technology and recent developments[J]. Transactions of the Indian Institute of Metals, 72(3): 559-579. DOI:10.1007/s12666-018-1516-4 |
| 石丽娟. 2014. 基于pH刺激的浸矿微生物群落结构及种群动态研究[D]. 长沙: 中南大学 |
| Spolaore P, Joulian C, Gouin J, et al. 2011. Relationship between bioleaching performance, bacterial community structure and mineralogy in the bioleaching of a copper concentrate in stirred-tank reactors[J]. Applied Microbiology Biotechnology, 89(2): 441-448. DOI:10.1007/s00253-010-2888-5 |
| Srichandan H, Mohapatra R K, Parhi P K, et al. 2019. Bioleaching approach for extraction of metal values from secondary solid wastes: A critical review[J]. Hydrometallurgy: 189. |
| Sun H, Chen M, Zou L, et al. 2015. Study of the kinetics of pyrite oxidation under controlled redox potential[J]. Hydrometallurgy, 155: 13-19. DOI:10.1016/j.hydromet.2015.04.003 |
| Wang J, Tian B, Bao Y, et al. 2018. Functional exploration of extracellular polymeric substances (EPS) in the bioleaching of obsolete electric vehicle LiNixCoyMn1-x-yO2 Li-ion batteries[J]. Journal of Hazardous Materials, 354: 250-257. DOI:10.1016/j.jhazmat.2018.05.009 |
| Wang L, Yin S, Wu A, et al. 2020. Synergetic bioleaching of copper sulfides using mixed microorganisms and its community structure succession[J]. Journal of Cleaner Production, 245: 118689. DOI:10.1016/j.jclepro.2019.118689 |
| Wang Z P, Zhang T. 2010. Characterization of soluble microbial products (SMP) under stressful conditions[J]. Water Research, 44(18): 5499-509. DOI:10.1016/j.watres.2010.06.067 |
| Wei D, Yan T, Zhang K, et al. 2017. Qualitative and quantitative analysis of extracellular polymeric substances in partial nitrification and full nitrification reactors[J]. Bioresource Technology, 240: 171-176. DOI:10.1016/j.biortech.2017.02.115 |
| Xia J, Song J, Liu H, et al. 2018. Study on catalytic mechanism of silver ions in bioleaching of chalcopyrite by SR-XRD and XANES[J]. Hydrometallurgy, 180: 26-35. DOI:10.1016/j.hydromet.2018.07.008 |
| Xiao N, Chen Y, Zhou W. 2019. Effect of humic acid on photofermentative hydrogen production of volatile fatty acids derived from wastewater fermentation[J]. Renewable Energy, 131: 356-363. DOI:10.1016/j.renene.2018.07.025 |
| Xie Y, Lu G, Ye H, et al. 2017. Fulvic acid induced the liberation of chromium from CrO42--substituted schwertmannite[J]. Chemical Geology, 475: 52-61. DOI:10.1016/j.chemgeo.2017.10.031 |
| Xu H, Cai H, Yu G, et al. 2013. Insights into extracellular polymeric substances of cyanobacterium Microcystis aeruginosa using fractionation procedure and parallel factor analysis[J]. Water Research, 47(6): 2005-2014. DOI:10.1016/j.watres.2013.01.019 |
| 叶茂友, 严苹方, 孙水裕, 等. 2016. 氧化亚铁硫杆菌生物浸出铅锌硫化矿尾矿及浸出过程中重金属形态分析研究[J]. 环境科学学报, 36(11): 4102-4111. |
| 叶茂友. 2017. 铅锌硫化尾矿中金属的生物浸出行为及浸出机理的研究[D]. 广州: 广东工业大学 |
| Ye M, Li G, Yan P, et al. 2017. Removal of metals from lead-zinc mine tailings using bioleaching and followed by sulfide precipitation[J]. Chemosphere, 185: 1189-1196. DOI:10.1016/j.chemosphere.2017.07.124 |
| Yu Z, Yu R, Liu A, et al. 2017. Effect of pH values on extracellular protein and polysaccharide secretions of Acidithiobacillus ferrooxidans during chalcopyrite bioleaching[J]. Transactions of Nonferrous Metals Society of China, 27(2): 406-412. DOI:10.1016/S1003-6326(17)60046-3 |
| Zhang S, Liang J, Huang J, et al. 2019. Analysis of the relationship of extracellular polymeric substances to the dewaterability and rheological properties of sludge treated by acidification and anaerobic mesophilic digestion[J]. Journal of Hazardous Materials, 369: 31-39. DOI:10.1016/j.jhazmat.2019.02.012 |
| Zhao H, Wang J, Yang C, et al. 2015. Effect of redox potential on bioleaching of chalcopyrite by moderately thermophilic bacteria: An emphasis on solution compositions[J]. Hydrometallurgy, 151: 141-150. DOI:10.1016/j.hydromet.2014.11.009 |
| Zhao J, Liu S, Liu N, et al. 2019. Accelerated productions and physicochemical characterizations of different extracellular polymeric substances from Chlorella vulgaris with nano-ZnO[J]. Science of the Total Environment, 658: 582-589. DOI:10.1016/j.scitotenv.2018.12.019 |
| Zhu L, Zhou J, Lv M, et al. 2015. Specific component comparison of extracellular polymeric substances (EPS) in flocs and granular sludge using EEM and SDS-PAGE[J]. Chemosphere, 121: 26-32. DOI:10.1016/j.chemosphere.2014.10.053 |
| 曾伟民, 邱冠周. 2010. 硫化铜矿生物堆浸研究进展[J]. 金属矿山, (8): 102-107+111. |
| 周洪波, 谢英剑, 张汝兵, 等. 2010. 中度嗜热混合菌在搅拌槽中浸出黄铜矿及其群落动态[J]. 中南大学学报(自然科学版), 41(1): 15-20. |
