 , 张尔翼, 杨祖洁, 余林鹏
, 张尔翼, 杨祖洁, 余林鹏
 , 周顺桂
, 周顺桂福建农林大学资源与环境学院, 福州 350002
收稿日期: 2020-12-30; 修回日期: 2021-02-20; 录用日期: 2021-02-20
基金项目: 国家自然科学基金(No.42077284,41701270);福建省自然科学基金(No.2019J01394);福建农林大学****科研人才计划项目(No.xjq201906)
作者简介: 何丹(1994-), 女, E-mail: hedan1354189433@163.com
通讯作者(责任作者): 余林鹏(1985—), 男, 博士, 讲师, 福建农林大学硕士生导师.研究领域为厌氧甲烷氧化、微生物燃料电池. E-mail: yulinpeng@fafu.edu.cn
摘要:考察了阳极电极材料、电极面积、电极电位、pH、阴极电子受体对甲烷生物燃料电池(MFC)产电性能的影响,并通过高通量测序、循环伏安法(CV)分析了其可能的电催化机制.结果表明,透气布/碳布(GTC)复合材料为阳极时产电性能(1251.3 mA·m-2)最佳,分别是石墨烯/中空纤维膜(G-HFM)阳极(34.8 mA·m-2)和碳布(CC)阳极(3.21 mA·m-2)的36倍和390倍;阳极面积越大,MFC启动时间越快,电流密度越大;当电极恒电位为0.1 V (vs.SHE)时,其产电能力较-0.1、+0.3及+0.5 V时高;pH=7最有利于产电;溶解氧为MFC阴极电子受体时,最大功2率密度(703.9 mW·m-2)优于铁氰化钾(457.2 mW·m-2)、空气阴极(124.2 mW·m-2)和高锰酸钾(20.7 mW·m-2)作为电子受体的MFC.阳极室微生物群落结构分析显示,电活性细菌Geobacter(17.14%)和Desulfovibrio(8.51%)为优势种,其产电机理可能是甲烷氧化菌(Methanobacterium、Methylomicrobium等)与电活性细菌协同氧化甲烷驱动MFC产电.添加NO气体、N-乙酰蛋氨酸和蛋白酶K均可明显抑制阳极生物膜的电化学活性,表明其胞外电子传递过程依赖细胞色素c、Ni-Fe氢酶及与电极接触的外膜蛋白的介导作用.
关键词:微生物燃料电池甲烷厌氧氧化产电能力电化学活性高通量测序
Research on the influencing factors and mechanisms of electricity generation of methane-driven microbial fuel cell
HE Dan
 , ZHANG Eryi, YANG Zujie, YU Linpeng
, ZHANG Eryi, YANG Zujie, YU Linpeng
 , ZHOU Shungui
, ZHOU ShunguiCollege of Resources and Environment, Fujian Agriculture and Forestry University, Fuzhou 350002
Received 30 December 2020; received in revised from 20 February 2021; accepted 20 February 2021
Abstract: The effects of anode material, electrode area, electrode potential, pH and cathode electron acceptor on the electricity generation of methane-driven microbial fuel cell (MFC) were investigated in this paper, and cyclic voltammetry (CV) and high-throughput sequencing were performed to reveal the possible electrocatalytic mechanisms. The results showed that the gas diffusion cloth/carbon cloth (GTC) composite anode showed the best performance (1251.3 mA·m-2), which was 36 times and 390 times higher than that of graphene/hollow fiber membrane (G-HFM) anode (34.8 mA·m-2) and carbon cloth (CC) anode (3.21 mA·m-2), respectively. The larger the anode area, the higher the current density generated and the faster the reactor started up. When the electrode potential was poised at 0.1 V (vs. SHE), the power generation was the highest than those with potentials poised at -0.1 V, +0.3 V and +0.5 V. The most favorable pH for power generation was 7. When dissolved oxygen was served as the electron acceptor, the maximum power density (703.9 mW·m-2) was much higher than those with potassium ferricyanide (457.2 mW·m-2), air cathode (124.2 mW·m-2) and potassium permanganate (20.7 mW·m-2) as electron acceptors. The microbial community structure in anode chamber was dominated by Geobacter (17.14%) and Desulfovibrio (8.51%). Thus, the mechanism of electricity generation in MFC was speculated to be the synergistic cooperation between methanotrophs (Methanobacium, Methylomicrobium) and electroactive bacteria. The addition of NO gas, N-acetylmethionine and proteinase K could significantly inhibit the electrochemical activity of the anodic biofilm, indicating that the extracellular electron transfer process was mainly mediated by cytochrome c, Ni-Fe hydrogenase and outer membrane proteins contacted with anode.
Keywords: microbial fuel cellanaerobic methane oxidationelectrogenesiselectrochemical activityhigh throughput sequencing
1 引言(Introduction)甲烷作为大气中最丰富的碳氢化合物, 是温室气体的重要成员之一, 由各种沉积物有机质的生物降解产生(Reeburgh et al., 2007).厌氧甲烷氧化(Anaerobic Oxidation of Methane, AOM)作为厌氧环境中去除甲烷的主要途径, 对全球碳循环起着重要的作用.微生物燃料电池(Microbial Fuel Cell, MFC)是一种典型的生物电化学系统(Bioelectrochemical System, BES), 能够通过微生物代谢的电化学反应将化学能转化为电能(Bullen et al., 2006).在MFC研究中, 大都是以有机化合物为底物(Pant et al., 2010; Sun et al., 2015), 而甲烷作为一种高能量密度化合物, 在产甲烷菌或产甲烷营养体催化下, 也被认为是一种潜在的MFC底物(Ren et al., 2017; McAnulty et al., 2017).AOM与MFC的结合不仅能发电, 而且可以减少甲烷温室气体排放, 具有重要的能源与环境意义, 因而近年来倍受关注(Rabaey et al., 2005).最近的研究报道指出, 基于甲烷氧化的一种新型MFC可以成功启动并运行, 其最大功率密度为62 mW·m-2(Chen et al., 2018).McAnulty等(2017)构建了以碳毡为阳极、石墨板为阴极的MFC, 并用甲烷八叠球菌(Methanosarcina acetivorans)来逆转甲烷生成途径, 将甲烷转化为乙酸盐, 其最大功率达到168 mW·m-2(McAnulty et al., 2017). Gallaher等(2017)构建的以铁氰化钾为阴极液、甲烷为底物的微生物燃料电池可以产生7 W·m-3的功率密度.此外, 甲烷氧化菌可氧化甲烷生成甲醇, 其微生物燃料电池的输出功率可以达到426.17 mW·m-2(Jaewook et al., 2018).以上这些研究集中于分析不同甲烷氧化菌的MFC功率和产电机制, 但关于甲烷驱动的MFC输出功率大小受何种因素影响, 以及如何提高其产电能力的研究相对较少.
因此, 本研究针对MFC产电性能的影响因素如电极材料、电子受体、pH等进行分析, 优化MFC运行条件并提高其产电性能, 以期为甲烷型微生物燃料电池的发展提供理论依据和技术参考.
2 材料与方法(Materials and methods)2.1 培养基与接种物接种物采集于福州污水处理厂厌氧活性污泥, 经MFC富集、驯化、再富集获得高AOM活性的菌群(Yu et al., 2019).采用无机培养基作阳极液(pH=7.0±0.2), 成分见文献(Ettwig et al., 2009; Yu et al., 2019).
2.2 BES构建及运行为解决甲烷溶解度和传质系数较低的问题, 制备了两种气体扩散阳极:石墨烯/中空纤维膜(G-HFM)复合电极和Gore-Tex透气布/碳布(GTC)复合电极.中空纤维膜(HFM)为提高甲烷传质速率提供了一种安全有效的方法, 但其不具有导电性, 故在其表面涂上导电的石墨烯层用作阳极(陈洁等, 2016);类似地, 透气布/碳布(GTC)复合材料中的非导电透气布微孔可以高效分散并传输甲烷至外表面的碳布而被用作阳极;碳布(CC)电极是一种常用于微生物燃料电池的电极材料, 故将其产电能力作为对照.实验装置结构如图 1所示, GTC电极(3 cm×5 cm)、CC电极(3 cm×5 cm)或G-HFM电极作为阳极材料, 饱和甘汞电极为参比电极, 石墨板(2 cm×3 cm×1.5 mm)为阴极.将阳极材料包裹于多孔的塑料圆管(直径1.5 cm, 高5 cm)表面, 阳极表面缠绕钛丝作为导线;塑料圆管一端密封, 另一端连接通入甲烷的导气管;导气管外连接装有50 mL甲烷(纯度99%)的注射器.阳极室加入90 mL无机培养基, 阴极室加入110 mL磷酸盐缓冲液(PBS, 0.1 mol·L-1, pH=7.0), 分别用CO2/N2混合气(体积比20/80)曝气60 min除氧.然后向阳极室加入20 mL AOM富集培养物, 继续曝气30 min后用橡胶塞密封, 置于37 ℃恒温箱培养.
图 1(Fig. 1)
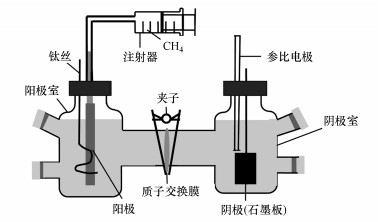 |
| 图 1 BES装置结构图 Fig. 1The structure of BES reactor |
GTC复合电极制备方法:将剪好的Gore-Tex透气布和碳布放入无水乙醇中浸泡2 h, 去除可能存在的有机物, 然后用去离子水冲洗干净, 烘干, 去除无水乙醇;烘干后将碳布和透气布紧密贴合在一起, 紧密缠绕在塑料圆管表面, 最后用棉线将碳布和外侧钛丝固定.制备CC电极时除仅用碳布外, 其他步骤同GTC电极.制备G-HFM复合阳极时, 将中空纤维膜丝(Polyvinylidene Fluoride, PVDF)(长约1 m, 外直径2.2 mm, 内直径1.2 mm, 微孔平均孔径0.1 μm)缠绕到塑料圆管表面, 然后每cm2电极制备5 mg石墨烯、100 μL nafion溶液和100 μL无水乙醇的混合物, 充分搅拌后, 均匀涂抹在中空纤维膜表面, 自然风干24 h.
空气阴极制作步骤如下:将碳布的一面均匀涂抹催化剂, 自然干燥, 然后与质子交换膜重叠压实.每cm2电极表面催化剂负载量如下(史昕欣, 2013):0.2 mg Pt/C催化剂与0.6 mg炭黑粉末均匀混合, 然后加入0.664 μL去离子水、5.336 μL nafion溶液、2.664 μL异丙醇.当溶解氧作为电子受体时, 采用相同方法修饰石墨板阴极表面.
2.3 实验处理设计阳极材料、电势、阳极面积、阳极液pH和阴极电子受体5个因素试验设计3~5个处理, 每个处理组设3个重复.研究不同阳极材料(即碳布(CC)、中空纤维膜(G-HFM)、透气布-碳布(GTC))和阳极面积(10、15、20 cm2)时, 将阳极电势恒定为+0.3 V (vs. SHE);进行不同阳极电势实验时, 分别对GTC阳极(面积15 cm2)施加-0.1、0.1、0.3、0.5 V (vs. SHE)的电势.上述3个因素实验的阴极液均为0.1 mol·L-1氯化钾的PBS溶液(0.1 mol·L-1, pH=7.0).研究因素为阳极液pH时, 采用GTC电极(面积15 cm2)作为阳极, 阳极和阴极之间连接1000 Ω电阻, 用NaOH和HCl调阳极液pH并以N2曝气, 阴极液为20 mmol·L-1铁氰化钾的PBS缓冲液.在进行4种不同阴极电子受体(即KMnO4、溶解氧(DO)、K3[Fe(CN)6]、空气(O2))实验时, 阳极液pH为7.0, GTC电极(面积15 cm2)作为阳极, 阳极和阴极间连接1000 Ω的电阻;阴极液(即PBS缓冲液)分别加入20 mmol·L-1铁氰化钾、5 mmol·L-1高锰酸钾(调pH=2)(Finkelstein et al., 2006);溶解氧作电子受体时, 采用气泵持续曝气提供溶解氧;空气阴极MFC则不加阴极液.
2.4 电化学分析方法MFC为恒电势条件运行时, 利用多通道电化学工作站(CHI1000C)对反应器阳极施加恒定的电势, 并连续监测产电电流变化.当阳极与阴极接入1000 Ω电阻时, 采用数据采集器(Keithley 2700)监测MFC电压输出(张茗迪等, 2019).在MFC电压输出最大时测定MFC极化曲线和功率密度曲线, 依次改变外电阻为50、100、150、200、300、400、600、800、1000、1500、2000、4000、6000、8000、10000 Ω, 采用万用表测定阳极电势和阴极电势, 获得功率密度图和极化曲线.
采用循环伏安法测定MFC电化学活性.以阳极为工作电极, 阴极为辅助电极, 饱和甘汞电极为参比电极, 将MFC与电化学工作站(CHI660E)相连, CV扫描参数设置如下:初始电势为0.6 V(vs. SHE), 终止电势为0.6 V(vs. SHE), 扫描速率为0.005 V·s-1, 扫描范围为-0.8~0.6 V(vs. SHE).进行非生物电极CV实验时, 取10 mL阳极室的上清液, 经0.22 μm滤头过滤, N2曝气除氧10 min, 以玻碳电极为工作电极, 铂片电极为辅助电极, 饱和甘汞电极为参比电极进行CV测定, 具体参数设置同上.添加抑制剂的CV实验中, 首先将GTC生物膜电极放入新配制的无氧阳极液进行CV扫描, 再分别用NO气体、N-乙酰蛋氨酸和蛋白酶K处理生物膜:①在新配制的无氧阳极液中用NO气体低速曝气处理1 h, 扫描CV;②将生物膜浸泡于100 mmol·L-1 N-乙酰蛋氨酸的新鲜无氧阳极液中, 静置处理1 h后扫CV;③浸泡于5.0 U·mL-1蛋白酶k的新鲜无氧阳极液处理1 h后, 扫CV, 参数同上.
进行原位电化学红外光谱(Electrochemical in situ Infrared Spectroscopy)实验时, 将MFC中AOM菌离心去除上清液, 向沉淀加少量无氧PBS, 搅拌混合均匀, 涂覆到玻璃碳电极上(直径为5 mm), 形成一个薄的生物膜, 在无氧的PBS中扫描, 扫描电位分别为-700、-500、-300、-100、100、300 mV (vs. SHE).扫描电化学显微镜(Scanning Electrochemical Microscopy, SECM)样品制备及测定方法如下:将MFC中AOM菌离心, 菌沉淀均匀涂覆到粘有导电双面胶的石墨板电极表面, 自然干燥后, 添加无氧的25 mmol·L-1铁氰化钾的0.1 mol·L-1氯化钾溶液, 基底石墨板电极恒定电位为-0.5 V (vs. SHE), 探针电位为0.4 V (vs. SHE), 扫数为20 μm·s-1.
2.5 扫描电子显微镜与微生物群落结构分析扫描电子显微镜(Scanning Electron Microscopy, SEM)用来表征GTC阳极外表面生物膜的形貌特征.剪取1 cm×1 cm大小的阳极碳布, 浸泡在4%戊二醇溶液中, 固定12 h;用磷酸盐缓冲液(PBS, 0.1 mol·L-1, pH=7.0)清洗碳布, 去除残留的戊二醇;依次浸泡于30%、40%、50%、60%、70%、80%、90%、100%(V/V)的乙醇中, 脱水15 min;烘干, 喷金, 设置电压20 kV, 放置于电镜上进行观察.采用高通量测序来分析阳极微生物菌种组成, 方法为:MFC运行(30 d)结束后, 按照FastDNA Spin Kit for Soil (Mpbio, USA)试剂盒按照说明书操作步骤对阳极室内微生物进行DNA提取.以提取的DNA为模板进行PCR扩增, 以341b4_F(5′-CTAYGGRRBGCWG CAG-3′)和806_R(5′-GGACTACNNGGGTATCTAAT-3′)(Lu et al., 2015)作为细菌和古菌的16S rRNA基因的扩增引物, 实验体系为:上、下引物各0.5 μL, 2×mix酶10 μL, DNA模板2 μL, 无菌水7 μL, 共20 μL.PCR程序为:95 ℃预变性3 min;95 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸45 s, 35次循环;最终72 ℃延伸10 min.最后对PCR产物进行纯化, 样品在Illumina MiSeq平台上进行测序(上海马吉尔生物科技有限公司, 中国).
3 结果与讨论(Results and discussion)3.1 阳极材料、面积、电极电势对BES产电性能的影响如图 2a所示, GTC复合电极反应器最大电流密度(1251.3 mA·m-2)是G-HFM复合电极(34.8 mA·m-2)的36倍, 而CC电极没有检测到明显的生物电流, 产电效率悬殊.G-HFM复合电极的电流只有GTC电极的1/36, 这是因为甲烷驱动的BES首先要解决甲烷的供给问题, GTC复合电极能较好地将甲烷气体传送到电极表面与微生物保持互相接触, 甲烷在AOM菌群作用下被氧化, 而后电子等被传送到阳极完成氧化还原反应, 产生电能.由图 2b可知, 不同面积GTC阳极的BES反应器均能产电.实验条件下最大电流密度呈现随阳极面积增加而增大的趋势, 即电流密度与面积大小成正相关, 而启动时间、到达最大电流密度的时间均与阳极面积大小成负相关(表 1).增加阳极表面积可增加具有催化作用的阳极表面AOM菌群生物膜, 即提高微生物在阳极的反应速率, 从而影响电池的运行, 表现为提高MFC的电流.
图 2(Fig. 2)
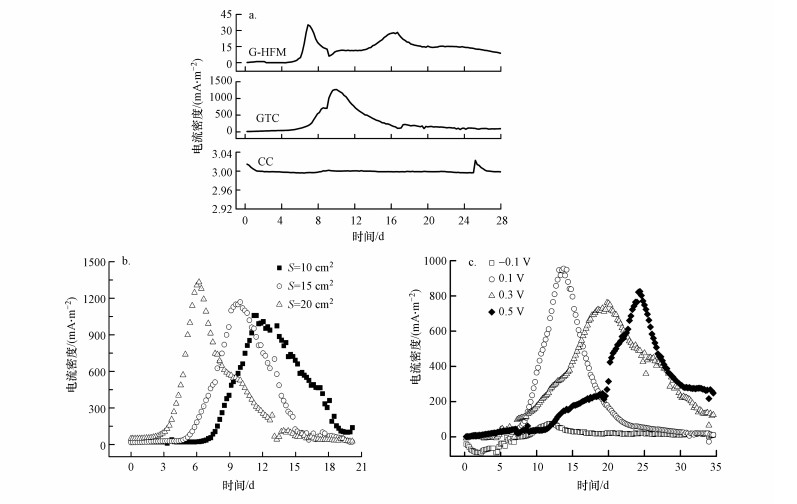 |
| 图 2 不同阳极材料(a)、阳极面积(b)和阳极电势(c) 条件下MFC的产电性能 Fig. 2MFC electricity generation performance at different anodic material(a), anodic area(b) and anodic potential(c) |
表 1(Table 1)
| 表 1 阳极材料、表面积和阳极电势对MFC产电的影响 Table 1 Effects of anode materials, surface area and anode potential on MFC power generation | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 阳极材料、表面积和阳极电势对MFC产电的影响 Table 1 Effects of anode materials, surface area and anode potential on MFC power generation
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
除施加电势为-0.1 V的反应器外, +0.1、+0.3和+0.5 V电位的BES都能产生较大的生物电流(图 2c), 其中, +0.1 V反应器的最大电流密度最高, 但其产电持续能力弱于其他两种高电势反应器.研究表明, 微生物可感应电极电势而采用不同的电子传递途径, 同时电极电势影响着微生物的群落组成结构(Dennis et al., 2016; Hirose et al., 2018).较负的电势不利于一些菌株的能量存储和胞外电子输出, 而较正的电势可引起微生物外膜蛋白的氧化损伤(Aelterman et al., 2008).因此, 反应器施加较低的正电势有助于微生物在电极上的富集和成膜过程(Aelterman et al., 2008).这可能是+0.1 V电势反应器最快达到最大电流的原因.
3.2 pH和电子受体对甲烷生物燃料电池产电性能的影响如图 3a所示, 不同pH条件下BES反应器均能够成功产电, 但电压输出性能差异较大, 其中, pH=7时电压输出的最大值明显高于其他pH条件, 且启动时间短, 输出时间最长.微生物代谢活性受pH的影响, 从而影响胞外电子的产量和传递速率;同时, 氢离子在质子交换膜的阻隔下传递效率也随着pH而变化, 导致电池内阻的改变.本实验BES的产电机制主要依赖AOM古菌和产电菌的协同作用, 分别负责甲烷氧化和胞外电子的传递过程(Yu et al., 2019), 两者所需的阳极液pH可能不同.古菌一般在中性pH条件下活性最高, 而产电菌可能在弱碱性时产电能力最强(郑宇等, 2010;陈桂顶等, 2015).如Gil等(2003)研究发现, 阳极液pH为7.0~8.0时有利于BES产电, 这与本研究AOM菌群在pH=7时产电能力最强一致.
图 3(Fig. 3)
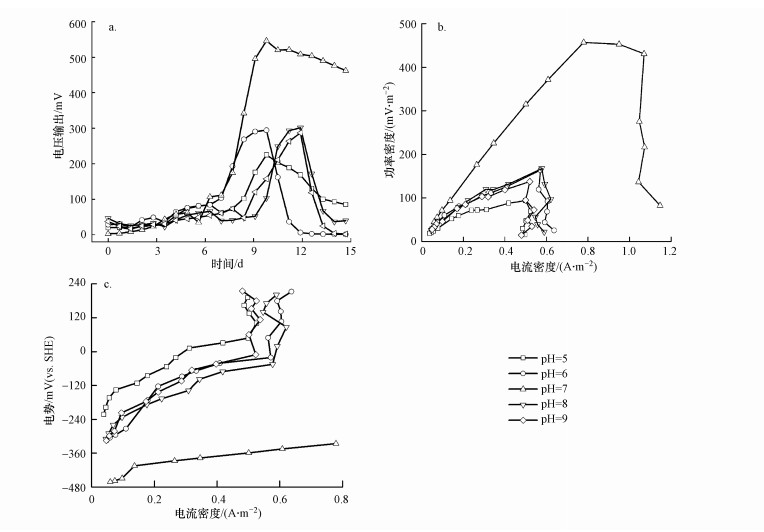 |
| 图 3 不同pH下MFC的输出电压(a)、功率密度曲线(b)和阳极极化曲线(c) Fig. 3MFC output voltage (a), power density curve (b) and anodic polarization curve (c) at different pH values |
功率密度测定结果如图 3b所示, pH=7的反应器最大功率密度分别是pH=5和pH=9的反应器的4.9倍和3.3倍.这说明阳极液的pH影响了AOM菌群的活性, 最终导致了不同MFC的产电性能.根据欧姆定律和最大功率密度可知, pH=5~9的电池内阻相近, 分别约为300、400、600、400、400 Ω.pH=7时阳极极化引起的电势损失最小(图 3c), 其极化程度与功率密度曲线和产电输出相对应.这证明pH对微生物生长代谢速率的影响要远大于对电池内阻的影响.因此, pH=7最有利于该AOM菌群的产电过程.
阴极为不同电子受体各处理组电压输出情况如图 4a所示, 空气阴极MFC的电压输出明显低于溶解氧MFC, 可能是因为质子或氧气的传质效率受到空气阴极结构的制约, 这也证明阴极反应类型和相应的还原速率对电池产电具有较大的影响.从产电量来看, 4种电子受体MFC的产电量依次是溶解氧(616.0 C)>铁氰化钾(534.5 C)>空气阴极(274.1 C)>高锰酸钾(69.5 C).同时, 溶解氧MFC的启动时间(输出电压≥50 mV)约为4.8 d, 明显快于铁氰化钾MFC(约9.6 d)和空气阴极MFC(约8.7 d).在MFC运行过程中, 高浓度高锰酸钾会对质子交换膜产生氧化破坏, 引起高锰酸钾向阳极室的渗透, 对阳极室微生物产生氧化胁迫, 因而其产电性能不强.此外, 溶解氧MFC高电压输出(≥200 mV)的持续时间最长(约13.2 d), 其次是铁氰化钾(11.1 d), 而空气阴极MFC仅持续了约7.3 d.因此, 通过曝气供给的溶解氧是甲烷BES的最佳电子受体.
图 4(Fig. 4)
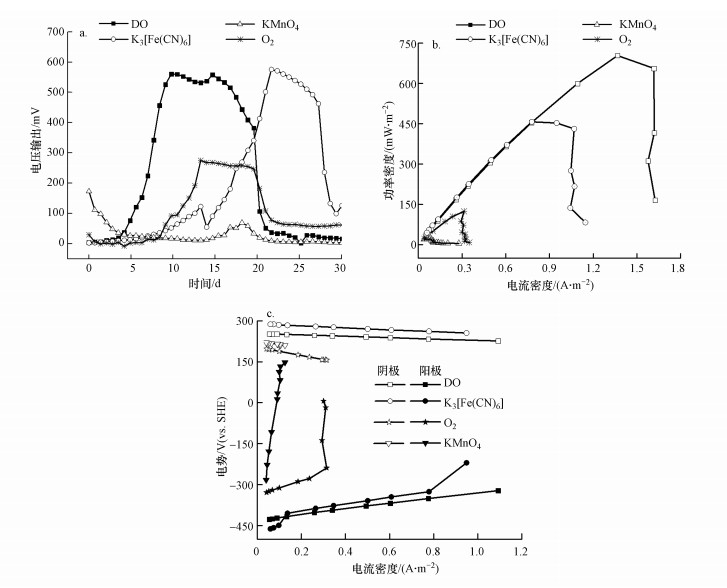 |
| 图 4 不同电子受体MFC电压输出(a)、功率密度曲线(b)和极化曲线(c) Fig. 4Voltage output (a), power density curve (b) and polarization curve (c) for different electron acceptor MFCs |
不同阴极电子受体MFC的功率密度曲线如图 4b所示, 溶解氧MFC的最大功率密度最大(703.9 mW·m-2), 比铁氰化钾MFC(457.2 mW·m-2)高0.5倍, 高锰酸钾MFC的最大功率密度最小(20.7 mW·m-2).极化曲线分析显示, 不同电子受体MFC的阴极极化和阳极极化均有明显差异(图 4c), 证明电子受体的不同对阳极微生物的电化学反应产生了较大影响.在较低的电流密度下, 高锰酸钾MFC的阳极电势迅速上升, 表明电化学极化引起了明显的活化电势损失.在较高的电流密度时, 过电势损失由浓差极化产生.与溶解氧MFC相比, 空气阴极MFC和铁氰化钾MFC在高电流密度时阳极极化程度高, 表明高电流时的传质过程是其产电的制约因素.此外, MFC内阻是影响产电功率的主要原因之一, 降低电池内阻有利于提高电池的产电能力.内阻分析表明, 溶解氧、铁氰化钾、空气阴极、高锰酸钾MFC的内阻依次增加, 分别约为300、600、1000、2000 Ω.持续不断地向阴极液曝气增大电子受体浓度(即溶解氧DO), 可加快阴极传质过程, 从而降低溶解氧MFC内阻.较快的传质和较低的内阻导致溶解氧MFC相对于其他电子受体MFC表现出最好的产电效果.
3.3 功能微生物群落结构及其电催化机制为了探究阳极室微生物的产电机制, 采用扫描电子显微镜分析了0.3 V恒电位条件下的GTC阳极生物膜的生长情况及形貌特征.如图 5a所示, 可清晰观察到大量的杆状和球状的微生物附着于碳布表面, 生长情况良好.在缺少电子穿梭体的MFC内, 微生物为了将甲烷氧化呼吸代谢产生的电子传递至胞外环境(即阳极), 会自发在阳极碳布上进行生长和成膜, 最终阳极表面形成了一层较好致密的生物膜.阳极室内的微生物在电子传递过程中获取生长所需的能量, 电子传递数量越多, 获得的能量越多, 生长越快, 从而维持以甲烷或AOM中间产物为底物的呼吸或合成代谢等生命活动.因此, 生物膜的形成为微生物胞外电子直接传递到电极提供了可能性.
图 5(Fig. 5)
 |
| 图 5 电极生物膜扫描电子显微镜图(a)和阳极室微生物群落结构 (属水平微生物相对丰度≥1%)(b) Fig. 5Scanning electron microscopy image of the electrode biofilm(a) and the structure of microbial community in anodes chamber (Relative abundance higher than 1% at the genus level)(b) |
高通量测序结果表明(图 5b), 阳极室中的微生物群落以Geobacter(17.14%)、Desulfovibrio(8.51%)、unclassified Bacteroridales(4.62%)、Pseudobacteroides(4.11%)、Thiomonas(3.76%)、Ignavibacterium(3.61%)等细菌为主, 含有少量的古菌(2.81%), 包括产甲烷古菌Methanobacterium(2.56%)和Methanosarcina(0.03%)等.此外也检测出了微量的I型和II型好氧甲烷氧化细菌, 如Methylomicrobium(0.58%)、Methylocystis(0.21%)、Methylomonas(0.16%), 表明这些微生物可能参与了AOM产电过程.Geobacter是典型的电活性细菌, 能够提供电子和转移电子给电极而产电.尽管本实验中Geobacter的丰度比Methanobacterium高约15%, 是阳极室微生物的优势种群, 但Geobacter似乎不能直接代谢甲烷, 因此, 不能氧化甲烷而单独产电.先前的研究表明, Methanobacterium是一种具有AOM活性的微生物, 其AOM中间产物主要为氨基酸(Zehnder et al., 1979; Moran et al., 2014).更重要的是, Methanobacterium可从固体电极上吸收电子进行电产甲烷(Cheng et al., 2009; Siegert et al., 2015).这表明Methanobacterium具有电活性, 能够进行胞外电子传递(Yan et al., 2018).因此, Methanobacterium可能参与了甲烷氧化伴随电子的生成及传递到阳极的过程.然而, Methanobacterium缺乏细胞色素c(Gao et al., 2017), 细胞外膜细胞色素c被认为在直接电子传递中起重要作用.故Methanobacterium的胞外电子传递能力可能较弱, 需要电活性细菌(如Geobacter)的合作实现高效产电.Gao等(2017)的研究也证实生物电化学系统中, Methanobacterium与Geobacter通过AOM中间产物(如氢气和甲酸)协同生长, 这与本研究结果相吻合.Desulfovibrio作为一种MFC中常见的硫酸盐还原菌, 其丰度仅次于Geobacter.一些硫酸盐还原菌具有电活性, 可以有效利用乳酸作为底物来发电(Kang et al., 2014).类似地, Gao等(2014)指出硫酸盐还原菌Desulfovibrio有助于MFC的发电和稳定性, 这可能是其丰度较高的原因.
采用CV测定了300 mV恒电势培养获得的阳极生物膜的电化学活性(即电催化活性).生物膜阳极的CV曲线检测出2个氧化峰(-0.01 V和0.26 V)和2个还原峰(-0.41 V、-0.05 V)(图 6a), 最大催化氧化电流达771.2 mA·m-2.而非生物电极则没有明显的氧化峰, 仅在-0.03 V处有一还原峰.这暗示阳极生物膜至少具有2种不同的电子传递组分, 并且在电池中没有分泌明显的电子穿梭体.一般来说, CV曲线的氧化/还原峰越高, 电化学活性越强, 这表明相对于非生物电极, 生物膜阳极具有较好的电催化能力.这些结果为阳极室微生物催化AOM产电提供了进一步的证据.
图 6(Fig. 6)
 |
| 图 6 阳极微生物的电化学活性及代谢抑制剂对阳极生物膜电化学活性的影响 Fig. 6Electrochemical activity of anodic microorganisms and effects of metabolic inhibitors on the electrochemical activities of anodic biofilms |
为了揭示生物膜的电子传递分子机制, 分别用乙酰蛋氨酸、NO气体和蛋白酶K处理GTC电极生物膜(图 6b~6d).乙酰蛋氨酸作为细胞色素c的专一性抑制剂(Nakamura et al., 2008), 当其作用于生物膜后, 原有的两对氧化还原峰(-0.11 V和-0.41 V, 中点电势-0.26 V;0.36 V和-0.14 V, 中点电势0.11 V)消失, 催化氧化的电流明显降低(图 6b).乙酰蛋氨酸对生物膜电化学活性的极大抑制, 证明细胞色素c参与了胞外电子传递过程.前期研究表明, NO可以通过与NiFe活性位点的反应不可逆地灭活氢化酶, NO也可以与细胞色素蛋白的血红素组结合(Ceccaldi et al., 2017).NO气体处理的GTC电极生物膜的电化学活性也受到了严重的抑制, 其氧化还原峰基本消失(图 6c), 这表明NiFe氢酶或细胞色素催化了厌氧甲烷氧化产电过程.蛋白酶K可以在不破坏细胞完整性的条件下, 降解其外膜蛋白(Ye et al., 2019).GTC生物膜经过蛋白酶K消化处理后, 氧化峰(0.23 V)消失, 还原峰(-0.03 V)减弱(图 6d), 证明细胞表面的外膜蛋白介导了微生物与电极之间的电子传递.因此, 细胞色素c、NiFe氢酶和细胞外膜蛋白在AOM产电过程发挥了关键作用.
Yu等(2019)研究报道甲烷氧化富集物氧化13C同位素标记的甲烷, 产生13C标记的乙酸, 证实通过乙酸作为甲烷氧化中间产物的微生物互营途径.根据富集的Methanobacterium古菌缺少细胞色素蛋白, 而Geobacter和Desulfovibrio等电活性菌都含有较多的细胞色素蛋白, 以及乙酰蛋氨酸阻断细胞色素蛋白的电子传递进而抑制产电的现象, 可推测产电过程存在微生物的互营相互作用, 即本试验MFC甲烷产电的机制可能是甲烷氧化菌(Methanobacterium等)与电活性细菌(如Geobacter和Desulfovibrio)的互营合作, 前者主要负责将甲烷氧化为中间产物, 后者彻底降解中间产物而实现产电.
SECM是一种高空间分辨度的扫描电化学探针技术, 通过记录电流响应, 可原位探测电极表面微区域中电活性物质(如c型细胞色素、氧化还原酶、微生物细胞等)的浓度和空间分布特征(Polcari et al., 2016).如图 7a所示, AOM菌的SECM图中出现了明显的、分布较为均匀的催化电流(红色区域), 最大电流达0.01 μA, 这表明AOM微生物具有良好的电化学活性.采用电化学原位傅里叶变换红外光谱(E-FTIR)技术进一步测定了AOM菌生物膜的氧化还原成分.如图 7b所示, AOM微生物的E-FTIR光谱在1701、1678、1655、1571、1546、1534、1455 cm-1处出现信号条带.其中, 1701 cm-1处的条带峰可能与羧基C=O的伸缩振动有关(Mot et al., 2011;Barud et al., 2013;Franca et al., 2014);而1600~1700 cm-1主要是蛋白酰胺I的C=O伸缩振动(Ataka et al., 2004);1678 cm-1处的信号条带归属于分子间聚集物(Lu et al., 2016).随着电位的增加, 1678 cm-1处的条带逐渐消失, 产生了两个新的条带(1701和1655 cm-1), 表明团聚体结构在氧化还原过程发生了转变. 1500~1600 cm-1处的信号由蛋白酰胺II的C—N键伸缩振动产生(Ataka et al., 2004);1571 cm-1处的微弱信号则与羰基有关(Wahyono et al., 2019);1534 cm-1处的条带是蛋白质酰胺II的N—H弯曲振动或C—N基团的拉伸振动(Armentia et al., 2002), 其强度随着电位的增加而减小直至消失, 最终在1546和1455 cm-1(甲基或者碳氢键的伸缩振动)处产生新的条带(Abidi et al., 2014).蛋白酰胺I、II的信号强度随电位增加的变化表明, 细胞外膜上存在氧化还原活性蛋白, 可以介导胞外电子传递, 其分子构象可能在氧化还原过程时发生变化, 这与CV结果相吻合.
图 7(Fig. 7)
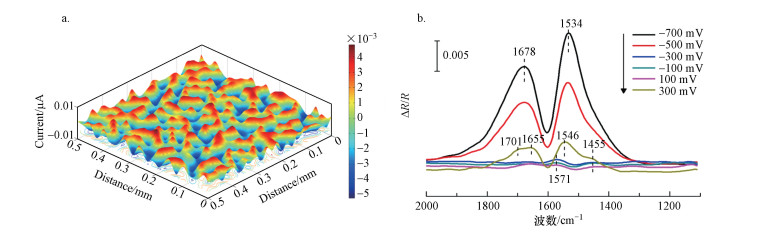 |
| 图 7 AOM菌的扫描电化学显微镜图(a)和电化学红外光谱图(b) Fig. 7Scanning electrochemical microscopy(a) and electrochemical in situ FTIR spectra(b) for AOM microorganisms |
4 结论(Conclusions)1) 甲烷微生物燃料电池产电性能受到阳极条件的制约. GTC电极的产电性能明显优于CC和G-HFM电极;最适产电pH为7;GTC阳极面积越大, 电池启动越快, 产电能力越强;当阳极恒电势为+0.1 V时, 反应器启动最快, 产电效果最好.
2) 阴极电子受体种类对甲烷MFC产电性能有较大的影响.4种电子受体MFC产电性能依次为:溶解氧>铁氰化钾>空气阴极>高锰酸钾.溶解氧MFC启动时间最短, 产电持续时间最长, 最大功率密度可达703.9 mW·m-2, 且电池内阻最小.
3) 甲烷MFC微生物能够在阳极表面形成致密的生物膜, 微生物群落结构以电活性细菌Geobacter(17.14%)、Desulfovibrio(8.51%)为优势菌, 古菌中以Methanobacterium(2.56%)丰度最高, 推测其产电机制依赖甲烷氧化菌(Methanobacterium、Methylomicrobium等)与电活性细菌的协同合作.
4) AOM微生物产电过程没有分泌明显的电子穿梭体, 电子传递以细胞接触电极的直接途径为主.乙酰蛋氨酸、NO气体、蛋白酶K对阳极生物膜的电化学活性有着明显的抑制作用, 证明细胞色素c、NiFe氢酶和细胞外膜蛋白与其电化学活性密切相关.
参考文献
| Abidi N, Cabrales L, Haigler C H. 2014. Changes in the cell wall and cellulose content of developing cotton fibers investigated by FTIR spectroscopy[J]. Carbohydrate Polymers, 100(2): 9-16. |
| Aelterman P, Freguia S, Keller J, et al. 2008. The anode potential regulates bacterial activity in microbial fuel cells[J]. Applied Microbiology and Biotechnology, 78(3): 409-418. DOI:10.1007/s00253-007-1327-8 |
| Armentia A, Lombardero M, Callejo A, et al. 2002. Is Lolium pollen from an urban environment more allergenic than rural pollen?[J]. Allergologia et Immunopathologia, 30(4): 218-224. DOI:10.1016/S0301-0546(02)79124-6 |
| Ataka K, Heberle J. 2004. Functional vibrational spectroscopy of a cytochrome c monolayer: SEIDAS probes the interaction with different surface modified electrodes[J]. Journal of the American Chemical Society, 126(30): 9445-9457. DOI:10.1021/ja048346n |
| Silva Barud H, de Araújo Júnior A M, Sybele S, et al. 2013. Antimicrobial Brazilian propolis (EPP-AF) containing biocellulose membranes as promising biomaterial for skin wound healing[J]. Evidence-Based Complementary and Alternative Medicine: 703024. |
| Bullen R A, Arnot T C, Lakeman J B, et al. 2006. Biofuel cells and their development[J]. Biosensors and Bioelectronics, 21(11): 2015-2045. DOI:10.1016/j.bios.2006.01.030 |
| Ceccaldi P, Etienne E, Dementin S, et al. 2016. Mechanism of inhibition of NiFe hydrogenase by nitric oxide[J]. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 1857: 454-461. DOI:10.1016/j.bbabio.2016.01.014 |
| 陈桂顶, 朱光灿, 周越. 2015. pH对腐熟蓝藻微生物燃料电池产电性能的影响[J]. 中南大学学报(自然科学版), 46(7): 2757-2761. |
| 陈洁, 孙健, 胡勇有. 2016. 石墨烯修饰电极微生物燃料电池及其抗菌性研究进展[J]. 环境科学学报, 36(2): 387-397. |
| Chen S, Smith A L. 2018. Methane-driven microbial fuel cells recover energy and mitigate dissolved methane emissions from anaerobic effluents[J]. Environmental Science: Water Research & Technology, 4(1): 67-79. |
| Cheng S A, Xing D F, Call D F, et al. 2009. Direct biological conversion of electrical current into methane by electromethanogenesis[J]. Environmental Science & Technology, 43(10): 3953-3958. |
| Dennis P G, Virdis B, Vanwonterghem I, et al. 2016. Anode potential influences the structure and function of anodic electrode and electrolyte-associated microbiomes[J]. Nature, 6: 39114. |
| Dziri L, Desbat B, Leblanc R M. 1999. Polarization-modulated FT-IR spectroscopy studies of acetylcholinesterase secondary structure at the air-water interface[J]. Journal of the American Chemical Society, 121(41): 9618-9625. DOI:10.1021/ja990099d |
| Ettwig K F, van Alen, van de Pas-Schoonen K T, et al. 2009. Enrichment and molecular detection of denitrifying methanotrophic bacteria of the NC10 phylum[J]. Applied and Environmental Microbiology, 75(11): 3656-3662. DOI:10.1128/AEM.00067-09 |
| Finkelstein D A, Tender L M, Zeikus J G. 2006. Effect of electrode potential on electrode-reducing microbiota[J]. Environmental Science & Technology, 40(22): 6990-6995. |
| Franca J R, de Luca M P, Ribeiro T G, et al. 2014. Propolis-based chitosan varnish: Drug delivery, controlled release and antimicrobial activity against oral pathogen bacteria[J]. BMC Complementary and Alternative Medicine, 14(1): 1-11. DOI:10.1186/1472-6882-14-1 |
| Gallaher J. 2017. The feasibility of methane as a feed-source for a microbial fuel cell[D]. Christchurch: The University of Canterbury. 1-80 |
| Gao C Y, Wang A J, Zhao Y G. 2014. Contribution of sulfate reducing bacteria to the electricity generation in microbial fuel cells[J]. Advanced Materials Research, 1008: 285-289. |
| Gao Y H, Lee J, Neufeld J D, et al. 2017. Anaerobic oxidation of methane coupled with extracellular electron transfer to electrodes[J]. Scientific Reports, 7(1): 5099. DOI:10.1038/s41598-017-05180-9 |
| Gil G C, Chang I S, Kim B H, et al. 2003. Operational parameters affecting the performance of a mediator-less microbial fuel cell[J]. Biosensors and Bioelectronics, 18(4): 327-334. DOI:10.1016/S0956-5663(02)00110-0 |
| Hirose A, Kasai T, Aoki M, et al. 2018. Electrochemically active bacteria sense electrode potentials for regulating catabolic pathways[J]. Nature Communications, 9(1): 1083. DOI:10.1038/s41467-018-03416-4 |
| Jaewook M, Saikaly P E, Logan B E. 2018. A two-staged system to generate electricity in microbial fuel cells using methane[J]. Chemical Engineering Journal, 352: 262-267. DOI:10.1016/j.cej.2018.07.017 |
| Kang C S, Eaktasang N, Kwon D Y, et al. 2014. Enhanced current production by Desulfovibrio desulfuricans biofilm in a mediator-less microbial fuel cell[J]. Bioresource Technology, 165: 27-30. DOI:10.1016/j.biortech.2014.03.148 |
| Lu R, Li W W, Katzir A, et al. 2016. Fourier transform infrared spectroscopy on external perturbations inducing secondary structure changes of hemoglobin[J]. Analyst, 141: 6061-6067. DOI:10.1039/C6AN01477A |
| Lu Y Z, Ding Z W, Ding J, et al. 2015. Design and evaluation of universal 16S rRNA gene primers for high-throughput sequencing to simultaneously detect DAMO microbes and anammox bacteria[J]. Water Research, 87: 385-394. DOI:10.1016/j.watres.2015.09.042 |
| Mahato M, Pal P, Kamilya T, et al. 2010. Hemoglobin-silver interaction and bioconjugate formation: A spectroscopic study[J]. The Journal of Physical Chemistry B, 114(20): 7062-7070. DOI:10.1021/jp100188s |
| McAnulty M J, Poosarla V G, Kim K Y, et al. 2017. Electricity from methane by reversing methanogenesis[J]. Nature Communication, 8: 15419. DOI:10.1038/ncomms15419 |
| Moran J J, House C, Freeman K H, et al. 2014. Trace methane oxidation studied in several Euryarchaeota under diverse conditions[J]. Archaea-an International Microbiological Journal, 1(5): 303. |
| Mot A C, Silaghi-Dumitrescu R, S?rbu C. 2011. Rapid and effective evaluation of the antioxidant capacity of propolis extracts using DPPH bleaching kinetic profiles, FT-IR and UV-vis spectroscopic data[J]. Journal of Food Composition and Analysis, 24(4/5): 516-522. |
| Nakamura R, Kai F, Okamoto A, et al. 2008. Self-constructed electrically conductive bacterial networks[J]. Angewandte Chemie International Edition, 48(3): 508-511. |
| Polcari D, Dauphin-Ducharme P, Mauzeroll J. 2016. Scanning electrochemical microscopy: A comprehensive review of experimental parameters from 1989 to 2015[J]. Chemical Reviews, 116(22): 13234-13278. DOI:10.1021/acs.chemrev.6b00067 |
| Pant D, van Bogaert G, Diels L, et al. 2010. A review of the substrates used in microbial fuel cells (MFCs) for sustainable energy production[J]. Bioresource Technology, 101(6): 1533-1543. DOI:10.1016/j.biortech.2009.10.017 |
| Rabaey K, Verstraete W. 2005. Microbial fuel cells: novel biotechnology for energy generation[J]. Trends in Biotechnology, 23(6): 291-298. DOI:10.1016/j.tibtech.2005.04.008 |
| Reeburgh W S. 2007. Oceanic methane biogeochemistry[J]. Chemical Reviews, 107(2): 486-513. DOI:10.1021/cr050362v |
| Ren Z Y. 2017. Microbial fuel cells: Running on gas[J]. Nature Energy, 2(6): 17093. DOI:10.1038/nenergy.2017.93 |
| 史昕欣. 2013. 空气阴极微生物燃料电池阴极结构及催化剂的研究[D]. 哈尔滨: 哈尔滨工业大学. 1-131 |
| Siegert M, Yates M D, Spormann A, et al. 2015. Methanobacterium dominates biocathodic archaeal communities in methanogenic microbial electrolysis cells[J]. ACS Sustainable Chemistry & Engineering, 3(7): 1668-1676. |
| Sun G T, Thygesen A, Meyer A S. 2015. Acetate is a superior substrate for microbial fuel cell initiation preceding bioethanol effluent utilization[J]. Applied Microbiology and Biotechnology, 99(11): 4905-4915. DOI:10.1007/s00253-015-6513-5 |
| Wahyono T, Astuti D A, Wiryawan K G, et al. 2019. Fourier transform mid-infrared (FTIR) spectroscopy to identify tannin compounds in the panicle of sorghum mutant lines[J]. IOP Conference Series Materials Science and Engineering, 546: 42-45. |
| Yan Z, Joshi P, Gorski C A, et al. 2018. A biochemical framework for anaerobic oxidation of methane driven by Fe(III)-dependent respiration[J]. Nature Communication, 9: 1642. DOI:10.1038/s41467-018-04097-9 |
| Ye J, Yu J, Zhang Y Y, et al. 2019. Light-driven carbon dioxide reduction to methane by Methanosarcina barkeri-CdS biohybrid[J]. Applied Catalysis B: Environmental, 257: 117916. DOI:10.1016/j.apcatb.2019.117916 |
| Yu L P, Yang Z J, He Q X, et al. 2019. Novel gas diffusion cloth bioanodes for high-performance methane-powered microbial fuel cells[J]. Environmental Science & Technology, 53: 530-538. |
| Zehnder A J B, Brock T D. 1979. Methane formation and methane oxidation by methanogenic bacteria[J]. Journal of Bacteriology, 137(1): 420-432. DOI:10.1128/jb.137.1.420-432.1979 |
| 张茗迪, 贾玉红, 尤宏, 等. 2019. g-C3N4/Cu2O/CF电极制备及在微生物燃料电池中的应用[J]. 环境科学学报, 39(9): 2945-2952. |
| 郑宇, 李天宏, 周顺桂, 等. 2010. pH值对猪粪废水微生物燃料电池产电性能的影响[J]. 应用基础与工程科学学报, 18(1): 1-9. DOI:10.3969/j.issn.1005-0930.2010.01.001 |
