 , 潘杨1,2
, 潘杨1,2
 , 陈越1, 张星宇1, 倪敏1
, 陈越1, 张星宇1, 倪敏11. 苏州科技大学环境科学与工程学院, 苏州 215009;
2. 城市生活污水资源化利用技术国家地方联合工程实验室, 苏州 215009
收稿日期: 2020-12-21; 修回日期: 2021-02-28; 录用日期: 2021-02-28
基金项目: 国家自然科学基金项目(No.51778390,51938010);江苏水处理技术与材料协同创新中心预研项目(No.XTCXSZ2020-4);江苏省研究生科研创新计划(No.KYCX19_2032)
作者简介: 杨婉静(1998-), 女, E-mail: 15706296875@163.com
通讯作者(责任作者): 潘杨, E-mail: panyang863@sina.com
摘要:以基于同步去除/富集磷酸盐的厌氧/好氧交替生物膜序批式反应器内生物膜为研究对象,研究了胞外聚合物(EPS)内磷含量形态及生物膜内微生物种群变化,探究EPS在生物膜去除/富集磷酸盐中的作用及其与微生物种群之间的联系.结果表明,生物膜反应器在厌氧外加COD为200 mg·L-1的条件下富集到了磷浓度为120.95 mg·L-1的富集液.EPS在生物膜吸/释磷过程中发挥重要作用,EPS磷含量占生物膜磷含量的69.16%~79.00%,31P核磁共振实验表明ortho-P为EPS内主要磷形态,占比为85.47%~88.60%.高通量测序结果表明生物膜内微生物种群变化明显,Candidatus_Competibacter为优势菌属,其丰度由1.23%增至38.87%,有利于形成更具粘性的EPS进而黏附在生物膜上,可能促进EPS在吸/释磷中发挥作用;暖绳菌科为优势聚磷菌,随实验温度升高,其丰度由5.29%减至4.90%.
关键词:生物膜强化生物除磷31P核磁共振高通量测序
The role of extracellular polymer substances in simultaneous removal/enrichment of phosphate in biofilms system
YANG Wanjing1
 , PAN Yang1,2
, PAN Yang1,2
 , CHEN Yue1, ZHANG Xingyu1, NI Min1
, CHEN Yue1, ZHANG Xingyu1, NI Min11. School of Environmental Science and Engineering, Suzhou University of Science and Technology, Suzhou 215009;
2. National & Local Joint Engineering Laboratory for Municipal Sewage Resource Utilization Technology, Suzhou 215009
Received 21 December 2020; received in revised from 28 February 2021; accepted 28 February 2021
Abstract: An anaerobic/aerobic alternate biofilm sequence-batch reactor was investigated for simultaneous removal/enrichment of phosphate.The role of extracellular polymer substances (EPS) in phosphate removal/enrichment in biofilm and its relationship with microbial populations were explored through studying the content and morphology of phosphorus in EPS and the changes of microbial population in biofilm. The results showed that the phosphate concentration in the bioflum enrichment was up to 120.95 mg·L-1 in the biofilm reactor under 200 mg·L-1 COD in anaerobic phase. EPS played an important role in the phosphorus absorption/release process of biofilm, and the phosphorus content in EPS accounted for 69.16%~79.00% of the phosphorus content in biofilm. 31P nuclear magnetic resonance experiments results showed that Ortho-P was the main form of phosphorus in EPS, accounting for 85.47%~88.60%. High-throughput sequencing results showed that the microbial population in the biofilm changed significantly. Candidatus_Competibacter was the dominant genus, and its abundance increased from 1.23% to 38.87%, which was conducive to the formation of more viscous EPS and its adhesion to the biofilm, and may enhance the role of EPS in phosphorus absorption and release. Caldilineaceae was the dominant phosphorus accumulating organisms and its abundance decreased from 5.29% to 4.90% with the increase of temperature.
Keywords: enhanced biological phosphorus removal31P nuclear magnetic resonancehigh-throughput sequencing
1 引言(Introduction)近年来, 随着磷矿资源日益枯竭, 从城市污水中去除磷并将其高倍富集回收已经成为了一种有效的资源化手段(Rittmann et al., 2011; Wong et al., 2013).磷的去除与富集主要依赖于活性污泥中具有吸/释磷作用的聚磷菌(phosphorus accumulating organisms, PAOs)(Yuan et al., 2012).近年来, 许多****研究发现胞外聚合物(extracellular polymeric substance, EPS)内含有大量的磷, 并在吸/释磷过程中发挥重要作用(Zhang et al., 2011; 方振东等, 2011; Li et al., 2015).Zhang等用阳离子交换树脂(cation exchange resin, CER)法提取强化生物除磷(enhanced biological phosphorus removal, EBPR)反应器污泥中EPS, 发现好氧末期约6.6%~10.5%污泥中的磷(TP污泥)保留在EPS中(Zhang et al., 2013a);Wang等采用加热法提取颗粒污泥序批式反应器(sequencing batch reactor, SBR)内污泥中EPS, 发现EPS中磷含量(TPEPS)占TP污泥30%(Wang et al., 2014);狄寿源等在SBR反应器内分别采用超声波法和CER法提取活性污泥中疏松结合胞外聚合物(LB-EPS)和紧密结合胞外聚合物(TB-EPS), 发现LB-EPS与TB-EPS中磷含量分别占TP污泥的4.67%~14.5%与47.12%~56.83%(狄寿源等, 2017), Zhang等及Long等分别提出结合EPS的EBPR代谢模型, 前者认为EPS是磷的动态储存库, 能够传输存储磷, 后者认为EPS不仅能传输存储磷, 还能够参与生物磷累积, 在吸/释磷过程中发挥主要作用(Zhang et al., 2013b; Long et al., 2017).由于接种污泥及EPS提取方法等因素, 造成不同****研究结果间存在一定差异, 但均反映出EPS在EBPR中发挥重要作用.
现有关于EPS的研究多集中在基于悬浮生长型活性污泥法的EBPR工艺, 对附着生长型的生物膜法研究较少, 然而现有研究表明生物膜法不仅有较高的除磷效率还可以实现从低磷浓度废水中高倍富集磷酸盐(Kodera et al., 2013; Tian et al., 2016), 有机物需求量更少(Wong et al., 2018), 可以实现在主流工艺中同步去除/高倍富集磷(Zhang et al., 2020).同时, 相较活性污泥法而言, 生物膜法无污泥量大、污泥膨胀等缺点, 在未来城市污水厂中更具有应用潜力(Zhang et al., 2020).
基于此, 本文以稳定除磷的厌氧/好氧交替生物膜序批式反应器中生物膜为研究对象, 采用合成废水在主流工艺中进行磷的去除与富集, 考察生物膜内磷含量分布, 吸/释磷过程中细胞及EPS中不同形态磷含量的动态变化, 结合液相中磷浓度变化探究细胞及EPS在吸/释磷过程中的作用.同时, 通过MiSeq高通量测序技术考察微生物种群特性及群落变化, 探究微生物种群与EPS之间的联系.
2 材料与方法(Materials and methods)2.1 生物膜反应器装置与运行反应器接种污泥来自苏州某污水处理厂, 经26 d驯化培养聚磷生物膜启动, 可实现同步去除/富集磷(章豪等, 2019b).反应器主要由好氧进水罐(180 L)、反应容器(6 L)、外加碳源罐(2 L)和厌氧回收罐(10 L)组成, 其中反应容器内悬浮载体填充比为40%.反应器每天运行4个周期, 每个周期为360 min, 包括230 min好氧、110 min厌氧、2 min进水、15 min出水和3 min闲置, 反应器进出水、搅拌及曝气均由定时器控制.好氧阶段:好氧进水电磁阀定时打开, 合成废水在重力作用下进入反应器中, 进水体积为5 L, 曝气装置定时打开, 促进好氧环境形成, 溶解氧(DO)控制在6.5 mg·L-1左右, 好氧阶段末期废水经生物膜好氧吸磷后达标排放至下水管道;厌氧阶段:厌氧进水泵定时打开, 回收罐中富集液被泵至反应器中, 进水体积为5 L, 进水完成后, 外加碳源电磁阀定时打开, 碳源溶液在重力作用下加至反应器中, 厌氧阶段末期, 富集液经生物膜厌氧释磷后泵回至厌氧回收罐.好氧、厌氧阶段搅拌器均定时打开, 强化混合, 均匀水质.实验阶段反应器内水温为(24±2) ℃.
2.2 合成废水好氧进水及外加碳源溶液采用人工合成废水.好氧进水为10 mg·L-1 PO43--P、40 mg·L-1 NH4+-N, 400 mg·L-1 NaHCO3调节pH为(7.5±0.2)(Kodera et al., 2013), 少量CaCl2·2H2O、MgSO4·7H2O、EDTA·2Na和微量元素(Liu et al., 1997).厌氧阶段采用无水乙酸钠为外加碳源, 碳源溶液加入后厌氧进水为200 mg·L-1 COD、40 mg·L-1 NH4+-N, 少量CaCl2·2H2O、MgSO4·7H2O、EDTA·2Na和微量元素.
2.3 EPS提取Zhang等(2013a)对比5种EPS提取方法(甲醛-NaOH法、超声法、EDTA法、加热法和CER法)发现, CER法提取EPS效率较高, 细胞溶解程度较低, 且聚磷降解程度较低, 适合用来提取EBPR活性污泥中EPS.因此, 生物膜内EPS采用CER法提取.在好氧及厌氧阶段末期取生物膜10 mL, 4 ℃下8000 r·min-1离心5 min, 弃去上清液, 0.1 mol·L-1 NaCl溶液洗涤两次去除残留可溶性物质, 后将生物膜用0.1 mol·L-1 NaCl溶液重悬至20 mL于100 mL烧杯内, 加入CER(70 g·g-1)(以挥发性悬浮固体(volatile suspended solids, VSS)计), 在冰水浴中于500 r·min-1下连续离子交换反应6 h, 反应结束后用滤径为250 μm的尼龙筛网除去树脂颗粒, 得到的混合液在4 ℃下12000 r·min-1离心20 min, 离心后上清液经0.45 μm醋酸纤维膜过滤即得EPS溶液, 部分储存在-20 ℃冰箱内用于后续化学分析测试, 部分经-80 ℃冰箱冰冻24 h后于-50 ℃下真空冷冻干燥48 h, 得到的EPS粉末在-20 ℃冰箱中储存待磷形态测定, 混合液经0.45 μm醋酸纤维膜过滤后剩下的沉淀物视为细菌细胞部分(Zhang et al., 2013a; Long et al., 2017)
2.4 胞内磷提取将细菌细胞重悬于去离子水(0~2 ℃)中, 采用超声细胞破碎仪提取重悬后的样品(Tao et al., 2020), 21 kHz, 10 W·mL-1, 冰浴超声提取10 min, 超声结束后将混合液在4 ℃下12000 r·min-1离心15 min, 上清液经-80 ℃冰箱冰冻24 h后于-50 ℃下真空冷冻干燥48 h, 得到的粉末在-20 ℃冰箱中储存待胞内P形态测定.
2.5 P形态测定采用31P核磁共振(nuclear magnetic resonance, NMR)检测样品内磷形态, 称取约15 mg冷冻干燥后粉末样品, 溶于0.2 mL D2O, 0.2 mL 0.1 mol·L-1 EDTA溶液, 测试前加入0.2 mL 2 mol·L-1 NaOH溶液, 采用核磁共振波谱仪扫描样品, 样品扫描次数不少于128次, 样品准备好后立即测试, 测试在2 h内完成, 避免磷形态的转变(Zhang et al., 2013a; 狄寿源等, 2017).采用MestReNova软件分析EPS及胞内磷形态核磁谱图.
2.6 微生物种群测定在反应器运行第0、30、60 d取厌氧阶段污泥于离心管中, 在1500 r·min-1下离心5 min, 去除上清液后置于-80 ℃冰箱中保存待测定. DNA提取与检测、PCR扩增与产物检测参考章豪等测定方法(章豪等, 2019a).
2.7 其他分析方法COD、PO43--P、NH4+-N、VSS及溶液中总磷(TP)均采用标准方法测定(国家环境保护总局《水和废水监测分析方法》编委会, 2002);生物膜中磷含量(TP生物膜)采用SMT法(Medeiros et al., 2005), 称取一定量生物膜样品于450 ℃马弗炉中煅烧3 h, 向煅烧后残渣中加入20 mL 3.5 mol·L-1 HCl, 在20 ℃、振速250 r·min-1条件下振荡16 h, 振荡结束后离心, 取上清液并测定其中正磷酸盐浓度;DO采用Inlab OXI7300溶氧仪测定;pH采用Inlab OXI7300 pH计测定, ORP采用HQ14D ORP测定仪.
3 结果与讨论(Results and discussion)3.1 液相中磷浓度变化反应器稳定运行30 d后开展实验.稳定运行期间反应器去除/富集磷性能及一个好氧-厌氧周期内液相中磷浓度变化分别如图 2a、2b所示, 图 2a中好氧进水取自好氧进水罐, 好氧/厌氧出水取自好氧/厌氧阶段末反应器下侧出水口.好氧进水实际磷浓度约为(10±1) mg·L-1, 好氧阶段生物膜吸收合成废水中的磷, 好氧阶段液相中磷浓度逐渐降低, 4 h后好氧出水磷浓度 < 0.5 mg·L-1, 在每个磷回收阶段内磷的去除率稳定在95%以上;厌氧阶段生物膜释放体内磷至外界溶液中, 厌氧阶段液相中磷浓度上升, 经多次好氧/厌氧周期后富集液中磷浓度逐渐上升, 最高达120.95 mg·L-1, 满足回收磷浓度标准(>50 mg·L-1)(Cornel et al., 2009).在阶段I和II, 反应器运行10 d后, 富集液磷浓度上升趋势变缓, 这是由于随着富集液磷浓度逐渐上升, 好氧末期残留在反应器中的低磷浓度出水会使厌氧初期反应器中回收罐进水磷浓度大幅下降, 同时, 厌氧末期残留在反应器中的富集液导致好氧初期反应器内磷浓度大幅上升, 约15 d后好氧出水>0.5 mg·L-1, 无法达到排放标准, 更换富集液.反应器稳定运行过程中, 生物膜吸/释能力逐渐增强, 阶段I及阶段II富集液磷浓度平均日增量分别为6.59 mg·L-1·d-1和8.06 mg·L-1·d-1, 因此回收阶段II富集到的富集液磷浓度高于阶段I的98.9 mg·L-1.
图 1(Fig. 1)
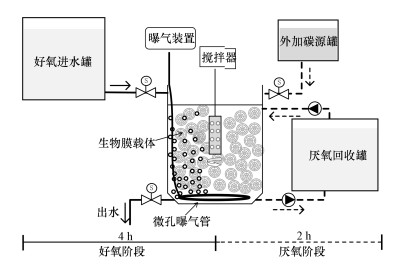 |
| 图 1 生物膜序批式反应器装置图 Fig. 1The diagram of biofilm sequencing batch reactor |
图 2(Fig. 2)
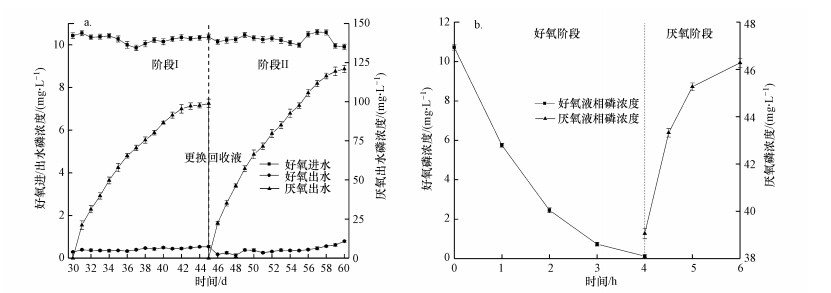 |
| 图 2 液相中磷浓度变化 (a.反应器运行性能图, b.一个好氧-厌氧周期内液相中磷浓度变化) Fig. 2Phosphorus concentration changes in the liquid phase (a.operation performance of the reactor, b. phosphorus concentration changes in the liquid phase during an aerobic-anaerobic phase) |
3.2 生物膜磷含量分布在第60 d测定生物膜、胞内及EPS在一个好氧-厌氧周期内磷含量(以VSS计)的变化, 探究生物膜内EPS扮演的角色.好氧/厌氧阶段生物膜磷含量及分布如图 3所示, 生物膜在好氧阶段吸收废水中的磷, 生物膜中磷含量(TP生物膜)由0 h的29.4 mg·g-1逐渐增至4 h的50 mg·g-1, 细胞内磷含量(TP细胞)逐渐由6.01 mg·g-1增至15.02 mg·g-1, EPS中磷含量(TPEPS)由23.1 mg·g-1逐渐增至4 h的34.58 mg·g-1.厌氧阶段生物膜释放磷, TP生物膜降至6 h的33.75 mg·g-1, 细胞释磷几乎在1 h内完成, TP细胞快速降至7.64 mg·g-1, 5 h后TP细胞下降速率明显减弱, 5~6 h TP细胞仅减少了0.13 mg·g-1, 由于细胞在厌氧阶段释放出的磷经过EPS后释放到生物膜外, 因此TPEPS在厌氧阶段并没有发生快速下降, 而是逐渐降至5 h的30.19 mg·g-1, 再降至6 h的25.91 mg·g-1.生物膜内磷含量在好氧/厌氧阶段变化趋势与液相中磷在好氧阶段减少厌氧阶段上升的结果相符.生物膜磷主要储存在EPS中, TPEPS占TP生物膜的比例(TPEPS/TP生物膜)为69.16%~79%, 好氧阶段随着生物膜吸磷, TP细胞逐渐上升, TPEPS/TP生物膜由78.56%逐渐降至69.16%, 厌氧阶段由于细胞内磷的快速释放, TPEPS/TP生物膜快速增至79%, 后随EPS中磷释放逐渐降至76.76%.生物膜吸/释磷由EPS及细胞共同发挥作用, EPS发挥作用相对较大, 好氧阶段EPS吸磷量占生物膜吸磷量的55.75%, 厌氧阶段EPS释磷量占生物膜释磷量的53.39%.上述结果说明, 生物膜内EPS中存在大量磷并在生物膜好氧/厌氧阶段吸/释磷中发挥重要作用.
图 3(Fig. 3)
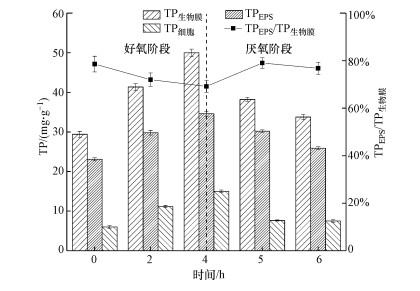 |
| 图 3 D60好氧-厌氧周期内生物膜、EPS及胞内磷含量变化 Fig. 3Changes of phosphorus content in biofilm, EPS and cell during an aerobic-anaerobic phase at D60 |
3.3 聚磷菌磷形态分析3.3.1 EPS内磷形态通过31P NMR谱图分析(Turner et al., 2003; Mcdowell et al., 2006), 在提取的D60好氧末期、厌氧末期EPS的谱图中均观察到正磷(ortho-P)、焦磷(pyro-P)和聚磷(poly-P)(包括末端与中部峰)的信号, 两个谱图中ortho-P比例均高于poly-P和pyro-P, 表明好氧和厌氧EPS中磷的主要形态均为ortho-P, 如图 4所示.EPS中各形态磷相对比例及含量如表 1所示, 好氧末期EPS内ortho-P占比为85.47%, pyro-P和poly-P占比分别为1.66%和12.87%, 经过厌氧释磷, TPEPS减少, EPS内ortho-P占比升至88.62%, 其含量显著减少, pyro-P占比及含量均未发生明显变化, poly-P占比略降至9.79%, 其含量由4.45 mg·g-1略降至2.54 mg·g-1, EPS中磷主要以ortho-P形态释出.同理, 随着好氧阶段TPEPS增加, pyro-P和poly-P无显著合成, 表明EPS内poly-P及pyro-P主要来源于细胞自溶, EPS无合成poly-P能力(Zhang et al., 2013b).由于EPS拥有丰富的官能团和较大的比表面积, 这些官能团可以和磷酸盐发生配位体交换, 形成磷酸盐配位络合物, 有利于EPS对磷酸盐的吸附(Yang et al., 2006), EPS中的ortho-P可能主要来源于好氧/厌氧阶段细胞吸/释磷时吸附在EPS中的磷.由于EPS在生物膜好氧/厌氧阶段吸/释磷过程中发挥主要作用, 且EPS主要以ortho-P形态吸/释磷, 好氧阶段不需要合成聚磷所消耗的能量, 厌氧阶段直接释放ortho-P, 有利于生物膜法在较低碳源条件下稳定运行.
图 4(Fig. 4)
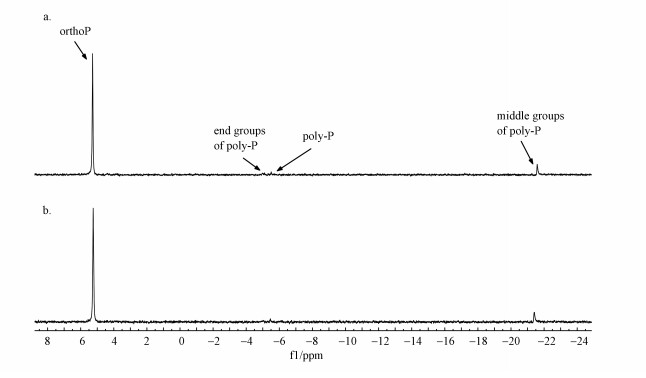 |
| 图 4 D60 EPS的31P NMR图谱 (a. EPS(好氧末期), b. EPS(厌氧末期)) Fig. 431P NMR spectrogram of EPS at D60 (a. EPS(end of the aerobic phase), b. EPS(end of the anaerobic phase)) |
表 1(Table 1)
| 表 1 D60好氧/厌氧末期EPS内不同形态磷在31P NMR谱图中的相对峰面积及含量 Table 1 31P NMR relative peak areas and phosphorus content of the identified phosphorus species in the EPS of the end of aerobic/anaerobic phase at D60 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 D60好氧/厌氧末期EPS内不同形态磷在31P NMR谱图中的相对峰面积及含量 Table 1 31P NMR relative peak areas and phosphorus content of the identified phosphorus species in the EPS of the end of aerobic/anaerobic phase at D60
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2(Table 2)
| 表 2 D60好氧/厌氧末胞内不同形态磷在31P NMR谱图中的相对峰面积及含量 Table 2 31P NMR relative peak areas and phosphorus content of the identified phosphorus species in the cell of the end of aerobic/anaerobic phase at D60 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2 D60好氧/厌氧末胞内不同形态磷在31P NMR谱图中的相对峰面积及含量 Table 2 31P NMR relative peak areas and phosphorus content of the identified phosphorus species in the cell of the end of aerobic/anaerobic phase at D60
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.3.2 细胞内磷形态好氧/厌氧末期细胞的31P NMR谱图如图 5所示, 在两张谱图中ortho-P、pyro-P和Poly-P(包括末端与中部峰)的信号均有出现, 好氧末期细胞内ortho-P、pyro-P及Poly-P比例均较高, 厌氧末期细胞内ortho-P及pyro-P比例明显高于Poly-P, 表明厌氧末期细胞内磷的主要形态为ortho-P及pyro-P.细胞内各形态磷相对比例如表 1所示, 好氧阶段, 细胞吸收外界磷, 利用ortho-P及pyro-P在体内合成poly-P, 好氧末期细胞内ortho-P及pyro-P占比降至47.56%和15.05%, poly-P占比升至37.38%, 厌氧阶段, 细胞分解体内poly-P, 释放ortho-P, 厌氧末poly-P占比降至5.72%, 其含量由5.61 mg·g-1降至0.43 mg·g-1, ortho-P及pyro-P占比升至69.72%和24.55%, 同时导致提取到的EPS内poly-P含量降低.生物膜细胞内TP细胞含量、ortho-P及poly-P好氧/厌氧相对比例变化趋势与传统除磷机制相同(Hirota et al., 2010; Acevedo et al., 2012), 然而好氧末期细胞内磷形态并非以Poly-P为主, 而是主要以ortho-P形态存在于细胞内, 可能是由于厌氧外加碳源相对较低, 胞内PHA合成量较少, 好氧阶段细胞无充分能量将外界ortho-P吸收进胞内合成聚磷, 从而导致大量ortho-P途径EPS被吸附截留, 实现好氧阶段液相中磷的去除.厌氧阶段, 胞内poly-P分解释放ortho-P至胞外, 同时EPS内ortho-P可能在浓度梯度驱动下释放至液相中, 进而实现磷酸盐的富集.EPS在吸/释磷过程中发挥主要作用, 使得生物膜法在较低碳源消耗下仍具有较强去除/富集磷性能.
图 5(Fig. 5)
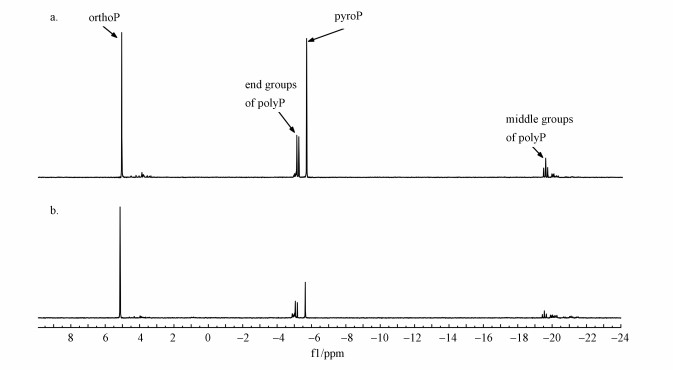 |
| 图 5 D60细菌细胞的31P NMR图谱 (a.细胞(好氧末期), b.细胞(厌氧末期)) Fig. 531P NMR spectrogram of cell at D60 (a.EPS(end of the aerobic phase).b. EPS(end of the anaerobic phase)) |
3.4 生物膜内微生物种群分析生物膜内微生物种群组成如图 6所示, D0、D30、D60分别为运行0、30、60 d的生物膜.由图 6a可知, 在微生物门水平上, 物种丰富度>1.5% 的菌门共8种, 优势菌门为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)等.现有研究表明变形菌门是常见PAOs所属菌门, 如红环菌科、莫拉氏菌科等(Tian et al., 2016).同时, 变形菌门是生物除磷的关键元素(Nguyen et al., 2011).随着变形菌门丰度由接种污泥中的21.40%升至62.60%, 生物膜去除/富集磷酸盐能力逐渐增强.为进一步明晰生物膜内微生物种群组成及变化, 在属水平上对微生物种群组成进行分析(图 6b), 物种丰富度>1.5%的菌属主要有20种.0、30、60 d的生物膜内菌属差异较大, 生物膜反应器稳定运行后生物膜内优势菌属为Candidatus_Competibacter(Ca.competibacter)、暖绳菌科(Caldilineaceae)、Defluviicoccus、红游动菌属(Rhodoplanes)、Tetrasphaera等.Ca.competibacter通常被定义为聚糖菌属(GAOs)(Meyer et al., 2003), 其有利于更具粘性的EPS形成(Seviour et al., 2011), EPS粘性的增强可能促进EPS在生物膜吸/释磷中发挥主要作用.其丰度由接种污泥中1.23%增至38.87%, 生物膜反应器启动及运行期间EPS含量逐渐上升(章豪等, 2019a)可能与Ca.Competibacter属逐渐增多有关.此外, 近年来, Ca.Competibacter中属于γ变形菌纲的Candidatus _Competibacter phosphatis已被证实具有合成和水解poly-P的能力(杨建鹏等, 2019), Ca.Competibacter属在生物膜吸/释磷中发挥的作用仍待进一步研究.暖绳菌科与其他菌属共同作用可提升活性污泥除磷作用(徐芯渝等, 2020), 其丰度未发生明显变化.生物膜内Defluviicoccus丰度由0 d的0.55%升至60 d的6.13%, Tetrasphaera丰度由最初的2.68%降至0.09%.Defluviicoccus是一种假定的GAOs(张超等, 2010), 而Tetrasphaera是PAOs, 随着生物膜反应器的运行, 生物膜内PAOs减少而GAOs增多可能是由于温度逐渐增高造成的.据研究, PAOs适宜生长温度为15 ℃左右, 温度>20 ℃时更适宜GAOs生长, GAOs即可占优势(王亚宜等, 2009; Zeng et al., 2019), 本实验中反应器启动及运行温度为22.1~26.2 ℃, 更适宜GAOs生长.
图 6(Fig. 6)
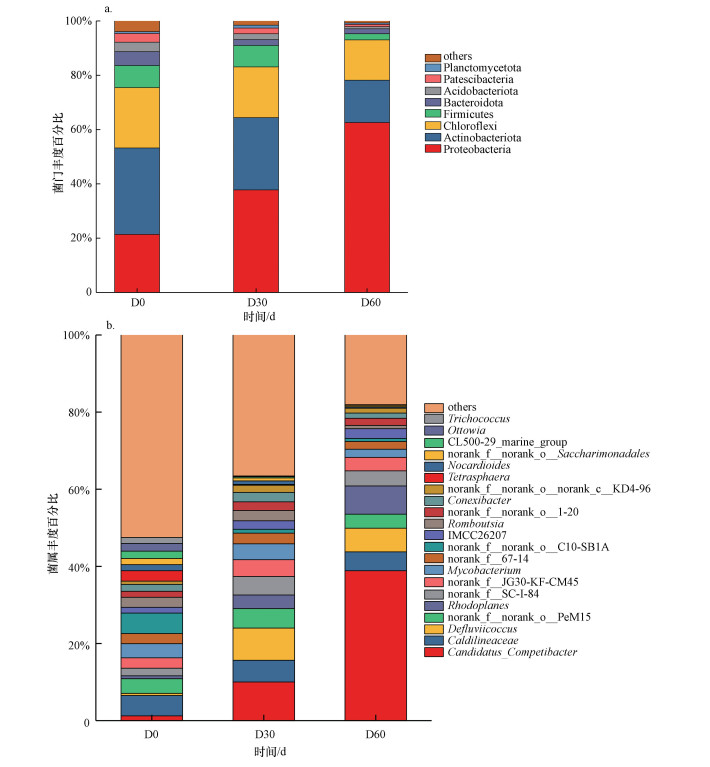 |
| 图 6 生物膜微生物种群分布 (a.门水平, b. 属水平) Fig. 6Microbial population distribution in biofilm (a. phylum level, b. genus level) |
4 结论(Conclusions)1) 本研究所采用生物膜反应器具有较强吸/释磷性能, 好氧阶段磷的去除率>95%, 厌氧阶段释磷所富集的富集液浓度最高可达120 mg·L-1, 可用于后续磷回收.
2) 生物膜内磷主要以正磷形态分布在EPS中, 生物膜好氧/厌氧阶段吸/释磷是细胞及EPS共同作用的结果, 其中EPS发挥主要作用, TPEPS占TP生物膜的69.16%~79.00%, 使得生物膜法在较低碳源消耗下仍具有较强去除/富集磷性能.
3) 在反应器运行过程中, 生物膜内微生物种群变化显著, 常见PAOs所属的变形菌门丰度由21.4%增至62.60%, 部分物种具有合成和水解聚磷酸盐的Ca.Competibacter菌属为主要优势菌属, 同时其有利于形成更具粘性的EPS, 可能促进EPS在生物膜吸/释磷中发挥主要作用, 由于实验温度>20 ℃, 不适宜PAOs生长, PAOs丰度较小且逐渐减小.
参考文献
| Acevedo B, Oehmen A, Carvalho G, et al. 2012. Metabolic shift of polyphosphate-accumulating organisms with different levels of polyphosphate storage[J]. Water Research, 46(6): 1889-1900. DOI:10.1016/j.watres.2012.01.003 |
| Cornel P, Schaum C. 2009. Phosphorus recovery from wastewater: Needs, technologies and costs[J]. Water Science & Technology A Journal of the International Association on Water Pollution Research, 59(6): 1069-1076. |
| 狄寿源, 龙向宇, 唐然, 等. 2017. 疏松和紧密结合EPS在强化生物除磷中的作用[J]. 中国给水排水, 33(9): 35-39. |
| 方振东, 龙向宇, 唐然, 等. 2011. 胞外聚合物结合磷效能的研究[J]. 环境科学学报, 31(11): 2374-2379. |
| 国家环境保护总局《水和废水监测分析方法》编委会. 2002. 水和废水监测分析方法[M]. 第四版. 北京: 中国环境科学出版社, 200-284. |
| Hirota R, Kuroda A, Kato J, et al. 2010. Bacterial phosphate metabolism and its application to phosphorus recovery and industrial bioprocesses[J]. Journal of Bioence & Bioengineering, 109(5): 423-432. |
| Kodera H, Hatamoto M, Abe K, et al. 2013. Phosphate recovery as concentrated solution from treated wastewater by a PAO-enriched biofilm reactor[J]. Water Research, 47(6): 2025-2032. DOI:10.1016/j.watres.2013.01.027 |
| Li W W, Zhang H L, Sheng G P, et al. 2015. Roles of extracellular polymeric substances in enhanced biological phosphorus removal process[J]. Water Research, 86: 85-95. DOI:10.1016/j.watres.2015.06.034 |
| Liu W T, Nakamura K, Matsuo T, et al. 1997. Internal energy-based competition between polyphosphate- and glycogen-accumulating bacteria in biological phosphorus removal reactors-Effect of PC feeding ratio[J]. Water Research, 31(6): 1430-1438. DOI:10.1016/S0043-1354(96)00352-1 |
| Long X, Tang R, Fang Z, et al. 2017. The roles of loosely-bound and tightly-bound extracellular polymer substances in enhanced biological phosphorus removal[J]. Chemosphere, 189: 679-688. DOI:10.1016/j.chemosphere.2017.09.067 |
| Mcdowell R W, Stewart I, Cade-Menun B J. 2006. An examination of spin-lattice relaxation times for analysis of soil and manure extracts by liquid state phosphorus-31 nuclear magnetic resonance spectroscopy[J]. Journal of Environmental Quality, 35(1): 293-302. DOI:10.2134/jeq2005.0285 |
| Medeiros J J G, Cid B P, Gómez E F. 2005. Analytical phosphorus fractionation in sewage sludge and sediment samples[J]. Analytical & Bioanalytical Chemistry, 381(4): 873. DOI:10.1007%2Fs00216-004-2989-z |
| Meyer R L, Saunders A M, Zeng R J, et al. 2003. Microscale structure and function of anaerobic-aerobic granules containing glycogen accumulating organisms[J]. Fems Microbiology Ecology, 45(3): 253-261. DOI:10.1016/S0168-6496(03)00159-4 |
| Nguyen H T T, Le V Q, Hansen A A, et al. 2011. High diversity and abundance of putative polyphosphate-accumulating Tetrasphaera-related bacteria in activated sludge systems[J]. Fems Microbiology Ecology, 76(2): 256-267. DOI:10.1111/j.1574-6941.2011.01049.x |
| Rittmann B E, Mayer B, Westerhoff P, et al. 2011. Capturing the lost phosphorus[J]. Chemosphere, 84(6): 846-853. DOI:10.1016/j.chemosphere.2011.02.001 |
| Seviour T W, Lambert L K, Pijuan M, et al. 2011. Selectively inducing the synthesis of a key structural exopolysaccharide in aerobic granules by enriching for Candidatus "Competibacter phosphatis"[J]. Applied Microbiology and Biotechnology, 92(6): 1297-1305. DOI:10.1007/s00253-011-3385-1 |
| Tao G J, Long X Y, Tang R, et al. 2020. Comparison and optimization of extraction protocol for intracellular phosphorus and its polyphosphate in enhanced biological phosphorus removal (EBPR) sludge[J]. The Science of the Total Environment, 699(Jan.10): 1343891-13438910. |
| Tian Q, Ong S K, Xie X, et al. 2016. Enhanced phosphorus recovery and biofilm microbial community changes in an alternating anaerobic/aerobic biofilter[J]. Chemosphere, 144(FEB.): 1797-1806. |
| Turner B L, Mahieu N, Condron L M. 2003. Phosphorus-31 nuclear magnetic resonance spectral assignments of phosphorus compounds in soil NaOH-EDTA extracts[J]. Soil ence Society of America Journal, 67(2): 497-510. DOI:10.2136/sssaj2003.4970 |
| Wang R, Peng Y, Cheng Z, et al. 2014. Understanding the role of extracellular polymeric substances in an enhanced biological phosphorus removal granular sludge system[J]. Bioresource Technology, 169: 307-312. DOI:10.1016/j.biortech.2014.06.040 |
| 王亚宜, 鲁文敏, 杨健, 等. 2009. 基于聚糖菌和聚磷菌竞争的代谢模型及影响因素[J]. 环境科学学报, 29(6): 1131-1138. DOI:10.3321/j.issn:0253-2468.2009.06.002 |
| Wong P Y, Cheng K Y, Kaksonen A H, et al. 2013. A novel post denitrification configuration for phosphorus recovery using polyphosphate accumulating organisms[J]. Water Research, 47(17): 6488-6495. DOI:10.1016/j.watres.2013.08.023 |
| Wong P Y, Cheng K Y, Krishna K C B, et al. 2018. Improvement of carbon usage for phosphorus recovery in EBPR-r and the shift in microbial community[J]. Journal of Environmental Management, 218(15): 569-578. |
| 徐芯渝, 李伟民, 叶姜瑜. 2020. 光合细菌强化SBR系统处理垃圾渗滤液及生物群落结构分析[J]. 环境工程, 38(1): 99-104. |
| 杨建鹏, 张健, 田晴, 等. 2019. 内源碳PHA的贮存对混合菌群耐低温特性的影响[J]. 环境科学, 40(4): 1914-1921. |
| Yang Y, Zhao Y Q, Babatunde A O, et al. 2006. Characteristics and mechanisms of phosphate adsorption on dewatered alum sludge[J]. Separation & Purification Technology, 51(2): 193-200. |
| Yuan Z, Pratt S, Batstone D J. 2012. Phosphorus recovery from wastewater through microbial processes[J]. Current Opinion in Biotechnology, 23(6): 878. DOI:10.1016/j.copbio.2012.08.001 |
| Zeng F, Jin W, Zhao Q. 2019. Temperature effect on extracellular polymeric substances (EPS) and phosphorus accumulating organisms (PAOs) for phosphorus release of anaerobic sludge[J]. RSC Advances, 9(4): 2162-2171. DOI:10.1039/C8RA10048A |
| 张超, 陈银广. 2010. 增强生物除磷系统中微生物及其代谢机制研究进展[J]. 环境科学与技术, 33(10): 86-90. |
| Zhang H, Bi Z, Pan Y, et al. 2020. Enhanced phosphorus storage in suspended biofilm by increasing dissolved oxygen[J]. ence of the Total Environment, 722: 137876. DOI:10.1016/j.scitotenv.2020.137876 |
| 章豪, 冯鑫, 单捷, 等. 2019a. 聚磷生物膜反应器磷负荷提升过程中微生物种群分析[J]. 环境科学学报, 39(11): 3764-3771. |
| 章豪, 高碧霄, 潘杨, 等. 2019b. 聚磷生物膜的快速启动及微生物特性研究[J]. 环境科学学报, 39(10): 3317-3324. |
| Zhang H L, Fang W, Wang Y P, et al. 2013a. Species of phosphorus in the extracellular polymeric substances of EBPR sludge[J]. Bioresource Technology, 142: 714-718. DOI:10.1016/j.biortech.2013.05.068 |
| Zhang H L, Fang W, Wang Y P, et al. 2013b. Phosphorus removal in an enhanced biological phosphorus removal process: roles of extracellular polymeric substances[J]. Environmental Science & Technology, 47(20): 11482-11489. |
| Zhang Z, Huang X. 2011. Study on enhanced biological phosphorus removal using membrane bioreactor at different sludge retention times[J]. International Journal of Environment & Pollution, 45(1/3): 15-24. |
