 , 王卅1,3, 郭书海1,3
, 王卅1,3, 郭书海1,3

1. 中国科学院沈阳应用生态研究所, 沈阳 110016;
2. 中国科学院大学, 北京 100049;
3. 污染土壤生物-物化协同修复技术国家地方联合工程实验室, 沈阳 110016
收稿日期: 2021-01-07; 修回日期: 2021-01-24; 录用日期: 2021-01-24
基金项目: 国家自然科学基金(No.21707150);国家重点研发计划项目(No.2018YFC1801900);辽宁省‘兴辽英才计划’项目(No.XLYC1802111)
作者简介: 荆佳维(1995—), 男, E-mail: jiawei95915@126.com
通讯作者(责任作者): 郭书海, E-mail: shuhaiguo@iae.ac.cn
摘要:石油污染改变土壤微生态环境,驱动了土壤微生物群落结构的演替与进化.为了深入探究油田区油污土壤中微生物群落分布特征,揭示区域性的土壤微生物群落结构成因,采用Miseq平台的16S rDNA扩增子测序技术分析了辽河油田和大庆油田区6组共计18个土壤样品的微生物群落多样性及结构组成,并结合土壤环境因子指标剖析了群落结构成因,进而预测了具有石油代谢能力的功能菌属.结果表明,石油含量随着距井口距离增加而减少,石油的空间分布特征是影响微生物群落结构变化的关键因子,6组土壤样品的OTU分属于49门、131纲、169目、328科和564属,微生物种群多样性随着污油浓度的增加而减小;两油田共有5个相同优势菌门,2种优势菌属;辽河油田区独特优势菌门为Saccharibacteria门,优势菌属为微枝形杆菌属(Microvirga)、分支杆菌属(Mycobacterium)和Defluviicoccus属;大庆油田独特优势菌门为拟杆菌门(Bacteroidetes),独特优势菌属包括盐单胞菌属(Halomonas)、食烷菌属(Alcanivorax)和海杆菌属(Marinobacter)等.冗余分析(RDA)结果表明污油组成是微生物群落差异性分布的决定性因素,胶质的高含量与强毒性诱导辽河油田区微生物群落获得较强的胁迫抗性;同时区域生态环境背景差异也是影响微生物群落整体胁迫抗性的重要因子.结合PICRUSt分析预测,共发现2种辽河油田区和5种大庆油田区石油功能降解优势菌属,为石油降解功能菌剂的种质资源的高效开发提供目标菌株.
关键词:油田土壤微生物群落环境因子污油组成高通量测序
Regional distribution of crude oil-contaminated soil microbial communities in typical oilfields
JING Jiawei1,2,3
 , WANG Sa1,3, GUO Shuhai1,3
, WANG Sa1,3, GUO Shuhai1,3

1. Institute of Applied Ecology, Chinese Academy of Sciences, Shenyang 110016;
2. University of Chinese Academy of Sciences, Beijing 100049;
3. National-Local Joint Engineering Laboratory of Contaminated Soil Remediation by Bio-physicochemical Synergistic Process, Shenyang 110016
Received 7 January 2021; received in revised from 24 January 2021; accepted 24 January 2021
Abstract: Petroleum pollution changes the soil microecological environment and drives the succession and evolution of soil microbial community structure. To explore the distribution characteristics of microbial community in oilfield soil,and reveal the causes of the formation of regional soil microbial community structure,the microbial community diversity and structure of 18 soil samples from 6 groups in Liaohe oilfield and Daqing oilfield are analyzed by Miseq16S rDNA sequencing technique. Then combining with the index of soil environmental factors,the causes of community structure are analyzed,and the functional bacteria with the ability of petroleum metabolism are predicted. The results showed that the petroleum content decreases with the increase of the distance from the oil well,and the spatial distribution of petroleum is the key factor affecting the change of microbial community structure. The OTUs of the 6 soil sample groups belong to 49 phyla,131 classes,169 orders,328 families and 564 genera. The diversity of microbial population decreases with the increase of petroleum pollution. There are 5 same dominant phyla and 2 dominant genera in the two oilfields. The unique dominant phylum in Liaohe oilfield is Saccharibacteria,and the dominant genera are Microvirga,Mycobacterium and Defluviicoccus. The unique dominant phylum in Daqing oilfield is Bacteroidetes,and the dominant genera are Halomonas,Alcanivora,Marinobacter,etc. The results of redundancy analysis (RDA) showed that the composition of oil was the decisive factor for the differential distribution of microbial community. The high content and strong toxicity of colloid induce the microbial community in Liaohe oilfield to acquire strong stress resistance. At the same time,the background difference of regional ecological environment is also an important factor affecting the overall stress resistance of microbial community. Combining with the PICRUSt analysis,predict 2 dominant genera of petroleum degradation in Liaohe oilfield and 5 in Daqing oilfield. It provids a target reference for the efficient development of petroleum degradation functional germplasm resources.
Keywords: oilfield soilmicrobial communityenvironmental factorspetroleum compositionhigh-throughput sequencing
1 引言(Introduction)陆上石油开采区土壤普遍存在石油污染, 由于微生物的种群特征受底物种类和浓度的影响, 导致土壤微生物群落发生不同程度的变化.石油作为特征污染底物, 其侵入土壤中会封闭土壤孔隙, 进而影响土壤含氧量, 使得好氧微生物活性降低, 同时石油类污染物会影响土壤酶活性, 影响微生物的代谢能力, 有些微生物可以利用石油烃作为碳源迅速生长, 而有些微生物由于石油的毒害作用生长受到抑制, 从而影响了土壤微生物群落的丰度和多样性(王梅等, 2010; Khan et al., 2018;张泽霆等, 2019; Koshlaf et al., 2019; 徐春燕等, 2020).Gao等(2015)对黄河三角洲石油污染土壤的研究发现, 土壤中微生物多样性与石油烃浓度呈正相关, 放线菌门、厚壁菌门和栖热菌门是该区域的优势菌群.Nakatsu等(2007)研究发现, 土壤中微生物多样性与多环芳烃浓度呈负相关, 石油污染使得油井周边土壤中的优势菌群发生了改变.甄丽莎等(2015)研究发现, 黄土高原土壤微生物多样性会随着石油含量的增加而降低, 其原因在于一定浓度的石油污染可以刺激土壤微生物群落中具有石油污染物降解能力的优势种群的生长, 而对其耐受性较差的微生物种群生长受到抑制被逐渐淘汰.由此可见, 石油对土壤的污染过程造就了差异化的土壤微生物群落特征, 并提供了潜在的特异性种质来源.
针对土壤微生物群落特征的分析, 已有研究多采用磷脂脂肪酸(PLFA)、变性梯度凝胶电泳(DGGE)、醌指纹和高通量扩增子测序等技术, 其中PLFA法通过分析微生物细胞结构的稳定组分(PLFA)的种类及组成比例来鉴别土壤微生物结构多样性, 但PLFAs并不能与土壤微生物物种一一对应, 且总体种类较少(姚晓东等, 2016);DGGE法通过分析差异化的16S rDNA碱基序列揭示微生物细菌群落结构组成, 但由于其分离DNA片段大小限制在100~500 bp, 故分析序列量非常有限(马悦欣等, 2003);醌指纹法通过环境中微生物醌的组成来反映微生物群体组成, 但其不能反映到属水平(胡洪营等, 2002).随着现代分子生物学研究的发展, 第二代测序(next generation sequencing, NGS)技术因其具有低成本、高通量、速度快、精度高等优点, 已被广泛应用于土壤微生物组成特征分析(张春兰等, 2012; 郭魏等, 2017; 施昊坤等, 2020).顾磊等(2017)应用高通量测序技术研究了玉北油田油气富集带微生物的丰度、分布和群落结构等特征, 并鉴定出假单胞菌属、芽孢杆菌属和土壤杆菌属是该区域利用烃类兼性生长的优势微生物.杨琴等(2015)应用高通量测序技术对长庆油田石油污染土壤的石油降解菌群研究发现, 该区域检测到包括变形菌门、放线菌门和厚壁菌门等24个门的细菌, 土壤菌群结构由于长期受石油污染的选择压力而发生了明显改变.
尽管目前对于特定油田区土壤微生物群落特征研究已有一定研究基础, 然而针对于具有地带性差异的不同油田区的土壤微生物群落的对比研究还存在不足, 尚未清晰认知石油污染背景下的油田区土壤微生物群落地带性特征, 及其与环境因子的互作关系.辽河油田地处辽宁省盘锦市, 属暖温带半湿润大陆性季风气候区, 年平均气温约10 ℃, 年降水量约650 mm, 大庆油田地处黑龙江省大庆市, 属北温带半干旱大陆性季风气候区, 年平均气温约5 ℃, 年降水量约425 mm, 两油田所处地理环境的特征具有较显著的地带性差异.对此, 本研究通过采集辽河油田和大庆油田的石油污染土壤样品, 借助高通量扩增子测序技术, 展开以下研究:①了解不同石油污染环境下土壤微生物的群落结构特征;②预测土壤中具有石油降解功能的功能菌群;③揭示不同油田区土壤生境条件与石油污染土壤微生物群落特征的互作关系, 为不同油田区石油污染土壤微生物群落的地带性分布研究从微生物地理学角度提供初步的理论基础和方法学探索.与此同时, 油田区特异性的微生物群落构成特征也为进一步的功能微生物种质资源的开发与利用提供理论指导, 以便准确高效的获取具有底物代谢特异性的石油多组分降解功能菌株, 促进微生物修复技术的深入发展.
2 材料与方法(Materials and methods)2.1 土壤样品采集供试土样分别采自开采20年以上年限的辽河油田某油井(41°04′39″N, 121°43′20″E)和大庆油田某油井(46°31′36″N, 124°58′02″E)周边.样品于2019年10月采集完成, 采集方法为以井口为中心, 通过放射状布设采样点位(图 1), 分别采集距井口0、10、20 m处表层(10~20 cm)土壤样品, 样品编号:辽河油田样品记为L1-1、L1-2、L1-3、L2-1、L2-2、L2-3、L3-1、L3-2、L3-3, 大庆油田样品记为D1-1、D1-2、D1-3、D2-1、D2-2、D2-3、D3-1、D3-2、D3-3, 并将样品按照距井口距离进行分组, 即划分为6个样品组:L1组(L1-1、L1-2、L1-3)、L2组(L2-1、L2-2、L2-3)、L3组(L3-1、L3-2、L3-3)、D1组(D1-1、D1-2、D1-3)、D2组(D2-1、D2-2、D2-3)和D3组(D3-1、D3-2、D3-3).采样日前10 d内无降水, 采样地无积水, 地表为无植被覆盖的油田区典型原状土壤, 采集的样品可以反映采样区土壤性质的常态.样品采集后分成两部分, 一部分保存在4 ℃条件下, 用于污油含量和土壤理化性质等指标测定, 另一部分于-20 ℃条件下保存, 用于土壤微生物群落分析.
图 1(Fig. 1)
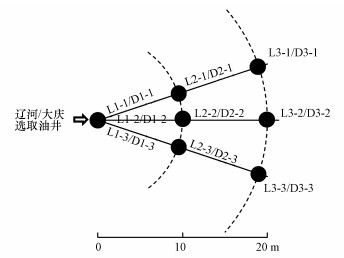 |
| 图 1 采样点示意图 Fig. 1Map of sampling sites |
2.2 土壤污油含量及族组分测定土壤中污油含量采用重量法测定(王如刚等, 2010).准确称取4 g过0.25 mm孔径筛的土壤样品混入于15 mL三氯甲烷中, 振荡处理30 min, 静置8 h, 55 ℃水浴加热1 h, 再于4500 r·min-1条件下离心5 min, 取上清液过滤至已称至恒重的干燥烧杯(m0)中, 剩余土壤参照上述流程重复提取2次, 收集合并提取液, 风干后称重(m1), 土壤样品含油量(R)计算公式如下:
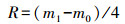 | (1) |
2.3 土壤理化性质测定参照《土壤农业化学分析方法》(鲁如坤, 1999), 土壤pH测定时以土水比1∶2.5(m∶V)混合振荡30 min后用pH计测定;土壤含水率采用烘干法(105 ℃)测定;总有机碳(TOC)测定时, 将过60目筛的土样经盐酸酸化去除无机碳后, 再使用总有机碳/总氮分析仪(Multi N/C 3100)测定;总氮(TN)采用凯式法测定;总磷(TP)采用碱熔-钼锑抗比色法测定.
2.4 土壤微生物DNA提取和高通量测序使用FastDNA Spin Kit for Soil试剂盒提取土壤微生物总DNA.对16S rRNA基因的V3~V4区进行PCR扩增, 引物选择341F(5′-ACTCCTACGGGAGG CAGCAG-3′)和806R(5′-GGACTACHVGGGTWTC TAAT-3′).PCR反应体系(25 μL)为:土壤总DNA 30 ng、引物341F/806R(5 μmol·L-1)各1 μL、BSA(2 ng·μL-1)3 μL、2×Taq Plus Master Mix 12.5 μL、ddH2O调整PCR总体积至25 μL.扩增条件为:94 ℃预变性5 min, 94 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸1 min, 共计28个扩增循环, 72 ℃最终延伸7 min.PCR反应产物用1%琼脂糖凝胶电泳检测.高通量测序委托北京奥维森基因科技有限公司通过Illumina Miseq测序平台完成.测序结果已上传至SRA数据库(BioProject ID:PRJNA691428).
2.5 数据处理和分析在Illumina Miseq测序平台得到的下机数据(Raw PE), 用Trimmomatic 0.36、Pear 0.9.6和Flash 1.20软件进行质量控制, 过滤低质量的fastq数据并拼接后得到raw tags, 再通过Vsearch 2.7.1软件去除嵌合体, 得到优质序列clean tags, 采用Uparse方法进行OTU (Operational taxonomic units)聚类分析, 对比Silva 16S rRNA数据库, 采用RDP Classifier贝叶斯算法对97%相似度水平的OTU代表序列进行分类学分析, 统计各样品的群落组成.基于OTU聚类结果计算各项Alpha多样性指数.利用Calculate and draw custom Venn diagrams(http://bioinformatics.psb.ugent.be/webtools/Venn/)绘制维恩图.非度量多维尺度分析(NMDS)和物种丰度聚类热图使用R 3.5.2软件vegan和ggplot2等软件包完成.冗余分析使用Canoco 5.02软件(Microcomputer Power公司, 美国)完成.功能预测分析使用PICRUSt 1.1.4软件完成.相关性分析和显著性检验使用SPSS 19.0软件(IBM公司, 美国)进行计算分析.部分图件使用Origin 2019b软件(OriginLab公司, 美国)绘制.
3 结果与分析(Results and analysis)3.1 土壤石油污染特征分析不同土壤样品组的石油含量和各组分占比情况见表 1.两个油田土壤样品组中L1和D1的石油含量最高, 分别达到14.50 g·kg-1和7.23 g·kg-1, 两个油田中土壤石油浓度L1>L2>L3、D1>D2>D3, 说明辽河油田和大庆油田油井周边土壤中石油含量随着距井口距离的增加而减小.族组分分析表明, 辽河油田污油组分中胶质所占比例最高, 胶质和沥青质总量平均占比达54.36%±1.82%, 高于大庆油田(42.99%±0.67%), 而烷烃所占比例仅为30.86%±4.52%, 显著低于大庆油田(36.33%±3.34%)(p<0.01).
表 1(Table 1)
| 表 1 不同土壤样品组中石油含量和土壤理化性质 Table 1 Oil content and physicochemical properties of soils | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 不同土壤样品组中石油含量和土壤理化性质 Table 1 Oil content and physicochemical properties of soils
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.2 土壤理化性质分析不同土壤样品组的土壤理化性质见表 1.辽河油田和大庆油田土壤样品组中pH和含水量比较均呈L1<L2<L3、D1<D2<D3的趋势, 而TOC含量则为L1>L2>L3、D1>D2>D3, 表明两个油田土壤的pH和含水率都随着距井口距离的增加而增大, TOC含量则随着距井口距离的增加而减小.两个油田土壤的TN和TP含量较高, 且在距井口不同距离的位置没有明显差别(p>0.05).辽河油田土壤中的N、P营养元素含量显著高于大庆油田(p<0.05).土壤样品的污油属性和理化性质指标的相关性分析结果如表 2所示, 结果表明, 土壤中石油含量与TOC含量呈显著正相关, 与pH和含水量分别呈负相关;TN、TP含量与烷烃和芳烃组分占比分别呈负相关, 而与胶质组分占比呈正相关.
表 2(Table 2)
| 表 2 污油属性和土壤理化性质指标的相关性分析 Table 2 Correlation analysis of oil attributes and soil physicochemical properties | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2 污油属性和土壤理化性质指标的相关性分析 Table 2 Correlation analysis of oil attributes and soil physicochemical properties
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.3 高通量测序数据处理及OTU聚类分析高通量测序数据处理过程中得到的序列统计及各样品的OTU数目如表 3所示, 各样品组的OTU数目通过比较整合各单样本OTU数目获得.两个油田内土壤样品组的OTU数目呈现L1<L2<L3, D1<D2<D3, 表明随着距井口距离的增大, 土壤中OTU数目减少, 即微生物种类数目下降.
表 3(Table 3)
| 表 3 测序数据处理统计 Table 3 Sequencing data processing statistics | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 3 测序数据处理统计 Table 3 Sequencing data processing statistics
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
不同土壤样品组间共有和独有的OTU数目分析如图 2所示, 图中单个点对应的条形图表示该组独有的OTU数目, 连线点对应的条形图表示相应的样品组共有的OTU数目.针对两个油田区内OTU数目分析表明, 辽河油田3个样品组共有的OTU数目为345个, L1与L2、L1与L3、L2与L3分别共有的OTU数目为585个、410个和1320个;大庆油田3个样品组共有的OTU数目为1065个, D1与D2、D1与D3、D2与D3分别共有的OTU数目分别为1247个、1190个和2132个.由此可见, 在两个油田区中, L1和D1样品组的OTU数目均与距井口较远处的样品组存在较显著的差异(p<0.05).进一步地, 在两个油田区之间的OTU数目分析中, 6组样品共有的OTU数目为237个, L1与D1共有的OTU数目为457个, L3与D3共有的OTU数目为1410个, 表明在两个油田区距井口相同距离处的样品, 群落结构既有一定的差异性, 也具有相似的特征.这种油田区内部及油田区间的微生物群落特征差异可能来源于石油污染物的胁迫程度及环境因素的影响.
图 2(Fig. 2)
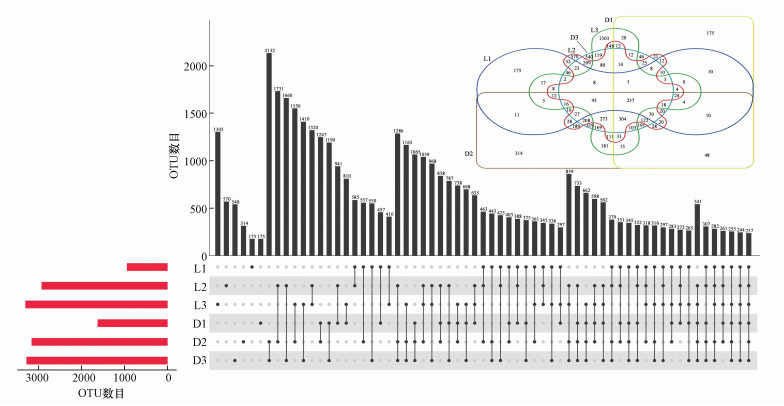 |
| 图 2 OTU分布维恩图 Fig. 2Venn diagram of OTU distribution |
3.4 微生物群落多样性分析各样品组的α多样性分析指数计算结果如表 4所示.Chao1指数和Shannon指数的大小分别代表样品总体物种的丰度和多样性(王广春等, 2017), 两指数均呈现L1<L2<L3, D1<D2<D3的趋势, 表明两个油田土壤样品的微生物群落多样性随着距井口距离的增加而增大.PD whole tree指数越大说明物种对进化历史保存的差异越大, 所反映的规律与Chao1和Shannon指数计算结果一致.
表 4(Table 4)
| 表 4 各样品组各项α多样性指数 Table 4 The Alpha diversity index of the sample group | ||||||||||||||||||||||||||||
表 4 各样品组各项α多样性指数 Table 4 The Alpha diversity index of the sample group
| ||||||||||||||||||||||||||||
3.5 微生物群落结构分析各土壤样品OTU水平的NMDS分析结果如图 3所示, 不同样品组内的3个样品均呈聚集状分布, 表明各个样品组内的样品间具有相似的群落特征, 即组内样品间数据重复性较好;L1和D1样品组与其他样品组的距离较远, 表明L1和D1与其他样品组相比有较显著的群落差异, 且L1和D1之间也有一定的群落差异性, Adonis检验进一步证明了组间的显著差异性, 同时Anoism检验反映了组间比组内更显著的差异分布.NMDS的stress系数小于0.2, 表明图中反映的样本差异信息极其可信.
图 3(Fig. 3)
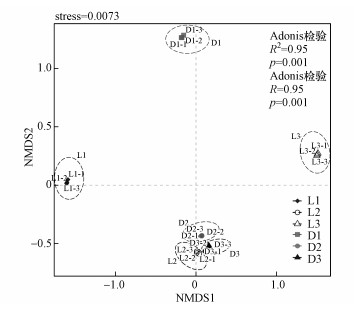 |
| 图 3 OTU水平土壤微生物NMDS分析 Fig. 3NMDS analysis of soil microorganisms at OTU level |
针对各土壤样品中微生物群落进行不同分类水平的结构分析, 两个油田区中6个土壤样品组的OTUs分属于49个门、131个纲、169个目、328个科和564个属.
门水平下的细菌分类如图 4所示, 6组土壤样品中相对丰度较高的门水平微生物主要包括变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、Saccharibacteria门、厚壁菌门(Firmicutes)、芽单胞菌门(Gemmatimonadetes)、硝化螺旋菌门(Nitrospirae)、浮霉菌门(Planctomycetes)、蓝藻门(Cyanobacteria)和Aminicenantes门.相对丰度均低于1%的菌门合并为others类别.其中变形菌门(Proteobacteria)在L1、L2、L3、D1、D2、D3组中相对丰度分别为24.52%、23.76%、34.68%、55.70%、27.84%、29.25%, 表现为优势菌门, 反映了其对两个油田的不同土壤环境都具有较强的适应性;然而在单一油田区内呈现不同的分布特征, 表现为在辽河油田土壤中距井口越远其相对丰度越高, 而在大庆油田土壤中呈现相反趋势.放线菌门(Actinobacteria)在6个样品组中同样表现出了丰度优势, 分别为18.29%、10.90%、13.27%、8.27%、22.20%、25.06%, 在单一油田区内表现为在辽河油田土壤中距井口越远其相对丰度越低, 而在大庆油田土壤中呈相反趋势.此外, 绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)和硝化螺旋菌门(Nitrospirae)在6个样本组中均有一定丰度, 并表现出一致性的距井口距离增加相对丰度升高的趋势.特别地, 拟杆菌门(Bacteroidetes)在D1样品组中相对含量高达22.68%, 高于其他样品组, 反映了其对大庆油田高浓度石油污染土壤环境特有的适应性, 以及对辽河油田土壤环境的不耐性.Saccharibacteria门在L1样品组中相对含量高达29.40%, 显著高于其他样品组.
图 4(Fig. 4)
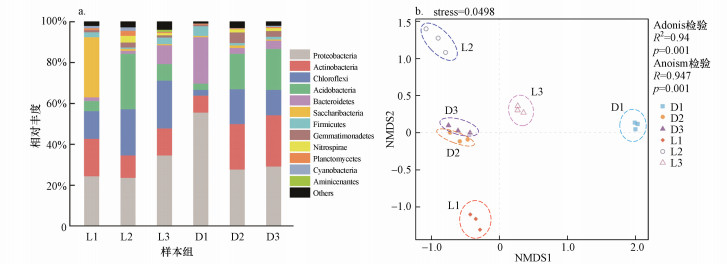 |
| 图 4 门水平的群落结构组成分布(a)及NMDS分析(b) Fig. 4Bacterial community structure (a) and NMDS analysis (b) at phylum level |
属水平下的细菌分类如图 5所示, 将相对丰度均低于1%的菌属合并为others.食烷菌属(Alcanivorax)、海杆菌属(Marinobacter)、Idiomarina属、Salinimicrobium属、盐单胞菌属(Halomonas)和Bradymonas属的相对丰度在D1样品组中较高, 分别为22.36%、12.82%、3.27%、2.94%、2.75%和1.57%, 但在辽河油田等其他样品组中相对丰度较低(除食烷菌属在D2中为0.87%外, 均低于0.2%).分支杆菌属(Mycobacterium)、Defluviicoccus属、Fontimonas属、Perlucidibaca属、Flavisolibacter属和Patulibacter属的相对丰度在L1样品组中较高, 分别为8.91%、2.95%、1.44%、1.30%、1.11%和1.14%, 但在大庆油田等其他样品组中相对丰度较低(除分支杆菌属在D2中为3.42%外, 均低于0.3%).Pseudarthrobacter属、鞘氨醇单胞菌属(Sphingomonas)、RB41菌和H16菌在各样品组中均具有一定含量占比, 其相对丰度随着距井口距离的增加而降低.溶杆菌属(Lysobacter)、硫杆菌属(Thiobacillus)、Gillisia属、厌氧绳菌属(Anaerolinea)、Pedobacter属、Arenimonas属和Polaromonas属的相对丰度在辽河油田L3样品组中较高, Rubrobacter属和假单孢菌属(Pseudomonas)的相对丰度在大庆油田D3样品组中较高, 且均随着距井口距离的减少而减小, 反映了其对不同油田区低浓度石油污染土壤背景环境的适应性.微枝形杆菌属(Microvirga)的相对丰度在辽河油田样品中随着距井口距离的增加而减小, 但在大庆油田样品中却呈现相反的趋势.
图 5(Fig. 5)
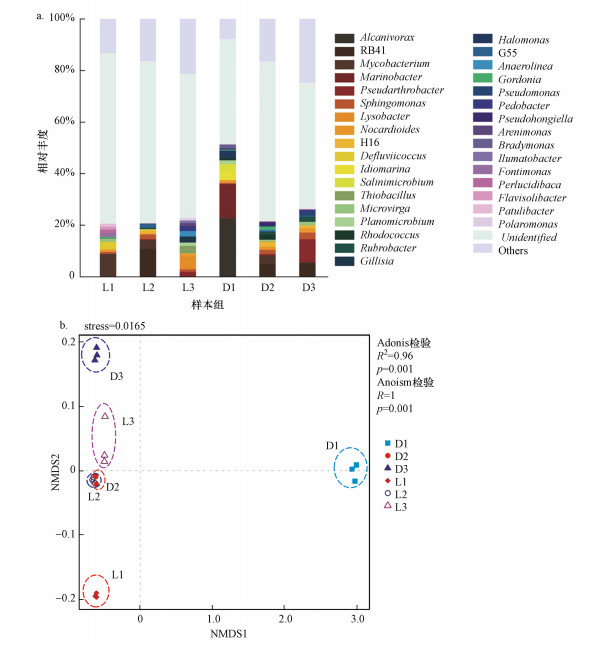 |
| 图 5 属水平的群落结构组成分布(a)及NMDS分析(b) Fig. 5Bacterial community structure (a) and NMDS analysis (b) at genus level |
在属水平上对6个样品组中相对丰度最高的20种优势菌属进行聚类分析(图 6), 所选择的菌属基本反映各样品组的微生物群落分布特征.结果表明, D2、D3和L2群落组成具有一定相似性, L1和L3间、L1和D1间均存在明显的群落分布差异, 其与NMDS分析结果(图 3)一致.鞘氨醇单胞菌属(Sphingomonas)和类诺卡氏属(Nocardioides)2属细菌在6组土壤中均有大量分布, 且分布较为均匀.Defluviicoccus属、微枝形杆菌属(Microvirga)和分支杆菌属(Mycobacterium)主要集中在辽河油田高浓度石油污染土壤中.Salinimicrobium属、盐单胞菌属(Halomonas)、Idiomarina属、游动球菌属(Planomicrobium)、食烷菌属(Alcanivorax)和海杆菌属(Marinobacter)主要集中在大庆油田高浓度石油污染土壤中.
图 6(Fig. 6)
 |
| 图 6 属水平的物种丰度聚类热图 Fig. 6Species abundance cluster heatmap at genus level |
3.6 细菌群落与石油污染特征及土壤理化性质的关系图 7a为土壤微生物群落与土壤理化指标的冗余分析结果排序图, 第一主轴和第二主轴分别解释了总方差变量的39.68%和20.58%.第一主轴上, pH是主要的影响因子, 第二主轴上总有机碳和含水量是主要的影响因子.具体分析表明, 与辽河油田细菌群落相关性较大的土壤理化指标是含水率和TOC含量, 与大庆油田细菌群落相关性较大的土壤理化指标是pH.分支杆菌属(Mycobacterium)和Defluviicoccus属与TOC含量呈正相关, 推测其对有机底物具有良好的代谢潜能.Pseudarthrobacter属、溶杆菌属(Lysobacter)和硫杆菌属(Thiobacillus)与含水量呈正相关.鞘氨醇单胞菌属(Sphingomonas)和RB41菌与pH呈正相关, 而海杆菌属(Marinobacter)、盐单胞菌属(Halomonas)、Idiomarina属、Salinimicrobium属和食烷菌属(Alcanivorax)则与pH呈负相关.各样本的分布特征与样本组的土壤理化性质分析结果(表 1)一致, 各菌属及各样本的分布特征与样本组内群落组成分析结果(图 5)一致.
图 7(Fig. 7)
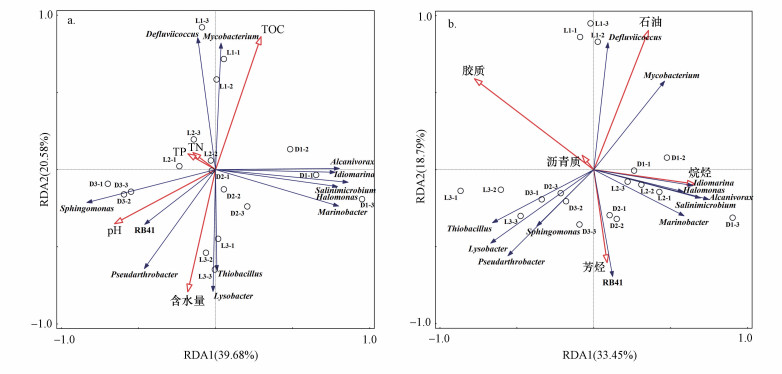 |
| 图 7 土壤微生物群落与土壤理化指标(a)及石油污染特征(b)的冗余分析 Fig. 7Redundancy analysis of soil microbial community and physicochemical(a) and soil pollution(b) characteristic |
图 7b为土壤微生物群落与石油污染特征指标的冗余分析结果排序图, 第一主轴和第二主轴分别解释了总方差变量的33.45%和18.79%.第一主轴上, 烷烃和胶质含量是主要的影响因子, 第二主轴上, 石油和芳烃含量是主要的影响因子.具体分析表明, 石油含量与辽河油田细菌群落分布相关性较大, 胶质含量与大庆土壤组样品群落分布呈负向相关, 烷烃含量与大庆油田细菌群落分布呈正向相关.分支杆菌属(Mycobacterium)和Defluviicoccus属与石油含量呈正相关, 说明这2种菌能够适应高浓度的石油污染环境, 可能具有较好的利用石油的能力.Pseudarthrobacter属、溶杆菌属(Lysobacter)、硫杆菌属(Thiobacillus)、鞘氨醇单胞菌属(Sphingomonas)和RB41菌与石油含量呈负相关, 说明高浓度的石油污染对这5种菌属在土壤中的生长起抑制作用.海杆菌属(Marinobacter)、盐单胞菌属(Halomonas)、Idiomarina属、Salinimicrobium属和食烷菌属(Alcanivorax)与烷烃含量呈正相关, 同时与胶质和沥青质的含量呈负相关, 说明这5种菌属可能具有良好的利用烷烃的能力, 却很难利用石油中的胶质和沥青质组分.各样本的分布特征与样本组的石油污染特征结果(表 1)一致, 各菌属及各样本的分布特征与样本组内群落组成分析结果(图 5)一致, 从而表明RDA图中分布距离较大的菌属是构成样品差异性的主要贡献者.
3.7 PICRUSt功能预测PICRUSt功能预测分析可以通过OTU预测群落的基因类型与数量, 再结合KEGG数据库的注释, 从而完成功能预测(Langille et al., 2013).通过PICRUSt功能基因预测得到的KEGG1级通路中的基因相对丰度结果如图 8a所示.各土壤样品组中与代谢相关的功能基因丰度最高, 均超过50%, 其中有关碳水化合物代谢和氨基酸代谢的功能基因丰度最高, 其次为有关异生物素的生物降解和代谢的功能基因丰度, 其中的部分功能基因与石油类污染物的降解和代谢相关.两个油田样品中有关遗传信息处理的功能基因丰度L1<L2<L3, D1<D2<D3, 说明石油污染程度对土壤微生物的生长产生影响.两个油田土壤样品中有关氨基酸代谢和有关异生物素的生物降解和代谢的功能基因丰度, L1和D1分别高于同油田中其他样品, 说明石油污染可能对功能微生物的聚集产生影响.
图 8(Fig. 8)
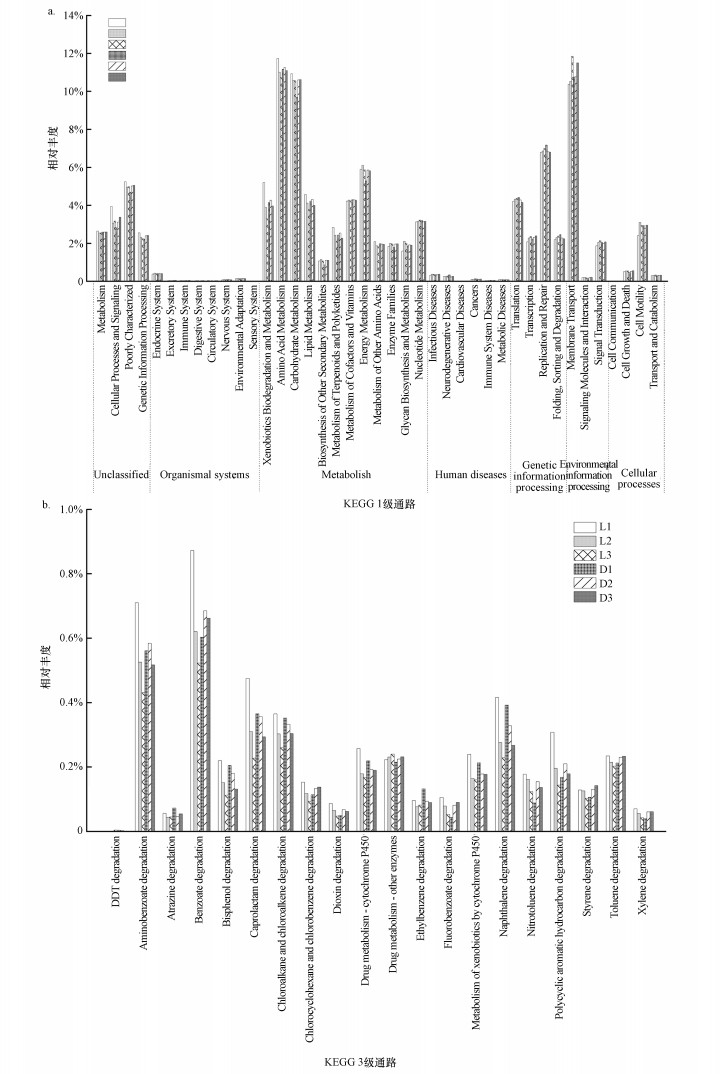 |
| 图 8 KEGG 1级(a)及KEGG 3级(b)通路注释结果 Fig. 8KEGG pathway at level 1(a) and 3(b) |
通过PICRUSt功能基因预测得到的KEGG 3级通路(有关异生物素的生物降解和代谢)中的有关石油降解的基因相对丰度结果如图 8b所示.各样品中, 有关萘降解、己内酰胺降解、氯烷和氯烯降解、双酚降解的功能基因, L1>L2>L3, D1>D2>D3.有关氨基苯甲酸、苯甲酸降解、硝基甲苯降解、多环芳烃降解、甲苯降解和二甲苯降解的功能基因, L1高于同油田内其他样品组, D1则低于同油田内其他样品组.说明石油污染影响了具有有机污染物降解功能的微生物的分布.
4 讨论(Discussion)4.1 油田土壤理化特性及石油污染特征本研究发现, 油田内土壤受石油污染程度随着距井口距离的增加而减小, 张海玲等(2014)的研究结果表明油田土壤中石油含量随着距油井水平距离的增大而减少.土壤中含水率和pH随着石油含量的减小而增大, 贾建丽等(2009)的研究结果表明, 石油的强疏水性会导致具有高浓度石油含量土壤的疏水性较高, 土壤储水能力减弱, 含水率降低.刘五星等(2007a)对南京某油井周边土壤研究发现石油污染会引起土壤pH的下降, 这与本研究的结果一致.土壤中总有机碳含量在距离油井近处更高, 这是因为由于采油活动产生的石油污染导致了土壤碳源的增加, 而总氮和总磷的含量在同一油田内各位置的差异不大, 这与刘五星等(2007b)和王传远等(2010)的研究结果相似.辽河油田污油与大庆油田污油的组分相比, 辽河油田污油组分中胶质和沥青质的占比更高, 这是因为辽河油田开采的原油主要是稠油, 而大庆油田开采的原油主要是轻质油, 并且辽河油田开采的主要是环烷基原油, 而大庆油田为石蜡基原油, 因此两油田土壤污油中烷烃组分占比都远高于芳烃.微生物在利用石油烃类碳源(烷烃和芳烃)时会消耗土壤中的N、P, 因此土壤中烷烃和芳烃含量占比与TN、TP含量呈负相关, 而胶质由于生物可利用性较低, 故呈现相反趋势.辽河油田土壤中的N、P含量高于大庆油田, 这为土壤微生物的生长提供了更多的营养物质, 与此同时, 盘锦市属暖温带大陆性半湿润季风气候区, 气候温度适宜, 降水充沛, 而大庆市地处北温带亚干旱季风气候区, 冬季漫长, 全年降水较少, 故辽河油田地区生态环境为微生物提供了更优质的生存条件, 使其微生物群落具有较强的抗胁迫能力.
4.2 油田土壤微生物群落结构特征6个样品组的OTU数目统计及多样性指数分析结果表明, 油田区土壤的微生物多样性随着距井口距离的减小而降低, 究其原因主要为碳源及环境条件的不同, 特定的微生物只能实现有限的石油烃类污染物的降解(马思佳等, 2017), 井口处土壤微生物在高浓度石油污染胁迫作用下多样性降低.辽河油田和大庆油田的污油组成具有一定差异, 其烃类含量及种类均很复杂, 可诱导产生一定数目的稀有菌属, L1和D1土壤样品组中独有的OTU数量可以对此有所佐证.
将在井口处样品中相对丰度较高的物种视为高强度石油污染胁迫下的优势菌, 而在非井口处样品中相对丰度较高的物种则为低强度石油污染胁迫下的优势菌, 两个油田区的优势菌门和菌属的对比结果见图 9.两个油田区相同的优势菌门有变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)和硝化螺旋菌门(Nitrospirae), 相同的优势菌属为Pseudarthrobacter属和鞘氨醇单胞菌属(Sphingomonas), 其中变形菌门(Proteobacteria)在辽河油田土壤中距井口越远其相对丰度越高, 而在大庆油田中则呈现相反趋势, 说明该菌门可能对烷烃具有较好的亲和力, 但对胶质和沥青质组分有一定程度的不耐受性;而放线菌门(Actinobacteria)在两个油田区中的分布趋势与前者相反, 说明其本身对石油具有一定代谢能力, 故在辽河油田油井下表现出更高的相对丰度, 但在大庆油田区中由于土壤石油污染浓度相比较低, 所提供的特异性碳源不足, 故使其表现出在距井口远处相对丰度更高的现象;此外, 绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、硝化螺旋菌门(Nitrospirae)、Pseudarthrobacter属和鞘氨醇单胞菌属(Sphingomonas)细菌的生长受到了石油污染的抑制影响, 呈现出相对丰度随着距井口距离的增加而降低的现象.大庆油田区高浓度石油污染土壤环境中独有的优势菌门为拟杆菌门(Bacteroidetes), 优势菌属包括食烷菌属(Alcanivorax)、海杆菌属(Marinobacter)、Idiomarina属、Salinimicrobium属、盐单胞菌属(Halomonas)和Bradymonas属, 它们可能具有良好的烷烃代谢能力.辽河油田区高浓度石油污染土壤环境中独有的优势菌门为Saccharibacteria门, 优势菌属包括分支杆菌属(Mycobacterium)、Defluviicoccus属、Fontimonas属、Perlucidibaca属、Flavisolibacter属和Patulibacter属, 它们可能不仅对石油有较好的代谢能力, 同时对胶质和沥青质组分有良好的耐受能力.此外, 溶杆菌属(Lysobacter)、硫杆菌属(Thiobacillus)、Gillisia属、厌氧绳菌属(Anaerolinea)、Pedobacter属、Arenimonas属、Polaromonas属等7种菌属和Rubrobacter属、假单孢菌属(Pseudomonas)2种菌属细菌分别在辽河油田区和大庆油田区中表现出对低浓度石油污染土壤背景环境的适应性, 以上菌属细菌生长可能受石油污染的明显抑制作用.
图 9(Fig. 9)
 |
| 图 9 两个油田门水平(a)和属水平(b)优势菌比较 (△表示0.01水平下与同油田区内井口处(L1和D1)其他物种相对丰度相比有显著差异;*表示0.01水平下与同油田区内非井口处(取L2和L3、D2和D3中的最大值)其他物种相对丰度相比有显著差异) Fig. 9Comparison of dominant bacteria in two oil fields at phylum (a) and genus (b) level |
祁燕云等(2019)的研究发现, 石油污染土壤强化修复后, 厚壁菌门(Firmicutes)丰度明显增加, 变形菌门(Proteobacteria)丰度明显减少, 优势菌属由微小杆菌属(Exiguobacterium)和原小单胞菌属(Promicromonospora)转变为类诺卡氏菌属(Nocardioides)和芽孢杆菌属(Bacillus).李晓楼(2017)的研究表明, 长期受石油污染的土壤中优势菌群为酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、浮霉菌门(Planctomycetes)和变形菌门(Proteobacteria).杨萌青等(2013)研究发现盐单胞菌属(Halomonas)是石油污染土壤中的优势菌属. 赵明阳等(2019)研究发现, 辽河油田部分采油厂周边土壤中的优势菌属包括鞘氨醇单胞菌属(Sphingomonas)、溶杆菌属(Lysobacter)、硫杆菌属(Thiobacillus)和Pseudarthrobacter属等.赵思宇(2019)的研究表明, 变形菌门(Proteobacteria)和放线菌门(Actinobacteria)是盘锦原生态土壤中的优势菌门, 该区域受到污染后变形菌门(Proteobacteria)和放线菌门(Actinobacteria)会更快对变化的环境做出响应.杜滢鑫等(2016)的研究表明, 变形菌门(Proteobacteria)和酸杆菌门(Acidobacteria)是大庆原生态土壤中的优势菌门, 其在受到污染影响后会更快对变化的环境做出响应.李倩等(2011)分离出的1株海杆菌属(Marinobacter)细菌具有良好的正构烷烃降解能力.牛之欣等(2005)的研究结果指出, 放线菌门(Actinobacteria)对胶质具有一定的降解能力.上述结果与本研究结果基本一致.RDA分析结果(图 7)中各菌属和各样本的分布特征也验证了此前的分析和推测.此外, 菌与菌之间的互作关系也是影响土壤群落组成的因素.杨智临等(2014)研究发现, 红球菌属(Rhodococcus)和类诺卡氏菌属(Nocardioides)可以共代谢石油污染土壤中的萘和菲.综上所述, 土壤微生物群落分布同时受碳源、环境因子和菌间互作关系等因素的影响, 其中碳源组成是最主要的因素.
土壤微生物群落结构与非生物因素的影响密不可分(杨智等, 2017).石油类污染物进入土壤后对生态环境的影响首先表现为土壤微生物数量和群落结构组成的改变, 不同地区石油污染条件下, 可胁迫发展出差异较大的土壤微生物群落结构(Lee et al., 2018).NMDS分析结果(图 3)显示, L1和D1与其他样品组相比有较显著的群落差异, 这可能是由于高浓度的石油胁迫造成的;L2、D2、D3样品组间由于受石油污染胁迫程度相对较小, 且土壤理化特征具有一定相似性, 故具有相似的群落特征;而L3与其他样品组间的群落差异推测是由于土壤含水率不同造成的;此外, L1和D1间的群落差异推测是来源于污油组分的差异.以上结果在RDA分析(图 7)时得到佐证.由此可见, 代谢基质中不同碳源的构成引起了群落结构的差异, 而当碳源结构相似时, 如同一油田区距井口较远处的多个样品组间(L2、D2、D3), 尽管pH、TN、TP等土壤环境因子有所差异, 但是土壤微生物群落组成仍然保持较高的相似度(图 3), 进一步诠释了碳源底物在微生物群落结构建成中的主导作用.
4.3 不同污油组成对微生物群落构成的影响王金成等(2012)对土壤微生物群落多样性与环境因子相关性的研究表明, 尽管石油及环境因子(pH、含水率、TP、TN等)对土壤微生物群落多样性的影响属于协同作用机制, 但石油是最主要的影响因子.辽河油田和大庆油田污油族组分及其含量差异明显, 特别是烷烃和胶质的含量.其中, 烷烃作为可生化性最强的污油组分, 其多样的分子结构与丰度直接影响微生物种群特征;而胶质是由稠环芳香片层缩合组成, 含有丰富的脂肪性结构单元, 并带有O、N、S等杂原子, 其可生化性较差, 但具有显著的毒性效应(Boukir, 2001; 王新伟等, 2013; 石植真, 2016).因此, 诸如食烷菌属(Alcanivorax)和海杆菌属(Marinobacter)等微生物虽然可能对烷烃或芳烃具有一定代谢能力, 但是对胶质组分几乎不能利用且抗性较差, 故呈现出在大庆油田高浓度石油污染土壤中成为优势菌, 但在辽河油田中相对丰度较低的现象.而分支杆菌属(Mycobacterium)和Defluviicoccus属等辽河油田高浓度石油污染土壤中的优势菌, 则对胶质毒性具有更强的抗性, 甚至可能对其有一定的代谢能力.同时, 在同一油田区内, 随着距井口距离的增加, 土壤中石油含量降低, 胶质组分含量降低, 毒性作用减弱, 对于胶质组分抗性较低的微生物更多的生存下来, 进而表现出更高的相对丰度.另外, RDA分析结果显示, 辽河油田井口附近的微生物群落分布受胶质的负向影响较低, 而大庆油田则相反.此外, 前述的共代谢特征也是优势菌群形成的重要因素之一.综上所述, 石油底物所造成的环境胁迫压力, 选择性的激发了微生物对底物碳源的代谢酶系表达, 从而特异性的诱导了微生物对底物碳源的降解利用, 进而构造出多样的代谢功能类群与区域性土壤微生物群落分布差异特征(宋佳宇等, 2013; 徐苗等, 2018; 吴盼云等, 2019).
4.4 石油降解功能微生物以石油为碳源的土壤环境中, 土壤微生物在石油烃类物质的胁迫作用下, 具有石油降解功能的微生物成为优势菌属, 强化了对土壤微生物种群的选择, 从而在石油污染土壤中呈现独特的群落结构及特点(岳冰冰等, 2011), 使得在高浓度石油污染的样品组中, 表现出了更高丰度的功能基因.国内外****通过添加不同底物对石油降解微生物进行分离和筛选, 目前已发现大量具有石油降解功能的微生物, 已有报道中石油烃类降解微生物中起主导作用的为细菌.杨茜等(2014)分离筛选出16株可以以石油烃为唯一碳源生长的不同菌属的菌株.刘虹等(2016)从石油污染场地中筛选出1株假单胞菌(Pseudomonas sp.)和1株无色杆菌(Achromobacter sp.), 2种单菌均能完全降解大部分烷烃.Chang等(2011)通过中试实验评估了老化石油污染土壤中生物降解性能, 由诺卡氏菌属(Nocardia)、沙门氏菌属(Salmonella)、红球菌属(Rhodococcus)和鞘脂单胞菌属(Sphingomonas)等属细菌组合的混合菌液, 在6 ℃条件下经过60 d可以降解55%的石油烃.上述结果表明, 石油烃类污染强化了土壤微生物种群的选择, 产生具有石油烃类降解功能的功能菌群, 这与本研究结果基本一致.在本研究中发现, 辽河油田区的2种优势菌属:分支杆菌属(Mycobacterium)、Defluviicoccus属和大庆油田区的5种优势菌属:海杆菌属(Marinobacter)、盐单胞菌属(Halomonas)、Idiomarina属、Salinimicrobium属、食烷菌属(Alcanivorax)可能具有石油降解功能, 其中诸如食烷菌属(Alcanivorax)、分支杆菌属(Mycobacterium)、海杆菌属(Marinobacter)和盐单胞菌属(Halomonas)等细菌具备可培养性.Djahnit等(2018)从石油污染底泥中分离出6株食烷菌属(Alcanivorax)细菌, 并对其代谢功能加以验证, 发现其均具有良好的烷烃降解能力.Leys等(2005)探究了三株分支杆菌属(Mycobacterium)细菌对菲、蒽、芘等多环芳烃的降解能力, 发现其均可在低营养环境下代谢多环芳烃.Mounier等(2018)在海杆菌属细菌Marinobacter hydrocarbonoclasticus SP17中发现了烷烃摄取蛋白.Ardakani等(2019)分离得到一株高效原油降解菌株, 经鉴定为盐单胞菌属(Halomonas)细菌.PICRUSt预测分析为群落组成赋予一定意义, 为未来进一步靶向性筛选菌株提供目标范围.鉴于目前微生物种质资源的开发处于一个瓶颈期, 传统的方法筛选挑选概率不高(赵光等, 2006), 本研究针对油田区地理微生物学从方法和认知上进行探索, 为未来基于地带性微生物群落分析的高通量筛选方法的探索提供理论支持, 依靠对土壤微生物群落结构的认知进行靶向性筛选, 从而有的放矢地优化微生物菌剂筛选技术.
5 结论(Conclusions)1) 油井周边土壤微生物多样性具有明显的空间分布特征.距离井口越近, 土壤中石油类污染物含量越高.烷烃、芳烃及胶质作为污染土壤中的主要碳源, 是决定微生物群落差异性分布的核心因素.辽河油田和大庆油田由于石油组分差异较大, 导致两个油田各自的微生物群落变异特征也有所不同, 因此, 土壤中石油的含量及其族组成是影响微生物群落结构变化的关键因子.
2) 辽河和大庆两油田区污染土壤微生物群落存在异同特征.相同的是两个油田的优势菌门均包括变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)和硝化螺旋菌门(Nitrospirae), 相同优势菌属为Pseudarthrobacter属和鞘氨醇单胞菌属(Sphingomonas).差异是辽河油田独特优势菌门为Saccharibacteria门, 优势菌属为Defluviicoccus属、微枝形杆菌属(Microvirga)和分支杆菌属(Mycobacterium);大庆油田独特优势菌门为拟杆菌门(Bacteroidetes), 优势菌属为Salinimicrobium属、盐单胞菌属(Halomonas)、Idiomarina属、游动球菌属(Planomicrobium)、食烷菌属(Alcanivorax)和海杆菌属(Marinobacter).
3) 污染物毒性是土壤中微生物结构变化的主要驱动因子, 同时生态环境背景状况也是重要影响因素.辽河油田石油污染物中胶质含量高, 毒性较大, 但该地区生态环境较好, 因此井口附近的微生物群落具有较强的抗胁迫能力, 而大庆油田则表现出相反的现象, 即脆弱生态环境下的微生物群落受污染物的影响更大.
4) 微生物群落结构的变化反映了微生物的适应性.在石油污染的胁迫作用下诱导产生具有底物靶向性的石油降解功能菌群;发现7种菌属可能具有降解石油污染物的功能, 可作为未来靶向性功能菌株筛选目标, 其中2种为辽河油田区优势菌属:分支杆菌属(Mycobacterium)、Defluviicoccus属;5种为大庆油田区优势菌属:海杆菌属(Marinobacter)、盐单胞菌属(Halomonas)、Idiomarina属、Salinimicrobium属和食烷菌属(Alcanivorax).
参考文献
| Ardakani M R, Papizadeh M. 2019. Biodegradation of crude oil by Halomonas elongata strain KWPA-12:A moderately halophilic strain detected in oil spills around Garo sulfidic springs, MIS Oilfield, Iran[J]. Energy, Ecology and Environment, 4(1): 26-36. DOI:10.1007/s40974-018-0107-x |
| Boukir A, Aries E, Guiliano M, et al. 2001. Subfractionation, characterization and photooxidation of crude oil resins[J]. Chemosphere, 43(3): 279-286. DOI:10.1016/S0045-6535(00)00159-4 |
| Chang W, Whyte L, Ghoshal S. 2011. Comparison of the effects of variable site temperatures and constant incubation temperatures on the biodegradation of petroleum hydrocarbons in pilot-scale experiments with field-aged contaminated soils from a cold regions site[J]. Chemosphere, 82(6): 872-878. DOI:10.1016/j.chemosphere.2010.10.072 |
| Djahnit N, Chernai S, Catania V, et al. 2018. Isolation, characterization and determination of biotechnological potential of oil degrading bacteria from Algerian centre coast[J]. Journal of Applied Microbiology, 126(3): 780-795. |
| 杜滢鑫, 谢宝明, 蔡洪生, 等. 2016. 大庆盐碱地九种植物根际土壤微生物群落结构及功能多样性[J]. 生态学报, 36(3): 740-747. |
| Gao Y C, Wang J N, Guo S H, et al. 2015. Effects of salinization and crude oil contamination on soil bacterial community structure in the Yellow River Delta region, China[J]. Applied Soil Ecology, 86: 165-173. DOI:10.1016/j.apsoil.2014.10.011 |
| 郭魏, 齐学斌, 李平, 等. 2017. 不同施氮水平下再生水灌溉对土壤细菌群落结构影响研究[J]. 环境科学学报, 37(1): 280-287. |
| 顾磊, 许科伟, 汤玉平, 等. 2017. 基于高通量测序技术研究玉北油田上方微生物多样性[J]. 应用与环境生物学报, 23(2): 276-282. |
| 胡洪营, 童中华. 2002. 微生物醌指纹法在环境微生物群体组成研究中的应用[J]. 微生物学通报, 29(4): 95-98. DOI:10.3969/j.issn.0253-2654.2002.04.023 |
| 贾建丽, 刘莹, 李广贺, 等. 2009. 油田区土壤石油污染特性及理化性质关系[J]. 化工学报, 60(3): 726-732. DOI:10.3321/j.issn:0438-1157.2009.03.028 |
| Khan M A I, Biswas B, Smith E, et al. 2018. Microbial diversity changes with rhizosphere and hydrocarbons in contrasting soils[J]. Ecotoxicology and Environmental Safety, 156: 434-442. DOI:10.1016/j.ecoenv.2018.03.006 |
| Koshlaf E, Shahsavari E, Haleyur N, et al. 2019. Effect of biostimulation on the distribution and composition of the microbial community of a polycyclic aromatic hydrocarbon-contaminated landfill soil during bioremediation[J]. Geoderma, 338: 216-225. DOI:10.1016/j.geoderma.2018.12.001 |
| Langille M G I, Zaneveld J, Caporaso J G, et al. 2013. Predictive functional profiling of microbial communities using 16S rRNA markergene sequences[J]. Nature Biotechnology, 31(9): 814-821. DOI:10.1038/nbt.2676 |
| Lee D W, Lee H, Lee A H, et al. 2018. Microbial community composition and PAHs removal potential of indigenous bacteria in oil contaminated sediment of Taean coast, Korea[J]. Environmental Pollution, 234: 503-512. DOI:10.1016/j.envpol.2017.11.097 |
| Leys N M, Bastiaens L, Verstraete W, et al. 2005. Influence of the carbon/nitrogen/phosphorus ratio on polycyclic aromatic hydrocarbon degradation by Mycobacterium and Sphingomonas in soil[J]. Applied Microbiology and Biotechnology, 66(6): 726-736. DOI:10.1007/s00253-004-1766-4 |
| 李倩, 崔志松, 赵爱芬, 等. 2011. 一株石油烃降解菌新种Marinobacter sp.PY97S的鉴定[J]. 微生物学报, 51(5): 648-655. |
| 李晓楼. 2017. 石油污染对土壤微生物群落多样性的影响[J]. 生物工程学报, 33(6): 968-975. |
| 刘虹, 杨元元, 刘娜, 等. 2016. 两种石油烃降解菌的鉴定及其对石油烃底物的降解[J]. 环境污染与防治, 38(6): 28-33. |
| 刘五星, 骆永明, 滕应, 等. 2007a. 石油污染土壤的生态风险评价和生物修复Ⅱ.石油污染土壤的理化性质和微生物生态变化研究[J]. 土壤学报, 44(5): 848-853. |
| 刘五星, 骆永明, 滕应, 等. 2007b. 我国部分油田土壤及油泥的石油污染初步研究[J]. 土壤, 39(2): 247-251. |
| 鲁如坤. 2000. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社. |
| Mounier J, Hakil F, Branchu P, et al. 2018. AupA and AupB are outer and inner membrane proteins involved in alkane uptake in Marinobacter hydrocarbonoclasticus SP17[J]. mBio, 9(3): e00520-18. |
| 马思佳, 顾卓江, 丁丽丽, 等. 2017. 碳源对活性污泥微生物细胞膜特性和群落结构影响[J]. 微生物学通报, 44(3): 561-573. |
| 马悦欣, Carola H, Jeremy W, 等. 2003. 变性梯度凝胶电泳(DGGE)在微生物生态学中的应用[J]. 生态学报, 23(8): 1561-1569. DOI:10.3321/j.issn:1000-0933.2003.08.014 |
| Nakatsu C H. 2007. Soil microbial community analysis using denaturing gradient gel electrophoresis[J]. Soil Science Society of America Journal, 71(2): 562-571. DOI:10.2136/sssaj2006.0080 |
| 牛之欣, 郭书海, 李凤梅, 等. 2005. 放线菌对稠油污染土壤中胶质沥青质的降解研究[J]. 农业环境科学学报, 24(4): 771-774. DOI:10.3321/j.issn:1672-2043.2005.04.035 |
| 祁燕云, 吴蔓莉, 祝长成, 等. 2019. 基于高通量测序分析的生物修复石油污染土壤菌群结构变化[J]. 环境科学, 40(2): 869-875. |
| 施昊坤, 吴次芳, 张茂鑫, 等. 2020. 土地整治对工业区周边土壤微生物多样性和群落结构影响分析[J]. 环境科学学报, 40(1): 212-223. |
| 石植真. 2016. 稠油中胶质沥青质的特性及油溶性降粘剂的研究进展[J]. 化工设计通讯, 42(5): 49-50. DOI:10.3969/j.issn.1003-6490.2016.05.040 |
| 宋佳宇, 陈梅梅, 张海涛, 等. 2013. 石油污染土壤微生物群落代谢特征分析[J]. 环境科学与技术, 36(10): 63-66+136. |
| 王梅, 江丽华, 刘兆辉, 等. 2010. 石油污染物对山东省三种类型土壤微生物种群及土壤酶活性的影响[J]. 土壤学报, 47(2): 341-346. |
| 王传远, 杨翠云, 孙志高, 等. 2010. 黄河三角洲生态区土壤石油污染及其与理化性质的关系[J]. 水土保持学报, 24(2): 214-217. |
| 王金成, 井明博, 肖朝霞, 等. 2012. 陇东黄土高原地区石油污染土壤微生物群落及其与环境因子的关系[J]. 水土保持通报, 32(5): 145-151. |
| 王如刚, 王敏, 牛晓伟, 等. 2010. 超声-索氏萃取-重量法测定土壤中总石油烃含量[J]. 分析化学, 38(3): 417-420. |
| 王广春, 席劲瑛, 胡洪营. 不同填料甲苯生物滤塔中微生物群落结构与代谢功能解析[J]. 环境科学学报, 37(10): 3936-3942 |
| 王新伟, 蔡婷, 刘宇, 等. 2013. 稠油重质组分微生物降解作用研究进展[J]. 生态环境学报, 22(7): 1255-1262. DOI:10.3969/j.issn.1674-5906.2013.07.028 |
| 吴盼云, 晁群芳, 赵亚光, 等. 2019. 克拉玛依石油污染土壤微生物群落结构及其代谢特征[J]. 基因组学与应用生物学, 38(5): 2062-2069. |
| 徐春燕, 贾晨波, 王涛, 等. 2020. 石油污染土壤中的微生物群落结构与降解菌的分离[J]. 环境科学与技术, 43(S1): 1-5. |
| 徐苗, 段魏魏, 赵亚光, 等. 2018. 石油污染土壤理化性质对微生物代谢特征的影响[J]. 环境工程, 36(2): 178-183. DOI:10.3969/j.issn.1673-1379.2018.02.013 |
| 杨萌青, 李立明, 李川, 等. 2013. 石油污染土壤微生物群落结构与分布特性研究[J]. 环境科学, 34(2): 789-794. |
| 杨茜, 吴蔓莉, 曹碧霄, 等. 2014. 石油降解菌的筛选、降解特性及其与基因的相关性研究[J]. 安全与环境学报, 14(1): 187-192. |
| 杨琴, 张海玲, 刘锐, 等. 2015. 长庆油田石油污染土壤微生物种群多样性研究[J]. 油气田环境保护, 25(5): 22-25+91. |
| 杨智, 陈吉祥, 周永涛, 等. 2017. 玉门油田污染荒漠土壤石油降解菌多样性[J]. 环境科学研究, 30(5): 799-808. |
| 杨智临, 陈海, 白智勇, 等. 2014. 生物共代谢法降解石油污染土壤中的萘、菲[J]. 油气田地面工程, 33(11): 48-49. |
| 姚晓东, 王娓, 曾辉. 2016. 磷脂脂肪酸法在土壤微生物群落分析中的应用[J]. 微生物学通报, 43(9): 2086-2095. |
| 岳冰冰, 李鑫, 任芳菲, 等. 2011. 石油污染地土壤微生物群落的碳源利用特性[J]. 应用生态学报, 22(12): 3259-3264. |
| 张泽霆, 陈英, 陈东, 等. 2019. 生物修复石油污染土壤研究现状[J]. 土壤通报, 50(1): 246-252. |
| 张春兰, 秦孜娟, 王桂芝, 等. 2012. 转录组与RNA-Seq技术[J]. 生物技术通报, (12): 51-56. |
| 张海玲, 杨琴, 赵敏. 2014. 陇东油田井场石油类物质自然迁移规律研究[J]. 油气田环境保护, 24(6): 7-10+64. |
| 赵光, 王宏燕. 2006. 土壤微生物多样性的分子生态学研究方法[J]. 中国林副特产, (1): 54-56. |
| 赵思宇. 2019. 盘锦湿地微生物多样性及土壤酶活性的研究[D]. 辽宁: 沈阳师范大学 |
| 赵明阳, 王卅, 李凤梅, 等. 2020. 辽河油田土壤石油污染及其微生物群落特征[J]. 应用生态学报, 31(12): 1-12. |
| 甄丽莎, 谷洁, 胡婷, 等. 2015. 黄土高原石油污染土壤微生物群落结构及其代谢特征[J]. 生态学报, 35(17): 5703-5710. |
| 中国石油天然气总公司. 1995. SY/T 5119-1995中华人民共和国石油天然气行业标准: 岩石可溶有机物和原油族组分柱层析分析方法[S]. 北京: 中国标准出版社 |
