 , 张欣, 刘燕, 王美仙
, 张欣, 刘燕, 王美仙

北京林业大学, 园林学院, 林木花卉遗传育种教育部重点实验室, 城乡生态环境北京实验室, 国家花卉工程技术研究中心, 花卉种质创新与分子育种北京市重点实验室, 北京 100083
收稿日期: 2020-08-21; 修回日期: 2020-09-21; 录用日期: 2020-09-21
基金项目: 国家自然科学基金项目(No.31600574);北京市共建项目专项; 北京林业大学建设世界一流学科和特色发展引导专项资金资助(No.2019XKJS0322);北京市教委科学研究与研究生培养共建科研项目(No.2019GJ-03)
作者简介: 唐敏(1995-), 女, E-mail: 294017018@qq.com
通讯作者(责任作者): 王美仙, 博士, 副教授, 硕士生导师, 研究方向为景观生态修复、植物景观规划设计、园林植物应用, 发表学术论文30余篇. E-mail: 625592760@qq.com
摘要:研究不同镉(Cd)浓度(0、25、50、100、200 mg·kg-1)处理下,栾树(Koelreuteria paniculata)、臭椿(Ailanthus altissima)、银杏(Ginkgo biloba)3种乔木叶、枝、根中Cd的含量与积累特征,并分析Cd对其叶片超微结构的影响,探讨Cd在3种乔木叶片与根系中的亚细胞分布和化学形态特征.结果表明,3种乔木体内的Cd含量随着土壤Cd处理浓度的增加而增加,且主要积累在根部.栾树和臭椿各器官中的Cd含量显著高于银杏,表明栾树和臭椿对Cd的积累能力强于银杏.高浓度Cd处理下,栾树和臭椿叶片细胞结构损伤明显,细胞内出现大量黑色絮状物,且附着在细胞壁及细胞器的表面.而银杏叶片细胞无明显损伤特征,说明银杏对Cd的耐受性强于栾树和臭椿.3种乔木叶片中的Cd多存在于细胞壁或可溶性组分中,根系中的Cd多存在于细胞壁中,Cd在各组织的叶绿体、线粒体和细胞核等细胞器中分布较少.3种乔木叶片和根系中分别以移动性和毒性相对较低的HAc、NaCl提取态Cd分配比例最大.3种乔木各器官对Cd的积累能力与其叶片细胞中叶绿体与线粒体组分Cd占比有显著负相关关系,与叶片中HAc提取态Cd分配比例呈显著正相关性.
关键词:镉乔木积累亚细胞分布化学形态
Accumulation, subcellular distribution and chemical forms of cadmium in three tree species
TANG Min
 , ZHANG Xin, LIU Yan, WANG Meixian
, ZHANG Xin, LIU Yan, WANG Meixian

Beijing Key Laboratory of Ornamental Plants Germplasm Innovation & Molecular Breeding, National Engineering Research Center for Floriculture, Beijing Laboratory of Urban and Rural Ecological Environment, Key Laboratory of Genetics and Breeding in Forest Trees and Ornamental Plants of Ministry of Education, School of Landscape Architecture, Beijing Forestry University, Beijing 100083
Received 21 August 2020; received in revised from 21 September 2020; accepted 21 September 2020
Abstract: The concentration and accumulation of Cd in leaves, stems, and roots of Koelreuteria paniculata, Ailanthus altissima, and Ginkgo biloba were studied under different treatment levels of Cadmium(Cd) concentrations(0, 25, 50, 100, 200 mg·kg-1). The influence of Cd on the ultrastructure in leaves was further analyzed. The subcellular distribution and chemical forms of Cd in leaves and roots of the three tree species were discussed. The results showed that Cd concentration in these three species of trees increased with the increase of Cd concentration in the soil, and the accumulation was mainly in the roots. The Cd concentration in the organs of Koelreuteria paniculata and Ailanthus altissima were significantly higher than that of Ginkgo biloba, indicating that the Cd accumulation ability of Koelreuteria paniculata and Ailanthus altissima were stronger than that of Ginkgo biloba. Under the treatment of high Cd concentration, the cell structure of leaves in Koelreuteria paniculata and Ailanthus altissima was obviously damaged, with large amount of black flocs appeared in the cells and attached to cell walls and the surface of organelles. However, there was no obvious damage in the cells of leaves in Ginkgo biloba, indicating that the tolerance of Ginkgo biloba to Cd was stronger than that of Koelreuteria paniculata and Ailanthus altissima. It was also found that Cd mostly existed in the cell wall or soluble components in the leaves of the three species of trees, and Cd mostly existed in the cell wall in the root systems. Cd was less distributed in organelles such as chloroplasts, mitochondria and nucleus. HAc- and NaCl- extracted Cd had the highest distribution ratio in leaves and roots of these trees respectively, with relatively low mobility and toxicity. The accumulation ability of Cd in each organ of the trees had a significant negative correlation with the proportion of Cd in chloroplast and mitochondria components in leaf cells, and a significant positive correlation with the proportion of Cd in HAc- extracted state in leaves.
Keywords: cadmiumtreeaccumulationsubcellular distributionchemical form
1 引言(Introduction)土壤重金属污染是城市面临的重要生态问题(王帆宇, 2016;Sarwar et al., 2017).相关研究表明, 北京地区土壤中重金属镉(Cd)含量突出, 需引起重视(韩玉丽等, 2015; 孙春媛等, 2016;杨少斌等, 2018).园林树木是城市生态建设的重要组成部分, 对重金属有吸收作用(崔冠卿, 2012; Pollard, 2016;Alahabadi et al., 2017).其中, 杨、柳(郭艳丽等, 2009)、忍冬(刘周莉等, 2013)、山矾(顾翠花等, 2015)是较理想的Cd富集性树种.重金属被植物吸收后, 会以不用的化学形态贮藏在各组织中, 其在植物体内的移动被限制, 以减轻对植物的毒害作用(Li et al., 2016).重金属的亚细胞定位可以揭示植物对重金属的积累和耐受机制, 植物的细胞壁、液泡等被认为在重金属耐受过程中发挥着重要作用(Gallego et al., 2012;Clemens et al., 2013).目前, 已发现Cd在一些木本植物亚细胞中的分布特点, 如杨柳科植物旱柳(杨卫东等, 2008)、灰杨(代惠萍, 2012;何佳丽, 2014)、秋华柳(李瑞等, 2018), 农林经济植物桉树(廖妤婕, 2014)、苹果砧木(Zhou et al., 2017), 以及园林植物马缨丹(方继宇等, 2014)、栾树(Yang et al., 2018)、三角梅(Wang et al., 2017).总体而言, 所涉及的园林乔木种类仍较少, 且Cd在各乔木树种中的亚细胞分布和化学形态特征具有差异, 但鲜有研究同时以多种木本植物为研究对象, 在同一实验条件下, 探索其积累机制的异同.栾树(Koelreuteria paniculata)、臭椿(Ailanthus altissima)、银杏(Ginkgo biloba)是北京园林中应用非常广泛的乡土树种, 适应性强(张国静等, 2012), 且前期实验研究发现这3种乔木对Cd具有一定的富集能力(唐敏等, 2019).因此, 研究这3种乔木对Cd的富集规律、细胞超微结构变化以及Cd在亚细胞中的分布和化学形态特征, 探索3种乔木对Cd积累特征与解毒机理, 旨在为Cd污染土壤的植物修复方法提供参考和依据.
2 材料与方法(Materials and methods)2.1 植物培养臭椿、栾树和银杏实生苗(1年生)购买于北京市顺义区苗木基地.试验基质土配比为草炭土∶珍珠岩=8∶2(体积比), 称取5 kg基质土装于口径24 cm, 高度26.5 cm的3加仑塑料盆中, 盆下垫托盘.试验设置Cd处理梯度5个(0、25、50、100、200 mg·kg-1), 每个梯度含4盆重复样, 供试Cd离子来源于药品CdCl2·2.5H2O(分析纯).4月初, 挑选长势良好和生长一致的植株进行移栽, 每盆栽植1株, 移栽后马上浇一次透水作为定根水, 置于阴凉通风的大棚环境下缓苗1个月.随后将盆栽苗木移到露天自然环境下, 在盆土中均匀插孔.按照设定的处理浓度, 准确称量CdCl2粉末药品溶解于1.2 L的去离子水中(若超过该水量, 浇灌后溶液会从盆底渗漏), 利用气压喷壶使CdCl2溶液呈喷雾状均匀地通过孔隙渗透到土壤中, 以保证药品和土壤混合均匀.试验期间雨天用塑料布进行遮雨处理, 盆土保持自然肥力, 不施肥, 每周等量浇入淡水1或2次.9月初, 采用完全收获法进行样品采集.植株用自来水冲洗干净后, 将根部在20 mmol·L-1 Na2-EDTA溶液中浸泡20 min, 去除根表吸附的Cd, 再用去离子水冲洗3次并擦干, 分成叶、枝、根3个部分.部分植物样品用于测定亚细胞组分和不同化学形态Cd含量, 保存于-80 ℃冰箱, 剩余样品在105 ℃下杀青30 min, 再用70 ℃烘干至衡重, 最后用粉碎机磨细干燥保存.
2.2 测定指标及测定方法2.2.1 各器官Cd含量的测定用万分之一电子天平称取叶、枝、根粉末干样各1 g, 采用HNO3-H2O2微波消解体系消解(黄晓纯等, 2013).消解定容后, 采用ICP-OES(Agilent 5110)测定Cd含量, 试验重复3次.
2.2.2 细胞超微结构的观察取植物叶片鲜样5~8 mm2, 投入4 ℃预冷的2.5%戊二醛固定液中, 固定液完全浸没样品后放入4 ℃冰箱保存.准备制片时倒掉固定液, 然后用磷酸缓冲液(PH 7.0)将样品漂洗3次, 每次15 min;在样品中加入1%的锇酸溶液浸没1~2 h;倒出锇酸溶液, 然后用磷酸缓冲液(pH 7.0)将样品再次漂洗3次, 每次15 min;后用30%、50%、70%、80%、90%和95% 共6种浓度的乙醇溶液对样品进行脱水处理, 每种浓度处理15 min;再用100%的乙醇处理20 min;最后用纯丙酮处理20 min.将样品用包埋剂与丙酮的混合液(体积比1∶1)浸没1 h;再用包埋剂与丙酮的混合液(体积比3∶1)浸没样品3 h;将样品浸没在纯包埋剂过夜;将经过渗透处理的样品包埋起来, 70 ℃加热过夜, 完成样品包埋工作.用超薄切片机(LEICA EM UC7型)对包埋好的样品进行切片, 保持切片厚度为70~90 nm, 用柠檬酸铅溶液和醋酸双氧铀50%乙醇饱和溶液对切片各染色5~10 min, 最后在透射电镜(HT-7700型)中观察(李叶等, 2016).
2.2.3 亚细胞组分的分离采用差速离心法分离不同的细胞组分(周芙蓉等, 2012;Yang等, 2018).称取植物冰冻样品1 g, 加入40 mL缓冲液(0.25 mol·L-1蔗糖+50 mmol·L-1Tris-HCl缓冲液(pH7.5)+1 mmol·L-1二硫苏糖醇(DTT)), 缓冲液少量多次加入, 在4 ℃低温下用研钵将样品研磨成匀浆.然后转移到50 mL离心管中, 使用冷冻离心机(4 ℃)按图 1步骤进行细胞组分逐级离心分离.其中, F1为细胞壁及未破碎残渣, F2为细胞核为主的成分, F3为线粒体和叶绿体成分, F4为核蛋白成分和可溶性组分(可溶性组分包括细胞质、液泡内大分子及无机盐离子及核糖体).
图 1(Fig. 1)
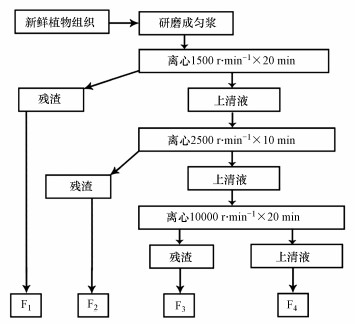 |
| 图 1 植物样品差速离心法分离步骤 Fig. 1Separation steps of plant samples by differential centrifugation |
2.2.4 不同化学形态Cd的提取采用化学试剂逐步提取法(Lu et al., 2017).称取植物冰冻样品1 g, 加入20 mL提取剂(少量多次加入), 用研钵将样品研磨成匀浆.然后转移至离心管中, 放入25 ℃的恒温培养箱振荡22 h, 然后在离心机4000 r·min-1转速离心15 min, 将上清液分离, 向离心管的沉淀中再加入10 mL的提取剂, 在25 ℃恒温振荡1 h后, 于4000 r·min-1转速离心15 min, 将两次离心后的上清液合并.采用5种提取剂依次逐步提取:80%乙醇(FE)、去离子水(FW)、1 mol·L-1 NaCl溶液(FNaCl)、2% HAc(FHAc)、0.6 mol·L-1 HCl(FHCl), 最后为残留态(FR).
将上述利用差速离心法和化学试剂逐步提取法分离的上清液和沉淀组分装入三角瓶中, 置于电热板(70 ℃)上蒸发至近干后, 采用HNO3 -HClO4法消解.消解定容后, 采用ICP-OES(Agilent 5110)测定Cd含量, 试验重复3次.
2.3 数据处理本文采用滞留率(程龙玲等, 2012)来反应根系对Cd的滞留作用, 根系对重金属的滞留率(%)=(根系重金属含量-枝叶重金属含量平均值)/ 根系重金属含量×100%.实验数据采用SPSS 23.0统计软件对数据进行处理, 采用最小显著差异法(LSD)进行数据组间的差异分析, 显著性水平设定为α=0.05.采用Person法进行相关性分析.数据为3次重复样品测定结果的平均值.
3 研究结果(Results)3.1 3种乔木各器官中Cd含量的对比结果表明, 栾树和臭椿各器官的Cd含量高于银杏, 随着Cd处理浓度的增加, 差异更为显著(表 1).低浓度(25、50 mg·kg-1)处理时, 3种乔木对Cd的总含量排序为臭椿>栾树>银杏.高浓度(100、200 mg·kg-1)处理时, 总含量排序为栾树>臭椿>银杏.随着土壤Cd处理浓度的增加, 3种乔木各器官Cd含量均呈上升趋势.栾树和臭椿各器官分布特征通常表现为根>枝>叶, 银杏为根>叶>枝.当处理浓度为200 mg·kg-1时, 栾树、臭椿、银杏根中的Cd含量分别可达其枝条的5.84、2.19、7.30倍, 叶片的13.57、11.10、5.71倍.可见, 根部是3种乔木积累Cd的主要部位, 对Cd具有较强的滞留作用, 滞留率最高可达88.13%(臭椿在Cd处理浓度为50 mg·kg-1时).
表 1(Table 1)
| 表 1 Cd处理下3种乔木各器官中的Cd含量 Table 1 Cd concentration in the organs of three trees species under Cd treatment | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 Cd处理下3种乔木各器官中的Cd含量 Table 1 Cd concentration in the organs of three trees species under Cd treatment
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.2 3种乔木在Cd胁迫下的细胞结构对比当植物受到重金属胁迫时, 植物细胞组织的微观结构会发生一定程度的变化.为了探究Cd胁迫对3种乔木叶片结构变化的影响, 通过透射电镜观察了3种乔木在Cd胁迫下叶片组织形态的微观变化.Cd胁迫下, 栾树和臭椿叶片出现大量黑色絮状物, 细胞壁及细胞器的表面被其附着, 叶绿体数量减少且叶绿体类囊体膜溶解, 片层结构模糊不清, 严重时出现解体与溃散特征(图 2c~2f, 2i~2l).高浓度Cd处理时, 栾树叶片细胞的细胞壁发生扭曲变形与破裂现象, 细胞器散乱, 细胞结构被破坏(图 2e~2f).而银杏叶片细胞受Cd胁迫影响较小, 细胞完整, 无显著毒性症状.细胞内没有大量黑色絮状物, 虽叶绿体因淀粉粒变大有肿胀的特征, 观察到有质体小球存在于叶绿体中, 但叶绿体形状仍能保持规则, 叶绿体膜仍基本完整并保持连续, 片层结构基本清晰(图 2o~2r).可见, 栾树和臭椿叶片细胞损伤程度高于银杏.
图 2(Fig. 2)
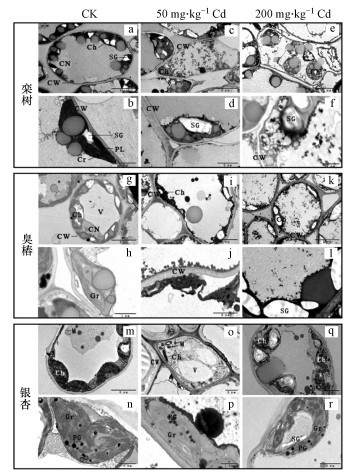 |
| 图 2 3种乔木叶片超微结构 (缩写标注: CN, 细胞核;CW, 细胞壁;PL, 原生质膜;V, 液泡;M, 线粒体;Ch, 叶绿体;Gr, 叶绿体基粒;SG, 淀粉粒;PG, 质体小球) Fig. 2Ultrastructure of three tree Leaves |
3.3 3种乔木叶片和根系亚细胞中Cd的分布栾树叶片各亚细胞组分Cd含量比例表现为各浓度胁迫下细胞壁组分占比显著高于其它组分(65.58%~78.54%).臭椿叶片各亚细胞组分Cd含量比例在低浓度时(25、50 mg·kg-1)表现为细胞壁组分占比最高(38.92%~39.35%), 高浓度时(100、200 mg·kg-1)表现为可溶性组分占比最高(41.38%~52.39%).银杏叶片各亚细胞组分Cd含量比例在中低浓度时(≤100 mg·kg-1)表现为可溶性组分占比最高(50.00%~66.67%), 当Cd处理浓度达到高浓度200 mg·kg-1时, 细胞壁组分(40.63%)Cd含量占比超过了可溶性组分(32.81%).Cd处理下, 栾树和臭椿根系各亚细胞组分Cd含量比例表现为细胞壁组分占比(栾树:45.75%~57.27%;臭椿:39.39%~56.69%)显著高于其它组分.银杏根系各亚细胞组分Cd含量比例在低浓度时(50 mg·kg-1)差异不显著, 在高浓度时(100、200 mg·kg-1)细胞壁组分占比(60.54%~66.57%)显著高于其余组分.可见, 3种乔木叶片中的Cd主要储存在细胞壁和可溶性组分中, 根系中的Cd主要储存在细胞壁组分中, Cd在细胞核、线粒体和叶绿体等细胞器组分中占比很小.
图 3(Fig. 3)
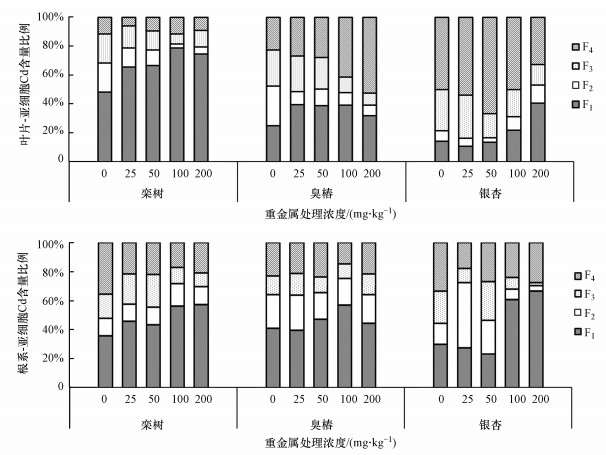 |
| 图 3 3种乔木叶片和根系各亚细胞组分Cd占比 (F1为细胞壁及破碎残渣, F2为细胞核, F3为线粒体和叶绿体, F4为核蛋白和可溶性成分) Fig. 3Proportion of Cd in subcellular components of leaves and roots of three tree species |
3.4 3种乔木叶片和根系中Cd的形态研究Cd胁迫下, 3种乔木叶片中均以移动性和毒性相对较低的HAc提取态Cd分配比例最大(栾树:42.86%~66.99%;臭椿: 22.61%~39.20%;银杏:22.86%~34.92%), 且随着Cd处理浓度的升高, HAc提取态Cd分配比例均呈上升趋势.同一Cd处理浓度下, 活性和毒性最强的乙醇提取态和水提取态Cd在3种乔木叶片中的分配比例通常表现为银杏>臭椿>栾树.3种乔木根系中均以移动性和毒性相对低的NaCl提取态Cd分配比例(栾树:66.81%~80.32%;臭椿: 21.68%~43.70%;银杏:34.76%~69.46%)最大.但随着Cd处理浓度的升高, 3种乔木根系中NaCl提取态Cd分配比例变化趋势不同, 栾树根系中呈上升趋势, 臭椿根系中先下降后又上升, 银杏根系中呈下降趋势.低浓度Cd(25、50 mg·kg-1)处理时, 活性和毒性最强的乙醇提取态和水提取态Cd在3种乔木中的分配比例表现为臭椿>银杏>栾树.高浓度Cd(100、200 mg·kg-1)处理时, 乙醇提取态和水提取态Cd在3种乔木中的分配比例表现为银杏>臭椿>栾树.
图 4(Fig. 4)
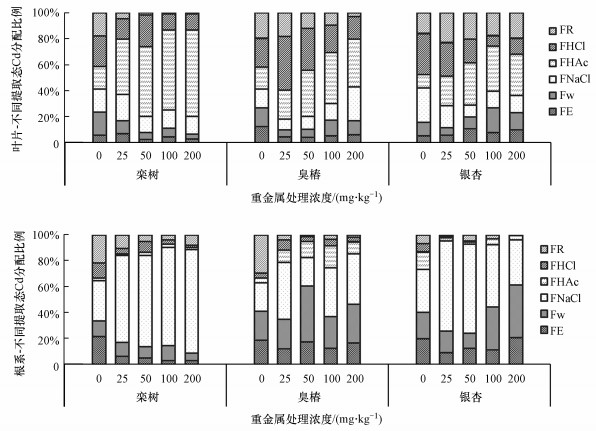 |
| 图 4 3种乔木叶片和根系中各化学形态Cd分配比例 (FE是硝酸盐、氯化物为主的无机盐及氨基酸等; Fw是水溶性有机酸盐;重金属的一代磷酸盐[M(H2PO4)2]等;FNaCl是果胶酸盐、与蛋白质呈结合态或吸着态的重金属等;FHAc是难溶的金属磷酸盐;FHCl是草酸盐等;FR是残渣态) Fig. 4Distribution ratio of Cd chemical forms in leaves and roots of three tree species |
4 讨论(Disscusion)4.1 3种乔木各器官中Cd含量的对比本试验发现, 栾树和臭椿体内的Cd含量分布通常为根>枝>叶, 银杏为根>叶>枝, 各器官Cd含量均随着土壤中Cd浓度的增加而增加, 且差异性显著.Cd在根系中过量积累, 主要原因可能是根系组织的内皮层细胞起到了横向截留作用, 限制了Cd向地上部转运, 从而导致植物地上部与根系中Cd的分布差异(王晓娟等, 2015).大多研究表明不同种类植物以及不同植物器官对Cd的吸收、累积能力有所不同, 但Cd进入植物体内后绝大部分累积在根部.如香樟、天竺桂、君迁子、银杏对Cd的吸收富集均表现为:根>茎>叶, 根部积累量占植株吸收总量的39.54%~89.28%(鲁艳, 2017).本研究与前人做的结果相似, 可见木本植物对Cd的运输途径有相似之处.
4.2 3种乔木在Cd胁迫下的细胞结构对比高浓度的Cd会损害植物根系, 减少养分的吸收, 抑制叶绿素的合成, 影响植物的生长(李秀珍等, 2008;Demim et al., 2013; ).在本实验中观察到, Cd胁迫会导致乔木叶片细胞中叶绿体的不规则排列和类囊体膜溶解.原因可能是Cd的过量积累会结合叶绿体中蛋白质上的巯基, 并取代铁、锌、镁等相关营养元素, 导致叶绿体的结构和功能活性受到破坏(安志装等, 2002).此外, Cd引起的超量活性氧自由基将叶绿素作为靶分子, 也可致使叶绿素结构破坏(何翠屏等, 2003).对比前人研究发现, Cd对植物的毒害作用具有相似性.如Cd处理后, 美洲商陆叶片细胞部分叶绿体挤在一起, 且肿胀变形, 类囊体片层结构减少甚至消失, 淀粉粒增大(Fu et al., 2011).毛竹幼苗使用50 μmol·L-1的Cd2+水培溶液处理后, 叶片细胞中叶绿体轮廓出现不规则的形状, 叶细胞叶绿体类囊体膜溶解, 细胞壁扭曲变形, 细胞结构被破坏(李松, 2015).
4.3 3种乔木叶片和根系亚细胞中Cd的分布3种乔木在Cd胁迫下, 大部分Cd均存在于细胞壁和可溶性组分, 细胞器组分中很少.细胞壁是重金属进入细胞的第一道屏障, 植物的细胞壁可将重金属与果胶和蛋白质结合, 从而减少其跨膜运输, 降低细胞原生质体内重金属的浓度(刘清泉等, 2014).可溶性部分主要由液泡组成, 液泡含有许多蛋白质, 糖和有机酸, 它们可以与重金属结合以降低其有效性, 减少进入细胞器的重金属数量(He et al., 2013;Li et al., 2014).对3种乔木各器官中Cd含量和亚细胞分布比例进行相关性分析, 发现3种乔木叶片中Cd含量与叶片细胞壁组分Cd占比呈正比, 相关性系数为0.627(p < 0.05);3种乔木叶、枝、根中Cd含量与其叶片中叶绿体和线粒体组分Cd占比呈反比, 相关性系数分别为-0.787(p < 0.01)、-0.691(p < 0.01)、-0.579(p < 0.01), 可见3种植物对Cd的积累能力与其体内Cd的亚细胞分布特征密切相关.Uraguchi et al.(2009)研究了两种不同基因型的黑燕麦, 发现在高积累且耐受品种中细胞壁的Cd含量随着Cd胁迫浓度的增加而增加, 且含量显著高于低积累品种.Xin et al.(2017)对敏感型和耐受型品种萝卜进行研究, 发现Cd敏感型的品种Cd主要分布在叶片的可溶性组分, 根系的细胞壁组分, 而耐受型品种中Cd在叶片和根系中都主要分布在可溶性组分.彭秋等(2019)以高、中、低Cd积累型品种辣椒为研究对象, 发现根、茎、叶、果各亚细胞组分中Cd含量均表现为细胞壁>细胞器>可溶性组分, 没有明显差异.总而言之, 受实验植物种类和实验条件的影响, 目前在耐受与敏感型植物或是高积累与低积累型植物的亚细胞中未发现Cd的分布特征有统一差异.
4.4 3种乔木叶片中Cd的形态研究重金属经过植物吸收、转运后, 会以不同化学形态存在于植物的各器官组织中, Cd在植物体内的迁移能力及毒性与化学形态密切相关(Mukherjee et al., 2018;Yao et al., 2019).所提取的重金属的活性随着提取剂(乙醇、去离子水、氯化钠、醋酸、盐酸)极性的增加其毒性和活性不断下降, 对植物的毒害作用也随之减小, 6种化学形态的Cd毒性排序为FE > FW > FNaCl > FHAc> FHCl> FR(Bais et al., 2006; Wang et al., 2012).本研究中, 随着Cd处理浓度的升高, 3种乔木叶片中HAc提取态Cd分配比例均呈现出上升趋势, 但根系中NaCl提取态Cd分配比例变化趋势不同.对3种乔木器官中Cd含量和各化学形态分配比例进行相关性分析, 发现3种乔木叶、枝、根中的Cd含量与其叶片中HAc提取态Cd分配比例呈正比, 相关性系数分别为0.820(p < 0.01)、0.527(p < 0.05)、0.668(p < 0.01), 说明3种乔木对Cd的积累能力与其体内Cd的存在形态密切相关.总结前人研究发现虽然不同植物中Cd存在形态有一定的差异, 但大多都遵循以下规律:外界Cd胁迫不断增加时, 植物体内迁移能力和毒性较低的Cd形态分配比例保持最大或升高, 从而减轻Cd对植物的毒害作用(陆仲烟等, 2013;白雪等, 2014;Lai, 2015).
5 结论(Conclusions)1) 3种乔木对Cd的积累含量有较大差异, 栾树和臭椿体内Cd含量远高于银杏.通过叶片细胞超微结构观察, 发现银杏细胞对Cd的耐受能力强于栾树和臭椿.因此, 对Cd积累能力强的植物并不一定对Cd耐受能力强.
2) Cd在3种乔木叶片和根系亚细胞结构上主要分布于细胞壁和可溶性组分中, 叶绿体、线粒体和细胞核等细胞器中Cd含量较少.3种乔木各器官中Cd的积累含量与其叶片中叶绿体与线粒体组分Cd占比呈显著负相关关系, 说明细胞壁固定与液泡区隔化作用可能是3种乔木积累与耐受Cd的重要机制.
3) Cd在3种乔木叶片和根系中分别主要以毒性较低、活性较弱的HAc和NaCl提取态Cd存储.3种乔木各器官对Cd的积累含量与其叶片中HAc提取态Cd分配比例呈显著正相关关系, 说明将体内的Cd向低毒性低移动性的形态转化也可能是3种乔木应对Cd胁迫的重要策略.
参考文献
| Alahabadi A, Ehrampoush M H, Miri M, et al. 2017. A comparative study on capability of different tree species in accumulating heavy metals from soil and ambient air[J]. Chemosphere, 172: 459. DOI:10.1016/j.chemosphere.2017.01.045 |
| 安志装, 王校常, 施卫明, 等. 2002. 重金属与营养元素交互作用的植物生理效应[J]. 土壤与环境, (4): 392-396. DOI:10.3969/j.issn.1674-5906.2002.04.017 |
| 白雪, 陈亚慧, 耿凯, 等. 2014. 镉在三色堇中的积累及亚细胞与化学形态分布[J]. 环境科学学报, 34(6): 1600-1605. |
| Bais H P, Weir T L, Perry L G, et al. 2006. The role of root exudates in rhizosphere interactions with plants and other organisms.[J]. Annual Review of Plant Biology, 57(1): 233-266. DOI:10.1146/annurev.arplant.57.032905.105159 |
| 程龙玲, 周守标, 吴晓艳, 等. 2012. 弯囊苔草对Cd胁迫的响应及其Cd富集能力的研究[J]. 中国草地学报, 34(2): 16-22. DOI:10.3969/j.issn.1673-5021.2012.02.003 |
| Clemens S, Aarts M G M, Thomine S, et al. 2013. Plant science: the key to preventing slow cadmium poisoning[J]. Trends in Plant Science, 18(2): 92-99. DOI:10.1016/j.tplants.2012.08.003 |
| 崔冠卿. 2012. 包头市绿化树种对土壤重金属元素的富集作用分析研究[D]. 呼和浩特: 内蒙古农业大学 |
| 代惠萍. 2012. 灰杨幼苗对镉的耐性及解毒生理机制研究[D]. 咸阳: 西北农林科技大学 |
| Demim S, Drouiche N, Aouabed A, et al. 2013. Cadmium and nickel: Assessment of the physiological effects and heavy metal removal using a response surface approach by L. gibba[J]. Ecological Engineering, 61: 426-435. DOI:10.1016/j.ecoleng.2013.10.016 |
| 方继宇, 贾永霞, 张春梅, 等. 2014. 马缨丹对镉的生长响应及其富集、转运和亚细胞分布特点研究[J]. 生态环境学报, 23(10): 1677-1682. DOI:10.3969/j.issn.1674-5906.2014.10.017 |
| Fu X, Dou C, Chen Y, et al. 2011. Subcellular distribution and chemical forms of cadmium in Phytolacca americana L.[J]. Journal of Hazardous Materials, 186(1): 103-107. DOI:10.1016/j.jhazmat.2010.10.122 |
| Gallego S M, Pena L B, Barcia R A, et al. 2012. Unravelling cadmium toxicity and tolerance in plants: Insight into regulatory mechanisms[J]. Environmental & Experimental Botany, 83: 33-46. |
| 顾翠花, 王懿祥, 白尚斌, 等. 2015. 四种园林植物对土壤镉污染的耐受性[J]. 生态学报, 35(8): 2536-2544. |
| 郭艳丽, 台培东, 冯倩, 等. 2009. 沈阳张士灌区常见木本植物镉积累特征[J]. 安徽农业科学, 37(7): 3205-3207. DOI:10.3969/j.issn.0517-6611.2009.07.140 |
| 韩玉丽, 邱尔发, 王亚飞, 等. 2015. 北京市土壤和TSP中重金属分布特征及相关性研究[J]. 生态环境学报, 24(1): 146-155. |
| 何翠屏, 王慧忠. 2003. 重金属镉、铅对草坪植物根系代谢和叶绿素水平的影响[J]. 湖北农业科学, (5): 60-63. DOI:10.3969/j.issn.0439-8114.2003.05.025 |
| 何佳丽. 2014. 杨树对重金属镉胁迫的分子生理响应机制研究[D]. 咸阳: 西北农林科技大学 |
| He S, Wu Q, He Z. 2013. Effect of DA-6 and EDTA alone or in combination on uptake, subcellular distribution and chemical form of Pb in Lolium perenne[J]. Chemosphere, 93(11): 2782-2788. DOI:10.1016/j.chemosphere.2013.09.037 |
| 黄晓纯, 刘昌弘, 张军, 等. 2013. ICP-MS测定蔬菜样品中重金属元素的两种微波消解前处理方法[J]. 岩矿测试, 32(3): 415-419. DOI:10.3969/j.issn.0254-5357.2013.03.010 |
| Lai H Y. 2015. Subcellular distribution and chemical forms of cadmium in Impatiens walleriana in relation to its phytoextraction potential[J]. Chemosphere, 138. |
| Li C C, Dang F, Cang L, et al. 2014. Integration of metal chemical forms and subcellular partitioning to understand metal toxicity in two lettuce (Lactuca sativa L.) cultivars[J]. Plant & Soil, 384(1/2): 201-212. DOI:10.1007/s11104-014-2194-6 |
| Li H, Luo N, Zhang L J, et al. 2016. Do arbuscular mycorrhizal fungi affect cadmium uptake kinetics, subcellular distribution and chemical forms in rice?[J]. Ence of the Total Environment, 571(15): 1183-1190. |
| 李瑞, 陈锦平, 陈红纯, 等. 2018. 水淹条件下秋华柳亚细胞中镉的分配特征[J]. 生态学报, 38(1): 186-194. |
| 李松. 2015. 重金属胁迫下毛竹幼苗生理响应及其吸收规律研究[D]. 杭州: 浙江农林大学 |
| 李秀珍, 李彬. 2008. 重金属对植物生长发育及品质的影响[J]. 安徽农业科学, 36(14): 5742-5746. DOI:10.3969/j.issn.0517-6611.2008.14.025 |
| 李叶, 黄华平, 邓睿, 等. 2016. 不同固定条件对几种植物样品超微结构的影响[J]. 热带作物学报, 37(11): 2100-2105. DOI:10.3969/j.issn.1000-2561.2016.11.011 |
| 廖妤婕. 2014. 丛枝菌根真菌作用下桉树对土壤中Pb、Zn和Cd的耐受机理研究[D]. 南宁: 广西大学 |
| 刘清泉, 陈亚华, 沈振国, 等. 2014. 细胞壁在植物重金属耐性中的作用[J]. 植物生理学报, 50(5): 605-611. |
| 刘周莉, 何兴元, 陈玮. 2013. 忍冬——一种新发现的镉超富集植物[J]. 生态环境学报, 22(4): 666-670. DOI:10.3969/j.issn.1674-5906.2013.04.020 |
| Lu H, Li Z, Wu J, et al. 2017. Influences of calcium silicate on chemical forms and subcellular distribution of cadmium in Amaranthus hypochondriacus L[J]. Entific Reports, 7: 40583. |
| 鲁艳. 2017. 香樟等4个树种对Cd2+污染修复潜能的研究[D]. 重庆: 西南大学 |
| 陆仲烟, 刘仲齐, 宋正国, 等. 2013. 大麦中镉的亚细胞分布和化学形态及PCs合成的基因型差异[J]. 农业环境科学学报, 32(11): 2125-2131. DOI:10.11654/jaes.2013.11.004 |
| 彭秋, 李桃, 徐卫红, 等. 2019. 不同品种辣椒镉亚细胞分布和化学形态特征差异[J]. 环境科学, 40(7): 3347-3354. |
| Pollard A J. 2016. Heavy metal tolerance and accumulation in plants of the southeastern United States[J]. Castanea, 81(4): 257-269. DOI:10.2179/16-084 |
| Sarwar N, Imran M, Shaheen M R, et al. 2017. Phytoremediation strategies for soils contaminated with heavy metals: Modifications and future perspectives[J]. Chemosphere, 171: 710-721. DOI:10.1016/j.chemosphere.2016.12.116 |
| 孙春媛, 赵文吉, 郑晓霞, 等. 2016. 北京城区土壤重金属空间分布及与降尘的关联性分析[J]. 中国科技论文, 11(9): 1035-1040. DOI:10.3969/j.issn.2095-2783.2016.09.013 |
| 唐敏, 张欣, 王美仙. 2019. 北京37种园林植物对4种重金属的富集力及其分级评价研究[J]. 西北林学院学报, 34(5): 263-268. DOI:10.3969/j.issn.1001-7461.2019.05.40 |
| Uraguchi S, Kiyono M, Sakamoto T, et al. 2009. Contributions of apoplasmic cadmium accumulation, antioxidative enzymes and induction of phytochelatins in cadmium tolerance of the cadmium-accumulating cultivar of black oat (Avena strigosa Schreb.)[J]. Planta, 230(2): 267-276. DOI:10.1007/s00425-009-0939-x |
| Wang C R, Luo X, Yuan T, et al. 2012. Biphasic effects of lanthanum on Vicia faba L. seedlings under cadmium stress, implicating finite antioxidation and potential ecological risk[J]. Chemosphere, 86(5): 530-537. DOI:10.1016/j.chemosphere.2011.10.030 |
| 王帆宇. 2016. 中国快速城市化进程中的环境污染: 形势研判、归因与应对策略[J]. 生态经济, 32(3): 174-180. DOI:10.3969/j.issn.1671-4407.2016.03.035 |
| Wang W J, Zhang M Z, Liu J N. 2017. Subcellular distribution and chemical forms of Cd in Bougainvillea spectabilis Willd. as an ornamental phytostabilizer: an integrated consideration[J]. International Journal of Phytoremediation, 20(11): 1087-1095. |
| 王晓娟, 王文斌, 杨龙, 等. 2015. 重金属镉(Cd)在植物体内的转运途径及其调控机制[J]. 生态学报, 35(23): 7921-7929. |
| Xin J, Zhao X, Tan Q, et al. 2017. Comparison of cadmium absorption, translocation, subcellular distribution and chemical forms between two radish cultivars (Raphanus sativus L.)[J]. Ecotoxicology and Environmental Safety, 145: 258-265. DOI:10.1016/j.ecoenv.2017.07.042 |
| Yang L P, Zhu J, Wang P, et al. 2018. Effect of Cd on growth, physiological response, Cd subcellular distribution and chemical forms of Koelreuteria paniculata[J]. Ecotoxicology and Environmental Safety, 160: 10-18. DOI:10.1016/j.ecoenv.2018.05.026 |
| 杨少斌, 于鑫, 孙向阳, 等. 2018. 北京城区绿地土壤重金属污染评价与空间分析[J]. 生态环境学报, 27(5): 933-941. |
| 杨卫东, 陈益泰, 屈明华. 2009. 镉在旱柳中亚细胞分布及存在的化学形态[J]. 西北植物学报, 29(7): 1394-1399. DOI:10.3321/j.issn:1000-4025.2009.07.016 |
| Yao Y, Fu P N, Huang Q Q, et al. 2019. Accumulation, subcellular distribution, and oxidative stress of cadmium in Brassica chinensis supplied with selenite and selenate at different growth stages[J]. Chemosphere, 216: 331-340. DOI:10.1016/j.chemosphere.2018.10.138 |
| 张国静, 杨伟强. 2012. 北京地区主要行道树树种适应性评价及病虫害防治[J]. 中国城市林业, 10(3): 47-50. DOI:10.3969/j.issn.1672-4925.2012.03.016 |
| 周芙蓉, 王进鑫, 张青, 等. 2012. 侧柏和国槐叶片中铅的化学形态与分布研究[J]. 农业环境科学学报, 31(11): 2121-2127. |
| Zhou J T, Wan H X, He J L, et al. 2017. Integration of cadmium accumulation, subcellular distribution, and physiological responses to understand cadmium tolerance in apple rootstocks[J]. Frontiers in Plant Science, 8: 966. DOI:10.3389/fpls.2017.00966 |
