 , 王丽1
, 王丽1
 , 莫康乐1, 李卫明2, 陈求稳1
, 莫康乐1, 李卫明2, 陈求稳11. 南京水利科学研究院, 南京 210029;
2. 三峡大学水利与环境学院, 宜昌 443002
收稿日期: 2020-07-26; 修回日期: 2020-09-30; 录用日期: 2020-09-30
基金项目: 国家重点研发计划(No.2019YFC0408901)
作者简介: 胡威(1995—), 男, E-mail: 1218241803@qq.com
通讯作者(责任作者): 王丽(1986—), 女, 博士, 讲师, 硕士生导师, 主要从事生态水力学方面的研究. E-mail: syauwangli@126.com
摘要:构建适用于城市大型底栖动物的生境适宜性模型,探究大型底栖动物与生境因子间的响应关系,对城市河流生态系统恢复具有重要指示意义.本文以长江下游北岸扬州市城市河网为研究对象,基于丰水期(2018年8月)和枯水期(2019年1月)的大型底栖动物调查数据,利用典范对应分析与相关性分析筛选城市河网生态健康的关键生境因子,采用GAM模型拟合关键生境因子与大型底栖动物优势种的关系,构建城市大型底栖动物生境特征研究模型.结果表明,本次调查共获得大型底栖动物48个物种,隶属3门6纲13目20科40属,其中,水生昆虫为优势类群,霍甫水丝蚓(Limnodrilus hoffmeisteri)为研究区域优势种.影响优势种霍甫水丝蚓的主要生境因子为溶解氧(DO)、CODMn、NH3-N、电导率(Cond),当霍甫水丝蚓生境适宜度为1.0时,水体中NH3-N含量界限值为0.554 mg·L-1,CODMn界限值为2.23 mg·L-1,DO界限值为7.87 mg·L-1,Cond界限值为272.5 S·m-1.GAM模型能识别城市水环境关键问题,有效解释城市大型底栖动物与生境因子间的响应关系,可为城市河网水生态修复提供参考依据.
关键词:城市河网大型底栖动物GAM模型生境因子
Community structure and habitat characteristics of macrobenthos in river network of Yangzhou City
HU Wei1,2
 , WANG Li1
, WANG Li1
 , MO Kangle1, LI Weiming2, CHEN Qiuwen1
, MO Kangle1, LI Weiming2, CHEN Qiuwen11. Nanjing Hydraulic Research Institute, Nanjing 210029;
2. College of Hydraulic and Environmental Engineering, China Three Gorges University, Yichang 443002
Received 26 July 2020; received in revised from 30 September 2020; accepted 30 September 2020
Abstract: Constructing a habitat suitability model suitable for urban macrobenthos and exploring the response relationship between macrobenthos and habitat factors are of great significance to the restoration of urban river ecosystems. This paper takes the urban river network of Yangzhou City on the north bank of the lower reaches of the Yangtze River as the research object. Based on the large-scale benthic survey data in the wet season (August 2018) and the dry season (January 2019), canonical correspondence analysis and correlation analysis were applied to screen the key habitat factors for the ecological health of urban rivers. The GAM model was used to fit the relationship between the key habitat factors and the dominant macrobenthos species in order to construct the urban macrobenthos habitat characteristic research model. The results showed a total of 48 species of macrobenthos were obtained from the survey, belonging to 3 phyla, 6 classes, 13 orders, 20 families and 40 genera. Insecta was the dominant population and Limnodrilus hoffmeisteri was the dominant species in the study area. The main habitat factors affecting dominant species Limnodrilus hoffmeisteri were DO, CODMn, NH3-N, Cond. The habitat suitability of Limnodrilus hoffmeisteri was 1.0, while the limit value of NH3-N, CODMn, DO and Cond were 0.554, 2.23, 7.87 mg·L-1 and 272.5 S·m-1, respectively. GAM model can identify the key problems of urban water environment, effectively explaining the response relationship between urban macrobenthos and habitat factors, and providing a reference basis for the ecological restoration of urban river network water.
Keywords: urban river networkmacroinvertebratesGAM modelhabitat factors
1 引言(Introduction)大型底栖动物群落是水生食物链的重要组成部分, 对水生态系统的健康具有重要意义(Butkas et al., 2010;Zhao et al., 2019).目前, 许多水生态系统出现栖息地丧失和生境退化的症状, 导致大型底栖动物生物多样性下降(Geist, 2011).其中较为严重的是城市河流生态系统, 随着人类活动影响加剧, 引发了一系列“城市溪流综合症(Urban Stream Syndrome)” (王强等, 2017).相较于自然河流, 城市河流具有明显的人工干扰特点(Gezie et al., 2017), 且平原城市地区一般地势平坦、河网纵横交错, 不利于污染物的扩散和稀释, 伴随着入河污水的加剧, 河流水质和水生生物群落明显退化, 城市河流生态系统健康受到了严重威胁(Mckinney, 2008).因此, 研究大型底栖动物群落对城市流域生境的需求, 建立准确的底栖动物与生境因子间的响应关系, 对流域水资源管理、城市河流生态恢复有重要的意义(陈凌娜等, 2018).
生境适宜性模型是研究生境因子对大型底栖动物群落综合影响的有效工具(Yi et al., 2018), 可以加深生境-群落关系的理解, 探索多种因子对群落的综合效应(Ahmadi et al., 2006), 从而准确评价大型底栖动物群落栖境适宜性的需求.选择合适的生境适宜性评价方法是构建生境适宜性模型的前提, 近年来, 研究人员开发了各种生境适宜性评价方法, 如生境适宜性指数、广义线性模型(Generalize Linear Model, GLM)、广义加性模型(Generalized Additive Model, GAM)、人工神经网络(ANNs)和模糊逻辑评价法等(Yi et al., 2014;Irene et al., 2018;Yigezu et al., 2018), 这些方法大多已被应用于研究栖息地适宜性和河流生境质量评价当中.Mouton等(2011)利用模糊逻辑评价法进行褐鳟鱼生境适宜性评价;Yi等(2016)利用广义加性模型对长江中华鲟进行生境适宜性评价;郑文浩等(2011)通过加权平均法和无度量多维标定(NMS)法研究了太子河流域大型底栖动物优势种群的栖息地适宜度;Gevrey等(2005)利用5种模型(ANNs、GAM、回归树、偏最小二乘法和多元线性回归)预测了荷兰大型底栖动物的物种丰富度和功能性摄食群.
目前, 底栖动物生境适宜性研究主要集中于自然河流生态系统, 有关城市河流生态系统中生境因子对大型底栖动物群落的影响研究还不够深入, 且大型底栖动物群落与生境因子之间的关系通常是非线性的、高度复杂的(Yi et al., 2018), 传统的生境适宜性评价方法难以明确地描述这些关系.基于此, 本文选择扬州市城市河网作为研究对象, 利用典范对应分析与相关性分析筛选城市河流生态环境健康的关键生境因子, 采用GAM模型拟合关键生境因子与大型底栖动物优势种的联系, 构建大型底栖动物生境特征研究模型, 以期为城市河流生境质量评价和生态修复提供理论基础.
2 材料与方法(Materials and methods)2.1 研究区域本文研究对象选为扬州市城市河网.扬州市地处江苏省中部, 长江下游北岸, 江淮平原南端.现辖区域位于东经119°01′~119°54′、北纬31°56′~33°25′.全市总面积为6591 km2, 陆地面积为4856 km2, 水域面积为1735 km2, 其中, 扬州市流域内河渠纵横交错, 主要河流有古运河、大运河、七里河等, 主要水系有大运河水系、淮河入江水道水系、长江水系等, 是长三角地区典型平原水网区的代表, 具有十分重要的水源战略地位.
为整体研究扬州市河网大型底栖动物群落分布特征, 分析大型底栖动物与生境因子间的响应机制, 本团队于丰水期(2018年8月)和枯水期(2019年1月)在扬州市河网进行了2次水生态调查, 采样点选取遵循每条城市内河不少于1个采样点位的原则, 共布设30个采样点位, 基本覆盖整个流域各种生境状况(图 1).
图 1(Fig. 1)
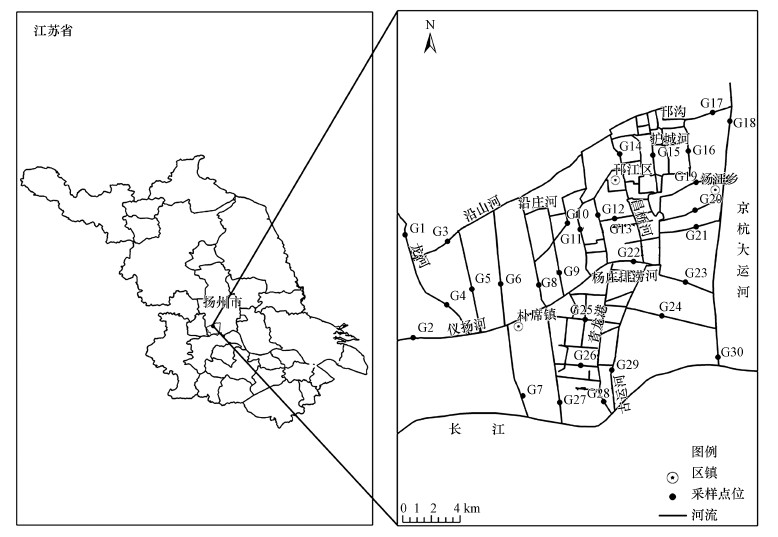 |
| 图 1 扬州市研究区域及采样站位 Fig. 1The study area of Yangzhou City and the sampling sites |
2.2 采样方法2.2.1 大型底栖动物采集依据《生物多样性观测技术导则淡水底栖大型无脊椎动物》的规定, 利用直径30 cm、60目孔径尼龙纱D型网在小于1.5 m深的河岸区用扫网法采集半定量和半定性底栖动物样品, 采集时每个样点在100 m长的河段范围内, 按照不同生境出现的比例采集, 采样样方为1~10个, 采样总面积为0.3~3 m2.样本在野外用60目分样筛筛选后放入封口袋, 加入10%甲醛溶液固定(王硕等, 2019), 在实验室内体式镜下进行分类鉴定和计数;鉴定时, 所有生物个体均被鉴定到可行的最低分类单元, 通常为属或种级.
2.2.2 生境因子采集样品采集方法均根据《地表水和污水监测技术规范》(HJ/T91—2002)进行.本次调查的生境因子包括:总氮(TN)、总磷(TP)、氨氮(NH3-N)、正磷酸盐(PO43-)、化学需氧量(CODMn)、浊度(Tur)、水深(Dep)、溶解氧(DO)、水温(Tem)、酸碱度(pH)、电导率(Cond)、悬浮颗粒物(SS).其中, 水深、水温、电导率、浊度、pH、DO等利用便携式YSI 6600水质监测仪(美国)现场测定;利用500 mL水样瓶采取水样, 置于-20 ℃冰箱中冷冻保存, 带回实验室测定其余生境因子, 测定分析方法参照《水和废水监测分析方法》(第4版).
2.3 数据分析2.3.1 大型底栖动物群落特征指数采用优势度指数(Y)对扬州市河网大型底栖动物群落多样性进行分析.
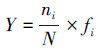 | (1) |
2.3.2 统计分析本文首先对生境因子进行K-S正态检验, 符合正态分布的指标进行Pearson相关分析, 不符合的进行Spearman相关分析, 以相关系数|r|>0.75为阈值(粟一帆等, 2019).再利用束缚型排序(Constrained Ordination)识别对大型底栖动物有显著影响的因子(邢圆等, 2019), 所有的生物数据在分析前进行log(x+1)转换.对底栖动物相对丰度矩阵进行去趋势对应分析(DCA), 若计算结果中最大的梯度长度大于3, 则选择单峰模型典范对应分析(CCA), 反之选择线性模型(RDA)进行分析.为减少实验分析误差, 选择相对丰度>1%的底栖动物种群进行分析(宋秀凯等, 2019).运用SPSS 22进行Pearson、Spearman相关性分析, 采用CANOCO 5进行DCA、CCA、RDA分析.
2.3.3 广义加性模型(GAM)利用广义加性模型(GAM) (Yi et al., 2016)来建立目标物种与关键生境因子的生境适宜度评价模型.自变量为优势物种在采样点位出现的个数, 因变量为采样点位的关键生境因子, 广义加性模型一般公式见式(2).
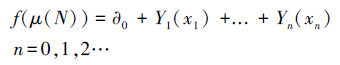 | (2) |
GAM模型拟合精度通过各步骤的残差偏差减少量来衡量.残差偏差是拟合模型的偏差, 类似于线性模型中的残差平方和(Wood, 2008), 采用逐步回归法计算残差偏差, 具体公式见式(3).
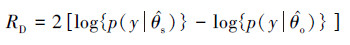 | (3) |
广义加性模型采用R软件的“mgcv”工具包进行分析, 基础数据处理在Excel 2010中完成.
3 结果与分析(Results and analysis)3.1 大型底栖动物群落组成和优势种本次调查共获得大型底栖动物48个物种共1610头, 隶属3门6纲13目20科40属.其中, 昆虫纲(Insecta)为优势种群, 物种数为21种, 隶属3目6科20属, 占总分类单元的44%;腹足纲(Gastropoda)11种, 共2目5科7属, 占比23%;其次是蛭纲(Hirudinea)7种, 共3目3科5属, 占比15%;寡毛纲(Oligochaeta)为4种, 共1目1科3属, 占比8%;双壳纲(Bivalvia)物种数相对较少为3种, 共3目3科3属, 占比6%;甲壳纲(Crustacea)物种数最少为2种, 隶属1目2科2属, 占比4%(图 2).对研究区域所有点位的底栖动物优势度进行统计, 优势度大于0.001的物种有28种, 各样点优势类群差别较大.其中, 主要优势种有霍甫水丝蚓Limnodrilus hoffmeisteri(Y=3.37)、黄色羽摇蚊Chironomus plumosus(Y=2.22)、柔嫩雕翅摇蚊Glyptotendipes cauliginellus(Y=1.14)、红裸须摇蚊Propsilocerus akamusi(Y=1.05)、铜锈环棱螺Bellamya aeruginosa(Y=0.653).其中, 霍甫水丝蚓在所有点位出现的频率均高于50%, 是广泛分布物种, 本文以霍甫水丝蚓为指示物种进行研究.
图 2(Fig. 2)
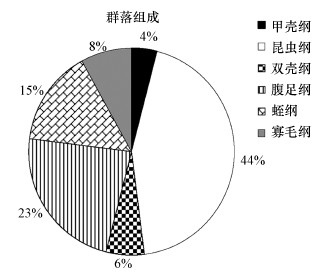 |
| 图 2 扬州市河网大型底栖动物群落结构 Fig. 2Community structure of macrobenthos in Yangzhou City |
3.2 影响大型底栖动物种分布的关键生境因子筛选3.2.1 扬州市城市河网生境因子特征扬州市河网生境因子指标的最大值、最小值、平均值及标准差描述性统计分析见表 1.总体来看, 扬州市流域生境状况较差, 水体污染严重.根据国家地表水质量标准(GB 3838—2002), TN、TP的最大值(2.635 mg·L-1、0.647 mg·L-1)均超过Ⅱ类标准限值2倍以上, NH3-N的最大值也远超过了Ⅱ类标准限值, 整体水质处于Ⅲ类水, 个别点位(G5、G11)达到了Ⅴ类水标准.扬州市区河流为典型的城市河流, 沿程水深、pH变化不大, 底质类型较为单一, 大多采用混泥土或浆砌石结构进行护坡或护砌.
表 1(Table 1)
| 表 1 扬州市河网生境因子值 Table 1 Values of habitat factor in Yangzhou River | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 扬州市河网生境因子值 Table 1 Values of habitat factor in Yangzhou River
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.2.2 关键生境因子对大型底栖动物的影响通过相关性分析(表 2)可知, 以相关系数|r|>0.75为阈值剔除相关性较强的因子, 筛选出的关键生境因子有7个, 分别为总氮(TN)、总磷(TP)、氨氮(NH3-N)、化学需氧量(CODMn)、电导率(Cond)、溶解氧(DO)、浊度(Tur).对大型底栖动物相对丰度矩阵进行DCA分析, 结果显示, 最大的梯度长度为3.5, 本文选择CCA分析关键生境因子与大型底栖动物的关联性.CCA分析结果如表 3、图 3所示.
表 2(Table 2)
| 表 2 相关分析结果 Table 2 Results of Spearman and Pearson correlation analysis | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2 相关分析结果 Table 2 Results of Spearman and Pearson correlation analysis
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 3(Table 3)
| 表 3 大型底栖动物群落与环境因子的典范对应分析结果 Table 3 CCA analysis of macrobenthos community structure and environmental factors | |||||||||||||||||||||||||
表 3 大型底栖动物群落与环境因子的典范对应分析结果 Table 3 CCA analysis of macrobenthos community structure and environmental factors
| |||||||||||||||||||||||||
图 3(Fig. 3)
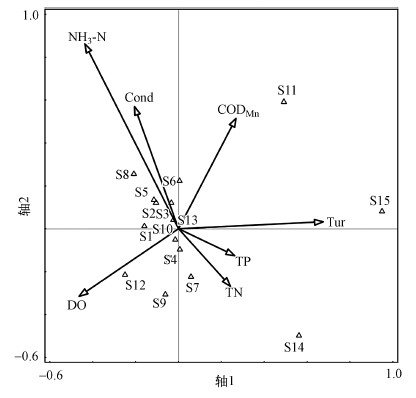 |
| 图 3 大型底栖动物群落与环境因子的典范对应分析排序图 (注:S1为Dicrotendipes sp.;S2为Glyptotendipes tokunagai;S3为Limnodrilus hoffmeisteri;S4为Glyptotendipes cauliginellus;S5为Bellamya aeruginosa;S6为Helobdella nuda;S7为Cricotopus sp.;S8为Eukiefferiella sp.;S9为Propsilocerus sp.;S10为Propsilocerus akamusi;S11为Alocinma longicornis;S12为Parafossarulus eximius;S13为Chironomus plumosus;S14为Branchiura sowerbyi;S15为Cardina denticulate.) Fig. 3CCA analysis ordination chart of macrobenthos community structure and environmental factors |
由CCA排序表可得, 前两个排序轴的特征值较大, 分别为0.403和0.389, 累计解释了13.68%和52.98%的优势物种数据方差变异和物种-环境关系变异, 轴3和轴4的特征值和解释率都相对较低.两个物种排序轴和环境排序轴近似垂直, 相关系数分别为0.01和0, 表明排序轴与环境因子间的线性结合程度较好地反映了底栖动物与环境因子之间的关系, 排序结果可靠.由CCA排序图可以看出(图 3), 轴1与环境因子Tur、DO的相关性较高, 轴2与环境因子CODMn、NH3-N、Cond的相关性较高, 表明这些因子对大型底栖动物丰度影响显著.优势种霍甫水丝蚓(S3)与DO、Tur的夹角为钝角, 与Cond、NH3-N、CODMn的夹角为锐角, 表明霍甫水丝蚓与DO、Tur呈负相关, 与Cond、NH3-N、CODMn呈正相关.
3.3 大型底栖动物与生境因子的响应关系由CCA分析可得, 影响扬州市河网大型底栖动物优势种的主要生境因子为Tur、DO、CODMn、NH3-N、Cond.利用逐步回归法筛选加入GAM模型中的生境因子, 其过程见表 4.GAM模型1到模型4中分别加入DO、CODMn、NH3-N、Cond后, 模型的残差偏差逐渐减小, 模型的性能显著增加(p < 0.05), 模型5中增加Tur因子后模型的性能并未改善(p>0.05), 故删除Tur.最终得到的GAM模型为模型4:s(DO)+ s(CODMn)+s(NH3-N)+s(Cond).模型拟合后生境因子DO、CODMn、NH3-N、Cond的决定系数R2分别为0.915、0.904、0.933和0.917, 拟合效果较好, 具体结果见图 4.由图 4可得, 优势种霍甫水丝蚓生境适宜度为1.0时, 水体中NH3-N含量界限值为0.554 mg·L-1, CODMn界限值为2.23 mg·L-1, DO界限值为7.87 mg·L-1, Cond界限值为272.5 S·m-1.
表 4(Table 4)
| 表 4 逐步回归过程方差分析表 Table 4 Variance analysis table of the forward stepwise regression process | ||||||||||||||||||||||||
表 4 逐步回归过程方差分析表 Table 4 Variance analysis table of the forward stepwise regression process
| ||||||||||||||||||||||||
图 4(Fig. 4)
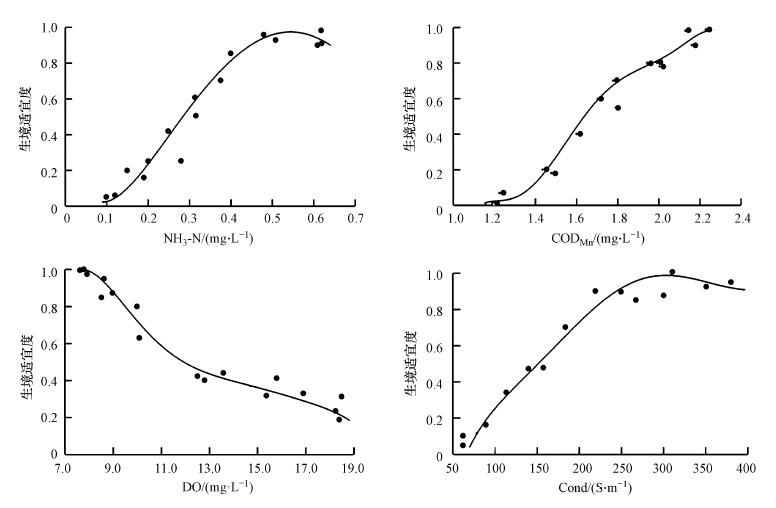 |
| 图 4 扬州市河网大型底栖动物优势物种生境适宜度 Fig. 4Habitat suitability of dominant macrobenthos species in Yangzhou City |
4 讨论(Discussion)4.1 城市水体大型底栖动物群落结构差异分析本研究中, 于扬州市城市河网共采集到大型底栖动物48种, 其中, 昆虫纲物种数最多, 以摇蚊科为绝对优势种群, 耐污种(霍甫水丝蚓Limnodrilus hoffmeisteri等)占据主导位置, 敏感物种(静泽蛭Helobdella stagnalis等)占比较小.大型底栖动物的群落组成依赖于河流生境的稳定性和多样性, 不同河流生境支持不同的大型底栖动物种群(张宇航等, 2018).同时, 与自然河流环境条件季节波动相比, 城市河流底栖动物季节变化相对较弱.结合扬州市河流的地理位置和采样点分布情况, 采样点均位于典型的城市受干扰河流中, 河道渠化较为普遍, 此外, 在G12、G19点位附近还存在多处水坝、排污管等设施, 水利设施的建设对水生昆虫的迁徙有一定阻碍作用(Blakely et al., 2006), 同时也降低了大型底栖动物的完整性(韩鸣花等, 2012).研究表明, 河道渠化、水坝、排水管等设施建设改变了城市河流的生境结构, 导致底质类型单一化, 大型底栖动物的多样性降低(Ramírez et al., 2012).扬州市河道底质主要以淤泥为主, 淤泥中有机物含量丰富, 城市污水、生活污水的排入也使得N、P等物质增加, 水体污染严重, 致使十足目、吻蛭目、EPT昆虫等敏感物种逐渐减少, 摇蚊科、寡毛类等耐污种成为主导种群.王强等(2017)在研究城市化进展对河流大型底栖动物群落的影响中发现, 城市河流底栖动物季节波动规律相对较弱, 以EPT昆虫为代表的敏感物种在城市河流中完全消失或者明显减少, 寡毛类、摇蚊类等耐污种成为优势种群, 这与本研究结果一致.综上, 城市化过程对底栖动物群落结构的影响是十分清晰的, 主要是由于高强度的人工干扰及水利设施建设导致的群落结构差异.此外, 城市化是一个漫长的过程, 今后底栖动物的研究中应补充较长的时间尺度, 在典型的城市河流研究区域对大型底栖动物进行长期的监测, 可为研究城市化与大型底栖动物间的关联性提供参考依据.
4.2 城市水体大型底栖动物GAM模型适用性分析DO、CODMn、NH3-N、Cond的拟合结果显示R2分别为0.915、0.904、0.933和0.917, GAM模型拟合结果能较好地解释城市大型底栖动物优势物种与生境因子的关系.与GLM(Vasconcelos et al., 2013)、城市河流生境评价方法(罗坤, 2017)等相比, GAM模型可以处理自变量和因变量之间的高度非线性、非单调的关系(Ahmadi et al., 2006).针对城市底栖动物和生境因子间的复杂性, GAM模型能有效识别水环境中的关键控制因子, 从而采取不同的策略建模, 最后以图形曲线的形式直观反映城市大型底栖动物与生境因子间的关系, 加深对城市水生态系统的理解(Alan, 2007).目前, GAM模型已经广泛应用于探究鱼类(Oskar et al., 2019)、沉水植物(Yu et al., 2020)物种分布与环境因子之间的关系, 但在城市大型底栖动物与环境变量上研究还不深入.Castella等(2010)应用GAM模型探究了大型底栖动物丰度与环境因子间的关联性, 通过偏差解释率、显著性检验值等指标确定NH3-N、温度等6个环境因子对大型底栖动物丰度影响最大.赵静等(2017)基于GAM模型研究了马鞍列岛海域大型底栖动物优势物种的分布特征及其与各环境因子的关系.但GAM模型也存在一个潜在问题, 即无法给出具体的参数函数(易雨君等, 2013), 在预测底栖动物的空间分布时会产生一定影响.综上, GAM模型适用于分析城市大型底栖动物与生境因子间的联系, 有效识别城市水环境中的关键问题, 此外, 在今后的工作中还需考虑不同生境适宜性评价方法间的比较与整合.
4.3 大型底栖动物优势物种与生境因子的关系研究结果显示, 影响扬州市底栖动物优势种生境质量的主要因子为CODMn、NH3-N、DO、Cond.其中, 霍甫水丝蚓与CODMn、NH3-N和Cond呈正相关, 与DO呈负相关.扬州市河网水体污染物主要来自排入的城市生活污水和工业废水, 有机物含量均较高, 而COD是测定城市河流有机物含量的重要指标(Beisel et al., 1998).GAM模型中显示, 优势物种霍甫水丝蚓生境适宜度随着CODMn升高而升高, 到达界限值2.23 mg·L-1后又缓慢降低.霍甫水丝蚓是耐污种, 多分布在工业废水排污口、污水处理厂排污口处, 随着CODMn升高, 水体中有机物分解降低了城市河流中的溶解氧含量, 抑制了喜富氧环境的大型底栖动物, 促进了耐低氧的寡毛类、摇蚊类的生长(Correa-Araneda et al., 2010), 同时污水中含有大量的丝状细菌, 会抑制敏感物种的生长(Pond, 2010).随着CODMn持续增加, 水体逐渐富营养化, 导致大型底栖动物群落结构稳定性降低(龚志军等, 2001), 优势种霍甫水丝蚓的生境适宜度逐渐下降.有研究表明, NH3-N对大型底栖动物生长的影响尤为显著(Miserendino et al., 2008), 且与水体中pH、温度密切相关(石小荣等, 2012).GAM模拟结果显示, 优势种霍甫水丝蚓的生境适宜度随着NH3-N浓度的增加而增加, 最终NH3-N浓度界限值为0.554 mg·L-1, 表明霍甫水丝蚓适宜在高氨氮水体中生存, 这与Miserendino等(2008)的研究结果一致.NH3-N是城市水体中水生植物和藻类生长必需的营养盐, 水体中水生植物可以利用氮元素提高大型底栖动物的生产力(Johnson et al., 2013), 同时, 水中NH3-N浓度增加会使得大量营养物质被微生物分解, 消耗水中氧气, 从而抑制低氧底栖动物的生长(Siuda et al., 2020).DO是水体中大型底栖动物生存的必要因子(粟一帆等, 2020), 也影响着大型底栖动物的丰度度和分布格局(Pedersen et al., 2007).GAM拟合结果表明, 随着DO浓度升高, 优势种的生境适宜度逐渐下降, DO浓度界限值为7.87 mg·L-1.孟云飞等(2019)在研究大型底栖动物的水环境因子阈值时发现, 水丝蚓属中的霍甫水丝蚓DO阈值为7.66 mg·L-1.在低氧环境中, 水体水质、食物的质量下降, 喜富氧环境的底栖动物生存率低下, 耐污型底栖动物对环境的耐受能力较高, 在低氧状态下也能生存.龚志军等(2001)研究发现, 在富营养化且DO浓度低的水环境中, 水丝蚓属、摇蚊属等耐污种群能大量生存, 这与本研究结果一致.电导率是解释城市河流底栖动物群落退化的重要指标(Isabel et al., 2012).模型拟合结果显示, 随着电导率升高, 优势种的生境适宜度逐渐升高, 到达界限值272.5 S·m-1后缓慢下降.扬州市河网污水的排入会提高水体离子的浓度, 对敏感类物种造成威胁(Kaushal et al., 2005), 而电导率反映水体离子的总浓度(Wenger et al., 2009), 电导率越高, 敏感物种越难存活, 只有耐污种(寡毛纲和摇蚊类)能存活.同时, 电导率与城市化干扰强度呈正相关(耿世伟, 2012), 扬州市河网是典型的城市河道, 河道渠化、生活污水排入等现象引起了一系列水污染问题, 致使敏感物种(锯齿新米虾Neocaridina denticulata等)生存率低下, 促进了耐污种(霍甫水丝蚓Limnodrilus hoffmeisteri等)的发展.综上, 本研究通过分析扬州市河网大型底栖动物优势种对生境因子的需求, 确定了优势种的生境因子控制量, 在扬州市城市河流治理中, 可参考CODMn、NH3-N、DO、Cond的控制量来进行生态修复.此外, 量化分析水生生物群落对水环境的需求, 构建城市河流污染物控制体系, 是未来城市河流生态修复的关键.
5 结论(Conclusions)1) 调查发现, 耐污种霍甫水丝蚓(Limnodrilus hoffmeisteri)为研究区域优势种, 表明扬州市河网整体水质较差, 水体污染严重.
2) GAM模型结果显示, 影响优势种霍甫水丝蚓(Limnodrilus hoffmeisteri)的主要生境因子为CODMn、NH3-N、DO、电导率, 表明扬州市河网主要以有机污染物为主, 随着CODMn、NH3-N和电导率升高导致水体中有机物分解, 降低了城市河网中的溶解氧含量, 抑制了喜富氧环境的大型底栖动物, 促进了耐污种的生长.
3) GAM模型能有效解释城市大型底栖动物优势种与生境因子的联系, 识别城市水环境的关键问题, 从而为城市河网有机物污染治理和生态修复提供依据.
参考文献
| Ahmadi N B, St H A, Bérubé M, et al. 2006. A review of statistical methods for the evaluation of aquatic habitat suitability for instream flow assessment[J]. River Research and Applications, 22: 503-523. DOI:10.1002/rra.918 |
| Alan Y C. 2007. Generalized additive models: An introduction with R[J]. Technometrics, 49(3): 360-361. |
| Beisel J N, Usseglio-Polatera P, Thomas S, et al. 1998. Stream community structure in relation to spatial variation: the influence of mesohabitat characteristics[J]. Hydrobiologia, 389(1/3): 73-88. DOI:10.1023/A:1003519429979 |
| Blakely T J, Harding J S, McIntosh A R, et al. 2006. Barriers to the recovery of aquatic insect communities in urban streams[J]. Freshwater Biology, 51(9): 1634-1645. DOI:10.1111/j.1365-2427.2006.01601.x |
| Butkas K J, Vadeboncoeur Y, Vander Z, et al. 2010. Estimating benthic invertebrate production in lakes: A comparison of methods and scaling from individual taxa to the whole-lake level[J]. Aquatic Sciences, 73(1): 153-169. DOI:10.1007/s00027-010-0168-1 |
| Correa-Araneda F, Rivera R, Urrutia J, et al. 2010. Effects of an urban zone on the benthonic macroinvertebrate community of a fluvial ecosystem in southern Chile[J]. Limnetica, 29(2): 183-194. |
| Castella E, Adalsteinsson, Hákon, et al. 2010. Macrobenthic invertebrate richness and composition along a latitudinal gradient of European glacier-fed streams[J]. Freshwater Biology, 46(12): 1811-1831. |
| 陈凌娜, 董斌, 彭文娟, 等. 2018. 升金湖自然湿地越冬鹤类生境适宜性变化研究[J]. 长江流域资源与环境, 27(3): 556-563. DOI:10.11870/cjlyzyyhj201803011 |
| Geist J. 2011. Integrative freshwater ecology and biodiversity conservation[J]. Ecological Indicators, 11(6): 1507-1516. DOI:10.1016/j.ecolind.2011.04.002 |
| Gezie A, Anteneh W, Dejen E, et al. 2017. Effects of human-induced environmental changes on benthic macroinvertebrate assemblages of wetlands in Lake Tana Watershed, Northwest Ethiopia[J]. Environmental Monitoring and Assessment, 189(4): 45-54. |
| Gevrey M, Park Y S, Verdonschot P F M, et al. 2005. Predicting Dutch Macroinvertebrate Species Richness and Functional Feeding Groups Using Five Modelling Techniques//Modelling Community Structure in Freshwater Ecosystems[M]. Berlin Heidelberg: Springer. 158-186 |
| 龚志军, 谢平, 唐汇涓, 等. 2001. 水体富营养化对大型底栖动物群落结构及多样性的影响[J]. 水生生物学报, 25(3): 210-216. DOI:10.3321/j.issn:1000-3207.2001.03.002 |
| 耿世伟. 2012. 河流廊道尺度效应对大型底栖动物群落影响研究[D]. 杭州: 浙江工业大学 |
| 韩鸣花, 于海燕, 周斌, 等. 2012. 城市溪流中径流式低坝对底栖动物群落结构的影响[J]. 生态学报, 32(2): 380-385. |
| Isabel D A A, Ferreira V, Graca M A S. 2012. The performance of biological indicators in assessing the ecological state of streams with varying catchment urbanisation levels in Coimbra, Portugal[J]. Limnetica, 31(1): 141-154. |
| Irene L, Gorosito, Mariano M B, et al. 2018. Advantages of combining generalized linear models and occupancy models to find indicators of habitat selection: Small mammals in agroecosystems as a case study[J]. Ecological Indicators, 85: 1-10. DOI:10.1016/j.ecolind.2017.10.003 |
| Johnson R C, Jin H S, Carreiro M M, et al. 2013. Macroinvertebrate community structure, secondary production and trophic-level dynamics in urban streams affected by non-point-source pollution[J]. Freshwater Biology, 58(5): 843-857. DOI:10.1111/fwb.12090 |
| Kaushal S S, Groffman P M, Likens G E, et al. 2005. Increased salinization of fresh water in the northeastern United States[J]. Proceedings of the National Academy of Sciences of the United States of America, 102(38): 13517-13520. DOI:10.1073/pnas.0506414102 |
| 罗坤. 2017. 城市化背景下河流健康评价研究[D]. 重庆: 重庆大学 |
| Miserendino M L, Brand C, Di P C Y. 2008. Assessing urban impacts on water quality, benthic communities and fish in streams of the Andes Mountains, Patagonia (Argentina)[J]. Water Air and Soil Pollution, 194(1/4): 91-110. |
| Mckinney M L. 2008. Effects of urbanization on species richness: A review of plants and animals[J]. Urban Ecosystems, 11(2): 161-176. DOI:10.1007/s11252-007-0045-4 |
| 孟云飞, 崔恩慧, 鲁甲, 等. 2019. 辽河流域太子河大型底栖动物群落与水环境因子关联性的量化分析[J]. 湖泊科学, 31(6): 1637-1650. |
| Mouton A M, Alcaraz-Hernandez J D, De B B, et al. 2011. Data-driven fuzzy habitat suitability models for brown trout in Spanish Mediterranean rivers[J]. Environmental Modelling & Software, 26(5): 615-622. |
| Oskar K, Karin F, Ariane W, et al. 2019. Scale effects on the performance of niche-based models of freshwater fish distributions[J]. Ecological Modelling, 405: 33-42. DOI:10.1016/j.ecolmodel.2019.05.006 |
| Pond G J. 2010. Patterns of Ephemeroptera taxa loss in Appalachian headwater streams(Kentucky, USA)[J]. Hydrobiologia, 641(1): 185-201. DOI:10.1007/s10750-009-0081-6 |
| Pedersen M L, Friberg N, Skriver J, et al. 2007. Restoration of Skjern River and its valley-Short-term effects on river habitats, macrophytes and macroinvertebrates[J]. Ecological Engineering, 30(2): 145-156. DOI:10.1016/j.ecoleng.2006.08.009 |
| Ramírez A, Engman A, Rosas K G, et al. 2012. Urban impacts on tropical island streams: some key aspects influencing ecosystem response[J]. Urban Ecosystems, 15(2): 315-325. DOI:10.1007/s11252-011-0214-3 |
| 粟一帆, 李卫明, 艾志强, 等. 2019. 汉江中下游生态系统健康评价指标体系构建及其应用[J]. 生态学报, 39(11): 3895-3907. |
| 粟一帆, 李卫明, 李金京, 等. 2020. 桥边河大型底栖动物生境适宜性研究[J]. 生态学报, 40(16): 1-11. |
| 宋秀凯, 程玲, 付萍, 等. 2019. 莱州湾金城海域网采浮游植物年际变化及与环境因子的关系[J]. 生态学报, 39(8): 2784-2793. |
| 石小荣, 李梅, 崔益斌, 等. 2012. 以太湖流域为例探讨我国淡水生物氨氮基准[J]. 环境科学学报, 32(6): 1406-1414. |
| Siuda W, Grabowska K, Kaliński T, et al. 2020. Trophic State, Eutrophication, and the Threats for Water Quality of the Great Mazurian Lake System//Korzeniewska E, Harnisz M, eds. Polish River Basins and Lakes-Part I[M]. Chambridge: Springer. 231-260 |
| Vasconcelos R P, Le P O, Costa M J, et al. 2013. Predicting estuarine use patterns of juvenile fish with generalized linear models[J]. Estuar Coast Shelf Science, 120: 64-74. DOI:10.1016/j.ecss.2013.01.018 |
| 王硕, 张建云, 林育青, 等. 2019. 基于大型底栖动物多度量指数的河流多尺度评价[J]. 环境科学研究, 32(2): 284-292. |
| Wood S N. 2008. Fast stable direct fitting and smoothness selection for generalized additive models[J]. Journal of the Royal Statistical Society, 70(3): 495-518. DOI:10.1111/j.1467-9868.2007.00646.x |
| Wenger S J, Roy A H, Jackson C R, et al. 2009. Twenty-six key research questions in urban stream ecology: an assessment of the state of the science[J]. Journal of the North American Benthological Society, 28(4): 1080-1098. DOI:10.1899/08-186.1 |
| 王强, 庞旭, 王志坚, 等. 2017. 城市化对河流大型底栖动物群落的影响研究进展[J]. 生态学报, 37(18): 6275-6288. |
| 邢圆, 吴小平, 欧阳珊, 等. 2019. 赣江水系大型底栖动物多样性与受胁因子初探[J]. 生物多样性, 27(6): 648-657. |
| 徐兆礼, 王云龙, 沈焕庭, 等. 1995. 长江口最大浑浊带区浮游动物的生态研究[J]. 中国水产科学, 2(1): 39-48. |
| Yi Y J, Sun J, Yang Y F, et al. 2018. Habitat suitability evaluation of a benthic macroinvertebrate community in a shallow lake[J]. Ecological Indicators, 90: 451-459. |
| Yi Y J, Cheng X, Wieprecht S, et al. 2014. Comparison of habitat suitability models using different habitat suitability evaluation methods[J]. Ecological Engineering, 71: 335-345. |
| Yigezu G, Mandefro B, Mengesha Y, et al. 2018. Habitat suitability modelling for predicting potential habitats of freshwater snail intermediate hosts in Omo-Gibe river basin, Southwest Ethiopia[J]. Ecological Informatics, 45: 70-80. |
| Yi Y J, Sun J, Zhang S H, et al. 2016. Assessment of Chinese sturgeon habitat suitability in the Yangtze River (China): comparison of generalized additive model, data-driven fuzzy logic model, and preference curve model[J]. Journal of Hydrology, 536: 447-456. |
| 易雨君, 程曦, 周静. 2013. 栖息地适宜度评价方法研究进展[J]. 生态环境学报, 22(5): 887-893. |
| Yu F Y, Yu J Y, Wen J W, et al. 2020. Generalized additive models for biomass simulation of submerged macrophytes in a shallow lake[J]. Science of the Total Environment, 711: 108-135. |
| Zhao C, Shao N, Yang S, et al. 2019. Integrated assessment of ecosystem health using multiple indicator species[J]. Ecological Engineering, 130: 157-168. |
| 张宇航, 张敏, 张海萍, 等. 2018. 北京河流大型底栖动物空间格局及其环境响应研究[J]. 生态毒理学报, 13(4): 101-110. |
| 赵静, 梁金玲, 周曦杰, 等. 2017. 基于GAM模型的马鞍列岛海域优势甲壳类与环境因子的关系研究[J]. 南方水产科学, 13(3): 26-35. |
| 郑文浩, 渠晓东, 张远, 等. 2011. 太子河流域大型底栖动物栖境适宜性[J]. 环境科学研究, 24(12): 1355-1363. |
