 , 李茹莹
, 李茹莹

天津大学环境科学与工程学院, 天津 300350
收稿日期: 2020-07-07; 修回日期: 2020-08-24; 录用日期: 2020-08-24
基金项目: 国家水体污染控制与治理科技重大专项(No.2017ZX07106004)
作者简介: 陶玥彤(1995—), 女, E-mail: taoyuetong@tju.edu.cn
通讯作者(责任作者): 李茹莹, E-mail: liruying@tju.edu.cn
摘要:生物电化学系统已被证明可以有效降解废水或污泥中的抗生素,但对于河道沉积物中抗生素降解效果的研究还十分有限.本研究以河道沉积物为底物,考察了沉积物中本底抗生素在微生物电解池(microbial electrolysis cell,MEC)和微生物燃料电池(microbial fuel cell,MFC)中的去除、迁移和降解效率,以及反应器运行期间的电化学性能和微生物种群结构变化.结果显示,MEC和MFC均可以强化沉积物中抗生素的去除,喹诺酮类抗生素和四环素类抗生素中的CTC的去除是向上覆水中迁移与生物电化学降解共同作用的结果,而大环内酯类抗生素和四环素类抗生素中的TC和OTC的去除主要是依靠生物电化学降解作用.TC和OTC在MEC中的降解效率分别比MFC高出82.6%和29.5%,而MFC对大环内酯类抗生素的降解效率比MEC高27.6%~40.6%.电化学性能测试结果显示,以河道沉积物为底物的MFC内阻较大导致其功率密度相对较低,但MFC阳极比MEC阳极表现出了更好的氧化效果.微生物种群结构变化分析发现,门水平上的Proteobacteria及其对应的纲水平上的Deltaproteobacteria和Gammaproteobacteria可能对抗生素的强化去除起到了主要的积极作用,而且MFC阳极比MEC更容易富集Proteobacteria.
关键词:微生物电解池微生物燃料电池抗生素河道沉积物
Enhanced removal of antibiotics from the river sediments by bioelectrochemical systems
TAO Yuetong
 , LI Ruying
, LI Ruying

School of Environment Science and Engineering, Tianjin University, Tianjin 300350
Received 7 July 2020; received in revised from 24 August 2020; accepted 24 August 2020
Abstract: Bioelectrochemical system has been demonstrated to degrade antibiotics in wastewater or sewage sludge effectively, but research on the degradation of antibiotics in river sediments were still very limited. In this study, microbial electrolysis cell (MEC) and microbial fuel cell (MFC) reactors were constructed using river sediment as the substrate to investigate the removal, migration and degradation of antibiotics in sediments, as well as the variation of electrochemical characteristics and microbial community structures. Results showed that both MEC and MFC enhanced the removal of antibiotics in sediments. The removal of quinolones and CTC depended on both migration and biodegradation, while the removal of macrolides, TC and OTC was mainly due to the bioelectrochemical degradation. The degradation efficiencies of TC and OTC in MEC were 82.6% and 29.5% higher than those in MFC, respectively, while the degradation efficiency of macrolides in MFC was 27.6%~40.6% higher than that in MEC. The electrochemical analysis results showed that the power density of MFC with sediments as the substrate was relatively low due to the large internal resistance, but the anode of MFC showed better oxidation function than MEC. Microbial analysis showed that Proteobacteria and its corresponding class Deltaproteobacteria and Gammaproteobacteria were likely to play an important role in the enhanced removal of antibiotics, and MFC were easier to enrich Proteobacteria on anodes than MEC.
Keywords: microbial electrolysis cellmicrobial fuel cellantibioticsriver sediment
1 引言(Introduction)抗生素因为具有良好的抑制和杀死病原微生物的作用, 近年来被大量用作疾病治疗药物和农畜业中动物生长促进剂(Menkem et al., 2019).数据显示从2000—2015年全球抗生素的总消费量增长了39%(Klein et al., 2018), 2005—2016年中国7条主要河流和4个海湾流域的水和沉积物中共检测到了94种抗生素(Li et al., 2018c).抗生素除了会造成一定的化学污染外, 还会给环境中的生物体带来严重的生物毒性, 比如诱导出现大量携带抗生素抗性基因的微生物, 从而引起潜在的生态环境和健康风险.
生物电化学方法可以将抗生素有效的降解成小分子物质, 降低大分子有机物对微生物降解的抑制作用, 进而保证了微生物的降解性能(Wang et al., 2020), 与传统的物理化学和生物降解方法相比更加清洁高效且成本较低.近年来用于抗生素降解的生物电化学系统(bioelectrochemical systems, BES)主要有微生物燃料电池(microbial fuel cell, MFC)和微生物电解池(microbial electrolysis cell, MEC).MEC和MFC都是利用阳极微生物的作用氧化有机物并释放电子, 而MEC是通过外加电压而给电子提供足够的能量, 并在阴极将水电离出的H+还原成H2(Lee et al., 2010), MFC则是通过自身产生的电压, 自动地将电子转移至阴极并与氧气和质子结合形成水, 同时产生电能(Hong et al., 2005).
已有大量研究考察了MEC或MFC对废水、污泥等基质中抗生素的降解效果.有研究以石墨棒为电极搭建了MEC反应器, 在0.2 V的外加电压下降解市政废水中的磺胺类抗生素, 7 d后降解效率可以达到41.0%~69.0%(Harnisch et al., 2013).有研究采用MEC处理初始浓度为30 mg·L-1的氯霉素废水, 在0.5 V外加电压下24 h内降解了99.98%(Kong et al., 2014).利用三维生物膜MEC反应器在施加0.8 V外加电压的情况下降解厌氧污泥中的磺胺甲恶唑和四环素, 40 h内降解效率分别为88.9%~93.5%和89.3%~95.6%(Zhang et al., 2016).利用MFC降解浓度为10 mg·L-1的磺胺甲恶唑废水, 在60 h内去除率可达到85.1%(Xue et al., 2019).利用MFC降解4 mg·L-1的诺氟沙星废水, 300 h后的降解效率可以达到65.5%, 最大功率密度可以达到700 mW·m-2(Ondon et al., 2020).利用双石墨烯修饰的生物电极搭建的MFC在8 d内对活性污泥中的土霉素(OTC)可以降解95.0%(Wang et al., 2019).尽管已有大量文献报道了MEC和MFC对废水或污泥中抗生素的降解效果, 但关于生物电化学系统对河道沉积物中抗生素降解效果的研究还十分有限, 对于MEC和MFC两种类型的生物电化学系统在抗生素降解中的性能差异性等方面的信息还鲜有报道.
因此, 本研究以城市河道实际水体中的沉积物为考察对象, 探究生物电化学系统对于沉积物中本底抗生素的降解效果, 对比两种生物电化学系统(MEC和MFC)降解沉积物中抗生素的性能, 为沉积物中抗生素类污染物的原位修复提供参考依据.
2 材料与方法(Materials and methods)2.1 试验材料河道沉积物取自天津市海河河道中, 将取出后的沉积物样品放入PVC塑料桶中避光保存并立刻运回实验室.沉积物在装入反应器前需挑出植物和碎石, 沉淀过夜后除去上覆水, 然后搅拌均匀.沉积物初始有机质含量为25.1%.
2.2 反应器搭建试验共搭设8个反应器, 其中MEC、MFC反应器各3个作为平行试验组, 设置2个装有电极的开路平行反应器作为对照组.反应器为长13.5 cm、宽9.5 cm、高15 cm的塑料矩形容器, 电极材料为石墨板.电极材料在使用前需要进行预处理, 首先将石墨板放入丙酮溶液中浸泡至少12 h, 目的是清洁石墨板表面和边缘, 利用丙酮清洗不会影响到极板的电子性能和微观结构以及化学性质(Swain, 2007); 再在1 mol·L-1的盐酸中浸泡1 h, 盐酸处理可以增强石墨电极的氧化还原反应性能, 有效地提高反应器的最大功率密度(Li et al., 2018b), 还可以有效地增加石墨颗粒的比表面积, 提高石墨材料中的碳和氮的含量进而提高其催化性能和微生物附着能力(Erable et al., 2009); 最后利用无水乙醇反复冲洗石墨板3次, 用超纯水冲洗石墨板至没有药品残留, 放在通风橱内晾干备用.为保障和提高反应器的产电性能, 在MEC、MFC阴极一侧涂抹0.5 mg·cm-2的20% Pt/C催化剂(Liang et al., 2020).向反应器中装入5 cm深的混合均匀的沉积物样品, 并沿反应器侧壁缓慢加入深度为5 cm的超纯水后在避光条件下静置, 让其在重力沉降条件下实现泥水分离, 待沉积物沉淀稳定后向MEC和MFC反应器中分别插入电极板.MEC反应器阳极和阴极间距为4 cm, 并外加10 Ω的电阻利用铜线连接至恒压直流三路电源(Keithley 2231A-30-3, USA), 提供0.5 V的外加电压.MFC反应器的阴极板垂直悬挂固定在反应器一侧的内壁上, 并保证其完全淹没在上覆水中, 阳极在距离阴极4 cm处竖直插入沉积物中, 并使用100 Ω的外部电阻通过钛丝连接两极, 具体反应器的构型如图 1所示.反应期间为了保证MFC阴极附近的溶解氧条件, 每日利用100 mL针筒手动间歇补充阴极附近上覆水中的溶解氧, 维持上覆水溶解氧浓度在4 mg·L-1以上.反应器放置在中试实验室(38°59′40″E, 117°18′48″N)避光阴凉处, 以防止室外阳光和室内灯光对反应器中抗生素的光解作用.反应器在室温下运行30 d, 运行期间反应器内上覆水温度保持在(19±1) ℃.
图 1(Fig. 1)
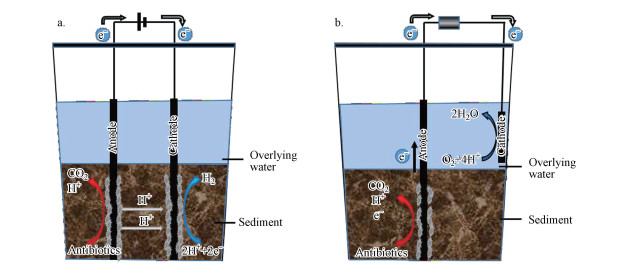 |
| 图 1 MEC反应器(a)与MFC反应器(b)的构型示意图 Fig. 1Schematic diagram of MEC reactors (a) and MFC reactors (b) |
2.3 数据采集反应器均连接至电压数据采集系统(Keithley Instruments 2700, USA), 每间隔10 min记录一次电压数值, 电流利用欧姆定律进行计算.每天利用万用表和Ag/AgCl参比电极测量MEC的阴极电势以及MFC的阳极电势.功率密度曲线利用外部电阻从47 kΩ按梯度变为200 Ω测得的电压数据进行极化曲线的绘制(Zhao et al., 2017).采用电化学工作站(CHI604E, Chenhua, Shanghai)在电位-0.3~0.4 V范围内对MEC反应器阴极和阳极进行循环伏安法测试(cyclic voltammetry, CV), MFC反应器阴极和阳极的CV曲线在-0.6~0.2 V范围内绘制, 扫描效率为1 mV·s-1.
2.4 抗生素测定反应器运行30 d后, 用注射器小心抽取每个反应器的上覆水, 然后用0.45 μm MCE滤膜进行过滤.过滤后的滤液用超纯水稀释至500 mL并保存于棕色玻璃瓶中, 通过固相萃取(solid phase extraction, SPE)进行进一步纯化.用土壤采样器收集反应器阳极附近厚度为1 cm的沉积物, 并利用冷冻干燥机进行冷冻干燥30 h, 干燥后的沉积物经200目筛研磨筛分后, 取2.000 g放入50 mL离心管中进行固相萃取预处理.预处理和固相萃取采用课题组前期报道的方法(Zhang et al., 2018).固相萃取后采用UPLC-MS/MS (Acquity UPLC和Xevo TQD MS/MS, Waters, USA)对上覆水和沉积物样品中的目标抗生素诺氟沙星(norfloxacin, NOR)、氧氟沙星(ofloxacin, OFL)、环丙沙星(ciprofloxacin, CIP)、四环素(tetracycline, TC)、土霉素(oxytetracycline, OTC)、金霉素(chlortetracycline, CTC)、阿奇霉素(azithromycin, AZI)和罗红霉素(roxithromycin, ROX)进行定量分析, 具体检测方法参考前期报道(宋淑敏等, 2017).
2.5 微生物分析采用高通量测序(诺禾致源, 中国)对MEC和MFC反应器运行30 d后的沉积物和阳极生物膜样品中的微生物群落结构进行分析.沉积物样品直接从反应器中取得, 极板生物膜样品在采集前用超纯水冲洗极板表面沉积物, 再用灭菌刀片将附着在电极表面的生物膜刮下备用.使用FastDNA Spin Kit for Soil试剂盒(MP Biomedicals Inc., USA)提取DNA.比较初始沉积物(IN)、MEC沉积物(SMEC)、MFC沉积物(SMFC)和对照组沉积物(SC)样品以及MEC、MFC和对照组阳极生物膜样品(AMEC、AMFC、AC)中微生物的相对丰度.
2.6 数据分析利用Origin 2018进行数据分析, 所有的数据均用平均值和标准偏差表示.抗生素从沉积物中的去除效率(ER)用式(1)进行计算.
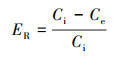 | (1) |
抗生素从沉积物中向上覆水中的迁移效率(EM)用式(2)进行计算.
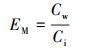 | (2) |
抗生素在沉积物中的降解效率(ED)则利用式(3)进行计算.
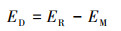 | (3) |
生物电化学系统对沉积物中抗生素的去除共包括两个部分, 分别为通过生物电化学作用降解的部分和反应过程中从沉积物向上覆水中迁移的部分.反应器运行30 d后的抗生素去除率如图 2a所示.对于喹诺酮类抗生素, 在MFC中的去除率比MEC高17.1%~36.9%.对照组对NOR和OFL没有去除效果, MFC与MEC对CIP的去除率相比于对照组分别高出109.4%和55.4%, 由此可见生物电化学系统可以明显强化沉积物中喹诺酮类抗生素的去除.对于四环素类抗生素, MEC对TC的去除率比MFC高出77.7%, 而对于OTC和CTC, MEC和MFC的去除率没有明显差别.由于四环素类抗生素比较容易生物降解(Li et al., 2018a), 因此对照组中四环素类抗生素的去除率可以达到11.2%~30.6%, 微生物电化学系统对四环素类抗生素从沉积物中去除也具有明显的促进作用.MFC对于大环内酯类抗生素的去除率比MEC高10.2%~36.8%, 比对照组高38.3%~103.0%.大环内酯类抗生素AZI和ROX也比较易于生物降解, 且生物电化学系统可进一步强化去除效果.
图 2(Fig. 2)
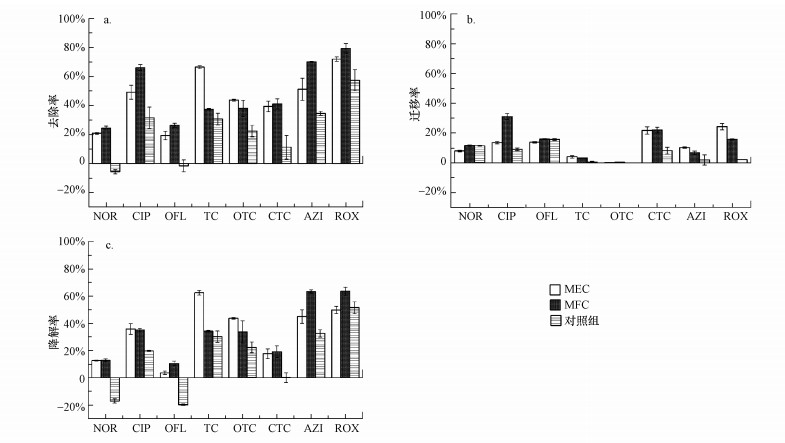 |
| 图 2 MEC与MFC反应器运行30 d后的抗生素去除率(a)、迁移率(b)和降解率(c) Fig. 2Antibiotics removal efficiency (a), migrate efficiency (b) and degradation efficiency (c) in MEC and MFC reactors after 30 days of operation |
图 2b显示了从沉积物向上覆水迁移的抗生素浓度百分比.对于喹诺酮类抗生素, MEC和MFC对CIP的迁移有一定促进作用, 特别是MFC中CIP的迁移率是对照组的2.8倍, 而NOR和OFL的迁移率在电化学作用下并无明显变化.四环素类抗生素在对照组中的迁移率普遍较低, 这是由于它们的吸附潜能很高, 而且当四环素与固相中的金属离子形成络合物时, 就会更加显著增加它们在固相中的吸附, 而不易迁移至上覆水中(Huang et al., 2020).TC和OTC在MEC和MFC系统中的迁移率也小于5%, 但CTC在两个系统中的迁移率明显的提高且比控制组高出94.6%~97.5%.生物电化学作用会显著促进大环内酯类抗生素向上覆水中迁移, 且在MEC作用下迁移率最高, 比MFC高出49.2%~54.4%.MEC和MFC对ROX向上覆水中迁移的促进作用最为明显, 迁移率比对照组分别高出4.5倍和3.2倍.
根据抗生素在沉积物中的去除率和向上覆水中的迁移率可以估算得出抗生素在生物电化学作用下的降解效率, 如图 2c所示.MEC和MFC对喹诺酮类抗生素中的NOR和CIP降解率基本相同, 其中CIP的降解率比对照组分别提高82.0%和78.5%, 因此MFC相较于MEC更高的NOR和CIP去除率(图 2a)主要是由于MFC对二者迁移率的更高的促进作用(图 2b).而对于OFL来说, MFC的降解效率明显高于MEC.对照组中NOR和OFL几乎没有降解效果, 甚至出现负去除的情况, 因此MEC和MFC促进了NOR和OFL的降解.由于MEC和MFC对NOR和OFL的迁移率没有明显的影响(图 2b), 因此生物电化学系统对NOR和OFL的强化去除主要是对其降解率的促进作用.但从总体上来说, 喹诺酮类抗生素的去除是迁移与生物电化学降解共同作用的结果.对于四环素类抗生素, TC和OTC在MEC中的降解效率最高, 分别比MFC分别高出82.6%和29.5%, 而MFC对CTC的降解效率略高于MEC.与迁移效率相比, 四环素类抗生素在沉积物中的去除主要是生物电化学作用降解, 而CTC更倾向于迁移和生物电化学降解的共同作用.MFC对大环内酯类抗生素的降解效率比MEC高27.6%~40.6%, 并且生物电化学降解是去除大环内酯抗生素的主要原因.与其他两类抗生素相比, 大环内酯类抗生素在生物电化学系统中更容易降解.
3.2 电化学特性3.2.1 MFC的产电性能MFC的输出电压值随时间的变化如图 3a所示.反应器运行期间的外阻选用100 Ω, 反应器运行第5 d起输出电压迅速升高, 在第15 d发现输出电压值在160 mV达到稳定.达到稳定后断开阴阳极并接入47 kΩ~200 Ω的电阻进行MFC功率密度的测定.功率密度测定结束后(即反应器运行第17 d)至第22 d, 输出电压又略有上升, 最大值达到234 mV.运行期间MFC的阳极电位变化见图 3b, MFC反应器在运行的3 d起反应器阳极电位开始逐渐下降, 在第15 d左右达到稳定最终的平均阳极电位为(-0.21±0.03) V, 与此同时图 3a中的MFC产电电压也逐渐达到稳定.由于MFC系统中的阳极电势的降低会使得开路电压增加, 而且阳极电势的变化是由于产电微生物在阳极不断富集导致的(黄霞 et al., 2007), 因此, MFC反应器在第14 d左右开始运行稳定, 阳极产电微生物开始得到有效富集.图 3c是MFC在运行稳定时测得的功率密度曲线以及极化曲线.MFC的最大功率密度为12.94 mW·m-2, 对应的内阻约为1986 Ω.与已有的MFC报道相比, 本研究中MFC的功率密度相对较低而内阻偏高, 可能是由于沉积物与废水、活性污泥等介质不同, 其流动性较差导致传质阻力较大.有研究表明, 沉积物的有机质过高也会对MFC系统的运行产生一定的负面影响(Zhao et al., 2016), 本研究中沉积物的有机质含量达到25%以上, 也可能是导致功率密度较低的原因之一.在运行期间对反应器的上覆水电导率进行监测, 结果显示MFC反应器上覆水的电导率在运行开始后第5 d从1300 μS·cm-1左右逐渐下降至900 μS·cm-1左右, 上覆水电导率的降低也可能是增大MFC的内阻的原因之一.
图 3(Fig. 3)
 |
| 图 3 MFC反应器运行期间的电压(a)、阳极电位(b)、功率密度曲线和极化曲线(c) Fig. 3Output voltage (a), anode potential (b), power density curve and polarization curve (c) of MFC reactors |
3.2.2 MEC反应器运行情况图 4显示了MEC反应器在30 d运行期间的电压和阴极电位变化情况.反应器运行第7 d起MEC反应器的电压值快速上升, 第15 d开始保持稳定在1.9 mV左右, 第20~25 d又有一定的上升趋势, 最高输出电压为2.7 mV.整体来说MEC反应器运行较为稳定.阴极电位在运行期间一直保持持续下降的趋势, 且最低为-0.75 V.由于本研究中MEC反应器的外接电阻(10 Ω)不变, 因而随着输出电压的不断上升, 输出电流也随之升高.电流密度的增加可以认为微生物在阳极不断富集, 而随着阳极生物膜的逐渐生长, 阴极电位随之下降(Lim et al., 2020), 因此MEC在运行期间内一直呈现较好的阳极微生物膜生长趋势.根据相关性分析结果显示, MEC的阴极电位与喹诺酮类抗生素和四环素中OTC的降解效率呈显著负相关(p < 0.05), 所以证明MEC在较低的阴极电位下可以有效地降解抗生素.
图 4(Fig. 4)
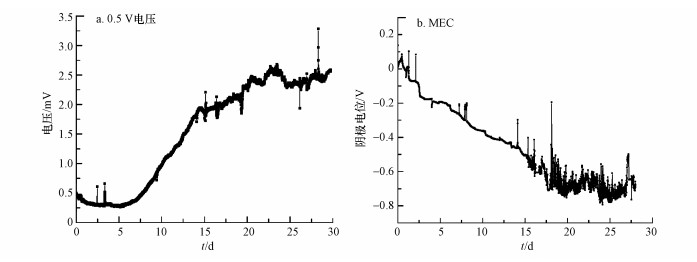 |
| 图 4 MEC反应器运行期间的电压(a)和阴极电位(b) Fig. 4Voltage (a) and cathode potential (b) of MEC reactors |
3.2.3 CV曲线图 5是MEC和MFC反应器运行结束后的阴极和阳极的循环伏安图(CV曲线).其中MEC和MFC的CV曲线的扫描电位范围不同, 与对照组相比, MEC表现出了更高的电流响应, 表明了MEC的电极微生物膜比对照组拥有更高的电化学活性.与MEC相比, MFC的CV曲线在-0.1 V左右出现了氧化峰, 因此MFC比MEC呈现出更好的氧化能力, 对大部分抗生素显示出较好的降解效果.
图 5(Fig. 5)
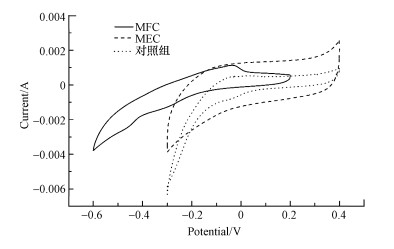 |
| 图 5 MEC和MFC生物阳极的CV曲线 Fig. 5Cyclic voltammograms of bioanodes in MEC and MFC |
3.3 微生物种群分析图 6显示了MEC、MFC和对照组反应器中微生物种群的相对丰度.由图 6a可知, 沉积物中的优势菌群为Proteobacteria(36.6%~46.4%)、Bacteroidetes(8.0%~11.5%)、Euryarchaeota(4.8%~20.9%)和Firmicutes(4.4%~12.1%).Proteobacteria、Bacteroidetes和Firmicutes均是生物电化学系统阳极微生物群落的主要门类, 其中Bacteroidetes是在阳极厌氧环境中生长的发酵细菌, 能够对有机污染物进行生物降解(Sack et al., 2011).与初始沉积物样品相比, 所有反应器中Euryarchaeota的相对丰度都显著降低, 除此之外对照组微生物群落结构与初始样品相比几乎没有发生任何改变.与初始沉积物样品相比, MFC和MEC反应器的沉积物中Proteobacteria相对丰度有所降低, 而阳极生物膜上Proteobacteria明显增加, 且在MFC阳极上相对丰度更高.由此可见, Proteobacteria更容易在阳极上富集, 可能在抗生素的降解过程中起到积极作用.此外, Firmicutes在MEC反应器的沉积物中和阳极生物膜中都有明显的富集, 且相对丰度明显高于MFC和对照组.Firmicutes已经被发现可以有效地参与转移电子的过程(Rabaey et al., 2004), 所以MEC反应器中Firmicutes丰度增加可能是由于在外加电压作用下, 沉积物中的电子被动转移能力要比MFC中依靠自身电压自动转移电子能力要更强.在MEC反应器中, Firmicutes可能对于抗生素的降解起到一定的作用.
图 6(Fig. 6)
 |
| 图 6 MEC和MFC反应器运行30 d后沉积物和阳极生物膜中的微生物在门水平(a)、纲水平(b)、科水平(c)和属水平(d)上的相对丰度 Fig. 6Relative abundance of microorganisms in the sediment (S-) and the on anodes (A-) of MEC and MFC reactors at phylum level (a), class level (b), family level (c) and genus level (d) |
由图 6b可知, 沉积物中纲水平上的优势微生物主要包括Deltaproteobacteria(18.8%~34.0%)、Gammaproteobacteria(10.7%~20.0%)、Bacteroidia(7.4%~11.1%)和Methanomicrobia(4.5%~20.3%).Deltaproteobacteria和Gammaproteobacteria均属于Proteobacteria, 与初始沉积物样品相比, MEC和MFC的沉积物中Deltaproteobacteria丰度均有所下降, 而Gammaproteobacteria丰度略有上升.在MEC的阳极生物膜中, Deltaproteobacteria丰度与初始沉积物相比没有明显变化, 但仍然高于对照组的阳极生物膜, 而Gammaproteobacteria丰度有所上升; 在MFC的阳极生物膜中, Deltaproteobacteria和Gammaproteobacteria均有明显的富集.MFC系统阳极生物膜中Deltaproteobacteria丰度要远高于MEC组和控制组, 其原因是Deltaproteobacteria可以参与MFC能源产生的过程, 属于MFC中常见的产电微生物.因此, 生物电化学系统对抗生素降解的促进作用可能是由于Deltaproteobacteria和Gammaproteobacteria在阳极的成功富集, 而在MFC阳极上更明显的富集效果可能是MFC对抗生素降解的强化作用略高于MEC的原因.Methanomicrobia属于产甲烷菌, 在MEC和MFC的运行过程中也检测到了甲烷的生成.
由图 6c可知, 从科水平分析可以看到沉积物中的优势微生物为Syntrophaceae(7.7%~20.6%)、Desulfobulbaceae(5.1%~18.0%)、Methanosaetaceae(3.9%~16.5%)和Rhodocyclaceae(3.3%~7.8%).与初始沉积物样品相比, Syntrophaceae和Methanosaetaceae的相对丰度在30 d反应周期后都明显减少, 而MFC和MEC阳极生物膜上的Desulfobulbaceae有着明显富集的现象, 而且MFC富集Desulfobulbaceae的能力更强, 它们的丰度分别是初始样品中丰度的37倍和27倍.已有文献报道Desulfobulbaceae可以促进沉积物中烃类污染物的降解(张海涵等, 2019), 而它在本研究中的明显富集表明, 其对抗生素的降解可能也起到重要的促进作用.在MFC阳极生物膜上, Campylobacterales也获得了有效地富集, 它是隶属于Proteobacteria的, 也印证了MFC比MEC更容易富集Proteobacteria.
由图 6d可知, 从属水平分析可以看到沉积物中的优势微生物为Methanosaeta(8.9%~16.5%)、Smithella(4.9%~12.7%)、Sulfuricurvum(0.03%~4.3%)和unidentified_Clostridiales(0.7%~3.6%).与初始样品相比, 具有产甲烷作用的Methanosaeta以及可以有效产生丁酸和甲烷的Smithella(芮俊鹏 et al., 2014)的丰度均有所降低, 而MFC阳极生物膜上的Sulfuricurvum丰度明显上升, Sulfuricurvum属于Proteobacteria, 该菌种可以利用氧气或硝酸盐作为电子受体而氧化沉积物中的硫化物, 在上覆水中的溶解氧充足的情况下可以有效参与到沉积物中硫化物的氧化过程, 可以有效地防止底泥恶臭现象的发生(王霖等, 2015).在本研究中, MFC中Sulfuricurvum丰度的升高是得益于MFC反应器在运行期间上覆水中溶解氧一直处于较高且稳定的状态, 而MFC的阳极是竖直插入沉积物中, 所以靠近表面沉积物的部分就会有效富集和生长Sulfuricurvum并且降解沉积物中的硫化物, 抑制底泥恶臭.Sulfuricurvum的丰度在MFC中的增加意味着阴极附近有充足的溶解氧, 并且能保证MFC成功启动.而MEC沉积物中的unidentified_Clostridiales丰度有明显升高, 分别是控制组和MFC沉积物组的1.25倍和1.29倍, unidentified_Clostridiales是BES系统中一种常见的优势微生物, 属于Firmicutes, 因此MEC比MFC更容易富集Firmicutes.
4 结论(Conclusions)本研究考察了生物电化学系统对河道沉积物中抗生素的降解效果, 结果表明, MEC和MFC均可以强化沉积物中抗生素的去除.喹诺酮类抗生素和四环素类抗生素中的CTC的去除是迁移与生物电化学降解共同作用的结果, 而生物电化学降解是大环内酯类抗生素和四环素类抗生素中TC和OTC去除的主要作用.3类抗生素中, 大环内酯类抗生素在生物电化学系统中更容易降解, 而喹诺酮类降解率较低.对于四环素类抗生素, TC和OTC在MEC中的降解效率最高, 比MFC分别高出82.6%和29.5%, 而MFC对CTC的降解效率略高于MEC.MFC对大环内酯类抗生素的降解效率比MEC高27.6%~40.6%.就降解效果而言, MFC对其中3种较易向上覆水迁移的抗生素的降解效率均明显高于MEC, 而MEC对不易向上覆水中迁移的TC和OTC的降解效果更好, 考虑到实际应用时应避免抗生素迁移至水体带来的二次污染的问题, 而且MFC对难降解抗生素的降解效果更优, 因此MFC可能更适于实际河道沉积物中抗生素的降解.由于河道沉积物的传质阻力较大, 造成MFC的内阻较大, 功率密度相对较低, 但CV曲线显示MFC阳极比MEC阳极表现出了更好的氧化效果.微生物种群结构变化分析发现, 门水平上的Proteobacteria及其对应的纲水平上的Deltaproteobacteria和Gammaproteobacteria可能对抗生素的强化去除起到了主要的积极作用, 而且MFC阳极比MEC更容易富集Proteobacteria.
参考文献
| Erable B, Duteanu N, Kumar S M S, et al. 2009. Nitric acid activation of graphite granules to increase the performance of the non-catalyzed oxygen reduction reaction (ORR) for MFC applications[J]. Electrochemistry Communications, 11(7): 1547-1549. DOI:10.1016/j.elecom.2009.05.057 |
| Harnisch F, Gimkiewicz C, Bogunovic B, et al. 2013. On the removal of sulfonamides using microbial bioelectrochemical systems[J]. Electrochemistry Communications, 26: 77-80. DOI:10.1016/j.elecom.2012.10.015 |
| Hong L, Stephen G, E L B. 2005. Electrochemically assisted microbial production of hydrogen from acetate[J]. Environmental Science & Technology, 39(11): 4317-4320. |
| Huang F, An Z, Moran M J, et al. 2020. Recognition of typical antibiotic residues in environmental media related to groundwater in China (2009-2019)[J]. Journal of Hazardous Materials: 122813. |
| 黄霞, 范明志, 梁鹏, 等. 2007. 微生物燃料电池阳极特性对产电性能的影响[J]. 中国给水排水, 23(3): 8-13. DOI:10.3321/j.issn:1000-4602.2007.03.003 |
| Klein E Y, Van Boeckel T P, Martinez E M, et al. 2018. Global increase and geographic convergence in antibiotic consumption between 2000 and 2015[J]. Proc Natl Acad Sci USA, 115(15): E3463-E3470. DOI:10.1073/pnas.1717295115 |
| Kong D, Liang B, Lee D J, et al. 2014. Effect of temperature switchover on the degradation of antibiotic chloramphenicol by biocathode bioelectrochemical system[J]. Journal of Environmental Science (China), 26(8): 1689-1697. DOI:10.1016/j.jes.2014.06.009 |
| Lee H S, Vermaas W F, Rittmann B E. 2010. Biological hydrogen production: prospects and challenges[J]. Trends Biotechnol, 28(5): 262-271. DOI:10.1016/j.tibtech.2010.01.007 |
| Li H N, Li B X, Ma J L, et al. 2018a. Fate of antibiotic-resistant bacteria and antibiotic resistance genes in the electrokinetic treatment of antibiotic-polluted soil[J]. Chemical Engineering Journal, 337: 584-594. DOI:10.1016/j.cej.2017.12.154 |
| Li N, Wang S, An J, et al. 2018b. Acid pretreatment of three-dimensional graphite cathodes enhances the hydrogen peroxide synthesis in bioelectrochemical systems[J]. Science of the Total Environmental, 630: 308-313. DOI:10.1016/j.scitotenv.2018.02.135 |
| Li S, Shi W, Liu W, et al. 2018c. A duodecennial national synthesis of antibiotics in China's major rivers and seas (2005-2016)[J]. Science of the Total Environmental, 615: 906-917. DOI:10.1016/j.scitotenv.2017.09.328 |
| Liang Y, Zhai H, Liu B, et al. 2020. Carbon nanomaterial-modified graphite felt as an anode enhanced the power production and polycyclic aromatic hydrocarbon removal in sediment microbial fuel cells[J]. Science of the Total Environmental, 713: 136483. DOI:10.1016/j.scitotenv.2019.136483 |
| Lim S S, Fontmorin J M, Izadi P, et al. 2020. Impact of applied cell voltage on the performance of a microbial electrolysis cell fully catalysed by microorganisms[J]. International Journal of Hydrogen Energy, 45(4): 2557-2568. DOI:10.1016/j.ijhydene.2019.11.142 |
| Menkem Z E, Ngangom B L, Tamunjoh S S A, et al. 2019. Antibiotic residues in food animals: Public health concern[J]. Acta Ecologica Sinica, 39(5): 411-415. DOI:10.1016/j.chnaes.2018.10.004 |
| Ondon B S, Li S, Zhou Q, et al. 2020. Simultaneous removal and high tolerance of norfloxacin with electricity generation in microbial fuel cell and its antibiotic resistance genes quantification[J]. Bioresource Technology, 304: 122984. DOI:10.1016/j.biortech.2020.122984 |
| Rabaey K, Boon N, Siciliano S D, et al. 2004. Biofuel cells select for microbial consortia that self-mediate electron transfer[J]. Applied Environmental Microbiology, 70(9): 5373-5382. DOI:10.1128/AEM.70.9.5373-5382.2004 |
| 芮俊鹏, 李吉进, 李家宝, 等. 2014. 猪粪原料沼气工程系统中的原核微生物群落结构[J]. 化工学报, 65(5): 1868-1875. DOI:10.3969/j.issn.0438-1157.2014.05.044 |
| Sack E L, van der Wielen P W, van der Kooij D. 2011. Flavobacterium johnsoniae as a model organism for characterizing biopolymer utilization in oligotrophic freshwater environments[J]. Applied Environmental Microbiology, 77(19): 6931-6938. DOI:10.1128/AEM.00372-11 |
| 宋淑敏, 张翔宇, 周佳虹, 等. 2017. 超高效液相色谱串联质谱法同时测定城市污水处理厂污泥中12种抗生素[J]. 环境化学, 36(9): 1923-1931. |
| Swain G M. 2007. 5-Solid Electrode Materials: Pretreatment and Activation[M]//C. G. ZOSKI, Handbook of Electrochemistry. Elsevier; Amsterdam: 111-153 |
| Wang J, Zhuan R. 2020. Degradation of antibiotics by advanced oxidation processes: An overview[J]. Science of the Total Environmental, 701: 135023. DOI:10.1016/j.scitotenv.2019.135023 |
| 王霖, 种云霄, 余光伟, 等. 2015. 黑臭底泥硝酸钙原位氧化的温度影响及微生物群落结构全过程分析[J]. 农业环境科学学报, 34(6): 1187-1195. |
| Wang Y, Zhang H, Feng Y, et al. 2019. Bio-Electron-Fenton (BEF) process driven by sediment microbial fuel cells (SMFCs) for antibiotics desorption and degradation[J]. Biosensors & Bioelectronics, 136: 8-15. |
| Xue W, Li F, Zhou Q. 2019. Degradation mechanisms of sulfamethoxazole and its induction of bacterial community changes and antibiotic resistance genes in a microbial fuel cell[J]. Bioresource Technology, 289: 121632. DOI:10.1016/j.biortech.2019.121632 |
| 张海涵, 王跃, 黄廷林, 等. 2019. 沉积物电缆细菌研究进展[J]. 中国环境科学, 39(7): 3048-3055. DOI:10.3969/j.issn.1000-6923.2019.07.042 |
| Zhang S, Song H L, Yang X L, et al. 2016. Effect of electrical stimulation on the fate of sulfamethoxazole and tetracycline with their corresponding resistance genes in three-dimensional biofilm-electrode reactors[J]. Chemosphere, 164: 113-119. DOI:10.1016/j.chemosphere.2016.08.076 |
| Zhang X, Li R. 2018. Variation of antibiotics in sludge pretreatment and anaerobic digestion processes: Degradation and solid-liquid distribution[J]. Bioresource Technology, 255: 266-272. DOI:10.1016/j.biortech.2018.01.100 |
| Zhao Q, Ji M, Li R, et al. 2017. Long-term performance of sediment microbial fuel cells with multiple anodes[J]. Bioresource Technology, 237: 178-185. DOI:10.1016/j.biortech.2017.03.002 |
| Zhao Q, Li R, Ji M, et al. 2016. Organic content influences sediment microbial fuel cell performance and community structure[J]. Bioresource Technology, 220: 549-556. DOI:10.1016/j.biortech.2016.09.005 |
